Журнал «Медицина неотложных состояний» 4 (59) 2014
Вернуться к номеру
Перший власний досвід застосування концентрату протромбіназного комплексу при життєзагрожуючій коагулопатії
Авторы: Підгірний Я.М., Філик О.В., Яєчник О.Р. - Львівський національний медичний університет імені Данила Галицького
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
У статті описано клінічний випадок ефективної корекції життєзагрожуючої гіпокоагуляції концентратом протромбіназного комплексу октаплекс у пацієнтки з політравмою. Продемонстровано нормалізацію таких показників, як протромбіновий індекс, міжнародне нормалізаційне відношення, тромбіновий індекс та рівень загального фібриногену, що поєднувалося з клінічними ознаками припинення дифузної кровоточивості. Проте впродовж наступних 6 діб лікування відзначались персистуючий дефіцит антитромбіну ІІІ, прогресуюче наростання рівня D-димерів та пригнічення системи фібринолізу, що корелювало зі зростанням рівня поліорганної дисфункції.
В статье описан клинический случай эффективной коррекции жизнеугрожающей гипокоагуляции концентратом протромбиназного комплекса октаплекс у пациентки с политравмой. Продемонстрирована нормализация таких показателей, как протромбиновый индекс, международное нормализационное отношение, тромбиновый индекс и уровень общего фибриногена, что сочеталось с клиническими признаками остановки диффузной кровоточивости. Однако в течение следующих 6 суток лечения отмечались персистирующий дефицит антитромбина III, прогрессирующее нарастание уровня D-димеров и угнетение системы фибринолиза, что коррелировало с нарастанием уровня полиорганной дисфункции.
This article describes a clinical case of effective correction for life-threatening hypocoagulation using octaplex, a prothrombinase complex concentrate, in a female patient with polytrauma. There is shown normalization of such indicators as prothrombin index, international normalizing ratio, thrombin index and total fibrinogen level that was associated with clinical signs of diffuse bleeding control. However, over the next 6 days of treatment we detected persistent deficit of antithrombin III, a progressive increase in the level of D-dimers and inhibition of fibrinolysis system, which correlated with an increase of multiple organ dysfunction.
політравма, гемостаз, концентрат протромбіназного комплексу.
политравма, гемостаз, концентрат протромбиназного комплекса.
polytrauma, hemostasis, prothrombinase complex concentrate.
Статья опубликована на с. 99-102
Вступ
У пацієнтів із політравмою при наявності синдрому загальної відповіді організму на запалення (СЗВЗ) синдром дисемінованого внутрішньосудинного згортання крові (ДВЗ-синдром) зустрічається у 50–70 % випадків [1].
Одними з причин, що асоційовані зі зростанням рівня летальності при політравмі, є розвиток гіпокоагуляції та пригнічення фібринолізу з одночасним формуванням депозитів фібрину в просвіті мікроциркуляторного русла та дифузною кровоточивістю. Такі клінічні симптоми передбачають замісне поповнення дефіциту факторів згортання крові [7]. Дана мета може бути досягнута кількома основними препаратами. Перш за все це свіжозаморожена плазма (СЗП). Проте існують відомі труднощі, що полягають у потребі застосування масивних об’ємів СЗП для адекватного поповнення факторів згортання та основного природного антикоагулянта антитромбіну ІІІ (АТ ІІІ). Доза СЗП у такому випадку повинна становити не менше 20 мл/кг/введення, кратність на добу визначається за клінічними та параклінічними показниками. Часто введення СЗП повинно поєднуватися із застосуванням еритроцитарної маси для корекції гострої постгеморагічної анемії. Декілька ретроспективних та проспективних досліджень, в основному виконані серед поранених військовослужбовців, підтверджують, що раннє застосування СЗП та еритроцитарної маси у співвідношенні 1 : 1 та 1 : 2 знижує рівень 30-денної летальності [4].
Таке масивне введення алогенних компонентів крові, безсумнівно, передбачає кількох донорів та асоційоване з можливим розвитком гострого посттрансфузійного ушкодження легень (TRALI — Transfusion-Related Acute Lung Injury). Інколи введення компонентів крові потрібно розпочинати на етапі первинної рідинної ресусцитації, тобто поєднувати зі стабілізацією серцево-судинної дисфункції [5].
Мета дослідження — вивчення основних патофізіологічних механізмів, що призводять до коагулопатії споживання та пригнічення фібринолізу у пацієнтів із політравмою, та аналіз досвіду застосування концентрату протромбіназного комплексу для корекції життєзагрожуючої гіпокоагуляції.
Матеріали та методи дослідження
Для дослідження системи гемостазу визначали протромбіновий індекс (ПТІ), тромбіновий індекс (ТІ), активований частковий тромбопластиновий час (АЧТЧ), міжнародне нормалізаційне відношення (МНВ), розчинні фібрин-мономерні комплекси (РФМК), антитромбін ІІІ, використовуючи мануальні методики з діагностичними наборами фірми «Технологія-Стандарт» (Росія); для дослідження часу ХІІа-залежного фібринолізу використовували діагностичний набір фірми «Ренам» (Росія); рівень D-димерів визначали кількісним методом за допомогою діагностичного набору фірми Siemens на напівавтоматичному коагулометрі Sysmex 560. Показники гемостазіограми, а також рівень тяжкості синдрому поліорганної недостатності (СПОН) за шкалою Sepsis-related Organ Failure Assesement (SOFA) моніторувалися на момент госпіталізації (T0); через 1 год від госпіталізації (T1); через 2 год відповідно (до застосування СЗП та транексамової кислоти) (T2); через 3 год відповідно (після застосування СЗП та транексамової кислоти) (T3); через 4 год відповідно (після застосування препарату протромбіназного комплексу) (T4); на 3-тю добу лікування (T3d); на 6-ту добу лікування (T6d).
Результати дослідження та їх обговорення
Хвора Ш., 29 років, була доставлена в клінічну міську лікарню № 8 м. Львова в критичному стані з діагнозом «тяжка поєднана травма тіла, закрита черепно-мозкова травма, удар головного мозку тяжкого ступеня, тупа травма живота, внутрішньочеревна кровотеча, перелом кісток таза». Травма внаслідок дорожньо-транспортної пригоди. Хвора була доставлена через 30 хв після отримання травми з катетеризованою периферичною веною, об’єм інфузії до надходження 500 мл (за рахунок кристалоїдних розчинів). Хвора була подана в ургентний операційний блок для проведення лікувально-діагностичних заходів. При лаважі черевної порожнини патологічного вмісту не отримано. Проведено забір крові для досліджень при надходженні (T0). Проводилася масивна інфузійна терапія з метою досягнення нормальних показників центрального венозного тиску (ЦВТ), проте впродовж 1 год інфузійної терапії кристалоїдними та колоїдними розчинами ЦВТ залишався нижчим за 50 мм вод.ст., розпочато вазопресорну підтримку. Через 1 год по лапароцентезному катетеру почали виділятися рожеві промивні води, наростали розміри ділянок підшкірних гематом, параклінічно (табл. 1) відмічалося (Т1) зниження ПТІ до 55 %, ТІ до 60 %, загального фібриногену до 1,1 г/л, тромбоцитів до 85 • 109/л, що можна трактувати як поєднання коагулопатії споживання та коагулопатії розведення.
Вирішено провести лапаротомію. Перед лапаротомією (Т2) в гемостазіограмі виявлено виражену гіпокоагуляцію. Проведено лапаротомію, одночасно із забезпеченням хірургічного гемостазу проводилася терапевтична корекція коагуляційних порушень за допомогою трансфузії СЗП у дозі 15 мл/кг маси тіла та внутрішньовенне введення транексамової кислоти 15 мг/кг. Параклінічно відмічалося (Т3) наростання ПТІ до 62 %, наростання АЧТЧ до 55 с (що може відображати порушення у внутрішньому та загальному коагуляційному каскадах), загальний фібриноген залишався на критично низькому рівні і становив 0,7 г/л, час фібринолізу зріс до 55 хв, рівень тромбоцитів був низьким і становив 86 • 109/л. Клінічно у пацієнтки відмічалася кровоточивість із місць ін’єкцій та геморагічні виділення по дренажу з черевної порожнини та ендотрахеальної трубки. Внутрішньовенно введено концентрат протромбіназного комплексу октаплекс у дозі 25 МО/кг. Клінічно через 2 год після його введення кровоточивість регресувала. Промоніторовано гемостазіограму (Т6), на якій виявлено нормалізацію рівня ПТІ, що становив 85 %, ТІ — 85 %, загальний фібриноген нормалізувався на рівні 3,1 г/л.
Проте, незважаючи на застосування компонентів крові (СЗП), інгібіторів фібринолізу та концентрату протромбіназного комплексу, у пацієнтки відмічалися низький рівень АТ ІІІ, що становив 78 % (T0) і в подальшому поступово знижувався до 65 % (T1) та 40 % (T2), незначно зростав до рівня 46 % (T3) після призначення СЗП і в подальшому залишався критично низьким і становив 52 % (T6), 58 % (T3d), 56 % (T6d).
Рівень D-димерів був високим на момент госпіталізації і становив 4620 нг/мл (T0), поступово зростав і на 3-тю добу дорівнював 30 500 нг/мл (T3d), що можна пояснити наявністю генералізованого мікротромбоутворення, яке клінічно маніфестувало прогресуванням СПОН.
На 3-тю добу лікування стан пацієнтки дещо покращився, регресувала серцево-судинна недостатність, що дало змогу знизити дозу вазопресорної терапії. Проте з 5-ї доби лікування наросли прояви СПОН, перш за все дихальної недостатності, що маніфестувала респіраторним дистрес-синдромом, та наросла серцево-судинна недостатність, що і призвело до летального кінця на 7-му добу від моменту госпіталізації.
У даному клінічному випадку продемонстровано ефективність терапевтичної корекції дефіциту факторів згортання за допомогою препарату октаплекс. Проте досягнення нормокоагуляції не вплинуло на віддалені результати лікування, оскільки порушення в системі гемостазу супроводжувалися значним персистуючим дефіцитом АТ ІІІ, що є найважливішим природним антикоагулянтом, та поступовим прогресуючим наростанням рівня D-димерів, що асоційовано зі значним зростанням рівня тяжкості стану пацієнта і, відповідно, зростанням імовірності летального кінця.
Клінічними умовами, що часто асоціюються з ДВЗ-синдромом, є тяжка травма, особливо при ушкодженні головного мозку. Комбінація механізмів, що включають вивільнення ліпідів та фосфоліпідів із тканин у системну циркуляцію, гемоліз та ушкодження ендотелію можуть призвести до активації коагуляційного каскаду. Крім того, існують дані про те, що цитокіни відіграють основну роль у розвитку ДВЗ, оскільки основні патерни синтезу цитокінів є гіпотетично аналогічними у пацієнтів із політравмою та у пацієнтів із сепсисом [2, 3].
Виживання пацієнта з травмою залежить від можливості контролю за двома клінічними ситуаціями: кровотечею в ранній фазі та тромбозом в пізній фазі травматичної хвороби. Поєднання фізіологічної відповіді системи гемостазу для загоєння рани та патологічні зміни в ній, що призводять до ДВЗ-синдрому, утруднюють розуміння механізмів двох стадій коагулопатії внаслідок травми.
Коагулопатія при травматичній хворобі є мультифакторною, проте в ранній стадії травми ініціатором патогенезу ДВЗ-синдрому та його домінантним проявом є фібринолітичний фенотип [6]. До активації залежного від тканинного фактора шляху коагуляції призводять високі рівні прозапальних цитокінів та тяжкі ушкодження тканин організму. Це веде до масивної генерації тромбіну та його активації. Водночас низькі рівні протеїну С і АТ ІІІ ведуть до неспроможності контролю за коагуляцією та свідчать про пригнічення антикоагулянтних механізмів. Первинний та вторинний фібриноліз потужно активуються шок-індукованою тканинною гіпоксією та дисемінованим формуванням фібрину. Згодом у таких пацієнтів спостерігається коагулопатія споживання та дифузна кровоточивість. Персистуючий високий рівень інгібітору активатора плазміногену І типу (РАІ-1), що експресується на тромбоцитах та ендотелії, згодом змінює ДВЗ-синдром із фібринолітичного фенотипу на тромботичний фенотип, що спостерігається впродовж перших 24–48 год після травми. Всі ці зміни вкладаються у визначення ДВЗ-синдрому, що можна чітко віддиференціювати від нормальної відповіді системи гемостазу при загоєнні ран [3]. Порушення в системі фібринолізу можна визначати за допомогою стандартних лабораторних тестів або ротаційної тромбоеластометрії (ROTEM), зокрема, при APTEM-аналізі після додавання антифібринолітичного агента апротиніну моніторують активацію зовнішнього шляху коагуляційного каскаду [6].
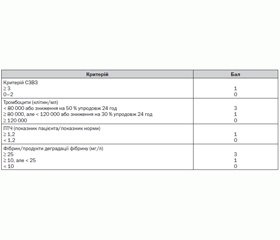
Японською асоціацією гострої медицини (табл. 2) та Міжнародним товариством із тромбозу та гемостазу запропоновані чутливі молекулярні маркери та діагностичні критерії ДВЗ-синдрому [2, 5].
Сума ≥ 4 балів за всіма показниками, наведеними в табл. 2, підтверджує діагноз дисемінованого внутрішньосудинного згортання крові [5].
Лікування ДВЗ-синдрому з фібринолітичним фенотипом повинно включати адекватне хірургічне лікування, усунення шоку, швидку і достатню замісну терапію тромбоконцентратом та СЗП для поповнення компонентів системи гемостазу та застосування антифібринолітичних препаратів (транексамової кислоти) [2, 6]. Важливо не тільки поповнювати втрачені компоненти коагуляційної ланки гемостазу при вже маніфестованій гіпокоагуляційній кровотечі, а й застосовувати антифібринолітики при гіперфібринолізі в ранньому періоді, щоб попередити масивне споживання факторів згортання. Це одна з ланок алгоритму інтенсивної терапії політравми, що може покращити результати лікування пацієнтів та знизити летальність.
Пацієнти з політравмою та ДВЗ при більш виражених проявах СЗВЗ та з більшою кількістю балів за рівнем тяжкості СПОН потребують більших об’ємів продуктів крові порівняно з пацієнтами без ДВЗ. При клінічній маніфестації ДВЗ у перший день політравми у таких пацієнтів спостерігається нормальна протромбіназна активність, проте зростає рівень РФМК, нижчим є рівень АТ ІІІ та зростає рівень розчинного тромбомодуліну. Множинний регресійний аналіз продемонстрував, що рівень АТ ІІІ є незалежним предиктором високого рівня РФМК у пацієнтів із ДВЗ. Високі рівні фібрину, продуктів деградації фібриногену, D-димерів та індекс співвідношення між рівнем фібрину і продуктів деградації фібриногену та рівнем D-димерів вказують на зростання фібрино(гено)лізу у пацієнтів з ДВЗ [3].
У рекомендаціях 2013 року щодо лікування тяжких періопераційних кровотеч зазначено, що при активній кровотечі слід підтримувати вміст гемоглобіну на рівні 70–90 г/л (рівень доказовості 1С); дотримуватися рестриктивної стратегії щодо трансфузії продуктів крові, що має позитивний вплив для зниження ступеня взаємодії між організмом пацієнта та алогенними продуктами крові (рівень доказовості 1А); експерти рекомендують застосовувати концентрат протромбіназного комплексу октаплекс (20–30 МО/кг) у пацієнтів із тяжкою кровотечею або схильністю до масивної кровотечі та пролонгованими коагуляційними тестами [4].
Проте зростання індексу МНВ/ПТЧ (без клінічних ознак кровотечі) не може бути показанням до застосування концентрату протромбіназного комплексу, особливо у пацієнтів у критичному стані (рівень доказовості 2С) [4]. Існують дані про використання препаратів протромбіназного комплексу у випадках масивної кровотечі та подовження коагуляційних тестів, хоча слід визнати, що даних щодо інтраопераційного застосування концентрату протромбіназного комплексу на сьогодні недостатньо. Дослідження на тваринах демонструють, що застосування концентрату протромбіназного комплексу може бути пов’язане зі зростанням ризику тромбоемболічних ускладнень та ДВЗ.
Висновки
1. Аналізуючи даний клінічний випадок, можна відзначити високу клінічну ефективність препарату октаплекс у пацієнтів із життєзагрожуючою гіпокоагуляцією при політравмі.
2. Пацієнти з політравмою, крім гіпокоагуляції, мають й інші порушення в системі гемостазу (критично низький рівень АТ ІІІ, поступове прогресуюче наростання рівня D-димерів та прогресуюче пригнічення фібринолізу), що сприяють прогресуванню СПОН та збільшують імовірність летального кінця.
1. Levi M. Disseminated intravascular coagulation / M. Levi, H. ten Cate // N. Engl. J. Med. — 1999. — Vol. 341(8). — P. 586-592.
2. Gando S. Trauma, shock, and disseminated intravascular coagulation: lessons from the classical literature / S. Gando, A. Sawamura, M. Hayakawa // Ann. Surg. — Vol. 254(1). — P. 10-19.
3. Normal prothrombinase activity, increased systemic thrombin activity, and lower antithrombin levels in patients with disseminated intravascular coagulation at an early phase of trauma: comparison with acute coagulopathy of trauma-shock / Y. Yanagida, S.S. Gando, А. Sawamura [et al.] // Surgery. — 2013. — Vol. 154(1). — P. 48-57.
4. Management of severe perioperative bleeding. Guidelines from the European Society of Anaesthesiology / А. Sibylle, Kozek-Langenecker, A. Afshari, P. Albaladejo [et al.] // Eur. J. Anaesthesiol. — 2013. — Vol. 30. — P. 270-382.
5. Баркаган З.С. Современные аспекты патогенеза, диагностики и терапии ДВС-синдрома / З.С. Баркаган, А.П. Момот // Медицина неотложных состояний. — 2013. — № 5(52). — С. 146-152.
6. Keene D. Damian. Rotational thromboelastometry-guided trauma resuscitation / Damian D. Keene, Giles R. Nordmann, Tom Woolley // Curr. Opin. Crit. Care. — 2013. — Vol. 19. — P. 605-612.
7. Holley D. Anthony. The «procoagulopathy» of trauma: too much, too late? / Anthony D. Holley, Michael C. Reade // Curr. Opin. Crit. Care. — 2013. — Vol. 19. — P. 578-586.

/100/100.jpg)
/101/101.jpg)