Журнал «» 4 (36) 2014
Вернуться к номеру
Діагностика та лікування легеневої гіпертензії Рекомендації робочої групи щодо легеневих гіпертензій — 2014
Рубрики: Кардиология
Разделы: Справочник специалиста
Версия для печати
Статья опубликована на с. 75-109
Автори-укладачі: професор Конопльова Л.Ф. (Київ) — модератор; академік НАМН України, професор Коваленко В.М. (Київ); чл.-кор. НАМН України, професор Амосова К.М. (Київ); професор Сіренко Ю.М. (Київ), д.м.н. Радченко Г.Д. (Київ)
За участю к.м.н. Кричинської І.В.
Список скорочень
NT-proBNP — N-кінцевий пропептид натрійуретичного гормону (В-типу)
АРЕ — антагоністи рецепторів ендотеліну
АТ — артеріальний тиск
БКК — блокатори кальцієвих каналів
ВВС — вроджені вади серця
ГКМП — гіпертрофічна кардіоміопатія
ГТТ — градієнт транспульмонального тиску
ДКМП — дилатаційна кардіоміопатія
ДМШП — дефект міжшлуночкової перегородки
ЕД — ендотеліальна дисфункція
ЕхоКГ — ехокардіограма
ІЛГ — ідіопатична легенева гіпертензія
ІХС — ішемічна хвороба серця
КПС — катетеризація правих відділів серця
КТ — комп’ютерна томографія
ЛА — легенева артерія
ЛАГ — легенева артеріальна гіпертензія
ЛАТ — легеневий артеріальний тиск
ЛГ — легенева гіпертензія
ЛП — ліве передсердя
ЛСО — легенево-судинний опір
ЛШ — лівий шлуночок
МС — мітральний стеноз
МНС — міжнародне нормалізоване співвідношення
НПВ — нижня порожниста вена
ПАК — пероральні антикоагулянти
ОФВ1 — об’єм форсованого видиху за 1 секунду
ПП — праве предсердя
ППГ — портопульмональна гіпертензія
ПШ — правий шлуночок
рГЦ — розчинна гуанілатциклаза
СВ — серцевий викид
СІ — серцевий індекс
СН — серцева недостатність
СТЛА — систолічний тиск у легеневій артерії
Т6ХХ — тест з 6-хвилинною ходьбою
ТЕЛА — тромбоемболія легеневої артерії
ТЗЛА — тиск заклинювання в легеневій артерії
ТПП — тиск в правому передсерді
ФДЕ-5 — фосфодіестераза 5
ФЗД — функція зовнішнього дихання
ФК — функціональний клас ВООЗ
ХОЗЛ — хронічне обструктивне захворювання легень
ХТЕЛГ — хронічна тромбоемболічна легенева гіпертензія
цГМФ — циклічний гуанозинмонофосфат
ЧДКП — час до клінічного погіршення
Вступ
Мета даної роботи полягає у представленні практичних, заснованих на принципах доказовості рекомендацій щодо діагностики та лікування легеневої гіпертензії (ЛГ) різних класів.
Необхідність впровадження цих рекомендацій зумовлена:
1. Відсутністю таких в Україні.
2. Відсутністю чітких вказівок, до компетенції яких спеціалістів належить ця категорія хворих (кардіологи, пульмонологи, суміжні спеціальності).
3. Зростаючою потребою лікарів у інформації про сутність захворювання, його форми, підходи до діагностики та лікування.
4. Необхідністю в наданні лікарям первинної ланки (сімейним, дільничним, терапевтам) лаконічних і чітких рекомендацій щодо діагностичних критеріїв, прийнятих у світовій практиці.
5. Відсутністю чітких вказівок на методи лікування даної патології, що ґрунтуються на доказовій базі з різним рівнем рекомендацій та ступенем доказовості.
6. Важливістю створення чітких схем диференціальної діагностики різних форм ЛГ.
7. Важливістю створення алгоритмів диференційованого лікування різних форм ЛГ, враховуючи накопичений досвід лікування цієї патології, доказовість окремих підходів до терапії, препаратів, прийнятих для лікування ЛГ та її ускладнень з урахуванням можливості застосування їх в Україні на даному етапі.
8. Потребою донести інформацію про діагностику та лікування ЛГ до сімейних лікарів, терапевтів, пульмонологів, кардіологів, ревматологів, інфекціоністів, гастроентерологів.
9. Важливістю ознайомлення лікарів із можливістю хірургічного лікування деяких форм ЛГ, показаннями до оперативного лікування, його видами та результатами, післяопераційним диспансерним наглядом.
10. Важливістю звернути увагу організаторів системи охорони здоров’я на необхідність організації спеціалізованих центрів ЛГ з метою створення єдиного реєстру хворих, які страждають від ЛГ, надання методичної та лікувально-консультативної допомоги, подальшого вивчення питань епідеміології, етіології, клінічних проявів захворювання та лікування.
Достовірна інформація з обстеження та лікування ЛГ важлива з таких причин:
— діагностичні обстеження є комплексними та часто вимагають міждисциплінарної взаємодії;
— лікування не обмежується препаратами, можуть знадобитися інтервенційні та хірургічні втручання;
— лікування є дорогим і має побічні дії. Успіх лікування залежить від правильної діагностики. При цьому важливо проводити ретельну диференціальну діагностику, враховуючи причину ЛГ і ступінь її тяжкості.
Ці рекомендації складено на підставі протоколів діагностики та лікування, прийнятих Європейським товариством кардіологів (European Sociaty of Cardiologists, ESC, 2009) і Європейським респіраторним товариством (European Respiratory Society, ERS, 2009), Фондом американського кардіологічного коледжу та Американською асоціацією серця (American College of Cardiology Foundation/American Heart Association, ACCF/AHA, 2009, 2013), та особистого багаторічного досвіду укладачів рекомендацій у спостереженні за хворими на цю патологію та їх лікуванні.
До історії вивчення ЛГ
Вимірювання тиску в легеневій артерії (ЛА) і вивчення гемодинаміки малого кола кровообігу тривалий час було ускладнене у зв’язку з відсутністю можливості прямого або непрямого вимірювання тиску в ЛА у людини доти, поки W. Forßman (1929) вперше у світі не продемонстрував безпеку катетеризації правої половини серця, a A. Cournand і D. Richard в 1951 році використали методику зондування Forßman для діагностичних цілей, за що всі троє отримали Нобелівську премію (1956)
Однак широке впровадження катетеризації серця та судин стало необхідним із початком розвитку серцево-судинної хірургії в 50-ті роки минулого століття (J.W. Kirklin, 1955; А.Н. Бакулєв, 1956; Н.М. Амосов, 1957; Є.Н. Мешалкін, 1961, та ін.). Удосконалення катетерів, використання катетеризації, у тому числі з рентгеноконтрастним дослідженням камер серця та судин, поява методу мікрокатетеризації, застосування плаваючого катетера (H. Swan, W. Ganz, 1970) дали потужний поштовх до вивчення легеневої гемодинаміки. У зв’язку з цим стало можливим визначити рівень тиску в ЛА, гемодинаміку малого кола кровообігу, а також довести, що при цілій низці захворювань (на сьогодні їх налічується більше 100), які супроводжуються підвищенням тиску в ЛА, реєструється підвищення опору в судинах легенів. Упровадження непрямих методів вимірювання артеріального тиску (АТ) в ЛА, розробка безкровних методів оцінки тиску в ЛА за допомогою методу доплерехокардіографії дало можливість вивчати захворювання, що супроводжуються ЛГ, широкому колу лікарів різних спеціальностей.
Визначення
Згідно з визначенням Європейського товариства кардіологів (2008), легенева гіпертензія (ЛГ) — це гемодинамічний та патофізіологічний стан, який характеризується підвищенням середнього тиску в легеневій артерії понад 25 мм рт.ст. та оцінюється за даними катетеризації правих відділів серця.
Слід звернути увагу на те, що експерти з ЛГ у своєму визначенні використовують поняття «середній тиск» у ЛА, у той час як за ехокардіографічним (ЕхоКГ) дослідженням при непрямому визначенні тиску в ЛА вказується систолічний тиск у ЛА (СТЛА). Середній тиск визначають за формулами (їх декілька). Найчастіше використовується формула Хікема: Pm = A/3 + Pd, де Pm — середній динамічний артеріальний тиск (мм рт.ст.), А — пульсовий тиск (мм рт.ст.); Pd — мінімальний або діастолічний артеріальний тиск (мм рт.ст.), або за досить поширеною формулою: Pm = 0,42А + Pd, де A — пульсовий, Pd — діастолічний тиск (мм рт.ст.). У такий спосіб СТЛА, що визначається при ЕхоКГ, вищий за зазначений у визначенні ЛГ, і це вважається нормою.
Класифікація легеневої гіпертензії
Залежно від особливостей гемодинаміки малого кола кровообігу розрізняють такі види ЛГ (табл. 1).
Клінічні стани з наявністю ЛГ поділяються на 6 груп з різноманітними патологічними, патофізіологічними, прогностичними особливостями та підходами до лікувальної тактики.
Оновлена клінічна класифікація легеневої гіпертензії (згідно з 5th WSPH (World Symposium on Pulmonary Hypertension), NICE, 2013)
1. Легенева артеріальна гіпертензія.
1.1. Ідіопатична (ІЛГ).
1.2. Спадкова.
1.2.1. Мутація гену, що кодує рецептори морфогенетичного протеїну кісткового мозку (BMRP2).
1.2.2. Мутація гену активін-рецептороподібної кінази ALK1 та ендогліну (з уродженою геморагічною телеангіоектазією або без неї) (ENG), кавеоліну-1 (CAV1), KCN.
1.2.3. Невідомої етіології.
1.3. ЛГ, асоційована з ліками або токсинами.
1.4. ЛГ, асоційована:
1.4.1. Із захворюваннями сполучної тканини.
1.4.2. ВІЛ-інфекціями.
1.4.3. Портальною гіпертензією.
1.4.4. Уродженими вадами серця.
1.4.5. Шистосомозом.
1.4.6. Венооклюзивна хвороба легенів і/або гемангіоматоз легеневих капілярів.
1.4.7. Персистуюча ЛГ немовлят.
2. ЛГ, асоційована з ураженням лівої половини серця.
2.1. Систолічна дисфункція.
2.2. Діастолічна дисфункція.
2.3.Захворювання клапанів.
2.4. Вроджена/набута обструкція притоку/відтоку та вроджена кардіоміопатія.
3. ЛГ, асоційована із захворюваннями легенів та/або гіпоксією.
3.1. При хронічній обструктивній хворобі легенів.
3.2. При інтерстиціальних хворобах легенів.
3.3. При інших захворюваннях легенів зі змішаними обструктивно-рестриктивними причинами.
3.4. При порушенні дихання під час сну.
3.5. При гіповентиляційній патології альвеол.
3.6. При хронічному перебуванні на високогір’ї.
3.7. При вадах розвитку легенів.
4. Хронічна посттромбоемболічна легенева гіпертензія.
5. ЛГ із невідомими та/або багатофакторними механізмами.
5.1. Гематологічні захворювання: хронічна гемолітична анемія, мієлопроліферативні захворювання, спленектомія.
5.2. Системні захворювання: саркоїдоз, гістіоцитоз Х, лімфангіолейоміоматоз.
5.3. Метаболічні порушення: хвороби накопичення глікогену, хвороба Гоше, захворювання щитоподібної залози.
5.4. Інші причини: пухлинна обструкція, фіброзуючий медіастиніт, хронічна ниркова недостатність, сегментарна ЛГ.
Сьогодні експерти та вчені більше уваги приділяють легеневій артеріальній гіпертензії. Мова йде про 1, 3 і 4-й пункти класифікації, тому що саме при прекапілярних формах ЛГ (табл. 1) відзначається тяжкий прогноз захворювання. Розробка сучасних видів лікування також відбувається для цих груп хворих, що не завжди може бути апроксимовано на інші форми ЛГ.
Для оцінки ступеня ЛГ при всіх формах використовуються рекомендації ВООЗ (2003) з виділенням 3 ступенів підвищення тиску в ЛА:
— легкий (25–45 мм рт.ст.);
— середній (46–65 мм рт.ст.);
— виражений (більше 65 мм рт.ст.).
Відповідно до функціональних класів (ФК) серцевої недостатності (СН), експертами ВООЗ (1998) була запропонована функціональна класифікація ЛГ:
I ФК — немає значного обмеження звичайної фізичної активності, звичайна активність не викликає посилення задишки, слабкості, болю в грудній клітці, пресинкопе (безсимптомна ЛГ).
II ФК — помірне зменшення фізичної активності; у спокої дискомфорт відсутній, але звичайний рівень активності викликає появу помірних симптомів (задишки, слабкості, болю в грудній клітці, пресинкопе).
III ФК — значне зниження фізичної активності: у спокої дискомфорт відсутній, але менший, ніж звичайний, рівень активності викликає появу помірних симптомів (задишки, слабкості, болю в грудній клітці, пресинкопе).
IV ФК — задишка та/або слабкість у спокої: симптоми збільшуються при мінімальному навантаженні, нездатність виконувати будь-які фізичні навантаження, можуть бути присутні ознаки правошлуночкової недостатності.
Функціональна класифікація важлива для оцінки тяжкості та прогнозу хворих на ЛАГ, а також для показань щодо різних методів лікування та оцінки результатів їх застосування.
Епідеміологія
Істинна захворюваність і навіть смертність від ЛГ на сьогодні невідомі. Тільки в США кількість хворих на ЛГ, за даними Управління з контролю харчових продуктів та лікарських засобів (Food and Drug Administration, FDA, США), оцінюється приблизно в 100 тисяч людей. У 80-х роках минулого сторіччя наводилася цифра 1–2 хворі на 1 млн населення. Вже за останніми даними, наприклад, Національного французького реєстру (M. Humbert et al., 2006), її поширеність оцінюється в 15 хворих на 1 млн чоловік. Із групи ЛАГ ІЛГ зустрічається частіше за інших (6 на 1 млн чоловік — 39,2 % усіх випадків ЛАГ). Сімейна ЛГ зустрічається в 3,9 % ЛАГ, із частотою мутацій понад 50 %, спорадичних випадків — 20 %. ЛГ, асоційована з вродженими вадами серця (ВВС), — 11,3 %, часто зустрічається при синдромі Ейзенменгера, дефекті міжшлуночкової й міжпередсердної перегородки (зазвичай невеликому, < 1,0 і < 2 см у діаметрі відповідно), загальному артеріальному стовбурі, при вадах серця з ЛГ після хірургічної корекції вади. ЛАГ, асоційована з системними захворюваннями сполучної тканини, становить 10,4 % серед хворих на ЛАГ, із застосуванням аноректичних препаратів — 9,5 %, з ВІЛ-інфекцією — 6,2 %. В основному ці дані отримані з національних реєстрів і результатів клінічних досліджень. Унаслідок збільшення поінформованості лікарів про ЛАГ зростає і рівень виявлення захворювання. За даними епідеміологічного дослідження, у якому ЛГ визначалася при ЕхоКГ-обстеженні, із 480 пацієнтів, у яких був підвищеним СТЛА, 78 % мали захворювання серця, 10 % — захворювання легень, 3,5 % — ЛАГ, 1,5 % — тромбоемболію (E. Gabbay et al., 2007). В Україні даних про поширеність і смертність від ЛГ та її різних форм немає, що пов’язано з відсутністю єдиного методично-консультативного центру та реєстру цих хворих.
Морфологічні зміни при ЛГ
Для всіх форм ЛАГ загальними ознаками є гіпертрофія та/або дилатація правого шлуночка, дилатація правого передсердя, розширення основного стовбура та головних гілок ЛА. Стінка стовбура та великих гілок стає товстішою. Відзначається ліпоїдоз їх стінок. Інтима має декілька еластичних мембран, що надають їй шаруватої будови (рис. 1).
Ступінь вираженості цих змін залежить від висоти тиску в ЛА, величини легенево-судинного опору (ЛСО) і тривалості захворювання. Різні рівні опору при пре- і посткапілярній ЛГ позначаються на морфологічній картині легеневих судин.
При прекапілярних формах ЛГ (ЛАГ), у першу чергу при ІЛГ як еталоні патогістологічних змін і клінічних проявів ЛАГ, до патологічного процесу приєднуються легеневі артерії, переважно дрібного калібру (40–300 мкм у діаметрі), зміни в судинах системи ЛА значно виражені та стосуються всіх шарів стінки: проліферація інтими, аж до облітерації судини. Характерний розвиток внутрішньолегеневих шунтів і утворення гломусних анастомозів. Часто (за нашими даними, близько 90 %) у дрібних судинах легенів виявляються мікротромбози (рис. 2).
Морфологічні ознаки ЛАГ при системних захворюваннях сполучної тканини спостерігаються у 80 % пацієнтів, при портальній гіпертензії — у 6 разів частіше, ніж у загальній популяції, при ВІЛ — у 600 разів частіше, ніж у загальній популяції, серед тих, які приймають препарат амінорекс, що знижує апетит, частота ЛАГ в 52 рази вища, ніж у популяції.
При посткапілярній ЛГ в артеріолах і дрібних артеріях виражена гіпертрофія циркулярних м’язових волокон, з’являються додаткові еластичні мембрани та поздовжній м’язовий шар, розташований зсередини від внутрішньої еластичної мембрани. Характерними є виражена гіпертрофія м’язових елементів дрібних вен, склероз їх інтими.
Існує декілька морфологічних класифікацій ЛАГ. У 1958 р. D. Heath і J. Edwards надали класичний опис структурних змін легеневих судин при ЛАГ, поділивши їх на 6 стадій: I стадія (гіпертрофія медії) і II (клітинна проліферація інтими) є початковими та, можливо, зворотними. Стадія III характеризується оклюзуючими просвіт змінами: подальшим потовщенням медії, гіперплазією інтими та фіброзно-еластичної тканини. Стадія IV — витончення медії, дилатація судини, оклюзія її просвіту фіброзною тканиною. III cтадія — в найкращому випадку частково зворотна. IV стадія абсолютно незворотна. Стадії V і VI є термінальними: виникають ангіоматозні зміни у вигляді множинних тонкостінних судин, які продовжуються у капіляри стінок альвеол (V), фібриноїдний некроз і тяжкий реактивний запальний ексудат у всіх шарах судин (VI).
Однак клінічне значення виявлення характерних для ЛАГ гістологічних змін у легеневих судинах незначне, тому що для нього необхідна прижиттєва біопсія легенів (відкрита або ендоскопічна), яка тепер не рекомендується у зв’язку з можливістю серйозних ускладнень.
Експертами ВООЗ у 1998 році запропонована морфологічна класифікація уражень судин при ЛГ, яка була модифікована на Всесвітньому симпозіумі з ЛАГ у Венеції у 2003 р. (табл. 2). Ця класифікація має значення при морфологічній ідентифікації захворювання швидше за все посмертно.
Патогенез легеневої гіпертензії
Патогенетичні механізми ЛГ різноманітні, причому в її виникненні й прогресуванні при різних захворюваннях можуть брати участь декілька факторів одночасно або послідовно. На фоні нових уявлень ключовою ланкою патогенезу ЛГ є дисфункція ендотелію легеневих судин. Вона може виникати через спадкові механізми та під впливом факторів зовнішнього середовища, які змінюють баланс метаболізму оксиду азоту, з одного боку, і ендотеліну та тромбоксану — з іншого. Це призводить до порушень вазоактивності легеневих судин і їх вазоконстрикції.
Одним із ключових моментів є збільшення концентрації ендотеліну та активація рецепторів до нього. Причиною росту концентрації ендотеліну може бути як збільшення його продукції, так і зменшення його утилізації в легенях. Іншим важливим механізмом у патогенезі ЛГ є порушення синтезу або доступності оксиду азоту (NO). Вагомим елементом у патогенезі ЛГ є також активація тромбоцитів, яка супроводжується вивільненням цілого ряду біологічно активних речовин: серотоніну, факторів згортання крові, тромбоцитарного фактору росту. Наслідком цього є прокоагулянтний стан у системі ЛА та виникнення тромботичних ускладнень. Усі зазначені порушення призводять до основних наслідків дисфункції ендотелію, які характерні для всієї 1-ї групи легеневої артеріальної гіпертензії:
1. Вазоконстрикції.
2. Ремодуляції судин.
3. Тромбоутворення.
Зазначені механізми розвитку ЛА є спільними для всієї групи ЛАГ (схема 1).
/81/81.jpg)
Однак ЛАГ за патогенезом є неоднорідною групою, та для кожного виду ЛАГ є ще й додаткові механізми її розвитку, що необхідно враховувати в лікарській практиці.
Так, пускові фактори в патогенезі ІЛГ залишаються до кінця невивченими. Як правило, дуже складно виявити єдину причину розвитку ІЛГ. До її формування мають відношення багато механізмів, що реалізуються на різних рівнях — від генетичного та молекулярного до системного. Автори Консенсусу експертів АСС і АНА (2009) вважають, що в цьому відношенні ЛАГ можна порівняти з онкологічними захворюваннями або атеросклерозом, враховуючи всю сукупність причин, сприяючих факторів і патогенетичних механізмів.
На сьогодні однією з відомих причин є мутація гена BMPR2, що зазвичай успадковується за аутосомно-домінантним типом з неповною пенетрантністю гена. Цей варіант називається «сімейна ЛАГ» і зустрічається менше ніж у 10 % усіх випадків патології. Однак установлено, що існують також аутосомно-рецесивні форми успадкування легеневої гіпертензії, і виділено безліч інших, негенетичних причин ЛГ, при цьому значна частка їх не є очевидною причиною розвитку даної патології.
Для спорадичної форми ІЛГ виявлений цілий ряд можливих факторів ризику її розвитку: ліки та хімічні речовини, ВІЛ-інфекція, портальна гіпертензія тощо, які викликають розвиток ІЛГ за наявності генетичної схильності. Тобто на сьогодні немає сумніву, що ІЛГ являє собою групу клінічних синдромів із різною етіологією.
При спорадичній формі ІЛГ це може бути поліморфізм генів, що кодують NО-синтазу, карбамілфосфат синтазу, синтез переносників серотоніну, або інші стимули, що відповідають за контроль росту легеневих судинних клітин. Тобто окремі патобіологічні процеси в клітинах і тканинах хворих на ІЛГ встановлено, однак взаємодії цих механізмів у розвитку та прогресуванні захворювання точно невідомі. Можна припустити, що спадкова схильність реалізується під впливом факторів ризику, викликаючи зміни різних типів клітин (тромбоцити, гладком’язі, ендотеліальні, запальні клітини), а також в екстрацелюлярному матриксі легеневого мікроциркуляторного артеріального русла.
Дисбаланс між тромботичними, мітогенними, вазоконстриктивними факторами та механізмами зворотної дії — антикоагулянтними, вазодилатуючими — сприяє вазоконстрикції та тромбозам, проліферативним і запальним змінам у легеневих судинах, що призводить до розвитку та прогресування патологічних обструктивних процесів у легеневих судинах, збільшення ЛСО, перевантаження та декомпенсації ПШ, смерті хворих.
При тромбоемболії ЛА (ТЕЛА) ЛГ розвивається внаслідок 2 основних механізмів:
1) обтурації гілок ЛА тромботичними масами і пов’язаного із цим підвищення ЛСО, що призводить до порушення ендотеліальної функції в судинах ЛА;
2) впливу рефлекторних і гуморальних механізмів із вивільненням біологічно активних речовин з елементів тромбів (переважно тромбоцитів), що особливо важливо для формування посттромбоемболічної ЛГ (схема 2).
/82/82.jpg)
При системних захворюваннях сполучної тканини (системна склеродермія, системний червоний вовчак, поліартрит, аортоартеріїт з ураженням системи ЛА тощо) як пусковий механізм у патогенезі ЛАГ має значення зменшення судинного русла ЛА та підвищення у зв’язку з цим ЛСО за рахунок запальних і склеротичних змін у цих судинах, що призводять до порушення їх ендотеліальної функції.
В основі підвищення СТЛА у хворих на ХОЗЛ і при торакодіафрагмальних хворобах, а також в осіб, які проживають на високогір’ї, з синдромом нічного апное, з синдромом Піквіка пусковим стимулом порушення ендотеліальної функції легеневих судин є альвеолярна гіпоксія, що було доведено в класичних роботах Ейлером і Лільєстрандом (1946) і відоме як рефлекс Ейлера — Лільєстранда. Згідно з існуючими даними, медіаторами спазму судин є катехоламіни, гістамін, ангіотензин II, тромбоксан А2 і деякі інші простагландини, вазопресин, деякі лейкотрієни. Слід зазначити, що вазоактивні медіатори регулюють не тільки судинний тонус, але й проникність судинної стінки, впливають на тромбоутворення та проліферацію гладком’язих клітин судинної стінки, фібробластів. Важливо звернути увагу, що ці зміни мають при цих захворюваннях часто локальний характер, відповідно до ділянок гіповентиляції альвеолярної тканини.
До патогенетичних механізмів ЛГ у хворих на ХОЗЛ належить також порушення функції дихальних м’язів, підвищення внутрішньогрудинного тиску, збільшення хвилинного об’єму крові в результаті гіпоксичного подразнення хеморецепторів аортальної та синокаротидної зони, порушення реології крові з формуванням вторинної поліцитемії. При розвитку ЛГ у хворих із сонним апное має значення часткове звуження верхніх дихальних шляхів під час сну.
Численні клінічні дослідження цих груп хворих із використанням катетеризації ПШ і ЛА дозволили зробити важливий висновок про те, що СТЛА у хворих із бронхолегеневими захворюваннями, як правило, невеликий, досягає не більше 40–50 мм рт.ст. і збільшується дуже повільно, зростаючи за 2–3 роки в середньому на 2 мм рт.ст., або практично не змінюється. У той же час слід відмітити, що навіть невелике підвищення тиску в ЛА у хворих на ХОЗЛ може мати прогностичне значення. При СТЛА > 45 мм рт.ст. тривалість життя рідко перевищує 5 років (Galie, 2004).
При вроджених вадах серця (ВВС) зі збільшеним легеневим кровотоком (дефект міжшлуночкової перегородки (ДМШП), незарощення артеріальної протоки, дефект міжпередсердної перегородки, загальний артеріальний стовбур, аномальний дренаж легеневих вен, дефект аортолегеневої перегородки, комбіновані вади) ЛГ без ранньої корекції вад зустрічається приблизно у 30 % дітей із ВВС.
На жаль, у деяких випадках вона може зберігатися та навіть прогресувати, незважаючи на адекватне хірургічне лікування. Крім ВВС зі збільшеним легеневим кровотоком, ЛГ може спостерігатися при низці ціанотичних вад, підвищенні тиску в легеневих венах (венозна ЛГ).
Розрізняють вроджену та набуту форму ЛГ при ВВС. Уперше думку про вроджений характер ЛГ при цих вадах висловив Edwards (1950), виявивши подібність у будові легеневих судин плода та померлих хворих із комплексом Ейзенменгера. У цих випадках уже в дитинстві у хворих з ВВС навіть при невеликому шунті домінують ознаки ЛАГ з високим ЛСО. На фоні високого ЛСО артеріовенозний викид практично відсутній або має місце зворотне скидання крові. Цю форму ЛГ із ВВС деякі автори називають вродженим комплексом Ейзенменгера.
Однак при ВВС спостерігається частіше набута форма ЛАГ, патогенез якої пов’язаний з гіперволемією малого кола, що спочатку призводить до розвитку помірної ЛГ, коли середній тиск у ЛА не перевищує 50–55 мм рт.ст., а ЛСО залишається нормальним. Це так звана гіперволемічна форма ЛГ (В.І. Бураковський і співавт., 1975). Надалі приєднується спазм легеневих судин і їх ремодуляція, у зв’язку з чим підвищується ЛСО, що на рівні сучасних знань слід пояснити включенням фактора ендотеліальної дисфункції з каскадом дисбалансу вазоактивних речовин та приєднанням морфологічних змін легеневих судин у вигляді проліферації інтими, еластофіброзу тощо, у розвитку яких, можливо, мають значення й часті запальні процеси в бронхолегеневій системі в дитячому віці через гіперволемію малого кола. Тобто патогенез ЛГ при ВВС є також складним, мають значення такі фактори:
— перевантаження лівого передсердя;
— переповнення венозного русла легень;
— запальні процеси в легенях;
— рефлекторний спазм артеріол;
— дисфункція ендотелію,
які призводять до ЛАГ, ремодуляції судин легень, тромбоутворення.
Пізню стадію в розвитку вроджених вад серця і великих судин із системно-легеневим шунтом при виникненні перехресного або зворотного скидання крові прийнято називати синдромом Ейзенменгера.
Механізм розвитку ЛАГ при ВІЛ-інфекції залишається незрозумілим. Припускається непрямий вплив ВІЛ через цитокіни, ендотелін-1, ростові фактори, тому що вірусна ДНК у клітинах легеневого ендотелію не виявляється. Можливо, має значення генетична схильність, тому що ЛАГ розвивається тільки в меншої частини ВІЛ-інфікованих хворих, у той же час при дослідженні мутацій BMPR2, які характерні для спадкової форми ІЛГ, у 20 хворих на ВІЛ-асоційовану ЛАГ не було виявлено. Є припущення, що в патогенезі ЛАГ у цих хворих мають значення й інші механізми:
1. ВІЛ-інфіковані альвеолярні макрофаги вивільняють численні біологічно активні речовини, такі як аніон, лімфокіни, тканинний фактор некрозу а, протеолітичні ферменти.
2. Може мати місце прямий або непрямий вплив ВІЛ-регуляторного гена, що може сприяти через стимуляцію ендотеліальних клітин вивільненню трансформуючого фактору росту , епідермального фактору росту та тромбоцитарного фактору росту, що, у свою чергу, може потім впливати на проліферацію ендотеліальних клітин.
3. Можливо, білок ВІЛ ЦР-120 безпосередньо стимулює виробництво моноцитами тканинного фактору некрозу а і ендотеліну-1.
4. Також передбачається аутоімунний механізм у розвитку ВІЛ-асоційованої ЛАГ.
У хворих на цироз печінки до патологічного процесу залучається мале коло кровообігу з розвитком ЛГ. У літературі комбінація ЛАГ і портальної гіпертензії іноді описується під назвою «портопульмональна гіпертензія» (ППГ). Хворі на ППГ становлять 8 % від усіх випадків ЛАГ, а у тих, що очікують на трансплантацію печінки, частота ЛАГ досягає 3,5–8,5 %, а за деяким даними літератури — не менше 10 %. Патогенез розвитку ЛГ у цих хворих найчастіше пояснюють гіперволемією малого кола кровообігу внаслідок портопульмонального шунтування. Має значення й порушення метаболізму місцево діючих вазоактивних речовин (оксид азоту, ендотелін-1 тощо), що виробляються синусоїдальними клітинами, сприяють підвищенню портального судинного тонусу. Причиною гіпердинамічного стану легеневого кровотоку можуть бути судинорозширювальні речовини, які надходять через мережу портокавальних шунтів, такі як глюкогон, адреномедулін, простагландини, аденозин тощо, які зазвичай виводяться печінкою.
Особливості патогенезу інших форм легеневої гіпертензії
Венозна (посткапілярна) ЛГ. До ендотеліальної дисфункції (ЕД) судин у понад 80–90 % випадків призводять патології лівих відділів серця, які характеризуються підвищенням тиску в лівому передсерді (ЛП). При мітральній недостатності, аортальних вадах, ішемічній хворобі серця (ІХС) і дилатаційній кардіоміопатії (ДКМП) основною причиною підвищення тиску в ЛП є порушення систолічної функції лівого шлуночка, а при артеріальній гіпертензії, гіпертрофічній кардіоміопатії (ГКМП), амілоїдозі серця раніше розвивається діастолічна дисфункція. При мітральному стенозі, міксомі ЛП, тромбозі, у тому числі кулястому, підвищення тиску в ЛП виникає у зв’язку з порушенням відтоку крові з нього.
Як правило, у більшості хворих ЛГ зі вказаними патологіями не досягає високих цифр, відповідаючи I–II ст. Це так звана пасивна ЛГ (табл. 1). У решти цих хворих ЛГ є непропорційно високою. Вона має назву реактивної посткапілярної ЛГ. Диференціальна діагностика між цими формами ґрунтується на різниці градієнту транспульмонального тиску (ГТТ) (середній тиск в ЛА мінус тиск заклинювання ЛА, що вимірюється при катетеризації). Якщо ГТТ < 12 мм рт.ст. — це пасивна ЛГ, якщо ГТТ > 12 рт.ст. — це реактивна (непропорційна) ЛГ. Саме при останній формі ЛГ при лікуванні, крім основного захворювання, додаються вазодилататори, які рекомендовані при ЛАГ.
При мітральному стенозі можливе підвищення СТЛА до 100 мм рт.ст. і більше. Цей стан зі значною ЛГ при МС позначається як другий бар’єр, що виникає:
— внаслідок тривалого існування вираженого мітрального стенозу, тромбоутворення, запальних і склеротичних змін у дрібних судинах легенів;
— внаслідок впливу рефлекторних (рефлекс Китаєва) і гуморальних механізмів з вивільненням біологічно активних речовин з елементів тромбів (здебільшого тромбоцитів).
Діагностика ЛГ
ЛГ у клінічному відношенні визначають не як нозологічну форму захворювання, а як синдром, що є спільним для всіх клінічних форм і проявляється однаковими клінічними ознаками (схема 3).
Етапи діагностики ЛГ:
1. Підозра на наявність у хворого ЛГ:
— клінічні симптоми;
— фізикальне обстеження.
2. Верифікація діагнозу ЛГ:
— ЕКГ;
— рентгенографія органів грудної клітки;
— трансторакальна ЕхоКГ;
— гемодинамічні показники — катетеризація правих відділів серця, вазореактивний тест.
3. Установлення клінічного класу ЛГ (згідно з класифікацією):
— функція зовнішнього дихання (ФЗД);
— вентиляційно–перфузійна сцинтиграфія легень;
— КТ;
— ангіопульмонографія;
— загальний і біохімічний аналізи крові, імунологічні дослідження, тест на ВІЛ, УЗД внутрішніх органів, мозковий натрійуретичний гормон.
4. Функціональна здатність хворих:
— тест з 6-хвилинною ходьбою;
— кардіопульмональний тест (пікове споживання О2).
Клінічні ознаки ЛАГ
Ретельно зібраний анамнез з урахуванням факторів навколишнього середовища, сімейного анамнезу, шкідливих звичок, професійних впливів, зв’язку захворювання з вагітністю, пологами, оперативними втручаннями тощо є запорукою успіху в постановці діагнозу ЛГ. Особлива увага повинна бути спрямована на пацієнтів, які в анамнезі мають прийом препаратів або токсинів, що можуть викликати легеневу гіпертензію.
Оновлений рівень ризику препаратів і токсинів, здатних викликати ЛАГ:
Визначений:
— амінорекс;
— фенфлурамін;
— дексфенфлурамін;
— токсична рапсова олія;
— бенфлуорекс.
Ймовірний:
— амфетаміни;
— L-триптофан;
— метамфетаміни.
Можливий:
— кокаїн;
— фенілпропаноламін;
— звіробій;
— хіміотерапевтичні препарати;
— селективний інгібітор зворотного захоплення серотоніну;
— перголід.
Малоймовірний:
— пероральні контрацептиви;
— естрогени;
— паління.
Специфічних симптомів для ЛГ немає, або початкові прояви ЛГ можуть бути мінімальними, що є причиною пізньої діагностики захворювання. Підозра на ЛАГ повинна виникнути з появою таких загальних симптомів, як задишка, загальна слабкість, стомлюваність, зниження працездатності. Клінічні симптоми ЛАГ — задишка, слабкість, біль у ділянці серця, запаморочення та синкопальні напади — зумовлені двома основними причинами: порушенням постачання кисню до органів і зниженням серцевого викиду.
Найчастіше скаргою у хворих на ЛАГ є задишка інспіраторного характеру. Вона не тільки є скаргою, але й об’єктивним симптомом. Чим вищий тиск у ЛА, тим чіткіше виражена задишка, хоча не в усіх випадках ступінь її вираженості відповідає ступеню підвищення тиску в ЛА. Нападів задухи зі станом ортопное не спостерігається.
Серцебиття зустрічається так само часто, як задишка. Воно супроводжує задишку при фізичному навантаженні та відображає зниження серцевого викиду.
Нерідко у хворих на ЛАГ спостерігаються запаморочення, синкопе (серцеві непритомності). Звичайна тривалість непритомності 2–5 хв, інколи до 20–25 хв. Як правило, ці стани виникають при фізичному навантаженні і є результатом фіксованого серцевого викиду.
Біль у ділянці серця є частою скаргою при ЛГ. Часто він нагадує типовий біль при стенокардії: має стискаючий характер, локалізується за грудиною, іррадіює в руку, лопатку, посилюється при фізичному навантаженні, однак триває від декількох хвилин до декількох годин і доби. Зазвичай не купірується нітрогліцерином, на відміну від ІХС, завжди супроводжується задишкою.
Кашель також є частою скаргою хворих на ЛГ. Причиною кашлю є тиск на бронхи розширеними та ущільненими легеневими артеріями. Особливістю такого кашлю є його непродуктивність і приступоподібний характер, посилюється в лежачому положенні.
В окремих випадках спостерігається зміна голосу (хриплий, сиплий, осілий тощо). Вважається, що цей феномен пов’язаний зі здавленням n. recurens розширеним основним стовбуром та/або лівою гілкою ЛА у хворих із високим ступенем ЛАГ.
Кровохаркання теж може бути ознакою ЛАГ, що пов’язано з розривом бронхолегеневих анастомозів, дрібних склерозованих артерій, розвитком інфаркту легенів.
Важливим етапом діагностики ЛГ є фізикальне обстеження. Насамперед слід звернути увагу на зовнішній вигляд хворого. При розвитку хвороби з дитинства й вираженій ЛГ відмічається відставання в масі тіла. Нерідко спостерігається деформація скелета грудної клітки, ціаноз, нігті у вигляді годинникових стекол, пальці рук і ніг у вигляді барабанних паличок. Уздовж лівого краю грудини та в епігастральній ділянці можна бачити пульсацію правого шлуночка, яка краще визначається пальпаторно. Визначення границь серця для діагностики ЛАГ не має високої інформативності, тому що їхній зсув може бути пов’язаний з розвитком серцевої недостатності.
При аускультації серця визначається акцент 2-го тону над ЛА, що вважається надійною ознакою підвищення тиску в ЛА. Іноді прослуховується так зване систолічне клацання, що пов’язане зі склерозом ЛА та її аневризмою. При розвитку відносної недостатності клапана ЛА прослуховується протодіастолічний шум Грехема Стілла. Іноді прослуховується ритм галопу над правим шлуночком (табл. 3).
/86/86.jpg)
Фібриляція передсердь не є характерною для ЛАГ. Артеріальний тиск має здатність до зниження, що пов’язано з рефлексом В.В. Паріна. Однак не виключається і комбінація ЛАГ з артеріальною гіпертензією.
Інформативність інструментальних методів дослідження для діагностики ЛАГ
Електрокардіографія
ЕКГ — це одне з перших обстежень при підозрі на ЛАГ. Виявляють гіпертрофію ПШ, P-pulmonale, часткову або повну блокаду правої ніжки пучка Гіса. При цьому реєструється так званий R- або qR-тип ЕКГ у відведеннях III, II, AVF, V1-V2, що характеризує переважно гіпертрофію шляхів відтоку ПШ. Зниження сегмента ST і негативний зубець Т у цих відведеннях пов’язують також із систолічним перевантаженням ПШ (рис. 3).
/86/86_2.jpg)
Однак ЕКГ не відзначається достатньою чутливістю (55 %) і специфічністю (70 %). Ознаки гіпертрофії ПШ і перевантаження правого передсердя є пізніми та непрямими ознаками ЛАГ. При слабко вираженій ЛАГ на ЕКГ у спокої можна не виявити ніяких характерних змін. Проте саме дані ЕКГ за відсутності специфічних клінічних ознак є єдиною достатньою підставою для подальшого дослідження з метою підтвердження ЛАГ (ЕхоКГ, а потім катетеризація правих відділів серця).
У хворих на ЛАГ тривалий час зберігається синусовий ритм, тому при виявленні ознак ЛГ і фібриляції передсердь потрібне подальше обстеження для виключення посткапілярної форми ЛГ.
Рентгенографія
Рентгенологічне дослідження органів грудної клітки дозволяє виявити патологічні зміни в 90 % випадків. Серед найчастіших симптомів: збільшення конуса ЛА (вибухання 2-ї дуги по лівому контуру серця в прямій проекції), збільшення діаметра правої гілки ЛА (у нормі 14 мм), «збідніння» легеневого малюнка на периферії за рахунок звуження та спорожніння дрібних судин легенів (рис. 4). Можливе виявлення розширення правого передсердя та ПШ, які краще визначаються в бічній проекції.
При рентгенографії визначають легеневі захворювання, застійні явища в легенях як ознаку посткапілярної ЛГ, ознаки збільшення лівих відділів серця, зміни конфігурації серця при вроджених вадах серця, що важливо мати на увазі для диференціальної діагностики ЛГ.
Ехокардіографія
Серед неінвазивних обстежень ЕхоКГ має найбільшу чутливість і специфічність і є найважливішим методом скринінгу ЛГ. Типова морфологічна картина при ЛГ включає гіпертрофію та розширення ПШ, парадоксальний рух міжшлуночкової перегородки, розширення правого передсердя. У хворих на ЛАГ дилатація ПШ визначається в 75 % випадків, парадоксальний рух міжшлуночкової перегородки — у 59 %. Кінцевий діастолічний об’єм лівого шлуночка залишається нормальним або зменшеним через недостатнє його наповнення.
Для діагнозу ЛГ важливим є доплерівське вимірювання швидкості зворотного потоку на трикуспідальному клапані з оцінкою СТЛА (рис. 5).
Для розрахунків СТЛА використовують формулу: СТЛА = аP + тиск у ПП, де аP = 4v2 — систолічний транстрикуспідальний градієнт тиску, v — максимальна швидкість потоку регургітації. Тиск у правому передсерді має дорівнювати 5 мм рт.ст. за умови спадання нижньої порожнистої вени (НПВ) після глибокого вдиху більше 50 %. Якщо спадання НПВ становить менше 50 %, тиск у ПП має дорівнювати 15 мм рт.ст. (Kircher et al., 1990). Така оцінка знаходиться в тісній кореляції з інвазивно встановленим СТЛА. За даними літератури, чутливість її в діагностиці ЛГ коливається від 79 до 100 %, специфічність від 69 до 98 %. Теоретично розрахунок середнього тиску в ЛА можливий за формулою (Fisher M.R. еt al., 2009): середній тиск ЛА = 0,61 х СТЛА + 2 мм рт.ст.
У практиці зустрічаються розбіжності між даними ЕхоКГ і катетеризації ЛГ до 20 і навіть 40 мм рт.ст. Тому золотим стандартом є катетеризація правих відділів серця та ЛА із прямим вимірюванням тиску в них.
Черезстравохідна ЕхоКГ не має переваг перед трансторакальною у діагностиці ЛАГ, однак вона корисна у виявленні внутрішньосерцевих шунтів (особливо міжпередсердної перегородки) і великих тромбоемболів у ЛА, що спостерігаються при тромбоемболічній ЛГ, а також наявності тромбів у порожнинах серця.
Якщо при ЕхоКГ виявлені ознаки ЛГ із одночасним збільшенням лівих камер серця (особливо лівого передсердя), систолічною або діастолічною дисфункцією лівого шлуночка, наявністю вад аортального або мітрального клапанів, слід діагностувати посткапілярну ЛГ (клас рекомендацій IІа, рівень доказовості С).
Пропонується таблиця для визначення ЛГ на основі пікової швидкості трикуспідальної регургітації (табл. 4).
Оскільки ехокардіографічному дослідженню для діагностики ЛГ надається велике значення, наводимо критерії її діагнозу в сукупності з іншими методами дослідження, запропоновані експертами ВООЗ (2009) (табл. 5).
Тести для дослідження бронхолегеневої системи
Дослідження ФЗД і дифузійної здатності легенів необхідні для виключення бронхообструктивних захворювань (ХОЗЛ у першу чергу), виражених рестриктивних станів із метою диференціальної діагностики ЛГ і уточнення тяжкості ураження легенів. При дослідженні дифузійної здатності легенів у хворих на ЛАГ виявляється зниження до 60–80 % від норми. Значення менше 50 % від необхідного вказує на хворобу легенів або захворювання сполучної тканини.
При пульсоксиметрії при ЛАГ виявляються нормальні показники або дещо знижені, в межах 93–95 %. Також виявляється незначне зменшення напруження кисню та зазвичай знижений через альвеолярну гіпервентиляцію рСО2. Наявність обструкції дихальних шляхів свідчить на користь ХОЗЛ. Зниження легеневих об’ємів і дифузійної здатності легенів можуть вказувати на паренхіматозні й інтерстиціальні захворювання легенів. Полісомнографія дозволяє виключити обструктивні порушення під час сну.
Перфузійна пульмосцинтиграфія з Те99m повинна бути виконана для виключення хронічної тромбоемболічної ЛГ (ХТЕЛГ). При внутрішньовенному введенні ізотопу вона дає можливість підтвердити ТЕЛА у 81 % випадків, якщо виявлені перфузійні дефекти, що охоплюють цілу легеню або її частину. Наявність лише сегментарних дефектів знижує цей показник до 50 %, а субсегментарних — до 9 %.
При ЛАГ зазвичай спостерігається нормальна або низька картина. Специфічність перфузійної сцинтиграфії нижча, ніж її чутливість, тому при даних сцинтиграфії з відхиленнями від норми потрібно провести легеневу артеріографію.
Комп’ютерну томографію (КТ) застосовують для диференціальної діагностики, тому що при ЛАГ паренхіма легенів у нормі. Спіральна КТ дає можливість при проведенні її з контрастуванням вивчити стан ЛА і її розгалужень. Для діагностики ТЕЛА вона є надійним методом, заміняючи ангіографію судин легенів.
Катетеризація правих відділів серця
Катетеризація правих відділів серця необхідна для підтвердження наявності ЛАГ та визначення її тяжкості, виключення захворювань лівих відділів серця та внутрішньосерцевого шунтування (необхідно визначити тиск заклинювання, збільшення якого вище 12–15 мм є характерним для таких хворих), а також для проведення проби з вазодилататором, так званого вазореактивного тесту. Показання для проведення КПС наведені в табл. 6.
Вазореактивний тест
Проведення тесту необхідне для виявлення хворих, так званих відповідачів, яким може бути показана терапія антагоністами кальцію. Використовуються вазодилататори короткої дії: інгаляції оксиду азоту, ілопросту, внутрішньовенне введення аденозину або простацикліну. Усі вони швидко знижують легенево-судинний опір, майже не впливаючи на тонус судин великого кола. Аденозин вводять шляхом в/в інфузії, починаючи з 50 мг/кг/хв, збільшуючи швидкість кожні 2 хв до появи побічних ефектів (гіпотензія, головний біль, почервоніння тощо). Результат оцінюють за зниженням легеневого судинного опору у відповідь на найбільшу дозу, що не викликає побічних ефектів. Пробу з простацикліном (епопростенол) проводять так само, але початкова швидкість уведення становить 2 нг/кг/хв, а збільшують її кожні 30 хв. Оксид азоту вводять інгаляційно: початкова концентрація речовини в суміші, що вдихається, 6–13 мг/м3, її збільшують з інтервалом у декілька хвилин до досягнення максимального ефекту. Пробу з ілопростом проводять таким чином. За допомогою компресійного небулайзера вводять 5 мкг ілопросту протягом ~15 хв. Після закінчення інгаляції реєструють гемодинамичні параметри та гази крові. Позитивною гострою відповіддю в цьому дослідженні АССР і ESC вважають параметри: зниження ЛАТ ≥ 10 мм рт.ст. до абсолютного значення середнього АТ в легеневій артерії ≤ 40 мм рт.ст. з підвищеним або незмінним серцевим викидом. За рекомендаціями Американської асоціації серця (АНА) 2009 року, у пацієнтів із початковим середнім АТ в легеневій артерії < 40 мм рт.ст. позитивною відповіддю може вважатися зниження середнього АТ в легеневій артерії на 20 % і більше.
Показання до проведення вазореактивного тесту наведено в табл. 7.
Інші методи дослідження
Найкращим методом, що дозволяє діагностувати ТЕЛА та встановити показання до ендартеректомії, вважається ангіопульмонографія.
УЗД внутрішніх органів дозволяє діагностувати цироз печінки та/або портальну гіпертензію. Однак необхідно за іншими методами (клінічними, вимірювання ЦВТ, використання кольорової доплерографії) виключити портальну гіпертензію внаслідок правошлуночкової СН.
Як методи обстеження рекомендується дослідження загального аналізу крові: вміст гемоглобіну, еритроцитів, гематокриту, лейкоцитів, тромбоцитів. Необхідні біохімічний аналіз крові для оцінки функції нирок, печінки; імунологічний — на наявність циркулюючих антитіл до кардіоліпіну, вовчаковий антикоагулянт; коагулограма; дослідження гормонів щитоподібної залози; серологічний тест на ВІЛ.
Виявлення SSA, SCI-70 або високих титрів ДНК-антитіл вказує на захворювання сполучної тканини, а високі титри антикардіоліпінових антитіл свідчать про ХТЕЛГ.
Визначення функціональної здатності хворих на ЛГ
Об’єктивна оцінка функціональної здатності хворих на ЛГ необхідна для оцінки тяжкості ЛГ і динаміки клінічного стану на фоні проведеної терапії. На сьогодні тест з 6-хвилинною ходьбою (Т6ХХ) є найважливішим методом оцінки фізичного стану хворого при ЛГ. Він полягає у вимірюванні дистанції, пройденої пацієнтом пішки за 6 хвилин у зручному для нього темпі. Результати тесту важливі для уточнення діагнозу при комплексному обстеженні, моніторуванні динаміки захворювання, ефективності лікування та оцінки прогнозу (рівень доказовості В, клас рекомендацій І). Тест зазвичай доповнюється оцінкою задишки за G. Borg (1982) (див. додаток). Дистанція ходьби < 300 м вказує на несприятливий прогноз.
Кардіопульмональний навантажувальний тест дає можливість оцінити вентиляцію та газообмін під час дозованого фізичного навантаження, індекс пікового споживання О2, анаеробний поріг. У хворих на ЛГ знижена величина анаеробного порогу та пікового споживання О2. Цей тест не має переваг порівняно з тестом з 6-хвилинною ходьбою і застосовується рідко.
Диференціальна діагностика захворювань, що супроводжуються ЛГ
Ідіопатична легенева гіпертензія. Навіть для лікарів розвинених країн світу ІЛГ являє собою не просте клінічне завдання. Однак останні роки ознаменувалися суттєвим поповненням доказової бази у зв’язку із серією фундаментальних, в тому числі клінічних, робіт, присвячених новим інструментальним методам обстеження та лікування. Завдяки великій увазі до цієї патології останнім часом покращилася її клінічна діагностика, але діагностувати ІЛГ на ранніх етапах дуже складно.
Типові симптоми, за якими можна запідозрити ІЛГ, неспецифічні. Діагностика захворювання можлива в розгорнутій стадії захворювання.
Симптоматика сімейної та спорадичної форм ЛАГ однакова. Захворювання частіше зустрічається у молодих жінок. У розгорнутій стадії ІЛГ задишка є найбільш постійною ознакою хвороби. Цілий ряд інших клінічних проявів (запаморочення, непритомності, різка слабкість) пов’язані з малим фіксованим ударним об’ємом ЛШ через високий ЛСО. За даними Національного реєстру США, задишка була початковою ознакою даної форми ЛАГ у 60 %, частота її збільшувалася до 90 % у розгорнутій стадії, слабкість відзначалася у 19 % випадків на початку захворювання та у 47 % — у розгорнутій стадії, біль у грудній клітці — у 5 і 47 %, стан, що передує непритомності, та непритомність — у 13 і 77 % відповідно. У зв’язку з цим необхідно звернути увагу на те, що, як і при інших формах ЛАГ, у хворих відсутні клінічні ознаки застою в легенях та не буває стану ортопное. Ціаноз у спокої не є постійною ознакою, тому що насичення крові киснем (SaO2) тривалий час залишається нормальним.
Інші клінічні ознаки — акцент II тону над ЛА, виявлення гіпертрофії ПШ і ПП при ЕКГ, ЕхоКГ-обстеженні — також є спільними з іншими формами ЛАГ. З особливостей ІЛГ потрібно відзначити, що ознаки гіпертрофії ПШ різко виражені, переважають над дилатацією, довго зберігається близьке до норми насичення крові киснем.
Діагностика ІЛГ ґрунтується на послідовному виключенні інших, більш поширених причин зі схожою клінічною симптоматикою. Для скринінгу, крім простого комплексного обстеження, необхідно оцінити тиск у ЛА за допомогою ЕхоКГ.
Діагноз сімейної ЛАГ ставиться у випадках, якщо хворі щонайменше два члени сім’ї. На сьогоднішній день визначено два генетичних дефекти, які викликають ЛАГ: мутації в кістковому морфогенетичному протеїновому рецепторі 2-го типу (BMPR-2) у хромосомі 2q33, що призводять до ЛАГ у 20 % носіїв, і мутації в гені ALK-1.
При ЛГ, асоційованій з ураженням дихальної системи (ХОЗЛ, інтерстиціальне захворювання легенів), раніше за все в клініці має місце прояв легеневої недостатності — обструктивна її форма при ХОЗЛ, рестриктивна — при ураженні паренхіми легенів. Частота ЛАГ становить 30–50 % серед хворих із тяжкими захворюваннями бронхолегеневої системи. Однак менше ніж у 10 % пацієнтів СТЛА досягає більше 40 мм рт.ст. Важливим є й факт раннього розвитку недостатності ПШ, навіть при нерізкому підвищенні СТЛА та при нормальних його цифрах, що низкою авторів останнім часом пояснюється розвитком дистрофічних процесів у міокарді, пов’язаних із хронічною гіпоксемією та інтоксикацією. Тому характерні такі симптоми, як експіраторна задишка (ХОЗЛ), рання поява дифузійного ціанозу, що корелює з гіпоксемією. Виявляються ознаки емфіземи легенів, бронхообструкції із сухими хрипами, що наростають, зі змінами показників функції зовнішнього дихання, зниженням ОФВ1, пікової об’ємної швидкості й іншими показниками бронхообструкції. При паренхіматозному ураженні (хронічна інтерстиціальна пневмонія, туберкульоз, канцероматоз, пневмосклероз, стан після резекції легені) виявляються перкуторні зміни, крепітація, вологі звучні хрипи, рентгенологічні вказівки на осередкові або дифузійні зміни в легенях, зменшення об’єму легеневої тканини, зниження життєвої ємності легень за даними ФЗД.
При ХОЗЛ навіть незначне підвищення тиску в ЛА може мати поганий прогноз. Відомо, що при ЛГ більше 45 мм рт.ст. тривалість життя рідко перевищує 5 років. У таких випадках симптоми ЛГ можуть перекривати симптоми основного захворювання. Однак клінічні ознаки ЛГ (задишка, слабкість, біль у ділянці серця, запаморочення тощо) можуть бути й проявами легеневої недостатності, яка у хворих із легеневою патологією виникає раніше серцевої недостатності.
ЕКГ і рентгенографія не є досить чутливими та специфічними методами для встановлення діагнозу ЛГ у цих хворих. При ЕКГ-дослідженні нерідко ознаки гіпертрофії ПШ не виявляються. Частіше реєструється S–тип ЕКГ, блокада правої ніжки пучка Гіса. ЕхоКГ часто ускладнена через зменшення ехокардіографічного вікна внаслідок емфіземи легенів.
Легенева гіпертензія при захворюваннях, що обмежують рух грудної клітки. До захворювань, що обмежують рух грудної клітки, належать кіфоз, кіфосколіоз, хвороба Бехтерєва, перенесена торакопластика тощо. Встановлена пряма залежність ЛГ від тяжкості та давності деформації грудної клітки. Клінічні симптоми ЛГ наростають із прогресуванням основного захворювання: підсилюється задишка, наростає ціаноз. Легеневі об’єми (життєва та загальна ємність легенів) зменшені. Насичення капілярної крові О2 знижене. Діагноз ЛАГ підтверджується ЕхоКГ, у рідких випадках виникає необхідність у КПС.
При піквікському синдромі хворі скаржаться на задишку, сонливість, відзначається підвищений апетит, іноді спрага, адинамія. Характерна надлишкова маса тіла. При огляді відзначається виражений дифузійний ціаноз. Легенева недостатність зумовлена також центральними порушеннями регуляції дихання. Найчастіше знижується хвилинний об’єм дихання. Зменшується життєва та загальна ємність легень, порушується ритм дихання, частіше за типом Чейна — Стокса з періодами апное. При дослідженні газів крові виявляється гіпоксемія, підвищення напруження СО2. Спостерігаються еритроцитоз, уповільнення швидкості осідання еритроцитів. Симптоми ЛГ не відрізняються від ХОЗЛ.
Слід підкреслити, що термін «легенева артеріальна гіпертензія» не є адекватним для хронічних хвороб легенів (Посібник з діагностики та лікування легеневої гіпертензії, Studgart — New York, 2006). При них дуже важливо оптимізувати лікування основного захворювання та скоригувати гіпоксемію. На сьогодні немає доказів, що при цих захворюваннях ефективна терапія ЛАГ. Насправді вона може справляти негативний вплив.
При ХТЕЛГ ЛГ розвивається, як правило, внаслідок гострої обтурації дистальних відділів ЛА або рецидивуючої ТЕЛА. За даними різних авторів, вона виникає у 0,5–17 % пацієнтів, що лікувалися з приводу ТЕЛА. Швидше за все, точне число таких хворих невідоме, тому що діагностика хронічної тромбоемболічної ЛГ ускладнена через відсутність настороженості щодо ризику її виникнення та через те, що ТЕЛА часто виникає в осіб середнього та літнього віку на фоні інших захворювань (ІХС, кардіопатії, вади тощо) і тому розвиток правошлуночкової недостатності в них часто пояснюється цією патологією, а клініка ЛГ маскується цими захворюваннями.
Для діагностики цієї форми ЛГ слід враховувати фактори ризику ТЕЛА: тривалу іммобілізацію, хронічну серцеву та легеневу недостатність, оперативне втручання на органах малого тазу та черевній порожнині, вагітність і післяпологовий період, переломи кінцівок тощо. При рецидивуючій ТЕЛА дрібних гілок ЛА слід ураховувати так звані малі клінічні ознаки: періодично виникаючі епізоди задишки, запаморочення, субфебрилітет, часті пневмонії, наростання ознак правошлуночкової недостатності. Має значення пошук джерел ТЕЛА — хронічний тромбофлебіт кінцівки, пухлини органів малого тазу та ін. Клінічна картина ХТЕЛГ стає схожою з ІЛГ.
Діагностика ЛГ при ВВС ґрунтується на зміні клінічної картини самої вади при розвитку ЛАГ. Так, при дефекті міжшлуночкової перегородки (ДМШП) та розвитку синдрому Ейзенменгера характерний для цієї вади систолічний шум поступово зменшує свою інтенсивність і може зникнути зовсім; з’являються ознаки гіпертрофії правих відділів серця, спочатку в комбінації з гіпертрофією ЛШ, що властива цій ваді, а надалі з переважаючою гіпертрофією ПШ із синдромом систолічного перевантаження (RIII > RI, qR або Rs в V1-V3, негативний зубець Т у цих відведеннях, блокада правої ніжки пучка Гіса, Р-pulmonale). Збільшення правих відділів серця виявляється й іншими інструментальними методами (рентгенологічними, ЕхоКГ, КТ). При доплер–ЕхоКГ визначається двоспрямоване або право-ліве шунтування крові. Клінічно у хворого з’являється і посилюється дифузійний ціаноз, формується симптом «барабанних паличок», розвивається правошлуночкова недостатність.
При відкритій артеріальній протоці спостерігається аналогічний хід подій: зникає характерний для вади систоло–діастолічний шум над ЛА за рахунок спочатку діастолічного компонента, II тон стає акцентованим і нерозщепленим. Формується гіпертрофія ПШ із подальшим його переважанням з відповідною клінікою, аналогічно ДМШП, тобто синдром Ейзенменгера.
Особливістю дефекту міжпередсердної перегородки є більш пізній розвиток необоротних змін у судинах легенів і відповідної клініки.
Діагностика синдрому Ейзенменгера при ВВС зі збільшеним легеневим кровотоком важлива у зв’язку з неоперабельністю в цій стадії, тому що корекція вади швидко призводить до правошлуночкової недостатності та смерті хворих. У такому разі основний тип оперативного втручання, що має бути розглянутий, — пересадка комплексу «серце — легені».
Пов’язана з ВІЛ-інфекцією ЛАГ має такі ж клінічні та гемодинамічні характеристики, як і ІЛГ, що підтверджується проведеними спостереженнями. Вона зустрічається в 0,1–0,5 % з оціночною частотою виникнення 0,1 % на рік. Виникнення ЛАГ не залежить від способу передачі ВІЛ. Хворі на ВІЛ можуть бути одночасно інфікованими вірусами гепатитів В і С, у зв’язку з чим мати клініку гепатиту. У них може розвинутися кардіопатія, перикардит, тромбоендокардит. Особливістю перебігу ВІЛ-асоційованої ЛАГ порівняно з ІЛГ слід вважати більш тяжкий стан пацієнтів за функціональним класом ЛГ (1998) при більш низькому середньому тиску в ЛА, а також гіршу виживаність. Застосування антиретровірусної терапії та агресивне ведення інфікованих пацієнтів подовжило тривалість життя. У пацієнтів з ВІЛ-асоційованою ЛГ виживаність протягом року становить від 51 до 58 % (у хворих на ІЛГ 68–77 %), через 2 роки — 32 %.
Для захворювань, що супроводжуються посткапілярною ЛГ, характерне поєднання симптомів ЛГ з клінічними проявами основного захворювання при систолічній, діастолічній або тій та іншій одночасно дисфункції лівого шлуночка. Це ІХС, ДКМП, артеріальні гіпертензії, ГКМП, аортальні вади, клінічна діагностика яких відома. Діагностика другої групи захворювань, що супроводжуються посткапілярною ЛГ (МС, міксома та тромбоз ЛП), також не потребує опису. Для їх підтвердження надійним методом є ЕхоКГ.
Для всіх цих захворювань характерні, крім клінічних симптомів основного захворювання, ознаки застою в легенях, які проявляються наявністю незвучної крепітації та дрібних вологих хрипів, станом ортопное, ознаками серцевої астми та набряку легенів в анамнезі, навіть якщо до цього часу у хворого була правошлуночкова недостатність. Лікування основного захворювання (відновлення коронарного кровотоку при ІХС, ефективна антигіпертензивна терапія при артеріальній гіпертензії, коригуючі операції при вадах серця тощо) призводить до зниження тиску в ЛА без спеціального лікування такої ЛГ.
ЛАГ при венооклюзійній хворобі легень або при легеневому капілярному гемангіоматозі є специфічною групою, яка відрізняється патогенезом та терапевтичним утручанням. Відомо лише 200 випадків даної форми ЛАГ. Частіше, на відміну від ІЛАГ, страждають чоловіки. Прогноз, як правило, значно гірший, ніж при ІЛАГ. Описані сімейні випадки. Вважається, що, можливо, дана ЛАГ пов’язана з мутацією рецептора 2-го кісткового морфогенетичного протеїну, що дає підстави вважати венооклюзійну хворобу легень іншим фенотипом ІЛАГ.
Діагноз венооклюзивної хвороби може бути встановлений завдяки комбінації: клінічна підозра, результати фізикального обстеження, бронхоскопії та дані рентгенологічного обстеження, що дозволяє не проводити біопсію легенів (золотий стандарт для підтвердження діагнозу венооклюзивної хвороби) у більшості випадків. Переважна кількість пацієнтів мають скарги такі ж, як при ІЛАГ. При фізикальному обстеженні виявляються хрипи з обох боків у базальних відділах легень та зміни пальців рук у вигляді барабанних паличок. Як привило, пацієнти страждають від більш вираженої гіпоксемії та мають значно більш низьку дифузійну здатність СО, що пояснюється наявністю інтерстиціального набряку та відкритим овальним вікном. На рентгенограмі органів грудної клітки можуть виявлятися В-лінії Керлі та периферичний інтерстиціальний інфільтрат. При комп’ютерній томографії присутність ліній субплевральних потовщень, центролобулярний (або лобулярний) симптом «матового скла» та медіастинальна лімфаденопатія є специфічними для венооклюзивної хвороби легень. Окрім того, прийом епопростенолу може викликати появу набряку легень, що також є діагностичною ознакою. У зв’язку з тим, що венооклюзивна хвороба асоціюється із альвеолярною геморагією, при бронхоскопії із бронхоальвеолярним промиванням виявляється велика кількість макрофагів із гемосидерином та значно підвищене число Гольде.
Ускладнення легеневої артеріальної гіпертензії
1. Загострення ЛАГ (легенево-гіпертонічний криз).
2. Синкопальні стани.
3. Кровохаркання та легенева кровотеча.
4. Аневризма та розрив легеневої артерії.
5. Недостатність клапана ЛА.
6. Парез голосової зв’язки.
7. Недостатність тристулкового клапана.
8. Тромбоз гілок ЛА.
9. Порушення ритму та провідності.
10. Правошлуночкова недостатність.
Загострення ЛАГ (легенево-гіпертонічний криз)
У хворих на ЛАГ можуть спостерігатися загострення захворювання, які проявляються посиленням ПШ-недостатності, гіпотензією, що пояснюють міжшлуночковими взаємодіями. У декомпенсованого хворого збільшення об’єму ПШ призводить до парадоксального зсуву перегородки зі зниженням кінцево-діастолічного об’єму ЛШ і хвилинного об’єму серця. Клінічними проявами стану є скарги на різку слабкість, запаморочення, непритомний стан. Можлива втрата свідомості. При огляді виявляється блідість шкіри, ціаноз. Пульс стає ниткоподібним, можливе порушення ритму, артеріальний тиск знижується до 80–70/60–40 мм рт.ст. При огляді та пальпації грудної клітки відзначається посилена прекардіальна пульсація за рахунок правого шлуночка. Прослуховується посилений ІІ тон над ЛА. Крім загального підтримуючого лікування, у таких хворих треба застосовувати такі 3 принципи терапії:
1. По можливості — усунення причини декомпенсації.
2. Зниження постнавантаження ПШ за допомогою максимально селективних вазодилататорів ЛА.
3. Застосування позитивних інотропів і/або в деяких випадках периферичних вазоконстрикторів.
Імовірними причинами, які можна усунути, є порушення режиму прийому препаратів, ТЕЛА, аритмії, інфекція з повільним перебігом, перевантаження рідиною. В останньому випадку необхідне стимулювання діурезу, навіть при гіпотонії.
Потрібно максимально швидко та ефективно викликати легеневу дилатацію. Краще ввести внутрішньовенно простаноїди — епопростенол або ілопрост. Початкова доза ілопросту 0,5 нг/кг/хв, яку підвищують через 30–60 хв на 0,1–0,2 нг/кг/хв до досягнення бажаного ефекту. Можна використовувати інгаляційний ілопрост, а іноді бозентан або силденафіл. Інотропні препарати (дофамін, добутамін, левосимендан) призначають при недостатній ефективності легеневих вазодилататорів.
Синкопальні стани
Синкопе (серцева непритомність) виникає у хворих на ЛАГ тільки під час фізичного навантаження або емоційного стресу. Патогенетично воно пов’язане зі збільшенням ЛСО і різким розширенням правого шлуночка зі зсувом міжшлуночкової перегородки в порожнину лівого шлуночка. При цьому ударний об’єм крові лівого шлуночка різко знижується, що призводить до ішемії мозку. Синкопе можна розглядати як симптом легенево-гіпертонічного кризу.
Кровохаркання та легенева кровотеча
Причиною кровохаркання у хворих на ЛАГ найчастіше є розриви бронхолегеневих анастомозів. У таких випадках кровохаркання рідко буває значним і припиняється самостійно. У хворих з ВВС у фазі синдрому Ейзенменгера з високим гематокритом (> 60 %) іноді відзначається покращення стану після кровохаркання. При частому та тривалому кровохарканні може розвинутися анемія. Виникає загроза легеневої кровотечі. Таким хворим необхідна гемостатична терапія. Їм може знадобитися емболізація бронхіальних судин.
Легенева кровотеча, як правило, смертельна, виникає у хворих з розшаровуючою аневризмою ЛА. У хворих на ЛГ на фоні ТЕЛА кровохаркання виникає при інфаркті легень. Воно, як правило, не потребує специфічного лікування.
У хворих на посткапілярну (венозну) ЛГ кровохаркання виникає внаслідок венозного застою в малому колі кровообігу. Це особливо характерно для хворих із мітральним стенозом. У хворих із системними захворюваннями сполучної тканини кровохаркання частіше викликається основним захворюванням (васкулітами) і рідше пов’язане з ЛАГ. У хворих на ХОЗЛ також необхідно проводити диференціальну діагностику кровохаркання. Воно дуже рідко може бути пов’язане з ЛГ. Частіше його причинами бувають деструктивні процеси в легенях (туберкульоз, рак) або бронхоектази.
Аневризма та розрив легеневої артерії
Аневризма основного стовбура ЛА і її гілок — наслідок значної ЛГ, що виникла вже давно. Клінічними проявами цього ускладнення є патологічна пульсація в ділянці II–III міжребер’я ліворуч, систолічне «клацання» при прослуховуванні, у 30 % випадків — протодіастолічний шум Грехема Стілла внаслідок відносної недостатності клапана ЛА. Ускладненням аневризми ЛА є її розшарування та розрив.
Парез голосової зв’язки
Парез голосової зв’язки виникає внаслідок тиску розширеним стовбуром і лівою гілкою ЛА на поворотний нерв, що призводить до «провисання» лівої голосової зв’язки. Клінічно ускладнення проявляється зміною тембру голосу від легкої хрипоти, осиплості до повної афонії. Слід зазначити мінливість вираженості цього симптому, що може пояснюватися деякими коливаннями легеневого артеріального тиску. Такі хворі часто безуспішно лікуються в отоларинголога.
Недостатність тристулкового клапана
Недостатність тристулкового клапана розвивається внаслідок дилатації ПШ. У більшості хворих на ЛАГ цьому передує гіпертрофія ПШ. У пацієнтів із хронічним легеневим серцем бронхолегеневого ґенезу (ХОЗЛ, ураження паренхіми легенів) часто недостатність тристулкового клапана розвивається без попередньої гіпертрофії ПШ, що пояснюється розвитком дистрофії в міокарді через гіпоксію, пов’язану з легеневою недостатністю, інтоксикацію внаслідок поточного запального процесу в бронхолегеневій системі. Клінічними ознаками відносної недостатності тристулкового клапана є позитивний венний пульс при огляді шиї, зсув границь серця вправо, систолічний шум на тристулковому клапані, що посилюється при вдиханні (симптом Ріверо —Корвальо). Діагноз підтверджується ЕхоКГ. Успіх лікування залежить від лікування основного захворювання.
Тромбоз гілок легеневої артерії
Утворення тромбів у системі ЛА при ЛГ частіше буває in situ внаслідок уповільнення потоку крові, порушення ендотеліальної функції судин легень, агрегатного стану крові. У частини хворих з вираженою СН, фібриляцією передсердь виникає ТЕЛА. Діагноз ґрунтується на посиленні задишки, ціанозі, ознаках ПШ-недостатності. Можливе синкопе. У плазмі крові визначається D-димер, на ЕКГ — збільшення ознак перевантаження ПШ, ПП. Підтверджується діагноз сцинтиграфією, КТ і ангіографією. Лікування проводиться відповідно до схем лікування ТЕЛА.
Порушення ритму та провідності
Для хворих на ЛАГ нехарактерний розвиток фібриляції передсердь. Вона є частим ускладненням захворювань, що супроводжуються венозною ЛГ, — мітрального стенозу, ІХС. Однак на пізніх етапах захворювання фібриляція передсердь можлива й у хворих на ІЛГ, рецидивуючу ТЕЛА, ХОЗЛ. Такі порушення ритму та провідності, як екстрасистолія, синоатріальна блокада, міграція водія ритму по передсердях, зустрічаються досить часто.
Правошлуночкова недостатність
Ознаки ПШ–недостатності відомі. Це — підвищення центрального венозного тиску, що клінічно проявляється набряканням шийних вен, збільшенням розмірів печінки, позитивним симптомом Плеша.
У хворих з’являються набряки нижніх кінцівок, асцит. Слід зазначити, що при ІЛГ, незважаючи на високий ЛСО і СТЛА, які у хворих спостерігаються тривалий час, ПШ виникає пізно. Для хворих на ХОЗЛ характерний ранній розвиток ПШ-недостатності після формування хронічного легеневого серця.
Лікування ЛГ
Лікування хворих на легеневу гіпертензію становить значні труднощі. Ситуація змінилася в останні роки завдяки значному збільшенню числа рандомізованих контрольованих досліджень.
Мета лікування ЛГ — зменшення вираженості симптомів, уповільнення прогресування захворювання, поліпшення якості життя хворих та збільшення його тривалості. Лікування необхідно починати відразу після встановлення діагнозу.
Антагоністи кальцію, антикоагулянти, серцеві глікозиди, киснетерапія на сьогодні, незважаючи на відсутність відповідних рандомізованих досліджень, становлять стандартну терапію, що широко застосовують у хворих на ЛГ. Разом з тим з’явилися нові групи лікарських препаратів, ефективність і безпеку яких доведено результатами контрольованих досліджень.
Загальні рекомендації
Для всіх хворих на ЛГ актуальні загальні рекомендації, дотримання яких дозволяє зменшити ризик можливого погіршення перебігу захворювання внаслідок впливу зовнішніх факторів. У повсякденному житті пацієнти з ЛГ повинні уникати умов виникнення таких потенційно небезпечних симптомів, як виражена задишка, синкопе, біль у грудях.
— Забороняються фізичні навантаження після їжі, при несприятливому температурному режимі. Хворим на ЛГ слід уникати різких змін положення тіла (ризик ортостатичних реакцій і синкопе). У той же час рекомендуються щоденні дозовані фізичні навантаження, які не викликають вищевказаних симптомів, що сприяє поліпшенню якості життя та зменшенню тяжкості клінічної симптоматики. При тривалій подорожі в сидячому положенні рекомендується робити перерви для нетривалих прогулянок кожні 2 години. У літаках рекомендується вставати із крісла та ходити по салону.
— Гіпоксія збільшує вазоконстрикцію при ЛГ, тому під час авіаперельотів для хворих на ЛГ необхідно обговорювати можливість проведення додаткової киснетерапії. Хворим на ЛГ слід виключити підйоми в гори (більше 1000 м над рівнем моря).
— Профілактика інфекційних захворювань є дуже важливим завданням для хворих на ЛГ. Слід рекомендувати пацієнтам щорічну вакцинацію від грипу та пневмококової інфекції. Виникнення пневмонії ускладнює перебіг ЛГ і є причиною смертельних випадків у 7 % хворих на ЛГ.
— Вагітність, пологи, замісна гормонотерапія в постменопаузному періоді пов’язані з підвищеним ризиком погіршення перебігу захворювання та смертності у цієї категорії хворих. Усім пацієнткам з ЛГ репродуктивного віку повинні бути рекомендовані відповідні методи контрацепції. Для хворих на ЛГ рекомендується використання контрацептивів, що не містять естрогенів, бар’єрні методи контрацепції, проведення хірургічної стерилізації. Замісна гормональна терапія показана пацієнткам з ЛГ у постменопаузі лише при виражених клімактеричних симптомах за умови досягнення адекватного контролю системи згортання крові.
— При планових хірургічних втручаннях перевагу слід віддавати епідуральній анестезії (табл. 9).
— При погіршенні фізичного стану (детренованості) можливе обговорення необхідності фізичної реабілітації під наглядом спеціаліста
Хворі на ЛГ високочутливі до зниження рівня гемоглобіну в крові, тому навіть невиражена анемія вимагає швидкого ефективного лікування. У хворих на ЛГ із вираженою гіпоксією, наприклад, на фоні легенево-системних шунтів, виникає вторинний еритроцитоз.
При рівні гематокриту більше 65 % і за наявності симптомів, що вказують на підвищену в’язкість крові (головний біль, порушення концентрації уваги), показана флеботомія.
Пацієнтам із ЛГ протипоказаний прийом бета-блокаторів, нітратів. Слід уникати тривалого прийому нестероїдних протизапальних засобів.
Медикаментозне лікування
Підтримуюча терапія
Загальна терапія хворих на ЛАГ включає прийом антикоагулянтів, діуретиків і дигоксину, а також інгаляції кисню.
Антикоагулянти
Показання до призначення антикоагулянтної терапії у хворих на ЛГ пов’язані з традиційними факторами ризику венозних тромбоемболій, такими як серцева недостатність, малорухливий спосіб життя, а також зі схильністю до тромботичних змін у легеневих судинах, мікроциркуляторному руслі та еластичних легеневих артеріях.
Сприятливі ефекти пероральних антикоагулянтів (ПАК) у хворих на ЛГ показані в одноцентрових ретроспективних дослідженнях хворих на ІЛАГ і ЛАГ, що виникла внаслідок прийому аноректиків.
Цільовий рівень міжнародного нормалізованого співвідношення (МНС) при ЛАГ становить 1,5–2,5 од. за рекомендаціями США та 2–3 од. за Європейськими рекомендаціями. При інших формах ЛГ рішення про призначення антикоагулянтів повинно в будь-якому випадку прийматися індивідуально на основі оцінки співвідношення «ризик/ефективність» (зокрема, при ЛАГ, асоційованій з портальною гіпертензією при варикозному розширенні вен стравоходу, коли існує високий ризик кровотечі). Пацієнти з ЛАГ, які отримують тривало внутрішньовенно простаноїди, мають високий ризик тромбозу катетера. Тому вони повинні отримувати ПАК за відсутності протипоказань.
Діуретики
Рекомендовані для лікування та профілактики застійних явищ, хоча рандомізовані дослідження до цього часу не проводилися. Дози діуретиків підбираються лікарем та повинні ретельно титруватися, щоб уникнути різкого зниження об’єму циркулюючої крові та системного тиску. Застосовуються петльові діуретики: фуросемід 20–120 мг/добу, торасемід 5–10 мг/добу. Слід ретельно контролювати функцію нирок і показники електролітного обміну для запобігання розвитку ускладнень хронічної діуретичної терапії. Антагоністи альдостерону (спіронолактон у дозі 25–150 мг/добу) можна використовувати при розвитку хронічної серцевої недостатності III–IV функціонального класу.
Киснева терапія
Мета лікування — підтримка насичення крові киснем не менше 90 %. Більшість пацієнтів із ЛГ, за винятком осіб із ВВС і легенево–системними шунтами, мають незначні ступені артеріальної гіпоксемії у спокої, якщо у них немає відкритого овального отвору. Застосування інгаляцій кисню знижує легенево-судинний опір, але в деяких випадках тривале застосування кисню, особливо у високих дозах, може викликати легеневу вазоконстрикцію та призвести до погіршення стану хворого. Використання кисню ефективне у хворих із ХОЗЛ, у той же час при вроджених вадах серця із шунтуванням крові праворуч-ліворуч розвивається рефрактерна до кисневої терапії гіпоксемія, внаслідок чого застосування кисню в цієї категорії хворих буде практично неефективним.
Ефективність тривалих (до 12–15 годин на добу) інгаляцій кисню (2 л/хв) показана у хворих на ЛГ на фоні ХОЗЛ.
Серцеві глікозиди
Внутрішньовенне введення дигоксину хворим на ІЛАГ супроводжується значним зменшенням рівня нор-адреналіну в плазмі крові. Серцеві глікозиди можуть призначатися у випадках фібриляції передсердь у хворих на ЛГ для зменшення частоти шлуночкового ритму (табл. 10).
Специфічна терапія ЛАГ
Антагоністи кальцію
Блокатори кальцієвих каналів показані хворим на ЛАГ із позитивною відповіддю на гострий вазореактивний тест (близько 15 % хворих на ЛАГ). Сприятливі клінічні та прогностичні ефекти антагоністів кальцію, що застосовуються у високих дозах хворими на ЛАГ з позитивним гострим вазореактивним тестом, були показані в одноцентрових нерандомізованих дослідженнях. До числа рекомендованих для лікування ЛАГ на сьогодні належать дигідропіридинові антагоністи кальцію (амлодипін, ніфедипін) та дилтіазем, з особливим акцентом на ніфедипін і дилтіазем.
Вибір препарату визначається початковою частотою серцевих скорочень. Пацієнтам із частотою серцевих скорочень у спокої менше 80 ударів на хвилину слід рекомендувати антагоністи кальцію дигідропіридинового ряду, при відносній тахікардії — дилтіазем.
Амлодипін є препаратом вибору для пацієнтів із ЛАГ із явищами правошлуночкової серцевої недостатності.
Слід підкреслити, що терапію антагоністами кальцію треба починати під суворим гемодинамічним контролем хворих на ЛАГ, що позитивно відповідають на гострий вазореактивний тест. Титрування дози препарату повинно проводитися поступово протягом декількох тижнів до максимальної дози, яка добре переноситься. Іноді системна гіпотонія, набряки гомілок і стоп перешкоджають збільшенню дози. Призначення дигоксину та/або діуретиків у деяких випадках дозволяє впоратися з побічними ефектами антагоністів кальцію.
Терапія антагоністами кальцію показана пацієнтам із серцевим індексом (СІ) понад 2,1 л/хв/м2 та/або сатурацією О2 венозної крові більше 63 % і/або тиском у правому передсерді менше 10 мм рт.ст. і з позитивною відповіддю на гостре призначення вазодилататора.
При серцевому індексі менше 2,1 л/хв/м2, та/або сатурації О2 у венозній крові менше 63 %, та/або тиску у правому передсерді більше 10 мм рт.ст., при IV ФК антагоністи кальцію не показані. Терапію потрібно починати в стаціонарі, ретельно титрувати дозу під контролем АТ, контролювати показники оксигенації крові та толерантність до навантажень (табл. 11).
Простагландини
На сьогодні простагландини розглядаються як перспективна група препаратів для лікування ЛГ, що мають вазодилатуючу, антиагрегантну й антипроліферативну дію (табл. 12).
Із цієї групи препаратів для лікування ЛАГ в Україні зареєстрований та застосовується інгаляційний ілопрост (вентавіс).
Ілопрост — хімічно стабільний аналог простацикліну, який можна використовувати для лікування ЛАГ як для внутрішньовенного введення, так і в інгаляційній формі за допомогою небулайзера. Тривалість дії інгаляційного ілопросту становить 60–120 хв, протягом доби необхідно провести 6–9 інгаляцій через небулайзер. Застосування інгаляційного ілопросту призводить до селективної легеневої вазодилатації, що викликає розширення судин у вентильованих альвеолах, уникаючи їх розширення в невентильованих ділянках.
Крім того, ілопрост має антитромботичну, протизапальну, антипроліферативну та фібринолітичну дії. Таке лікування поліпшує гемодинамічні зміни й здатність переносити фізичне навантаження пацієнтами з ЛАГ. Терапія ілопростом ефективна у хворих з III–IV ФК ЛГ: при ІЛАГ, ЛАГ, асоційованій з захворюваннями сполучної тканини та зумовленій дією токсинів, синдромі Ейзенменгера; неоперабельній хронічній тромбоемболічній легеневій гіпертензії. Доказова база щодо застосування ілопросту для монотерапії у хворих на ЛАГ і ХТЕЛГ включає подвійне сліпе рандомізоване плацебо-контрольоване дослідження AIR та відкрите багатоцентрове тривале рандомізоване дослідження AIR-2. У першому була показана ефективність і переносимість інгаляційного ілопросту в 203 пацієнтів з ІЛГ, ХТЕЛГ та ЛАГ, асоційованій із системними захворюваннями сполучної тканини або прийомом аноректиків (III і IV ФК). Згідно з отриманими даними, поліпшення ФК як мінімум на 1 клас, більше ніж 10%-й приріст дистанції в тесті з 6-хвилинною ходьбою та відсутність погіршення або фатального результату були досягнуті в 17 % пацієнтів групи ілопросту та в 5 % групи плацебо. Дистанція в тесті з 6-хвилинною ходьбою у групі ілопросту до 12-го тижня збільшилася на 36,4 м порівняно з плацебо. Причому в підгрупі хворих на ІЛГ був досягнутий найкращий результат (+ 58,8 м). У другому дослідженні — AIR-2 — оцінювалася ефективність і переносимість інгаляційного ілопросту протягом 24 міс. терапії. На фоні лікування гемодинамічний ефект (зниження тиску в легеневій артерії) зберігався або наростав, необхідність у будь-яких підвищеннях дози через тахіфілаксію була відсутня.
Відзначалося значне поліпшення толерантності до фізичних навантажень, що визначається за даними тесту з 6-хвилинною ходьбою, індексом задишки, ФК. За весь період спостереження виживаність для групи пацієнтів з ІЛГ становила 91,4 %, у той час як розрахунковий рівень виживаності склав усього 63,1 %.
Отримані дані підтвердили коротко- і довгострокову ефективність інгаляційного ілопросту; у тривалих відкритих дослідженнях не показано ризику збільшення числа побічних ефектів препарату.
Епопростенол (не зареєстрований в Україні) — синтетичний аналог простацикліну. Внутрішньовенна терапія епопростенолом протягом 12 тижнів призводила до поліпшення гемодинамічних показників, якості життя хворого, збільшення дистанції 6-хвилинної ходьби, зменшення вираженості симптомів захворювання. У деяких дослідженнях було встановлено підвищення виживаності серед хворих, які отримують дану терапію, порівняно з пацієнтами на стандартній терапії ЛАГ. Внутрішньовенна терапія епопростенолом ефективна у хворих на ІЛАГ, при дифузійних захворюваннях сполучної тканини, синдромі Ейзенменгера, III–IV ФК.
Епопростенол має короткий період напіврозпаду (3–5 хвилин) і призначається у вигляді інфузії через центральний венозний катетер.
Початкова доза становить 2 нг/кг/хв з подальшим її підвищенням при добрій переносимості до 20–40 нг/кг/хв. Побічні ефекти терапії епопростенолом включають гіперемію з приливами, нудоту, блювання, діарею, біль у ділянці щелепи, скелетно-м’язовий біль, шкірні висипання еритематозного характеру, а також ускладнення, пов’язані з тривалим застосуванням центрального катетера. Слід уникати різкої відміни інфузії епопростенолу через високий ризик розвитку синдрому рикошету, погіршення гемодинамічних показників і смерті.
Трепростиніл* (не зареєстрований в Україні) — трициклічна бензидинова похідна епопростенолу із задовільною хімічною стабільністю, що дозволяє вводити його у фізіологічному розчині при температурі навколишнього повітря як внутрішньовенно, так і підшкірно.
Підшкірне введення препарату можна проводити за допомогою мікроінфузійної помпи та маленьких підшкірних катетерів. У цих випадках усуваються ускладнення, пов’язані з постійним втручанням у центральну венозну мережу, наприклад інфекції, а догляд за системою набагато простіший.
Безперервне підшкірне або внутрішньовенне введення трепростинілу призводить до поліпшення толерантності до фізичних навантажень, зниження легеневого судинного опору, поліпшення клінічного стану хворих на ЛАГ. Найбільше покращання переносимості до фізичних навантажень отримано у хворих з найважчим початковим станом і у хворих, здатних переносити високі дози препарату.
Найчастішим побічним ефектом препарату є біль у місці введення, що стає причиною припинення лікування у 8 % випадків і обмежує підвищення дози ще в частини хворих.
Антагоністи ендотелінових рецепторів — бозентан, амбризентан, таксентан, мацитентан є пероральними засобами. Механізм їх дії зумовлений пригніченням фармакологічних ефектів ендотелінів.
Для ендотеліну-1 ними є:
— скорочення гладком’язих клітин судин і бронхів;
— проліферація та міграція ГМК;
— проліферація фібробластів;
— гіпертрофія кардіоміоцитів;
— адгезія та агрегація тромбоцитів;
— міграція лейкоцитів, моноцитів, макрофагів і вивільнення цитокінів;
— позитивний іно- і хронотропний ефект.
Бозентан блокує як рецептор ендотеліну А, так і рецептор ендотеліну В. У 2 рандомізованих подвійних сліпих дослідженнях у пацієнтів з ЛАГ III–IV класу за NYHA він показав значний ефект, у зв’язку з чим затверджений для застосування в Європі та Америці. При ретроспективному аналізі результатів 2-річного спостереження за 103 хворими на ІЛГ III ФК при застосуванні бозентану виявлено, що поліпшення фізичної активності та гемодинаміки спостерігається через 4 місяці терапії та зберігається протягом 1 року й більше. У всіх пацієнтів, які приймають антагоністи рецепторів ендотеліну, необхідний щомісячний контроль показників функції печінки. Підвищення рівня трансаміназ більше ніж у 3 рази вимагає зниження дози або відміни препарату. Бозентан дозволений у США, Канаді, Японії, а також у країнах Європейського Союзу для лікування ІЛГ і ЛАГ, пов’язаній із захворюваннями сполучної тканини у хворих із II–IV ФК. В Україні препарати цієї групи не зареєстровані.
Інгібітори фосфодіестерази–5. Обґрунтуванням для застосування інгібіторів фосфодіестерази-5 при ЛАГ є активація шляху циклічного гуанозинмонофосфату (цГМФ). Пригнічуючи гідроліз циклічного гуанозинмонофосфату, препарати даного класу підвищують його рівні в крові, що зумовлює вазодилатаційні, антипроліферативні та проапоптичні ефекти, здатні уповільнити ремоделювання легеневих артерій. У системному кровотоці експресія фосфодіестерази-5 мінімальна, що пояснює відносну селективність інгібіторів фосфодіестерази-5 стосовно легеневого циркуляторного русла. Крім того, є докази, що інгібітори фосфодіестерази-5 можуть безпосередньо посилювати скоротність правого шлуночка.
Силденафіл (єдиний в Україні препарат з показаннями при ЛГ) — інгібітор фосфодіестерази-5, запобігаючи деградації цГМФ, викликає зниження легеневого судинного опору та перевантаження правого шлуночка. На сьогодні вже накопичені дані, що демонструють добру переносимість і ефективність силденафілу у хворих на ЛАГ різної етіології. У клінічних дослідженнях силденафіл застосовувався в разових дозах 20–80 мг 2–3 рази на день і викликав поліпшення гемодинаміки та толерантності до фізичних навантажень у хворих на ЛГ. Описані деякі побічні ефекти препарату — головний біль, закладеність носа, приливи, раптова втрата слуху, порушення кольоросприйняття, диспепсія. Силденафіл рекомендується хворим на ЛГ, у яких неефективна інша медикаментозна терапія.
Тадалафіл (на даний час зареєстрований в Україні тільки для лікування еректильної дисфункції) — інгібітор фосфодіестерази-5 із тривалим періодом напіввиведення (близько 17,5 години), що вимагає однократного застосування протягом доби. У рандомізованих дослідженнях призначення тадалафілу хворим на ЛАГ у дозі 40 мг/добу призводило до збільшення дистанції в тесті з 6-хвилинною ходьбою. Лікування тадалафілом не супроводжувалося зміною ФК ЛАГ, однак трохи подовжувався час до декомпенсації.
Побічні ефекти препарату — головний біль, міалгія, назофарингіт, біль у кінцівках, нудота, біль у спині, диспепсія, закладеність носа, раптова втрата слуху, порушення кольоросприйняття (табл. 13).
Стимулятори розчинної гуанілатциклази (рГЦ). Останнім часом запропоновано новий препарат для лікування ЛГ, що пройшов успішні клінічні випробування та готується до реєстрації в Україні. За механізмом дії він належить до стимуляторів розчинної гуанілатциклази (рГЦ). Циклічний гуанозинмонофосфат (цГМФ) є важливим медіатором перфузії добре вентильованих ділянок легенів. Препарати, які збільшують рівні цГМФ, сприяють розширенню легеневих судин, зберігаючи при цьому оптимальний газообмін. цГМФ генерується рГЦ під дією оксиду азоту.
Ріоцигуат є першим і єдиним представником нового класу сполук — стимуляторів рГЦ. Ріоцигуат має подвійний механізм дії: підвищує чутливість рГЦ до ендогенного NO, а також прямо стимулює рГЦ незалежно від NO, активуючи синтез цГМФ, який відіграє важливу роль у регулюванні судинного тонусу, проліферації, фіброзу та запалення. За рахунок цього нового механізму дії ріоцигуат має більшу ефективність при ЛАГ і інших формах ЛГ, таких так хронічна тромбоемболічна легенева гіпертензія, для яких немає затверджених способів специфічного медикаментозного лікування. Оскільки ЛАГ пов’язана з ендотеліальною дисфункцією, зниженими рівнями NO і порушеною активністю рГЦ, застосування ріоцигуату для лікування даної патології є перспективним напрямком.
Ріоцигуат — єдиний препарат, який демонструє стабільно високу ефективність при 2 різних типах легеневої гіпертензії: ХТЕЛГ (де операція неможлива або неефективна) і ЛАГ. Аналіз вторинних кінцевих точок досліджень продемонстрував статистично значимі зміни, зокрема ЛСО, рівня N-кінцевого пропептиду натрій-уретичного гормону (В-типу) (NT-proBNP), функціонального класу за ВООЗ, часу до клінічного погіршення (ЧДКП) та індексу вираженості задишки за шкалою Борга. Позитивна тенденція була відзначена при оцінці якості життя за Європейською анкетою (EQ-5D) і Опитувальником життя з легеневою гіпертензією (LPH).
При лікуванні ХТЕЛГ у дослідженнях ріоцигуат значно поліпшував толерантність до фізичних навантажень у пацієнтів із неоперабельною формою, а також у хворих на стійку або рецидивуючу ЛГ після легеневої тромбендартеректомії. Також у цих пацієнтів спостерігалося стабільне суттєве поліпшення клінічно значимих вторинних показників, таких як гемодинаміка, ФК, рівень NT-proBNP.
Згідно з даними дослідження, виживаність пацієнтів з ЛАГ і ХТЕЛГ після лікування ріоцигуатом упродовж 4,5 року становила > 91 %. Значне поліпшення наставало через 4 тижні після початку лікування; надалі поліпшення тривало. Дослідження також показало, що ріоцигуат добре переноситься та має добрий профіль безпеки як при монотерапії, так і в комбінації з АРЕ (антагоністи рецепторів ендотеліну) або простаноїдами (не внутрішньовенними, наприклад інгаляційний ілопрост) у пацієнтів із ЛАГ. Найбільш частими несприятливими явищами при прийомі ріоцигуату були головний біль, запаморочення, периферичні набряки та шлунково-кишкові симптоми, такі як диспепсія та нудота.
Комбінована терапія ЛАГ. Згідно з різними джерелами, для досягнення ефекту лікування пацієнтів з тяжкою ЛАГ часто буває недостатньо монотерапії, незалежно від класу препаратів, що застосовуються. У таких випадках має сенс використовувати комбіновану терапію, враховуючи різні точки прикладання та можливість впливати на різні ланки патогенезу ЛГ. При цьому можливе одночасне призначення двох препаратів або приєднання другого або третього препарату до попередньої терапії, яка виявилася недостатньо ефективною. Наводимо основні критерії хворих на ЛАГ (тяжка форма), яким показана комбінована терапія:
Клінічний статус: клас IV ФК за NYHA, або погіршення з III до IV ФК, або стійкий III ФК з одночасним погіршенням у тесті з 6-хвилинною ходьбою або кардіопульмональному тесті з фізичним навантаженням.
Тест з 6-хвилинною ходьбою: менше 350–380 м.
Кардіопульмональний тест із фізичним навантаженням: пікове VO2 < 11 мл/кг/хв, максимальний (систолічний) тиск < 120 мм рт.ст.
Додаткові параметри: ЕхоКГ (погіршення індексу TEI, перикардіальний випіт), рівень BNP збільшується мінімум на 20 %, катетеризація ПШ: ЛСО > 10 од. Вуда, СІ 2 л/хв/м2, тиск у правому передсерді (ТПП )> 12 мм рт.ст., SO2 < 60 %.
У світовій практиці накопичений досвід застосування комбінованої терапії ЛАГ з використанням основних груп препаратів: простаноїдів, інгібіторів фосфодіестерази та антагоністів рецепторів ендотеліну. Основними в цьому напрямку є дослідження STEP (інгаляційний ілопрост + бозентан), TRIUMPH (бозентан або силденафіл + інгаляційний трепростиніл), PACES (епопростенол + силденафіл). Найбільш вивченою є комбінація інгаляційного ілопросту й бозентану. З фармакологічної точки зору ілопрост ідеально підходить для комбінованої терапії завдяки його потужному ефекту та незначному фармакологічному потенціалу взаємодії.
Однією з комбінацій для поліпшення результатів лікування хворих із ЛАГ із позитивним терапевтичним ефектом і одночасно меншою вартістю лікування може бути комбінована терапія інгаляційного ілопростом із силденафілом. У літературі вже висвітлюється такий досвід.
У світі проводяться дослідження комбінованого застосування інгаляційного ілопросту та ріоцигуату. Первинні клінічні дані свідчать про високу привабливість цієї комбінації з позицій ефективності, безпеки та комплайєнсу.
При різних формах ЛАГ, у тому числі асоційованих з іншими захворюваннями, мають місце деякі особливості лікування, які відображені в рекомендаціях АСС і АНА.
Останнім часом (2010) для лікування ВВС і ЛГ було схвалено 3 класи препаратів, дія яких спрямована на модифікацію дисфункції ендотелію: простаноїди, антагоністи рецепторів ендотеліну та інгібітори фосфодіестерази 5-го типу. Існують деякі дослідження, які продемонстрували більшу ефективність бозентану при ІІІ ФК.
Терапевтичну флеботомію необхідно проводити при гематокриті понад 65 %. При цьому необхідно провести ізоволюмічну заміну рідини (750–1000 мл ізотонічного розчину NaCl замість 400–500 мл крові). При повторних флеботоміях необхідно стежити за можливим розвитком дефіциту заліза з метою його поповнення. Профілактика тромбоемболічних ускладнень за допомогою ацетилсаліцилової кислоти вважається неефективною. Антикоагулянти рекомендуються тільки при фібриляції передсердь.
Існують певні особливості лікування хворих на ЛАГ внаслідок захворювань легень і/або гіпоксії. Що стосується рекомендацій щодо лікування ЛГ при легеневій патології, то доведено, що при ЛГ, пов’язаній з ХОЗЛ, головна роль приділяється безперервному (16 год/добу) лікуванню киснем. У пацієнтів із розладами дихання, пов’язаними зі сном і нічною десатурацією, ефективне застосування неінвазивної домашньої вентиляції. Згідно з сучасними уявленнями, застосування вазодилататорів, таких як БКК, простаноїди, анагоністи ендотелінових рецепторів і інгібітори фосфодіестерази 5 (ФДЕ-5), для лікування ЛГ, пов’язаної з ХОЗЛ, показане тільки в окремих випадках (при середньому тиску в ЛА понад 40 мм рт.ст.).
При інтерстиціальних захворюваннях легень із ЛГ 35 мм рт.ст. терапія зазначеними вазодилататорами виправдана. Існують дані про застосування ілопросту інгаляційно при цих захворюваннях зі зменшенням тиску в ЛА та збільшенням сатурації кисню в крові (табл. 15).
При ВІЛ-асоційованій ЛАГ терапевтичні підходи ще менш вивчені, ніж при інших формах ЛАГ. Труднощі полягають у тому, що гострий вазоконстрикторний тест, рекомендований для хворих на ІЛГ з метою виявлення відповідачів для лікування антагоністами кальцію, у хворих на ВІЛ-асоційовану ЛАГ не описаний. До того ж, блокатори кальцієвих каналів виявилися неефективними у пацієнтів з ВІЛ-асоційованою ЛАГ. Існують дані трьох досліджень щодо ефективності перорального простаноїда берапросту (Galie N et al., 2002) та селективного антагоніста ендотелінових рецепторів амбризентану (N. Galie et al., 2008). Декілька досліджень продемонстрували можливість покращити толерантність до фізичного навантаження та гемодинамічні показники при застосовуванні в даної категорії хворих епопростенолу внутрішньовенно (H. Nunes et al., 2003), трепростинілу підшкірно (L. Cea-Calvo et al., 2003) та ілопросту інгаляційно (H.A. Ghofrani et al.). Отримані позитивні клінічні та гемодинамічні результати при використанні бозентану у хворих на ЛАГ, асоційовану з ВІЛ. Даних про ефективне застосування антагоністів ендотеліальних рецепторів й інгібіторів ФДЕ-5 у контрольованих дослідженнях немає. Проте існує застереження, що силденафіл дуже обережно слід застосовувати разом із ритонавіром та саквінавіром через можливу взаємодію.
Ефективна антикоагулянтна терапія може поліпшувати прогноз при ВІЛ-асоційованій ЛАГ. Проте вона не рекомендована для рутинного використання через високий ризик виникнення кровотеч, низьку прихильність та можливість перехресної взаємодії з іншими препаратами. Однак пероральні антикоагулянти, які входять у схему лікування ІЛГ, необхідно з великою обережністю застосовувати у ВІЛ-інфікованих хворих, частіше вони протипоказані через ризик кровотечі та можливу лікарську взаємодію з препаратами для лікування ВІЛ-інфекції.
Як правило, наявність ВІЛ-інфекції є протипоказанням до проведення трансплантації.
Роль високоактивної антиретровірусної терапії у веденні ВІЛ-асоційованої ЛАГ поки не встановлена. Одне дослідження показало, що ВІЛ-асоційована ЛАГ може виникнути й у хворих з добре контрольованою ВІЛ-інфекцією, а антиретровірусна терапія не призводить до регресії симптомів або затримки розвитку захворювання, і основою лікування є специфічна терапія з приводу ЛГ (табл. 16).
Для пацієнтів з ЛАГ, що асоціюється з портальною гіпертензією, застосовується той же алгоритм, що й для ІЛГ. Однак при складанні схеми лікування необхідно враховувати супутні захворювання.
Слід звернути увагу на стан функції печінки (як і при інших захворюваннях, що супроводжуються ЛАГ). Призначення таким хворим антикоагулянтів може загрожувати кровотечею. При вирішенні питання про трансплантацію печінки хворим на цироз слід провести обстеження для виявлення ЛАГ, яка є протипоказанням до цієї операції, якщо СТЛА понад 35 мм рт.ст. або легенево-судинний опір понад 250 дин•с•см–5 (табл. 17).
ЛАГ є добре відомим ускладненням таких системних захворювань сполучної тканини, як системна склеродермія (частота ЛГ може досягати 7–12 % випадків), червоний вовчак, дерматоміозит, синдром Шегрена. Лікування такої категорії пацієнтів є більш комплексним, ніж хворих на ІЛАГ. Воно проводиться на фоні імуносупресивної та протизапальної терапії. Відповідь на призначення БКК при вазореактивному тесті зустрічається значно рідше, ніж при ІЛАГ. Співвідношення ризик/користь при ПАК-терапії невідоме. Основні принципи лікування хворих на ЛАГ із системними захворюваннями такі ж, як і при лікуванні ІЛАГ. Це пов’язане з тим, що подібні хворі включалися у більшість рандомізованих клінічних досліджень. Існує аналіз у підгрупах хворих із склеродермією у спостереженнях на фоні прийому бозентану, силденафілу, трепростанілу. Внутрішньовенне застосування епопростенолу супроводжувалося покращенням толерантності до фізичного навантаження, симптоматики та гемодинамічних параметрів при 3-місячному спостереженні за хворими із системною склеродермією. Проте результати виживання таких хворих були гіршими, ніж при ІЛАГ. Наявність системного захворювання сполучної тканини не є протипоказанням до трансплантації при неефективності медикаментозної терапії.
Особливості лікування ЛГ при захворюваннях лівих відділів серця. ЛГ при захворюваннях лівих відділів серця належить до посткапілярної форми. У таких випадках основним методом є лікування основного захворювання. Застосовувати специфічну терапію, рекомендовану для лікування ЛАГ, небажано. Більше того, призначення зазначених препаратів може бути небезпечним у зв’язку з можливістю розвитку набряку легенів. Невеликі дослідження продемонстрували ефективність силденафілу (покращення переносимості фізичного навантаження та якості життя) у даної категорії пацієнтів. У випадках, коли має місце виявлена при ЕхоКГ тяжка ЛГ, не адекватна ураженню серця, рекомендується інвазивний метод вимірювання тиску заклинювання для уточнення характеру ЛГ (табл. 19).
Лікування посттромбоемболічної ЛГ. При лікуванні посттромбоемболічної ЛГ з метою зниження тиску в ЛА та легенево-судинного опору призначаються ті ж схеми лікування, що і при ЛАГ. Хворі повинні бути проконсультовані на предмет проведення тромбоендартеректомії.
Даний вид хірургічного лікування хворих на ЛГ із тромботичною обтурацією проксимальних відділів легеневих артерій дозволяє зменшити ЛСО, покращити систолічну функцію правого шлуночка, толерантність до фізичних навантажень, збільшити тривалість життя хворих. Легенева ендартеректомія проводиться хворим при хронічній ТЕЛА та посттробоемболічній ЛГ. Операційна смертність у кращих медичних центрах коливається від 5 до 11 %. Важливим елементом успішного проведення операції є відбір пацієнтів. Визначальним фактором повинна бути саме тяжкість тромботичної оклюзії. При цьому власне величина тиску в ЛА не має значення, оскільки в пацієнтів із найбільш високим СТЛА досягається найбільший ефект від такого втручання. У більшості хворих регресують симптоми, збільшується переносимість навантаження, поліпшуються гемодинамічні показники та якість життя. За даними ретроспективного аналізу, 5-річна виживаність у цих хворих досягає 75 %.
Основним протипоказанням до проведення тромбоендартеректомії є виражене ураження паренхіми легенів (ОФВ1 < 30 %) (табл. 20).
Лікування венооклюзивної хвороби легень не є чітко встановленим. Більше того, вазодилататори та, особливо, простаноїди потрібно застосовувати із великою обережністю через можливість виникнення набряку легень. Тому пацієнти мають лікуватися в спеціалізованих центрах. Проте є деякі повідомлення про покращення стану пацієнтів на фоні застосування цих препаратів. Немає даних щодо призначення даній групі пацієнтів інгібіторів фосфодіестерази-5. Передсердна септостомія може обговорюватися, якщо немає значної гіпоксемії. Пацієнти мають направлятися на трансплантацію, як тільки діагноз встановлено.
Хірургічне лікування хворих на ЛГ
Передсердна септостомія — створення перфорації в міжпередсердній перегородці — стала застосовуватися у хворих із правошлуночковою серцевою недостатністю після висновків Rozkovec і співавт., що хворі на ІЛАГ із вторинним відкриттям овального вікна мають кращу виживаність, ніж ті, у яких міжпередсердну перегородку збережено. Створення скидання крові праворуч-ліворуч дозволяє знизити тиск у правому передсерді, покращити функцію правого шлуночка, збільшити переднавантаження лівого шлуночка та серцевого викиду, що призводить до зменшення частоти запаморочень, синкопе, підвищення толерантності до фізичного навантаження. Суть операції полягає в наступному: у міжпередсердну перегородку встановлюють балонний катетер, який поступово розширюють, поки показник насичення артеріальної крові О2 не знизиться на 10 %. Мета операції — зниження тиску в ПП, розвантаження ПШ, збільшення переднавантаження ЛШ і серцевого викиду. Однак з урахуванням ризику відновлення небезпечної для життя артеріальної гіпоксемії та, як наслідок, збільшення смертності, особливо у хворих на тяжку правошлуночкову недостатність, передсердна септостомія показана при неефективності всіх видів медикаментозного лікування або як підготовчий етап перед трансплантацією легенів.
Передсердна септостомія рекомендується хворим на ЛГ з ІІІ і IV ФК (ВООЗ) з частими синкопе або рефрактерною до терапії правошлуночковою серцевою недостатністю. Смертність хворих при проведенні передсердної септостомії становить 5–15 %.
Трансплантація легенів або комплексу серце — легені
Трансплантація легенів або комплексу серце — легені показана при ІЛГ, синдромі Ейзенменгера, пацієнтам із серцевою недостатністю, що відповідає IV ФК за NYHA, з результатами тесту з 6-хвилинною ходьбою менше 400 м, при серцевому індексі менше ніж 2,0 л/хв/м2 або сатурації артеріальної крові, що дорівнює або менше 63 %, і/або тиску в правому передсерді, що дорівнює або більше 10 мм рт.ст., і/або середньому тиску в ЛА понад 55 мм рт.ст.
Відносними протипоказаннями є вік (до 55 років), попередні торакальні операції. Абсолютні протипоказання до трансплантації легенів:
1. Виражена дисфункція інших життєво важливих внутрішніх органів (хронічна ниркова недостатність: кліренс креатиніну < 50 мг/мл/хв, захворювання печінки, підтверджене біопсією).
2. ВІЛ-інфекція.
3. Активне онкологічне захворювання (за винятком базально–клітинної та плоскоклітинної карциноми шкіри).
4. Носіння HBs-антигену.
5. Гепатит С, підтверджений біопсією печінки.
6. Паління, прийом алкоголю, наркотиків останні 6 місяців.
У єдиному проспективному неконтрольованому дослідженні було показано, що 3- і 5-річна виживаність після проведених трансплантацій однієї або двох легенів, комплексу серце — легені у хворих на ЛГ склала 55 і 45 % відповідно. Операції трансплантації однієї або обох легень, комплексу серце — легені проводяться у хворих на ІЛАГ. При синдромі Ейзенменгера трансплантація однієї або обох легень може комбінуватися з корекцією дефекту міжпередсердної або міжшлуночкової перегородки. Показники виживаності після трансплантації однієї або обох легень у хворих на ЛГ практично однакові, тому залежно від клінічної ситуації виправдане використання будь-якого підходу. У більшості центрів переважно виконують білатеральну трансплантацію легенів у зв’язку з меншим числом післяопераційних ускладнень.
Алгоритм лікування хворих на ЛГ
Після встановлення діагнозу ЛГ починають загальні заходи та терапію антагоністами кальцію (за відсутності протипоказань), діуретиками при затримці рідини, киснем — при гіпоксемії, глікозидами — при рефрактерній правошлуночковій недостатності та/або суправентрикулярній тахікардії. Гострі проби на вазореактивність повинні проводитися всім хворим на ЛАГ. Найбільш імовірний позитивний ефект від призначення високих доз антагоністів кальцію слід очікувати у хворих на ІЛГ і ЛГ внаслідок прийому аноректиків. Саме в цих хворих застосовуються антагоністи кальцію в максимально переносимих дозах, стійкість ефекту повинна оцінюватися через 3 і 6 місяців від початку терапії.
Для пацієнтів з ЛГ I і II ФК (ВООЗ) рекомендується стандартна терапія антикоагулянтами, серцевими глікозидами, діуретиками, киснетерапія, при позитивному вазореактивному тесті — антагоністами кальцію. У цих хворих можливе використання ріоцигуату, курсової терапії простагландином Е1. Питання про доцільність призначення таким хворим силденафілу залишається відкритим через відсутність спеціально запланованих досліджень у пацієнтів з ЛГ I і II ФК (ВООЗ).
Основною популяцією для вивчення нових препаратів для лікування ЛГ у рандомізованих дослідженнях були найтяжчі хворі на ЛГ із III і IV ФК (ВООЗ).
Пацієнти з негативною пробою при I–II ФК (ВООЗ) повинні продовжувати медикаментозну терапію під ретельним динамічним контролем.
Пацієнтам із III ФК (ВООЗ), негативним або позитивним вазореактивним тестом призначається курсове лікування ілопростом, простагландином Е1, ріоцигуатом або інгаляційним оксидом азоту; має місце призначення бозентану або силденафілу. Пацієнтам із IV ФК (ВООЗ) рекомендується призначення ілопросту або бозентану, а також комбінації цих препаратів у пацієнтів, призначення яким препарату першого або другого вибору не дозволяє досягти позитивної динаміки. Вивчення стратегії лікування хворих на ЛГ є метою проведених на даний час рандомізованих досліджень.
Хірургічні методи лікування — передсердна балонна септостомія та/або трансплантація легенів — показані при рефрактерній до медикаментозного лікування ЛГ (схема 4).
Диспансеризація хворих на ЛГ
Для контролю за станом хворих на ЛАГ і оцінки результатів проведеної терапії хворі повинні постійно надглядатися сімейним лікарем разом із кардіологом, а при ЛГ, асоційованій з іншими захворюваннями, також із суміжними фахівцями (пульмонологом — при захворюваннях легенів, інфекціоністом — при ВІЛ, гастроентерологом — при портальній гіпертензії тощо). Запропоновано строки обстеження хворих і об’єм дослідження (табл. 21).
Прогноз при ЛГ
Прогноз при ЛАГ несприятливий. Середня тривалість життя після встановлення діагнозу ЛАГ у США в період з 1981 по 1985 рр. становила 2,8 року. З того часу виживаність покращилась. П’ятирічна виживаність серед пацієнтів, які приймають епопростанол, сьогодні становить 47–55 % і більше 70 % у тих хворих, у яких був покращений функціональний клас до I або II. Однак у середньому близько 15 % пацієнтів, які отримують сучасну терапію, все-таки помирають протягом року.
Предиктори поганого прогнозу після початку лікування включають підвищений тиск у правому передсерді, низький серцевий індекс, низьку змішану венозну сатурацію кисню, збереження симптомів функціонального класу III/IV, погану переносимість фізичних навантажень, перикардіальний випіт і підвищення рівня передсердного натрійуретичного пептиду В-типу (табл. 22).
Виживаність хворих на ЛГ значною мірою залежить ще й від її етіології. При ЛГ, асоційованій із системною склеродермією, або такій, що розвинулася внаслідок перенесеної або рецидивуючої ТЕЛА, прогноз гірший, ніж при ІЛГ або ВІЛ-асоційованій ЛГ (за умови адекватної терапії). При ЛГ, асоційованій з уродженими вадами, прогноз значно кращий, ніж при ІЛГ, що швидше за все пов’язане з наявністю скидань крові з ПШ або ЛА у велике коло кровообігу, що сприяє розвантаженню ПШ і більш тривалому збереженню його функції. Поліпшенню прогнозу життя хворих при ІЛГ, ТЕЛА сприяє відкриття овального вікна або функціонування вже існуючого (у здорових дорослих у 25 % випадків воно повністю прикрито заслінкою з наявністю несуттєвого ліво-правого скидання або без нього).
Додаток 1
Методика виконання тесту 6ХX
Тест 6ХХ слід проводити в ранковий час.
Пацієнт повинен легко поснідати за 3–4 години до початку тесту, не приймати кардіологічних препаратів, не палити як мінімум за 2 години до проби.
Для тесту 6ХХ у коридорі завдовжки 30 м ставляться непомітні для пацієнта розмітки через кожні 3 м дистанції.
Протягом 10 хвилин до тесту 6ХХ пацієнт повинен спокійно посидіти.
У цей час необхідно зачитати йому наступний текст:
«За 6 хвилин вам необхідно пройти якомога більшу відстань, при цьому не можна бігти або переміщатися перебіжками. Ви будете ходити по коридору туди і назад. Якщо з’явиться задишка або слабкість, ви можете уповільнити темп ходьби, зупинитися та відпочити. Під час відпочинку можна притулитися до стіни, потім необхідно продовжити ходьбу. Пам’ятайте, ваша мета — пройти максимальну відстань за 6 хвилин».
/107/107.jpg)
Під час тесту можна йти за пацієнтом, не форсуючи темп його ходьби.
Кожні 60 с необхідно підбадьорювати пацієнта, промовляючи спокійним тоном фрази: «Всі добре» або «Молодець, продовжуйте».
Не можна інформувати пацієнта про пройдену дистанцію та час, що залишився.
Якщо пацієнт уповільнює ходьбу, можна нагадати про те, що він може зупинитися, відпочити, притулитися до стіни, а потім, як тільки відчує, що може йти, продовжити ходьбу.
Після закінчення 6 хв слід попросити пацієнта зупинитися та не рухатися, поки не буде виміряна пройдена відстань.
Необхідно виміряти відстань з точністю до 1 м, потім запропонувати хворому присісти та спостерігати за ним як мінімум 10 хв. У цей час він може заповнити форму оцінки задишки за G. Borg, 1982. Не потрібно повідомляти пацієнту дистанцію, пройдену в кожному з тестів.
Список літератури
1. Агапитов Л.И. Лечение легочной гипертензии у детей // Лечащий врач. — 2010. — № 7.
2. Амосова Е.Н., Коноплева Л.Ф., Карел Н.А. Первичная легочная гипертензия и современние подходы к ее лечению // Международный медицинский журнал. — 2002. — № 1–2. — С. 21–26.
3. Амосова К.М., Конопльова Л.Ф., Клуннік М.О., Казаков В.С. Зміни морфо-функціонального стану серця хворих на хронічну посттромбоемболічну легеневу гіпертензію із супутньою ішемічною хворобою серця та вираженою систолічною дисфункцією лівого шлуночка під впливом довготривалого лікування інгібіторами АПФ та антагоністами кальцієвих каналів // Ліки України. — 2001. — № 7–8 (48–49). — С. 48–52.
4. Багрий А.Е., Дядик А.И., Моногарова Н.Е., Вишневецкий И.И. Легочная гипертензия и хроническое легочное сердце (cor pulmonale) // Новости медицины и фармации. Кардиология (241). — 2008 (тематический номер).
5. Беленков Ю.Н., Чазова Н.Е. Первичная легочная гипертония.— М.: Нолидже, 1999. — 144 с.
6. Бураковский В.И., Бухарин В.А., Плотникова Л.Р. Легочная гипертензия при врожденных пороках сердца. — М.: Медицина. — 248 с.
7. Гаврисюк В.К., Ячник А.И. Хроническое легочное сердце. — К., 1997. — 96 с.
8. Гарбузенко Д.В. Портопульмональная гипертензия и гепатопульмональный синдром у больных циррозами печени // Пульмонология. — 2006. — № 1. — С. 103–107.
9. Задионченко В.С., Погонченкова И.В., Гринева З.О. и др. Хроническое легочное серце // Рос. кардиолог. журнал. — 2003. — № 4. — С. 35–46.
10. Зиньковский М.Ф., Гулая Н.М., Косякова Г.В., Довгань А.М. Легочная артериальная гипертензия. — К.: Книга плюс, 2005. — 96 с.
11. Зиньковский М.Ф Врожденные пороки сердца / Под редакцией А.Ф. Возианова. — К.: Книга-плюс, 2010. — 1200 с.
12. Калачева Т.П., Чернявская Г.М., Белобородова Э.И. Формирование легочной гипертензии у больных циррозами печени // Бюллетень сибирской медицины. — 2009. — № 4(2). — С. 43–50.
13. Коноплева Л.Ф. Дифференцированное лечение легочной гипертензии и ее осложнений // Здоров’я України. — 2011, червень.— С. 45–47.
14. Коноплева Л.Ф. Тромбоэмболия легочной артерии: диагностика и лечение в свете Рекомендаций Европейского общества кардиологов (2008) // Здоров’я України. — 2009. — № 14. — С. 55–58.
15. Коноплева Л.Ф. Легочная гипертензия // Therapia. — 2011. — № 12. — С. 15–24.
16. Коноплева Л.Ф., Шишкина Н.В. Комбинированная терапия легочной артериальной гипертензии // Consilium medicum. — 2013. — Т. 7, № 2. — С. 20–25.
17. Крахмалова Е.О. Хроническая постэмболическая легочная гипертензия: терапевтические аспекты. Особенности течения, диагностики и современные подходы к лечению // Сердечная недостаточность. — 2010. — № 2. — С. 1–11.
18. Лакшина Н.А., Цветкова О.А., Рогова Е.Ф. Трудности постановки диагноза и современные подходы к терапии тромбоэмболии мелких ветвей легочной артерии // Клиническая медицина. — 2000. — Т. 78, № 12. — С. 51–54.
19. Нетяженко В.З. Сучасні принципи діагностики та лікування тромбоемболії легеневої артерії // Мистецтво лікування. — 2003. — № 4. — С. 47–52.
20. Рекомендації Європейського товариства кардіологів 2010 року щодо ведення дорослих із природженою вадою серця. Частина III // Серце і судини. — 2013. — № 1. — С.12–21.
21. Рекомендации Европейского общества кардиологов и Европейского респираторного общества по диагностике и лечению легочной гипертензии (новая версия, 2009).
22. Сиренко Ю.Н. Легочная гипертензия. Часть 1. Классификация, патогенез, клиника, диагностика // Артериальная гипертензия. — 2009. — № 2. — С. 7–13.
23.Сиренко Ю.Н. Легочная гипертензия. Часть 2. Лечение. Наблюдение. Прогноз // Артериальная гипертензия. — 2009. — № 3. — С. 7–13.
24. Терещенко С.Н., Павликова Е.П., Мерай И.А. Место мозгового натрийуретического пептида в диагностике сердечной недостаточности // Сердечная недостаточность. — 2003. — № 2. — С. 103–104.
25. Трисветова Е.Л. Диагностика и лечение легочной гипертензии // Медицинские новости. — 2009. — № 15. — С. 13–18.
26. Тромбоэмболия легочной артерии. Новые рекомендации ESC (2008) // Med. Rev. — Vol. 4. — P. 56–65.
27. Фейгенбаум Х. Эхокардиография. — М.: Видар, 1999. — 496 с.
28. Фризе Д., Штейнмюллер М., Гофрани А. ВИЧ-ассоциированная легочная гипертензия. — М., 2005. — С. 21.1–21.10.
29. Чазова И.Е., Миронова Н.А. Оценка продолжительности жизни больных первичной легочной гипертензией // Терапевтический архив. — 2005. — Т. 77, № 3. — С. 43–48.
30. Шостак Н.А., Клименко А.А., Андрияшкина Д.Ю., Новиков И.В. Митральние порки и легочная гипертезияв практике ревматолога и терапевта // РМЖ. — www.rmj.ru/articles_6412.htm
31. McLaughlin V.V., Archer S.L., Badesch D.B. et al.. ACCF/AHA 2009 Expert Consensus Document on Pulmonary Hypertension. A Report of the American College of Cardiology Foundation Task Force on Expert Consensus Documents and the American Heart Association. Developed in Collaboration With the American College of Chest Physicans American Thoracic Society, Ins., and Pulmonary Hypertension Association // Circulation. — 2009. — 119 (16). — Р. 2250–94; Am. Colli. Cardiol. — 2009. — 53 (17). — 1573–619.
32. Aheam G.S., Tapson V.F., Rebeiz A., Greenfeld J.C. Electrocadiographic to define clinical status in pulmonary hypertension and pulmonary arterial hypertension secondary to collagen vascular disease // Chest. — 2002. — 122. — P. 524–527.
33. Alp S., Skrygan M., Schmidt W.E., Bashan A. Sildenafil improves hemodynamic parametes in COPO — an investigate of six patients // Pulm. Pharmacol. Ther. — 2006. — Vol. 19 (6). — P. 386–90.
34. Barst R.J., Rich S., Widlitz A. et al. Clinical efficacy of sitaxsentan, an endothelin-A receptor antagonist, in patients with pulmonary arterial hypertension // Chest. — 2002. — 121. — P. 1860–8.
35. Bedard E., Dimopoulos K., Gatzoulis M.A. Has there been any progress made on pregnancy outcomes among women with pulmonary arterial hypertension? // Eur. Heart J. — 2009. — 30. — P. 256–265.
36. Behr J. et al A role for combination therapy in pulmonary arterial hypertension // Pneumologie. — 2005. — Oct 59 (10). — 730.
37. Behr J., Ryu J.H. Pulmonary hypertension in interstit lung disease // Eur. Respir. J. — 2008. — 31. — P. 1357–67.
38. Berman E.B., Barst R.J. Eisenmenger’s syndrome // Prodr. Cardiovas. Dis. — 2002. — 45. — P. 129–138.
39. Budts W., Wert F. Провал медицины; эволюция ДМПП в синдром Эйзенменгера // Acta Cardiol. — 2000. — 55 (4) — P. 265–267.
40. Chin K.M., Rubin L.I. Pulmonary arterial hypertension // J. Am. College of Card. — 2008. — Vol. 51, № 16. — Р. 735–97.
41. Connolly H.M., Crary J.L., McGoon M.D. et al. Valvular heart disease associated with fenfluramine-phenteramine // N. Engl. J. Med. — 1997. — 337. — P. 581–588.
42. Currie P.J., Seward J.B., Chanki R. Continuous wave Doppler determination of right ventricular pressure: a simultaneous Doppler-catheterization study 127 patientes // J. Am. Coll. Cardiol. — 1985. — 6. — P. 750–756.
43. D’Alonzo G.E., Barst R.J., Ayres S.M. et al. Survival in patients with primary pulmonary hypertension. Results from a national prospective registry // Ann. Intern. Med. — 1991. — 115. — P. 343–349.
44. Degano B., Guillaume M., Savale L., Montani D., Jaіs X., Yaici A., Le Pavec J., Humbert M., Simonneau G., Sitbon О. HIV-associated pulmonary arterial hypertension: survival and prognostic factors in the modern therapeutic era // AIDS. — 2009. — Sep 16.
45. Fawzy M.E., Hassan W., Stefadouros M. et al. Prevalence and fate of severe pulmonary hypertension in 559 consecutive patients with severe rheumatic mitral stenosis undergoing mitral ballon valvulotomy // J. Heart Valve Dis. — 2004. — 13. — P. 942–947.
46. Fishman A.P. Respiratory gases in the regulation of the pulmonary circulation // Physiol. Rev. — 1961. — P. 214–279.
47. Forssman W. Die Sondierung des rechten Herzens // Klin. Wochnschr. — 1929. — 8 — P. 2085–2087.
48. Frank H. et al. The effect of anticoagulant therapy in primary and anorectic drug-inducend pulmonary hypertension // Chest. — 1997. — 112. — P. 2085–2087.
49. Galie N., Brundage B., Ghofrani Audiz R. et al. Tadalafil therapy for pulmonary arterial hypertension // Circulation. — 2009. — 119. — Р. 2894–903.
50. Galie N., Ghofrani H.A., Torbicki A. Sildenafil citrate therapy for pulmonary arterial hypertension // New Engl. J. Med. — 2005. — 353. — P. 2148–2157.
51. Galie N., Torbicki A., Barst R et al. The Task Forse on Diagnosis and Treatment of Pulmonary Arterial Hypertension of the Europen Society of Cardiology. Guidelines on Diagnosis and Treatment of Pulmonary Arterial Hypertension // Eur. Heart J. —2004. — 25. — P. 2243–2278.
52. Galiè N. et al. Updated Treatment Algorithm of Pulmonary Arterial Hypertension // J. Am. Coll. Cardiol. — 2013. — Dec 24; 62 (25 Suppl.). — D60–72.
53.Gan C.T., McCann G.P., Marcus J.T. et al. NT-proBNP reflects right ventricular structure and function in pulmonary hypertension // Eur. Respir. J. — 2006. — Vol. 28, № 6. — P. 1190–1194.
54. Ghofrani H.A., Wiedemann R., Rose F. et al. Combination Therapy with Oral Sildenafil and Inhaled Iloprost for Severe Pulmonary Hypertension // Ann. Intern. Med. — 2002. — 136. — Р. 515–522.
55. Guidelines on diagnosis and treatment of pulmonary hypertension: The task force on diagnosis and treatment of pulmonary hypertension of the European society of cardiology (ESC) and the European Respiratory Society (ERS), endorsed by the International Society of Heart and Lung Transplantation (ISHLT) // Eur. Heart J. — 2009. — Vol. 30. — P. 2493–2537.
56. Hertz M.L., Taylor D.O., Trulok E.P. et al. The registry of international Society for Heart and Lung Transplantation Nineteenth official report // J. Heart Lung Transplantation. — 2002. — 21. — Р. 950–970.
57. Нoeper M.M., Olschewsky H., Ghofrani H.A. et al. A comparison of the acute hemodynamic effecktsinhaled bitric oxide and aerosolized iloprostin pulmonary arterial hypertension // J. Am. Coll. Cardiol. — 2000. — 35; 1. — Р. 176–182.
58. Humbert M., Barst R.J., Robbins I.M., Channick R.N., Galie N., Boonstra A., Rubin L.J., Horn E.M., Manes A., Simonneau G. Combination of bosentan with epoprostenol in pulmonary arterial hypertension: BREATHE-2 // Eur. Respir. J. — 2004. — 24. — 353–359.
59. Humbert M., Sitbon O., Chaouat A. еt al. Pulmonary arterial hypertension in France. Results from a National Registry // Am J. Respr. Crit Care Med. — 2006. — 173 (9). — P. 1023–1030.
60. Jachec W., Foremny A., Domal-Kwiatkowska D. еt al. Expression of TGF-beta and receptor genes (T–beta RI, T–beta RII and T–beta RIII — betaglycan) in peripheral blood leucocytes in patients with idiopathic pulmonary arterial hypertension and Eisenmenger’s syndrome // Int. J. Mol Med. — 2008. — Jan. 21 (1). — P. 99–107.
61. Kanemoto W. Electocardiogram in primary hypertension // Eur. J. Cardiol. — 1980. — 12. — Р. 181–193.
62. Mathai S.C., Girgis R.E., Fisher M.R., Champion H.C., Housten-Harris T., Zaiman A., Hassoun P.M. Addition of sildenafil to bosentan monotherapy in pulmonary arterial hypertension // Eur. Respir. J. — 2007. — 29. — Р. 469–475.
63. McGoon M., Gutterman D., Steen V. еt al. Sereening, early detection and diagnosis of pulmonary arterial hypertension // Chest. — 2006. — 126. — P. 143–343
64. McLaughlin V.V., Shiltington A., Rich S. Survival in primary pulmonary hypertension: the impact of epoprostenol therapy // Circulation. — 2002. — 106. — P. 1477–1482.
65. McMurtry I.F. et al. Endothelin B receptor deficiency potentiates ET-–1 and hypoxic pulmonary vasoconstriction // Am. J. Phsiol. Lung Cell. Mol. Phsiol. — 2001. — 280 — P. 1040–1048.
66. Migueres M., Escamillia R., Coca F. еt al. Pulsed Doppler echocardiography in diagnosis of COPD // Chest. — 1990. — 98. — P. 280–285.
67. Naeije R., MacNee W. Pulmonary circulation // Chronic Obstructive Pulmonary Disease/ Ed. by Calverley Р., MacNee W., Pride N., Renard S. — 2nd edition. — London: Arnold Health Sciences, 2003. — P. 228–42.
68. Olschewski H. et al. Inhaled iloprost for severe pulmonary hypertension // N. Engl. J. Med. — 2002. — 347 (5). — P. 322–329.
69. Olschewski H., Ghofrani H.A., Walmrath D. et al. Inhaled prostacyclin and iloprost in severe pulmonary hypertension secondary to lung fibrosis // Am. J. Respir. Crit. Care Med. — 1999. — 160. — P. 600–7.
70. Olschewski H., Hoeper M.M., Borst M.M., Ewert R. et al. Diagnosis and Therapy of Chronic Pulmonary Hypertension // Pneumologie. — 2006. — 60. — P. 749–771.
71. Reichenberger F., Voswinckel R., Enke B., Rutsch M. et al. Long-term treatment with sildenafil in chronic thromboembolic pulmonary hypertension // Eur. Respir. J. — 2007. — 30. — P. 922–927.
72. Rich S., Kaufmann E., Levy P.S. The effect of high doses of calcium-channel blockers on survival in primary pulmonary hypertension // N. Eng. J. Med. — 1992. — 327. — P. 76–81.
73. Opitz C.F., Wensel R., Winkler J. et al. Clinical efficacy and survival with first-line inhaled iloprost therapy in patients with idiopathic pulmonary arterial hypertension // Eur. Heart J. — 2005. — 26. — P. 1895–902.
74. Raymond R.J., Hinderliter A.L., Willis P.W. et al. Echocardiographic predictors of adverse outcomes in primary pulmonary hypertension // J. Am. Coll. Cardiol. — 2002. — 39 — P. 1214–1219.
75. Primary pulmonary hypertension. Executive summary from Word symposium — Primary pulmonary hypertension / Ed. by S. Rich. — Evian (France): WHO, 1998.
76. Rich S., Kaufmann E., Levy P.S. The effect of high doses of calcium–channel blockers on survival in primary pulmonary hypertension // N. Engl. J. Med. — 1992. — 327. — P. 76–81.
77. Rich S., Sеiditz M., Dodin Е. et al. The short-term effects of digoxin in right ventricular dysfunction from pulmonary hypertension // Chest. — 1998. — 114. — P. 787–792.
78. Simonneau G., Galie N., Rubin. et al. Clinical classification of pulmonary hypertension // J. Am. Coll. Cardiol. — 2004. — 43 (12, Suppl. S). — P. 5S–12S.
79. Simonnean G. et al. Updated clinical classification of pulmonary hypertension // J. Am. Coll. Cardiol. — 2013. — 62 (25–S).
80. Sitbon O., Humbert M., Jais X. et al. Long-term response calcium channel blockers in idiopathic pulmonary arterial hypertension // Circulation. — 2005. — Vol. 11. — P. 3105–3111.
81. Sitbon O., Humbert M., Nunes H. et al. Long-term intravenous epoprostenol infusion in primary pulmonary hypertension prognosic factors and survival // J. Am. Coll. Cardiol. — 2002. — 40. — P. 780–788.
82. Snow V., Qaseem A., Barry P. et al. and the Joint American Academy of Family Physicians/American College of Physicians Panel on Deep Venous Thrombosis/Pulmonary Embolism. Management of Venous Thromboembolism: A Clinical Practice Guideline from the American College of Physicians and the American Academy of Family Physicians // Annals of Internal Medicine. — 2007. — 146 (3). — 204–210.
83. Stoika S.C. et al. Трансплантация сердца и легких при синдроме Эйзенменгера: ранние и долгосрочные результаты // Ann. Thorac. Surg. — 2000. — Р. 72–91.
84. Swan H.I., Ganz W., Forrester J. et al. Catheterization of the heart in man with use of a flow-directed balloon — tipped catheter // N. Engl. J. — 1970. — 283 (9). — P. 447–451.
85. Torbicki A., Perrier A., Konstantinides S. et al. Guidelines on the diagnosis and management of acute pulmonary embolism. The Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC) // European Heart Journal. — 2008. — 29 (18). — Р. 2276–2315.
86. Trembath R.C., Thomson J.R., Machado R.D. et al. Clinical and molecular genetic features of pulmonary hypertension in patients with hereditary hemorrhagic teleangiectasia // N. Engl. J. Med. — 2001. — 345 (5). — P. 325.
87. Trulock E.P., Christie J.D., Edwards L.B. et al. Registry of the Intеrnational Society for Heart and Lung Transplantation: twenty-fourth official adult lung and heart-lung transplantation report // Heart Lung Traпsplant. — 2007. — 26. — P. 782–795.
88. Zarate N.S. Синдром Эйзенменгера. Достижения в патобиологии и лечении // Arch. Cardiolog. Mex. — 2002. — 72. — S. 207–11.
89. Zuber J., Calmy A., Evison J. et al. Pulmonary arterial hypertension related to HIV infection improved haemodynamics and survival associated with antiretroviral therapy // Clin. Infect. Dis. — 2004. — 38 — Р. 1178–85.
90. Vongpatanasin W., Brickner M.E., Hillis L.D., Lange R.A. The Eisenmenger’s syndrome in adults // Ann. Intern. Med. — 1998. — Vol. 128. — P. 745–755.
91. Wadell T.K., Kenndy et al. Heart — lung or lung transplantation for Eisenmenger syndrome // J. Heart Lung Transplant. — 2003. — 21 (7). — P. 731–7.
92. Wiedemann R., Ghofrani H.A., Weissmann N. et al. Atrial natriuretic peptide in severe primary and nonprimary pulmonary hypertension: response to iloprost inhalation // J. Am. Coll. Cardiol. — 2001. — Vol. 38, № 4. — P. 1130–1136.
93. Wilkens H., Guth A., König J. et al. Effect of inhaled iloprost plus oral sildenafil in patients with primary pulmonary hypertension // Circulation. — 2001. — Sep. 11. — 104 (11). — Р. 1218–22.
94. Wood P. Pulmonary hypertension // Mod. Conc. Cardiov. Dis. — 1959. — Vol. 28. — P. 513.

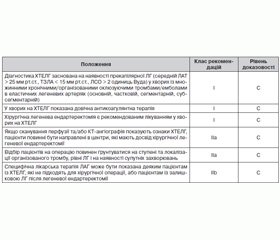
/79/79.jpg)
/80/80.jpg)
/85/85.jpg)
/81/81_2.jpg)
/87/87.jpg)
/88/88.jpg)
/89/89.jpg)
/90/90.jpg)
/94/94.jpg)
/95/95.jpg)
/96/96.jpg)
/97/97.jpg)
/99/99.jpg)
/100/100.jpg)
/101/101.jpg)
/102/102.jpg)
/103/103.jpg)
/106/106.jpg)
/105/105.jpg)