Международный неврологический журнал 5 (67) 2014
Вернуться к номеру
Применение препарата Зеродол в комплексной терапии вертеброгенных болевых синдромов пояснично-крестцовой локализации
Авторы: Колосова Т.В., Асауленко Е.И., Головченко Ю.И. - Национальная медицинская академия последипломного образования имени П.Л. Шупика, г. Киев; Харитонова Е.В. - Поликлиника № 2 Святошинского района, г. Киев
Рубрики: Неврология
Разделы: Справочник специалиста
Версия для печати
Статья посвящена одной из актуальных проблем в неврологии — лечению пациентов с вертеброгенными болевыми синдромами. При данной патологии патогенетически обоснованным является применение нестероидных противовоспалительных препаратов. Авторы приводят данные собственного исследования эффективности и безопасности препарата Зеродол (ацеклофенак) в комплексном лечении пациентов с вертеброгенными рефлекторными болевыми синдромами пояснично-крестцового отдела позвоночника в сравнении с терапией диклофенаком натрия.
Стаття присвячена одній з актуальних проблем у неврології — лікуванню пацієнтів з вертеброгенними больовими синдромами. За даною патологією патогенетично обґрунтованим є застосування протизапальних препаратів.. Автори наводять дані власного дослідження ефективності й безпеки препарату Зеродол (ацеклофенак) у комплексному лікуванні пацієнтів з вертеброгенними рефлекторними больовими синдромами попереково-крижового відділу хребта порівняно з терапією диклофенаком натрію.
The article deals with one of the most pressing problems in neurology — the treatment of patients with vertebrogenic pain syndromes. In this pathology, the use of anti-inflammatory drugs is pathogenetically substantiated. The authors provide data of their own research on the effectiveness and safety of Zerodol (aceclofenac) in the combination therapy of patients with vertebrogenic reflex pain syndromes in the lumbosacral spine in comparison with diclofenac sodium therapy.
вертеброгенный болевой синдром, лечение, ацеклофенак.
вертеброгенний больовий синдром, лікування, ацеклофенак.
vertebrogenic pain syndrome, treatment, aceclo-fenac.
Статья опубликована на с. 110-114
Одной из основных задач терапии вертеброгенных болевых синдромов является адекватное купирование боли. Результатами многочисленных многоцентровых исследований, направленных на изучение и терапию острой боли, доказана высокая анталгическая эффективность нестероидных противовоспалительных средств (НПВС). Благодаря сочетанию болеутоляющего, жаропонижающего и противовоспалительного действий НПВС являются наиболее часто применяемыми в мире лекарствами. По данным Всемирной организации здравоохранения (ВОЗ), около 20 % населения планеты регулярно принимают НПВС.
С другой стороны, использование НПВС сопряжено с побочными реакциями (ПР), встречающимися примерно в 25 % случаев. При этом в спектре ПР преобладают поражения желудочно-кишечного тракта (ЖКТ), так называемые НПВС-индуцированные гастропатии, встречающиеся значительно чаще у лиц пожилого и старческого возраста, которые достигают 52,5 % (Свінціцький А.С. и соавт., 2004).
На основании многолетнего опыта применения НПВС разработаны меры по улучшению переносимости препаратов этой группы, включающие в комплексную терапию препараты, обеспечивающие цитопротективный эффект в отношении слизистой ЖКТ, — ингибиторы протонного насоса (ИПП). Однако ИПП успешно лечат только диспептические расстройства и не снижают риск индуцированных неселективными НПВС кровотечений из нижних отделов желудочно-кишечного тракта (Яременко О.Б., 2006).
Одним из направлений в решении проблемы гастротоксичности признано использование селективных ингибиторов ЦОГ-2, что связано с особенностями их механизма действия — избирательным ингибированием изофермента ЦОГ-2, обеспечивающим известные терапевтические эффекты НПВС. Однако с появлением селективных ингибиторов ЦОГ-2 возникла необходимость учитывать и риск развития кардиоваскулярных осложнений, теоретическим обоснованием для которых является гипотеза простациклин-тромбоксанового дисбаланса, провоцирующегося избирательным выключением функции ЦОГ-2.
С целью профилактики осложнений НПВС-терапии необходимо не только учитывать абсолютные противопоказания, но и оценивать факторы риска, а именно: возраст (старше 65 лет); пептические язвы желудка и двенадцатиперстной кишки, а также кровотечения в анамнезе; прием НПВС в высоких дозах; длительные курсы лечения (более 3 мес.); одновременный прием нескольких НПВС; сочетание с глюкокортикостероидами; комплексную терапию с антикоагулянтами и антиагрегантами, некоторые другие (Викторов А.П., 2006).
Однако решающее значение успешности НПВС-терапии остается за рациональным выбором препарата с позиций польза/риск.
Особый интерес вызывают данные о том, что неселективные НПВС с определенными фармакокинетическими свойствами (короткий период полураспада, быстрое всасывание и элиминация, отсутствие печеночной рециркуляции) и сбалансированной активностью в отношении ЦОГ-1 и ЦОГ-2 могут превосходить селективные ингибиторы ЦОГ-2 по эффективности и быть сравнимы с ними по безопасности (Насонов Е.Л., 2002; Чичасова Н.В и соавт., 2003; Henrotin Y. еt al., 2001). К таким препаратам относится ацеклофенак — производное фенилуксусной кислоты. Препарат обладает коротким периодом полураспада (4 ч), быстро всасывается — максимальная концентрация в крови достигается уже через 1–3 часа после приема, при этом его концентрация в синовиальной жидкости достигает 57 % от уровня концентрации в плазме. Выводится почками (до 66 %). Лечебная доза препарата составляет 200 мг/сут. Доказано, что ацеклофенак ингибирует оба изофермента ЦОГ с преимущественным угнетением ЦОГ-2 (Lemmel E.M. et al., 2002), а также подавляет синтез ряда провоспалительных цитокинов (фактора некроза опухоли a, интерлейкина-1b) (Haskinsson E.C., 2000).
В настоящее время накоплен большой практический опыт применения ацеклофенака при различных ревматологических заболеваниях. Полученные результаты многочисленных клинических исследований продемонстрировали сходную эффективность ацеклофенака и неселективных НПВС (диклофенака, индометацина, теноксикама, напроксена) при лечении ревматоидного артрита (Liorente Melero M.J., 2002).
При проведении ряда клинических исследований по лечению остеоартроза коленных суставов с применением ацеклофенака был получен анальгезирующий эффект, сопоставимый с результатами лечения другими НПВС (диклофенаком, пироксикамом, напроксеном) (Ward D.E. et al., 1995; Pasero G. et al., 1994; Perez Busquiner M. et al., 1997). E. Battle-Gualda et al. (2007) в двойном слепом рандомизированном 6-недельном исследовании 168 больных остеоартрозом коленных суставов продемонстрировали более выраженный обезболивающий эффект ацеклофенака в дозе 200 мг/сут при его лучшей переносимости по сравнению с парацетамолом в дозе 3 г/сут.
В исследовании J.T. Dingle, M. Parker (1997), в котором принимали участие пациенты с болезнью Бехтерева, также была продемонстрирована равная терапевтическая эффективность ацеклофенака и других НПВС (индометацина, теноксикама, напроксена) при купировании боли, уменьшении продолжительности утренней скованности, улучшении двигательной активности.
Результаты проспективного открытого многоцентрового 12-месячного исследования SSMM (Safety Assessment of Marketed Medicines), в котором принимали участие 10 142 больных с ревматоидным артритом, остеоартрозом, анкилозирующим спондилоартритом, свидетельствовали о лучшем профиле переносимости ацеклофенака в сравнении с диклофенаком. Авторы E. Huskisson, M. Irani, F. Murray (2007) пришли к заключению: применение ацеклофенака сопровождалось меньшим риском развития НПВС-гастропатий и лучшей переносимостью.
Применению ацеклофенака в клинике нервных болезней посвящены единичные работы. Результаты проведенного двойного слепого многоцентрового клинического исследования по сравнению эффективности и переносимости ацеклофенака и диклофенака резината у пациентов с острой болью в нижней части спины продемонстрировали анальгетическую эффективность ацеклофенака, которая не уступает диклофенаку, а также клинически лучший профиль безопасности и переносимости ацеклофенака в сравнении с диклофенаком (Schattenkirchner M., Milachowski K.А., 2003). Целью исследования явилось изучение эффективности и безопасности препарата Зеродол (Ipka) в комплексном лечении пациентов с вертеброгенными рефлекторными болевыми синдромами пояснично-крестцового отдела позвоночника в сравнении с терапией диклофенаком натрия.
Материалы и методы
Обследовано 48 пациентов (31 женщина, 17 мужчин) с вертеброгенной люмбалгией/люмбоишиалгией, сопровождающейся умеренным болевым синдромом. Средний возраст составил 53,8 ± 3,9 года. Длительность заболевания колебалась от 1 месяца до 5 лет, причем в 39 % случаев — более 3 лет. В І группе (28 больных) на фоне традиционной терапии (дегидратирующей, витаминотерапии, физиотерапевтических методов) назначался Зеродол (ацеклофенак) перорально в дозе 200 мг/сут. Больным контрольной группы (ІІ группа, 20 пациентов) в комплексную терапию был включен диклофенак натрия перорально в дозе 150 мг/сут. Курс терапии составил 14 дней. Пациенты І и ІІ групп были сопоставимы как по возрастному и половому составу, так и по клинической картине заболевания.
Пациентам проводились неврологическое, общие лабораторные и инструментальные исследования (спондилография, магнитно-резонансная томография позвоночника).
Критериями исключения были эрозивно-язвенные поражения желудочно-кишечного тракта в стадии обострения, перфорации или кровотечения в последние 6 месяцев, аллергические реакции на НПВС, бронхиальная астма, нарушение свертывающей системы крови или сопутствующее лечение антикоагулянтами (кроме малых доз аспирина), беременность, тяжелые функциональные нарушения печени и почек.
Согласно рекомендации ВОЗ по стандартизации способов оценки исходов лечения пациентов с болью в нижней части спины (Ehrlich G.E. et al., 1999), эффективность терапии оценивалась по динамике следующих диагностических шкал и опросников: визуальная аналоговая шкала (ВАШ), тест Шобера, опросник Освестри, данные анамнеза и физикального обследования. Кроме того, использовались шкала общего клинического впечатления, шкала оценки вертеброневрологической симптоматики А.И. Беловой и соавт. (2002). Оценивался профиль безопасности. Исследование проводили до лечения, через 5 дней и на 14-й день наблюдения.
Оценка болевого синдрома проводилась по визуальной аналоговой шкале. ВАШ представляет собой отрезок прямой линии длиной 10 см, на которой через каждые 2 см нанесены опорные слова: 0 — отсутствие боли, 2 см — слабая боль, 4 см — умеренная, 6 см — сильная, 8 см — очень сильная, 10 см — максимально возможная боль. По шкале оценки вертеброневрологической симптоматики А.И. Беловой и соавт. (2002) (модифицированная, 10 баллов) определялись наличие и выраженность мышечно–тонического синдрома, проявляющегося рефлекторным люмбоишиалгическим сколиозом, анталгическими позами в положении сидя, лежа, симптомами натяжения (Ласега, градусы), наличием пальпаторной болезненности и напряжением паравертебральных мышц поясничной области. Кроме того, исследовался объем активных движений в поясничном отделе позвоночника в сагиттальной плоскости (проба Шобера, см) и во фронтальной плоскости (наклоны в стороны, см; рассчитывался показатель, равный разнице между расстоянием от пальцев вытянутых вдоль тела рук до пола в исходном положении и при боковых наклонах).
Для выявления степени нарушений жизнедеятельности при болевом синдроме использовался опросник Освестри, позволяющий получить информацию о степени влияния боли на самообслуживание пациента. Опросник содержит 10 разделов, отражающих как жалобы пациента, так и нарушения в сферах самообслуживания, трудовой, бытовой активности и отдыха. Каждый раздел содержит 6 утверждений, оценивающихся от 0 до 5 баллов. Полученные по разделам баллы суммируются, максимальное число баллов равно 50. Интерпретация полученных результатов проводилась по следующей схеме: 0 баллов — нет нарушений; 5–14 баллов — легкие нарушения; 15–24 балла — умеренные нарушения; 25–34 балла — тяжелые нарушения, более 34 баллов — функция нарушена полностью.
Шкала общего клинического впечатления предусматривает следующие градации: –1 балл — ухудшение; 0 баллов — отсутствие эффекта; 1 балл — незначительно выраженный эффект; 2 балла — умеренный эффект; 3 балла — значительный эффект.
На основании выявленных побочных явлений оценивался профиль безопасности.
Основанием для выхода из исследования служили: непереносимость препарата, нежелание больного продолжать участие в исследовании, необходимость назначения других средств лечения, которые могли повлиять на оценку эффективности.
Для статистической обработки полученных данных использовались методы вариационной статистики с определением достоверности динамики показателей по t-критерию Стьюдента. Обработка результатов исследования проводилась с применением пакета статистических программ Microsoft Excel.
Результаты лечения
До начала лечения пациентов обеих групп беспокоили боли в пояснице, ягодичной области и в ноге, усиливающиеся при движении (чаще при ходьбе), при незначительных физических нагрузках, при длительном пребывании в положении сидя, стоя, а также при кашле и чихании. В положении лежа боли, как правило, исчезали или резко снижалась их интенсивность. Болевые ощущения были оценены как умеренные и составили по ВАШ 5,4 ± 0,3 см и 5,1 ± 0,3 см в I и II группах.
В неврологическом статусе мышечно-тонический синдром проявлялся рефлекторным люмбоишиалгическим сколиозом и анталгическими позами в положении сидя, стоя, симптомами натяжения (Ласега). При пальпации имело место повышенное напряжение поясничных мышц, особенно многораздельных, в виде паравертебральных тяжей, не исчезающих (или запаздывающих с одной или двух сторон) при наклонах туловища вперед на 20° и более. До лечения показатели мышечно-тонического синдрома составили в I группе 5,0 ± 0,3 балла, во II группе — 5,2 ± 0,3 балла. При этом симптом Ласега незначительно превышал 40° и составил в І и ІІ группах в среднем 42,6 ± 2,2° и 44,1 ± 2,4°. В обеих группах движения в поясничном отделе позвоночника были ограничены, болезненны, сглажен поясничный лордоз. Проба Шобера в начале лечения соответствовала 2,1 ± 0,3 см и 2,0 ± 0,3 см в І и ІІ группах. При наклонах в сторону боли — 4,3 ± 0,4 см и 3,8 ± 0,3 см в І и ІІ группах соответственно. Сумма баллов опросника Освестри в обеих группах достигала верхней границы умеренных нарушений жизнедеятельности: 23,4 ± 1,8 балла (І группа) и 24,1 ± 2,5 балла (ІІ группа).
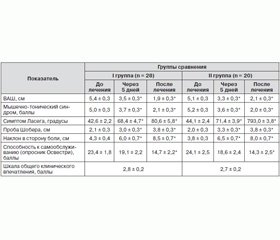
Динамика основных клинических показателей в исследуемых группах до и после курса лечения представлена в табл. 1.
Исследование, проводившееся через 5 дней, продемонстрировало позитивную динамику неврологического статуса в обеих группах, о чем свидетельствовали достоверные изменения большинства показателей используемых шкал и опросников. Выраженность болевого синдрома достоверно уменьшилась по ВАШ в І группе с 5,4 ± 0,3 см до 3,5 ± 0,3 см (р < 0,05), во ІІ группе — с 5,1 ± 0,3 см до 3,3 ± 0,3 см (р < 0,05), восстановился сон, повысился эмоциональный фон настроения (рис. 1).
/113/113.jpg)
По нашим наблюдениям, устойчивый обезболивающий эффект наступал на 3–5-й день от начала комплексной терапии с применением Зеродола. Продолжительность обезболивающего эффекта соответствовала 5–6 часам, затем эффект снижался. Для продолжения успешной курации болевого синдрома в ряде случаев требовался повторный прием препарата.
Достоверно снизился показатель мышечно-тонического синдрома в І группе с 5,0 ± 0,3 балла до 3,7 ± 0,3 балла (р < 0,05), во ІІ группе — с 5,2 ± 0,3 до 3,6 ± 0,3 балла (р < 0,05). Увеличился объем движений в поясничном отделе позвоночника в обеих группах. Возросли показатели пробы Шобера (І группа — с 2,1 ± 0,3 см до 3,0 ± 0,3 см, р < 0,05; ІІ группа — с 2,0 ± 0,3 см до 3,3 ± 0,3 см, р < 0,05).
Увеличился объем движений и во фронтальной плоскости в обеих группах (І группа — с 4,3 ± 0,4 см до 6,0 ± 0,7 см, р < 0,05; ІІ группа — с 3,8 ± 0,3 см до 6,5 ± 0,7 см, р < 0,05). Уменьшились трудности при усаживании в постели из положения лежа, больные начали удерживать выпрямленные ноги на весу, снизилась выраженность рефлекторного сколиоза. Симптомы натяжения Ласега достигли 60°.
Повысилась способность пациентов к самообслуживанию, показатели опросника Освестри соответствовали уровню умеренных нарушений жизнедеятельности и составили 19,1 ± 2,2 балла в І группе и 18,6 ± 2,4 балла во ІІ группе. Однако изменения не достигли достоверности (р > 0,05).
Курс лечения в среднем составил 14,7 ± 0,2 дня. После проведенной терапии болевой синдром был купирован; в ряде случаев пациенты отмечали незначительные боли в поясничной области или дискомфорт при увеличении физических нагрузок либо при длительном пребывании в вынужденных позах, продолжительной ходьбе. Позитивная динамика показателей опросников и шкал подтвердила активное восстановление неврологического и психоэмоционального статуса пациентов, самообслуживания, качества жизни. В обеих группах достоверно снизились показатели ВАШ и достигли уровня слабого болевого синдрома (1,9 ± 0,3 см и 2,1 ± 0,3 см в I и II группах, р < 0,05). Достоверно увеличился объем движений в поясничном отделе позвоночника (исчезли рефлекторный люмбоишиалгический сколиоз и анталгические позы, болезненность паравертебральных точек, восстановился объем движений в сагиттальной (проба Шобера) и во фронтальной (наклоны в сторону боли) плоскостях (табл. 1). По данным опросника Освестри, повысилось качество жизни пациентов обеих групп — после курса лечения показатель нарушения самообслуживания снизился до уровня легких нарушений: 14,7 ± 2,2 балла и 14,3 ± 2,5 балла в І и ІІ группах соответственно (р < 0,05).
Эффективность терапии с использованием Зеродола была оценена по шкале общего клинического впечатления в 2,8 ± 0,1 балла (при максимальном значении 3 балла). Значительное улучшение отмечали 43 % пациентов (12 больных), улучшение составило 52 % (15 пациентов), в 5 % случаев (1 пациент) наблюдалось «незначительное улучшение». Эффективность НПВС-терапии во ІІ группе оценивалась в 2,7 ± 0,1 балла, при этом значительное улучшение наблюдалось в 40 % случаев (8 пациентов), улучшение составило 55 % (11 больных), незначительное улучшение — 5 % (1 пациент). Таким образом, в обеих группах улучшение и значительное улучшение составило 95 %.
За период лечения у пациентов І группы применение Зеродола не вызвало побочных реакций, требующих отмены препарата. У двух пациентов (10 %) во IІ группе были выявлены побочные явления в виде тошноты, болей в эпигастральной области, не приведшие к отмене препарата.
Результаты исследования позволили сделать следующий вывод: полученные данные свидетельствуют о клинической эффективности препарата Зеродол в комплексной терапии вертеброгенных рефлекторных болевых синдромов, сопоставимой с традиционной НПВС-терапией (диклофенаком натрия) при значительно лучшей переносимости и безопасности.
1. Викторов О.П. Алергічні реакції на лікарські засоби: сучасні проблеми // Новости медицины и фармации. — 2006. — № 16. — С. 14–16.
2. Свінціцький А.С., Пузанова О.Г. Окремі клінічні аспекти застосування НПЗП // Doctor. — 2004. — № 3. — С. 70–71.
3. Шкалы, тесты и опросники в медицинской реабилитации / Под ред. А.И. Беловой, О.И. Щепетовой. — М.: Антидор, 2002. — 440 с.
4. Насонов Е.Л., Чичасова Н.В., Шмидт Е.И. Перспективы применения неселективных нестероидных противовоспалительных препаратов (на примере кетопрофена) и селективных ингибиторов ЦОГ-2 в клинической практике // Русский медицинский журнал. — 2002. — Т. 10, № 22. — С. 1014–1017.
5. Яременко О.Б. Кардиоваскулярная безопасность нестероидных противовоспалительных препаратов: суть проблемы и алгоритм практических действий // Терапия. — 2006. — № 2. — С. 30–36.
6. Battle-Gualda E. et al. Aceclofenak vs paracetamol in the management of systematic osteoarthritis of the knee: a double-blind 6 week randomized controlled trial // Osteoartritis Cartilage. — 2007. — 15 (8). — 900–908.
7. Huskisson E., Irani M., Murray F. A large prospective open-label, multicentre SAMM study, comparing the safety of aceclofenak with diclfenac in patients with rheumatic disease // Eur. J. Rheumatol. Inflamm. — 2000. — Vol. 17. — P. 1–7.
8. Henrotin Y., De Leval X., Mathy-Hartet M. et al. In vitro effects of aceclofenak and its metabolites on the production by chondrocytes of inflammatory mediators // Inflamm. Res. — 2001. — Vol. 50. — P. 391–399.
9. Lemmel E.M., Leeb B., De Bast J., Aslanidis S. Patient and physician satisfaction with aceclofenak: results of the European Observational Cohort Study Aceclofenak is the treatment of choice for patients and physicians in the management of inflammatory pain // Curr. Med. Res. Opin. — 2002. — 18 (3). — 146–153.
10. Ward D.E., Veys E.M., Bowdker J.M., Roma J. Comparison of aceclofenak with diclfenac in the treatment of osteoarthrosis // Clin. Rheumatol. — 1995. — Vol. 14. — P. 656–662.
11. Pasero G., Ruju G., Macolongo R. et al. Aceclofenak versus naproxen in the treatment of ankylosing spondylitis: a double-blind, controlled study // Curr. Тher. Res. — 1994. — Vol. 55. — P. 833–842.
12. Perez Busquiner M., Calero E., Rodriguez M. et al. Comparison of aceclofenak with naproxen in the treatment of osteoarthrosis // Clin. Rheumatol. — 1997. — Vol. 16. — P. 154–159.
13. Dingle J.T., Parker M. NSAID stimulation of human cartilage matrix synthesis: a study of the mecthanism of action of aceclofenak // Clin. Drug Invest. — 1997. — Vol. 14. — P. 353–362.
14. Schattenkirchner M., Milachowski KA (2003). A double-blind, multicentre, randomised clinical trial comparing the efficacy and tolerability of aceclofenak with diclfenac resinate in patients with acute low back pain // Clin. Rheumatol. — 2003 May. — 22 (2). — 127–35.

/113/113_2.jpg)