Международный неврологический журнал 5 (67) 2014
Вернуться к номеру
Використання габапентину (Медітану) в клінічній практиці невролога з позиції доказової медицини
Авторы: Свістільнік Р.В. - Старокостянтинівський військовий госпіталь, Хмельницька обл.
Рубрики: Неврология
Разделы: Справочник специалиста
Версия для печати
В оглядовій статті узагальнюються можливості використання антиконвульсанта габапентину (Медітану) в клінічній практиці при різноманітних захворюваннях як центральної, так і периферичної нервової системи з позиції доказової медицини та останніх рекомендацій Європейської федерації неврологічних товариств (EFNS), британського Національного інституту здоров’я і клінічної кваліфікації (NICE), Американської академії неврології (AAN) і окремих провідних асоціацій і товариств.
В обзорной статье обобщаются возможности использования антиконвульсанта габапентина (Медитана) в клинической практике при различных заболеваниях как центральной, так и периферической нервной системы с позиций доказательной медицины и последних рекомендаций Европейской федерации неврологических обществ (EFNS), британского Национального института здоровья и клинической квалификации (NICE), Американской академии неврологии (AAN) и отдельных ведущих ассоциаций и обществ.
This review article summarizes the possible use of anticonvulsant agent gabapentin (Meditan) in clinical practice for a variety of diseases of both central and peripheral nervous system from the standpoint of evidence-based medicine and the recent guidelines of European Federation of Neurological Societies (EFNS), British National Institute for Health and Care Excellence (NICE), American Academy of Neurology (AAN) and some leading associations and societies.
габапентин, Медітан®, біль, фармакотерапія.
габапентин, Медитан®, боль, фармакотерапия.
gabapentin, Meditan®, pain, pharmacotherapy.
Статья опубликована на с. 123-130
Близько 20 років у клінічній практиці використовується антиконвульсант габапентин, що створювався як структурний аналог гальмівного нейромедіатора y-аміномасляної кислоти (ГАМК) [2, 16, 25].
У 1994 році габапентин був ліцензований як додаткова терапія для лікування парціальних нападів епілепсії. Після використання габапентину більше ніж у 8,7 млн пацієнтів було визначено його досить низьку токсичність і відсутність тяжких побічних дій, що стало поштовхом до вивчення його дії на невропатичний біль [25]. У рандомізованих плацебо-контрольованих дослідженнях було показано його ефективність при невропатичному болі, що в подальшому спонукало до більш широкого використання препарату [25].
Габапентин мав також сприятливий профіль безпечності з мінімальним ризиком взаємодії з іншими лікарськими засобами, відсутністю впливу на ферменти печінки CYP450, що визначило його як засіб вибору для лікування невропатичного болю. Найбільш частими побічними діями засобу були головокружіння (23,9 %), сонливість (27,4 %), атаксія (7,1 %) і периферичні набряки (9,7 %). Габапентин практично не метаболізується в печінці, а головним чином екскретується нирками, що повинно враховуватися у хворих із патологією нирок, оскільки ризик побічних дій препарату в них може зростати [2, 21, 26].
Особливості препарату надавали йому певні переваги над іншими антиконвульсантами. Так, карбамазепін, фенітоїн, фенобарбітал, примідон є потужними активаторами печінкових ферментів, а вальпроєва кислота — потужним інгібітором цитохромів печінки, що може впливати на метаболізм інших засобів і призводити до посилення їх токсичності та взаємодії. Окрім того, вони є гепатотоксичними засобами й можуть сприяти аномаліям розвитку плода у вагітних жінок, які їх використовують. У той же час гепатотоксичної та ембріотоксичної дії габапентину виявлено не було [20].
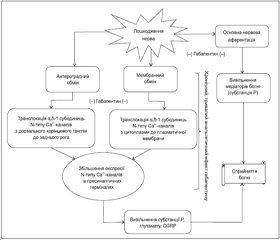
Точний механізм дії габапентину на збудливість нейронів до кінця не визначений. Основними місцями дії габапентину є дорзальний ріг спинного мозку, голубувата пляма (locus coeruleus) стовбура мозку та корінцевий дорзальний ганглій (рис. 1) [21].
Підгрупа a2qкальцієвих каналів на корінцевих спінальних гангліях була визначена як основна молекулярна ціль габапентину [16, 21, 25].
Доведено, що він взаємодіє з a2q1 субодиницями підгруп потенціалзалежних кальцієвих каналів і гальмує входження іонів Са2+, тим самим знижуючи вивільнення з пресинаптичних терміналей нейромедіаторів, які беруть участь у розвитку невропатичного болю, а саме: глутамату, субстанції Р, пептиду, зв’язаного з геном кальцитоніну (CGRP), що призводить до зменшення збудливості ноцицептивних нейронів спинного мозку [2, 21, 25]. Також було доведено, що габапентин зменшує не тільки вивільнення субстанції Р, але й її утворення, що викликано активацією нуклеарного фактора kB (NF-kB) та прозапальними цитокінами, тим самим призводить до зменшення больового синдрому за рахунок пригнічення запального процесу [21].
Окрім пригнічення вивільнення глутамату в корінцевих спінальних гангліях, габапентин призводить до модуляції активності його NMDA-рецепторів, знижуючи активність К+-каналів [2, 25]. Також було виявлено, що габапентин здатний частково пригнічувати потоки іонів Са2+ активованими NMDA-рецепторами в гіпокампальних нейронах CA1, зменшуючи ступінь нейронального пошкодження, викликаного механізмами ексайтотоксичності 31].
Ще одним механізмом дії габапентину, як вважається, може бути пригнічення антероградного аксоплазматичного транспорту a2q1 підгруп від корінцевих спінальних гангліїв до основних провідних терміналей нервів в дорзальному розі спинного мозку, тим самим габапентин нормалізує в ньому вміст білка a2q1. Такий механізм дії може мати антиалодинічний ефект [21].
Виникнення больового синдрому внаслідок неврального пошкодження також пов’язане з надмірною експресією протеїнкінази С в спинному мозку, що причетна до ноцицептивної нейропластичності. Виявлено, що габапентин пригнічує надмірну експресію протеїнкінази С у процесі лікування, що може додатково справляти знеболювальний ефект [21].
Знеболювальний ефект габапентину може також реалізуватися через механізми периферичного больового синдрому, діючи на супраспінальному рівні, стимулюючи низхідне гальмування дорзальних нейронів спинного мозку. Периферичне невральне пошкодження призводить до зміни пластичності ГАМКергічних нейронів у голубуватій плямі (locus coeruleus) стовбура головного мозку (збільшуючи вивільнення ГАМК) і в дорзальному розі спинного мозку (зменшуючи вивільнення ГАМК). Габапентин вибірково зменшує пресинаптичне вивільнення ГАМК у голубуватій плямі, що призводить до збільшеного виділення норадреналіну, який гальмує больову нейротрансмісію в спинному мозку через активацію a2-адренорецепторів [21].
Важливим є також факт, що габапентин не взаємодіє з ГАМК-А- і ГАМК-В-рецепторами, а також гліциновими, адренергічними й холінергічними рецепторами. Пікова концентрація габапентину досягається через 2–3 години після прийому, а період напіввиведення становить 5–7 годин, тому інтервал між прийомами засобу не повинен перевищувати 12 годин. Вживання їжі не впливає на фармакокінетику препарату, його біодоступність становить 60 %. Габапентин досить легко проникає через гематоенцефалічний бар’єр [2].
Отже, враховуючи особливості препарату, габапентин зайняв одне з важливих місць у лікуванні різноманітної неврологічної патології як ЦНС, так і периферичної нервової системи, що було показано в численних дослідженнях.
Невропатичний біль
Міжнародна асоціація дослідження болю (IASP, 2011) визначає невропатичний біль як біль, викликаний ураженням або хворобою соматосенсорної нервової системи, який спостерігається у 7–8 % європейського населення [9, 28].
Центральний невропатичний біль — це біль, викликаний ураженням центральної соматосенсорної нервової системи, а периферичний невропатичний — біль, викликаний ураженням периферичної соматосенсорної нервової системи. Невропатичний біль може бути нестійким або постійним, довільним або викликаним. Клінічно проявляється прострілами, відчуттям пробігання електричного струму, поколюванням, відчуттям печії і «повзання мурашок» (парестезії). Також можуть спостерігатися алодинія (біль, викликаний стимулом, що зазвичай його не викликає), гіпералгезія (збільшена реакція на стимул, що є зазвичай неболючим), дизестезії (спотворене сприйняття подразників, коли тактильні або теплові стимули сприймаються хворим як больові чи холодові) тощо [2, 28].
Причинами пошкодження периферичної нервової системи, що викликають невропатичний біль, можуть бути метаболічні порушення, травми, інфекції, інтоксикації, механічне здавлювання. Причинами центрального невропатичного болю можуть бути травми спинного і головного мозку, інсульти, множинний склероз, сирингомієлія тощо [2].
Патофізіологічною основою невропатичного болю є порушення, пов’язані з генерацією та проведенням ноцицептивного сигналу в нервових волокнах, а також процеси контролю збудливості ноцицептивних нейронів у структурах спинного і головного мозку. Порушення генерації імпульсів у периферичних нервах проявляється у вигляді ектопічної активності. Ці розряди виникають унаслідок збільшення кількості та зміни структури натрієвих каналів на мембрані нервових волокон. Розвиток нейрогенного больового синдрому супроводжується збільшенням збудливості і реактивності ноцицептивних нейронів у дорзальних рогах спинного мозку, у таламічних ядрах і соматосенсорній корі великих півкуль [2].
Лікування нейрогенних больових синдромів доволі складне. Вони практично не піддаються лікуванню звичайними анальгетиками та протизапальними засобами.
Серед засобів, що впливають на патогенетичні механізми нейрогенного больового синдрому, особливе місце займають антиконвульсанти. Деякі антиконвульсанти поєднують у собі два і більше механізми впливу на збудливість нейрональних мембран, забезпечуючи гальмування гіперактивних нейронів [2].
Одним із таких засобів є габапентин. Висока терапевтична ефективність габапентину була продемонстрована в рандомізованих плацебо–контрольованих клінічних дослідженнях у хворих на діабетичну полінейропатію, постгерпетичну невралгію, тригемінальну невралгію, при комплексному регіональному больовому синдромі, центральному больовому синдромі та ін.
Так, згідно з рекомендаціями Американської асоціації анестезіологів (American Society of Anesthesiologists) саме антиконвульсанти повинні використовуватися у хворих із невропатичним болем (рівень А) [30]. Згідно з рекомендаціями британського Національного інституту здоров’я і клінічної кваліфікації (National Institute for Health and Clinical Excellence — NICE) трициклічний антидепресант амітриптилін, селективний інгібітор зворотного захвату серотоніну та норадреналіну (СІЗЗСН) дулоксетин, антиконвульсанти габапентин і прегабалін є препаратами початкового лікування невропатичного болю [28].
Діабетична полінейропатія
Діабетична сенсомоторна полінейропатія — найбільш поширена патологія нервової системи при цукровому діабеті, що значно впливає на якість життя хворих, погіршує перебіг основного захворювання і сприяє більшим економічним затратам в охороні здоров’я. Діабетична полінейропатія з больовим синдромом уражає 16 % хворих на цукровий діабет, у 39 % вона важко піддається лікуванню [21].
За останніми рекомендаціями Європейської федерації неврологічних товариств (EFNS), амітриптилін (25–150 мг/добу), СІЗЗСН дулоксетин (30–60 мг/добу) і венлафаксин (37,5–150 мг/добу), антиконвульсанти габапентин (1200–3600 мг/добу) і прегабалін (150–600 мг/добу) є засобами першої лінії в лікуванні больового синдрому при діабетичній полінейропатії (рівень А) [9].
Однак через значні ризики та побічні ефекти амітриптиліну і СІЗЗСН габапентин є препаратом вибору в лікуванні хворих похилого віку з діабетичною полінейропатією, оскільки має добру переносимість і безпечний порівняно з іншими засобами. Рандомізоване сліпе плацебо-контрольоване дослідження довело, що монотерапія габапентином у дозі 900–3600 мг/добу протягом 8 тижнів значно зменшувала больовий синдром і покращувала якість життя хворих на діабетичну полінейропатію порівняно з плацебо. В інших рандомізованих дослідженнях було показано однакову ефективність габапентину (900–2400 мг/добу) порівняно з амітриптиліном (25–90 мг/добу), однак переносимість габапентину була значно кращою, ніж амітриптиліну. Дослідження також виявили, що габапентин не тільки зменшує больовий синдром при діабетичній полінейропатії, але також покращує серцеву автономну функцію у хворих на цукровий діабет з ознаками кардіальної невропатії [21, 34].
Постгерпетична невралгія
Постгерпетична невралгія — хронічний больовий синдром у дерматомі ураженого нерва, що зберігається через 4–6 тижнів після перенесеного оперізуючого лишаю, викликаного вірусом герпесу (Varicella zoster), навіть після зникнення герпетичного висипання, у 10–15 % хворих може зберігатися протягом багатьох місяців і років [6, 18].
Основними механізмами, що лежать в основі постгерпетичної невралгії, є центральна та периферична сенситизація. Периферична сенситизація виникає внаслідок неврального пошкодження вірусом, запальним процесом і набряком, після чого збільшується чутливість больових рецепторів. Збільшена збудливість і постійна імпульсація сенсорних провідних шляхів у спинному мозку та супраспінальних структур, залучених у ноцицепцію, формують феномен, відомий як центральна сенситизація. Біохімічні основи цього процесу до кінця ще не визначені [18, 22].
Біль при постгерпетичній невралгії має гострий стріляючий характер і супроводжується відчуттям печії в ураженому дерматомі. У деяких хворих спостерігається алодинія [18, 22].
Габапентин виявився досить ефективним засобом у лікуванні симптомів постгерпетичної невралгії, оскільки здатний впливати на більшість механізмів її виникнення, включаючи сенситизацію, що було доказано в багатьох рандомізованих плацебо-контрольованих дослідженнях. Габапентин ефективно зменшує больовий синдром, покращує сон і якість життя хворих у дозі 1800–3600 мг/добу протягом 8 тижнів [21, 37]. У деяких дослідженнях було продемонстровано однакову ефективність габапентину в дозі 600 мг/добу порівняно з дозою 1200–2400 мг/добу[21]. Титрація дози повинна розпочинатися з 300–900 мг/добу з поступовим збільшенням до 3600 мг/добу щоденно або в триденний період залежно від переносимості препарату [6].
Отже, згідно з останніми рекомендаціями EFNS, габапентин поряд із прегабаліном і трициклічними антидепресантами є препаратом першої лінії в лікуванні постгерпетичної невралгії (рівень А) [9]. Габапентин також був дозволений Управлінням із контролю якості продуктів і ліків США (FDA) як засіб першої лінії в лікуванні постгерпетичної невралгії [18].
Невралгія трійчастого нерва
Невралгія трійчастого нерва (хвороба Фозергіля) — хронічне захворювання, що проявляється раптовим коротким колючим або прострілюючим болем у ділянці обличчя в межах іннервації гілок трійчастого нерва. Поширеність даної патології становить приблизно 1 на 25 000 чоловік. Міжнародне товариство головного болю поділяє невралгію трійчастого нерва на класичну і симптоматичну [27, 32].
Основною причиною невралгії, як вважають, є демієлінізація корінця трійчастого нерва в ділянці його виходу зі стовбура головного мозку. Це призводить до зміни експресії і напруження натрієвих каналів, що збільшує чутливість до больових подразників та сприяє генерації нервових імпульсів із розвитком картини невралгії. Іншою причиною невралгії трійчастого нерва може бути здавлювання трійчастого нерва судиною [27, 33].
Зазвичай біль у 97 % випадків є однобічним і виникає в межах іннервації 2-ї та 3-ї гілки трійчастого нерва, лише в 5 % випадків біль може локалізуватися в ділянці 1-ї гілки. Невралгія характеризується пароксизмами стріляючого болю за типом проходження електричного струму й може тривати до 2 хвилин. Пароксизм часто провокується чисткою зубів, голінням обличчя, вмиванням, прийманням їжі [33].
Оскільки причиною пароксизмів є збудження натрієвих каналів, препаратом вибору для лікування невралгії трійчастого нерва є карбамазепін (рівень А). Однак через незадовільну переносимість адекватних доз препарату, побічні ефекти, іноді відсутність ефекту часто використовують препарати другої лінії [9].
Габапентин рекомендують використовувати як засіб другої лінії в лікуванні невралгії трійчастого нерва поряд із ламотриджином і баклофеном [21]. Ефективна доза підбирається залежно від ефективності й переносимості препарату. Зазвичай розпочинають терапію з 300 мг на ніч у першу добу, 600 мг/добу наступного дня і 900 мг — на третю добу, розподілені на три прийоми. У подальшому доза може бути збільшена кожні 3 доби до 1800–3600 мг/добу залежно від ефективності й переносимості. Середня ефективна доза може становити 900 мг/добу, в деяких хворих ефективність відзначається після прийому значно менших доз. У хворих похилого віку, які більш чутливі до побічної дії габапентину, рекомендується збільшувати дозу на 300 мг щотижня, а починати лікування з дози 100 мг/добу. Серед побічних ефектів найбільш часто можуть спостерігатися сонливість, головокружіння, порушення координації, нудота. Однак вони зазвичай самостійно зникають протягом 10 днів від початку лікування [27, 33].
В одному з нещодавніх досліджень було показано більшу ефективність і значно кращу переносимість і безпечність габапентину в дозі 900 мг/добу порівняно з карбамазепіном у дозі 1200 мг/добу протягом 2 місяців у хворих на тригемінальну невралгію, що значно розширює можливості в лікуванні хворих на цю патологію [32].
Комплексний регіональний больовий синдром
Комплексний регіональний больовий синдром (КРБС), або синдром Зудека, — це больовий синдром, що виникає після травми кінцівки й супроводжується тривалими вазомоторними, трофічними порушеннями та остеопорозом [7].
Визначають два типи КРБС: І тип, раніше відомий як рефлекторна симпатична дистрофія, виникає без очевидного пошкодження нерва, ІІ тип, раніше відомий як каузалгія, виникає при фактичному пошкодженні нерва [7, 24].
У патогенезі КРБС важлива роль належить зміні активності симпатичної нервової системи або підвищенню чутливості периферичних тканин до впливу симпатичної нервової системи. Процеси дегенерації переважають над регенерацією, що призводить до розростання сполучної тканини, що додатково подразнює симпатичні нерви й тим самим створює порочне коло [7, 24].
Клінічно КРБС характеризується пекучим болем, сенсорними розладами (гіперпатією, алодинією), вазомоторними реакціями (зміна температури та кольору), набряком, моторно-трофічними змінами в кінцівці з розвитком остеопорозу. Больовий синдром має дифузний характер і не зв’язаний з певним дерматомом [7, 34].
У лікуванні КРБС використовують різні групи препаратів, однак для лікування саме невропатичного больового синдрому та сенсорних порушень при КРБС найкраще себе зарекомендував габапентин, який тривалий час ефективно використовується при цій патології. Рандомізовані плацебо-контрольовані дослідження показали ефективність габапентину в зменшенні больового синдрому при КРБС у дозі 900–2400 мг/добу протягом 2–6 місяців використання [24, 34]. Також при використанні габапентину у хворих із тяжким больовим синдромом зменшувалась потреба в наркотичних анальгетиках і використовувались значно менші їх дози [24].
Отже, згідно з рекомендаціями Міжнародної асоціації з вивчення болю (International Association for the Study of Pain) та Американської академії медицини болю (AAPM) габапентин є препаратом першої лінії при КРБС (рівень І) [7].
Невропатичний біль при інших патологіях
Монотерапія габапентином (300–1800 мг/добу) зменшувала невропатичний біль при полінейропатії, викликаній хіміотерапією у хворих на онкопатологію. У рандомізованому відкритому дослідженні комбінація габапентину з опіоїдними анальгетиками значно зменшувала больовий синдром у хворих на онкопатологію порівняно з хворими, які отримували лише опіоїдні анальгетики [21].
За останніми рекомендаціями EFNS, лише габапентин рекомендований для полегшення больового синдрому при полінейропатії у хворих на онкопатологію (рівень А) [9].
Габапентин виявився ефективним в лікуванні больової полінейропатії у хворих на СНІД у дозі 2000–3600 мг/добу [9, 34].
Останні настанови EFNS рекомендують габапентин як препарат першої лінії для лікування центрального невропатичного болю у хворих на множинний склероз, після перенесеного інсульту і при пошкодженні спинного мозку (рівень А) [9].
Рухові порушення
Есенційне тремтіння — прогресуюче захворювання нервової системи, що характеризується головним чином кінетичним тремором рук і може супроводжуватися іншими моторними проявами (атаксією, тремором спокою тощо) і немоторними симптомами (когнітивними й особистісними розладами). Есенційне тремтіння досить суттєво впливає на повсякденну якість життя, включаючи письмо та вживання їжі. Пропранолол і примідон — найбільш ефективні засоби симптоматичного лікування есенційного тремтіння, рекомендовані FDA та AAN (рівень А). Однак 30–50 % хворих не відповідають на лікування цими засобами та не можуть їх використовувати через їх побічні дії. Тому часто використовують альтернативні засоби. При неможливості використовувати пропранолол чи примідон AAN рекомендує використовувати габапентин у монотерапії, а також алпразолам, атенолол і топірамат як засоби, вірогідно ефективні при есенційному тремтінні (рівень В) [11].
Синдром неспокійних ніг — розлад, який характеризується неприємними відчуттями в нижніх кінцівках, що виникають у спокої (частіше в нічний час), спонукають хворого робити рухи ногами, які полегшують стан, що часто призводить до порушення сну. Нещодавно FDA схвалило препарат габапентин як засіб для лікування синдрому неспокійних ніг. Ефективність габапентину була протестована під час 12-тижневого клінічного дослідження, яке показало суттєве покращання стану хворих порівняно з плацебо [14].
Деменція
Поведінкові та психологічні симптоми часто спостерігаються у хворих на деменцію й призводять до погіршення повсякденної якості життя та труднощів у догляді за такими хворими. Нещодавнє дослідження показало ефективність габапентину в діапазоні доз 200–1200 мг/добу в лікуванні поведінкових і психологічних розладів у хворих на деменцію як у комбінації з нейролептиками, так і в монотерапії [36].
Радикулопатії
Біль у попереку є однією з найбільш поширених причин звернення по медичну допомогу, що значно погіршує працездатність та якість життя, а в деяких хворих може призводити до інвалідизації. Найбільш часто причинами болю в попереку є розвиток попереково-крижових радикулопатій, що виникають унаслідок дегенеративних змін у хребті, формування міжхребцевих гриж дисків з ураженням нервових корінців. Досить часто такі зміни призводять до розвитку хронічного больового синдрому в попереку невропатичного характеру, який може тривати місяцями й практично не піддаватися лікуванню звичайними анальгетиками та нестероїдними протизапальними засобами. Тому звичайно для більш ефективного лікування такого болю використовують антидепресанти й антиконвульсанти. Оскільки амітриптилін не завжди добре переноситься та має багато побічних дій, препаратами вибору стають антиконвульсанти, а саме габапентин і прегабалін, що показали свою ефективність у лікуванні хронічного болю в спині [8].
Так, використання габапентину (починаючи з 300 мг/добу й поступово збільшуючи дозу до 1200–1800 мг/добу у три прийоми) протягом 8 тижнів у хворих на хронічні попереково-крижові радикулопатії з ураженням L5-S1 корінців і тривалим больовим синдромом призводило до вірогідного (p < 0,001) зменшення болю в спокої, іррадіюючого болю в кінцівки, покращення якості життя, зменшення показників інвалідності та депресії як під час лікування, так і після [17].
В іншому рандомізованому плацебо-контрольованому дослідженні у хворих із радикулопатією L5-S1 корінців була показана ефективність габапентину в дозі 900–3600 мг/добу протягом 8 тижнів у лікуванні цієї патології порівняно з плацебо. У хворих, які приймали габапентин, значно зменшувався біль у спокої (p < 0,001), покращувалися моторна й сенсорна функція (p < 0,001), збільшувався обсяг активних рухів у попереку (p < 0,001), зменшувалися симптоми натягу (p < 0,001) [38].
Американське товариство болю (American Pain Society) та клінічні практичні рекомендації Американської колегії терапевтів (American College of Physicians) рекомендують також використання габапентину в лікуванні підгострого та хронічного болю в спині (рівень С) [8].
Мігрень
Мігрень — ідіопатичне захворювання, яке проявляється нападами переважно однобічного інтенсивного головного болю пульсуючого характеру, що посилюється при фізичному навантаженні та супроводжується вегетативними симптомами, такими як нудота, блювота, фотофобія й фонофобія [10].
При частоті нападів більше ніж 2 на місяць, які порушують якість життя й не знімаються антимігренозними засобами, рекомендовано профілактичне лікування. Антиконвульсанти використовуються в профілактичному лікуванні мігрені поряд з b-блокаторами й антидепресантами. За останніми рекомендаціями EFNS, вальпроєва кислота й топірамат є препаратами першого вибору для профілактики мігрені (рівень А). Як альтернатива з інших антиконвульсантів, при непереносимості чи неефективності топірамату чи вальпроєвої кислоти, рекомендовано використовувати лише габапентин у дозі 1200–1600 мг/добу протягом 3 місяців (рівень С). Інші антиконвульсанти були неефективними або не мають доказової бази для використання при мігрені [10].
Ністагм та осцилопсія
Мимовільні або патологічні рухи очей викликають надмірне переміщення зображення на сітківці без наступного відповідного розвантаження зорового входу, що призводить до нечіткого бачення й до ілюзії руху оточуючих предметів — осцилопсії. Це призводить до просторової дезорієнтації, порушення поступального балансу та запаморочення.
Ністагм визначається як повторні, ритмічні й такі, що змінють один одного за напрямком, мимовільні рухи очей, швидка фаза яких ініціюється повільним зміщенням очних яблук. Визначають фізіологічний і патологічний ністагм. Ністагм, як і осцилопсія, може виникати при різній патологій ЦНС, такій як мозочкові дегенерації, мальформація Арнольда — Кіарі, множинний склероз тощо. Габапентин — один із небагатьох засобів, у тому числі з антиконвульсантів (клоназепам, рідше карбамазепін), який здатен зменшувати прояви ністагму, направленого вниз, дисоційованого вертикального ністагму, набутого маятникоподібного ністагму, уродженого ністагму, а також при осциляціях і рекомендований EFNS для їх лікування в дозі до 2400 мг/добу [35].
Отже, габапентин показав себе ефективним і безпечним засобом для лікування різноманітної патології нервової системи з позиції доказової медицини. Деякою перешкодою для широкого використання засобу в Україні є його висока вартість. Тому поява на фармацевтичному ринку генеричного вітчизняного препарату габапентину — Медітан® компанії «Фармак», що відрізняється значно меншою ціною, має високу ефективність та оптимальне співвідношення якість/ціна, робить його доступним для хворих.
Терапевтична добова доза Медітану при більшості видів патології нервової системи становить 900–3600 мг/добу й може застосовуватися протягом декількох тижнів залежно від ефекту знеболювання та можливих побічних дій. Засіб використовують тричі на добу за такою схемою: 1-ша доба — 300 мг на ніч, 2–га — 300 мг двічі на добу, 3–тя доба — 300 мг тричі на добу. При епілепсії початкова добова доза може становити 900 мг/добу. У подальшому можливе збільшення дози на 300 мг кожні 3 доби до ефективної, тобто схема приблизно така: 1-й тиждень — 900 мг/добу, 2-й — 1800 мг/добу, 3-й — 2400 мг/добу, 4-й тиждень — 3600 мг/добу.
Вперше надруковано
в журналі «Практикуючий лікар», 2014, № 2
1. Маликова Л.А. Влияние леветирацетама на содержание медиаторных аминокислот в структурах мозга крыс при аудиогенном эпилептиформном припадке / Л.А. Маликова, И.Б. Федотова, П.М. Клодт // Психофармакол. и биол. наркол. — 2008. — Т. 8, № 3–4. — С. 2448–2452.
2. Кукушкин М.Л. Неврогенная (невропатическая) боль / М.Л. Кукушкин // Лекарственный вестник. — 2006. — № 6. — C. 61–64.
3. American Epilepsy Society Subcommittee of the American Academy of Neurology and the Technology Assessment Subcommittee and Quality Standards Treatment of new onset epilepsy: Report of the Therapeutics and Efficacy and tolerability of the new antiepileptic drugs I / J.A. French, A.M. Kanner, J. Bautista [et al.] // Neurology. — 2004. — Vol. 62. — P. 1252–1260.
4. American Epilepsy Society Subcommittee of the American Academy of Neurology and the Technology Assessment Subcommittee and Quality Standards Treatment of new onset epilepsy: Report of the Therapeutics and Efficacy and tolerability of the new antiepileptic drugs II / J.A. French, A.M. Kanner, J. Bautista [et al.] // Neurology. — 2004. — Vol. 62. — P. 1261–1273.
5. A Randomized Study of the Effects of Single-dose Gabapentin versus Placebo on Postoperative Pain and Morphine Consumption after Mastectomy / J. Dirks, B.B. Fredensborg, D. Christensen [et al.] // Anesthesiology. — 2002. — Vol. 97. — P. 560–564.
6. Coetzer R. Postherpetic neuralgia / R. Coetzer // S. Afr. Pharm. J. — 2011. — V. 78. — P. 36–39.
7. Complex Regional Pain Syndrome: Practical Diagnostic and Treatment Guidelines, 4th Edition / R.N. Harden, A.L. Oaklander, A.W. Burton [et al.] // Pain Medicine. — 2013. — P. 50.
8. Diagnosis and Treatment of Low Back Pain: A Joint Clinical Practice Guideline from the American College of Physicians and the American Pain Society / R. Chou, A. Qaseem, V. Snow [et al.] // Ann. Intern. Med. — 2007. — Vol. 147. — P. 478–491.
9. EFNS guidelines on the pharmacological treatment of neuropathic pain: 2010 revision / N. Attal, G. Cruccu, R. Baron [et al.] // European Journal of Neurology. — 2010. — Vol. 17. — P. 1113–1123.
10. EFNS guideline on the drug treatment of migraine — revised report of an EFNS task force / S. Evers, J. Afra, A. Frese [et al.] // European Journal of Neurology. — 2009. — Vol. 16. — P. 968–981.
11. Evidence-based guideline update: Treatment of essential tremor: Report of the Quality Standards Subcommittee of the American Academy of Neurology / T.A. Zesiewicz, R.J. Elble, E.D. Louis [et al.] // Neurology. — 2011. — Vol. 77. — P. 1752–1755.
12. Evidence-based guidelines for the pharmacological treatment of anxiety disorders: recommendations from the British Association for Psychopharmacology / D.S. Baldwin, I.M. Anderson, D.J. Nutt [et al.] // Psychopharm. Journal of Psychopharmacology. — 2005. — Vol. 19. — P. 567–596.
13. Evidence-based guideline: Treatment of painful diabetic neuropathy: Report of the American Academy of Neurology, the American Association of Neuromuscular and Electrodiagnostic Medicine, and the American Academy of Physical Medicine and Rehabilitation / V. Bril, J. England, G.M. Franklin [et al.] // Neurology. — 2011. — Vol. 76. — P. 1758–1765.
14. FDA approves Horizant to treat restless legs syndrome / FDA NEWS, 07.04.2011 // http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ ucm250188.htm.
15. Gabapentin premedication: assessment of preoperative anxiolysis and postoperative patient satisfaction / M. Tirault, L. Foucan, B. Debaene [et al.] // Acta Anaesth. Belg. — 2010. — Vol. 61. — P. 203–209.
16. Gabapentin Does Not Reduce Preoperative Anxiety When Given Prior to Total Hip Arthroplasty / H. Clarke, J. Kay, B.A. Orser [et al.] // Pain Medicine. — 2010. — Vol. 11. — P. 966–971.
17. Gabapentin monotherapy in patients with chronic radiculopathy: the efficacy and impact on life quality / K. Yildirim, O. Deniz, G. Gureser [et al.] // J. Back Musculoskelet Rehabil. — 2009. — Vol. 22. — P. 17–20.
18. Gharibo C. Neuropathic pain of postherpetic neuralgia / C. Gharibo, C. Kim // Pain medicine news. — 2011. — №. 12. — P. 84–92.
19. Gamma-Aminobutyric Acid (GABA) // Alternative Medicine Review. — 2007. — Vol. 12. — P. 274–279.
20. Honarmand A. Gabapentin: An update of its pharmacological properties and therapeutic use in epilepsy / A. Honarmand, M. Safavi, M. Zare // J. Res. Med. Sci. — 2011. — Vol. 16. — P. 1062–1069.
21. Implications and mechanism of action of gabapentin in neuropathic pain / A. Kukkar, A. Bali, N. Singh, A.S. Jaggi // Arch. Pharm. Res. — 2013. — Vol. 36. — P. 237–251.
22. Koch K. Postherpetic neuralgia in everyday practice / K. Koch // S. Afr. Fam. Pract. — 2012. — Vol. 54. — P. 487–490.
23. McCleane G. Does gabapentin have an analgesic effect on background, movement and referred pain? A randomised, double-blind, placebo controlled study / G. McCleane // The Pain Clinic. — 2001. — Vol. 13. — P. 103–107.
24. Mackey S. Pharmacologic Therapies for Complex Regional Pain Syndrome / S. Mackey, S. Feinberg // Curr. Pain Headache Rep. — 2007. — Vol. 11. — P. 38–43.
25. MacEwan A. Gabapentin / A. MacEwan, G. McKay, M. Fisher // Pract. Diab. Int. — 2009. — Vol. 26. — P. 206–207.
26. McLean M.J. Gabapentin dosing in the treatment of epilepsy / M.J. McLean, B.E. Gidal // Clin. Ther. — 2003. — Vol. 25. — P. 1382–406.
27. Melvin G. Drug therapy for trigeminal neuralgia / G. Melvin, S. Sandhiya, C. Indumathi // Journal of Dentistry. — 2001. — Vol. 1, Issue 2. — P. 28–31.
28. National Institute for Health and Care Excellence (NICE) Neuropathic pain — pharmacological management: the pharmacological management of neuropathic pain in adults in non-specialist settings. Qinical guideline 173. — London, UK: NICE, 2013. — Р. 41.
29. Pathak L. Effect of gabapentin premedication on preoperative anxiety and postoperative pain / L. Pathak, A. Chaturvedi // Health Renaissance. — 2013. — Vol. 11. — P. 254–259.
30. Practice Guidelines for Chronic Pain Management. An Updated Report by the American Society of Anesthesiologists Task Force on Chronic Pain Management and the American Society of Regional Anesthesia and Pain Medicine // Anesthesiology. — 2010. — Vol. 112. — P. 1–24.
31. Protective effect of gabapentin on N-methyl-D-aspartate-induced excitotoxicity in rat hippocampal CA1 neurons / Y.S. Kim, H.K. Chang, J.W. Lee [et al.] // J. Pharmacol. Sci. — 2009. — Vol. 109. — P. 144–147.
32. Qazi J.A. Gabapentin for the treatment of trigeminal neura–lgia / J.A. Qazi, W.-U.-R. Qureshi, A.H. Qaz // Pakistan Oral & Dental Journal. — 2012. — Vol. 32, № 2. — Р. 218–221.
33. Recommendations for the Management of Idiopathic Trigeminal Neuralgia / C.P. Ping, J.W.Y. Ip, J.M.K. Lam [et al.] // Medical Progress. — 2003. — Vol. 30. — P. 13–20.
34. Rose M.A. Gabapentin: pharmacology end its use in pain management / M.A. Rose, C.A. Kam // Anaesthesia. — 2002. — Vol. 57. — P. 451–462.
35. Straube A. Nystagmus and oscillopsia / A. Straube, A. Bronstein, D. Straumann // European Handbook of Neurological Management / Edited by N.E. Gilhus, M.P. Barnes and M. Brainin. — Blackwell Publishing Ltd. — 2011. — Vol. 1, 2nd Edition. — P. 459–468.
36. Tampi R.R. Gabapentin for the treatment of behavioral and psychological symptoms of dementia / R.R. Tampi, B. Ozkan, D. Williamson // Advances in Alzheimer’s Disease. — 2012. — Vol. 1. — P. 13–16.
37. The Canadian Network for Mood and Anxiety Treatments (CANMAT) task force recommendations for the management of patients with mood disorders and comorbid anxiety disorders / A. Schaffer, D. McIntosh, B.I. Goldstein [et al.] // Annals of Clinical Psychiatry. — 2012. — Vol. 24. — P. 6–22.
38. The effectiveness of gabapentin in patients with chronic radiculopathy / K. Yildirim, M. Sisecioglu, S. Karatay [et al.] // The Pain Clinic. — 2003. — Vol. 15. — P. 213–218.
39. Updated ILAE evidence review of antiepileptic drug efficacy and effectiveness as initial monotherapy for epileptic seizures and syndromes / T. Glauser, E. Ben–Menachem, B. Bourgeois [et al.] // Epilepsia. — 2013. — Vol. 54. — P. 551–563.
40. World Federation of Societies of Biological Psychiatry (WFSBP) guidelines for the pharmacological treatment of anxiety, obsessive-compulsive and post-traumatic stress disorders — first revision / B. Bandelow, J. Zohar, E. Hollander, S. Kasper, H.J. Moller, WFSBP Task Force on Treatment Guidelines for Anxiety O–CaP–TSD // World J. Biol. Psychiatry. — 2008. — Vol. 9. — P. 248–312.

/124/124.jpg)