Международный неврологический журнал 5 (67) 2014
Вернуться к номеру
Лечение невропатической боли при радикулопатии (научный обзор и личные наблюдения)
Авторы: Свиридова Н.К., Баринов А.Н., Махинов К.А. - Национальная медицинская академия им. П.Л. Шупика, г. Киев, Украина; Первый Московский государственный медицинский университет им. И.М. Сеченова, Россия
Рубрики: Неврология
Разделы: Справочник специалиста
Версия для печати
В научном обзоре освещаются вопросы этиологии и патогенеза, диагностики, консервативного и хирургического лечения дискогенных радикулопатий. Представлен обзор препаратов, воздействующих на патофизиологические механизмы боли при корешковом синдроме.
У науковому огляді детально висвітлюються питання етіології, патогенезу, діагностики, консервативного і хірургічного лікування дискогенних радикулопатій. Наведений огляд препаратів, що впливають на патофізіологічні механізми болю при корінцевому синдромі.
The scientific review deals with the issues of etiology and pathogenesis, diagnosis, conservative and surgical treatment of discogenic radiculopathy. There is provided an overview of drugs that have an effect on the pathophysiological mechanisms of pain in radicular syndrome.
радикулопатии, грыжа межпозвоночного диска, габапентин.
радикулопатії, грижа міжхребцевого диска, габапентин.
radiculopathy, herniated disc, gabapentin.
Статья опубликована на с. 148-156
Корешковый синдром, или радикулопатия (устаревшее название — радикулит, радикулоишемия), — это симптомокомплекс, возникающий в результате сдавления или раздражения спинномозговых корешков, включающий в себя болевой синдром в позвоночнике и/или в конечности (реже в туловище и внутренних органах), симптомы натяжения и дефицитарную неврологическую симптоматику в соответствующем пораженному корешку дерматоме и/или миотоме. Помимо радикулопатии, боль в спине и конечности может возникать при многочисленных миофасциальных синдромах, дисфункции фасеточных и крестцово-подвздошных суставов, а также при тоннельных невропатиях.
Для определения тактики лечения решающее значение имеет правильная диагностика причины боли у пациента. Диагнозы «радикулопатия» (М54.1) и «ишиас» (М54.3) имеют разные этиопатогенетические механизмы возникновения заболевания: в первом случае — грыжу межпозвоночного диска, вызывающую диско-радикулярный конфликт, во втором — тоннельную невропатию седалищного нерва, обусловленную спазмом грушевидной мышцы. Соответственно, в лечении радикулопатии может быть целесообразно применение оперативных методов декомпрессии корешка путем дискэктомии, в то время как лечение ишиаса значительно реже требует хирургического вмешательства (невролиз, спайкотомия) и проводится на более дистальном уровне и совершенно другим методом.
В настоящее время, по данным ряда авторов, наблюдается избыточная и необоснованная хирургическая активность в лечении болей в спине. Оптимизм нейрохирургов, основанный на клинической практике быстрого и эффективного обезболивания в результате хирургического вмешательства, приводит к широкому использованию относительных показаний к проведению оперативного лечения боли в спине, среди которых основным является длительный или рецидивирующий болевой синдром, а не наличие неврологического дефицита вследствие компрессии корешка нерва. Абсолютными показаниями к проведению оперативного лечения радикулопатии являются прогрессирующий парез иннервируемых пораженным корешком мышц конечности и тазовые нарушения, что встречается не более чем у 1 % больных.
Гипердиагностика показаний к оперативному лечению дискогенных радикулопатий в США приводит к полумиллиону дискэктомий ежегодно, что составляет 1 операцию на 600 жителей Северной Америки в год, то есть в среднем каждый десятый гражданин США в течение жизни переносит дискэктомию, но при этом в 20 % случаев болевой синдром у оперированных пациентов сохраняется или усиливается, несмотря на устранение анатомического дефекта [17, 18]. В экономически менее развитых странах показатели хирургической активности в среднем на душу населения значительно ниже [19], но при этом частота неэффективных дискэктомий, по оценкам разных авторов, выше и достигает 47 % [1]. Рецидив боли после анатомически успешной дискэктомии обозначается термином «синдром неудачно оперированного позвоночника» (FBSS — failed back surgery syndrome) или «постдискэктомический синдром» и крайне плохо поддается лечению, обрекая большинство больных на пожизненный прием анальгетиков (в том числе и наркотических) в постоянно возрастающих дозах.
Отдаленные результаты хирургического лечения межпозвоночных грыж значительно уступают ближайшим [20]. А через 2 года после операции число и длительность госпитализаций не отличаются от дооперационных. По мере увеличения времени, прошедшего после оперативного вмешательства, число обострений в год приближается к дооперационному. С плохим результатом оперативного вмешательства ассоциировано наличие у пациентов невропатической боли, тревожно-депрессивных расстройств. Целесообразность дискэктомии становится весьма сомнительной в тех случаях, когда болевой синдром не связан с диско-радикулярным конфликтом.
Бессимптомные грыжи межпозвоночных дисков встречаются во много раз чаще межпозвоночных грыж, вызывающих боль в спине, а точнее — в спине и конечности (радикулопатию) [2, 7, 9, 21, 22]. И размер здесь также не имеет значения! Главными определяющими факторами, обусловливающими наличие и характер болевого синдрома, являются:
— направление, в котором пролабирует грыжа (рис. 1);
/149/149.jpg)
— выраженность аутоиммунной воспалительной реакции организма в ответ на компоненты пульпозного ядра, пролабировавшие через дефект фиброзного кольца.
Если грыжа направлена в тело позвонка (грыжа Шморля) или в центр позвоночного канала (центральная грыжа), то диско-радикулярный конфликт не возникнет. Боли в спине у таких пациентов будут, скорее всего, связаны со снижением высоты межпозвоночного диска, ухудшением его амортизирующей функции и перераспределением нагрузки на фасеточные суставы пораженного позвоночного двигательного сегмента, что приводит к прогрессированию остеоартроза из-за функциональной перегрузки и деформации сустава с рефлекторными мышечно-тоническими синдромами [1, 7, 8]. Таким образом, пациенты, имеющие центральные грыжи межпозвоночных дисков, или грыжи Шморля, чаще всего либо бессимптомны, либо страдают неспецифической болью в спине, обусловленной фасеточным синдромом. Только латеральные и фораминальные грыжи, вызывающие диско-радикулярный конфликт, обусловленный механическим повреждением корешка нерва и/или вторичным асептическим и дисиммунным воспалением, по-настоящему опасны в плане развития радикулопатии [8, 9, 12]. Заподозрить такую грыжу можно, если боль из спины распространяется в руку или ногу и сопровождается слабостью и чувствительными расстройствами в конечности, симптомами натяжения корешка. Но и такая грыжа не является абсолютным показанием к дискэктомии. Современные медицинские технологии позволяют проводить лечение таких состояний локальным введением анестетиков с глюкокортикоидами или нестероидными противовоспалительными препаратами (НПВП) в зону диско-радикулярного конфликта путем трансфораминальных или эпидуральных блокад или (при недостаточной по времени эффективности блокад) малоинвазивными методами — лазерной вапоризацией, холодноплазменной абляцией, которые будут описаны ниже. При консервативной терапии радикулопатий наблюдается типичная ситуация: через несколько дней или недель на фоне лечения (или даже без оного) боль исчезает, при этом грыжа остается прежних размеров и на прежнем месте. Возможность регресса корешковой боли при сохранности анатомического дефекта межпозвоночного диска (грыжи) может свидетельствовать против необходимости хирургического устранения данного дефекта (дискэктомии). Проспективные наблюдения за пациентами с компрессионной радикулопатией показывают достоверное уменьшение грыж и секвестраций дисков (в 75–100 % случаев) и компрессии неврального содержимого (21–80 %) через 14 месяцев даже при отсутствии терапии [5, 8, 9, 23].
Наиболее полно хирургические и консервативные методы лечения радикулопатии сопоставлялись в исследовании SPORT (Spine Patient Outcomes Research Trial) [20]. Это многоцентровое рандомизированное клиническое исследование, сравнивающее исходы хирургической и консервативной тактики лечения радикулопатии (N = 501), и наблюдательное исследование пациентов, отказавшихся от рандомизации и выбравших либо дискэктомию, либо продолжение консервативного лечения (N = 743). В исследование SPORT были включены пациенты с подтвержденными на МРТ или КТ грыжами межпозвоночных дисков с соответствующей дефицитарной корешковой симптоматикой, включая боли в ноге. До момента регистрации пациенты испытывали корешковые боли не менее 6 недель. Около 20–25 % из зарегистрированных пациентов имели повторные эпизоды радикулита в течение полугода и более. Кандидатам на хирургическое лечение предлагалось зачисление либо в рандомизированную группу, либо в группу наблюдения. Пациенты, которые вошли в рандомизированное клиническое исследование, не имели каких-то предпочтений в выборе лечения, и 50 % из них предпочли провести операцию через 3 месяца. Операционная группа показала менее 5 % осложнений, которые в целом были незначительными. Тем не менее в обеих группах в исследовании SPORT были отмечены значимые клинические улучшения, более выраженные в хирургической группе. Различия между группами оперативного и консервативного лечения уменьшились с течением времени: после 1 и 2 лет рандомизированное исследование не выявило существенных различий в результатах между этими группами, в то время как в наблюдательной когорте было зарегистрировано статистически значимое различие в улучшении у пациентов, которые перенесли операцию, и через 2 года. Таким образом, у пациентов, оперированных в рандомизационном порядке, мнение которых не учитывалось при выборе тактики терапии, различия между группами хирургического и консервативного лечения практически нивелировались через 2 года, хотя пациенты, перенесшие операцию, продолжали сообщать о меньшем уровне боли и лучшем функциональном состоянии. А в исследуемой группе, независимо от полученного вмешательства, большинство пациентов были удовлетворены лечением и высоко оценили результаты терапии. Изучение результатов SPORT показало позитивное влияние принятия пациентом собственного решения по лечебной тактике [20].
/152/152.jpg)
Если основным преимуществом хирургического подхода является более быстрое уменьшение или прекращение боли, то часто решение о проведении операции может зависеть от того, насколько плохо чувствует себя пациент и как быстро он желает избавиться от боли. Кроме того, выбор операции может больше зависеть от финансовой и психологической ситуации, чем от хирургических показаний и сопутствующих заболеваний. Вынужденное ограничение функциональной активности для уменьшения болей при радикулопатии может повлиять на решение пациента о проведении операции. Также надо учитывать финансовые возможности для оплаты операции и потенциал поддержания занятости: консервативное лечение может задержать восстановление, что может снизить возможность заботиться о семье, зарабатывать на жизнь или выдерживать конкуренцию на работе. Медленное выздоровление — в течение 1–2 лет — может быть пагубным для социально-экономического положения пациента, его семьи и привести к потере рабочего места — для таких пациентов хирургический вариант может оказаться предпочтительным, несмотря на риски осложнений. Современные нейрохирургические методы лечения радикулопатии характеризуются небольшими разрезами, минимальной кровопотерей; послеоперационное восстановление длится несколько недель по сравнению с несколькими месяцами при открытых операциях. Однако показано, что техника выполнения декомпрессии (открытая операция или микродискэктомия) не влияет на исход оперативного вмешательства [11].
Многие пациенты в исследовании SPORT отмечали улучшение в течение разумного периода времени без хирургического вмешательства, поэтому не имеет смысла настаивать на операции, предпочтительнее предоставить выбор пациенту. Данные SPORT подтвердили низкий риск серьезных осложнений (усугубление пареза, развитие синдрома конского хвоста или прогрессирование нестабильности позвоночника) при получении консервативной помощи.
В консервативной терапии острой радикулопатии имеется необходимость максимально быстро избавить пациента от мучительных болей во избежание хронификации заболевания, вызванной сенситизацией периферической и центральной нервной системы, «бомбардируемой» болевыми импульсами от воспаленных мышц, связок, фасеточных суставов и других структур позвоночника. Это достигается применением препаратов для симптоматического и патогенетического лечения боли (прежде всего нестероидных противовоспалительных препаратов и антиконвульсантов) [2, 4, 6]. Для профилактики хронификации острой радикулопатии необходимо как можно раньше начать обезболивающую терапию и ограничить нагрузку на пораженный отдел позвоночника путем фиксации специальными ортопедическими пособиями (корсетом, реклинатором, воротником Шанца — в зависимости от пораженного отдела). Микротравмы в процессе реабилитации способны вызвать кинезиофобию (страх движения), а также ускорить процессы хронификации, растормаживая (сенситизируя) потоком афферентной болевой информации соответствующие отделы спинного и головного мозга. При радикулопатии нет необходимости в соблюдении строгого постельного режима даже в первые дни заболевания, а также в использовании опоры при передвижении (трости или костыля). Необходимо убедить пациента, что небольшая физическая нагрузка не опасна, посоветовать поддерживать повседневную активность, а после купирования острого болевого синдрома как можно скорее приступить к работе, не забывая при этом о лечебной физкультуре, необходимой для предотвращения последующих эпизодов болей в спине [2, 4–8]. В связи с этим современный подход к лечению корешкового синдрома подразумевает максимально раннее назначение препаратов, воздействующих в первую очередь на патофизиологические механизмы боли.
Для симптоматической терапии невропатического болевого синдрома при радикулопатиях применяются антиконвульсанты, которые эффективно успокаивают расторможенные ноцицептивные структуры головного и спинного мозга, подавляя периферическую и центральную сенситизацию, являющуюся основным патогенетическим механизмом формирования невропатической боли при поражении корешка. Блокируя натриевые каналы на мембранах нервных волокон, противосудорожные (карбамазепин, ламотриджин) и антиаритмические (мексилетин) препараты снижают возбудимость нейронов ноцицептивных структур. Это приводит к тому, что болевая импульсация перестает генерироваться ядрами задних рогов спинного мозга и волокнами черепно-мозговых нервов (тройничного, языкоглоточного и др.). В большей степени регрессу подвергаются пароксизмальные стреляющие боли, парестезии и гипералгезии. Причем более выраженный анальгетический эффект наблюдается при лечении краниальных невралгий, чем болей в нижней части тела. Однако выраженный седативный эффект, головокружение и атаксия, возникающие вследствие неселективности подавления активности натриевых каналов (изменяется функциональная активность структур головного мозга, не вовлеченных в процессы патологической алгогенной гипервозбудимости) на фоне приема антиконвульсантов, могут настолько снижать качество жизни пациентов в первые дни лечения, что они нередко вынуждены отказываться от него. И хотя в течение недели эти побочные явления значительно ослабевают или полностью регрессируют, терапия блокаторами натриевых каналов (карбамазепином, окскарбазепином) не всегда возможна. Значительно лучший профиль переносимости отмечен у габапентина, который является жирорастворимой аминокислотой, по химическому строению схожей с тормозным медиатором гамма–аминомасляной кислотой (ГАМК) — нейротрансмиттером, участвующим в модуляции (подавлении передачи) боли. В основе развития различных видов спонтанной и стимулзависимой боли лежат механизмы, связанные с нарушением процессов торможения нервного импульса на уровне заднего рога, то есть сенситизация структур ноцицептивной системы. Именно эти процессы и являются мишенью для патогенетического воздействия габапентина, который не только значимо уменьшает выраженность болевого синдрома, но и не снижает качество жизни больных, так как частота побочных эффектов минимальна. Габапентин обладает рядом биохимических свойств, позволяющих воздействовать на патогенез невропатического болевого синдрома:
1. Взаимодействие с альфа-2- и дельта-2- субъединицами потенциалзависимых Са2+-каналов и торможение входа ионов Са2+ в нейроны — таким образом снижается гипервозбудимость клеточных мембран, уменьшается сенситизация ноцицептивных нейронов.
2. Увеличивается синтез гамма-аминомасляной кислоты (тормозного нейромедиатора), что стимулирует активность глутаматдекарбоксилазы — это приводит к повышению активности антиноцицептивной системы.
3. Ингибирование синтеза глутамата (возбуждающего нейромедиатора, обладающего к тому же эксайтотоксичностью) ведет к снижению возбудимости структур ноцицептивной системы и предотвращению гибели нейронов
4. Модуляция активности NMDA-рецепторов воздействует на процессы формирования «болевой памяти».
Предполагается, что центральный анальгетический эффект габапентина развивается вследствие взаимодействия со специфическими альфа-2-дельта-2-кальциевыми каналами, что приводит к снижению потенциала действия мембран аксонов. Кроме того, габапентин повышает концентрацию ГАМК в нейрональной цитоплазме и увеличивает содержание серотонина в плазме крови. Показан анальгетический эффект габапентина (Габагаммы) в лечении корешковой невропатической боли. При этом частота возникновения и выраженность побочных эффектов, характерных для антиконвульсантов (тошнота, головокружение, сонливость, тремор, нистагм, сухость во рту), значительно ниже, чем у других препаратов этой группы. Неоспоримым преимуществом Габагаммы перед остальными габапентиноидами является гибкая линейка дозировок: наличие промежуточной дозировки 400 мг позволяет осуществлять более индивидуализированный подбор терапии в зависимости от клинических особенностей пациента и его болевого синдрома. Начальная рекомендованная доза габапентина составляет 300 мг в 1-й день, 600 мг (в 2 приема) во 2-й день и 900 мг (в 3 приема) в 3-й день, дальнейшее увеличение суточной дозы осуществляется последовательным прибавлением 300 мг до достижения оптимальной дозы 1800 мг/сут. Для максимального эффекта возможно дальнейшее увеличение суточной дозы до 2400 мг при нормальной переносимости начиная с 15-го дня применения и до 3600 мг — начиная с 21-го дня. Однако, по нашим наблюдениям, крупным (выше среднего роста и/или страдающим ожирением) пациентам лучше начинать прием Габагаммы с 400 мг, прибавляя соответственно по 400 мг в сутки, достигая в первую неделю титрования дозы 1200 мг/сут и при недостаточной эффективности терапии в первую неделю приема — 2400 мг/сут во вторую и 3600 мг/сут в третью неделю приема Габагаммы. Это позволяет быстрее достичь максимально эффективной суточной дозы препарата, не теряя комплайенса больного и не вызывая выраженных побочных эффектов. При ночной экзацербации (усилении) болевого синдрома (даже для пациентов обычного телосложения) более эффективна схема назначения 400 мг Габагаммы вечером, 300 мг утром и 300 мг днем во избежание дневной сонливости. Далее возможно повышение дозировок до 2000 мг/сут во вторую неделю приема и 3000 мг/сут — в третью. Габагамма хорошо переносится вплоть до максимальной дозы 3600 мг в сутки как пожилыми пациентами, так и пациентами, принимающими другие анальгетики. Однако, по нашим наблюдениям, большинству пациентов с невропатической болью при радикулопатиях бывает достаточно 900 или 1000 мг (при ночной экзацербации (усилении) боли) в сутки [4].
Ключевым направлением в патогенетическом лечении радикулопатии является применение НПВП, блокирующих выработку медиаторов воспаления — простагландинов за счет ингибирования фермента циклооксигеназы (ЦОГ). Многочисленные исследования свидетельствуют, что генетический полиморфизм является одним из важнейших факторов, которые влияют на эффективность и безопасность НПВП-терапии. Современная фармакология накопила большое количество новых данных по фармакогенетике НПВП, которые значительно расширяют устоявшиеся представления и углубляют наше понимание проблемы рефрактерности боли в спине к НПВП-терапии. Генетический полиморфизм пациента может обусловливать широкий спектр изменчивости фармакодинамического и фармакокинетического профиля лекарств, что непременно будет влиять на эффективнисть и безопасность их применения. Следует отметить, что НПВП не рекомендуются для монотерапии более 10–14 дней. Если недельный курс приема препарата не купирует болевой синдром, то это должно побудить врача пересмотреть тактику лечения и выяснить причины неэффективности НПВП в каждом конкретном случае [2, 5, 7]. А причин такой неэффективности может быть несколько: плохое кровоснабжение в очаге воспаления (тогда противовоспалительный препарат можно ввести адресно прямо в эпицентр боли и воспаления путем блокады с местными анестетиками (рис. 2, 3) под компьютерно-томографическим, ультразвуковым или рентгеноскопическим контролем) или стойкий спазм паравертебральных мышц с формированием порочного круга «боль — спазм — боль» [3]. Для воздействия на патогенетические механизмы хронификации боли (прежде всего на мышечный спазм) на втором этапе лечения используют миорелаксанты (баклофен 10–30 мг/сут, ноофен 500–1500 мг/сут, тизанидин 6–12 мг/сут, толперизон 150–450 мг/сут). Основным механизмом действия вышеперечисленных препаратов является торможение возбуждения двигательного нейрона в ответ на болевые стимулы и эмоциональный дискомфорт. Альфа-2-адреномиметик тизанидин нормализует повышенный мышечный тонус, блокируя выделение возбуждающего нейротрансмиттера глутамата в двигательных нейронах переднего рога спинного мозга, а также активирует нисходящие антиноцицептивные влияния голубого пятна ствола мозга. Блокатор натриевых каналов толперизон подавляет ретикулоспинальные растормаживающие воздействия на гамма-мотонейроны, регулирующие тонус мышц. Активаторы рецепторов гамма-аминомасляной кислоты ГАМК-Б опосредованно воздействуют на кальциевые каналы двигательных и чувствительных нейронов спинного мозга, подавляя медленные постсинаптические потенциалы, суммирующиеся в болевые импульсы и повышение тонуса мышц, а также уменьшают возбудимость нейронов лимбической системы и, соответственно, тревожность пациентов. Таким образом, миорелаксанты оказывают обезболивающее действие, помогая расторможенным отделам нервной системы вернуться в состояние покоя, то есть стирая «болевую память». Это не только уменьшает выраженность боли при хроническом болевом синдроме, но и предотвращает усиление острой боли и переход ее в хроническую форму [2, 3]. При назначении ГАМК-Б-миметиков необходимо учитывать возможные побочные явления: сонливость, нарушение концентрации внимания при приеме баклофена ограничивают способность больных к вождению автотранспорта. При необходимости сохранения высокой физической и интеллектуальной активности в период лечения целесообразно назначение препаратов гамма-амино-бета-фенилмасляной кислоты, однако высокая кислотность действующего вещества может усугублять диспептические явления, особенно при НПВП-индуцированной гастропатии. В связи с этим большей безопасностью в отношении желудочно-кишечного тракта по сравнению с фенибутом обладает ноофен, представляющий собой таблетки, покрытые кишечнорастворимой оболочкой.
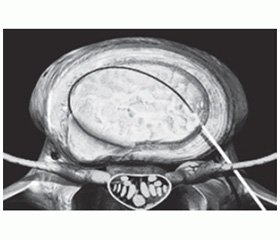
Дополнительным и наиболее эффективным малоинвазивным методом терапии радикулопатии на любом этапе лечения оказывается локальное инъекционное введение лекарственного препарата (блокада), обладающего противоотечным и противовоспалительным действием, в зону диско-радикулярного конфликта [2, 7, 10–13]. Такой способ введения при радикулопатиях применяется для местных анестетиков, а также НПВП и глюкокортикоидов эпидурально и трансфораминально (рис. 2).
Однако проведение блокад требует наличия специальных навыков у врача, осуществляющего эту процедуру, а в ряде случаев — высокотехнологичной аппаратуры, обеспечивающей правильное попадание иглы в пораженную область, — компьютерного томографа (рис. 3), рентгенографической установки с электронно-оптическим преобразователем или ультразвукового сканера. Поэтому методика блокад пока еще не распространена повсеместно, хотя и используется в медицине более ста лет — с 1906 года, когда Хьюго Селлхайм впервые применил паравертебральную блокаду межреберного нерва, вводя раствор новокаина, синтезированного Эйнхорном двумя годами ранее. В 1912 году эта блокада была модифицирована Капписом для шейного отдела.
/153/153.jpg)
По своему назначению блокады подразделяются на диагностические, прогностические и лечебные. С помощью диагностических блокад осуществляется уточнение диагноза ex juvantibus. Цель прогностической блокады — обозначить границы эффективности лечения и дать временно почувствовать пациенту, что он будет испытывать после высокочастотной денервации сустава или деструкции нерва и сможет ли он переносить чувствительные и вегетативные нарушения, возникшие в результате данного воздействия [11].
При проведении лечебных блокад используется большой арсенал медикаментозных средств, что, с одной стороны, определяется фармакодинамикой и механизмом их действия, с другой — этиопатогенетическими особенностями развития болевого синдрома.
К числу препаратов, использующихся при лечебных блокадах, относятся гормональные средства (глюкокортикоиды), применение которых основано на их противовоспалительном, десенсибилизирующем и противоотечном действии как локально в тканях, так и системно в организме [2, 10, 13]. В клинической практике необходимо учитывать и возможное системное действие гормонов. Именно из-за системного действия глюкокортикоиды необходимо с осторожностью применять у пожилых пациентов, больных сахарным диабетом, гипертонической болезнью, заболеваниями ЖКТ, сердечной недостаточностью, со сниженным иммунным статусом и при инфекционных заболеваниях. Поэтому в начале локальной инъекционной терапии радикулопатии у пожилых больных целесообразно применение растворов короткодействующих глюкокортикоидов (дексаметазона) для оценки не только эффективности, но и безопасности этого вида лечения, а при отсутствии значимых побочных явлений (неконтролируемая гипергликемия и/или артериальная гипертензия, сердечная недостаточность, дисменорея и т.п.) и в случае недостаточной эффективности препаратов короткого действия рекомендуется применение микрокристаллических суспензий глюкокортикоидов. Наибольшую эффективность и длительность действия доказал пролонгированный инъекционный двухкомпонентный глюкокортикоидный препарат дипроспан. Входящая в состав препарата быстрорастворимая соль бетаметазона натрия фосфат (2 мг) обеспечивает быстрое начало действия дипроспана — через 20–40 мин после введения, а микрокристаллическая депо-фракция бетаметазона дипропионат (5 мг) обеспечивает длительный противовоспалительный эффект дипроспана в месте блокады — продолжительностью не менее 4 недель.
Альтернативными дополнительными препаратами, лишенными побочных эффектов глюкокортикоидов, являются НПВП. Они применяются преимущественно для инфильтраций (блокад) триггерных зон мышц при миофасциальных синдромах и для параартикулярных блокад при фасеточном синдроме. Применение мелоксикама для локальной инъекционной терапии (лечебных блокад) при радикулопатии [7, 16] отличается высоким профилем безопасности. Для лечебных блокад используется раствор 15 мг (1,5 мл) мелоксикама и 1 мл местного анестетика (0,5% новокаина или 1% лидокаина). Если вводить интрафораминально большой объем раствора анестетика, то получается обратный эффект: раствор распространяется в обратном направлении по ходу иглы и концентрация действующего вещества (НПВП или глюкокортикоида) в зоне диско-радикулярного конфликта оказывается минимальной (рис. 3б).
Помимо лечебных целей, в ряде случаев проведение блокад необходимо для диагностики и определения оптимальной стратегии последующего лечения. Так определяется прогноз эффективности внутридисковой электротермической аннулопластики (рис. 4), лазерной вапоризации или холодноплазменной абляции межпозвоночного диска при радикулопатии. Если интрафораминальное введение анестетика под контролем компьютерной томографии устраняет болевой синдром, то проведение вышеуказанных малоинвазивных пункционных нейрохирургических воздействий может быть эффективным [9, 10, 12]. Понятно, что без НПВП и/или глюкокортикоида длительность обезболивающего действия анестетика составит всего лишь несколько часов, но в случае исчезновения у пациента после блокады болевого синдрома хотя бы на час мы можем уверенно говорить о том, что процедура денервации будет эффективна. В этом случае блокаду можно рассматривать как прогностическую. Следует отметить, что в ряде случаев достаточный терапевтический эффект имеет интрафораминальное введение вместе с местным анестетиком раствора глюкокортикоида (дипроспана), обеспечивающего патогенетическое воздействие на аутоиммунные и компрессионно-ишемические механизмы диско-радикулярного конфликта (противовоспалительное, противоотечное и ремиелинизирующее действие). Обычно фораминальной блокады бывает достаточно для того, чтобы уменьшить выраженность болевых ощущений и чувствительных (а иногда и двигательных) расстройств до следующего обострения радикулопатии. В случае недостаточной по времени эффективности лечебных фораминальных блокад и при условии наличия несеквестрированной латеральной (фораминальной) грыжи диска менее 7 мм проводится малоинвазивная процедура лазерной вапоризации (или ее модификация — фораминопластика), холодноплазменной абляции или внутридисковой электротермической аннулопластики (рис. 4), которая эффективна у 50–65 % пациентов [9].
/154/154.jpg)
Если и эта пункционная процедура не приводит к регрессу болевого синдрома, тогда производится оперативное нейрохирургическое вмешательство открытым доступом. Вопрос о проведении пункционных или открытых нейрохирургических вмешательств при болях в спине ставится в случае неэффективности правильно проводимой консервативной терапии в течение трех месяцев [2, 7, 8].
При хроническом течении болевого синдрома на третьем этапе лечения радикулопатии применяются психотропные препараты из разряда антидепрессантов. Частое наличие депрессии у пациентов с хронической болью в спине послужило поводом к включению в стандарты терапии антидепрессантов, которые неожиданно оказались весьма эффективны в лечении всех видов хронической боли, независимо от наличия коморбидной депрессии. Более того, оказалось, что анальгетический эффект антидепрессантов развивается значительно раньше тимолептического, что побудило исследователей к поиску механизмов действия этой группы препаратов при болевых синдромах. Полагают, что антидепрессанты повышают активность эндогенной подавляющей боль (антиноцицептивной) системы мозга за счет повышения концентрации ключевых нейромедиаторов антиноцицептивной системы — серотонина и норадреналина [2, 8]. Ограничивающим фактором применения трициклических антидепрессантов в лечении хронических болей в спине является наличие выраженных побочных явлений (сонливость, потеря координации движений, повышение артериального давления, задержка мочи и т.д.) и синдрома отмены (возобновление болей, развитие тревоги, психомоторного возбуждения и даже судорожных припадков при резком прекращении приема этих лекарств). В связи с этим более безопасно назначение антидепрессантов из группы селективных ингибиторов обратного захвата серотонина (СИОЗС), таких как эсциталопрам, не имеющих вышеуказанных побочных эффектов при доказанной эффективности в лечении хронической боли в спине и невропатической боли при радикулопатии [14].
Для активации регенеративных процессов в периферических нервах используются нейротропные комплексы, содержащие большие дозы витаминов группы В (В1 В6, B12) [4, 7, 24]. Одновременное применение тиамина (В1), пиридоксина (В6) и цианокобаламина (В12) влияет на стимуляцию аксоплазматической части транспорта структурных элементов мембраны или миелиновой оболочки, например холина. Тиамин способствует ремиелинизации через активацию фосфолипазы-A, что усиливает гидролиз эфиров жирных кислот, кроме того, посредством усиления энергообеспечения в форме АТФ поддерживает аксоплазматический транспорт, что особенно важно для восстановления трофической функции нерва при множественном аксоплазматическом сдавлении (МАС-синдроме) [7]. Пиридоксин участвует в синтезе транспортных белков и сфингозина — структурного элемента мембраны нервного волокна и нейромедиаторов антиноцицептивной системы (серотонина, норадреналина). Цианокобаламин обеспечивает доставку жирных кислот для клеточных мембран и миелиновой оболочки. Применение витамина В12 способствует не только ремиелинизации (за счет активации реакции трансметилирования, обеспечивающей синтез фосфатидилхолина мембран нервных клеток), но и снижению интенсивности болевого синдрома, что связано с собственным антиноцицептивным действием высоких доз цианокобаламина. Таким образом, нейротропные компоненты Мильгаммы ампул улучшают скорость проведения нервного импульса, улучшают репаративные процессы в периферическом нерве. Анестетик, лидокаин в составе Мильгаммы ампул, предназначен для обеспечения безболезненности процедуры инъекции, что повышает комплайенс больных. Применяется схема лечения тоннельных невропатий, включающая курс из 10 внутримышечных инъекций Мильгаммы с последующим переходом на Мильгамма® таблетки 3 раза в день в течение 2–8 недель (в зависимости от тяжести невропатии). В отличие от инъекционной формы Мильгаммы, Мильгамма® таблетки не содержат витамин В12, длительный прием которого сопряжен с рядом побочных эффектов, поэтому могут применяться в течение нескольких месяцев, вплоть до полного исчезновения чувствительных расстройств в конечности [2, 4, 7]. Имеются данные о целесообразности использования антиоксидантов — препаратов тиоктовой кислоты (например, Тиогамма® таблетки — 1 таблетка (600 мг тиоктовой кислоты) утром) в патогенетическом лечении чувствительных и двигательных расстройств у больных с радикулопатиями [25]. Наивысшую доказательную базу антиоксиданты и витамины группы В имеют в лечении неврологических осложнений сахарного диабета и алкоголизма, но тем не менее их потенциал в лечении дискогенных радикулопатий требует дальнейшего изучения. Антихолинэстеразные препараты, также использующиеся для терапии поражения периферических нервов при сахарном диабете [24], имеют патогенетически обоснованную целесообразность применения при радикулопатиях. В основе механизма их действия лежит блокада калиевой проницаемости мембраны и обратимое ингибирование холинэстеразы, что приводит к стимулирующему влиянию на проведение импульса в нервно-мышечном синапсе.
При хронических радикулопатиях вне обострения возможно применение мобилизационных техник мануальной терапии, однако следует понимать, что чрезмерное увлечение жесткими манипуляционными техниками может приводить к гипермобильности позвоночных двигательных сегментов (усугубляющей имеющуюся динамическую компрессию пораженного корешка нерва), поэтому число таких манипуляций должно быть минимизировано. Основные принципы физиолечения радикулопатии:
1. Исключение неблагоприятных статико-динамических нагрузок на пораженный отдел позвоночника и область компрессии нерва (на первых этапах периода декомпенсации — необходимость покоя и фиксации).
2. Фазовость лечения: восстановление нормальной биомеханики движений в позвоночнике при отсутствии необходимости обеспечения защитной фиксации пораженного позвоночного сегмента.
3. Комплексность лечения: необходимость воздействий не только на позвоночник, но и на экстравертебральные патологические очаги (например, в малом тазу — лечение эндометриоза, простатита и т.п.), участвующие в формировании мышечно-тонических синдромов посредством активации висцеромоторного рефлекса. Этот принцип соответствует, во-первых, общим теоретическим положениям о целостности организма; во-вторых, подчеркивает клиническую роль экстеро-, проприо- и интероцептивных импульсов в развитии патологии позвоночника. Важно добиться не просто ремиссии, а ремиссии устойчивой, с такой фиксацией позвоночника, с таким состоянием костных, сосудистых, мышечных и соединительнотканных элементов костно-мышечных тоннелей, которые обеспечили бы профилактику обострений радикулопатии.
4. Щадящий характер лечебных воздействий: они не должны быть более вредными, чем сама болезнь.
5. Уменьшение болевых ощущений. Речь идет о снижении возбудимости или функциональном выключении соответствующих центральных и периферических нервных структур. Вместе с тем следует помнить, что в условиях декомпенсации и нестабильности болевая импульсация в определенные моменты является источником необходимых сигналов для осуществления защитных и компенсаторных реакций.
Поведенческая и когнитивно-поведенческая психотерапия помогает скорректировать неправильные, пpепятствующие выздоpовлению пpедставления пациента о пpиpоде своего заболевания, изменить социальное подкрепление болевого поведения, уменьшить зависимость от анальгетической терапии и повысить уровень повседневной активности. Эта концепция легла в основу разработки психотерапевтических программ лечения боли — «школ боли». При реализации этих программ результаты лечения хронической боли наиболее высоки, так как в них используется комплексный подход, сочетающий в себе методы психотерапии, рефлексотерапии, лечебной физкультуры и фармакотерапии [2, 4–6, 8].
Определение целесообразности оперативного лечения радикулопатии у пациента с грыжей межпозвоночного диска должно являться прерогативой невролога, но окончательное решение о тактике лечения все равно остается за больным. Немаловажным фактором для достижения положительного результата может быть желание пациента сделать блокаду или быть прооперированным, а также его убежденность в пользе данного метода лечения, при условии полной информированности со стороны лечащего врача. Если больным положительно воспринимаются более инвазивные методы лечения или если психосоциальные или экономические факторы требуют более быстрого восстановления, то рассмотрение хирургического лечения является оправданным.
Анализ литературных данных, касающихся диагностики и лечения боли, а также наш собственный клинический опыт показывают, что ни один из отдельно применяющихся методов хирургического, фармакологического, физического или психологического лечения радикулопатии не может сравниться по своей эффективности с мультидисциплинарным подходом, когда все вышеуказанные методы, назначенные в комплексе, взаимно потенцируют друг друга. При этом риск возникновения побочных явлений существенно снижается за счет уменьшения доз и сокращения курса приема анальгетиков.
1. Филатова Е.Г., Кокина М.С. Анализ неудач хирургического лечения болей в спине // Российский журнал боли. — 2012. — № 3–4 — С. 22–25.
2. Алексеев В.В., Баринов А.Н., Кукушкин М.Л., Подчуфарова Е.В., Строков И.А., Яхно Н.Н. Боль: Руководство для врачей и студентов / Под ред. Н.Н. Яхно. — М.: МедПресс, 2009. — 302 с.
3. Баринов А.Н. Сегментарные механизмы формирования мышечного спазма, спастичности и хронизации боли // Врач. — 2012. — № 5. — С. 17–23.
4. Баринов А.Н., Мурашко Н.К., Яворский В.В., Терентьева Н.В. Невропатическая боль при поражении периферической нервной системы: стратификация лечения // Медицинский совет. — 2013. — № 4. — С. 54–62.
5. Европейские рекомендации по лечению неспецифической боли в пояснично-крестцовой области в условиях первичной медицинской помощи: Реферат / Под ред. Н.Н. Яхно, Е.В. Подчуфаровой. — М.: Практическая медицина, 2010. — 24 с.
6. Зиновьева О.Е., Строков И.А., Баринов А.Н., Ахмеджанова Л.Т. Нейромидин в лечении диабетической полиневропатии // Неврологический вестник. — 2007. — № 6. — С. 52–55.
7. Меркулова Д.М., Баринов А.Н., Меркулов Ю.А. Синдром множественного аксоплазматического сдавления: особенности диагностики и лечения тоннельных невропатий при патологии шейного отдела позвоночника // Фарматека. — № 20.
8. Яхно Н.Н., Баринов А.Н., Подчуфарова Е.В. Невропатическая и скелетно-мышечная боль. Современные подходы к диагностике и лечению // Клиническая медицина. — 2008. — Т. 86, № 11. — С. 9–15.
9. Andersson G.B., Mekhail N.A., Block J.E. Treatment of intractable discogenic low back pain. A systematic review of spinal fusion and intradiscal electrothermal therapy (IDET) // Pain Physician. — 2006. — Vol. 9. (3). — 237–248.
10. Benyamin R.M., Manchikanti L., Parr A.T. et al. The Effectiveness of Lumbar Interlaminar Epidural Injections in Managing Chronic Low Back and Lower Extremity Pain, Systematic Review // Рain Physician. — 2012. — Vol. 15, Issue 4. — E363–404.
11. Gibson J.N.A., Waddell G. Surgical Interventions for lumbar disc prolapse // Cochrane Database Syst. Rev. — 2009. — 1. — CD01350.
12. Datta S., Everett C.R., Trescot A.M. et al. An updated systematic review of the diagnostic utility of selective nerve root blocks // Pain Physician. — 2007. — Vol. 10 (1). — 113–128.
13. Manchikanti L., Buenaventura R.M., Manchikanti K.N. et al. Effectiveness of Therapeutic Lumbar Transforaminal Epidural Steroid Injections in Managing Lumbar Spinal Pain, Systematic Review // Рain Physician. — 2012. — Vol. 15, Issue 3. — E199–E245.
14. Mazza M., Mazza O., Pazzaglia C. et al. Escitalopram 20 mg versus duloxetine 60 mg for the treatment of chronic low back pain // Expert Opin. Pharmacother. — 2010. — Vol. 11 (7). — 1049–52.
15. Sayegh F.E., Kenanidis E.I., Papavasiliou K.A. et al. Efficacy of steroid and nonsteroid caudal epidural injections for low back pain and sciatica: a prospective, randomized, double-blind clinical trial // Spine. — 2009. — Vol. 34 (14). — 1441–7.
16. Borghi B., Aurini L., White P.F. et al. Long-lasting beneficial effects of periradicular injection of meloxicam for treating chronic low back pain and sciatica // Minerva Anestesiol. — 2013. — Vol. 79 (4). — 370–8.
17. Carragee E.J. et al. Clinical outcomes after lumbar discectomy for sciatica: The effects of fragment types and annular competence // J. Bone Joint Surg. Am. — 2003. — 85 (1). — 102–108.
18. Dewing C.B. et al. The outcome of lumbar microdiscectomy in a young, active population: correlation by herniation type and level // Spine. — 2008. — 33. — 33–38.
19. Weinstein J.N., Bronner K.K., Morgan T.S., Wennberg J.E. Trends and geographic variations in major surgery for degenerative diseases of the hip, knee, and spine // Health Aff. (Millwood). — 2004. (Suppl. Web exclusive). — var81–89.
20. Weinstein J.N., Tosteson T.D., Lurie J.D. et al. Surgical vs Nonoperative Treatment for Lumbar Disk Herniation. The Spine Patient Outcomes Research Trial (SPORT): A Randomized Trial // JAMA. — 2006. — 296 (20). — 2441–2450.
21. Boden S.D., Davis D.O., Dina T.S., Patronas N.J., Wiesel S.W. Abnormal magnetic–resonance scans of the lumbar spine in asymptomatic subjects: a prospective investigation // J. Bone Joint Surg. Am. — 1990. — 72. — 403–408.
22. Jensen M.C., Brant-Zawadzki M.N., Obuchowski N., Modic M.T., Malkasian D., Ross J.S. Magnetic resonance imaging of the lumbar spine in people without back pain // N. Engl. J. Med. — 1994. — 331. — 69–73.
23. Saal J.A., Saal J.S. Nonoperative treatment of herniated lumbar intervertebral disc with radiculopathy // Spine. — 1989. — 14. — 431–437.
24. Eckert M., Schejbal P. Therapy of neuropathies with a vitamin B combination // Fortschr. Med. — 1992. — 110 (29). — 544–8.
25. Memeo A., Loiero M. Thioctic acid and acetyl-L-carnitine in the treatment of sciatic pain caused by a herniated disc: a randomized, double-blind, comparative study // Clin. Drug Investig. — 2008. — 28. — 495–500.