Международный неврологический журнал 6 (68) 2014
Вернуться к номеру
Васкулярный эндотелиальный фактор роста 1 как предиктор неблагоприятных кардиоваскулярных событий у пациентов с гипертонической болезнью III стадии. Результаты одногодичного наблюдения. Часть II
Авторы: Березин A.E., Лисовая O.A. - Запорожский государственный медицинский университет
Рубрики: Неврология
Разделы: Справочник специалиста
Версия для печати
Целью исследования явилось изучение предсказующей ценности серийных измерений циркулирующего уровня васкулярного эндотелиального фактора роста 1 у больных артериальной гипертензией III стадии.
Материал и методы. В исследование было включено 102 пациента с гипертонической болезнью III ст. легкой и умеренной степени тяжести через 3 недели после перенесенного мозгового ишемического инсульта. Период наблюдения составил 12 месяцев с 3-месячными интервалами. Циркулирующий уровень VEGF-1 оценивался в начале исследования и через шесть месяцев наблюдения. Клинические интервью проводились каждые 3 месяца в течение 1 года после получения образцов крови. В качестве клинических точек учитывались все кардиоваскулярные исходы, а именно повторный инсульт или транзиторная ишемическая атака, ишемическая болезнь сердца, внезапная смерть, сахарный диабет, сердечно-сосудистые события, включая хроническую сердечную недостаточность, и потребность в госпитализации по этим причинам.
Результаты. Анализ полученных данных показал, что нарастание концентрации VEGF-1 на протяжении шести месяцев у лиц после перенесенного мозгового ишемического инсульта ассоциируется с увеличением частоты возникновения кардиоваскулярных событий по сравнению с лицами с отсутствием прироста циркулирующего уровня VEGF-1. Корригированное отношение шансов в отношении возникновения кумулятивных кардиоваскулярных событий для пациентов с артериальной гипертензией III стадии при инициальном уровне VEGF-1 более 403,57 пг/мл по сравнению с более низкими концентрациями последнего составляет 4,11 (95% ДИ = 2,66–7,28; P = 0,001), а при увеличении циркулирующего VEGF-1 к шестому месяцу наблюдения более 450,15 пг/мл по сравнению с более низкими его концентрациями отношение шансов повышается до 5,46 (95% ДИ = 3,12–7,90; P = 0,001).
Вывод. Циркулирующий уровень васкулярного эндотелиального фактора роста 1 является независимым предиктором возникновения кумулятивных кардиоваскулярных исходов у больных с гипертонической болезнью III стадии на протяжении 1 года после мозгового ишемического инсульта.
Метою дослідження було вивчення прогностичної цінності серійних вимірювань циркулюючого рівня васкулярного ендотеліального фактора росту 1 у хворих на артеріальну гіпертензію III стадії.
Матеріал і методи. У дослідження були включені 102 пацієнти з гіпертонічною хворобою III ст. легкого та помірного ступеня тяжкості через 3 тижні після перенесеного мозкового ішемічного інсульту. Період спостереження становив 12 місяців із 3-місячними інтервалами. Циркулюючий рівень VEGF-1 оцінювався на початку дослідження та через шість місяців спостереження. Клінічні інтерв’ю проводилися кожні 3 місяці протягом 1 року після отримання зразків крові. Як клінічні точки враховувалися всі кардіоваскулярні результати, а саме повторний інсульт або транзиторні ішемічні атаки, ішемічна хвороба серця, раптова смерть, цукровий діабет, серцево-судинні події, включаючи хронічну серцеву недостатність, і потреба в госпіталізації з цих причин.
Результати. Аналіз отриманих даних показав, що наростання концентрації VEGF-1 протягом шести місяців в осіб після перенесеного мозкового ішемічного інсульту асоціюється зі збільшенням частоти виникнення кардіоваскулярних подій порівняно з особами з відсутністю приросту циркулюючого рівня VEGF-1. Кориговане відношення шансів щодо виникнення кумулятивних кардіоваскулярних подій для пацієнтів із артеріальною гіпертензією III стадії при ініціальному рівні VEGF-1 більше 403,57 пг/мл порівняно з більш низькими концентраціями останнього становить 4,11 (95% ДІ = 2,66–7,28; P = 0,001), а при збільшенні циркулюючого VEGF-1 до шостого місяця спостереження понад 450,15 пг/мл порівняно з більш низькими його концентраціями відношення шансів підвищується до 5,46 (95% ДІ = 3,12–7,90; P = 0,001).
Висновок. Циркулюючий рівень васкулярного ендотеліального фактора росту 1 є незалежним предиктором виникнення кумулятивних кардіоваскулярних наслідків у хворих із гіпертонічною хворобою III стадії протягом 1 року після мозкового ішемічного інсульту.
The aim of the study was to investigate the predictive value of serial measurements of circulating vascular endothelial growth factor 1 (VEGF) level in stage III hypertensive patients.
Materials and Methods. One hundred and two patients with mild to moderate arterial hypertension III stage within 3 weeks after ische-mic stroke were included into the study. Follow-up was 12 months with a 3 month intervals. The circulating VEGF-1 level was assessed at baseline and after six months. Clinical interviews were conducted every 3 months for 1 year after receiving blood samples. As a clinical point we determined follow cardiovascular outcomes: recurrent stroke or transient ischemic attack, ischemic heart disease, sudden death, diabetes mellitus, cardiovascular events, including chronic heart failure, and the need for hospitalization for these reasons.
Results. The analysis of obtained outcomes have shown that increased VEGF-1 concentration within six months after ischemic stroke has been positively associated with incidence of cardiovascular events, when compared with individuals without increased circulating levels of VEGF-1. Adjusted odds ratio for the occurrence of cumulative cardiovascular events in stage III hypertension patients with VEGF-1 at baseline more 403.57 pg/ml, when compared with lower concentrations of it was 4.11 (95% CI = 2.66–7.28; P = 0.001), and an increased sixth month circulating VEGF-1 over 450.15 pg/ml, when compared with lower concentrations of it was associated with adjusted odds ratio 5.46 (95% CI = 3.12–7.90; P = 0.001).
Conclusion. Circulating vascular endothelial growth factor 1 level is an independent predictor of one-year cumulative cardiovascular events in patients with stage III hypertension after cerebral ischemic stroke.
васкулярный эндотелиальный фактор роста 1, ишемический инсульт, гипертоническая болезнь III ст., серийные измерения, клинические исходы, прогноз.
васкулярний ендотеліальний фактор росту 1, ішемічний інсульт, гіпертонічна хвороба ІІІ ст., серійні вимірювання, клінічні результати, прогноз.
vascular endothelial growth factor 1, ischemic stroke, arterial hypertension, serial measurements, clinical outcomes, predicted value.
Статья опубликована на с. 124-131
(Часть I опубликована в «Международном неврологическом журнале» № 1(63), с. 61)
Несмотря на значительное количество исследований, демонстрирующих непосредственную взаимосвязь между содержанием некоторых провоспалительных цитокинов и кардиоваскулярным риском, у пациентов с артериальной гипертензией (АГ), перенесших мозговой ишемический инсульт, роль низкоинтенсивной провоспалительной активации в отношении модуляции отсроченных клинических событий остается противоречивой. Предполагается, что васкулярный эндотелиальный фактор роста 1 (vascular endothelial growth factor — VEGF) у пациентов, перенесших мозговой инсульт, оказывает ранний нейропротекторный и отсроченный атеротромботический эффекты за счет индукции неоангиогенеза, повышения проницаемости сосудистой стенки, активации миграции моноцитов и эндотелиоцитов, потенцирования воспалительного ответа [10, 13]. В то же время предсказующая ценность серийных измерений VEGF-1 в отношении рекуррентных сердечно–сосудистых событий у пациентов с АГ III стадии не установлена.
Целью исследования явилось изучение предсказующей ценности серийных измерений циркулирующего уровня васкулярного эндотелиального фактора роста 1 в отношении наступления повторных кардиоваскулярных событий у больных артериальной гипертензией III стадии.
Материал и методы исследования
В исследование было включено 102 пациента с гипертонической болезнью III ст. легкой и умеренной степени тяжести через 3 недели после перенесенного мозгового ишемического инсульта. Инициальная тяжесть мозгового инсульта верифицировалась с помощью шкалы NIHSS (National Institute of Health Stroke Scale) [11]. Тип ишемического инсульта классифицировался на основании критериев TOAST [2]. Функциональная способность пациентов оценивалась с помощью шкалы Бартела [4] и модифицированной шкалы Рэнкина [5]. Функциональные исходы были оценены при поступлении пациента в стационар и через 3 недели лечения до включения в исследование. Всем пациентам выполнялась контрастная спиральная компьютерная томография на аппарате Somatom Spirit (Siemens, Германия) по традиционной методике с использованием неионного контраста Omnipak (Amersham Health, Ирландия).
Образцы крови для последующего определения уровней васкулярного эндотелиального фактора роста 1 и высокочувствительного С-реактивного протеина (hs-СРП) отбирались в утренние часы (7:00–8:00) в охлажденные силиконовые пробирки с добавлением 2 мл 5% раствора трилона Б и центрифугировались при постоянном охлаждении со скоростью 6 тыс. оборотов в минуту в течение 15 минут. После этого плазма крови немедленно замораживалась, а затем хранилась при температуре не более –35 °С. Содержание VEGF-1 было измерено методом ELISA в начале исследования и через шесть месяцев наблюдения с использованием коммерческих лабораторных наборов производства Bioscience (США) в соответствии с инструкцией фирмы-производителя. Содержание hs-СРП было измерено с помощью нефелометрической техники на аппарате AU640 Analyzer (Olympus Diagnostic Systems Group, Япония).
Верификация кардиоваскулярных событий
Для верификации клинически значимых кардиоваскулярных событий использовался метод интервью с интервалом 1 месяц, а также ревьюирование доступной медицинской документации на протяжении 1 года наблюдения. В качестве клинических точек учитывались все кардиоваскулярные исходы, а именно повторный инсульт или транзиторные ишемические атаки, ишемическая болезнь сердца (ИБС), внезапная смерть, сахарный диабет, сердечно-сосудистые события, включая хроническую сердечную недостаточность, и потребность в госпитализации по этим причинам. Верификация впервые возникших случаев ИБС, васкулярных событий, сердечной недостаточности, а также сахарного диабета осуществлялась с учетом действующих клинических соглашений [3, 14, 17]. Все данные о возникших кардиоваскулярных событиях представлялись как кумулятивные.
Дизайн исследования: открытое когортное проспективное испытание.
После подписания информированного согласия всем пациентам проведены общеклиническое исследование, оценка неврологической симптоматики и васкулярных факторов риска, тяжести АГ, выполнены ЭКГ, эхокардиография, МСКТ, а также осуществлено взятие образцов крови.
Этические принципы. Исследователи строго придерживались всех требований, предъявляемых к клиническим испытаниям в соответствии с Хельсинкской декларацией прав человека (1964), Конференцией по гармонизации надлежащей клинической практики (GCP-ICH), Конвенцией Совета Европы о защите прав и достоинства человека в связи с использованием достижений биологии и медицины, Конвенцией о правах человека и биомедицине, включая Дополнительный протокол к Конвенции о биомедицинских исследованиях, и законодательством Украины.
Статистическая обработка результатов
Анализ полученных данных проводился с использованием программы SPSS for Windows v. 20.0 (SPSS Inc., Chicago, Il., США). Все данные были представлены в виде среднего значения (М), 95% доверительного интервала (ДИ), медианы (Ме), а также квартилей, межквартильного интервала (МКИ) или перцентилей. Гипотезу о нормальности распределения исследуемых показателей проверяли с использованием критерия Шапиро — Уилка. В зависимости от типа распределений анализируемых показателей использовали непарный t-критерий Стьюдента или U-критерий Манна — Уитни. При проведении парных сравнений уровней показателей внутри групп применяли парный критерий Вилкоксона. Для сравнений двух показателей в лонгитюде использовали метод ANOVA. Для анализа таблиц сопряженности 2 × 2 при сравнении категоризированных переменных применяли двусторонний точный критерий Фишера или Chi2-тест. Потенциальные факторы (возраст, пол, тип инсульта, индексы по шкалам Бартел и Рэнкина, латерализация поражения, тяжесть АГ, васкулярные факторы риска, наличие сахарного диабета, гиперлипидемия, уровень hs-CРП и васкулярного эндотелиального фактора роста 1), которые могли бы ассоциироваться с наступлением кумулятивных клинических событий, были идентифицированы с помощью унивариантного анализа (ANOVA). В последующем в мультивариантной пропорциональной модели Кокса были верифицированы предикторы кардиоваскулярных событий на протяжении 1 года наблюдения. С помощью ROC (Receiver operating characteristic) анализа были установлены концентрации васкулярного эндотелиального фактора роста 1 с наиболее оптимальной предсказующей ценностью в отношении кумулятивной клинической точки. Кривые выживаемости Каплана — Мейера были построены для групп пациентов с различными концентрациями васкулярного эндотелиального фактора роста 1. Различия считали достоверными при значениях P < 0,05.
Результаты
Общая характеристика пациентов, принявших участие в исследовании, представлена в табл. 1. Детальное описание исследуемой группы пациентов представлено в части I этой статьи [1].
Анализ полученных данных показал, что после подписания информированного согласия на протяжении всего периода наблюдения было зарегистрировано 57 кардиоваскулярных событий, среди которых 4 смертельных исхода (2 фатальных инсульта и 2 фатальных инфаркта миокарда), 6 клинически значимых эпизодов аритмий (фибрилляции предсердий), 17 впервые выявленных случаев ИБС (стенокардия напряжения низких функциональных классов), 9 повторных инсультов (5 лакунарных и 2 кардиоэмболических), 10 новых случаев сахарного диабета 2-го типа, 4 впервые возникших случая хронической сердечной недостаточности и 7 повторных госпитализаций вследствие кардиоваскулярных причин.
Анализ полученных данных показал, что медиана исходного содержания VEGF-1 в крови пациентов с рекуррентными кардиоваскулярными событиями и лиц без таковых существенно не отличается и составляет 344,87 пг/мл (95% ДИ = 245,67–493,46 пг/мл) и 352,10 пг/мл (95% ДИ = 205,31–573,81 пг/мл) соответственно (P > 0,1). Уровень циркулирующего VEGF-1 через 6 месяцев наблюдения у пациентов с рекуррентными кардиоваскулярными событиями и без таковых составлял 814,51 пг/мл (95% ДИ = 428,17–1033,45 пг/мл) и 203,59 пг/мл (95% ДИ = 200,13–285,81 пг/мл) соответственно (P < 0,001). Обращает на себя внимание тот факт, что в когорте больных с повторными кардиоваскулярными событиями на протяжении одного года наблюдения в первые шесть месяцев исследования циркулирующий уровень VEGF-1 статистически значимо возрастал (% = 57,7 %; P < 0,001). Напротив, у больных без вновь возникших сердечно-сосудистых событий концентрация VEGF-1 снижалась на протяжении шести месяцев наблюдения (% = –42,2 %; P < 0,001), что привело к появлению достоверной разницы в концентрациях VEGF-1 в исследуемых когортах больных.
Для последующего анализа содержание VEGF-1 было представлено в зависимости от количества рекуррентных кардиоваскулярных событий за 1 год наблюдения. Оказалось, что инициальный циркулирующий уровень VEGF–1 у больных с АГ III стадии, продемонстрировавших одно, два, три и более случая повторных сердечно-сосудистых событий, составляет 373,80 пг/мл (95% ДИ = 342,90–479,70 пг/мл), 539,96 пг/мл (95% ДИ = 444,28–865,56 пг/мл) и 724,66 пг/мл (95% ДИ = 558,72–890,66 пг/мл) соответственно, что достоверно превышает таковой у лиц, для которых новые клинически значимые кардиоваскулярные исходы документированы не были (Ме = 289,28 пг/мл; 95% ДИ = 279,71–345,88 пг/мл) (P = 0,001 для всех случаев). Концентрация VEGF-1, измеренная через 6 месяцев наблюдения, у больных с одним, двумя, тремя и более случаями повторных сердечно-сосудистых событий составляла 484,51 пг/мл (95% ДИ = 428,19–588,01 пг/мл), 815,45 пг/мл (95% ДИ = 583,02–1045,99 пг/мл) и 964,61 пг/мл (95% ДИ = 806,61–1135,83 пг/мл) соответственно, что достоверно превышает таковую у лиц, для которых новые клинически значимые кардиоваскулярные исходы документированы не были (Ме = 203,59 пг/мл; 95% ДИ = 200,14–285,81 пг/мл) (P = 0,001 для всех случаев). Вместе с тем в когорте пациентов с документированными кардиоваскулярными событиями циркулирующий уровень VEGF-1, измеренный как в начале исследования, так и через 6 месяцев наблюдения, достоверно различался только у пациентов, имеющих более 2 зарегистрированных событий по сравнению с лицами, у которых последние возникали один раз в год.
С помощью ROC-анализа мы установили, что наиболее оптимальными точками разделения (cutoff-points) циркулирующих концентраций VEGF-1 у больных с АГ III стадии в начале исследования (модель 1) и через шесть месяцев наблюдения (модель 2) являются 403,57 и 450,15 пг/мл соответственно.
Для указанных точек разделения чувствительность и специфичность составили 78,6 и 70,0 %, а также 85,7 и 70,5 % соответственно при величинах отношения правдоподобия позитивного и негативного результатов, равных 1,12 и 0,305, а также 2,86 и 0,202. Вместе с тем площадь под ROC-кривой (AUC — area under curve) для обеих моделей существенно различалась и составляла 0,76 (95% ДИ = 0,602–0,917; P = 0,001) и 0,824 (95% ДИ = 0,707–0,921; P = 0,001), что демонстрирует более высокую прогностическую ценность модели 2 (рис. 1).
/128/128.jpg)
При этом наиболее значимым прогностическим потенциалом в этом отношении обладают: содержание VEGF-1 через 6 месяцев наблюдения более 450,15 пг/мл (коэффициент В = 0,014; индекс Wald = 8,25; Р = 0,009), инициальная элевация VEGF-1 более 403,57 пг/мл (коэффициент В = 0,002; индекс Wald = 6,515; Р = 0,011), циркулирующий уровень высокочувствительного СРП (коэффициент В = 0,392; индекс Wald = 5,784; Р = 0,016), мужской пол (коэффициент В = 0,025; индекс Wald = 1,885; Р = 0,012). В связи с этим при проведении последующего регрессионного анализа Кокса мы корригировали полученные данные в зависимости от гендерной принадлежности и уровня циркулирующего СРП. Оказалось, что корригированное отношение шансов (ОШ) в отношении возникновения кумулятивных кардиоваскулярных событий для пациентов с АГ III стадии при инициальном уровне VEGF-1 более 403,57 пг/мл по сравнению с более низкими концентрациями последнего составляет 4,11 (95% ДИ = 2,66–7,28; P = 0,001), а при увеличении циркулирующего VEGF-1 к шестому месяцу наблюдения более 450,15 пг/мл по сравнению с более низкими его концентрациями ОШ повышается до 5,46 (95% ДИ = 3,12–7,90; P = 0,001).
При построении кривых Каплана — Мейера (рис. 2) было подтверждено, что у пациентов с инициальным содержанием VEGF-1 более 403,57 пг/мл накопление ожидаемых суммарных кардиоваскулярных событий достоверно больше, чем у лиц с более низким содержанием VEGF-1 (P = 0,001). При этом расхождение кривых накопления событий достигало статистической значимости уже через 14 недель наблюдения. Аналогичная динамика накопления кардиоваскулярных событий прослеживалась и в отношении концентраций VEGF-1 (более и менее 450,15 пг/мл), измеренных через шесть месяцев наблюдения. Обращает на себя внимание тот факт, что для обеих когорт пациентов, сформированных с помощью post-hoc-анализа в зависимости от шестимесячного уровня VEGF-1, расхождение кривых Каплана — Мейера достигает статистической значимости через 10 недель после начала исследования. С клинической точки зрения наибольшую ценность могло бы представлять доказательство прогностической ценности факта нарастания концентрации VEGF-1 при серийных измерениях последнего.
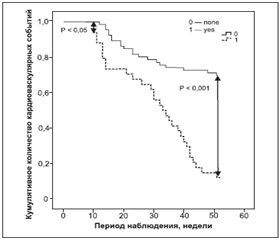
В связи с этим мы проверили гипотезу о том, что для каждого пациента с АГ ІІІ стадии прирост концентрации VEGF-1 более чем на 2σ за шесть месяцев наблюдения может иметь еще большую ценность в отношении накопления клинических точек, чем локальное повышение циркулирующего уровня VEGF-1 при случайном измерении. Анализ полученных данных показал, что в когорте пациентов с нарастанием концентрации VEGF-1 частота накопления кардиоваскулярных событий статистически значимо опережает таковую у лиц с отсутствием прироста циркулирующего уровня VEGF-1 (рис. 3). Расхождение кривых Каплана — Мейера отмечается уже через 10 недель и продолжает нарастать к исходу периода наблюдения.
/129/129_2.jpg)
Кроме того, корригированное ОШ в отношении возникновения кумулятивных кардиоваскулярных событий для пациентов с АГ III стадии при наличии элевации уровня VEGF-1 при серийных измерениях составляет 6,10 (95% ДИ = 4,70–8,30; P = 0,001), что существенно выше, чем аналогичные данные, полученные для случайных измерений концентраций VEGF-1 в начале исследования и через шесть месяцев наблюдения.
Обсуждение
Полученные нами данные подтверждают гипотезу о том, что повышение концентрации VEGF-1 свыше 450,15 пг/мл к шестому месяцу наблюдения тесно ассоциировано с ухудшением клинического прогноза заболевания. В ряде ранее проведенных исследований предикторный потенциал VEGF-1 не был установлен для пиковых концентраций последнего в когорте больных с документированным атеросклеротическим поражением магистральных артерий головы и шеи и мозговым инсультом в анамнезе, хотя теоретические предпосылки для подобной гипотезы выглядят привлекательно [18]. В частности, установлено, что высвобождение VEGF-1 вследствие фокальной церебральной ишемии, c одной стороны, опосредует реализацию нейропротективных влияний, способствует неоангиогенезу и нейрогенезу [6, 15], а с другой — индуцирует постишемическое нейроваскулярное ремоделирование [7]. Последнее, вероятно, лежит в основе прогрессирующего нарушения пространственной периваскулярной нейроцитоархитектоники, расширения зоны пенумбры и усугубления церебральной ишемии [8, 12]. Поскольку ангиопоэтический эффект VEGF-1 носит системный характер, то можно предположить, что неоваскуляризация в области «угрожаемой» атеромы будет способствовать прогрессирующему нарушению механических качеств покрышки, формированию феномена «усталости» покрышки, дисфункции эндотелия, что в конечном итоге приводит к атеротромбозу с соответствующим васкулярному бассейну клиническим эквивалентом [16]. Таким образом, у пациентов, перенесших мозговой инсульт, немедленные эффекты VEGF-1, вероятно, носят адаптивный характер, тогда как отсроченные могут ассоциироваться с возникновением неблагоприятных клинических событий, опосредованных, в частности, атеротромбозом. Последняя гипотеза нашла подтверждение в результатах нашего исследования. Мы полагаем, что нарастание концентрации VEGF-1 может являться отражением феномена прогрессирования васкулярного ремоделирования в отдаленной перспективе, что ассоциируется с увеличением частоты возникновения повторных кардиоваскулярных событий.
Выводы
1. У пациентов с АГ III стадии нарастание концентрации VEGF-1 на протяжении шести месяцев после перенесенного мозгового ишемического инсульта ассоциируется с увеличением частоты возникновения кардиоваскулярных событий по сравнению с пациентами с отсутствием повышения циркулирующего уровня VEGF-1.
2. Корригированное отношение шансов в отношении возникновения кумулятивных кардиоваскулярных событий для пациентов с АГ III стадии при инициальном уровне VEGF-1 более 403,57 пг/мл по сравнению с более низкими концентрациями последнего составляет 4,11 (95% ДИ = 2,66–7,28; P = 0,001), а при увеличении циркулирующего VEGF-1 к шестому месяцу наблюдения более 450,15 пг/мл по сравнению с более низкими его концентрациями отношение шансов повышается до 5,46 (95% ДИ = 3,12–7,90; P = 0,001).
1. Березин A.E., Лисовая O.A. Васкулярный эндотелиальный фактор роста 1 как предиктор неблагоприятных кардиоваскулярных событий у пациентов с гипертонической болезнью III стадии. Результаты одногодичного наблюдения. Часть I // Международный неврологический журнал. — 2014. — № 1(63). — 61–67.
2. Adams H.P., Bendixen B.H., Kappelle L.J., Biller J., Love B.B., Gordon D.L., Marsh E.E. III. Classification of subtype of acute ischemic stroke: definitions for use in a multicenter clinical trial: TOAST: Trial of Org 10172 in Acute Stroke Treatment // Stroke. — 1993. — 24. — 35–41.
3. American College of Cardiology Foundation/American Heart Association Task Force; American Stroke Association; American Association of Neuroscience Nurses; American Association of Neurological Surgeons; American College of Radiology; American Society of Neuroradiology; Congress of Neurological Surgeons; Society of Atherosclerosis Imaging and Prevention; Society for Cardiovascular Angiography and Interventions; Society of Interventional Radiology; Society of NeuroInterventional Surgery; Society for Vascular Medicine; Society for Vascular Surgery; American Academy of Neurology; Society of Cardiovascular Computed Tomography. Brott T.G., Halperin J.L., Abbara S., Bacharach J.M., Barr J.D., Bush R.L., Cates C.U., Creager M.A., Fowler S.B., Friday G., Hertzberg V.S., McIff E.B., Moore W.S., Panagos P.D., Riles T.S., Rosenwasser R.H., Taylor A.J., 2011. ASA/ACCF/AHA/AANN/AANS/ACR/ASNR/CNS/SAIP/SCAI/SIR/SNIS/SVM/SVS guideline on the management of patients with extracranial carotid and vertebral artery disease: executive summary // J. Neurointerv. — Surg. — 2011. — 3(2). — 100–130.
4. Collin C., Wade D.T., Davies S., Horne V. The Barthel ADL Index: a reliability study // Int. Disabil. Stud. — 1988. — 10. — 61–63.
5. Hacke W., Kaste M., Fieschi C., von Kummer R., Davalos A., Meier D., Larrue V., Bluhmki E., Davis S., Donnan G., Schneider D., Diez-Tejedor E., Trouillas P., for the Second European-Australasian Acute Stroke Study Investigators. Randomised double-blind placebo-controlled trial of thrombolytic therapy with intravenous alteplase in acute ischaemic stroke (ECASS II) // Lancet. — 1998. — 352. — 1245–1251.
6. Hayashi T., Abe K., Itoyama Y. Reduction of ischemic damage by application of vascular endothelial growth factor in rat brain after transient ischemia // J. Cereb. Blood Flow Metab. — 1998. — 18(8). — 887–895.
7. Hermann D.M., Zechariah A. Implications of vascular endothelial growth factor for postischemic neurovascular remodeling // J. Cereb. Blood Flow Metab. — 2009. — 29. — 1620–1643.
8. Lo E.H. A new penumbra: transitioning from injury into repair after stroke // Nat. Med. — 2008. — 14. — 497–500.
9. Luo Y., Wang Z., Li J., Xu Y. Serum CRP concentrations and severity of ischemic stroke subtypes // Can. J. Neurol. Sci. — 2012. — 39(1). — 69–73.
10. Luque A., Carpizo D.R., Iruela-Arispe M.L. ADAMTS1/METH1 inhibits endothelial cell proliferation by direct binding and sequestration of VEGF165 // J. Biol. Chem. — 2003. — 278. — 23656–23665.
11. Lyden P.D., Lu M., Levine S., Brott T.G., Broderick J. A modified National Institutes of Health stroke scale for use in stroke clinical trials. Preliminary reliability and validity // Stroke. — 2001. — 32. — 1310–1317.
12. Merrill M.J., Oldfield E.H. A reassessment of vascular endothelial growth factor in central nervous system pathology // J. Neurosurg. — 2005. — 103(5). — 853–868.
13. Orecchia A., Lacal P.M., Schietroma C. et al. Vascular endothelial growth factor receptor-1 is deposited in the extracellular matrix by endothelial cells and is a ligand for the alpha 5 beta 1 integrin // J. Cell. Sci. — 2003. — 116. — 3479–3489.
14. Sacks D.B., Arnold M., Bakris G.L., Bruns D.E., Horvath A.R., Kirkman M.S, Lernmark A., Metzger B.E., Nathan D.M. Guidelines and recommendations for laboratory analysis in the diagnosis and management of diabetes mellitus // Clin. Chem. — 2011. — 57(6). — 1–47.
15. Sun Y., Jin K., Xie L., Childs J., Mao X.O., Logvinova A., Greenberg D.A. VEGF-induced neuroprotection, neurogenesis, and angiogenesis after focal cerebral ischemia // J. Clin. Invest. — 2003. — 111. — 1843–1851.
16. Testa U., Pannitteri G., Condorelli G.L. Vascular endothelial growth factors in cardiovascular medicine // J. Cardiovasc. Med. — 2008. — 9. — 1190–1221.
17. Williams S.V., Fihn S.D., Gibbons R.J. American College of Cardiology; American Heart Association; American College of Physicians-American Society of Internal Medicine. Guidelines for the management of patients with chronic stable angina: diagnosis and risk stratification // Ann. Intern. Med. — 2001. — 135(7). — 530–547.
18. Zhao H., Bao X.J., Wang R.Z., Li G.L., Gao J., Ma S.H., Wei J.J., Feng M., Zhao Y.J., Ma W.B., Yang Y., Li Y.N., Kong Y.G. Postacute ischemia vascular endothelial growth factor transfer by transferrin-targeted liposomes attenuates ischemic brain injury after experimental stroke in rats // Hum. Gene Ther. — 2011. — 22. — 207–215.

/126/126.jpg)
/127/127.jpg)
/129/129.jpg)