Журнал «Медицина неотложных состояний» 6 (61) 2014
Вернуться к номеру
Оптимизация профилактики венозных тромбоэмболических осложнений в оперативной онкопульмонологии
Авторы: Черний В.И., Смирнова Н.Н., Егоров А.А., Егоров А.Н., Босько И.Л. - Донецкий национальный медицинский университет им. М. Горького, кафедра анестезиологии, интенсивной терапии, медицины неотложных состояний и кардиохирургии Учебно-научного института последипломного образования; Донецкое областное клиническое территориальное медицинское объединение,
отделение анестезиологии и интенсивной терапии (без коек)
Рубрики: Медицина неотложных состояний, Хирургия, Онкология
Разделы: Клинические исследования
Версия для печати
В статье изучается влияние операции и анестезии, низкомолекулярных гепаринов и транексамовой кислоты на XIIа-зависимый фибринолиз, анти-Ха-активность плазмы крови, активность антитромбина III и системы протеина С у онкопульмонологических больных. На основании полученных данных и международных рекомендаций предлагается методика тромбопрофилактики при торакотомии, сочетающая достаточную эффективность и минимальный риск повышенной интраоперационной кровоточивости.
У статті вивчається вплив операції й анестезії, низькомолекулярних гепаринів і транексамової кислоти на XІІа-залежний фібриноліз, анти-Ха-активність плазми крові, активність антитромбіну III і системи протеїну С у онкопульмонологічних хворих. На підставі отриманих даних і міжнародних рекомендацій пропонується методика тромбопрофілактики при торакотомії, що поєднує достатню ефективність і мінімальний ризик підвищеної інтраопераційної кровоточивості.
The article examines the impact of surgery and anesthesia, low molecular weight heparins and tranexamic acid on XIIa-dependent fibrinolysis, anti-Xa activity of blood plasma, the activity of antithrombin III and protein C system in oncopulmonological patients. Based on the findings and international guidelines, the technique of thromboprophylaxis during thoracotomy, combining sufficient efficacy and minimal risk of increased intraoperative bleeding, is proposed.
фибринолиз, транексамовая кислота, низкомолекулярный гепарин, оперативная онкопульмонология.
фібриноліз, транексамова кислота, низькомолекулярний гепарин, оперативна онкопульмонологія.
fibrinolysis, tranexamic acid, low molecular weight heparin, operative oncopulmonology.
Статья опубликована на с. 93-97
Введение
По данным Министерства здравоохранения Украины, при отсутствии профилактики частота объективно подтвержденного госпитального тромбоза глубоких вен достигает 40 % в общей хирургии и 60 % в ортопедии. Около четверти тромбов глубоких вен являются опасными как причина тромбоэмболии легочной артерии, которая, в свою очередь, является причиной до 10 % летальных случаев в хирургических стационарах [1].
В Национальных руководствах по тромбопрофилактике Украины, Западной Европы и США профилактика венозного тромбоэмболизма (ВТЭ) при торакальных операциях рассматривается отдельно. Уменьшение объема легких при лоб- или пульмонэктомии, травматизация крупных сосудов малого круга кровообращения, применение диатермокоагуляции, нередко злокачественный характер основного заболевания, как правило, немолодой возраст больных и наличие хронических сопутствующих заболеваний ведут к повышению риска тромботических осложнений.
При торакальных операциях, согласно приказу № 329 МЗ Украины, рекомендовано начинать профилактику венозного тромбоэмболизма за 2 часа до операции средними профилактическими дозами низкомолекулярных гепаринов (НМГ) с последующим переходом через 8–12 часов после операции на высокие дозы [1].
Согласно рекомендациям Национального института здоровья и качества клинической помощи в Англии и Уэльсе (NICE), профилактика ВТЭ у больных, которым предстоит гинекологическая, урологическая или торакальная операция, начинается сразу после поступления в стационар с механических методов. В дальнейшем при низком риске кровотечений добавляются фармакологические методы [2].
Коллектив авторов Американского колледжа торакальных врачей (АССР) у больных со средним риском венозного тромбоэмболизма, которым предстоит торакальная операция, рекомендует применение нефракционированного или низкомолекулярного гепарина либо перемежающуюся пневматическую компрессию нижних конечностей. У больных с высоким риском венозного тромбоэмболизма и низким риском кровотечения рекомендовано сочетанное применение гепарина и механических методов профилактики, таких как перемежающаяся пневматическая компрессия и эластичные чулки. У пациентов с высоким риском развития кровотечения должны быть использованы механические методы до тех пор, пока снижение риска кровотечения позволит применить фармакологические методы [3].
Таким образом, на сегодняшний день у клиницистов нет единого мнения по поводу времени начала тромбопрофилактики у пациентов онкопульмонологического профиля, дозы и режима введения нефракционированного гепарина либо НМГ, а также методов снижения риска возникновения спровоцированной ими повышенной интраоперационной кровоточивости.
Одним из направлений уменьшения интраоперационной кровоточивости, в том числе на фоне фармакологической профилактики венозного тромбоэмболизма НМГ, является применение в качестве ингибитора фибринолиза транексамовой кислоты [4].
Целью данной работы была оптимизация методики тромбопрофилактики в оперативной онкопульмонологии на основании отечественных и зарубежных рекомендаций, а также собственных исследований.
Материалы и методы
В течение 2012–2013 гг. было обследовано 54 пациента в возрасте от 26 до 79 лет II–III функционального класса по ASA, которым были произведены торакотомии по поводу опухолей легкого, объем вмешательства — от энуклеации или атипичной резекции доли легкого до пульмонэктомии.
Общая анестезия при торакотомии осуществлялась по общепринятой методике ингаляционной анестезии севофлюраном либо тотальной внутривенной анестезии пропофолом с применением эндобронхиальной двухпросветной интубации и искусственной однолегочной вентиляции.
В первую группу вошли пациенты (21 чел.) с умеренным и высоким риском развития ВТЭ (по Caprini еt al.), которым проводилась механическая (эластичное бинтование нижних конечностей) и фармакологическая профилактика ВТЭ (низкими (2500 МЕ) или высокими (3500 МЕ) профилактическими дозами бемипарина натрия). НМГ вводились за 12 часов до операции, в дальнейшем — 1 раз в 24 часа до полного восстановления двигательной активности больного (обычно 3–5 дней).
Во вторую группу вошли пациенты (18 чел.) с умеренным и высоким риском развития ВТЭ (по Caprini еt al.), которым проводилась механическая (эластичное бинтование нижних конечностей) и фармакологическая профилактика ВТЭ (низкими или высокими профилактическими дозами бемипарина натрия). НМГ вводились за 12 часов до операции, как и в первой группе. Наряду с этим за 30 мин до операции вводился препарат транексамовой кислоты (транексам) 10 мг/кг внутривенно однократно с целью уменьшения интраоперационной кровопотери.
Контрольную группу составили 15 человек I–II класса по ASA с низким и умеренным риском развития ВТЭ, которым проводилась только механическая профилактика.
Кровь для анализа забирали из локтевой вены в стандартный вакутейнер с цитратом натрия. 1-й раз — в палате (перед введением транексамовой кислоты и отправкой больного в операционную), 2-й раз — по окончании операции на операционном столе.
XIIа-калликреин-зависимый фибринолиз определялся при помощи набора «Фибринолиз-тест» предприятия «Технология-Стандарт» (г. Барнаул, Российская Федерация), анти-Ха-активность гепарина — коагулогическим методом при помощи набора реагентов «Реаклот-гепарин-тест» НПО «Ренам» (Российская Федерация), активность антитромбина III в плазме крови человека — по U. Abildgaard при помощи набора реагентов «Реаклот-АТ III» НПО «Ренам», активность системы протеина С плазмы крови — «Протеин С-тест» НПО «Ренам».
Статистический анализ данных проводился при помощи программы MedStat [5].
Результаты и их обсуждение
Изменения, происходящие с анти-Ха-активностью гепарина плазмы крови у пациентов под действием торакотомии, резекции легкого и общей анестезии, были изучены у пациентов контрольной группы, которым не проводилась фармакологическая профилактика ВТЭ при помощи НМГ. Результаты представлены на рис. 1.
/94/94.jpg)
Происходит выраженное, статистически значимое снижение анти-Ха-активности гепарина плазмы крови под действием операционной травмы, усиленного тромбообразования с последующим истощением антикоагулянтного звена системы гемостаза. Это указывает на напряжение в условиях операционной травмы как в свертывающей, так и в противосвертывающей системах организма больных. Эти данные показывают, что оптимальным является дооперационный старт фармакологической тромбопрофилактики.
В наших предыдущих публикациях уже доказывались преимущества предоперационного старта фармакологической тромбопрофилактики НМГ за 12 часов до операции — отсутствие повышенной интраоперационной кровоточивости и гематом в области послеоперационной раны при статистически достоверном повышениии анти-Ха-активности гепарина плазмы крови до профилактического уровня — 0,1–0,3 Ед/мл — во время оперативного лечения [6]. Поэтому такая же схема применения НМГ была использована и у пациентов исследуемых групп.
Также в контрольной группе исследовалась скорость XIIа-зависимого фибринолиза до и во время операции. Было выявлено исходное достоверное удлинение времени XIIа-зависимого фибринолиза у данного контингента больных в сравнении с референтными значениями (240–600 с), что, по литературным данным, наблюдается в состоянии предтромбоза [7]. Это еще раз доказывает преимущество предоперационного старта фармакологической тромбопрофилактики. Под действием операционной травмы время фибринолиза статистически значимо снижалось. Полученные результаты иллюстрирует рис. 2.
Таким образом, торакотомия с резекцией легкого в состоянии общей анестезии приводит к одновременному снижению анти-Ха-активности гепарина и укорочению времени XIIа-зависимого фибринолиза плазмы крови пациентов (усилению активности фибринолитической системы).
Исходя из этих данных, а также учитывая, что одним из направлений уменьшения интраоперационной кровоточивости является применение в качестве ингибитора фибринолиза транексамовой кислоты, можно сделать вывод о целесообразности одновременного применения НМГ и транексамовой кислоты в оперативной пульмонологии.
При исследовании времени XIIа-зависимого фибринолиза плазмы крови у пациентов, получавших НМГ за 12 ч до операции, наблюдалось укорочение времени фибринолиза с возвратом показателей к норме (240–600 с) в сравнении с пациентами, не получавшими НМГ (рис. 2, 3). Это можно объяснить тем, что гепарин через систему активированного протеина С косвенно стимулирует фибринолиз за счет подавления продукции эндотелиальными клетками ингибитора активатора плазминогена-1 посредством механизма обратной связи, образует комплексы с плазмином, фибриногеном и адреналином, которые оказывают фибринолитическое действие [8]. Видимо, таким же свойством обладают и НМГ. При этом действие операционной травмы не приводило к дальнейшему укорочению времени XIIа-зависимого фибринолиза, как у больных, не получавших НМГ перед операцией.
У пациентов группы 2, получавших одновременно НМГ и транексамовую кислоту, время XIIа-зависимого фибринолиза существенно не отличалось от такового у пациентов группы 1, однако сразу после операции наблюдалось достоверное снижение фибринолитической активности (удлинение времени фибринолиза) по сравнению с дооперационным уровнем (рис. 3).
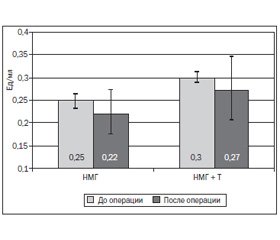
Таким образом, НМГ не влияют на эффективность транексамовой кислоты. Для того чтобы выяснить влияние транексамовой кислоты на эффективность НМГ, была исследована анти-Ха-активность гепарина плазмы крови у пациентов исследуемых групп (рис. 4).
/96/96.jpg)
Как видно из рис. 4, применение транексамовой кислоты не приводит к снижению эффективности НМГ. Значения анти-Ха-активности гепарина плазмы крови у пациентов остаются в пределах профилактического диапазона (0,1–0,3 Ед/мл) в течение оперативного вмешательства. Снижение анти-Ха-активности после операции у пациентов обеих групп в сравнении с исходным уровнем объясняется временным фактором — прошло больше времени с момента введения.
Чтобы более полно исследовать возможное влияние совместного применения НМГ и транексамовой кислоты на антикоагулянтный потенциал системы гемостаза, была исследована активность антитромбина III и системы протеина С.
Исходя из данных, представленных на рис. 5, можно сделать вывод, что транексамовая кислота на фоне действия НМГ не приводит к снижению активности антитромбина III. Напротив, отсутствует наблюдаемое у пациентов, получавших только НМГ, достоверное снижение активности антитромбина III по окончании операции. Возможно, это объясняется тем, что уменьшается расход антитромбина III на ингибирование плазминогена, поскольку фибринолитическая активность снижается под действием транексамовой кислоты [9].
Аналогичная картина получена при исследовании влияния транексамовой кислоты на фоне действия НМГ на систему протеина С: отсутствие достоверного снижения активности системы протеина С по окончании операции у пациентов, получавших НМГ и транексамовую кислоту, и наличие такового у пациентов группы 1 (рис. 6). Возможно, это объясняется противовоспалительным действием транексамовой кислоты, что приводит к меньшему напряжению в системе протеина С под действием операционной травмы [9].
Объяснение механизмов влияния транексамовой кислоты на антитромбин III и систему протеина С требует более глубоких исследований. Однако с уверенностью можно сказать, что на фоне действия НМГ транексамовая кислота не приводит к снижению их активности.
В настоящее время в отделении анестезиологии Донецкого областного клинического территориального медицинского объединения введен протокол тромбопрофилактики при плановых операциях на легких на основе оценки риска и рекомендаций Джозефа Каприни и соавторов [10], а также приказа № 329 МЗ Украины и собственных исследований, приведенных выше. Он представлен в табл. 1.
В Украине фирмой Nikopharm выпускается препарат гемаксам, 1 мл раствора которого содержит 50 мг транексамовой кислоты. Препарат успешно применяется наряду с транексамом.
Выводы
1. У больных раком легкого наблюдается исходное ослабление фибринолитической активности плазмы крови.
2. У пациентов, подвергающихся резекции легкого, наблюдаются снижение анти-Ха-активности гепарина и укорочение времени XIIа-зависимого фибринолиза плазмы крови по сравнению с исходным уровнем.
3. Применение бемипарина натрия за 12 ч до операции приводит к интраоперационному повышению анти-Ха-активности гепарина до профилактического уровня и нормализации фибринолитической активности плазмы крови.
4. Применение транексамовой кислоты на фоне действия бемипарина натрия увеличивает время XIIа-зависимого фибринолиза во время резекции легкого по сравнению с дооперационным уровнем.
5. Применение транексамовой кислоты на фоне действия бемипарина натрия при резекции легкого не снижает антикоагулянтный потенциал системы гемостаза, поскольку не приводит к снижению анти-Ха-активности, активности ситемы протеина С и активности антитромбина III.
6. Одновременное применение бемипарина натрия и транексамовой кислоты не приводит к взаимному снижению эффективности и может быть использовано в схеме тромбопрофилактики у больных с повышенным риском интраоперационного кровотечения.
1. Наказ МОЗ України від 15.06.2007 № 329.
2. National Institute for Health and Clinical Excellence [электронный ресурс]. — Режим доступа: http://www.nice.org.uk/nicemedia/live/12695/47195/47195.pdf / Название с экрана (дата обращения: 10.04.2014).
3. The Ninth ACCP conference on antithrombolytic and thrombolytic therapy // CHEST. — 2012. — 141(2)(Suppl). — 7S-47S.
4. Henry D.A., Carless P.A., Moxey A.J., O’Connell D., Stokes B.J., Fergusson D.A., Ker K. Anti-fibrinolytic use for minimising perioperative allogeneic blood transfusion / Cochrane Database of Systematic Reviews 2011. — Issue 3.
5. Лях Ю.Е., Гурьянов В.Г., Хоменко В.Н., Панченко О.А. Основы компьютерной биостатистики: анализ информации в биологии, медицине и фармации статистическим пакетом MedStat. — Донецк: Издатель Папакица Е.К., 2006.
6. Черний В.И., Смирнова Н.Н., Егоров А.А., Егорова В.В., Ступаченко Д.О., Пащенко А.А., Босько И.Л. Применение бемипарина натрия для профилактики венозного тромбоэмболизма в оперативной онкопульмонологии // Біль, знеболювання i інтенсивна терапія. — 2012. — № 1-д. — С. 558-561.
7. Долгов В.В., Свирин П.В. Лабораторная диагностика нарушений гемостаза. — М.; Тверь: Триада, 2005. — 227 с.
8. Третьякова О.С. Физиология и патология гемостаза // Дитячий лікар. — 2010. — № 3. — С. 51-61.
9. Васильев С.А., Виноградов В.Л., Гемджян Э.Г. Транексам — антифибринолитический гемостатик // Тромбоз, гемостаз и реология. — 2008. — № 1. — С. 28-34.
10. Caprini J.A. Thrombotic Risk Assessment: A Hybrid Approach [электронный ресурс]. — Режим доступа: http://www.venousdisease.com/Publications / J.A. Caprini-Hybrid Approach 3-10-05.pdf (дата обращения: 20.11.13).

/95/95.jpg)
/96/96_2.jpg)
/96/96_3.jpg)