Журнал «Медицина неотложных состояний» 6 (61) 2014
Вернуться к номеру
Оцінка нутритивного статусу й енергопотреби в дітей у критичних станах
Авторы: Міщук В.Р. - Львівський національний медичний університет імені Данила Галицького
Рубрики: Медицина неотложных состояний
Разделы: Справочник специалиста
Версия для печати
У статті розглянуто питання оцінки нутритивного статусу й енергетичних потреб у тяжкохворих дітей. Проаналізовані сучасні рекомендації щодо оцінки антропометричних даних дітей різних вікових груп, а також інформативність лабораторних методів діагностики нутритивної недостатності. Наголошено на важливості коректного визначення енергетичних потреб у критично хворих дітей. Найбільш точним методом, що дає змогу оцінити потреби в енергії, а також адекватність її використання, є непряма калориметрія.
В статье рассмотрены вопросы оценки нутритивного статуса и энергетических потребностей у тяжелобольных детей. Проанализированы современные рекомендации по оценке антропометрических данных детей разных возрастных групп, а также информативность лабораторных методов диагностики нутритивной недостаточности. Подчеркнута важность корректного определения энергетических потребностей у критически больных детей. Наиболее точным методом, который позволяет оценить потребности в энергии, а также адекватность ее использования, является непрямая калориметрия.
This article describes the estimation of nutritional status and energy requirements in critically ill children. There are analyzed the current recommendations for assessment of the anthropometric data of children of different age groups as well as comprehension of laboratory methods for diagnosis of nutritional deficiency. There has been emphasized the importance of the correct determination of energy requirements in critically-ill children. The most accurate method that allows estimate energy requirements and the adequacy of its use is indirect calorimetry.
нутритивний статус, непряма калориметрія, енергетичні потреби.
нутритивный статус, непрямая калориметрия, энергетические потребности.
nutritional status, indirect calorimetry, energy requirements.
Статья опубликована на с. 193-197
Недостатність живлення у госпіталізованих дітей асоціюється із збільшенням фізіологічної нестабільності, зростанням частоти інфекційних ускладнень, порушенням репаративних процесів, зростанням летальності та тривалості госпіталізації [1, 3, 5]. Згідно з даними керівництва щодо нутритивної підтримки (НП) ASPEN (2009), поширення недостатності живлення серед тяжкохворих дітей залишається практично незмінним протягом останніх двох десятиріч [3]. Цей факт свідчить про невирішеність багатьох питань, що стосуються нутритивної підтримки педіатричних пацієнтів, і потребу в проведенні високоякісних мультицентрових досліджень у цьому напрямку. У той же час вказується на неприпустимість екстраполяції результатів досліджень у дорослих на дитячу популяцію пацієнтів у зв’язку з відсутністю доказової бази щодо ефективності і безпечності багатьох із них у дітей [3].
На сьогодні не підлягає сумніву потреба адекватного живлення критично хворих пацієнтів. Однак успішна реалізація цього завдання потребує врахування багатьох взаємопов’язаних факторів, серед яких першочерговими є оцінка нутритивного статусу пацієнта при надходженні у відділення інтенсивної терапії (ВІТ) і розробка плану нутритивної підтримки. Оскільки у пацієнтів, які знаходяться у критичному стані, відмічається глибока і стереотипна метаболічна відповідь, що обумовлена синдромом гіперметаболізму–гіперкатаболізму, розрахунок енергетичних потреб є визначальним для подальшої реалізації НП [3].
Важливість оцінки нутритивного статусу пацієнта при надходженні у ВІТ обумовлена потребою в суттєвій корекції енергетичних розрахунків, і недооцінка останнього чинника часто призводить до неможливості досягнення цілей НП.
Ряд проспективних когортних досліджень і ретроспективний аналіз повідомили про нездатність досягти добової цільової калорійності у тяжкохворих дітей [3]. У дослідженні, що вивчало ендокринні та метаболічні реакції дітей з менінгококовим сепсисом, мета харчування була досягнута тільки у 25 % випадків [2]. Аналогічні спостереження були зроблені у 95 дітей у відділенні інтенсивної терапії, де пацієнти отримали в середньому 58,8 % оцінюваних потреб в енергії. В іншому огляді оцінювалась нутритивна підтримка у 42 хворих у педіатричному ВІТ, при цьому порівнювалось фактичне споживання енергії з оціночними енергетичними потребами. Тільки 50 % хворих отримали повну розраховану потребу в енергії, в середньому через 7 днів перебування у ВІТ [7, 8].
Згідно з керівництвом щодо нутритивної підтримки у критично хворих дітей ASPEN (2009), діти у критичному стані, які надходили у ВІТ, повинні бути оцінені на предмет мальнутриції чи нутритивного ризику (D). Оцінка нутритивного статусу дитини базується на антропометричних, лабораторних даних і клінічному обстеженні [3]. Слід зауважити, що на відміну від дорослих діти різних вікових груп демонструють різні за інтенсивністю темпи росту та метаболізму. Зокрема, найвищі темпи росту спостерігаються в перші місяці життя, причому лінійний приріст росту в цей період становить 4 см на 1 кг маси тіла. Після цього швидкість росту зменшується до нового сплеску в пубертатному віці [1]. Також відрізняється розвиток різних органів і систем. Зокрема, мозок і окружність голови головним чином ростуть протягом перших двох років, і окружність голови досягає в цей час 80 % від показників дорослих. Тому інтерпретація антропометричних даних дітей є складною і потребує використання певних референсних даних, що базуються на дослідженні популяції цієї вікової групи. Серед антропометричних даних, що рекомендуються для оцінки нутритивного статусу, використовують значення маси тіла, зросту, відношення маси тіла до зросту, індекс маси тіла, товщину жирової складки над трицепсом, кружність середини плеча.
Найбільш уніфікованими антропометричними критеріями оцінки нутритивного статусу дітей до 3 років є норми зросту, розроблені Всесвітньою організацією охорони здоров’я (ВООЗ) у 2006 році. Ці норми ґрунтуються на результатах багатоцентрового дослідження показників фізичного розвитку 8440 дітей у 6 країнах світу з 1997 по 2003 рік [1]. Ці норми наведені у вигляді графіків референсних значень, з якими порівнюються певні антропометричні показники конкретного пацієнта. За схожим принципом побудовані референсні показники розвитку дітей, що розроблені центрами з контролю і профілактики захворювань CDC (США) та Euro-Growth (Євросоюз), які були впроваджені у 2000 році і можуть використовуватись для оцінки антропометричних показників конкретного пацієнта [6].
Однак, за словами експерта ESPEN із дитячої нутриціології B. Koletzko, на сьогодні не існує єдиного універсального визначення нутритивної недостатності у дітей [6]. Найчастіше використовуються критерії, вказані в табл. 1.
Іншими варіантами нутритивної недостатності у дітей є виснаження і квашіоркор (табл. 2). Виснаження (marasmus) розвивається впродовж кількох тижнів або місяців і характеризується типовою зовнішністю, зумовленою втратою підшкірно-жирової клітковини. Діти з таким станом мають нормальні рівні альбуміну й інших транспортних білків у сироватці крові, набряки відсутні. Розміри печінки нормальні. На відміну від попереднього стану квашіоркор розвивається гостро, часто у зв’язку з інфекцією. Рівні сироваткового альбуміну й інших транспортних білків, а також лімфоцитів знижені. На тілі, обличчі та кінцівках з’являються набряки. У дітей зберігається жирова тканина, що маскує виснаження м’язів. Мають місце дерматит, зміни волосся, у тяжких випадках — жирова інфільтрація печінки. Наведені стани розвиваються після гострого стресу та супроводжуються високою летальністю [1, 6].
Слід зауважити, що більшість дослідників звертають увагу на необхідність інтерпретації антропометричних показників у критично хворих дітей у контексті інфузійної терапії, діуретичної терапії, наявності набряків тощо [3].
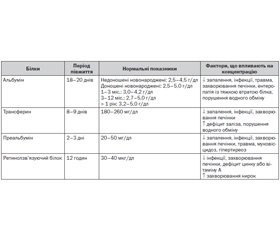
Із сироваткових білків для оцінки нутрітивного статусу найчастіше визначають альбуміни, трансферин, а також ретинолзв’язуючий білок (табл. 3). Альбумін, що має великий пул і досить тривалий період піврозпаду (14–20 днів), мало свідчить про безпосередній статус живлення. Незалежно від нутритивного стану концентрації сироваткового альбуміну можуть змінюватись після вливання донорського альбуміну, зневоднення, сепсису, травми, захворювань печінки. Таким чином, його надійність як маркера вісцерального протеїнового статусу викликає сумніви [3, 6].
Преальбумін (також відомий як транстиретин) є стійким циркулюючим глікопротеїном, що синтезується в печінці. Він названий так за своєю близькістю до альбуміну на електрофоретичній смузі і має період піврозпаду 24–48 год. Концентрація преальбуміну в сироватці зменшується при захворюваннях печінки і може бути підвищеною при нирковій недостатності. Преальбумін може визначатись у більшості клінік і є гарним маркером пулу вісцерального білка [1, 6]. Однак, як і альбумін, преальбумін не завжди точно відображає стан нутритивного статусу і відповідь на нутрітивну підтримку під час гострої запальної реакції. Зокрема, у дітей з опіковою травмою рівень сироваткових гострофазових білків піднімається протягом 12–24 годин стресу через зміни пріоритетів печінкового білкового синтезу у відповідь на пошкодження. Це зростання пропорційне тяжкості травми. При періодичному вимірюванні сироваткової концентрації преальбуміну і С-реактивного білка (СРБ) можна виявити їх обернену залежність. Так, концентрація сироваткового преальбуміну зменшується, а СРБ зростає пропорційно величині травми чи стресової реакції і повертається до норми після закінчення гострої стадії захворювання. Таким чином, визначення рівня СРБ у тяжких хворих може допомогти визначити, чим спричинений низький рівень сироваткових білків — стресом чи дефіцитом у харчуванні [3].
Одним із лабораторних маркерів нутритивної недостатності, що також характеризує імунологічний статус, є загальна кількість лімфоцитів (ЗКЛ). Цей показник імунної функції є найбільш доступним для госпіталізованих пацієнтів. Його можна обчислити на основі кількості лейкоцитів (КЛ) за формулою: КЛ/мм3 х % лімфоцитів = ЗКЛ/мм3. Величина цього показника менше 1500 асоціюється з нутритивною недостатністю. У немовлят віком до 3 міс. відхиленням від норми вважають показник менше 2500. Незалежно від нутритивного статусу показники імунологічної функції можуть змінюватись при травмі, хіміотерапії, застосуванні імуносупресантів. Деякі дослідження засвідчили, що ЗКЛ є не надто інформативним маркером через низьку чутливість і специфічність [1].
Щодо розрахунку енергетичних витрат, то згідно з керівництвом щодо нутритивної підтримки у критично хворих дітей ASPEN (2009), у критично хворих дітей витрати енергії повинні оцінюватись протягом усього часу захворювання. Оцінка енергетичних витрат щодо використання стандартних рівнянь є часто ненадійною (D). У підгрупі пацієнтів із підозрою на метаболічні порушення чи нутритивну недостатність є бажаним використання непрямої калориметрії (НК). Коли застосування НК є неможливим або недоступним, стартові розрахунки в енергії можуть базуватись на опублікованих формулах і номограмах (Е) [3].
Для розрахунку загальних енергетичних витрат (total energy expenditure — TEE) використовують суму базального енергетичного обміну (basal metabolic rate — BMR), енергетичних витрат на засвоєння їжі, фізичну активність (ФА) і ріст. BMR передбачає такі умови: стан натще 10–12 годин, пацієнт після сну, пацієнт лежить, нормальна температура тіла і навколишнього середовища, відсутність психічного і фізичного стресу. У клініці часто використовуються енергетичні витрати у стані спокою (resting energy expenditure — REE). RЕЕ може включати термогенез недавно спожитої їжі і відрізняється від BMR не більше ніж на 10 %. RЕЕ може підвищуватись при патологічних станах, таких як запалення, гарячка, хронічні хвороби (серцеві, легеневі та ін.), чи зменшуватись відповідно до низького надходження енергії [1, 6].
Фактор фізичної активності — кількість енергії, що витрачається на щоденні рухи і фізичну активність. У старших дітей фактор активності знаходиться у великій пропорційній залежності від загальних витрат енергії. У госпіталізованих дітей на ліжковому режимі він зменшується. Щоб розрахувати потреби дітей відповідно до активності, були прийняті різноманітні метаболічні константи (Енергетичні потреби = REE х ФА). Загалом у пацієнтів ВІТ фактор активності становить 1,1 або 1,2 [1, 5].
Енергетичні потреби залежать від прискореного росту і становлять 30–50 % від усієї спожитої енергії у вчасно народжених немовлят і є ще більшими у недоношених. Діти, які відновлюються після білково-енергетичного голодування, потребують більше калорій, щоб скоригувати їх дефіцит росту (вага, зріст). У таких випадках енергетичні потреби розраховують, базуючись на 50-й перцентилі ваги і зросту для конкретного віку, переважно на вагу. Ця відмінність має зумовити призначення більшої кількості калорій (понад добову потребу), щоб досягнути усунення затримки росту. Як альтернатива розрахунок може базуватись на фактичній вазі, збільшеній в 1,2–1,5 або навіть у 1,5–2,0 раза у тяжких випадках недостатності травлення, щоб забезпечити більше калорій, необхідних для дітей із затримкою росту. Крім того, калораж має бути встановлений відповідно до прибавки зросту і ваги [5].
Для визначення REE можуть бути використані метод непрямої калориметрії, спеціалізовані формули, а також таблиці референсних даних.
Більшість експертів вважають, що для пацієнтів у ВІТ найкращим способом встановити енергетичні потреби є вимірювання REE за допомого непрямої калориметрії [1, 3, 5]. При НК визначають споживання кисню (VO2) й утворення вуглекислого газу (VСO2). НК може бути виконана у пацієнта на спонтанному диханні, а також у хворих на штучній вентиляції легень (ШВЛ). НК дає два важливі блоки інформації: REE та визначення використання субстрату, що відображає респіраторний коефіцієнт (RQ). За скороченим рівнянням Weir REE обчислюють так: REE (ккал/хв) = 3,94 х VO2 + 1,11 х VСO2 [1, 4].
Респіраторний коефіцієнт обчислюють як відношення утвореного СO2 до використаного O2 (RQ = VСO2 /VO2). У нормі RQ знаходиться в межах 1,0–0,85. RQ дає змогу визначити, як організм використовує «пальне». Окислення глюкози асоціюється з RQ близько 1,0. При окисленні жиру цей показник становить 0,7. У випадку перегодовування пацієнта, що супроводжується ліпогенезом, RQ буде мати значення > 1,0, тоді як у випадку недостатнього харчування RQ буде менше від 0,85 [1, 4]. Окрім того, за допомогою показників непрямої калориметрії може бути обчислений серцевий викид методом Фіка, що важливо для хворих у критичному стані. На медичному ринку представлені як окремі метаболографи (ССМ Express. Medgraphics USA), так і приліжкові реанімаційні монітори з опцією метаболічного моніторингу (МПР6-03.Triton. Росія).
Якщо говорити про розроблені формули для розрахунку BMR, REE, TTE, то на даний час найбільше використовуються рівняння ВООЗ (WHO), Гарріса — Бенедикта (Н-В), Schofield [1, 5, 6].
Ряд досліджень, проведених нещодавно, підтвердили, що рутинне використання формул веде до неадекватної оцінки BMR, REE у різних вікових групах. Duroetal встановили, що формули WHO та Schofield недооцінюють BMR у здорових дітей < 3 років. Thompsonetal оцінювали енергетичні потреби у здорових дітей і встановили, що всі формули переоцінюють REE. Найгіршою оцінкою у цій віковій групі була формула Н-В. Ці формули є особливо неадекватними у дітей із порушенням росту і будови тіла. У випадках недостатнього приросту маси тіла рівняння Schofield найкраще визначало BMR. Згідно з рекомендаціями ESPEN (2005), найадекватніша оцінка втрат енергії у дітей може визначатися за допомогою формул Schofield [5] (табл. 4).
Усі вищезгадані формули розроблені на основі вивчення популяції здорових дітей і мають використовуватись із пересторогою при різноманітних захворюваннях і супутніх розладах травлення, оскільки вони неточно відображають реальний рівень BMR. Це створює передумови до недогодовування або перегодовування тяжкохворих дітей під час перебування у ВІТ, що асоціюється з погіршенням результату у кожному випадку [3]. У той час як проблеми, пов’язані з недогодовуванням, були добре задокументовані, перегодовування також може мати виражені негативні наслідки. Зокрема, це призводить до збільшення роботи дихання за рахунок збільшення продукції СО2 і потенційно може подовжити потребу в ШВЛ. Перегодовування може погіршувати функцію печінки, викликаючи стеатоз і холестаз, а також збільшувати ризик інфекційних ускладнень вторинно до гіперглікемії. Гіперглікемія, пов’язана з надлишковою калорійністю, асоціюється з пролонгуванням ШВЛ і збільшенням госпіталізації у ВІТ [3]. Загалом оцінювання енергетичної потреби повинні аналізуватися в динаміці захворювання і регулярно переглядатись у тяжкохворих дітей [3].
Щодо референсних значень, то середні добові потреби в енергії для парентерального харчування, що були адекватними для більшості пацієнтів, за рекомендаціями ESPEN (2005) наведено в табл. 5 [5].
/197/197.jpg)
Потрібно звернути увагу, що окремі клінічні ситуації можуть суттєво змінювати енергетичні витрати пацієнтів у ВІТ. Так, ШВЛ у більшості випадків зменшує енергетичні витрати. Однак у період відлучення пацієнта від ШВЛ енергетичні витрати збільшуються [6]. У критично хворих дітей, які знаходяться на вентиляції, витрати енергії протягом дня є незмінними і одноразове 30-хвилинне вимірювання енергії може бути прийнятним. З іншого боку, міжденні варіації можуть бути великими [1, 6].
Ряд досліджень визначає, що більшість операцій, зокрема таких, як абдомінальні, не супроводжуються підвищенням ЕП. ВMR зростає через 2–4 години після операції і повертається до базових значень через 12–24 години. Збільшення рівня ВMR у післяопераційних пацієнтів чітко співвідноситься із тяжкістю оперативного втручання, він більший у недоношених дітей і у немовлят віком > 48 годин. Через те, що підвищення рівня ВMR є коротким щодо тривалості і включає тимчасові метаболічні зміни, немає потреби збільшувати прийом енергії у дітей, які мали неускладнені операції. Однак неадекватне знеболювання і психологічний дискомфорт можуть приводити до додаткових енергетичних витрат [5, 6].
У дітей із черепно-мозковою травмою було відмічено значне збільшення BMR. Витрати енергії дуже відрізнялися і були значно нижчими у дітей із поганим результатом. Нервово-м’язова блокада і гіпотермія зменшували їх до визначеного рівня [5].
Пацієнти з опіковою травмою демонструють екстремальний гіперметаболізм на ранніх стадіях захворювання. Goran et al. порівняли виміри BMR із передбачуваними за формулою Гарріса — Бенедикта і встановили, що потреби в енергії у 95 % пацієнтів приблизно є такими: ВMR x 2 [5].
У пацієнтів після трансплантації кісткового мозку виміряні показники енергетичних втрат виявились вірогідно нижчими, ніж вказують формули ВООЗ і Schofield [5].
На величину втрат енергії може суттєво впливати застосування фармакопрепаратів. Зокрема, застосування інотропів і вазопресорів збільшує енергетичні витрати; bблокатори, опіоїди, седативні препарати, нестероїдні протизапальні зменшуть витрати енергії.
Висновки
Попри доведену важливість НП у критично хворих дітей, багато аспектів цього питання потребують подальшого вивчення. Застосування стереотипного підходу до НП без урахування індивідуальних особливостей нутритивного статусу дитини, особливостей клінічного стану і перебігу захворювання можуть нівелювати зусилля клініцистів і мати можливі негативні ускладнення.
Найкращим методом оцінки REE тяжкохворих дітей є непряма калориметрія. Застосування цього методу метаболічного моніторингу в Україні з багатьох причин є малодоступним.
Для розрахунку REE використовуються формули ВООЗ і, особливо, Schofield для дітей < 10 років.
Для підрахунку загальних енергетичних витрат у пацієнтів ВІТ треба брати до уваги такі додаткові фактори: 1) стрес-фактор (1,5–1,8 — у пацієнтів з опіками, 1,3–1,5 — у хворих з травмою, сепсисом); 2) фактор активності (у критично хворих дітей 1,0–1,1); 3) фактор росту (у критично хворих дітей 1,0 — у гострій стадії, у період реконвалесценції — 1,1–1,4).
Пацієнти, які мають недостатню вагу і потребують відновлення ваги, можуть потребувати 130–150 % REE.
Під час розрахунку загальних енергетичних потреб слід брати до уваги наявність супутньої патології, ШВЛ, седації, аналгезії, інотропної підтримки. У сумнівних випадках за основу загальних енергетичних витрат слід брати REE.
1. Cамур П.К. Харчування в педіатрії / П.К. Самур, К. Кінг. — Львів: Медицина світу, 2012. — 537 с.
2. Acute stress response in children with meningococcal sepsis: important differences in the growth hormone/insulin-like growth factor I axis between nonsurvivors and survivors / De Groof F., Joosten K.F., Janssen J.A. [et al.] // J. Clin. Endocrinol. Metab. — 2002. — № 87. — P. 3118–3124.
3. A.S.P.E.N. Clinical Guidelines: Nutrition Support of the Critically Ill Child / N.M. Mehta, C. Compher and A.S.P.E.N. Board of Directors Journalof Parenteral and Enteral Nutrition. — 2009. — Vol. 33, № 3. — P. 260–276.
4. Clinical use of the respiratory quotient obtained from indirect calorimetry / S.A. McClave, C.C. Loven, M.J. Kleber [et al.] // J. Parenter. Enteral. Nutr. — 2003. — Vol. 1, № 27. — P. 21–26.
5. Guidelines on Paediatric Parenteral Nutrition of the European Society of Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN) and the European Society for Clinical Nutrition and Metabolism (ESPEN), Supported by the European Society of Paediatric Research (ESPR) / B. Koletzko, O. Goulet, J. Hunt [et al.] // J. Pediatr. Gastroenterol. Nutr. — 2005. — Vol. 41, Suppl. 2. — P. 1–87.
6. Koletzko B. Pediatric Nutrition in Practice / B. Koletzko. — Bazel: Karger, 2008. — 306 p.
7. Malnutrition in critically ill children: from admission to 6 months after discharge / Hulst J., Joosten K., Zimmermann L. [et al.] // Clin. Nutr. — 2004. — № 23. — P. 223–232.
8. Rogers E.J. Barriers to adequate nutrition in critically ill children / E.J. Rogers, H.R. Gilbertson, R.G. Heine, R. Henning // Nutrition. — 2003. — № 19. — P. 865–868.
9. Taylor R.M. Nutritional support in critically ill children / R.M. Taylor, V.R. Preedy // Clin. Nutr. — 2003. — № 22. — P. 365–369.

/194/194.jpg)
/195/195.jpg)
/196/196.jpg)