Журнал «Актуальная инфектология» 2 (3) 2014
Вернуться к номеру
Сучасні погляди на ротавірусну інфекцію у дітей: епідеміологічні та клініко-патогенетичні особливості
Авторы: Леженко Г.О., Усачова О.В., Тарасенко Н.В., Пашкова О.Є. — Запорізький державний медичний університет
Рубрики: Инфекционные заболевания
Разделы: Клинические исследования
Версия для печати
На підставі аналізу епідеміологічних, клінічних та лабораторних даних, що характеризують перебіг ротавірусної інфекції у дітей Запорізької області, наведені сучасні особливості хвороби. Відмічені динамічні зміни клініко-лабораторних показників лактазної недостатності, що мають місце на тлі ротавірусної інфекції в дітей раннього віку. Доведена ефективність застосування Saccharomyces boulardii в комплексному лікуванні дітей, хворих на ротавірусну інфекцію.
На основании анализа эпидемиологических, клинических и лабораторных данных, характеризующих течение ротавирусной инфекции у детей Запорожской области, приведены современные особенности заболевания. Отмечены динамические изменения клинико-лабораторных показателей лактазной недостаточности, которые имеют место при ротавирусной инфекции у детей раннего возраста. Показана эффективность применения Saccharomyces boulardii в комплексном лечении ротавирусной инфекции у детей.
Based on the analysis of epidemiological, clinical and laboratory data characterizing the course of rotavirus infection in children of Zaporizhya region, there are provided the modern features of the disease. The authors marked dynamic changes in clinical and laboratory parameters of lactase deficiency, which occur during rotavirus infection in infants. The efficiency of Saccharomyces boulardii in complex treatment of rotavirus infection in children is shown.
ротавірусна інфекція, діти, епідеміологія, клініка, патогенетичні особливості, лактазна недостатність, Saccharomyces boulardii.
ротавирусная инфекция, дети, эпидемиология, клиника, патогенетические особенности, лактазная недостаточность, Saccharomyces boulardii.
rotavirus infection, children, epidemiology, clinical picture, pathogenetic features, lactаse insufficiency, Saccharomyces boulardii.
Статья опубликована на с. 12-17
Ротавірусна інфекція (РВІ) займає особливе місце в структурі гострих кишкових інфекцій (ГКІ) (обумовлює 9–74 % усіх ГКІ в дітей) [1]. За даними ВООЗ, у світі щорічно реєструється до 125 млн випадків РВІ, 600–900 тис. з яких завершуються летально, що становить майже чверть серед хворих на діарею [2, 3]. Найвища летальність реєструється в країнах Південної Азії, Африки, Індії, Латинської Америки — 360 800 випадків, що становить 82 % від загального числа летальних випадків. За останні роки летальність від РВІ в розвинених країнах Європи, Північної Америки, в Австралії знижується, однак рівень захворюваності залишається досить високим [5]. Отже, РВІ є складною медико-соціальною проблемою для країн усього світу через значну поширеність, досить високі показники захворюваності і смертності, суттєві фінансові витрати в разі захворювання та наслідків [6].
У типових випадках клінічна картина РВІ характеризується гострим початком, лихоманкою, гастроентеритом, розвитком токсикозу з ексикозом на фоні осмотичної діареї, вторинною дисахаридазною недостатністю. Практично у всіх дітей відзначаються зміни в мікрофлорі кишечника (зниження індигенної мікрофлори, ріст умовно-патогенної флори), що значно погіршує клінічну симптоматику та сповільнює елімінацію ротавірусів [7].
Достеменно відомо, що NSP4-пептид ротавірусу є специфічним для ротавірусу ентеротоксином, здатним викликати секреторний тип діареї подібно до бактеріальних токсинів. Крім того, ентеротоксин NSP4 блокує функцію деяких транспортних протеїнів щіткової облямівки ентероцита [8]. Зокрема, за відсутності гістологічного пошкодження ротавірус викликає зниження активності SGLT1-опосередкованого симпорту Na+-D-глюкози, який проходить у щітковій облямівці кишкових ворсин і крипт. Через те, що SGLT1 підтримує реабсорбцію води у фізіологічних умовах, механізм ротавірусної інфекції включає загальне інгібування Na+-зв’язаних транспортних систем, а отже, і реабсорбції води. Було доведено, що NSP4 безпосередньо і практично миттєво інгібує SGLT1 в щітковій облямівці ентероцитів кролика [9].
Доведено, що вторинна дисахаридазна недостатність, яка має місце при РВІ, переважно обумовлена дефіцитом ферменту лактази-флоризингідролази, пов’язаного з апікальною поверхнею щіткової облямівки ентероцитів. У ранній період захворювання лактазна недостатність (ЛН) обумовлена не ротавірусіндукованою загибеллю ентероцитів, не порушенням синтезу ферменту, а пригніченням його вивільнення з ентероцитів, що спричиняється NSP4-ентеротоксином [10]. Виникнення дисахаридазної недостатності, переважно лактазної, веде до накопичення в товстій кишці нерозщеплених дисахаридів. У нижніх відділах тонкого й у товстому кишечнику відбувається зброджування лактози кишковою мікрофлорою з утворенням великої кількості водню та органічних кислот, рН кишкового вмісту зміщується в бік кислого середовища, що призводить до посилення перистальтики. Збільшення кишкового вмісту, великий об’єм газів та посилена перистальтика призводить до розвитку так званої бродильної діареї, що супроводжується болями в животі [11].
У Запорізькій області за останні роки рівень захворюваності РВІ перевищує такий по Україні в цілому та по деяких окремих регіонах і має тенденцію до зростання із 372,1 випадку на 100 тис. дитячого населення у 2007 році до 746,6 — у 2013 році. Проте сучасні регіональні дані стосовно епідеміологічних та клініко-патогенетичних особливостей перебігу ротавірусної інфекції в дітей раннього віку не з’ясовані.
Незважаючи на певний арсенал фармацевтичних препаратів, які використовуються для лікування ротавірусної інфекції, сьогодні залишається необхідність пошуку лікарських засобів, здатних поліпшити стан хворого і прискорити процес його одужання. Останніми роками в терапію ротавірусної інфекції міцно увійшли різні біологічні препарати, що є представниками нормальної мікрофлори кишечника людини або мають виборчу антагоністичну дію стосовно патогенних або умовно-патогенних мікроорганізмів [11]. На цьому тлі звертав на себе увагу препарат Ентерол 250® («Біокодекс», Франція). Препарат містить пробіотик природного походження, що самоелімінується, і лікувальні дріжджі Saccharomyces boulardii, виділені з тропічної рослини лічі (Індокитай). Пробіотик має пряму противірусну й протимікробну активність. Водночас для них характерний прямий мікробний антагонізм стосовно патогенних, умовно-патогенних мікроорганізмів та грибів, що порушують мікробіоценоз кишечника. Разом із тим Saccharomyces boulardii проявляють антитоксичну дію, що зумовлена продукцією протеаз, які розщеплюють токсини. Saccharomyces boulardii покращують трофіку слизової оболонки тонкого кишечника в результаті вивільнення сперміну та спермідину, регулюють внутрішньопросвітний рівень рН, підвищують активність травних ферментів, сприяють активації протиінфекційного захисту за рахунок посилення утворення секреторного IgА та секреторного компонента інших Ig в тонкому кишечнику. Заслуговують на увагу такі властивості Saccharomyces boulardii, як антисекреторний ефект (зменшення секреції води та солей), здійснюваний за допомогою зниження утворення цАМФ в ентероцитах, ферментативна активність, обумовлена підвищенням активності дисахаридаз тонкого кишечника (лактази, сахарази, мальтази) [12]. Після перорального прийому ліофілізовані Saccharomyces boulardii швидко досягають стабільного стану, не затримуються в кишечнику і виводяться з випорожненням протягом декількох днів.
Мета роботи: аналіз епідеміологічних і клініко-патогенетичних особливостей перебігу ротавірусної інфекції в дітей раннього віку, які живуть у м. Запоріжжі, та оцінка ефективності застосування Saccharomyces boulardii в комплексному лікуванні хворих на ротавірусну інфекцію.
Матеріали та методи дослідження
Для реалізації мети роботи було проведено вивчення епідеміологічних особливостей ротавірусної інфекції у дітей, які живуть у Запорізькій області. Аналіз епідеміологічних показників проведений за період 2007–2012 років.
Вивчення особливостей перебігу ротавірусної інфекції проведено на базі 5-ї дитячої багатопрофільної міської лікарні м. Запоріжжя, де за період з 01.12.2011 р. по 01.12.2012 р. на стаціонарному лікуванні з приводу РВІ перебувало 138 дітей віком до 3 років. Нами було проведено ретроспективний аналіз медичної документації 100 дітей раннього віку, які були госпіталізовані з приводу ГКІ неясної етіології. У всіх пацієнтів при обстеженні було лабораторно підтверджено ротавірусну етіологію захворювання. Під час аналізу враховували клініко-анамнестичні і лабораторні дані пацієнтів. У день госпіталізації всім дітям проводились загальноклінічні аналізи крові та сечі, біохімічний аналіз крові (рівень глюкози, загального білірубіну, креатиніну, сечовини, активність АлАТ), аналіз сечі на наявність кетонових тіл. Всім пацієнтам проводилася копроцитограма. Фекалії пацієнтів досліджували бактеріологічним методом на наявність Shigella, Salmonella, патогенних E.coli та умовно-патогенної флори кишечника. Антиген ротавірусу в калі виявляли за допомогою тест-систем Cito Test для експрес-діагностики (імунохроматографічний метод).
Також було проаналізовано наявність клініко-лабораторних ознак лактазної недостатності у 20 дітей віком від 1 до 18 міс., які знаходилися на грудному вигодовуванні, у динаміці базисної терапії РВІ. Критеріями відбору до групи спостереження були: наявність РВІ, підтвердженої лабораторно, вік від 1 до 18 міс., перебування на грудному вигодовуванні, госпіталізація не пізніше другої доби від появи перших симптомів захворювання, відсутність в анамнезі явищ ЛН, виключення ГКІ, викликаної патогенними бактеріями. Пацієнтів із хронічною чи вродженою патологією шлунково-кишкового тракту (ШКТ) виключали з дослідження. Усім дітям тричі (в день госпіталізації, на 3-тю та 5-ту добу лікування) проводили визначення вмісту вуглеводів у фекаліях за допомогою проби Бенедикта та рН-метрію фекалій. Контрольну групу становили 30 дітей раннього віку без ознак діареї.
Залежно від особливостей застосовуваної схеми терапії хворі були розподілені нами на 2 групи, репрезентативні за статтю, віком та тяжкістю стану. Першу (основну) групу становили 20 дітей від 6 місяців до 3 років, які на додаток до загальноприйнятої терапії, що включала низьколактозне харчування, регідратацію, дезінтоксикацію, ферменти та кишковий антисептик ніфуроксазид, отримували препарат Ентерол 250®. Препарат застосовували з першого дня госпіталізації протягом 5 діб у вікових дозах: діти до 1 року отримували 1/2 пакетика 3 рази на день, діти старше 1 року — 1 пакетик 2 рази на день. У другу (порівняльну) групу увійшли 25 хворих, які отримували тільки базисну терапію. Критерії ефективності призначених схем лікування оцінювалися за регресом основних клінічних симптомів ротавірусної інфекції (лихоманки, блювоти, ознак токсикозу й ексикозу), нормалізацією апетиту, динамікою нормалізації випорожнень.
Статистичну обробку отриманих результатів проводили за допомогою програмного забезпечення Statistica 6.1 (StatSoft) методами варіаційної статистики із застосуванням непараметричного критерію Манна — Уїтні для малих вибірок та методів кореляційного аналізу. Статистично вірогідною вважали різницю при p < 0,05.
Результати та їх обговорення
При аналізі захворюваності на РВІ в Запорізькій області за останні 5 років (рис. 1) нами було відмічено її зростання більше ніж у 1,5 раза, що, імовірно, значною мірою пов’язано з широким впровадженням специфічної діагностики РВІ. У наступні 3 роки (2009–2011 рр.) захворюваність на РВІ трималася майже на одному рівні з подальшим зниженням у 2012 р.
Аналіз вікової структури захворюваності на РВІ у 2011–2012 рр. (рис. 2), вказував, що найвищі показники захворюваності на РВІ мали місце в дітей перших двох років життя. Як видно з рис. 2, вікова група 5–9 років у 2012 році хворіла на РВІ в 8,5 раза рідше за дітей раннього віку, а діти 15–17 років — майже у 100 разів. Таким чином, звертала на себе увагу чітка тенденція до зниження захворюваності на РВІ з віком, а найбільш уразливою категорією виступали діти перших 2 років життя.
Загалом за 2012 рік у Запорізькій області було зареєстровано 1376 випадків РВІ. З них 1315 (95,5 %) випадків припадає на дитяче населення області. Аналіз вікової структури пацієнтів з РВІ у 2012 році (рис. 3) показав, не лише переважання пацієнтів першого року життя, але й те, що серед дітей раннього віку найбільшу частку становлять хворі віком 6–12 місяців (631 дитина — 48 %), що відповідає сучасним літературним даним.
При дослідженні особливостей клінічного перебігу РВІ у 100 дітей раннього віку ми з’ясували, що в більшості (72 особи, або 72 %) пацієнтів РВІ перебігала на тлі обтяженого преморбідного фону: з них 27 (27 %) перебували на ранньому штучному вигодовуванні, 45 (45 %) мали залізодефіцитну анемію легкого та середньотяжкого ступеня, у 9 (9 %) було діагностовано рахіт, 32 (32 %) мали обтяжений алергологічний анамнез, тимомегалія I–II ступеня спостерігалася у 8 (8 %) хворих.
Аналіз клінічних даних показав, що 68 (68 %) хворих були госпіталізовані в перші 2 доби від появи перших клінічних симптомів захворювання. Основними скаргами при госпіталізації були блювання, діарея, лихоманка, відмова від їжі, болі в животі, здуття. У 98 пацієнтів РВІ мала гострий початок і лише у 2 розвивалася поступово зі зниження апетиту, загальної слабкості, субфебрилітету з приєднанням діарейного синдрому на 2-гу — 3-тю добу.
У більшості пацієнтів (98 осіб, або 98 %) захворювання перебігало в середньотяжкій формі, лише двоє дітей (2 %) переносили тяжку форму хвороби. Тяжкість перебігу РВІ визначали ступінь ексикозу, вираженість температурної реакції та диспептичних проявів. Ексикоз I ступеня встановлено в 67 (67 %) хворих, II ступеня — у 33 (33 %). Домінуючим синдромом виступав діарейний, прояви якого спостерігалися в 98 (98 %) хворих. У 69 (69 %) дітей діарея виникала в 1-й день хвороби, у 24 (24 %) — на 2–3-й і в 4 (4 %) — після 3-ї доби від дебюту захворювання. Тривалість діарейного синдрому в 58 дітей (5 %) становила 2–7 діб, у 26 (26 %) — 7–9 і в 15 (15 %) — понад 10 днів. Випорожнення були у збільшеному об’ємі у 31 (31 %) дитини; мали жовтий чи жовто-зелений колір у 77 пацієнтів (77 %), водянистий характер — у 98 (98 %); іноді пінистий характер з домішками слизу, зелені, неперетравлених шматочків — у 42 дітей (42 %). В 11 (11 %) дітей на 11 ± 3 день захворювання мала місце друга хвиля діареї.
Другим за частотою виявлення симптомом РВІ була лихоманка, що реєструвалася в 93 (93 %) дітей групи спостереження. У більшості хворих (62 дитини — 62 %) температура тіла сягала фебрильних цифр, у 13 (13 %) — перевищувала 39 оС. Підвищення температури відмічалося з перших днів захворювання й досягало максимальних цифр до 2-го дня хвороби в більшості пацієнтів (86 дітей — 86 %). У переважної більшості хворих (63 дитини — 63 %) лихоманка була нетривалою (до 4 днів) — у середньому 3,0 ± 1,5 доби.
Блювота спостерігалася у 83 (83 %) хворих на РВІ. У 62 (62 %) дітей цей синдром з’являвся в перший день захворювання, у 8 (8 %) був зареєстрований на 2-гу — 3-тю добу, а у 13 (13 %) — у більш віддалений термін, досягаючи максимуму (4,0 ± 2,3 раза на добу) в перші три дні хвороби. Виявлено, що у 18 (18 %) дітей віком до 3 місяців життя блювання або зовсім було відсутнім, або з’являлося після 4-ї доби хвороби. Його еквівалентом у пацієнтів даної вікової категорії було зригування. Тривалість блювоти у 73 хворих (73 %) не перевищувала 3 доби, становлячи в середньому 1,9 ± 1,3 дня. Друга хвиля появи даного синдрому визначалася у 18 (18 %) дітей.
Аналізуючи результати біохімічного дослідження крові, проведеного в перші два дні з моменту госпіталізації, ми зафіксували, що в 46 (46 %) дітей відмічалося підвищення активності АлАТ на фоні нормальних цифр загального білірубіну. За результатом УЗД у 19 (19 %) з них відзначено гепатомегалію. Всі хворі з цитолітичним синдромом були обстежені на маркери вірусних гепатитів А, В і С, що виявилися негативними. Підвищення активності АлАТ в 1,5 раза спостерігалося в 21 (21 %) дитини, у 2 рази — у 18 (18 %) дітей, у 3 рази і більше — у 7 (7 %) дітей. З них у 26 (26 %) пацієнтів цей лабораторний синдром мав короткотривалий характер із нормалізацією показників протягом тижня від моменту госпіталізації. У той же час у 12 (12 %) дітей цитолітичний синдром зберігався понад 7–10 діб.
Підвищення в крові рівня креатиніну відмічено у 31 (31 %) хворого. Цей показник у середньому досягав 118,0 ± 15,5 ммоль/л і нормалізувався на 3–5-й день лікування. Виявлено, що вміст креатиніну підвищувався переважно у 18 (18 %) дітей, які мали прояви ексикозу II ступеня. Рівень продуктів азотистого обміну крові був прямо пропорційним ступеню зневоднення. Так, показники креатиніну 101–119 ммоль/л мали 13 (13 %) пацієнтів з ексикозом I ступеня і 7 (7 %) дітей з ексикозом II ступеня, тоді як більш високі його рівні (120–150 ммоль/л) спостерігалися виключно у дітей із II ступенем зневоднення. Отже, прояви ниркової недостатності при РВІ мали переважно преренальний характер.
Ацетонемічний синдром відзначався в 37 (37 %) хворих і був короткотривалим (1,3 ± 0,7 дня). Максимальні значення кетонових тіл у сечі фіксували на 1-шу — 3-тю добу захворювання і вони досягали 1–2 «+» у 27 (27 %) пацієнтів, 3–4 «+» — у 10 (10 %) дітей. У 20 (20 %) хворих на момент госпіталізації було зафіксовано гіпоглікемію, ще в 7 (7 %) рівень глюкози відповідав нижній межі норми. Виявлено, що найвищі рівні ацетону в сечі корелювали з гіпоглікемією.
Отже, лише у 38 (38 %) дітей досліджуваної групи спостерігався неускладнений перебіг РВІ, а у 62 (62 %) захворювання перебігало з ускладненнями: у 46 (46 %) хворих мали місце прояви реактивного гепатиту, у 35 (35 %) — ацетонемічного синдрому, у 8 (8 %) — нефропатії.
Під час додаткового дослідження на ЛН було з’ясовано (табл. 1), що у 18 (90 %) з 20 обстежених дітей уже в день госпіталізації відмічалося підвищення рівня вуглеводів у випорожненнях порівняно з віковими показниками (у дітей до 1 року без діареї цей показник не перевищував 0,25 %, у фекаліях дітей старше року вуглеводи були відсутніми), що становив у середньому 0,6 ± 0,3 %.
Середні показники проби Бенедикта з 0,6 ± 0,3 % у день госпіталізації зростали до 1,0 ± 0,3 % на 3-тю добу та залишались майже на тому ж рівні (0,9 ± 0,3 %) на 5-ту добу дослідження. Слід відмітити, що у 10 (50 %) дітей цей показник залишався на максимальних цифрах з 3-ї до 5-ї доби включно. Нами було відмічено, що показник максимальної кількості вуглеводів у фекаліях має сильний обернений кореляційний зв’язок із віком дітей, r = –0,7 (р < 0,05). Так, діти вікової категорії 1–6 міс. мали найвищі показники проби Бенедикта (1,6 ± 0,3 %), що перевищували максимальні вікові в середньому в 6,3 раза (рис. 4). Даний показник у дітей віком 6–12 міс. становив 0,9 ± 0,6 % і перевищував віковий у 3,4 раза та значно варіював. У групі дітей 12–18 міс. максимальне значення кількості вуглеводів у калі було найнижчим і становило в середньому 0,8 ± 0,3 %. Таким чином, найбільш суттєво РВІ впливала на вміст вуглеводів у калі дітей першого півріччя життя, які повністю знаходилися на грудному вигодовуванні.
Слід відмітити відсутність кореляції між динамічними змінами максимальних показників кількості вуглеводів у фекаліях та ступенем вираженості діарейного синдрому при РВІ (r = –0,17; р > 0,05). Так, максимальна кількість випорожнень у дітей групи дослідження відмічена в середньому на 2,3 ± 1,1 добу з тенденцією до зменшення діареї в динаміці спостереження, тоді як показник проби Бенедикта в більшості дітей досягав максимуму (1,0 ± 0,3 %) на 3-тю добу, залишаючись майже на тому ж рівні (0,9 ± 0,3 %) до 5-ї доби захворювання. При цьому лише 5 (25 %) пацієнтів мали наростаючий характер діареї з максимальними її проявами з 3-ї до 5-ї доби хвороби включно. Саме в цій групі дітей відзначався сильний прямий кореляційний зв’язок між вираженістю діарейного синдрому та середніми показниками проби Бенедикта в динаміці РВІ (r = 0,9; р < 0,01), тобто із збільшенням кількості вуглеводів у фекаліях хворих збільшувалася частота випорожнень протягом доби.
При аналізі показників кислотності фекалій обстежених пацієнтів встановлено, що в абсолютної більшості хворих (16 осіб, або 80 %) дітей у день госпіталізації спостерігався різко кислий рН калу — нижче 5,5 (у середньому 5,3 ± 0,2), що характерно для бродильної диспепсії (у групі контролю середній показник рН становив 5,8 ± 0,3). На 3-тю добу РВІ показник рН калу залишався майже на тому самому рівні і становив 5,3 ± 0,2, будучи різко кислим у 15 (75 %) дітей. На 5-ту добу захворювання спостерігалося деяке підвищення кислотності фекалій до 5,6 ± 0,3 в середньому.
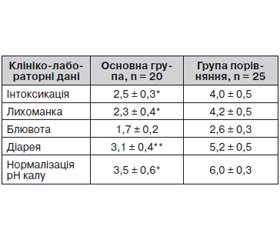
Порівняльний аналіз клінічної ефективності застосованих схем терапії показав, що позитивна динаміка клінічної картини спостерігалася в обох групах хворих. Проте у дітей, які додатково отримували препарат, що містить Saccharomyces boulardii, швидше, ніж у дітей групи порівняння, зникали симптоми інтоксикації, ознаки диспептичного та діарейного синдромів, що свідчило про позитивний вплив пробіотика на динаміку захворювання (табл. 2).
/tirag/15/15_2.jpg)
Як видно з табл. 2, у пацієнтів основної групи вірогідно скорочувалася середня тривалість лихоманки, блювоти, діареї та інтоксикації. Протягом 3 днів випорожнення нормалізувались у 15 (75 %) хворих в основній групі і тільки у 12 (48 %) — у групі порівняння. Прояви загальної інтоксикації в 11 (55 %) хворих основної групи не відмічалися вже до кінця 2-ї доби, а на 3-й день лікування були відсутні в 16 (80 %) пацієнтів, у той час як у групі порівняння у 12 (48 %) дітей симптоми інтоксикації зберігалися на 4–5-й день лікування. Крім того, у 14 (70 %) хворих, які отримували в комплексній терапії Saccharomyces boulardii, температура тіла нормалізувалася на другу добу перебування в стаціонарі, тоді як в групі порівняння тільки у 8 (32 %). Слід підкреслити, що середня тривалість блювоти на тлі прийому Saccharomyces boulardii скоротилася в 1,5 раза (р < 0,05), а діареї — в 1,7 раза (p < 0,01) порівняно з хворими, які отримували тільки базисну терапію. Визначення показників кислотності фекалій виявило нормалізацію показнику рН калу у 15 (75 %) хворих основної групи на 3-тю — 4-ту добу від початку лікування, в той час як у групі порівняння в 10 (45 %) пацієнтів ознаки бродильної диспепсії зберігалися на 5–6-й день, а у 3 (25 %) дітей — на 7-й день терапії.
Звертає на себе увагу той факт, що застосування Saccharomyces boulardii в комплексній терапії ротавірусної інфекції у дітей дозволило зменшити термін перебування хворих у стаціонарі до 5,1 ± 1,3 доби проти 7,5 ± 2,3 доби в групі порівняння.
Препарат Ентерол 250® добре переносився всіма хворими. Алергічних та інших побічних реакцій унаслідок прийому препарату не було відмічено в жодному випадку.
Висновки
1. РВІ є поширеною гострою інфекційною патологією дітей раннього віку. Тяжкість перебігу РВІ обумовлена як розвитком зневоднення на тлі вираженого диспептичного синдрому, так і наявністю ускладнень. Серед останніх домінують реактивний гепатит (46 %), ацетонемічний синдром (35 %) та нефропатія (8 %), лактазна недостатність.
2. Серед лабораторних ознак ЛН більш ранніми є зміни рН калу у бік кислого середовища, а накопичення вуглеводів у фекаліях досягає максимуму на 3-й добі хвороби (90 %); лабораторні ознаки ЛН у дітей раннього віку зберігаються тривало — до 5-ї доби РВІ.
3. Застосування Saccharomyces boulardii в комплексній терапії дітей, хворих на ротавірусну інфекцію, патогенетично обґрунтоване та призводить до більш швидкого поліпшення загального стану хворих, скорочення тривалості лихоманки, інтоксикаційного, диспептичного та діарейного синдрому, що дозволяє скоротити терміни перебування в стаціонарі.
1. Клінічні особливості ротавірусної інфекції у дітей на сучасному етапі / Л. Р. Шостакович-Корецька, О.М. Герасименко, О.Л. Кривуша [та ін.] // Сучасна педіатрія. — 2007. — № 3 (6). — С. 15–20.
2. Soriano-Gabarro M. Burden of rotavirus disease in European Union countries / M. Soriano-Gabarro, J. Mrukowicz, T. Vesikari // Pediatr. Infect. Disease. — 2006. — Vol. 25, № 1. — P. 7–11.
3. Lepage Philippe Rotavirus infection in Europe: Time for effective prevention. / Philippe Lepage // The Pediatric Infectious Disease Journal. — 2006. — Vol. 25 (1). — P. 5–6.
4. Незгода И.И. Ротавирусная инфекция у детей: современные подходы к лечению / И.И. Незгода, О.В. Бондарюк // Новости медицины и фармации. — 2007. — № 2 (206) — С. 16–17.
5. Дзюблик І.В. Ротавірусна інфекція: навчально методичний посібник для лікарів / Дзюблик І.В. — К.: Олпрінт, 2004. — 116 с.
6. Мазанкова Л.Н., Рыбалко Г.А. Профилактика ротавирусной инфекции у детей // Актуальные вопросы инфекционной патологии и вакцинопрофилактики у детей. V конгресс педиатров-инфекционистов России: тезисы. — М., 2006. — С. 99–101.
7. Rotavirus NSP4: a multifunctional viral enterotoxin / Ball J.M., Mitchell D.M., Gibbons T.F., Parr R.D. // Viral immunol. — 2005. — Vol. 18 (1). — Р. 27–40.
8. Lorrot M. Physiopathologie de la diarhee a rotavirus / M. Lorrot, M. Vasseur // Arch. Pediatr. — 2007. — Vol. 14 (3). — Р. 145–151.
9. Rotavirus NSP4: a multifunctional viral enterotoxin / Ball J.M., Mitchell D.M., Gibbons T.F., Parr R.D. // Viral immunol. — 2005. — Vol. 18 (1). — Р. 27–40.
10. Самаль Т.Н. Лактазная недостаточность у детей раннего возраста — современные подходы // Т.Н. Самаль, С.Е. Украинцев // Медицинская панорама. — 2004. — № 2. — С. 60–62.
11. Тимченко В.Н. Особенности течения и лечения ротавирусной инфекции у детей / В.Н. Тимченко, Е.Б. Павлова, М.Д. Субботина // Лечащий врач. — 211. — № 8. — С. 107–108.
12. Козловский О.А. Опыт применения пробиотика Энтерол-250 в лечении острых кишечных инфекций / О.А. Козловский, М.Т. Гафарова, А.А. Дегтярева [и др.] // Новости медицины и фармации. — 2005. — № 3 (163). — С. 14.

/tirag/14/14.jpg)
/tirag/15/15.jpg)