Журнал «Актуальная инфектология» 2 (3) 2014
Вернуться к номеру
Стан компенсаторно-адаптаційних механізмів у хворих на гнійні менінгіти в динаміці захворювання
Авторы: Рябоконь О.В., Задирака Д.А. — Запорізький державний медичний університет
Рубрики: Инфекционные заболевания
Разделы: Клинические исследования
Версия для печати
У статті проаналізовано клінічні ознаки вегетативної дисфункції та стан компенсаторно-адаптаційних механізмів у хворих на гнійні менінгіти в динаміці захворювання. Виявлено, що у хворих на гнійні менінгіти у розпал захворювання домінування загальномозкової, менінгеальної симптоматики поєднується з окремими об’єктивними ознаками вегетативної дисфункції та зниженням потужності варіабельності ритму серця з наявністю вегетативного дисбалансу в бік ваготонії. У динаміці у хворих на гнійні менінгіти на тлі загальноприйнятого лікування з 2-го тижня превалюють клінічні ознаки вегетативної дисфункції, що зберігаються й на момент виписки у 72,7 % обстежених, поєднуючись із дисбалансом параметрів нейрогуморальної регуляції у вигляді зменшення потужності спектральних параметрів варіабельності ритму серця з наявністю вегетативного дисбалансу у бік ваготонії.
В статье проанализированы клинические признаки вегетативной дисфункции и состояние компенсаторно-адаптационных механизмов у больных гнойными менингитами в динамике заболевания. Выявлено, что у больных гнойными менингитами в разгар заболевания доминирование общемозговой, менингеальной симптоматики сочетается с отдельными объективными признаками вегетативной дисфункции и снижением мощности вариабельности ритма сердца с наличием вегетативного дисбаланса в сторону ваготонии. В динамике у больных гнойными менингитами на фоне общепринятого лечения со 2-й недели превалируют клинические признаки вегетативной дисфункции, которые сохраняются и на момент выписки у 72,7 % обследованных, сочетаясь с дисбалансом параметров нейрогуморальной регуляции, в виде уменьшения мощности спектральных параметров вариабельности сердечного ритма с наличием вегетативного дисбаланса в сторону ваготонии.
The article analyzes the clinical features of autonomic dysfunction and state of compensatory-adaptive mechanisms in patients with purulent meningitis in the dynamics of the disease. We found that in patients with purulent meningitis at the height of the disease dominance of cerebral, meningeal symptoms combined with some objective evidence of autonomic dysfunction and reduced power of heart rate variability with the presence of autonomic imbalance towards vagotonia. In the dynamics in patients with purulent meningitis against the background of conventional treatment clinical signs of autonomic dysfunction prevail from the 2nd week, they persist at discharge in 72.7 % of patients, combining with imbalanced parameters of neurohumoral regulation, in the form of reduced power of spectral parameters of heart rate variability with presence of autonomic imbalance towards vagotonia.
гнійний менінгіт, вегетативна дисфункція, варіабельність ритму серця.
гнойный менингит, вегетативная дисфункция, вариабельность ритма сердца.
purulent meningitis, autonomic dysfunction, heart rate variability.
Статья опубликована на с. 53-56
Актуальність проблеми гнійних менінгітів (ГМ) для практичної охорони здоров’я визначається, крім епідемічних та медико-соціальних аспектів, тяжкістю патології, часто ускладненим перебігом захворювання з розвитком стійких наслідків, а також високими показниками летальності [7, 8, 14, 15, 18]. За даними Всесвітньої організації охорони здоров’я, щорічно у світі реєструється понад 1 млн випадків ГМ, з яких 200 тис. закінчуються летально [9].
Доведено, що одним із показників здоров’я є компенсаторно-адаптаційні можливості організму [1]. Для того, щоб при нових умовах зберегти існуючий рівень функціонування або перейти на більш адекватний, необхідне певне напруження регуляторних механізмів, спрямованих на мобілізацію функціональних резервів. Саме ступінь напруження регуляторних систем визначає функціональний стан людини з точки зору ефективності пристосування організму до нових умов. Встановлено, що серцево-судинна система є чутливим індикатором адаптаційних реакцій організму, який дозволяє виявити частку різних рівнів і систем регуляції [2, 5], а аналіз варіабельності серцевого ритму (ВСР) є одним з найбільш поширених неінвазивних методів їх оцінки [13, 16].
Мета роботи: підвищити ефективність оцінки перебігу гнійних менінгітів в динаміці захворювання на підставі комплексу клінічних даних та варіабельності серцевого ритму.
Матеріали та методи
До дослідження включено 60 пацієнтів із ГМ, які лікувалися у відділенні реанімації та інтенсивної терапії з подальшим перебуванням у відділенні нейроінфекцій Запорізької обласної клінічної лікарні. Серед обстежених чоловіків було 33, жінок — 27. Вік хворих від 19 до 60 років, середній вік становив 40,8 ± 2,5 року. Всі пацієнти включені в дослідження за випадковою ознакою та інформованою згодою.
Діагноз ГМ був установлений на підставі типової клінічної картини та результатів дослідження спинномозкової рідини. Провідними в етіологічній структурі ГМ були менінгококова (15 — 25,0 %) та пневмококова (14 — 23,33 %) інфекції. ГМ, викликані іншими збудниками (стрептококом, стафілококом, псевдомонадою), зареєстровано у 3 (5 %) хворих. У 28 обстежених (46,7 %) уточнити етіологію ураження ГМ не вдалося. Всі хворі отримували традиційне лікування: загальноприйняті антибактеріальні препарати, інфузійну терапію, сечогінні препарати, глюкокортикостероїди, у періоді ранньої реконвалесценції — ноотропи, засоби, що покращують мозковий та периферійний кровообіг, вітаміни групи В. Клінічні ознаки вегетативної дисфункції виявляли за допомогою опитувальника Вейна, при цьому синдром вегетативної дисфункції діагностували за наявності понад 15 балів [4].
Функціональний стан вегетативної нервової системи (ВНС) визначали методом комп’ютерної кардіоінтервалометрії [17] з використанням електрокардіографічної діагностичної системи Cardio Lab 2000. Аналізували спектральні параметри ВРС: Totalpower, мс2 — дисперсія R-R інтервалів на всьому сегменті 0,000–0,400 Гц; VLF, мс2 — потужність у діапазоні дуже низьких частот 0,003–0,040 Гц; LF, мс2 — потужність у діапазоні низьких частот 0,040–0,150 Гц; HF, мс2 — потужність у діапазоні високих частот 0,150–0,400 Гц; LF norm, HF norm, % — відносні показники, що відображають внесок кожного спектрального компонента в спектр нейрогуморальної регуляції; LF/HF — індекс вегетативного балансу. Контрольну групу становили 20 здорових осіб.
Результати досліджень статистично опрацьовано з використанням сформованої бази даних обстежених пацієнтів і здорових осіб у програмі Statistica® for Windows 7.0. Обчислювали середні значення (M), середні помилки середньої арифметичної (m). Для оцінки вірогідності різниці кількісних ознак між незалежними вибірками застосовували критерій Манна — Уїтні, між залежними вибірками — критерій Вілкоксона.
Результати досліджень та їх обговорення
Аналізуючи анамнестичні дані, ми виявили, що в перші 3 доби від початку захворювання за медичною допомогою звернулися 38 хворих (63,3 %). Причини пізньої госпіталізації хворих на ГМ такі: пізнє звернення за медичною допомогою, відмова від госпіталізації при первинному зверненні, клінічна картина не розпізнана лікарями первинної ланки на початку захворювання. Відомо, що термін госпіталізації хворих на ГМ має значний вплив на наслідки та прогноз захворювання. Так, при пневмококовому ГМ при госпіталізації після 48 годин летальність досягає 85,7 % [3].
Більшість пацієнтів (38 — 63,3 %) надходили до стаціонару у тяжкому стані, обумовленому набряком-набуханням головного мозку та вираженим інтоксикаційним синдромом. Порушення свідомості у вигляді коми виявлено в 1 (6,7 %) хворого, сопор мав місце у 7 (11,7 %) пацієнтів. У половині випадків порушення свідомості було обумовлене дезорієнтацією, загальмованістю, неадекватністю, психомоторним збудженням та галюцинаторним синдромом.
Клінічна картина ГМ незалежно від етіології інфекційного процесу характеризувалася гострим початком хвороби, головним болем різного ступеня вираженості, гарячкою та запальними змінами в лікворі.
Найбільш характерним симптомом загальноінтоксикаційного синдрому була гарячка, яка виявлена у всіх випадках ГМ. У більшості обстежених (37 – 61,7 %) спостерігалося підвищення температури тіла до фебрильних цифр, у 4 (6,7 %) — гіпертермія. Слід зазначити, що субфебрильна температура у дебюті захворювання мала місце у 8 (13,3 %) пацієнтів. На зниження апетиту, слабкість скаржилися 33 (55 %) хворі.
Аналізуючи загальномозкову симптоматику, ми виявили, що нудота мала місце у 39 (65 %) обстежених. Одноразова або повторна блювота, яка не приносила полегшення та не пов’язана з прийомом їжі, визначалася у 35 (58,3 %) пацієнтів. Серед обстежених хворих фотофобію, гіперакузію та болючість при пальпації або русі очних яблук виявлено у 22 (36,7 %) пацієнтів.
Найчастіше виявлялася ригідність потиличних м’язів, що на початку захворювання мала місце у 56 (93,3 %) обстежених, симптом Керніга був виявлений у 34 (56,7 %) хворих, синдром Брудзинського (верхній або комбінація верхнього з нижнім) — у 18 (30 %).
Треба зазначити, що на момент госпіталізації, враховуючи домінування симптомів інтоксикації та подразнення мозкових оболонок, об’єктивні дані вегетативної дисфункції у вигляді пастурального тремору верхніх кінцівок та повік, який підсилювався при інтенції, було виявлено лише в кожного п’ятого хворого (14 — 23,3 %).
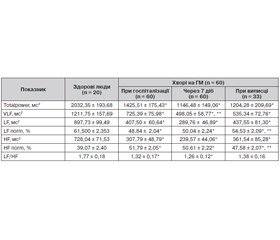
При аналізі спектральних параметрів функціонального стану ВНС у хворих на ГМ в розпал захворювання зареєстровано зниження (р < 0,007–0,00001) порівняно з показниками здорових людей загальної потужності (Totalpower), потужності спектра впливу гуморальних систем (VLF), а також потужності спектра низькочастотних коливань (LF) та потужності спектра високочастотних коливань (HF), що відображають відповідно активність симпатичного та парасимпатичного відділів ВНС. Вегетативний дисбаланс у бік парасимпатикотонії проявився збільшенням (р < 0,002) частки парасимпатичних впливів (HF norm) у загальному спектрі вегетативної регуляції й зниженням (р < 0,02–0,002) частки симпатичних впливів (LF norm) та індексу вегетативного балансу (LF/HF) (табл. 1).
На фоні базисної терапії стан хворих на ГМ з позитивною динамікою: на 5,1 ± 0,6 день відновлювався рівень свідомості, на 4,4 ± 0,6 добу нормалізувалася лихоманка, регресування проявів інтоксикаційного синдрому відбувалося на 7,0 ± 1,1 добу, зменшилась вираженість цефалгічного та менінгеального синдромів.
Проте з другого тижня захворювання крім об’єктивних даних вегетативної дисфункції у вигляді пастурального тремору повік та верхніх кінцівок, який мав місце вже у 38 (63,3 %) обстежених, виявлялися й суб’єктивні. Так, на періодичний цефалгічний синдром на тлі змін метеоумов скаржилися 57 (95,0 %) хворих, підвищену втомлювальність після незначного фізичного навантаження — 57 (95,0 %), розлади сну — 32 (53,3 %), серцебиття — 22 (36,7 %). Наявність вегетативної дисфункції на 2-му тижні лікування було підтверджено сумою балів (32,4 ± 1,1) при проведенні опитування хворих за шкалою Вейна.
Превалювання в клінічній симптоматиці вегетативних розладів у хворих на ГМ починаючи з 2-го тижня лікування поєднувалося із поглибленням змін спектральних параметрів ВСР. Прогресування ознак вегетативної дисфункції проявлялося зниженням параметра VLF (p < 0,04) на тлі стабільно змінених інших досліджуваних параметрів порівняно з аналогічним показником у розпал захворювання. Ці ознаки відображають церебральні ерготропні впливи на різні рівні, які відповідають за адаптацію [12] та є чутливим індикатором управління метаболічними процесами й надійним маркером енергодефіцитних станів [11].
При спостереженні за хворими на ГМ у періоді реконвалесценції на тлі загальноприйнятої терапії було зафіксовано певний регрес симптомів вегетативної дисфункції. Підвищена втомлюваність регресувала на 16,8 ± 1,7 добу, головний біль — на 15,3 ± 0,9 добу, розлади сну — на 16,2 ± 1,1 добу, серцебиття — на 15,8 ± 1,4 добу, постуральний тремор — на 18,8 ± 0,9 добу. Про зменшення клінічних проявів вегетативної дисфункції на фоні базисної терапії свідчило також зниження (р < 0,00001) середнього бала за опитувальником Вейна до 21,00 ± 1,05 бала порівняно з попередніми даними. Проте на момент виписки зі стаціонару в більшості пацієнтів (24–72,7 %) зберігалися як суб’єктивні, так і клінічні ознаки вегетативних розладів.
На фоні регресу клінічних ознак вегетативної дисфункції на момент виписки у хворих на ГМ зареєстрована позитивна динаміка спектральних показників ВСР у вигляді підвищення (р < 0,02) потужності спектра низькочастотних коливань (LF) та зниження потужності (р < 0,04) частки парасимпатичних впливів (HF norm) порівняно з аналогічними параметрами при госпіталізації. Проте на тлі завершення базисного лікування зберігався низький рівень потужності основних спектральних параметрів ВСР з наявністю вегетативного дисбалансу в бік ваготонії.
Виявлений у нашому дослідженні у хворих на ГМ дисбаланс параметрів нейрогуморальної регуляції у вигляді зменшення потужності спектральних параметрів ВСР з наявністю вегетативного дисбалансу у бік ваготонії, який зберігався протягом усього періоду захворювання та поєднувався з превалюванням клінічних ознак вегетативної дисфункції, на нашу думку, відіграє певну роль у затримці видужання цих хворих. Адже, згідно з літературними даними [6], в умовах спокою парасимпатичний і симпатичний відділи ВНС проявляють функціональний синергізм. Тоді як в екстремальних умовах між відділами ВНС при їх одночасній активації може проявлятися функціональний антагонізм. У силу впливу ряду генетичних і філогенетичних факторів в екстремальних умовах відзначається перевага парасимпатичної або симпатичної ланки нервової регуляції. Переважання парасимпатикотонії в екстремальних умовах вказує на функціональне зниження симпатичного відділу ВНС, що супроводжується зниженням активності кори надниркових залоз, і на активацію трофотропних впливів, характерних для адаптації на низькому функціональному рівні. При цьому у пацієнтів спостерігаються астенодепресивні ознаки [10].
Виявлені в нашому дослідженні зміни нейрогуморальної регуляції у хворих на ГМ, що зберігаються й у періоді реконвалесценції, обумовлюють, на нашу думку, перспективність цього дослідження щодо подальшої розробки індивідуалізації патогенетичного лікування.
Висновки
1. У хворих на гнійні менінгіти в розпал захворювання домінування загальномозкової, менінгеальної симптоматики поєднується з окремими об’єктивними ознаками вегетативної дисфункції у вигляді постурального тремору повік й верхніх кінцівок та зниженням потужності варіабельності ритму серця з наявністю вегетативного дисбалансу в бік ваготонії.
2. У динаміці у хворих на гнійні менінгіти на тлі загальноприйнятого лікування з 2-го тижня превалюють клінічні ознаки вегетативної дисфункції, що поєднуються з триваючим зниженням потужності спектра гуморальних впливів (p < 0,04) на тлі стабільно змінених інших параметрів варіабельності серцевого ритму.
3. Період реконвалесценції у хворих на гнійні менінгіти характеризується збереженням клінічних проявів вегетативної дисфункції у 72,7 % хворих, низькою потужністю варіабельності ритму серця з наявністю вегетативного дисбалансу у бік ваготонії.
1. Апанасенко Г.Л. Диагностика индивидуального здоровья / Г.Л. Апанасенко // Валеология. — 2002. — № 3. — С. 27–31.
2. Баевский Р.М. Анализ вариабельности сердечного ритма: история и философия, теория и практика / Р.М. Баевский // Клиническая информатика и телемедицина. — 2004. — № 1. — С. 54–64.
3. Белошицкий Г.В. Клинико-эпидемиологические особенности пневмококковых менингитов / Г.В. Белошицкий, И.С. Королева // Эпидемиология и инфекционные болезни. — 2007. — № 2. — С. 20–23.
4. Вегетативные расстройства: Клиника, диагностика, лечение / Под ред. A.M. Вейна. — М.: ООО «Медицинское информационное агентство», 2003. — 726 с.
5. Коваленко С.О. Індивідуальні особливості хвильової структури серцевого ритму при дозованому фізичному навантаженні / С.О. Коваленко // Спортивна медицина. — 2006. — № 1. — С. 3–9.
6. Лычкова А. Э. Механизмы синергизма отделов вегетативной нервной системы / А.Э. Лычкова // Успехи физиол. наук. — 2006. — Т. 37, № 1. — С. 50–67.
7. Менингококковая инфекция и гнойные бактериальные менингиты: рук. по лабораторной диагностике / Королева И.С., Белошицкий Г.В.]; под ред. В.И. Покровского. — М.: ООО «Медицинское информационное агентство», 2007. — 112 с.
8. Менингиты и менингоэнцефалиты / Лобзин Ю.В., Пилипенко В.В., Громыко Ю.А. — СПб.: ООО «Издательство Фолиант», 2003. — 128 с.
9. Роль нейроспецифических белков в патогенезе бактериальных гнойных менингитов у детей / Т.Е. Макарова, Г.Г. Обухова // Дальневосточный журнал инфекционной патологии. — 2011. — № 18. — С. 73–78.
10. Сергеенко Н.И. Функциональные взаимоотношения отделов вегетативной нервной системы в условиях общей анестезии / Н.И. Сергеенко. — Витебск, 2009. — 236 с.
11. Флейшман А.Н. Медленные колебания гемодинамики / А.Н. Флейшман. — Новосибирск, 1999. — С. 264.
12. Хаспекова Н.Б. Регуляция вариативности ритма сердца у здоровых и больных с психогенной и органической патологией мозга: Дис... д-ра мед. наук. — М., 1996. — 217 с.
13. Fang Y. Effect of different breathing patterns on nonlinearity of heart rate variability / Y. Fang, J.T. Sun, C. Li [et al.] // Conf. Proc. IEEE Eng. Med. Biol. Soc. — 2008. — P. 3220–3223.
14. Khwannimit B. Acute bacterial meningitis in adults: a 20 year review / B. Khwannimit, P. Chayakul, A. Geater [et al.] // Southeast Asian J. Trop. Med. Public Health. —2004. — Vol. 35, № 4. — P. 886–892.
15. Manga N.M. Adult purulent meningitis caused by Streptococcus pneumoniae in Dakar, Senegal / N.M. Manga, S.A. Diop, R. Ka-Sall // Med. Trop. — 2008. — Vol. 68, № 6. — P. 625–628.
16. Shields R.W. Jr. Heart rate variability with deep breathing as a clinical test of cardiovagal function / R.W. Jr. Shields // Cleve Clin. J. Med. — 2009. — № 76, Suppl. 2. — P. 37–40.
17. Task Force of the European Sosiety of Cardiology and the North American Sosiety of Pacing and Electrophysiology. Heart Rate Variability. Standards of Measurements, physiological interpretation, and clinical use // Circulation. — 1996. — № 93. — Р. 1043–1065.
18. Weisfelt M., van de Beek D., Spanjaard L. et al. Clinical features, complications, and outcome in adults with pneumococcal meningitis: a prospective case series / M. Weisfelt, D. Van de Beek, L. Spanjaard [et al.] // Lancet Neurol. — 2006. — Vol. 5, № 2. —P. 123–129.

/tirag/54/54.jpg)