Журнал «Актуальная инфектология» 2 (3) 2014
Вернуться к номеру
Распознание искусственно вызванных вспышек инфекционных болезней
Авторы: Супотницкий М.В. — Федеральное государственное бюджетное учреждение; «Научный центр экспертизы средств медицинского применения»; Министерства здравоохранения Российской Федерации, г. Москва
Рубрики: Инфекционные заболевания
Разделы: Справочник специалиста
Версия для печати
В настоящее время эпидемиологические подходы к расследованию биологических террористических актов строятся на основании тех же представлений, которые используются для эпидемиологического расследования эпидемических процессов (вспышек), имеющих естественные причины. Поэтому цель настоящей работы — обосновать подходы к распознанию искусственно вызванных вспышек инфекционных болезней. Установлено, что искусственные эпидемические процессы (вспышки) имеют самостоятельные эпидемиологические, этиологические и клинические аспекты. В настоящее время можно выделить два типа развития искусственного эпидемического процесса: 1) когда биологический агент применяется преступниками однократно; 2) когда его применяют многократно. Характерными особенностями эпидемического процесса первого типа можно считать сжатую эпидемическую кривую с пиком заболеваемости, укладывающимся в среднее значение инкубационного периода болезни, и локализованность эпидемического очага (эпидемиология точечного источника). Для второго типа характерна растянутая эпидемическая кривая, намного превышающая продолжительность инкубационного периода болезни. Общими для обоих типов искусственных эпидемических процессов будут невозможная эпидемиология — особенность искусственных эпидемических процессов, свидетельствующая о том, что в природе не существует условий для их развития, и невозможная клиническая форма болезни, т.е. клиническая форма, не встречающаяся при естественном заражении, например патология мелкодисперсного аэрозоля, которую может вызвать только аэрозоль с дисперсной фазой 1–5 мкм. В эпидемиологическом расследовании искусственно вызванной вспышки инфекционной болезни выделено три этапа: сбор эпидемиологических данных, описательный этап и аналитический этап. Анализ особенностей поражений микроорганизмами, которые относятся к потенциальным агентам биологического оружия, показал, что клиника, патанатомия, патогистология, молекулярно-генетические методы исследований дают достаточно информации для распознания искусственного характера таких вспышек инфекционной болезни. Однако их специфика такова, что по сути они формируют самостоятельную (третью) часть эпидемиологии, которая имеет свои методологию, цели и задачи — эпидемиологию искусственных эпидемических процессов и биологических поражений.
На даний час епідеміологічні підходи до розслідування біологічних терористичних актів будуються на підставі тих самих уявлень, що використовуються для епідеміологічного розслідування епідемічних процесів (спалахів), що мають природні причини. Тому мета цієї роботи — обґрунтувати підходи до розпізнавання штучно викликаних спалахів інфекційних хвороб. Встановлено, що штучні епідемічні процеси (спалахи) мають самостійні епідеміологічні, етіологічні та клінічні аспекти. На даний час можна виділити два типи розвитку штучного епідемічного процесу: 1) коли біологічний агент застосовується злочинцями одноразово; 2) коли його застосовують багаторазово. Характерними особливостями епідемічного процесу першого типу можна вважати стислу епідемічну криву з піком захворюваності, що вкладається в середнє значення інкубаційного періоду хвороби, і локалізованість епідемічного вогнища (епідеміологія точкового джерела). Для другого типу характерна розтягнута епідемічна крива, що набагато перевищує тривалість інкубаційного періоду хвороби. Спільними для обох типів штучних епідемічних процесів будуть неможлива епідеміологія — особливість штучних епідемічних процесів, яка свідчить про те, що в природі не існує умов для їх розвитку, та неможлива клінічна форма хвороби, тобто клінічна форма, що не зустрічається при природному зараженні, наприклад патологія дрібнодисперсного аерозолю, яку може викликати тільки аерозоль з дисперсною фазою 1–5 мкм. В епідеміологічному розслідуванні штучно викликаного спалаху інфекційної хвороби виділено три етапи: збір епідеміологічних даних, описовий етап і аналітичний етап. Аналіз особливостей уражень мікроорганізмами, які належать до потенційних агентів біологічної зброї, показав, що клініка, патанатомія, патогістологія, молекулярно-генетичні методи досліджень дають достатньо інформації для розпізнання штучного характеру таких спалахів інфекційної хвороби. Проте їх специфіка така, що по суті вони формують самостійну (третю) частину епідеміології, що має свої методологію, мету і завдання — епідеміологію штучних епідемічних процесів і біологічних уражень.
Currently epidemiological approaches to the investigation of biological terrorist attacks are based on the same concepts that are used for epidemiological investigation of epidemic processes (outbreaks) that have natural causes. Therefore, the aim of this paper — to base approaches to identification of artificially induced outbreaks of infectious diseases. It is found that artificial epidemic processes (outbreaks) have distinct epidemiologic, etiologic and clinical aspects. Currently there are two types of artificial epidemic process development: 1) when the biological agent is used once by criminals; 2) when it is used repeatedly. Characteristic features of the epidemic process of the first type can be regarded compressed epidemic curve with a peak of incidence fit into the average value of the incubation period of the disease, and localization of an epidemic outbreak (epidemiology of point source). The second type is characterized by stretched epidemic curve far exceeds the duration of the incubation period of the disease. Common to both types of artificial epidemic process will be impossible epidemiology — feature of artificial epidemic processes, indicating that in nature there are no conditions for their development, and impossible clinical form of a disease, ie clinical form not occurring under natural infection, such as pathology of fine aerosol, which may be caused only by spray with a dispersed phase of 1–5 microns. In an epidemiological investigation of artificially induced outbreak of infectious disease there are three phases: the collection of epidemiological data, descriptive and analytical stage. Analysis of features of lesions by microorganisms that are potential agents of biological weapons, has shown that clinic, pathoanatomy, pathohistology, molecular genetic research methods provide sufficient information to recognize the artificial nature of such outbreaks of infectious disease. However, their specificity is that in fact they form an independent (third) part of epidemiology, which has its own methodology, goals and objectives — epidemiology of artificial epidemic processes and biological lesions.
биологический террористический акт, эпидемиология, натуральная оспа, геморрагические лихорадки, сап, мелиоидоз, чума, сибирская язва.
біологічний терористичний акт, епідеміологія, натуральна віспа, геморагічні лихоманки, сап, меліоїдоз, чума, сибірська виразка.
biological terrorist attack, epidemiology, smallpox, hemorrhagic fever, glanders, melioidosis, plague, anthrax.
Статья опубликована на с. 116-141
Масштабный биотеррористический акт, совершенный в США в 2001 г., показал, что в мире существуют силы, способные планировать и осуществлять такие преступления, не боясь быть установленными. Однако до настоящего времени эпидемиологические подходы к расследованию таких преступлений строятся на основании тех же представлений, которые используются для эпидемиологического расследования эпидемических процессов, имеющих естественные причины. Поэтому цель настоящей работы — обосновать подходы к распознанию искусственно вызванных вспышек инфекционных болезней. Для этого нами рассмотрены основные отличия между естественными и искусственными вспышками (эпидемиями) инфекционных болезней, эпидемиология и эпидемиологические типы таких вспышек, общие этапы и виды эпидемиологического расследования и частные особенности обнаружения искусственно вызванных поражений возбудителями сибирской язвы, чумы, туляремии, бруцеллеза, сапа, мелиоидоза, геморрагических лихорадок, лошадиных энцефалитов и их генетически измененных вариантов.
Основные отличия между естественными и искусственными вспышками (эпидемиями) инфекционных болезней. Кратко их сопоставление проведено в табл. 1. На основании этого сопоставления можно предположить, что попытки прервать искусственную вспышку инфекционной болезни, воздействуя на звенья классической триады эпидемического процесса, окажутся неэффективными, так как такой триады при искусственно вызванных эпидемиях не может быть в принципе. Имеющиеся данные по динамике развития террористических вспышек инфекционных болезней [1–6] позволяют выделить два сценария биологического теракта или диверсии: 1) когда биологический агент применяется преступниками однократно; 2) когда его применяют многократно. Соответственно, можно выделить два типа развития искусственного эпидемического процесса.
Эпидемиология вспышки инфекционной болезни, вызванной однократным применением биологического агента. Характерной особенностью эпидемиологии таких вспышек инфекционных болезней можно считать сжатую эпидемическую кривую с пиком заболеваемости, укладывающимся в среднее значение инкубационного периода болезни. При большинстве естественно возникающих эпидемий наблюдается постепенный рост числа заболевших (предэпидемическая стадия), так как люди постепенно вступают в контакт с возрастающим числом больных, насекомых — переносчиков инфекции или объектов в окружающей среде, являющихся передатчиками патогенного микроорганизма (рис. 1).
В противоположность естественно возникающим эпидемиям, люди, ставшие объектом нападения с применением биологического оружия (БО), должны вступить в контакт с биологическим агентом примерно в одно и то же время. Сжатая эпидемическая кривая будет наблюдаться в большинстве случаев экспонирования к точечному источнику инфекции, включая и умышленно вызванные вспышки пищевого отравления [2]. Такая кривая зависит от инкубационного периода и характера течения болезни.
В качестве примера искусственно вызванных вспышек инфекционных болезней данного типа рассмотрим модель, разработанную Kaufmann et al. [1]. Ее авторы провели теоретическую оценку последствий биотеррористического нападения на пригород крупного города. Они исходили из того, что нападение производится путем генерирования мелкодисперсного аэрозоля биологического агента вдоль линии и поперек направления ветра (линейный источник — см. ниже). Аэрозольное облако проходит над площадью цели за период времени в пределах 2 ч. Предполагалось также, что ингалируемая доза составила не менее одной ID50 (infectious dose 50 % — количественный показатель вирулентности возбудителя инфекционной болезни, выражаемый значением инфицирующей дозы, которая при данном пути заражения вызывает развитие болезни у 50 % экспериментальных животных).
Человек, который экспонировался к облаку спор B.anthracis в любой точке в период 2 ч его прохождения, вдыхал одну ID50, а человек, который экспонировался к B.melitensis или F.tularensis, вдыхал от одной до десяти ID50, в зависимости от его близости к источнику аэрозоля.
Эпидемическая кривая для ингаляционного поражения спорами возбудителя сибирской язвы, рассчитанная по суткам после экспонирования, давала 0 % случаев на период менее одних суток, 5 % — через сутки, 20 % — через 3 суток, 35 % — через 4 суток, 20 % — через 4 суток, 10 % — через 5 суток, 5 % — через 6 суток и 5 % — через 7 и более суток (рис. 2).
/tirag/120/120.jpg)
Летальность также варьировала в зависимости от суток, в которые были замечены первые симптомы. Для пациентов с симптомами, появившимися в первые сутки, летальность считалась равной 85 %. Для пациентов с симптомами, появившимися на 2-е сутки, — 80 %; при появлении симптомов на 3-и сутки — 70 %; на 4–6-е сутки — 50 %; на 7-е и последующие сутки — 70 %. Возросшая летальность среди заболевших при инкубационном периоде 4 и более суток рассчитывалась, исходя из допущения запаздывания диагностики и, как следствие, начала лечения.
Эпидемическая кривая для ингаляционного поражения возбудителем бруцеллеза по суткам после экспонирования характеризовалась 4 % случаев в интервале 0 суток, 6 % случаев — 8 суток, 14 % — от 15 до 28 суток, 40 % — от 29 до 56 суток, 26 % — от 57 до 112 суток, 10 % — от 113 суток и далее. Летальность оценивалась на уровне 0,5 %.
Эпидемическая кривая для ингаляционного поражения возбудителем туляремии по суткам после экспонирования предполагалась следующей: в период менее одних суток — 0 % случаев, 1 сутки — 1 %, 2 суток — 15 %, 3 суток — 45 %, 4 суток — 25 %, 5 суток — 10 %, 6 суток — 3 %, 7 и более суток — 1 %. Оцениваемая летальность составляла 7,5 %.
Наивысший пик поступления в лечебные учреждения людей, больных сибирской язвой и туляремией, будет иметь место на 3-и сутки после однократного применения террористами сибиреязвенной или туляремийной рецептуры. Пик поступления больных бруцеллезом можно ожидать в интервале от 29 до 56 суток. Если биологический агент вызывает такую клиническую форму болезни, когда больной способен образовать эпидемическую цепочку (легочные случаи чумы, натуральная оспа), то после первого пика может появиться второй вследствие того, что первоначально экспонированные люди могут инфицировать тех, кто не экспонировался до этого [2, 3].
Локализованность эпидемического очага (эпидемиология точечного источника). Это вторая характерная особенность искусственного эпидемического процесса, вызванного однократным ингаляционным применением биологического агента. Вспышка болезни возникает с подветренной стороны от возможной точки атаки аэрозолем. Если появится подозрение, что вспышка вызвана ингаляционным инфицированием людей (например, после выявления «патологии мелкодисперсного аэрозоля»; см. ниже), то среди заболевших можно определить круг лиц, находившихся в зоне прохождения аэрозольного облака. Зная инкубационный период болезни, можно с точностью до одних суток установить дату биологического нападения.
Полоса поражения будет зависеть от способа рассеивания биологических агентов и высоты источника аэрозоля над местностью. Известны три способа рассеивания биологических агентов [10].
1. Рассеивание точечным источником — предполагает рассеивание аэрозоля стационарным генератором из одной точки.
2. Рассеивание линейным источником — аэрозоль возбудителя инфекционной болезни рассеивается по одной линии либо по множеству линий, прочерченных поперек направления ветра. Например, такими линейными источниками будут установленные или сброшенные с одного или нескольких самолетов (других транспортных средств) источники аэрозоля (бомбы малого калибра или другие диспергирующие устройства). В последнем случае формируется линия небольших точечных источников, дающих широкую полосу аэрозоля по поверхности земли. Распределение людей, получивших ингаляционное поражение, будет зависеть от высоты линейного источника аэрозоля.
3. Рассеивание многоточечным источником — источники аэрозоля расположены на местности (или над местностью) в произвольном порядке. Каждый из них представляет собой небольшой точечный источник, зона поражения одного источника перекрывается другим. Наиболее вероятно использование такого способа для применения биологических агентов с низкой вирулентностью, например спор сибирской язвы. Их инфицирующая доза для человека при ингаляционном поражении находится в пределах 8–50 тыс. спор, что значительно больше, чем у других потенциальных агентов БО. Локализованность эпидемического очага может иметь место и при умышленном распространении возбудителя инфекции продуктами питания и водой.
Эпидемиология вспышки инфекционной болезни, вызванной многократным применением биологического агента. Опыт эпидемиологического расследования уже совершенных биологических террористических актов показывает, что характерной особенностью психологии преступников, решившихся на такое преступление, является их способность к многократным попыткам его осуществления на протяжении месяцев и даже лет [5, 12]. Будучи неудовлетворенными полученными результатами, они повторяли попытки инфицирования людей до тех пор, пока не получали нужный результат или убеждались в невозможности его получения. Кроме того, одновременно могут действовать несколько групп биотеррористов. Многократным контаминированием преступниками пищи в салат-барах была вызвана масштабная вспышка сальмонеллезного гастроэнтерита в Далласе в 1984 г., длившаяся почти полтора месяца [5]. Почтовая рассылка не менее четырех конвертов с сухой рецептурой спор возбудителя сибирской язвы стала причиной вспышек ингаляционной и кожной форм сибирской язвы в США в сентябре – октябре 2001 г. [11]. Секта «Аум-Синрике» в начале 1990-х гг. в течение нескольких лет пыталась вызвать поражение населения Японии ботулиническим токсином или спорами B.anthracis [12, 13]. И только после многочисленных неудач секта приступила к подготовке терактов с использованием зарина. Поэтому распространенное среди специалистов представление о сжатой эпидемической кривой биологического террористического акта верно не для всех возможных сценариев. При многократном использовании террористами биологических агентов возникнет несколько первичных очагов инфекционных болезней, появление которых будет растянуто во времени, значительно превышающем средний инкубационный период болезни. Так как террористы способны подвергнуть биологической атаке несколько объектов, находящихся на значительном удалении друг от друга, то эпидемиологам не удастся очертить границы одного очага поражения, привязанного к прохождению аэрозольного облака. Для такого террористического акта (диверсии) характерной особенностью будет растянутая эпидемическая кривая, отражающая многократное экспонирование людей к биологическому агенту, и обширная территория, на которой их придется выявлять (рис. 3).
При осуществлении биологической диверсии многократное применение биологического агента может иметь своей целью имитацию природной вспышки инфекционной болезни. В этом случае основным критерием для установления искусственного эпидемического процесса станет его невозможная эпидемиология (см. ниже).
Впоследствии, когда картина вспышки прояснится, можно будет проследить сжатые эпидемические кривые в ее отдельных локализованных очагах [6, 11].
Характерным для такого террористического акта или диверсии будет одновременное появление сразу нескольких инфекционных болезней с невозможной эпидемиологией.
Эпидемиологические особенности искусственно вызванной вспышки инфекционной болезни, характерные для обоих сценариев биологического нападения. К наиболее важным из них можно отнести следующие.
Невозможная эпидемиология. Эта особенность искусственных эпидемических процессов, свидетельствующая о том, что на момент вспышки инфекционной болезни в природе не существовало условий для ее развития. Например, эпидемиология лошадиных энцефалитов у людей тесно связана с экологией вирусов — возбудителей болезни в естественно возникающих эндемических очагах. Сведения о широком распространении случаев инфицирования вирусом венесуэльского энцефалита лошадей среди людей за пределами известных эндемических районов при отсутствии условий для природной трансмиссии — комаров-переносчиков и наличия этой болезни у лошадей следует рассматривать как свидетельствующие о неестественном попадании вируса в кровь людей. К невозможной (неправильной) эпидемиологии также нужно относить все случаи появления болезни, которая является необычной для данного географического района, особенно если таких болезней появляется сразу несколько [2]. К ним целесообразно отнести и те вспышки, когда болезнь возникает вне рамок обычного сезона, благоприятного для распространения ее возбудителя, или в отсутствие возможности естественного переноса обычно выполняющими эту функцию переносчиками [3].
Кожная форма сибирской язвы в США, вспыхнувшей в разных штатах осенью 2001 г., вызвала подозрение об искусственном происхождении после того, как эпидемиологами не был найден источник возбудителя инфекции, обычно выявляемый в случаях естественного инфицирования людей (контакт с мясом или кожей погибших от сибирской язвы животных). Эти подозрения усилились при обнаружении ингаляционных случаев сибирской язвы у людей, не связанных с производственными условиями, при которых возможно образование аэрозоля спор B.anthracis [11].
Особенно сложный характер приобретает установление невозможной эпидемиологии вспышки болезни в тех случаях, когда злоумышленники пытаются замаскировать свою акцию под естественный случай, например, моделированием естественного механизма передачи возбудителя или вызвать вспышку болезни в эндемическом по данному возбудителю районе. Действующие в природе механизмы поддержания возбудителей инфекционных болезней и развития самих эпидемий настолько сложны, что их невозможно подделать. Поэтому при появлении групповых заболеваний среди людей необходимо проследить всю цепочку, по которой возбудитель инфекционной болезни проник в человеческую популяцию, но уже в обратном направлении — от заболевших лиц к природному резервуару. Эпидемическая цепочка всегда состоит из нескольких звеньев. В случае искусственного происхождения эпидемии отдельные звенья в цепочке отсутствуют. Кроме того, конкретный природный очаг инфекции всегда содержит определенные возбудители с характерными для них свойствами. Природные популяции возбудителей инфекций, как правило, гетерогенны. Но террорист не может просто взять и заменить в существующем резервуаре природный штамм на тот, который ему захочется, либо исключить его из действующей эпидемической цепочки. И если в данном регионе ведется постоянный мониторинг свойств штаммов микроорганизмов (серологические, культуральные, морфологические и биохимические свойства, плазмидный состав и др.), циркулирующих в эпидемических и эпизоотических цепочках, то отличить «своего» от «чужого» при отсутствующих звеньях эпидемической цепи вполне возможно.
Примеры расследования преступлений, совершенных с использованием биологического агента, когда преступники пытались замаскировать их под естественные вспышки энтероинфекции, приведены в литературе [5, 24]. В обоих случаях именно несоответствие штамма микроорганизма, примененного злоумышленниками для поражения людей, тому, который мог вызвать вспышку болезни в данном регионе, послужило основанием для эпидемиологов предположить ее искусственное происхождение.
Обнаружение биологических агентов, измененных с помощью методов генной инженерии или тех штаммов, про которые известно, что они исследуются как потенциальные агенты БО. Наглядный пример — обнаружение преодолевающего иммунитет (vaccine-resistant) и устойчивого к пенициллинам третьего поколения штамма Ames во время почтовой вспышки сибирской язвы в США осенью 2001 г. [11, 14].
Однако обнаружение в очаге подозрительной вспышки резистентных к антибиотикам штаммов возбудителей инфекционных болезней, потенциальных агентов БО, свидетельствует о ее искусственном характере только в совокупности с другими эпидемическими признаками искусственного эпидемического процесса (эпидемиология точечного источника и/или невозможная эпидемиология и др.). В ином случае такая находка может оказаться расширением наших знаний о живой природе. Например, в Индии был выделен природный штамм B.anthracis, устойчивый к пенициллинам, обычно используемым для лечения сибирской язвы [15], а на Мадагаскаре обнаружен штамм Y.pestis, резистентный к стрептомицину [16].
Невозможная клиническая форма болезни. Невозможная в том смысле, что она не встречается при естественном заражении данным возбудителем. Например, кожная форма сибирской язвы хорошо известна инфекционистам, и она наиболее часто встречается среди людей, контактирующих с мясом и шкурами болевших сибирской язвой животных. Ее характерное проявление — сибиреязвенный карбункул. Однако при парентеральном введении B.anthracis развивается не знакомая инфекционистам локальная форма сибирской язвы без развития карбункула, но с обширными некрозами и отеками в участке инъекции [17–19]. Частным случаем невозможных клинических форм болезни является патология мелкодисперсного аэрозоля.
Патология мелкодисперсного аэрозоля. Переведение биологических поражающих агентов в аэрозоль с дисперсной фазой 1–5 мкм — наиболее вероятный и эффективный способ их применения. Осуществляется с помощью специальных диспергирующих приборов и боеприпасов. Легочные формы инфекционных болезней, возбудителей которых специалисты относят к поражающим агентам БО, при естественном пути заражения встречаются очень редко как казуистика (легочные формы сибирской язвы, чумы, туляремии и др.) и имеют специфическую патологию. К патологии мелкодисперсного аэрозоля целесообразно отнести только поражения, вызванные проникновением в глубокие отделы легких аэрозоля биологических поражающих агентов с размером частиц менее 5 мкм (рис. 4).
Этот размер частиц позволяет биологическому агенту длительное время находиться в воздухе во взвешенном состоянии и после вдыхания проникать в альвеолы человека. Инфицирующие частицы такого размера обычно не встречаются в природных очагах инфекционной болезни. Их невозможно создать без специального оборудования (жидкий аэрозоль) или знания засекреченных технологических процессов, позволяющих получать, хранить и применять сухие биологические рецептуры такой дисперсности. Обнаружение патологии мелкодисперсного аэрозоля у жертв биологического нападения говорит о высоком уровне его подготовки и крайней опасности для общества организации, его осуществившей (табл. 2).
Крупнодисперсные аэрозоли биологических поражающих агентов тоже способны вызывать поражения у людей, но при на порядок больших инфицирующих дозах. Комментируя описанные отдельными авторами закономерности патогенеза и клиники инфекционной болезни, вызванной аэрозолями поражающего агента с различным размером частиц, Огарков и Гапочко [21], основываясь на своем опыте аналогичных исследований, отметили, что эти закономерности не являются непреложными для каждого конкретного случая. При очень высокой концентрации мелкодисперсного аэрозоля инфицирование человека может происходить не через легкие, а через верхние дыхательные пути или одновременно через эти два отдела дыхательного тракта. Вместе с тем относительно крупные частицы аэрозоля при высоких концентрациях и длительной экспозиции способны проникать в глубокие отделы легких и инициировать развитие патологического процесса. К тому же такие частицы способны дезинтегрироваться в органах дыхания и проникать в глубокие отделы дыхательного тракта.
Распространенность легочных поражений. По мнению ряда специалистов, такие поражения свидетельствуют о террористическом акте [3, 22]. Однако легочных поражений может вообще не быть в следующих случаях:
1) возбудитель инфекционной болезни не вызывает легочных поражений при любом способе инфицирования (например, бруцеллы, вирусы лошадиных энцефалитов и ботулинические токсины);
2) биологический агент попал в организм человека с пищей или водой (возбудители энтероинфекций) или был введен ему в кровь (токсины);
3) частицы примененной преступниками рецептуры не обладают дисперсностью, позволяющей возбудителю инфекционной болезни проникать в глубокие отделы легких человека.
Последний случай продемонстрировали результаты расследования биотеррористического акта в США в 2001 г. Рецептура спор возбудителя сибирской язвы, содержащаяся в поврежденных почтовых конвертах, под воздействием влаги «скомковалась», и поэтому она вызвала только кожные формы болезни у людей лишь при непосредственном контакте с их кожей [11].
Как и в случае с антибиотикорезистентными штаммами возбудителей инфекционных болезней, обнаружение вспышки инфекционной болезни с преобладанием больных с поражениями легких свидетельствует о ее искусственном характере только в совокупности с другими признаками искусственного эпидемического процесса (эпидемиология точечного источника и/или невозможная эпидемиология, патология мелкодисперсного аэрозоля и др.).
Эпидемиологическое расследование искусственно вызванной вспышки инфекционной болезни. Складывается из последовательного выполнения трех этапов: сбора эпидемиологических данных, описательного и аналитического этапа. Эпидемиологическое расследование искусственно вызванной вспышки инфекционной болезни проводится с целью выявления всех эпидемических обстоятельств и последствий преступления, совершенного с помощью биологических агентов.
Текущее расследование начинается после выявления признаков искусственной вспышки инфекционной болезни (эпидемиология точечного источника, неправильная эпидемиология и др.) на любом этапе эпидемиологического расследования вспышки инфекционной болезни, считавшейся возникшей естественным путем. Эпидемиологическое расследование проводится заново.
Ретроспективное расследование проводится в отношении завершившейся вспышки инфекционной болезни после того, как правоохранительным органам станет известна причастность к ней какой-либо преступной организации.
Текущее эпидемиологическое расследование в очаге искусственно вызванной вспышки инфекционной болезни. Опыт, накопленный в ходе расследования искусственных вспышек сальмонеллеза, дизентерии Шмитца и сибирской язвы [11, 20, 23, 24], показывает, что распознание искусственного характера вспышки возможно еще на этапе сбора эпидемиологических данных.
После установления признаков искусственного характера вспышки прежде всего меняется понимание эпидемического очага. В контексте развития искусственных эпидемических вспышек — это территория, на которой произошло применение (преднамеренное распространение) биологического агента, способного вызывать инфекционный процесс или другие поражения у людей. Протяженность такого очага, его границы определяются замыслом преступления; техническими возможностями преступников; выбранным ими объектом преступления; моделью территории, на которой совершено биологическое нападение; дисперсностью рецептуры биологического агента; метеоусловиями в момент применения биологического агента и другими подобными факторами. Далее вносятся коррективы в уже проведенный сбор эпидемиологических данных.
Учитывая то обстоятельство, что деятельность преступников еще не пресечена, необходимо выделить случай искусственного эпидемического процесса. То есть в стандартное клиническое определение случая болезни внести дополнения, отражающие все варианты течения инфекционного процесса (поражения), зависящие от особенностей применения данного биологического агента, включая еще не обнаруженные клинические случаи. Например, при расследовании биотеррористического акта в США в 2001 г. вспышки кожной и ингаляционной форм сибирской язвы с неправильной эпидемиологией, наблюдаемые в разных штатах, были объединены в одно эпидемиологическое расследование [23]. Впоследствии установлено, что они вызваны одной и той же рецептурой возбудителя сибирской язвы, но имеющей разный агрегатный состав [11].
Для сбора данных об обстоятельствах, приведших к поражению биологическими агентами, проводится анализ научной литературы на предмет описания сходных случаев и построения аналогий: анализируются истории болезни в стационарах и поликлиниках, поднимаются протоколы патологоанатомических вскрытий. По ним выявляются больные (умершие), которые могли иметь клинику болезни, подходящую под описание случая искусственного эпидемического процесса; проводятся опросы (анкетирование) пораженных людей; выполняются медицинские осмотры лиц, находившихся на территории эпидемического очага и пока не имеющих клинических признаков болезни.
Вопросы анкеты формулируются в зависимости от особенностей вспышки. При опросе заболевших (либо родственников погибших) надо выяснить, где заболевшие (погибшие) были в период времени, соответствующий среднему инкубационному периоду болезни, особенно выявляя те места, где состояние атмосферы или окружающая обстановка могли быть благоприятными для поражения аэрозолем. Составить почасовую раскладку территориальных перемещений пациента в течение нескольких дней за период не менее 2/3 среднего инкубационного периода болезни (объем проводимой работы будет зависеть от количества пациентов и ресурсов эпидемической службы). Нанести эту информацию на карту по улицам и зданиям по каждому заболевшему (умершему). При выявлении территориальных совпадений в перемещении больных и погибших исследовать участки их пересечения с максимально возможной точностью.
Выполняются лабораторные исследования материала от пораженных людей, животных и объектов внешней среды и других мест предполагаемого применения биологического агента. При сборе информации об искусственном эпидемическом процессе надо иметь в виду, что в отсутствие эпидемической настороженности врачами могут быть поставлены другие диагнозы, не противоречащие наблюдаемой ими клинике болезни. Например, больные с бубонной формой чумы или туляремии могут регистрироваться как больные с неспецифическими лимфаденитами и лечиться в хирургических стационарах. Больные с кожной сибирской язвой — пройти незамеченными под диагнозом «дерматит», больные с кишечной сибирской язвой — остаться нераспознанными под диагнозом «острая токсикоинфекция». Больные с легочной формой туляремии — острого респираторного заболевания или пневмонии (очаговая, сегментарная или долевая).
На описательном этапе эпидемиологического расследования искусственного эпидемического процесса выполняется исследование интенсивности, динамики, пространственной характеристики и структуры заболеваемости в очагах. Сопоставляются данные морфологического, иммунологического, биохимического и генетического исследования штаммов микроорганизмов, выделенных в очагах вспышек (от больных и погибших; из окружающей среды в местах экспонирования людей к биологическому агенту; находящихся на остатках устройств, с помощью которых они были применены, и обнаруженных в лаборатории преступников). Данные по интенсивности эпидемического процесса на определенных территориях (в коллективах) дают возможность эпидемиологам установить масштаб вспышки, их количество и возможные объекты преступления. Данные по динамике эпидемического процесса (распределение абсолютных чисел или частотных показателей во времени) позволяют установить кратность применения биологического агента.
Пространственная характеристика эпидемического процесса позволяет получить представление о модели территории, на которой произошло применение биологического агента, и о способе его применения. Структура заболеваемости дает представление: 1) об объекте преступления (если распределение частотных показателей проводится в отношении каких-то групп населения); 2) качестве использованной биологической рецептуры (патология мелкодисперсного аэрозоля свидетельствует о тщательности подготовки преступления и высоком технологическом уровне террористической организации либо ее «кукловодов»); 3) близости жертв биологического нападения к источнику аэрозоля (распределение частотных показателей проводится в отношении клинических форм болезни, вызванных крупнодисперсными и мелкодисперсными аэрозолями).
Установление причастности одних и тех же штаммов возбудителя инфекционной болезни к разным вспышкам и обнаружение их в лаборатории преступников позволяет получить полную картину замысла преступления и путей распространения возбудителя инфекционной болезни в искусственном эпидемическом процессе.
На аналитическом этапе эпидемиологического расследования искусственного эпидемического процесса анализируются технические аспекты биологического нападения. По результатам этого анализа выдвигается предположение о техническом устройстве или способе, использованном для осуществления биологического нападения. По уровню осуществления биологического нападения, клинике болезни, патанатомии, эпидемиологии и другим данным, полученным при эпидемиологическом расследовании в очаге искусственного эпидемического процесса, составляется описание причастной к преступлению организации с указанием уровня образования ее членов, их профессиональных навыков и потенциальных возможностей; строится модель биотеррористического акта (диверсии): делается предположение о возможных связях организации с зарубежными и отечественными организациями, обладающими технологиями, использованными для совершения преступления.
Ретроспективное эпидемиологическое обследование очага искусственно вызванной вспышки инфекционной болезни. Типичным примером такого расследования можно считать расследование инцидента с возбудителем сибирской язвы в районе Kameido Токио в 1993 г. [12]. Проведение такого расследования предполагает те же этапы, что и при текущем расследовании искусственного эпидемического процесса. Однако у эпидемиологов может не оказаться образцов, взятых с объектов окружающей среды, чистой культуры возбудителя инфекционной болезни и информации об эпидемии от непосредственно вовлеченных в нее лиц.
Обнаружение искусственного поражения возбудителем сибирской язвы. Сибирская язва (Anthrax) — опасная сапрозоонозная инфекционная болезнь людей и животных, вызываемая спорообразующей бактерией Bacillus anthracis. Характеризуется острым началом, тяжелой интоксикацией, лихорадкой, септицемией, возникновением отеков и карбункулов. Протекает в кожной, легочной и кишечной формах. С Первой мировой войны B.anthracis неоднократно применялась для осуществления биологических террористических актов и диверсий. В США и в Соединенном Королевстве с середины 1940-х гг. возбудитель сибирской язвы изучался как летальный агент БО. Для его боевого применения разрабатывались специальные рецептуры и боеприпасы. В первой половине 1952 г. их применяли для поражения войск и населения Северной Кореи и Северо-Восточного Китая. Специальные рецептуры на основе B.anthracis и снаряженные ими боеприпасы находились на вооружении американской армии до 1968 г. под шифром «N».
Одна из сибиреязвенных рецептур, созданная в USAMRIID, использована для осуществления биотеррористического акта в США в сентябре — октябре 2001 г. [6, 11, 23]. Наиболее вероятно их применение посредством использования многоточечных источников и диверсионными (террористическими) методами.
Основным критерием для раннего распознания искусственного происхождения вспышки сибирской язвы может быть невозможная эпидемиология болезни. Естественное происхождение кожной формы болезни предполагает указание в анамнезе на контакт с инфицированным B.аnthracis мясом, шкурами животных или почвой. Отсутствие такого контакта при наличии сибиреязвенного карбункула на коже пациента дает основание для выявления иных источников возбудителя болезни. Например, ими могут оказаться вскрытые конверты с неизвестным порошком, подарки или предметы, полученные им от других людей (организаций). А так как количество сухой сибиреязвенной рецептуры, способной вызвать кожную форму сибирской язвы, обычно незначительно и заболевший может ее не заметить, то необходимо:
1) поинтересоваться у него наличием подобных поражений на коже у лиц из его ближайшего окружения (родственники, коллеги по работе и др.);
2) провести сбор эпидемиологических данных среди этого окружения пациента. В случае обнаружения больных с кожной формой сибирской язвы необходимо расспросить их по поводу возможных контактов с источниками инфицирования B.anthracis, включая контакты с неизвестным порошком.
Кишечная форма сибирской язвы может быть предположена при обнаружении выраженного несоответствия между крайне тяжелым состоянием больного и отсутствием к тому локальных данных в сочетании с прогрессирующим упадком сердечной деятельности; тяжелыми нарушениями со стороны желудочно-кишечного тракта (ЖКТ) (тупые боли в животе, рвота, непостоянный жидкий стул); обнаружением присутствия экссудата в брюшной полости (действие токсина B.anthracis). На вскрытии: множественные карбункулы и очаговые геморрагические инфильтраты в тонких кишках и в верхнем отделе толстой кишки; явления серозного перитонита; геморрагический менингоэнцефалит; геморрагический лимфаденит забрюшинных и брыжеечных лимфатических узлов [25].
Подозрения об искусственном происхождении кишечной сибирской язвы обоснованы, если выявлен разрыв в цепочке движения инфицированного продукта от естественного источника заражения. Например, споры B.anthracis обнаружены в котлетах, но отсутствуют в мясе, из которого сделан фарш для котлет. Даже если они попали в продукт, вызвавший вспышку кишечной сибирской язвы, с какого-то оборудования (разделочные столы, котлы, мясорубки и т.п.), то для исключения искусственной контаминации должен быть выявлен природный источник возбудителя болезни, контаминировавший это оборудование ранее.
Любой случай ингаляционной сибирской язвы, обнаруженный среди жителей городов, не имеющих отношения к переработке шерсти и кожи животных, должен рассматриваться с точки зрения его искусственного происхождения. Подозрение об искусственном характере вспышки уже после установления диагноза «ингаляционная сибирская язва» может быть основано на следующем сочетании данных рентгенологического исследования и компьютерной томографии, клинических проявлений болезни и результатов вскрытия [11, 26]:
1) на рентгенограммах и компьютерных томограммах — наличие патологических процессов в паренхиме легких. Им будут сопутствовать характерные для ингаляционной сибирской язвы патологические процессы в медиастинуме (медиастинальное расширение, паратрахеальные утолщения, хиларные утолщения и др.) и в плевре (экссудативный плеврит) (рис. 5);
/tirag/128/128.jpg)
2) среди клинических проявлений болезни в числе ранних симптомов — наличие обильного пота; а при анализе клинической картины болезни в целом — отсутствие короткого периода улучшения состояния больного между начальной и молниеносной фазами болезни, характерного для легочной сибирской язвы, возникающей в результате естественного заражения;
3) среди патологоанатомических находок — выраженный геморрагический медиастенит, уплотнения в легких, при микроскопическом изучении — выраженный некроз и геморрагии лимфатических узлов, интраальвеолярный и интерстициальный отек с фокальными геморрагиями и фибриновыми отложениями в легких, некроз селезенки. Нет признаков первичного вовлечения в инфекционный процесс ЖКТ (т.е. карбункулы в пищеводе, желудке, тощей и подвздошной кишке не обнаружены).
Парентеральное введение B.аnthracis можно предположить у лиц, получавших какие-либо медицинские назначения, сопровождавшиеся инъекциями, и у инъекционных наркоманов. При подкожном инфицировании человека возбудителем сибирской язвы возможны следующие группы симптомов: повышенная температура тела, обширные воспаления и отеки подкожной клетчатки, прилегающей к участкам, используемым для инъекционного введения, и признаки регионарного лимфаденита. Внутривенное инфицирование B.anthracis можно предположить в случае внезапной («апоплексической») смерти человека, при вскрытии которого выявляются признаки серозного или серозно-геморрагического полиаденита, полнокровие и дистрофические изменения в паренхиматозных органах, кровоизлияния в легких [17–19, 27, 28].
При установлении этиологии болезни наиболее целесообразно использование полимеразной цепной реакции. Нельзя считать надежными тесты на получение гемокультур B.anthracis и на IgG-антитела к протективному антигену сибиреязвенного токсина. В случае быстрой смерти пациента IgG-антитела к протективному антигену сибиреязвенного токсина могут не успеть образоваться. Рост возбудителя сибирской язвы на питательных средах в случаях, когда кровь у пациента была отобрана на первой стадии болезни, имел место для всех тех больных, которым не проводилась антибиотикотерапия. Но кровь становится стерильной после начала лечения пациента антибиотиками [11].
Выявление причин эпизоотий сибирской язвы среди сельскохозяйственных животных при расследовании таких преступлений не менее важно, чем выявление причин вспышек среди людей. Во-первых, эпизоотии формируют первые звенья эпидемической цепи, ведущей B.аnthracis в человеческие популяции. Их прослеживание позволяет сделать рабочие предположения об искусственном или, наоборот, естественном происхождении вспышки сибирской язвы среди людей. Во-вторых, сами эпизоотии могут быть вызваны искусственно при осуществлении саботажа путем непрямых действий. Основную роль в распространении сибирской язвы среди населения в этом случае сыграет зараженное B.anthracis мясо. Именно таким образом неустановленными преступниками была вызвана вспышка сибирской язвы в Свердловске весной 1979 г. Поэтому надо обязательно убедиться в том, что в регионе, где выявлена сибирская язва среди животных, существуют природные условия для ее возникновения, а инфицирование животных произошло из природного резервуара. Далее, используя VNTR-анализ (variable-number tandem repeat — варьирующие по числу тандемные повторы) и анализ полногеномного полиморфизма отдельных нуклеотидов, необходимо убедиться в том, что штамм B.anthracis, вызвавший эпизоотию, характерен для данного региона, и что именно он вызвал вспышку сибирской язвы среди людей.
При поиске доказательств генетического вмешательства в геном возбудителя сибирской язвы необходимо учитывать следующие обстоятельства. Обнаружение в очагах эпизоотий штаммов B.аnthracis, устойчивых к отдельным антибиотикам, еще не говорит в пользу того, что штаммы были генетически изменены. Однако их надо рассматривать как генетически измененные и передавать специалистам для плазмидного и сиквенс-анализа в случаях, если они обнаружены:
1) при обстоятельствах, которые относятся к неправильной эпидемиологии;
2) у штамма B.аnthracis обнаружена резистентность сразу к нескольким антибиотикам, используемым в распространенных схемах экстренной специфической профилактики и лечения сибирской язвы (например, пенициллины и ципрофлоксацин, пенициллины и тетрациклин или доксициклин);
3) штамм B.аnthracis оказался способным «пробить» иммунитет, созданный у человека менее года назад полноценной вакцинацией живыми или комбинированными сибиреязвенными вакцинами.
Обнаружение искусственного поражения возбудителем чумы. Чума (pestis, plague, black death) — опасная сапрозоонозная инфекционная болезнь людей и животных, вызываемая неспорулирующейся бактерией Yersinia pestis. Характеризуется острым началом, тяжелой интоксикацией, лихорадкой, септицемией, помрачением сознания, возникновением бубонов и карбункулов. Протекает в кожной, легочной и септицемической формах. Карантинная инфекция. Особую опасность возбудителю чумы придает его способность при легочной форме болезни распространяться между людьми.
Попытки диверсионного применения культур Y.pestis и зараженных чумой грызунов замечены еще в годы Первой мировой войны. С начала 1930-х гг. и до окончания Второй мировой войны возбудитель чумы активно исследовался японскими военными как потенциальный агент БО. Он неоднократно применялся ими в варварских экспериментах на людях и для осуществления биологических диверсий против китайских войск и мирного населения Китая. В США и в Соединенном Королевстве с середины 1940-х гг. возбудитель чумы изучался как летальный агент БО. До 1968 г. рецептуры на основе возбудителя чумы находились на вооружении американской армии под шифром «N». Наиболее вероятно применение Y.pestis посредством использования линейных и многоточечных источников и диверсионными (террористическими) методами [29–31].
Основным критерием для раннего распознания искусственного происхождения вспышки сибирской язвы могут быть невозможная эпидемиология и невозможная клиника болезни. Естественной вспышке чумы среди людей (в бубонной, септической и легочной формах), даже ограничившейся единичными случаями болезни, должны предшествовать чумные эпизоотии среди грызунов; прослеживаться эпидемическая цепочка от местностей, где чумные эпизоотии замечены, к людям, инфицированным возбудителем чумы.
В случае возникновения подозрения об искусственном характере чумной вспышки важно принять во внимание то, что экология возбудителя чумы сложна и плохо изучена. Появление на территории, длительное время свободной от чумы, больных чумой грызунов и инфицированных Y.рestis блох, может свидетельствовать об активизации древнего и забытого очага чумы. Поэтому необходимо по историческим источникам убедиться в том, что вспышки чумы на данной территории имели место в прошлом [32].
Крупным естественным вспышкам легочной чумы предшествуют локальные вспышки бубонной и легочной чумы на территориях активизировавшихся природных очагов чумы. Движение легочной чумы в таких случаях прослеживается по больным легочной чумой, выявленным на транспортных коммуникациях. Обычно крупные естественные вспышки легочной чумы не имеют единого центра развития и представляют собой растянутый во времени процесс распространения бронхолегочной чумы. Крупные эпидемии бубонной и легочной чумы имеют длительный период (до нескольких десятилетий) небольших вспышек-предшественников, свидетельствующих о постепенном «разогреве» природного очага чумы [32].
Подозрения об искусственном характере вспышки бубонной чумы обоснованы при обнаружении в общественных местах блох, инфицированных Y.pestis, связь которых с больными чумой грызунами установить не удается. Такие вспышки ограничиваются единичными заболевшими.
В природных очагах чумы вторично-легочная чума развивается на фоне вспышек бубонной чумы как ее осложнение. Первично-легочная чума, возникшая у человека в результате воздушно-капельной инфекции, в основном развивается как нисходящая бронхопневмония. В инфекционный процесс вовлекаются слизистая верхних дыхательных путей, лимфоидная ткань миндалин, плевра, перибронхиальные лимфатические узлы. На рентгенограммах выявляются затемнения долей легких и признаки экссудативного плеврита. В отличие от нее случаи первично-легочной чумы, развившиеся в результате непосредственного экспонирования человека к мелкодисперсному аэрозолю возбудителя чумы, преимущественно будут представлены невозможными клиническими формами болезни — очаговыми поражениями в нижних долях легких (очаговые затемнения легочной ткани на рентгенограмме) без вовлечения в инфекционный процесс слизистой верхних дыхательных путей, лимфоидной ткани миндалин, листков плевры, перибронхиальных лимфатических узлов. Тяжесть таких поражений у отдельного человека (при прочих равных условиях) будет зависеть от ингалированной им дозы возбудителя чумы, вирулентности штамма и дисперсности аэрозоля. Вторичные случаи первично-легочной чумы в очаге поражения мелкодисперсным аэрозолем, т.е. возникшие в результате воздушно-капельной передачи возбудителя болезни от людей, заболевших легочной чумой в результате экспонирования к аэрозолю, будут протекать как типичная чумная бронхопневмония [20, 32].
При поиске доказательств генетического вмешательства в геном возбудителя чумы необходимо учитывать, что генетика Y.pestis изучена детально. Для Y.pestis могут быть использованы методы генетической модификации и векторы клонирования, разработанные для E.coli и других грамотрицательных микроорганизмов. В Y.pestis в условиях in vitro легко переносятся плазмиды вирулентности близкородственных микроорганизмов, и наоборот [33].
В очагах искусственно вызванных вспышек чумы с наибольшей вероятностью можно встретить штаммы возбудителя чумы со следующими модификациями (и их сочетаниями):
— резистентные к антибиотикам, используемым в распространенных схемах лечения чумы (стрептомицин, хлорамфеникол, гентамицин);
— обладающие более высокой вирулентностью, чем исходные природные штаммы (введение в Y.pestis генов токсинов и иммунорегуляторных белков);
— с измененной антигенной специфичностью, «пробивающие» иммунитет, создаваемый коммерческими вакцинами.
Дифференцировать генетически измененные Y.pestis от их природных вариантов по фенотипическим признакам сложно из-за поддержания в природных резервуарах большого количества атипичных штаммов Y.pestis. Генотипическое и фенотипическое разнообразие наблюдают даже среди чумных изолятов из одного и того же природного очага [34].
Ответ на вопрос о том, является ли штамм Y.pestis, выделенный от жертв биотеррористического акта, атипичным или генетически модифицированным, затруднен еще и в связи с отсутствием согласованной бактериальной систематики этого таксона, что не позволяет определить основную единицу биологического разнообразия — вид, не говоря уже о подвиде. Скорее всего для ответа на него необходимо:
1) установить прототипный (наиболее близкий) природный штамм Y.pestis и провести сравнение его генома с геномом штамма Y.pestis, выделенного при обстоятельствах, которые относятся к неправильной эпидемиологии;
2) пользуясь знаниями о существующих в природных экосистемах генах патогенности (антибиотикорезистентности) и механизмах их передачи, провести экспертную оценку возможности или, наоборот, невозможности искусственного происхождения данного штамма;
3) обнаружение в геноме Y.pestis кластеров генов вирулентности или антибиотикорезистентности в составе интегративного вектора с известной историей конструирования требует уже поиска лаборатории, где этот штамм был получен.
Туляремия (чумоподобная болезнь, малая чума, заячья лихорадка, кроличья лихорадка, лихорадка леммингов, лихорадка оленьей мухи), встречающаяся в основном в Северном полушарии, — опасная сапрозоонозная инфекционная болезнь людей и животных, вызываемая неспорообразующей бактерией Francisella tularensis. Протекает с наличием специфического лимфаденита и поражениями различных органов (глаза, легкие, ЖКТ и др.). В природных условиях туляремией заражаются в результате контакта кожных или слизистых покровов человека с тканями или жидкостями тела инфицированных животных или при укусах инфицированных кровососущих членистоногих насекомых. Реже болезнь развивается вследствие вдыхания контаминированной F.tularensis пыли, потребления контаминированной пищи или воды. Заражение аэрозолем вызывает тифоидную или легочную форму туляремии. Больной туляремией не представляет опасности для окружающих.
С конца 1920-х гг. возбудитель туляремии из-за небольшой инфицирующей дозы для человека, примерно 10 КОЕ (КОЕ — показатель, указывающий на число образующих колонии бактерий в 1 мл среды), считается перспективным агентом БО. В 1950–1960-х гг. на вооружении армии США состояли специальные рецептуры на основе возбудителя туляремии и снаряженные ими боеприпасы. Наиболее вероятно применение F.tularensis посредством использования линейных и многоточечных источников и диверсионными (террористическими) методами [29, 35].
Основным критерием искусственного происхождения вспышки туляремии является ее неправильная эпидемиология. Невозможность отнести эпидемиологию вспышки к одному из эпидемиологических типов естественных туляремийных вспышек [36] должно вызвать подозрение у эпидемиологов о преднамеренном распространении возбудителя туляремии. Способ распространения F.tularensis, выбранный преступниками, можно предположить по клинической форме болезни (ингаляционно, алиментарным путем, парентерально).
К неправильной эпидемиологии болезни нужно отнести выделение от людей возбудителя туляремии не встречающегося в России и в Украине подвида tularensis [38], если его распространение не обнаружено в природных очагах, которые посещали заболевшие туляремией. При выявлении среди людей вспышек туляремии, вызванных характерным для обеих стран подвидом holarсtica, должна быть установлена их связь с местностями, где он циркулирует среди грызунов.
Ориентироваться при расследовании биопреступления на невозможные клинические формы болезни вне их связи с неправильной эпидемиологией туляремии невозможно. Местных проявлений, например, таких, которые дает сибиреязвенный токсин при парентеральном введении B.аnthracis, при инъекционном введении F.tularensis не будет. Болезнь разовьется в бубонной, язвенно-бубонной или первично-септической форме.
Аэрозоль с дисперсностью частиц 1–5 мкм образуется не только при использовании генераторов аэрозоля и специальных боеприпасов, но и в незначительных количествах при разделке тушек больных туляремией животных. Его иногда оказывается достаточно, чтобы вызвать легочную форму болезни с поражением глубоких отделов легких у людей, находящихся даже на расстоянии от источника инфекции. Например, Hauri et al. [38] описали групповой случай ингаляционного заражения туляремией людей, находящихся на расстоянии 5 м от места промывки струей воды тушки больного туляремией зайца. Один из заболевших погиб с диагнозом «двусторонняя пневмония», несмотря на лечение моксифлоксацином (moxifloxacin). Ретроспективно у него была установлена легочная форма туляремии. Поэтому клинически и рентгенологически трудно установить различия между бронхопневмоническим вариантом течения легочной формы туляремии у людей, вызванным заражением в ее природных очагах, и таким же вариантом течения болезни, вызванным ингаляцией F.tularensis в составе преднамеренно созданного аэрозоля. Кроме того, клинические и рентгенологические признаки легочной формы туляремии довольно изменчивы, что затрудняет ее диагностику независимо от того, произошло инфицирование в природных условиях либо оно стало результатом биопреступления.
В то же время если установлено, что вспышка легочной туляремии вызвана распылением аэрозоля, то анализ клинических особенностей болезни может многое рассказать специалистам о типе диспергирующего устройства, характеристиках примененной рецептуры, инфицирующей дозе и даже о расстоянии, на котором находились жертвы преступления от источника аэрозоля. Поражение глубоких отделов легких — бронхопневмонический вариант туляремии вызовет аэрозоль в диапазоне частиц 1–5 мкм. Бронхитический, или так называемый гриппоподобный, вариант туляремии будет вызван более крупной фракцией распыленного аэрозоля. Но этот аэрозоль имеет и более высокую скорость оседания частиц, чем аэрозоль со средним размером частиц в диапазоне 1–5 мкм, его распространение ограничено значительно меньшим расстоянием от источника, чем аэрозоля 1–5 мкм. Существует прямая зависимость между величиной ингаляционной дозы возбудителя туляремии и количеством первичных легочных поражений [21, 39].
При обнаружении культур возбудителя туляремии в лаборатории преступников или изъятии у них рецептуры туляремийного микроба, приготовленной в неустановленной лаборатории, необходимо провести их сопоставительный MLVA-анализ и анализ полногеномного полиморфизма со штаммами F.tularensis, выделенными от жертв биопреступления.
При поиске доказательств генетического вмешательства в геном возбудителя туляремии необходимо учитывать, что в отличие от возбудителя чумы возбудитель туляремии более однороден по фенотипическим признакам и его генетика изучена хуже и менее подробно описана, чем у Y.pestis. Уникальное таксономическое положение рода Francisella делает невозможным использование для генетического переноса векторов на основе репликонов плазмид кишечной палочки. Видимо, для получения генетически измененных штаммов возбудителя туляремии не пригодны и отработанные на традиционных модельных микроорганизмах (кишечная палочка) методы генетического переноса и векторы. Последнее обстоятельство лишает экспертов возможности обнаружить в геноме F.tularensis генетические конструкции с уже известным происхождением и историей.
В очагах искусственно вызванных вспышек туляремии с наибольшей вероятностью можно встретить штаммы возбудителя туляремии, резистентные к антибиотикам, используемым в распространенных схемах лечения туляремии (стрептомицин, гентамицин, ципрофлоксацин, доксициклин), и с измененной антигенной специфичностью. Такие штаммы F.tularensis, скорее всего, будут получены путем целенаправленного поиска среди штаммов, выделенных от людей и животных, заболевших туляремией в ее природных очагах. Их геном не будет иметь признаков, характерных для какого-то явного генно-инженерного вмешательства. Его секвенирование позволит обнаружить только инсерции и делеции, единичные нуклеотидные полиморфизмы, единичные тандемные повторы и вариабельные участки генов, характерные для процессов микромутирования и пластичности генома.
Бруцеллез (мальтийская, средиземноморская, неаполитанская, кипрская, ундулирующая, козья лихорадка; септицемия Брюса; болезнь Банга; болезнь Траума) — опасная сапрозоонозная инфекционная болезнь людей и животных с высоким потенциалом к хронизации. Протекает как лимфогематогенный хрониосепсис, системный ретикулоэндотелиоз и артериоваскулит септико-аллергического характера. Приводит к поражению опорно-двигательного аппарата, нервной, сердечно-сосудистой и других систем человека. В настоящее время известно 6 основных видов возбудителей бруцеллеза: Brucella melitensis, B.abortus bovis, B.abortus suis, B.neotomae, B.canis, B.ovis. В природных условиях источниками инфекции для людей являются мелкий и крупный рогатый скот, свиньи, а в некоторых местностях России — и северные олени. Наиболее важное эпидемиологическое значение принадлежит мелкому рогатому скоту вследствие облигатной патогенности для человека B.melitensis [40].
Возбудители бруцеллеза — это калечащие агенты БО. Наиболее вероятно применение возбудителей бруцеллеза посредством использования линейных и многоточечных источников и диверсионными (террористическими) методами [29, 35].
Основным критерием искусственного происхождения вспышки бруцеллеза является неправильная эпидемиология. Распознание искусственного характера вспышки бруцеллеза затрудняют продолжительные инкубационный и продромальные периоды болезни, сочетающиеся с неясностью и полиморфностью клинических признаков. Быстро обнаруживаемые острые формы болезни могут составить небольшую часть выявленных случаев бруцеллеза, но при этом их далеко не сразу распознают как бруцеллез. У большей части больных клинические проявления бруцеллеза ограничатся только признаками продрома, в последующем бруцеллез у них будет протекать как хроническая калечащая инфекция, распознать которую можно только по иммунологическим реакциям. Невозможных клинических форм болезни, которые сразу бросятся в глаза при ингаляционной чуме или сибирской язве, ингаляционное поражение бруцеллами не даст. Поэтому будет очень сложно определить источник аэрозоля возбудителя бруцеллеза, идентифицировать его тип, установить территориальную локализацию, оценить масштаб преступления, время его совершения и принять меры к ликвидации всех последствий.
Зацепкой для установления искусственного характера вспышки бруцеллеза будет обнаружение разрыва эпидемической цепи, ведущей от природного источника возбудителя бруцеллеза к людям (для B.melitensis — козы и овцы; B.abortis — крупный рогатый скот; B.suis — свиньи, северные олени). При естественной вспышке бруцеллеза по крайней мере у части заболевших людей в анамнезе должен прослеживаться либо прямой контакт с этими животными, либо опосредованный — через полученные от них инфицированные бруцеллами продукты (молоко, шерсть, шкуры). Обнаружение бруцелл в конечных продуктах сельхозпроизводства, употребляемых человеком в пищу, требует установления их в исходном продукте, т.е. установления источника контаминации этих продуктов. Необходимо найти сельскохозяйственное предприятие, из которого этот продукт попал в продажу, затем установить наличие вспышки бруцеллеза среди содержащихся там животных и подтвердить идентичность штаммов, выделенных от людей и от животных. На самом предприятии необходимо установить все обстоятельства появления бруцеллеза среди животных, включая выявление поставщиков кормов и проверку кормов на контаминацию бруцеллами.
Для оценки последствий биологической диверсии следует выявить всех инфицированных бруцеллами лиц. Для этого необходимо провести серологическое исследование на бруцеллез лиц, которым в предполагаемый период в местных лечебных учреждениях были поставлены диагнозы гриппа, ОРЗ, брюшного тифа, паратифа, пневмонии, инфекционного гепатита, туберкулезного менингита, ревматического полиартрита, лимфогранулематоза, лихорадки Ку, сыпного тифа, малярии и сепсиса. Затем установить, где заболевшие были в период времени, соответствующий среднему инкубационному периоду бруцеллеза, и определить локализацию источника аэрозоля либо установить продукты питания (торговые точки, пункты общественного питания), которые могут быть общими для всех инфицированных бруцеллами лиц.
Подходы к обнаружению генетически измененных штаммов возбудителей бруцеллеза в основном те же, что и для обнаружения генетически измененных штаммов возбудителей сибирской язвы и чумы. В отличие от этих возбудителей инфекционных болезней у Brucella собственные плазмиды не обнаружены, однако их трансформация осуществляется без особых проблем плазмидами других микроорганизмов методами конъюгативного переноса или электропорацией. Показано, что B.abortus S19 способна поддерживать плазмиды широкого круга хозяев из микроорганизмов других таксонов и разных групп несовместимости: pTH10 (IncP), pSa (IncW) и R751 (IncP), а также передавать участки своей хромосомной ДНК кишечной палочке благодаря конъюгативной плазмиде pTH10. Также был показан обмен внутри рода бруцелл приобретенными плазмидами. Генетически измененные варианты бруцелл приобретали резистентность к тетрациклину, канамицину, стрептомицину, триметоприму, ампициллину [41].
В очагах искусственно вызванных вспышек бруцеллеза с наибольшей вероятностью можно будет встретить штаммы возбудителя бруцеллеза с модификациями липополисахаридов (ЛПС), не характерными для данного вида. Например, ЛПС B.melitensis у менее вирулентной для человека B.suis, но более эффективно преодолевающей защиту, создаваемую живой бруцеллезной вакциной на основе штамма 19. Возможно обнаружение штаммов бруцелл, резистентных к антибиотикам, обычно используемых для лечения бруцеллеза. Так как собственные плазмиды у бруцелл не обнаружены, то обнаружение плазмид у штамма, выделенного при обстоятельствах, характерных для умышленного распространения бруцелл среди людей или животных, должно вызвать настороженность в отношении его искусственного происхождения.
Caп [malleus (лат.); rotz (нем.); glanders, farcy (англ.); morve (франц.); morva (итал.); muermo (исп.)] — опасная инфекционная болезнь животных и человека, вызываемая бактерией Burkholderia mallei. Протекает в острой и хронической формах. Характеризуется образованием специфических клеточных гранулем на слизистых оболочках носа, гортани, трахеи, в ткани легких и других паренхиматозных органах и кожных покровах. Болезнь известна с древности как болезнь лошадей. В природных условиях источниками B.mallei для людей в России являются лошади. С 1915 г. она рассматривалась германским Генштабом как диверсионный поражающий агент и успешно использовалась германской агентурой для заражения лошадей и мулов, используемых в войсках Антанты [30]. В годы Второй мировой войны B.mallei широко использовалась японскими военными для диверсий на приграничных территориях СССР [31]. B.mallei очень опасна для работающего с ней персонала лабораторий. Вакцин, эффективно защищающих от заражения B.mallei, не разработано. Наиболее вероятно применение возбудителя сапа посредством использования линейных и многоточечных источников и диверсионными (террористическими) методами.
Естественная заболеваемость сапом среди людей всегда спорадическая, эпидемий сапа не бывает. Обычно заражения В.mallei носят профессиональный характер: болеют работники животноводства, лица, занятые уходом за лошадьми, ослами, мулами, ветеринарные специалисты, сотрудники бактериологических лабораторий [42]. Если для заболевшего сапом человека (и если болезнь не появилась в виде вспышки!) не удается однозначно установить источник инфекции, то не обязательно это будет означать неправильную эпидемиологию. Более вероятно, что источник возбудителя болезни находится в каком-то хозяйстве или бактериологической лаборатории, но его скрыли. Поэтому прежде чем делать вывод об искусственном происхождении болезни у конкретного человека, необходимо попытаться установить ее профессиональный характер — контакты заболевшего с лошадьми, ослами и мулами либо его работу с культурами возбудителя сапа в лаборатории.
О механизме инфицирования В.mallei можно судить по клинике болезни. Для естественного инфицирования в результате травмы или пореза при контакте с инфицированным животным характерно появление в области входных ворот инфекции красно-багровой папулы, окруженной рожистоподобной краснотой, переходящей затем в пустулу с кровянистым содержимым и в язву.
При ингаляционном инфицировании отсутствуют поражения, характерные для порезов и травм. Болезнь первые две недели протекает в острой форме с явлениями озноба, бронхита и пневмонии, из носа выделяются сукровичная жидкость и гной [43].
Возбудитель сапа легко поддается генетической модификации, но работ по данному направлению в открытой литературе мало [44, 45]. Подозрение о применении генетически модифицированной B.mallei должно возникнуть:
1) при обнаружении штаммов, резистентных к антибактериальным препаратам, обычно используемым для лечения сапа (тетрациклин, триметоприм, сульфамид);
2) обнаружении любых плазмид у штаммов B.mallei, выделенных при обстоятельствах, характерных для умышленного распространения возбудителя сапа среди людей или животных.
Мелиоидоз (melioidosis; cин.: псевдосап, сап Восточной Индии, псевдохолера, пневмоэнтерит, септицемия морфинистов, болезнь Флетчера — Стентона, сапоподобное заболевание из Рангуна) — опасная сапрозоонозная инфекционная болезнь людей и животных, вызываемая бактерией Burkholderia pseudomallei. Эндемична для Юго-Восточной Азии, Австралии и Мадагаскара. Протекает в форме острой или хронической септикопиемии. Благодаря разнообразным клиническим симптомам в острой форме напоминает сап, чуму, холеру, грипп и ряд других инфекционных болезней с явлениями поражения различных органов, с кожными и подкожными гнойничковыми фокусами.
Возбудитель мелиоидоза поддерживается в экосистемах, сформировавшихся в отдельных типах почв и в застойных мелких, хорошо прогреваемых водоемах. Полипатогенен. Вызывает инфекционный процесс не менее чем у 50 видов позвоночных. Основными факторами передачи B.pseudomallei для человека являются почва и вода. В эксперименте доказана возможность трансмиссивной передачи возбудителя мелиоидоза через укус блох и комаров. В России и Украине природные очаги мелиоидоза не описаны. С 1930-х гг. военными специалистами он рассматривается как потенциальный агент БО [30, 31]. Вакцин, эффективно защищающих от заражения возбудителем мелиоидоза, не разработано.
С целью поражения людей наиболее вероятно применение B.pseudomallei посредством использования линейных и многоточечных источников и диверсионными (террористическими) методами.
Любой случай мелиоидоза, выявленный среди жителей России и Украины, не выезжавших в регионы, эндемичные по мелиоидозу, либо не имевших отношения к работе с возбудителем мелиоидоза в лаборатории, можно рассматривать как проявление неправильной эпидемиологии болезни. В то же время надо учитывать ограниченность имеющихся знаний по экологии В.рseudomallei. В связи с потеплением климата границы природных очагов мелиоидоза могут расшириться на север. Возможна активизация собственных природных очагов мелиоидоза, ранее неизвестных. Поэтому при диагностировании даже единичного заболевания мелиоидозом необходимо провести широкие серо-эпидемические исследования среди людей, проживающих на той территории, где этот случай был зарегистрирован. Одновременно целесообразно провести ретроспективное исследование историй болезни в хирургических и инфекционных стационарах на предмет выявления случаев инфекции с подобной клиникой, уделяя особое внимание случаям болезни, осложнившимся септицемией, вызванной Burkholderia, которую идентифицировали как синегнойную палочку.
Даже в регионах, эндемичных по мелиоидозу, болезнь проявляет себя единичными случаями среди людей, занятых сельским хозяйством, и, как правило, среди заболевших мелиоидозом преобладают люди с хроническими болезнями [46]. Поэтому любые групповые заболевания мелиоидозом среди здоровых людей также надо рассматривать как неправильную эпидемиологию болезни и исключать возможность их умышленного инфицирования.
Информации по невозможным клиническим формам мелиоидоза в открытой литературе нет. Можно предполагать, что ингаляционное поражение по крайней мере в течение первых 3–5 сут. после экспонирования человека к мелкодисперсному аэрозолю возбудителя мелиоидоза будет захватывать нижние отделы легких, что при ретроспективном исследовании можно установить по ранним рентгенограммам больного. Однако из-за высокой способности к диссеминации и пневмотропности возбудителя мелиоидоза эта фаза болезни будет кратковременной. Она перейдет в септическую или септикопиемическую с поражениями печени, селезенки и диссеминированной формой легочного мелиоидоза. При чрескожном заражении В.рseudomallei в естественных условиях первичного фокуса, как при сапе, не формируется.
После подкожного введения В.рseudomallei в участке введения возникают абсцессы и некроз ткани, и у пациента необходимо выяснить, кто, когда и при каких обстоятельствах делал ему инъекцию. Необходимо учитывать анамнез пациента и зависимость от наркотиков.
Молекулярные методы исследования (например, полногеномное сиквенс-типирование) мало что дадут для установления географического происхождения выявленного из тканей жертв биотеррористического акта (диверсии) штамма В.рseudomallei. Однако их можно использовать для сопоставления со штаммами, обнаруженными в лаборатории преступников, в найденных диспергирующих устройствах, объектах окружающей среды и других источниках.
Возбудитель мелиоидоза легко подвергается генетической модификации. Все известные методы генетического переноса (конъюгация, трансформация, фаговая трансдукция) отработаны для В.pseudomallei в начале 1990-х гг. Еще раньше обнаружены собственные плазмиды мелиоидозного микроба. Векторные молекулы на основе репликонов плазмид групп несовместимости IncQ, IncW, IncN, IncP стабильно поддерживаются в клетках В.pseudomallei и близкородственных псевдомонад [47].
Анализ плазмидных профилей малоинформативен для выявления генетически измененных штаммов возбудителя мелиоидоза. Явной связи между культуральными и биологическими свойствами штаммов и наличием плазмид у В.pseudomallei не обнаружено. Плазмидные ДНК, выделенные из различных штаммов возбудителя мелиоидоза, обладают взаимной гомологией и гомологией с геномной ДНК В.pseudomallei и близкородственных псевдомонад — В.mallei и В.сepacia. В зависимости от размера генома плазмидные ДНК обозначены pPMl, pCM2, рСМ3 и рСМ4 [48].
Из-за большого генетического разнообразия изолятов возбудителя мелиоидоза предпочтительней осуществлять полный сиквенс их генома с использованием технологии пиросеквенирования. Первым признаком генетической модификации возбудителя мелиоидоза, выявленного в очаге предполагаемой биологической диверсии и теракта, будет обнаружение в его геноме кластера генов в составе интегративного вектора с известной историей конструирования.
Натуральная оспа, оспа обезьян. Натуральная оспа (Variola major, Variola vera, Smallpox, Die Pocken, Blattern) — острая высококонтагиозная вирусная болезнь. В типичных случаях характеризуется общей интоксикацией, лихорадкой, высыпаниями на коже и слизистых оболочках, последовательно проходящими стадии пятна, пузырька, пустулы, корочки и рубца. Вызывается вирусом натуральной оспы (ВНО; Variola virus, VAR, VARV). По вирулентности для людей ВНО делится на два подвида: Variola major (летальность среди заболевших людей колеблется в пределах от 5 до 40 %) и Variola minor, или алястрим (летальность 0,1–2 %). Вспышки малой оспы отмечались параллельно и независимо от таковых большой оспы. Люди, выживающие после натуральной оспы, могут частично или полностью терять зрение, и у них на коже остаются рубцы в местах бывших язв.
Других природных хозяев, кроме человека, для ВНО не установлено. Поэтому при естественном заражении наиболее вероятным источником вируса для человека является другой человек, больной натуральной оспой. До конца 1950-х гг. военными специалистами ВНО не рассматривался в качестве потенциального агента БО из-за всеобщей и регулярно проводимой противооспенной вакцинации войск и населения [49]. Кроме того, в эти годы не существовало технологий получения ВНО в количествах, достаточных для боевого применения. С 1980 г. массовая вакцинация против натуральной оспы отменена, и в настоящее время восприимчивость населения к ВНО повсеместная.
Военными специалистами ВНО рассматривается в качестве потенциального поражающего агента БО из-за низкой инфицирующей дозы для людей; устойчивости к высушиванию и длительному хранению и при переводе в аэрозоль [35, 50]. В настоящее время натуральная оспа считается ликвидированной болезнью, официальные коллекции ВНО находятся только в двух лабораториях: Centers for Disease Control and Prevention (CDC; Атланта, США) и в Федеральном бюджетном учреждении науки «Государственный научный центр вирусологии и биотехнологии «Вектор» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Новосибирск, Россия).
Появление единственного случая натуральной оспы — чрезвычайное происшествие мирового масштаба. Любую внезапно возникшую вспышку натуральной оспы на начальном этапе эпидемиологического расследования целесообразно рассматривать как искусственно вызванную. Из-за отсутствия у врачей эпидемической настороженности по натуральной оспе и медленного развития ее эпидемий болезнь может распространяться месяцами единичными случаями, маскируясь под диагнозами «корь», «скарлатина», «токсический капилляротоксикоз», «ветряная оспа», «болезнь Лайма» и др. Поэтому для установления масштабов и времени совершения преступления необходимо изучить истории болезни людей с такими диагнозами, обратившихся в местные лечебные учреждения не менее чем за три месяца, предшествующих выявленному случаю натуральной оспы. Особое внимание надо обратить на больных, имевших одновременно патологию органов дыхания (бронхит, пневмония) и сыпь. У выявленных пациентов целесообразно проанализировать сроки появления и характер сыпи, исходы болезни и данные объективного исследования в динамике (рентгенография, компьютерная томография, серология).
Также необходимо вести поиски пациентов с двумя клинически различающимися типами натуральной оспы: первично-инфицированные, т.е. экспонированные к мелкодисперсному аэрозолю ВНО; и вторично-инфицированные, т.е. те, кто заразился ВНО воздушно-капельным путем от первично-инфицированных больных. Соответственно будут и два пика заболеваемости: первый, наибольший, вызванный экспонированием людей к мелкодисперсному аэрозолю; и второй, более растянутый по времени, включающий вторично-инфицированных лиц.
Для первично-инфицированных пациентов характерна невозможная клиника болезни — быстрое (в течение 3–5 сут. от начала первых симптомов) развитие легочного поражения, начинающееся с очаговой пневмонии в нижних отделах легкого, переходящее в фибронекротическую бронхопневмонию и системные поражения с развитием энантем и экзантем, с некротическими изменениями в лимфоидных органах, коже, слизистых, репродуктивных органах. В случаях массированного заражения ВНО, возможного вблизи от источника аэрозоля, болезнь будет развиваться без второй фазы подъема температуры [52].
При однократном применении ВНО для такой вспышки будут характерны сжатая эпидемическая кривая с пиком заболеваемости, укладывающимся в средние значения инкубационного периода при натуральной оспе (эпидемиология точечного источника), и относительная локализованность эпидемического очага, т.е. выявленные пораженные должны пересекаться в одно и то же время на одной территории. Необходимо отличать натуральную оспу, вызванную ингаляцией мелкодисперсного аэрозоля ВНО:
1) от так называемой легочной формы оспы, когда у больных при отсутствии кожных элементов развивается пневмония;
2) осложнений со стороны легких при плоской форме оспы [51].
Для вторично-инфицированных пациентов характерно типичное течение натуральной оспы, при которой основными являются поражения кожи и слизистых. Поражения же легких развиваются позже как вторичные, чаще — в период нагноения. Локализованный эпидемический очаг возможен только в организованных коллективах. Учитывая длительный инкубационный период болезни и возможность нескольких генераций передачи ВНО, вторично-инфицированных больных натуральной оспой, скорее всего, придется разыскивать по всей территории страны.
Натуральную оспу необходимо дифференцировать от обезьяньей. При выявлении случаев обезьяньей оспы среди людей прежде всего надо искать контакты таких больных с животными, зараженными вирусом обезьяньей оспы (ВОО). Обычно ими бывают обезьяны, белки и грызуны. Отсутствие таких контактов можно рассматривать как невозможную эпидемиологию болезни. Типы больных будут те же, что и для натуральной оспы, если для преступления использован штамм ВОО, происходящий из долины реки Конго [51].
В месте накожного введения ВНО или ВОО быстро развиваются оспины с обширной зоной гиперемии. Под этим участком формируется плотный и отечный инфильтрат, который является подножьем для побочных оспин, одновременно развиваются лимфаденит и системная инфекция. Подкожное введение вирусов приводит к местному поражению с образованием участка некроза, отека, гиперемии, побочных оспин и системной инфекции. Внутривенное введение вызывает типичную системную инфекцию, тяжесть которой зависит от дозы введенного вируса.
ВНО не имеет недостатков, которые могут вызвать у преступников желание вмешаться в его геном, а потом запутаться в разнообразных рукотворных эффектах при поддержании полученного штамма вируса. Значительно большую опасность, чем генетически измененные штаммы ВНО, представляют природные антигенно-атипичные штаммы ВНО, обнаруженные в середине 1970-х гг. [51]. В отношении таких вирусов вакцинация может оказаться малоэффективной. Более вероятно, что объектом генно-инженерного вмешательства преступников станет не ВНО, а другие патогенные и даже непатогенные для человека ортопоксвирусы [53]. Подозрение о применении генетически модифицированных или специально селекционированных ВНО и ВОО должно возникнуть:
1) при обнаружении у заболевших людей штаммов вирусов, резистентных к препаратам, обычно используемым для лечения поксвирусных инфекций (цидофовир, рибаверин, адефовир, рифампицин, метисазон);
2) установлении низкой защитной эффективности вакцинации, правильно проведенной живыми противооспенными вакцинами.
Достоверно установить же факт вмешательства в геном ортопоксвируса, использованного для совершения преступления, можно по результатам его секвенирования, сопоставив выявленную нуклеотидную последовательность с эталонной. Геном ортопоксвирусов обладает большой емкостью. Интерес у экспертов должны вызвать нуклеотидные последовательности генов токсинов эукариотических организмов; генов других вирусов, особенно когда обнаруживаются репликоны этих вирусов; гены белков, участвующих в регуляции иммунных ответов, но отсутствующие в геноме эталонного вируса; гены прионовых белков.
Вирусные геморрагические лихорадки (viral haemorrhagic fever, VHF, ВГЛ) — группа мало отличающихся друг от друга по клинике зоантропонозных острых инфекционных болезней, вызываемых оболочечными РНК-вирусами семейств: аренавирусы (вирус Ласса, вирус Хунин, вирус Мачупо, вирус Гуанарито, вирус Сэбия); буньявирусы (вирус геморрагической лихорадки с почечным синдромом, вирус конго-крымской лихорадки, вирус лихорадки долины Рифт); филовирусы (вирус Марбург, вирус Эбола); флавивирусы (вирус болезни леса Киассанур, вирус омской геморрагической лихорадки, вирус желтой лихорадки, вирус лихорадки Денге). Первичный резервуар этих вирусов неизвестен. Передача вирусов в природных очагах из вторичных резервуаров среди млекопитающих к людям происходит либо артроподами-переносчиками (вирусы конго-крымской лихорадки, желтой лихорадки, лихорадки Денге, лихорадки долины Рифт, омской геморрагической лихорадки, болезни леса Киассанур), либо в результате непосредственного контакта с больными или погибшими животными (вирусы Ласса, Эбола, Марбург). Вирусы Ласса, Эбола и Марбург могут передаваться между людьми воздушно-капельным путем. На территории России имеются природные очаги вирусов, вызывающих геморрагическую лихорадку с почечным синдромом (Башкортостан, Удмуртия, Марий-Эл, Мордовия, Чувашия, Ульяновская и Пензенская области), конго-крымскую лихорадку (Краснодарский и Ставропольский края, Астраханская, Волгоградская и Ростовская области, республики Дагестан, Калмыкия и Карачаево-Черкесия), омскую геморрагическую лихорадку (степные и лесостепные районы Омской, Новосибирской, Тюменской, Курганской и Оренбургской областей). Инкубационный период болезни у человека после заражения вирусами геморрагических лихорадок составляет от 2–21 сут. Основными клиническими проявлениями ВГЛ являются лихорадка, астения, тошнота, рвота, диарея, макулопапулезная сыпь, геморрагический диатез и шок [54, 55].
Общий анализ крови в большинстве случаев выявляет вначале лейкопению, затем тромбоцитопению. Большинство больных умирают в состоянии ступора с проявлениями интоксикационного шока. Главной причиной гибели при ВГЛ является развитие синдрома диссеминированного внутрисосудистого свертывания (ДВС-синдром, коагулопатия, тромбогеморрагический синдром), отека легких и головного мозга. Вакцин, позволяющих эффективно осуществлять специфическую профилактику в природных очагах ВГЛ, нет. Исключение составляет инактивированная вакцина против желтой лихорадки. Специфическое лечение ВГЛ не отработано [54, 55].
Как потенциальные агенты БО возбудители геморрагических лихорадок стали упоминаться в научной литературе после вспышки болезни, вызванной вирусом Эбола в Южном Судане и Заире в 1976 г. [56]. К наиболее пригодным для использования в целях биологической войны специалисты относят вирусы Эбола, Марбург, Ласса, Мачупо и Хунин [54]. Основной способ их применения для поражения людей — создание аэрозоля [35].
Распознание искусственного поражения возбудителями геморрагических лихорадок должно проводиться на основе установления невозможной эпидемиологии болезни и невозможной клинической формы болезни. Любой иммунологически и генетически подтвержденный диагноз геморрагической лихорадки, возбудитель которой не встречается на территории России или Украины, служит основанием для предположения о совершенном биологическом нападении:
1) если заболевший в течение месяца перед появлением лихорадки не выезжал в страны, эндемичные по данной болезни;
2) в этот же период времени он не находился в контакте с таким же больным, который мог контактировать с лицами, приехавшими из стран, где распространена данная болезнь;
3) заболевший не работал с возбудителем данной болезни в вирусологической лаборатории;
4) не контактировал с животным, привезенным из местности, эндемичной по данной болезни.
При расследовании такого преступления необходимо иметь в виду, что парентеральное введение возбудителей лихорадок Эбола, Марбург и Ласса не оставляет следов, так как очагов некроза в месте инъекции вируса не образуется. Клиническая картина болезни в этом случае не отличается от наблюдаемой у пациентов, заразившихся в природных очагах болезни. Основными критериями установления преднамеренного распространения возбудителей геморрагических лихорадок будут анамнез пациента (упоминание им медицинских манипуляций, сопровождающихся парентеральным введением каких-то лекарств) и доказанная невозможная эпидемиологии болезни. Для доказательства последней надо учитывать сложность экологии возбудителей геморрагических лихорадок и возможность расширения их ареалов в связи с изменением климата и техногенного воздействия на окружающую среду.
Прежде чем выдвинуть предположение о невозможной эпидемиологии обнаруженной/новой геморрагической лихорадки, необходимо провести исчерпывающее эпидемиологическое исследование и убедиться в том, что вирус не имеет на территории, где зарегистрирована вспышка вызванной им болезни, ранее неизвестного природного резервуара. Обнаружение уже депонированных в зарубежных коллекциях штаммов вирусов свидетельствует о невозможной эпидемиологии вспышки.
Поражение мелкодисперсными аэрозолями вирусов Эбола и Марбург можно предположить по наличию характерного патологического процесса в легких (невозможная клиническая форма болезни).
У людей, заразившихся этими вирусами в природных очагах, легочная ткань обычно оказывалась не вовлеченной в первичный инфекционный процесс. Поражения легких у них были вызваны гематогенным заносом возбудителя болезни в легочную ткань и повышением проницаемости эндотелиальной выстилки кровеносных сосудов из-за высвобождения цитокинов и хемокинов инфицированными макрофагами. Поэтому для таких поражений характерны маловыраженные геморрагии в легочной ткани и эндартериит небольших артериол [54].
Моделирование заражения мелкодисперсными аэрозолями вирусов Эбола и Марбург, выполненное на приматах [57, 58], позволяет предположить, что при поражении мелкодисперсными аэрозолями этих вирусов у погибших людей на вскрытии будет обнаружена выраженная интерстициальная пневмония, ориентированная вокруг терминальных бронхиол (бронхиолоцентрическая модель пневмонии). Возможно обнаружение некротических изменений в эпителии бронхиол и мелких бронхов и в трахеобронхиальных и медиастинальных лимфатических узлах, сопоставимых с поражениями лимфатических узлов брюшной полости (рис. 6).
/tirag/137/137.jpg)
Установить по клинической и патологоанатомической картине болезни факт ингаляционного поражения человека вирусом Ласса сложно. Результаты моделирования болезни на приматах показывают, что легкие могут вовлекаться в инфекционный процесс и при парентеральном заражении. Для доказательства ингаляционного поражения человека вирусом Ласса недостаточно установить только факт развития интерстициальной пневмонии. У людей, заразившихся вирусом лихорадки Ласса в природном очаге болезни, пневмония начинается на второй неделе болезни [59]. Можно предположить, что у людей, пораженных мелкодисперсным аэрозолем вируса Ласса, пневмония будет развиваться как первичный процесс, и поэтому она может быть обнаружена рентгенологически еще в первую неделю болезни, после появления лихорадки. У погибших пациентов, кроме очагов интерстициальной пневмонии, возможно обнаружение обширных поражений трахеобронхиальных и медиастинальных лимфатических узлов.
Возбудители геморрагических лихорадок Марбург, Эбола и Ласса имеют еще меньше недостатков, чем ортопоксвирусы, которые бы могли вызвать у террористов желание подвергнуть себя дополнительному риску, вмешиваясь в их геном. Кроме того, геном этих вирусов значительно меньше, чем геном ортопоксвирусов, и представлен РНК, а не ДНК, что значительно снижает возможности генных инженеров по получению генетически измененных штаммов возбудителей геморрагических лихорадок Марбург, Эбола и Ласса. Обнаружение более вирулентных для людей рекомбинантов, образовавшихся между вирусами Эбола одного субтипа, не следует рассматривать как проявление деятельности человека, так как такие рекомбинанты встречаются в природе [60].
Геном аренавирусов консервативен. Рекомбинанты, образовавшиеся между штаммами вируса Ласса разных линий, циркулирующих в природных резервуарах, неизвестны. Но аренавирусы могут обмениваться сегментами генома (реассортировать) в культурах клеток, коинфицированных разными видами аренавирусов [61]. Подозрение о применении генетически модифицированного возбудителя лихорадки Ласса должно возникнуть при обнаружении у жертв вспышки болезни штаммов вирусов, являющихся реассортантами с другими аренавирусами или рекомбинантами штаммов вируса Ласса разных линий. Такое же подозрение должны вызвать штаммы вируса Ласса, резистентные к рибовирину, если неизвестно о применении рибовирина в данном очаге для лечения людей и при отсутствии сведений об эпизоотии Ласса среди грызунов. Достоверно установить факт вмешательства в геном вирусов, вызывающих геморрагические лихорадки, можно по результатам секвенирования, сопоставив выявленную нуклеотидную последовательность вируса с эталонной.
Арбовирусные энцефалиты (encephalitic arboviruses) — группа мало отличающихся друг от друга по клинике зооантропонозных болезней, вызванных арбовирусами, для которых характерны гриппоподобный синдром (flu-like syndrome), энцефаломенингеальный синдром (encephalitis-meningitis syndrome), остро развивающийся вялый паралич (acute flaccid paralysis) и во многих случаях бессимптомное течение инфекционного процесса (asymptomatic infections) [62]. Арбовирусы (от англ. Arthropod-borne viruses) — это собирательный термин, обозначающий группу РНК-вирусов, переносчиками которых от животных к человеку являются членистоногие (москиты, клещи, мухи). Арбовирусы классифицируют на семейства и роды на основе их морфологии (размер, форма, капсидная симметрия, наличие или отсутствие оболочки), физических (структура генома и антигенный состав) и биологических свойств (механизмы репликации и трансмиссии, хозяева, патогенность для человека и др.). В группу арбовирусов входят четыре семейства: семейство Togaviridae (род Alphavirus: вирус восточного лошадиного энцефалита, Eastern Equine encephalitis virus, EEEV; вирус западного энцефалита лошадей, Western equine encephalomyelitis virus, WEEV; вирус энцефалита Сент-Луис, St. Louis encephalitis virus; вирус венесуэльского энцефалита лошадей, Venezuelan equine encephalitis virus, VEEV; семейство Flaviviridae (род Flavivirus: вирус Западного Нила, West Nile virus, вирус Повассан, Powassan); семейство Bunyaviridae (род Bunyavirus: вирус Ла Кросс, La Crosse virus, калифорнийская группа вирусов); семейство Reoviridae (род Coltivirus: вирус колорадской комариной лихорадки, Colorado tick fever virus) [62, 63].
Природные очаги арбовирусов имеют строгие ограничения, налагаемые на них наличием амплифицирующих вирусы хозяев и насекомых-переносчиков, особенностями их жизненных циклов, климатических условий и другими экологическими и биологическими факторами. Люди обычно не вовлекаются в энзоотические жизненные циклы арбовирусов из-за низкого уровня виремии, развивающейся у них на пике инфекционного процесса и не позволяющей насекомым осуществлять непрерывно процесс передачи вируса от человека животным и наоборот. Исключением из этого правила являются вирусы, вызывающие лихорадку Денге и VEEV, способные создавать в организме человека высокую вирусную нагрузку. Однако передача вирусов от человека к человеку воздушно-капельным путем или при тесных контактах не происходит. Заражение возможно при переливании инфицированной крови или в результате пересадки органов, взятых у инфицированного человека, а также перинатально и трансплацентарно [62].
На территории России в природных очагах поддерживаются арбовирусы, относящиеся к семейству Flaviviridae: вирус японского энцефалита (южные районы Приморья), вирус клещевого энцефалита (распространен повсеместно в средних широтах), вирус Западного Нила (Волгоградская, Астраханская и Омская области). Природных очагов вирусов лошадиных энцефалитов в России и других странах СНГ не обнаружено.
Вирусы, возбудители арбовирусных энцефалитов и особенно альфавирусы, вызывающие лошадиные энцефалиты (WEEV, VEEV и EEEV), рассматривались в качестве перспективных агентов БО еще перед Второй мировой войной [49, 64]. Причины столь раннего интереса военных к вирусам этого рода обобщены в работе J.F. Smith et al. [65]:
1) эти вирусы могут производиться в больших количествах недорогими способами;
2) относительно стабильны и сохраняют инфекционность для человека в аэрозолях;
3) среди этой группы вирусов есть такие, которые могут быть использованы как для инкапситации, так и для смертельного поражения противника, в зависимости от серотипа штамма;
4) большое количество серотипов среди вирусов VEEV и EEEV и трудности получения иммунитета слизистых поверхностей к этим вирусам создают проблемы разработчикам вакцин.
Основной способ применения вирусов лошадиных энцефалитов для поражения людей — создание аэрозоля. Среди них военными специалистами на основе анализа случаев внутрилабораторных заражений персонала выделяется VEEV, как обладающий наиболее высокой инфективностью в аэрозоле [35, 66].
Любой иммунологически и генетически подтвержденный диагноз лошадиного энцефалита, выявленного на территории России и Украины, служит основанием для предположения о совершенном биологическом нападении:
1) если заболевший в течение месяца перед появлением лихорадки и/или симптомов энцефалита не выезжал в страны, эндемичные по данной болезни;
2) в эти же сроки заболевший не работал с возбудителем данной болезни в вирусологической лаборатории.
Вне природных очагов вирусов лошадиных энцефалитов заражение людей WEEV, VEEV и EEEV возможно только ингаляционным и парентеральным способами. При установлении способа заражения жертв биотеррористического акта необходимо учитывать, что вирусы, возбудители лошадиных энцефалитов, не обладают тропностью к легочной ткани и не вызывают местных процессов (некрозы, карбункулы, абсцессы) в участке внутримышечной инъекции. Внутривенное введение этих вирусов дает ту же клиническую картину болезни, что наблюдается в их природных очагах при трансмиссии комарами. Поэтому основными клиническими признаками искусственно вызванных лошадиных энцефалитов будут те же, что наблюдают врачи при естественном заражении людей в природных очагах. Если принять во внимание экспериментальные данные, полученные в опытах на модельных животных, факт ингаляционного заражения мелкодисперсным аэрозолем все же можно установить ретроспективно, используя методы иммуногистохимического окрашивания эпителия мелких бронхов, бронхиол либо альвеол. Но кроме признаков апоптоза или дегенерации клеток в участках, положительных на вирус, трудно рассчитывать на обнаружение других гистологических подтверждений ингаляционного заражения возбудителями лошадиных энцефалитов. У жертв террористического преступления, ингаляционно инфицированных VEEV, возможно обнаружение патологических изменений в медиастинальных лимфатических узлах.
Возбудители лошадиных энцефалитов благодаря тропности к нейронам обонятельной системы, находящихся в носовых ходах человека, могут проникнуть в мозг, не попадая в кровеносное русло и не вызывая вирусемии. Поэтому вблизи от источника аэрозоля возможно инфицирование людей крупнодисперсным аэрозолем вируса. Клинически такое заражения проявится быстрым, в течение 1–3 сут., развитием энцефалитно-менингеального синдрома и синдрома острого вялого паралича без вирусемии. Методы иммуногистохимического окрашивания эпителия носовых ходов могут оказаться полезными для определения участка первичной аппликации вируса.
Целью генетических модификаций генома вирусов, возбудителей арбовирусных энцефалитов, будет повышение их вирулентности. Арбовирусы, циркулирующие среди позвоночных, очень разнородны по вирулентности для человека и лошадей. Вирулентность отдельных штаммов арбовирусов зависит от источника их выделения и пассажной истории. Поэтому к первому направлению, которое может быть использовано преступниками для получения генетически модифицированных вариантов арбовирусов, можно отнести выбор и селекцию среди уже существующих в природе наиболее вирулентных штаммов. Эти штаммы, если и будут отличаться от природных штаммов, то только отдельными нуклеотидными заменами в участках генома, некритических для проявления вирулентности вирусом. Их можно распознать путем сопоставления нуклеотидных последовательностей вирусов, выделенных в очаге c доказанной неправильной эпидемиологией, с нуклеотидными последовательностями референс-штаммов, хранящихся в специализированных лабораториях.
Второй подход заключается в получении химерных вирусов, содержащих генетический материал вирусов либо различных субтипов, либо разных видов. Полученные химеры были использованы для экспериментального заражения лошадей. Исследователями продемонстрировано, что они вызывают инфекционный процесс у лошадей с титром вируса в крови, достаточным для инфицирования комаров (viremiacompetent equine phenotype) [67].
Подозрение о применении генетически модифицированного арбовируса должно возникнуть при обнаружении у жертв вспышки энцефалита химерных арбовирусов, выходящих за рамки известных природных вирусных химер Sindbis/VEEV [68], либо при обнаружении в геноме высоковирулентных для человек арбовирусов генов, ранее неизвестных для данного рода. Достоверно установить факт вмешательства в геном вирусов, вызывающих вирусные энцефалиты, можно путем сравнительного секвенирования их генома.
***
Огромный вред эпидемиологии нанесла глобальная кампания по ложному обвинению Саддама Хусейна в подготовке биологической войны. В ее основе лежал миф о доступности БО странам третьего мира и всякого рода местечковым террористам. В результате эпидемиологические представления упростились, и появились мифы вроде возникновения чумы «черной смерти» в середине XIV в. как результата применения БО. Приведенные в статье данные показывают, что расследование биотеррористических актов и диверсий — это самостоятельная часть эпидемиологии, которая имеет свои методологию, цели и задачи.
1. Kaufmann A.F., Meltzer M.I., Schmid G.P. The economic impact of a bioterrorist attack: are prevention and postattack intervention programs justifiable? // Emerg. Infect. Dis. — 1997. — 3(2). — 83–94.
2. Franz D.R., Jahring P.B., Friedlander A.M., Hoover D.L., Byrne W.R., Pavlin J.A. et al. Clinical recognition and management of patiensts exposed to biological warfare agents // JAMA. — 1997. — 278(5). — 399–411.
3. Pavlin J.A. Epidemiology of bioterrorism // Emerg. Infect. Dis. — 1999. — 5(4). — 528–30.
4. Dembek Z. Modeling for bioterrorism incidents. Biological weapons defense. — N.J., 2005.
5. Torok T.J., Tauxe R.V., Wise R.P., Livengood J.R., Sokolow R., Mauvais S. et al. A large community outbreak of salmonellosis caused by intentional contamination of restaurant salad bare // JAMA. — 1997. — 278(5). — 389–95.
6. Dewan P., Fry A., Laserson K., Quinn C.P., Hayslett J.A., Broyles L.N. et al. Inhalational anthrax outbreak among postal workers, Washington, DC, 2001 // Emerg. Infect. Dis. — 2002. — 8. — 1066–72.
7. Супотницкий М.В. Эпидемиология искусственных эпидемических процессов как третий раздел эпидемиологии // Новости медицины и фармации. — 2013. — (4). — 16–19 (5). — 16–9.
8. Черкасский Б.Л. Руководство по общей эпидемиологии. — М., 2001.
9. Бакулов И.А., Ведерников В.А., Семенихин А.Л. Эпизоотология с микробиологией. — М., 1997.
10. US Departments of the Army, Navy and Air Force. Employment of chemical and biological agents. March; 1966 (FM 3–10; NWIP 3612; AFM 355–4 FMFM 11–3).
11. Jernigan D.B., Raghunathan P.L., Bell B.P., Brechner R., Bresnitz E.A., Butler J.C. et al. Investigation of bioterrorism-related anthrax, United States, 2001: epidemiologic findings // Emerg. Infect. Dis. — 2002. — 8. — 1019–28.
12. Takahashi H., Keim P., Kaufmann C.K., Kimothy L.S., Kiyosu T. et al. Bacillus anthracis incident, Kameido, Tokyo, 1993 // Emerg. Infect. Dis. — 2004. — 10(1). — 117–9.
13. Atlas R.M. Combating the threat of biowarfare and bioterrorism // BioScience. — 1999. — 49(6). — 465–77.
14. Ivins B.E., Welkos S.L., Knudson G.B. Little SF. Immunization against anthrax with aromatic compound dependent (Aro1) mutants of Bacillus anthracis and with recombinant strains of Bacillus subtilis that produce anthrax protective antigen // Infect. Immun. — 1990. — 58(2). — 303–8.
15. Lalitha M., Thomas M. Penicillin resistance in Bacillus anthracis // Lancet. — 1997. — 349(9064). — 1522.
16. Guiyoule A., Gerbaund G., Buchrieser C., Galimand M., Rahalison L., Chanteau S. et al. Transferable plasmid-mediated resistance of Yersinia pestis // Emerg. Infect. Dis. — 2001. — 7. — 43–8.
17. Дмитриев И. Случай массового подкожного заражения сибирской язвой во время антирабических прививок // Гигиена и эпидемиология. — 1928. — (10). — 64–74.
18. Ramsay C.N., Stirling A., Smith J., Hawkins G., Brooks T., Hood J. et al. An outbreak of infection with Bacillus anthracis in injecting drug users in Scotland // Eurosurveillance. — 2010. — 15. — Is. 2.
19. Ringertz S.H., Hoiby E.A., Jensenius M., Mohlen J., Caugant, Arne D.A., Fossum M.K. Injectional anthrax in a heroin skin-popper // Lancet. — 2000. — 356(9241). — 1574–5.
20. Супотницкий М.В. Биологическая война. — М., 2013.
21. Огарков В.И., Гапочко Н.Г. Аэрогенная инфекция. — М., 1975.
22. Wiener S.L. Strategies of Biowaffarae Defense // Military Medicine. — 1987. — 152(1). — 25–8.
23. Hoffmaster A.R., Fitzgerald C.C., Mayer L.W., Popovic T. Molecular subtyping of Bacillus anthracis and the 2001 bioterrorism associated anthrax outbreak, United States // Emerg. Infect. Dis. — 2002. — 8(10). — 1011–6.
24. Kolavic S.A., Kimura S.L., Simone S.L., Slutsker L., Barth S., Haley C.E. An outbreak of Shigella dysenteriae type 2 among laboratory workers due to intentional food contamination // JAMA. — 1997. — 278(5). — 396–8.
25. Богданов ИЛ. К клинике кишечной формы антракса // Клиническая медицина. — 1935. — 8. — 1228–32.
26. Guarner J., Jernigan J.A., Wun Ju Shieh, Tatti K., Flannagan L.M., Stephens D.S., Popovic T. et al. Pathology and pathogenesis of bioterrorism-related inhalational anthrax // Amer. J. Pathol. — 2003. — 163(2). — 701–9.
27. Литусов Н.В., Васильев Н.Т., Васильев П.Г., Евстигнеев В.И., Равилов А.З., Щербаков В.Н. и др. Патоморфогенез сибирской язвы. — М., 2002.
28. Powell A., Crozier J., Hodgson H., David J., Galloway A. A case of septicaemic anthrax in an intravenous drug user // BMC Infectious Diseases 2011. — Available from http://www.biomedcentral.com/147112334/11/21/
29. Sidell F.R., Tafuqi E.T., Franz D.R. Medical aspects of chemical and biological warfare. — Washington, 1997.
30. Блюменталь Н. Бактериологическая война (сокращенный обзор) // Военно-медицинский журнал. — 1932. — III(2). — 167–75.
31. Материалы судебного процесса по делу бывших военнослужащих японской армии, обвиняемых в подготовке и применении бактериологического оружия. — М., 1950.
32. Супотницкий М.В., Супотницкая Н.С. Очерки истории чумы. — М., 2006.
33. Wolf-Watz H., Portnoy D., Bolin I., Falkow S. Transfer of the virulence plasmid of Yersinia pestis to Yersinia pseudotuberculosis // Infec. Immun. — 1985. — 48(1). — 241–3.
34. Anisimov A.P., Lindler L.E., Pier G.B. Intraspecific diversity of Yersinia pestis // Clin. Microbiol. Rev. — 2004. — 17(2). — 434–64.
35. Army FM 8–284. Navy NAVMED P15042 Air Force AFMAN (I) 44–156 Marine Corps MCRP 4–11.1C. 2000.
36. Олсуфьев Н.Г., Руднев Г.П. Руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. — М., 1966. — Т. VII, Туляремия. — С. 190–234.
37. Ellis J., Oyston P., Green M., Richard W. Tularemia // Clin. Microbiol. Rev. — 2002. — 15(4). — 631–46.
38. Hauri A.M., Hofstetter H., Seibold E., Kaysser P., Eckert J., Neubauer H., Splettstoesser W.D. Investigating an airborne tularemia outbreak, Germany // Emerg. Infect. Dis. — 2010. — 16(2). — 238–43.
39. Day W.C., Berendt R.F. Experimental tularemia in Macaca mulatta: relationship of aerosol particle size to the infectivity of airborne Pasteurella tularensis // Infect. Immun. — 1972. — 5(1). — 77–82.
40. Corbel M.J. Brucellosis: an overview // Emerg. Infect. Dis. — 1997. — 3(2). — 213–221.
41. Rigby C.E., Fraser A. Plasmid transfer and plasmid mediated genetic exchange in Brucella abortus // Can. J. Vet. Res. — 1989. — 53. — 326–330.
42. Цветков Н.Е., Черняк В.З. Сап. — М., 1935.
43. Илюхин В.И., Батманов В.П., Лозовая Н.А. Клиника и лечение сапа / Под ред. Н.Г. Тихонова // Сап: Сб. науч. тр. — Волгоград, 1995. — С. 85–100.
44. Меринова Л.К., Агеева Н.П. Генетика Pseudomonas mallei / Под ред. Н.Г. Тихонова // Сап: Сб. науч. тр. — Волгоград, 1995. — С. 19–30.
45. Filonov A.E., Manzeniuk I.N., Svetoch E.A. Conjugative transfer and expression of R plasmids of the genus Pseudomonas in the cells of Pseudomonas mallei C15 // Antibiot. Khimioter. — 1996. — 41(3). — 20–4.
46. Ip M., Osterberg L.G., Chau P.Y., Raffin T.A. Pulmonary melioidosis // Chest. — 1995. — 108. — 1420–4.
47. Abaev I.V., Astashkin E.I., Pachkunov D.M., Stagis N.I., Shiton V.T., Svetoch E.A. Pseudomonas mallei and Pseudomonas pseudomallei: introduction and maintenance of natural and recombinant plasmid replicons // Mol. Gen. Mikrobiol. Virusol. — 1995. — (1). — 28–36.
48. Меринова Л., Гришкина Т.А., Тарасова Т.Д., Антонов В.А. Генетика возбудителя мелиоидоза / Под ред. Н.Г. Тихонова // Мелиоидоз: Сб. науч. тр. — Волгоград, 1995. — С. 27–47.
49. Розбери Т., Кабат Э. Бактериологическая война. — М., 1955.
50. Ротшильд Д. Оружие завтрашнего дня. — М., 1966.
51. Маренникова С.С., Щелкунов С.Н. Патогенные для человека ортопоксвирусы. — М., 1998.
52. Chapman J.L., Nichols D.K., Martinez M.J., Raymond J.W. Animal models of Orthopoxvirus infection // Vet. Pathol. — 2010. — 47(5). — 852–70.
53. Jackson P.J., Ramsay A.J., Christensen C.D., Beaton S., Hall D., Ramshaw I. Expression of mouse interleukin14 by a recombinant ectromelia virus suppresses cytolytic lymphocyte responses and overcomes genetic resistаnce to mousepox // J. Virol. — 2001. — 75(3). — 1205–10.
54. Borio L., Inglesby T., Peters C.J., Jahrling P.B., Ksiazek T., Johnson K.M. et al. Hemorrhagic fever viruses as biological weapons. Medical and public health management // JAMA. — 2002. — 287(18). — 2391–405.
55. Kortepeter M., Christopher G., Cieslak T. USAMRIID’s medical management of biological casualties. Handbook. — Forth Edition Editors. — US Army Medical Research Institute of Infectious Diseases (USAMRIID), Fort Detrick, Maryland, 2001.
56. Гайслер Э. Биологическое и токсинное оружие сегодня. — London, 1986.
57. Johnson E., Jaax N., White J.P. Lethal experimental infections of rhesus monkeys by aerosolized Ebola virus // Int. J. Exp. Path. — 1995. — 76. — 227–36.
58. Alves D.A., Glynn A.R., Steele K.E., Lackemeyer M.G., Garza N.L., Buck J.G. et al. Aerosol exposure to the Angola strain of Marburg virus causes lethal viral hemorrhagic fever in Cynomolgus macaques // Vet. Pathol. — 2010. — 47(5). — 831–51.
59. Callis R.T., Jahrling P.B., DePaolli A. Pathology of Lassa virus infection in the rhesus monkey // Am. J. Trop. Med. Hyg. — 1982. — 31(5). — 1938–1045.
60. Wittmann T.J., Biek R., Hassanin A., Rouquet P., Reed P., Yaba P. et al. Isolates of Zaire ebola virus from wild apes reveal genetic lineage and recombinants // Proc. Natl. Acad. Sci. USA. — 2007. — 104(43). — 17123–7.
61. Lukashevich I.S., Patterson J., Carrion R., Moshkoff D., Ticer A., Zapata J. et al. A live attenuated vaccine for Lassa fever made by reassortment of Lassa and Mopeia viruses // J. Virol. — 2005. — 79(22). — 13934–42.
62. Davis L.E., Beckham J.D., Tyler L.L. North American encephalitic arboviruses // Neurol. Clin. — 2008. — 26(3) (727-ix. doi:10.1016/j.ncl.2008.03.012).
63. Lanciotti R.S., Roehrig J.T., Deubel V., Smith J., Parker M., Steele K. et al. Origin of the West Nile virus responsible for an outbreak of encephalitis in the Northeastern United States // Science. — 1999. — 286. — 2333–7.
64. Huxsoll D.L., Patrick W.C., Parrott C.D. Veterinary services in biological disasters // J. Am. Vet. Med. Assoc. — 1987. — 190(6). — 714–22.
65. Smith J.F., Davis K., Hart M.K. et al. Viral encephalitidis / Sidell F.R., Tafuqi E.T., Franz D.R. // Medical aspects of Chemical and Biological Warfare. — Washington, 1997. — P. 561–89.
66. Zacks M.A., Paessler S. Encephalitic Alphaviruses // Vet. Microbiol. — 2010. — 140(3–4). — 281. — doi:10.1016/j.vetmic.2009.08.023
67. Greene I.P., Paessler S., Austgen L., Anishchenko M., Brault A.C., Bowen R.A., Weaver S.C. Envelope glycoprotein mutations mediate equine amplification and virulence of epizootic Venezuelan equine encephalitis virus // J. Virol. — 2005. — 79(14). — 9128–33.
68. Weaver S.C., Kang W.L., Shirako Y., Rumenapf T., Strauss E.G., Strauss J.H. Recombinational history and molecular evolution of western equine encephalomyelitis complex alphaviruses // J. Virol. — 1997. — 71. — 613–623.

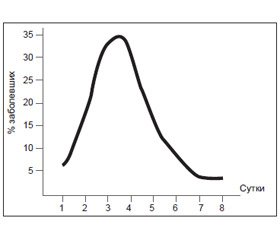
/tirag/118/118.jpg)
/tirag/119/119.jpg)
/tirag/119/119_2.jpg)
/tirag/121/121.jpg)
/tirag/122/122.jpg)
/tirag/124/124.jpg)
/tirag/125/125.jpg)