Журнал «Актуальная инфектология» 3 (4) 2014
Вернуться к номеру
Вплив різних схем патогенетичного лікування на стан прооксидантно-антиоксидантного гомеостазу у хворих на гострий гепатит В із супутнім хронічним вживанням алкоголю в гепатотоксичних дозах
Авторы: Рябоконь О.В., Фурик О.О., Ушеніна Н.С. – Запорізький державний медичний університет
Рубрики: Инфекционные заболевания
Разделы: Клинические исследования
Версия для печати
Обстежені 133 хворі на гострий гепатит В віком від 18 до 60 років. У роботі показано, що у хворих на гострий гепатит В із супутнім хронічним вживанням алкоголю в гепатотоксичних дозах розпал захворювання характеризується більшими порушеннями прооксидантно-антиоксидантної регуляції за рахунок вищого рівня альдегідфенілгідразонів спонтанної окисної модифікації білків крові та нітритів, що поєднується з низьким умістом L-аргініну в сироватці крові. Період реконвалесценції в цих хворих характеризується вищим рівнем альдегідфенілгідразонів й кетонфенілгідразонів спонтанної окисної модифікації білків крові, вищим умістом нітритів у поєднанні з низьким умістом L-аргініну в сироватці крові порівняно з хворими без супутнього ураження печінки. Залучення L-аргініну гідрохлориду (Тівортін) та тіотриазоліну до лікування хворих на гострий гепатит В із хронічним вживанням алкоголю в гепатотоксичних дозах сприяє поліпшенню прооксидантно-антиоксидантних процесів за рахунок зниження вмісту нітритів і кетонфенілгідразонів спонтанної окисної модифікації білків крові, підвищення вмісту L-аргініну й активності каталази в сироватці крові, сприяє нормалізації активності аланінамінотрансферази та збільшенню частоти сероконверсії HBeAg — anti-HBе порівняно з хворими, у лікуванні яких використовували лише базисні засоби.
Обследованы 133 больных острым гепатитом В в возрасте от 18 до 60 лет. В работе показано, что у больных острым гепатитом В с сопутствующим хроническим употреблением алкоголя в гепатотоксических дозах разгар заболевания характеризуется большими нарушениями прооксидантно-антиоксидантной регуляции за счет высокого уровня альдегидфенилгидразонов спонтанной окислительной модификации белков крови и нитритов, что сочетается с низким содержанием L-аргинина в сыворотке крови. Период реконвалесценции у этих больных характеризуется высоким уровнем альдегидфенилгидразонов и кетонфенилгидразонов спонтанной окислительной модификации белков крови, высоким содержанием нитритов в сочетании с низким содержанием L-аргинина в сыворотке крови по сравнению с больными без сопутствующего поражения печени. Добавление L-аргинина гидрохлорида (Тивортин) и тиотриазолина к лечению больных острым гепатитом В с хроническим употреблением алкоголя в гепатотоксических дозах способствует улучшению прооксидантно-антиоксидантных процессов за счет снижения содержания нитритов и кетонфенилгидразонов спонтанной окислительной модификации белков крови, повышению содержания L-аргинина и активности каталазы в сыворотке крови, способствует нормализации активности аланинаминотрансферазы и увеличению частоты сероконверсии HBeAg — anti-HBe по сравнению с больными, в лечении которых использовали только базисные средства.
The study involved 133 patients with acute hepatitis B aged from 18 to 60 years. The article shows that in patients with acute hepatitis B and concomitant chronic consumption of alcohol in hepatotoxic doses consumption, the height of disease is characterized by larger disturbances in prooxidant-antioxidant regulation due to the higher level of aldehyde phenylhydrazone of spontaneous oxidative modification of blood proteins and nitrites, which is combined with the low L-arginine content in blood serum. The period of convalescence in these patients is characterized by a higher level of aldehyde phenylhydrazones and ketone phenylhydrazones of spontaneous oxidative modification of blood proteins, a higher content of nitrites in combination with low L-arginine content in the blood serum, as compared with patients without concomitant liver disease. The use of L-arginine hydrochloride (Tivortin) and thiotriazoline in the treatment of patients with acute hepatitis B with chronic consumption of alcohol in hepatotoxic doses improves antioxidant-prooxidant processes by reducing the content of nitrites and ketone phenylhydrazones of spontaneous oxidative modification of blood proteins, increased content of L-arginine and catalase activity in blood serum, contributes to the normalization of alanine aminotransferase activity, and increased frequency of HBeAg — anti-HBe seroconversion compared with patients who are treated using only basic agents.
гострий гепатит В, прооксидантно-антиоксидантний гомеостаз, алкоголь, L-аргініну гідрохлорид, тіотриазолін.
острый гепатит В, прооксидантно-антиоксидантный гомеостаз, алкоголь, L-аргинина гидрохлорид, тиотриазолин.
acute hepatitis B, prooxidant-antioxidant homeostasis, alcohol, L-arginine hydrochloride, thiotriazoline.
Статья опубликована на с. 21-26
Вступ
Гепатит В залишається однією з найважливіших проблем медичної науки та практичної охорони здоров’я, що обумовлено його значним поширенням, високим рівнем захворюваності, складністю патогенезу, недостатньою ефективністю лікування, тяжкими наслідками хвороби [3].
На перебіг гострого гепатиту В (ГГВ) та його наслідки може впливати низка факторів, зокрема коінфікування іншими вірусами гепатитів, наявність супутніх уражень печінки невірусного генезу. Серед комбінованих уражень печінки особлива увага на сьогодні приділяється вірусно-алкогольним [2]. У ряді досліджень доведено негативний вплив алкоголю на перебіг HBV-інфекції, що полягає в прогресуванні захворювання, розвитку цирозу [4] та гепатоцелюлярної карциноми [11, 14] через синергізм пошкоджувальної дії алкоголю, насамперед ацетальдегіду, та HBV на печінку.
Провідну роль у патогенезі багатьох захворювань печінки, зокрема HBV-інфекції, відіграють імунні реакції, які беруть безпосередню участь у розвитку запалення, адекватної імунної відповіді та регенерації печінки [16]. Відомо, що ефективність імунної відповіді організму тісно пов’язана з функціональним станом прооксидантної та антиоксидантної систем [9]. Розвиток окисного стресу, обумовлений порушенням прооксидантно-антиоксидантного гомеостазу, призводить до генерації активних форм кисню, що ушкоджують клітинні мембрани та тісно пов’язані з безліччю патологічних змін в організмі [10].
Незважаючи на значну кількість робіт, присвячених вивченню гепатиту В, клініко-патогенетична роль змін прооксидантно-антиоксидантного гомеостазу та можливості корекції цих порушень у хворих на ГГВ із наявністю супутнього хронічного вживання алкоголю в гепатотоксичних дозах залишаються недостатньо визначеними.
Мета роботи — визначити динаміку параметрів прооксидантно-антиоксидантного гомеостазу у хворих на гострий гепатит В із супутнім хронічним вживанням алкоголю в гепатотоксичних дозах на тлі лікування L-аргініну гідрохлоридом (Тівортін) та тіотриазоліном.
Матеріал та методи дослідження
Під спостереженням були 133 хворі на ГГB віком від 18 до 60 років. Чоловіків було 92, жінок — 41. Усі хворі введені до дослідження за випадковою ознакою та письмовою інформованою згодою. Діагноз ГГВ установлено за результатами клініко-епідеміологічних, біохімічних, інструментальних досліджень, підтверджено виділенням в крові відповідних маркерів (HBsAg, HBeAg, anti-HBcor IgM). Маркери інших вірусних гепатитів та ВІЛ-інфекції були негативні.
При розподілі хворих на ГГВ на групи враховували наявність чи відсутність хронічного вживання алкоголю в гепатотоксичних дозах, використовуючи класифікацію вживання алкогольних напоїв з урахуванням періодичності й дози спожитого алкоголю [8]. Залежно від наявності або відсутності хронічного вживання алкоголю в гепатотоксичних дозах групи хворих на ГГВ були сформовані так: І групу становили 52 хворі на ГГВ із хронічним вживанням алкоголю в гепатотоксичних дозах, які залежно від отриманого лікування були розділені на підгрупи: IА підгрупа — 25 хворих, які додатково до базисного лікування отримали L-аргініну гідрохлорид та тіотриазолін (основна група); IБ підгрупа — 27 пацієнтів, які отримували лише базисну терапію (група порівняння). II група — 81 хворий на ГГВ без супутнього фактора, які отримували традиційну базисну терапію. Досліджувані групи хворих були репрезентативними за статтю та віком. Усі пацієнти були обстежені двічі: при госпіталізації та на момент виписки зі стаціонару. Контрольна група — 20 здорових осіб.
L-аргініну гідрохлорид призначався пацієнтам внутрішньовенно краплинно у 4,2% розчині по 100,0 мл щоденно протягом 5 днів, потім перорально L-аргініну аспартат (Тівортін аспартат) по 15,0 мл 3 рази на добу на курс 15 днів, який поєднували з тіотриазоліном (діюча речовина морфоліній 3-метил-1,2,4-триазоліл-5-тіоацетат) 2,5% — 2,0 мл — 5 днів внутрішньом’язово з наступним пероральним прийомом по 1 таблетці (100 мг) тричі на добу 15 днів [6].
Методом імуноферментного аналізу з використанням приладу DigiScan-400 (Австрія) в сироватці крові визначали вміст anti-HBeAg IgG («Вектор-Бест», Росія) відповідно до методики, запропонованої виробником. Для оцінки стану прооксидантно-антиоксидантної системи визначали вміст продуктів спонтанної окисної модифікації білків (ОМБ), а саме альдегідфенілгідразону (АФГ) і кетонфенілгідразону (КФГ), а також уміст нітритів, активність каталази у сироватці крові спектрофотометричним методом, вміст L-аргініну в сироватці крові визначали хроматографічним методом.
Статистичну обробку отриманих даних здійснювали на персональному комп’ютері з використанням сформованої бази даних обстежених пацієнтів і здорових осіб контрольної групи в програмі Statistica® for Windows 6.0 (StatSoft Inc., № AXXR712D833214FAN5). Обчислювали середні значення (M), середні помилки середньої арифметичної (m), вираховували відсоток відхилення від відповідних у групах порівняння. Для оцінки вірогідності різниці ознак між двома незалежними вибірками застосовували непараметричні статистичні методи: критерій Манна — Уїтні — для кількісних ознак; метод x2 — для якісних ознак. Для оцінки вірогідності різниці ознак між двома залежними вибірками застосовували непараметричний критерій Вілкоксона. Для оцінки ступеня зв’язку між ознаками застосовували метод рангової кореляції Спірмена з обчисленням коефіцієнту кореляції (r).
Результати досліджень та їх обговорення
У результаті біохімічних досліджень крові в розпал ГГВ у хворих І групи середній показник вмісту загального білірубіну у сироватці крові становив 203,8 ± 11,5 мкмоль/л і був вищим (р < 0,05) від цього показника пацієнтів ІІ групи (170,3 ± 6,6 мкмоль/л). При порівнянні вираженості цитолітичного синдрому в розпал ГГВ виявлено відсутність статистично значущої різниці між I та II групами (р > 0,05). Так, активність аланінамінотрансферази (АлАТ) у сироватці крові хворих І та ІІ групи становила 9,6 ± 0,4 ммоль/год • л та 9,2 ± 0,3 ммоль/год • л відповідно (р > 0,05).
При порівнянні показників маркерного профілю при надходженні хворих встановлено, що в усіх пацієнтів обох груп позитивними були HBsAg, anti-HBcor IgM, а частота виявлення позитивного HBeAg не відрізнялася (x2 = 1,42, р > 0,05) у досліджуваних групах.
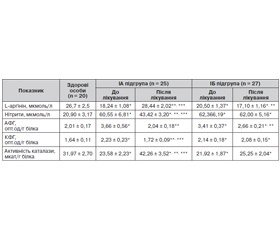
Аналіз результатів дослідження параметрів прооксидантно-антиоксидантного гомеостазу у хворих на ГГВ, які отримали базисну терапію, продемонстрував, що в період розпалу хвороби у І групі показники АФГ та КФГ спонтанної ОМБ крові були вищими (р < 0,01–0,05), ніж у здорових осіб. У пацієнтів ІІ групи показник АФГ спонтанної ОМБ був вищим (р < 0,05), а показник КФГ спонтанної ОМБ мав тільки тенденцію (р > 0,05) до більш високого рівня, ніж у здорових осіб. При порівняльному аналізі в період розпалу встановлено, що показник АФГ ОМБ у сироватці крові хворих І групи був вищим (р < 0,05), а показник КФГ ОМБ мав лише тенденцію (р > 0,05) до підвищення порівняно з аналогічними показниками хворих ІІ групи (табл. 1).
У період реконвалесценції у хворих ІБ підгрупи показники АФГ і КФГ спонтанної ОМБ крові мали тенденцію до відновлення (р > 0,05) в динаміці захворювання, але залишалися вірогідно вищими (р < 0,05) за аналогічні показники здорових людей. У хворих II групи показники АФГ і КФГ спонтанної ОМБ крові не відрізнялися (р > 0,05) від аналогічних параметрів здорових людей. Порівняльний аналіз показав, що на момент виписки зі стаціонару у хворих ІБ підгрупи вміст АФГ та КФГ спонтанної ОМБ був вищим (р < 0,05), ніж у пацієнтів ІІ групи (табл. 1).
Виражені прооксидантні зміни поєднувалися у хворих на ГГВ, що перебігає на тлі хронічного вживання алкоголю в гепатотоксичних дозах, з порушенням антиоксидантного захисту, про що свідчила низька порівняно зі здоровими людьми активність каталази в сироватці крові протягом усього періоду спостереження на тлі базисного лікування. Крім того, у хворих І групи на відміну від хворих II групи вміст нітритів у сироватці крові був вищим (р < 0,05–0,001) протягом усього періоду спостереження (табл. 1).
Зазначені зміни показників прооксидантно-антиоксидантної регуляції в бік активації вільнорадикального окислення поєднувалися зі змінами вмісту L-аргініну у сироватці крові, що мали різноспрямований характер у пацієнтів досліджуваних груп. Уже при госпіталізації вміст L-аргініну в сироватці крові хворих І групи виявився нижчим (на 23,2 %, р < 0,05), а в пацієнтів ІІ групи вищим (р < 0,05) на 20,3 % за аналогічний показник здорових людей. У подальшому в динаміці у хворих на ГГВ І групи вміст L-аргініну в сироватці крові залишався нижчим (р < 0,01–0,001) порівняно як зі здоровими людьми, так і з пацієнтами II групи (табл. 1).
Роль прооксидантно-антиоксидантних змін у розвитку цитолітичного синдрому підтверджує ряд кореляційних зв’язків між параметрами хворих на ГГВ. Зареєстровані позитивні середньої сили кореляційні взаємозв’язки між активністю АлАТ у сироватці крові та показником АФГ спонтанної ОМБ крові (r = +0,38, р < 0,05); між умістом білірубіну в сироватці крові та вмістом продуктів АФГ (r = +0,34, р < 0,05) та КФГ спонтанної ОМБ крові (r = +0,36, р < 0,05). Кореляційний аналіз показав негативний сильний зв’язок між активністю АлАТ у сироватці крові та каталазою (r = –0,94, р < 0,01); негативний середньої сили зв’язок між умістом білірубіну в сироватці крові та каталазою (r = –0,38, р < 0,05).
Порівняння основних біохімічних параметрів при виписці хворих на ГГВ показало, що наявність хронічного вживання алкоголю в гепатотоксичних дозах відіграє певну роль в затримці видужання цих хворих, що підтверджувалося триваючим, більш вираженим синдромом цитолізу печінкових клітин. На тлі нормалізації рівня загального білірубіну у більшості пацієнтів обох груп зниження активності АлАТ у сироватці крові хворих IБ підгрупи відбувалося повільніше, ніж у пацієнтів II групи. Активність цього ферменту при виписці залишалася вищою (р < 0,05) у пацієнтів IБ підгрупи і становила 2,33 ± 0,17 ммоль/год•л проти 1,82 ± 0,07 ммоль/год•л у хворих II групи.
Про затримку одужання хворих І групи порівняно з пацієнтами II групи свідчать також результати динаміки маркерного профілю пацієнтів. Так, у хворих IБ підгрупи частіше (x2 = 14,21, р < 0,01) зберігалася циркуляція в крові HBsAg та рідше (x2 = 9,67, р < 0,05) реєструвалася сероконверсія HBeAg — anti-HBe.
Відомо, що в умовах окисного стресу й неконтрольованої реакції активних форм кисню переважають процеси нерегульованої модифікації білків, що зрештою призводить до втрати їх біологічної активності, при цьому окисно-модифіковані білки генерують нові антигени й негативно впливають на імунну відповідь [1]. Вживання алкоголю збільшує продукцію активних форм кисню, знижує рівень антиоксидантів та підвищує окисний стрес, збільшуючи токсичні впливи вільних радикалів [17]. До того ж у хворих на ГГВ індукуються гострофазові показники, зокрема оксид азоту, що є захисною реакцією, оскільки він здатний інгібувати реплікацію ряду вірусів. Система оксиду азоту бере участь у механізмі ураження печінки при гострій вірусній інфекції та тривалій персистенції гепатотропних вірусів. При цьому єдиним субстратом для синтезу оксиду азоту є L-аргінін — відносно незамінна амінокислота, особливо в умовах патології [5]. Шлях L-аргінін — оксид азоту відіграє головну роль у підтримці запальної відповіді, апоптозу та в захисті від вільнорадикального ураження. При запальних процесах, зокрема при інфекціях, ендогенний синтез L-аргініну не забезпечує фізіологічні потреби. Недостатність субстрату L-аргініну викликає зниження синтезу оксиду азоту з посиленням утворення пероксинітриту, що справляє цитотоксичну дію та ушкоджує гепатоцити [13].
З урахуванням виявлених особливостей динаміки стану прооксидантно-антиоксидантного гомеостазу для підвищення ефективності базисної патогенетичної терапії хворих на ГГВ із хронічним вживанням алкоголю в гепатотоксичних дозах було застосовано одночасне призначення L-аргініну гідрохлориду (Тівортін) і тіотриазоліну (ІА підгрупа).
У період розпалу ГГВ середні показники основних біохімічних параметрів, прооксидантно-антиоксидантного гомеостазу у хворих ІА підгрупи до призначення лікування статистично не відрізнялися (р > 0,05) від відповідних параметрів хворих ІБ підгрупи, які отримали традиційну базисну терапію.
На момент завершення терапії при аналізі динаміки вмісту показників прооксидантно-антиоксидантного гомеостазу в сироватці крові пацієнтів ІА підгрупи виявлено зниження (р < 0,05) концентрації АФГ і КФГ спонтанної ОМБ крові порівняно з показниками до лікування, при цьому зазначені показники в цей період не відрізнялися (р > 0,05) від аналогічних параметрів здорових людей (табл. 2).
Зареєстровано підвищення (р < 0,001) вмісту каталази в динаміці захворювання, проте цей показник залишався вірогідно вищим (р < 0,05–0,001), ніж у хворих IБ підгрупи та здорових людей. До того ж у хворих IА підгрупи виявлено зниження (р < 0,05) вмісту нітритів та підвищення (р < 0,001) вмісту L-аргініну в сироватці крові в динаміці захворювання (табл. 2).
Порівняльний аналіз показав, що на момент виписки зі стаціонару у хворих IА підгрупи вміст нітритів, КФГ спонтанної ОМБ крові був нижчим (р < 0,05–0,01), а вміст L-аргініну та каталази вищим (р < 0,001), ніж у пацієнтів IБ підгрупи (табл. 2).
Порівняння вираженості цитолітичного синдрому в період реконвалесценції показало нижчу (р < 0,05) активність АлАТ у сироватці крові в пацієнтів IА підгрупи, які додатково до базисного лікування отримували терапію L-аргініну гідрохлоридом і тіотриазоліном. Активність цього ферменту в зазначений період становила 1,84 ± 0,09 ммоль/год • л проти 2,33 ± 0,17 мммоль/год • л відповідно у хворих IА та IБ підгруп.
Проведений аналіз маркерного профілю при виписці хворих на ГГВ, що перебігає на тлі хронічного вживання алкоголю в гепатотоксичних дозах, показав збереження циркуляції в крові HBsAg у всіх хворих обох груп. Проте сероконверсія HBeAg — anti-HBe найчастіше (x2 = 8,75, р < 0,01) відбувалася у пацієнтів ІА підгрупи — у 21 (84,0 %) проти 12 (45,0 %) пацієнтів ІБ підгрупи. Крім того, виявлено, що вміст anti-HBe в сироватці крові хворих IА підгрупи був вищим (р < 0,05), ніж у хворих IБ підгрупи, — 0,69 ± 0,09 од. проти 0,38 ± 0,07 од. відповідно.
В експериментальних та клінічних дослідженнях доведено, що L-аргінін має імуномодулюючі та антиоксидантні властивості, підвищує артеріальний кровотік у печінці, зменшує венозний опір у системі портальної вени, нормалізує печінкову оксигенацію, запобігає гіпоксії гепатоцитів, прискорює розщеплення вільних радикалів, що покращує детоксикаційну функцію гепатоцитів, за рахунок підтримки печінкового кровообігу впливає на обмін колагену та зменшує тяжкість фіброзу печінки [12]. HBV може індукувати оксидативний стрес, що відіграє провідну роль в ураженні печінки, та перебігає на тлі підвищеного рівня оксиду азоту, що чинить вазодилатуючий ефект, перешкоджає активації цитокінами синтезу молекул адгезії, виявляє захисну дію, виступаючи як фактор антиоксидантної активності, проявляє цитопротективну, протизапальну й антимікробну дію. Оксид азоту відносять до основних регуляторів нормальної функції ендотелію, серцево-судинної, імунної та інших систем [15].
Висновки
1. У хворих на гострий гепатит В із хронічним вживанням алкоголю в гепатотоксичних дозах період розпалу характеризується більшими порушеннями прооксидантно-антиоксидантної регуляції за рахунок вищого рівня альдегідфенілгідразонів спонтанної окисної модифікації білків крові (р < 0,05) та нітритів (р < 0,01), що поєднується з низьким вмістом L-аргініну (р < 0,05) у сироватці крові.
2. Період реконвалесценції у хворих на гострий гепатит В із хронічним вживанням алкоголю в гепатотоксичних дозах характеризується вищим рівнем альдегідфенілгідразонів (р < 0,05) й кетонфенілгідразонів (р < 0,05) спонтанної окисної модифікації білків крові, що мають кореляцію з активністю аланінамінотрансферази (r = +0,34 й r = +0,34, р < 0,05 відповідно), вищим вмістом нітритів (р < 0,01) у поєднанні з низьким вмістом L-аргініну (р < 0,05) у сироватці крові порівняно з хворими на гострий гепатит В без супутнього ураження печінки.
3. Залучення L-аргініну гідрохлориду до лікування хворих на гострий гепатит В із хронічним вживанням алкоголю в гепатотоксичних дозах сприяє поліпшенню прооксидантно-антиоксидантних процесів за рахунок зниження вмісту нітритів і кетонфенілгідразонів спонтанної окисної модифікації білків крові, підвищення вмісту L-аргініну й активності каталази у сироватці крові, що зрештою сприяє нормалізації активності аланінамінотрансферази (р < 0,05) та збільшенню частоти сероконверсії HBeAg — anti-HBe (84 проти 45 %, x2 = 8,75, р < 0,01) порівняно з хворими, у лікуванні яких використовували лише базисні засоби.
1. Дубинина Е.Е. Окислительная модификация протеинов, ее роль при патологических состояниях / Е.Е. Дубинина, А.В. Пустыгина // Укр. біохім. журн. — 2008. — № 6. — С. 5–18.
2. Зайцев И.А. Естественное течение вирусного гепатита В / И.А. Зайцев, Л.С. Бондарев, В.А. Мирошниченко // Сучасна гастроентерологія. — 2007. — № 1. — С. 81–86.
3. Мовчан А.В. Особенности эпидемического процесса вирусного гепатита В и организации мер борьбы в современных условиях / А.В. Мовчан, Л.В. Маслова // Питання експериментальної та клінічної медицини. Збірник статей. — 2011. — № 15. — С. 97–102.
4. Назар П.С. Зміни біохімічних показників та загального аналізу крові в осіб із алкогольним ураженням печінки / П.С. Назар, О.І. Осадча, М.М. Левон // Буковинський мед. вісник. — 2012. — № 1. — С. 59–62.
5. Олещук О.М. Протективна роль оксиду азоту при ішемії-реперфузії печінки / О.М. Олещук // Фармакологія та лікарська токсикологія. — 2010. — № 6. — С. 41–45.
6. Пат. 67226 Україна, МПК (2012.01) А 61 К 31/00. Спосіб комплексного лікування гострого вірусного гепатиту В на тлі супутнього алкогольного ураження печінки / Фурик О.О., Рябоконь О.В.; заявники та патентовласники Запорізький держ. мед. ун-т, О.О. Фурик, О.В. Рябоконь. — № U201108411; заявл. 04.07.11; опубл. 10.02.12, Бюл. № 3.
7. Савченкова Л.В. Клиническая фармакология тиотриазолина / Л.В. Савченкова, Д.А. Филатов, И.П. Белоусова // Укр. мед. альманах. — 2008. — № 3. — С. 212–217.
8. Соціальна медицина та організація охорони здоров’я / За ред. Ю.В. Вороненка, В.Ф. Москаленка. — Тернопіль: Укрмедкнига, 2000. — 680 с.
9. Association of pro-inflammatory cytokines, adipokines & oxidative stress with insulin resistance & non-alcoholic fatty liver disease / R. Kumar, S. Prakash, S. Chhabra [et al.] // Indian. J. Med. Res. — 2012. — Vol. 136. — P. 229–236.
10. Ethanol potentiates hepatitis B virus replication through oxidative stress-dependent and -independent transcriptional activation / B.Y. Min, N.Y. Kim, E.S. Jang [et al.] // Biochem. Biophys. Res. Commun. — 2013. — Vol. 431. — P. 92–97.
11. Gao B. Alcoholic liver disease: pathogenesis and new therapeutic targets / B. Gao, R. Bataller // Gastroenterology. — 2011. — Vol. 141. — Р. 1572–1585.
12. Ijaz S. The effect of consecutively larger doses of L-argentine on hepatic microcirculation and tissue oxygenation in hepatic steatosis / S. Ijaz, M.C. Winslet, A.M. Seifalian // Microvascular Research. — 2009. — Vol. 78. — P. 206–210.
13. L-arginine supplementation reduces cardiac noradrenergic neurotransmission in spontaneously hypertensive rats / C.W. Lee, D. Li, K.M. Channon [et al.] // J. M. Cell. Cardiol. — 2009. — Vol. 47. — P. 149–155.
14. Light alcohol drinking and cancer: a meta-analysis / V. Bagnardi, M. Rota, E. Botteri [et al.] // Oncol. — 2013. — Vol. 24. — Р. 301–308.
15. Oxidative stress and antioxidants in hepatic pathogenesis / Hye-Lin, Hye-Jun Shin, Mark A. Feitelson et al. // World Journal of Gastroenterology. — 2010. — Vol. 16. — Р. 6035–6043.
16. The characteristic of T cells response to HBV–specific antigen proteins in patients with HBV infection / X. Feng, H.P. Yan, H.Y. Liao [et al.] // Zhonghua Shi Yan He Lin Chuang Bing Du Xue Za Zhi. — 2012. — Vol. 26. — P. 253–525.
17. The effect of chronic alcohol intoxication and smoking on the activity of oral peroxidase / N. Waszkiewicz, A. Zalewska, S.D. Szajda [et al.] // Folia Histochem. Cytobiol. — 2012. — Vol. 50. — P. 450–455.

/tirag/23/23.jpg)
/tirag/24/24.jpg)