Журнал «Актуальная инфектология» 3 (4) 2014
Вернуться к номеру
Фиброз печени: современные принципы диагностики
Авторы: Дуда А.К., Окружнов Н.В., Бойко В.А. — Национальная академия последипломного образования им. П.Л. Шупика, г. Киев; Трихлеб В.И. — Украинская военно-медицинская академия, г. Киев
Рубрики: Инфекционные заболевания
Разделы: Справочник специалиста
Версия для печати
Фиброз печени — это закономерное следствие практически всех заболеваний печени любой этиологии. Мы сталкиваемся с рядом стандартных стереотипных процессов, которые разворачиваются в ткани печени. Преимущественно это процессы хронического воспаления, которым противостоят процессы регенерации тканей печени. В основе нарушения равновесия между процессами фиброзирования и регенерации лежит накопление экстрацеллюлярного матрикса. Фиброз печени в своем развитии приводит к циррозу печени, гепатоцеллюлярной карциноме, а рост заболеваемости наблюдается во всем мире. Кроме того, это генетически детерминированный процесс, но модифицируемые факторы играют важную роль в прогрессировании данного заболевания. Современные данные свидетельствуют о возможности обратимого фиброза печени.
Фіброз печінки — це закономірний наслідок практично всіх захворювань печінки будь-якої етіології. Ми стикаємось із рядом стандартних стереотипних процесів, що розгортаються у тканині печінки. Переважно це процеси хронічного запалення, яким протистоять процеси регенерації тканин печінки. В основі порушення рівноваги між процесами фіброзування й регенерації лежить накопичення екстрацелюлярного матриксу. Фіброз печінки у своєму розвитку призводить до цирозу печінки, гепатоцелюлярної карциноми, а ріст захворюваності спостерігається у всьому світі. Крім того, це генетично детермінований процес, але фактори, що модифікуються, відіграють важливу роль у прогресуванні даного захворювання. Сучасні дані свідчать про можливість оборотного фіброзу печінки.
Liver fibrosis — a natural consequence of almost all liver diseases of any origin. We are faced with a number of standard stereotype processes that take place in the liver tissue. Mostly it is the processes of chronic inflammation, which oppose the processes of liver tissue regeneration. The basis of imbalance between the processes of fibrosis and regeneration is an accumulation of extracellular matrix. Liver fibrosis in its development leads to liver cirrhosis, hepatocellular carcinoma, and the increase in morbidity rate is observed worldwide. Furthermore, the process is genetically determined, but modifiable factors play an important role in the progression of this disease. Current data indicate the possibility of reversible liver fibrosis.
фиброз печени, неинвазивная диагностика фиброза печени, FibrоТеst-ActiTest.
фіброз печінки, неінвазивна діагностика фіброзу печінки, FibrоТеst-ActiTest.
liver fibrosis, non-invasive diagnosis of liver fibrosis, FibroTest-ActiTest.
Статья опубликована на с. 59-64
За последнее время с проблемой гепатитов столкнулись миллионы людей. В мире насчитывается около 240 млн пациентов с хроническим вирусным гепатитом В и около 700 млн — с хроническим вирусным гепатитом С, т.е. каждый 6-й житель нашей планеты. Это достаточно широко распространенная патология среди населения. Ежегодно порядка 1,5 млн жителей планеты погибают от острых и хронических процессов, обусловленных вирусами гепатитов.
Вирусные гепатиты с парентеральным механизмом передачи (хронические вирусные гепатиты В и С) на протяжении ряда последних лет продолжают оставаться широко распространенным инфекционным заболеванием среди населения нашей страны. Наиболее уязвимой группой на протяжении последних лет наблюдения остается молодое трудоспособное население детородного возраста (21–39 лет). В этой возрастной группе показатель заболеваемости в 1,5–2 раза превышает таковой среди всего населения. В 2012 г. в структуре заболеваемости наиболее пораженной возрастной группой были лица в возрасте 30–39 лет (32 %), на втором месте — 19–29 лет (24 %). В большинстве случаев заражение происходит в результате случайных половых связей без презерватива, при внутривенном введении наркотических препаратов, а также зарегистрированы случаи инфицирования при пользовании чужими предметами личной гигиены (маникюрные, педикюрные принадлежности, бритвенные приборы, инструменты для пирсинга и тату). Большое значение имеет и передача вируса от матери ребенку во время беременности или в родах.
Широкое распространение и не всегда определенный прогноз хронических гепатитов, включая вирусные гепатиты В и С, требуют выработки оптимальной диагностической и лечебной тактики для каждого пациента. Для улучшения долгосрочного прогноза необходима диагностика и мониторирование стадии фиброза печени в условиях естественного течения или на фоне проводимой терапии [1].
Фиброз печени (ФП) — это закономерное следствие практически всех заболеваний печени любой этиологии. Мы сталкиваемся с рядом стандартных стереотипных процессов, которые разворачиваются в ткани печени. Преимущественно это процессы хронического воспаления, которым противостоят процессы регенерации тканей печени. В основе нарушения равновесия между процессами фиброзирования и регенерации лежит накопление экстрацеллюлярного матрикса. Такое накопление в течение хронического поражения печени в 6–10 раз превышает нормальные показатели. ФП в своем развитии приводит к циррозу печени, гепатоцеллюлярной карциноме, а рост заболеваемости наблюдается во всем мире.
Кроме того, ФП — это генетически детерминированный процесс, но модифицируемые факторы играют важную роль в прогрессировании данного заболевания. Современные данные свидетельствуют о возможности обратимого фиброза печени. К сожалению, те результаты, которые были получены на экспериментальных животных, на сегодняшний день не получают такого же подтверждения у людей [2, 3].
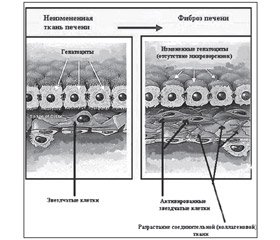
Основным источником и генератором избыточного экстрацеллюлярного матрикса являются клетки Ито. В норме пул этих клеток в печени составляет около 10–15 % от всех клеточных структур в тканях печени. Следует заметить, что фиброз печени в той или иной степени выявляется примерно в 40–45 % секций, которые проводятся в связи со смертью людей в развитых странах [4].
Клетки Ито являются основным продуцентом фиброза в тканях печени и располагаются в так называемых пространствах Диссе. Это пространства, которые находятся между функциональными гепатоцитами и основными клетками тканей печени, а также эндотелиальными сосудами в тканях печени.
Клетки Ито в покое являются одними из депо ретиноидов и витамина А. В результате повышения их активности снижается пул ретиноидов. Они превращаются в активные клетки — миофибробласты — и начинают заполнять пространство Диссе и функциональные пространства, которые имеются между эндотелиоцитами в сосудах печеночной дольки. Таким образом, данные клетки начинают заполняться компонентами экстрацеллюлярного матрикса [11].
Таким образом, фиброз печени — это универсальная генетически заложенная реакция на повреждение печени. Она характеризуется избыточным количеством фиброзной ткани вследствие как увеличения ее образования, так и уменьшения скорости разрушения. В ответ на инфекцию, вызванную гепатотропными вирусами (вирусы гепатитов В, С и D, цитомегаловирусы, вирус Эпштейна — Барр и др.), воздействие алкоголя, лекарственных и токсических средств возникает патологический процесс в печеночных клетках. Выраженность этих явлений различна: от дистрофических проявлений, связанных с блокадой ферментных систем клетки и нарушением ее жизнеобеспечения, до некроза [5].
/tirag/60/60.jpg)
На первом этапе фиброз гепатоцитов развивается как защитная реакция для поддержания структуры и архитектоники печени, после того как образуются пустоты на месте погибших клеток. Это проявляется увеличением размеров органелл клеток, а клинически — гепатомегалией.
На фоне процессов регенерации происходит лизис избыточно образованной фиброзной ткани под действием специфических ферментов — коллагеназ. Адекватная регенерации печени сопровождается освобождением от избыточной фиброзной ткани. При хроническом повреждении печени нарушаются физиологические процессы, а количество фиброзной ткани в печени нарастает [6, 14].
Избыточное отложение фиброзной ткани в конечном итоге приводит к развитию цирроза печени. Важность диагностики и оценки стадии фиброза печени определяется последствиями патологического процесса. Имеют место следующие изменения:
1) нарушение процессов обмена между клетками печени и кровью; шунтирование крови — сброс крови из приносящих сосудов в печеночные вены, что приводит к движению крови в обход печеночной клетки и в свою очередь — к невозможности адекватно осуществлять дезинтоксикационную и синтетическую функции печени;
2) прогрессирование хронического заболевания печени в сторону цирроза печени приводит к уменьшению спектра и снижению эффективности лечебных мероприятий;
3) успешно проведенное лечение с прекращением действия повреждающего фактора — вирусов гепатитов В, С, D, алкоголя и других токсических факторов приводит к обратному развитию патологических процессов и регрессу фиброза.
Золотым стандартом оценки выраженности степени фиброза печени остается биопсия.
Проводимое гистологическое исследование позволяет уточнить следующие параметры:
1) причину заболевания печени;
2) оценить стадию фиброза;
3) индекс гистологической активности;
4) принять решение о тактике ведения больного;
5) оценить естественное течение патологического процесса;
6) оценить эффективность проведенной терапии.
На сегодняшний день самым востребованным методом является полуколичественный способ оценки выраженности индекса фиброза по шкале МЕТАVIR. Согласно данной шкале, выделяют 4 стадии фиброза: F1, F2, F3, F4.
По шкале METAVIR выделяют 5 стадий фиброза при хроническом гепатите С:
— F0 — фиброз отсутствует;
— F1 — портальный и перипортальный фиброз без образования септ;
— F2 — портальный и перипортальный фиброз с единичными септами;
— F3 — портальный и перипортальный фиброз со множественными септами;
— F4 — цирроз.
Некровоспалительная активность
Активность или степень активности определяет повреждения при портальном воспалении и гепатоцеллюлярном некрозе.
По шкале METAVIR выделяется 4 стадии активности:
— A0 — активность отсутствует;
— A1 — минимальная активность;
— A2 — умеренная активность;
— A3 — высокая активность.
Оценка индекса гистологической активности также важна. Она позволяет судить о возможности прогрессирующего течения заболевания.
Так, в отношении вирусного гепатита С (ВГС) в настоящее время нет четких ориентиров в прогнозе — разовьется ли у пациента цирроз печени или нет.
При хроническом гепатите В (ВГВ) важным критерием прогноза является уровень вирусной нагрузки. Однако наиболее объективным критерием прогноза является скорость прогрессирования стадии фиброза, которую можно оценить по результатам повторных биопсий или неинвазивных методов обследования.
/tirag/62/62.jpg)
К сожалению, биопсия печени, оставаясь золотым стандартом определения стадии фиброза, является методом с возможными осложнениями вплоть до летальных исходов. По данным 9 мультицентровых исследований, количество летальных случаев варьирует от 0 до 3,3 на 1000 биопсий печени. По мнению ряда авторов, результаты исследования биоптатов дают неоднозначную информацию. Это затрудняет оценку как исходного состояния пациента, так и динамики наблюдения за эффективностью проводимой терапии. Так, был проведен анализ 2084 биопсий печени, осуществленных в 89 французских медицинских центрах в 1997 г. В 91 % случаев проводилась чрескожная биопсия печени и в 9 % — трансвенозная. Анализ показал следующие негативные моменты:
— в 1,5 % случаев полученный биологический материал оказался непригодным для проведения диагностики;
— у 20 % пациентов регистрировались умеренно выраженные боли после процедуры;
— у 3 % пациентов боли были значительными, что потребовало проведения внутривенной аналгезии с последующей госпитализацией (это в тех случаях, когда биопсия проводилась амбулаторно).
Среди осложнений превалировали следующие:
— эпизоды снижения артериального давления — у 39 пациентов (1,9 %), что потребовало медикаментозного лечения;
— различные серьезные осложнения возникли у 12 (0,58 %) пациентов, но без смертельных исходов.
К серьезным осложнениям были отнесены:
— кровотечение в брюшную полость (1 случай);
— случайная пункция желчного пузыря (3 случая);
— случайная пункция легких (1 случай);
— у 3 больных были пунктированы другие органы.
Прокол других органов имел место при слепой биопсии печени без ультразвукового контроля.
Частота осложнений возрастала с количеством пассов иглой для биопсии: при одном пассе — 26,6 %, при 2 и более — 68 %. Дополнительные пассы проводились из-за того, что не был получен пригодный для исследования материал.
Частота осложнений зависела от опыта и квалификации врача, проводившего биопсию: 34,4 % осложнений — у менее опытных и 27,4 % — у более опытных. При опросе после процедуры 9 % пациентов заявили, что больше никогда не согласятся на проведение биопсии печени.
Аналогичное исследование было проведено в Швейцарии в 1992 г. Частота осложнений была сопоставима с французскими исследованиями. Отмечено 0,3 % серьезных осложнений, включая и смертельные исходы.
Биопсия печени, как метод оценки фиброза печени, имеет серьезные ограничения, обусловленные рядом объективных и субъективных причин.
К объективным причинам относятся следующие:
— малый объем биоптата (обычно он составляет 1/500 000 часть ткани органа), который при наличии неравномерно-диффузного поражения печени может иметь разные стадии фиброза и индекс гистологической активности;
— сравнение результатов парных биопсий, полученных из правой и левой доли печени пациентов, инфицированных ВГС, показало, что расхождение на 1 балл индекса гистологической активности имелось в 25 % случаев;
— у 14,5 % пациентов отмечалась ситуация, когда по биопсии из одной доли печени был поставлен цирроз печени, а по биопсии из другой доли — выраженный фиброз;
— получение адекватного объема биоптата (длиной минимум 25 мм с захватом не менее 11 портальных трактов) не гарантировано при чрескожном доступе.
К субъективным причинам различий в определении стадии фиброза относят квалификацию врача-морфолога. При оценке разными специалистами-морфологами различия наблюдались в 20 % случаев.
Динамическое наблюдение за степенью фиброза печени с помощью биопсии затруднено ввиду вышеописанных ограничений. Представленные данные обосновали необходимость создания надежных неинвазивных методов диагностики ФП как при первичном обследовании, так и при последующем динамическом наблюдении [8].
Маркеры фиброза печени разделяют на прямые (биомаркеры, отражающие динамику количества фиброзных волокон и составляющих их веществ) и непрямые (АлАТ, АсАТ, альфа-2-макроглобулин, гаптоглобин, аполипопротеин А1, гамма-глутамилтранспептидаза, общий билирубин и др.), свидетельствующие о нарушении функции печени при выраженном фиброзе и циррозе печени. Изолированно возможности прямых серологических маркеров фиброза изучены в научных исследованиях. В широкой клинической практике они не получили достаточного распространения.
К непрямым серологическим маркерам фиброза печени относят рутинные лабораторные тесты, отражающие нарушение функции печени. Они также позволяют оценить наличие фиброза, особенно на стадии цирроза печени.
Считается, что уровень АсАТ имеет более сильную связь с фиброзом, чем уровень АлАТ. Соотношение АсАТ/АлАТ > 1 (коэффициент де Ритиса) является достоверным показателем выраженной стадии фиброза печени (в том числе цирроза).
Что касается уровня АлАТ, то даже при нормальных его значениях на фоне хронической инфекции вирусами гепатитов В и С в трети случаев определяется фиброз выше 2-й стадии по шкале МЕТАVIR (эти пациенты подлежат противовирусной терапии) [7, 12].
Для улучшения диагностической точности различных лабораторных тестов было разработано несколько индексов, основанных на комбинации непрямых маркеров ФП. Наиболее распространенной является диагностическая панель тестов:
1. FibrоТеst-ActiTest — включает тест, предназначенный для диагностики фиброза и некротически-воспалительной активности в ткани печени (тест-система Roche Diagnostics, Швейцария):
— ФиброТест — диагностика фиброза печени.
— АктиТест — оценка вирусной некротически-воспалительной активности.
2. FibroМах включает 5 модулей (ВioPredictive, Франция):
— ФиброТест — диагностика фиброза печени;
— АктиТест — оценка вирусной некротически-воспалительной активности;
— СтеатоТест — диагностика стеатоза печени;
— НешТест — диагностика неалкогольного стеатогепатита;
— АшТест — диагностика алкогольного стеатогепатита.
При проведении тестов FibroМах используются математические формулы, которые для получения результата проверяют каждый параметр. Алгоритм включает в себя такие переменные, как возраст, вес, рост и пол.
3. GenoFibrоТеst представляет собой экспертную систему биохимических показателей крови при обследовании больного ВГС, которая включает 4 модуля (ВioPredictive, Франция):
— ФиброТест — диагностика фиброза печени;
— определение вирусной нагрузки при ВГС (метод полимеразной цепной реакции);
— определение генотипа ВГС;
— определение интерлейкина 28В (IL-28В).
Неинвазивная диагностика фиброза печени с применением методики FibrоТеst-ActiTest позволяет определить стадию фиброза и индекс гистологической активности и предназначена для оценки стадии фиброза и контроля за его развитием на фоне терапии, а также для оценки некротически-воспалительных процессов в печеночной ткани.
FibrоТеst-ActiTest рассматривается в качестве альтернативы для чрескожной биопсии печени у пациентов с хроническим вирусным гепатитом. Оба теста получили широкую известность во Франции, Европе и США. Во Франции эти тесты применяются в более чем 500 частных лабораториях и 37 государственных госпиталях.
Первоначально тесты разрабатывались для пациентов, инфицированных вирусами гепатитов С и В, а затем стали применяться и при других нозологических формах хронических заболеваний печени [13].
FibrоТеst включает 5 биохимических показателей:
— альфа-2-макроглобулин;
— гаптоглобин;
— аполипопротеин А1;
— гамма-глутамилтранспептидаза;
— общий билирубин.
ActiTest включает перечисленные выше 5 компонентов + дополнительно АлАТ.
По данным ряда исследований, при хроническом вирусном гепатите для начальных стадий фиброза диагностическая точность метода составляет более 70 %, при выраженном фиброзе и циррозе — 100 %.
Благодаря применению FibrоТеst число необходимых биопсий печени сокращается на 46 %. Это особенно актуально у больных, у которых проведение биопсии сопряжено с определенными трудностями или риском (например, коагулопатия, тромбоцитопения), или при отказе пациента, а также для оценки стадии фиброза в динамике. Результат теста легко читается и понятен доктору и пациенту.
Методы визуализации печени (УЗИ, МРТ) в настоящее время играют ключевую роль в диагностике стадии заболевания печени в силу неинвазивности и доступности. Они позволяют оценить морфологические параметры органа: форму, размеры, структуру, наличие или отсутствие объемных образований, провести реогепатографию — исследование в сосудистых режимах для косвенной оценки плотности и эластичности ткани печени.
Применение аппаратов УЗИ (с увеличением изображения при помощи цифровых технологий) делает возможной визуализацию зернистости ткани печени, перипортального фиброза и других изменений, указывающих на нарушение гистоархитектоники органа.
Однако описательные характеристики УЗИ подвержены большому разбросу и не позволяют дифференцировать морфологические стадии хронического гепатита, особенно начальные. При накоплении фиброзной ткани в печени изменяются ее физические свойства — увеличивается плотность органа и сопротивление портальному кровотоку. В связи с этим перспективным в клинической практике является определение плотности или эластичности ткани печени с помощью прямых методов.
К прямым методам оценки фиброза печени относят ультразвуковую эластометрию печени с помощью аппарата FibroScan (EchoSens, Франция), определяемую в кПа. Метод позволяет оценить наличие фиброза печени, генерируя вибрационные импульсы, и по результатам компьютерного анализа судить об изменении эластических свойств печени и темпов прогрессирования фиброза.
Аппарат FibroScan представлен ультразвуковым преобразовательным датчиком, в который установлен источник колебаний средней амплитуды и низкой частоты. Генерируемые датчиком колебания передаются на подлежащие исследуемые ткани печени и создают упругие волны, подвергающие модуляции отраженный ультразвук. Скорость распространения упругих волн определяется эластичностью печеночной ткани.
Суммарный объем подвергающейся исследованию печеночной ткани в среднем составляет 6 см3 (датчик М), что многократно превышает таковой при пункционной биопсии печени. Применение датчиков нового поколения (XL) позволяет обследовать объем до 24 см3.
Заключение
Применение неинвазивных методов диагностики фиброза печени на современном этапе расширило спектр обследования пациентов, дало возможности большей объективизации проводимого обследования и терапии больного. Это способствовало предотвращению многих нежелательных осложнений, возможных при проведении инвазивных методов.
Все неинвазивные методы оценки фиброза печени можно разделить на две группы: методы визуализации и лабораторной оценки состояния органа.
Методы визуализации печени (УЗИ, МРТ) дают возможность выявить наличие зернистости ткани печени, перипортального фиброза и других изменений, указывающих на нарушение гистоархитектоники органа. К прямым методам оценки фиброза печени относят ультразвуковую эластометрию печени с помощью аппарата FibroScan. Метод позволяет оценить наличие фиброза печени и судить об изменении эластических свойств печени и прогрессировании фиброза.
Неинвазивная диагностика фиброза печени с применением методики FibrоТеst-ActiTest позволяет определить стадию фиброза и индекс гистологической активности и предназначена для оценки стадии фиброза и контроля за его развитием на фоне терапии, а также для оценки некротически-воспалительных процессов в печеночной ткани. FibrоТеst-ActiTest рассматривается в качестве альтернативы для чрескожной биопсии печени у пациентов с хроническим вирусным гепатитом.
1. Шерлок Ш., Дули Дж. Заболевания печени и желчных путей: Практическое руководство. — М.: ГЭОТАР-медицина, 2002. — 864 с.
2. Bataller R., Brenner D.A. Liver fibrosis // J. Clin. Invest. — 2005. — 115(2). — 209–218.
3. Iredale J.P. Models of liver fibrosis: exploring the dynamic nature of inflammation and repair in a solid organ // J. Clin. Invest. — 2007. — 117(3). — 539–548.
4. Parsons C.J., Takashima M., Rippe R.A. Molecular mechanisms of hepatic fibrogenesis // J. Gastroenterol. Hepatol. — 2007. — 22(1). — 79–84.
5. Сторожаков Г.И., Ивкова А.Н. Патогенетические аспекты фиброгенеза при хронических заболеваниях печени // Клин. перспективы гастроэнтерологии, гепатологии. — 2009. — 2. — 3–10.
6. Павлов Ч.С., Золотаревский В.Б., Томкевич М.С. Возможности обратимости цирроза печени // Рос. журнал гастроэнтерологии, гепатологии и колопроктологии. — 2006. — 1. — С. 20–29.
7. Северов М.В. Обратимость фиброза и цирроза печени при HCV-инфекции // Гепатологический форум. — 2008. — 1. — С. 2–6.
8. Павлов Ч.С., Глушенков Д.В., Ивашкин В.Т. Современные возможности эластометрии, фибро- и акти-теста в диагностике фиброза печени // Рос. журнал гастроэнтерологии, гепатологии и колопроктологии. — 2008. — 4. — 43–52.
9. Rockey D.C. Antifibrotic therapy in chronic liver disease // Clin. Gastroenterol. Hepatol. — 2005. — 3. — 95–107.
10. Павлов Ч.С., Ивашкин В.Т. Биопсия печени: методология и практика сегодня // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. — 2006. — Т. XVI, № 4. — С. 65–78.
11. Павлов Ч.С., Ивашкин В.Т., Шульпекова Ю.О., Золотаревский В.Б. Современные представления о патогенезе, диагностике и лечении фиброза печени // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. — 2005. — Т. XV, № 2. — С. 13–20.
12. Шульпекова Ю.О., Ивашкин В.Т., Мамаев С.Н. и др. Уровень трансформирующего фактора роста-1b (TGF-1b) в сыворотке крови и показатели клеточного иммунитета у больных хроническим гепатитом С (ХГС) // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. Приложение № 12. Материалы шестой российской конференции «Гепатология сегодня», 20–23 марта 2003 г. — 2003. — Т. ХI, № 1. — С. 14.
13. Baroni G.S., D’Ambrosio L., Curto P., Casini A., Mancini R., Jezequel A.M. et al. Interferon gamma decreases hepatic stellate cell activation and extracellular matrix deposition in rat liver fibrosis // Hepatology. — 1996. — 23. — 1189–1199.
14. Bickel M., Baringhaus K.-H., Gerl M., Gunzler V., Kanta J., Schmidts L. et al. Selective inhibition of hepatic collagen accumulation in experimental liver fibrosis in rats by a new prolyl 4-hydroxylase inhibitor // Hepatology. — 1998. — 28.