Журнал «Актуальная инфектология» 3 (4) 2014
Вернуться к номеру
Адаптована клінічна настанова, заснована на доказах. Грип та гострі респіраторні інфекції
Рубрики: Инфекционные заболевания
Разделы: Официальная информация
Версия для печати
Статья опубликована на с. 123-191
Склад мультидисциплінарної робочої групи з опрацювання клінічної настанови
Голубовська Ольга Анатоліївна — завідувач кафедри інфекційних хвороб Національного медичного університету імені О.О. Богомольця, д.м.н., професор, головний позаштатний спеціаліст Міністерства охорони здоров’я України зі спеціальності «Інфекційні хвороби»;
Ліщишина Олена Михайлівна — директор Департаменту стандартизації медичних послуг ДП «Державний експертний центр Міністерства охорони здоров’я України», к.м.н.;
Андрейчин Михайло Антонович — завідувач кафедри інфекційних хвороб з епідеміологією, шкірними та венеричними хворобами Тернопільського державного медичного університету імені І.Я. Горбачевського, президент асоціації інфекціоністів України, член-кореспондент АМНУ, д.м.н., професор;
Бацюра Ганна Володимирівна — асистент кафедри сімейної медицини та амбулаторно-поліклінічної допомоги Національної медичної академії післядипломної освіти імені П.Л. Шупика, к.м.н.;
Граділь Григорій Іванович — доцент кафедри інфекційних хвороб Харківського національного медичного університету, к.м.н.;
Глушкевич Тетяна Георгіївна — завідувач бактеріологічної лабораторії Державного закладу «Український центр з контролю та моніторингу захворювань Міністерства охорони здоров’я України», головний позаштатний спеціаліст МОЗ України зі спеціальності «Бактеріологія»;
Демчишина Ірина Вікторівна — завідувач лабораторії вірусології та СНІДу, референс-лабораторії Міністерства охорони здоров’я з діагностики грипу та ГРВІ Центральної СЕС Міністра охорони здоров’я України;
Дихановська Тетяна Альбертівна — завідувач центру грипу та ГРВІ державного закладу «ЦСЕС» Міністерства охорони здоров’я України;
Дубинська Галина Михайлівна — завідувач кафедри інфекційних хвороб з епідеміологією вищого державного навчального закладу України «Українська медична стоматологічна академія», д.м.н., професор;
Зінчук Олександр Миколайович — завідувач кафедри інфекційних хвороб з епідеміологією Львівського державного медичного університету імені Данила Галицького, д.м.н., професор;
Колеснікова Ірина Павлівна — завідувач кафедри епідеміології Національного медичного університету імені О.О. Богомольця, д.м.н., головний позаштатний спеціаліст Міністерства охорони здоров’я України зі спеціальності «Епідеміологія»;
Крамарьов Сергій Олександрович — завідувач кафедри дитячих інфекційних хвороб Національного медичного університету імені О.О. Богомольця, д.м.н., професор, головний позаштатний спеціаліст Міністерства охорони здоров’я України зі спеціальності «Дитячі інфекційні хвороби»;
Кулєш Олена Валеріївна — асистент кафедри інфекційних хвороб Національного медичного університету імені О.О. Богомольця;
Матюха Лариса Федорівна — завідувач кафедри сімейної медицини та амбулаторно-поліклінічної допомоги Національної медичної академії післядипломної освіти імені П.Л. Шупика, д.м.н., професор, головний позаштатний спеціаліст Міністерства охорони здоров’я України зі спеціальності «Загальна практика — сімейна медицина»;
Морозов Анатолій Миколайович — професор кафедри нейрохірургії Національного медичного університету імені академіка О.О. Богомольця, д.м.н., професор;
Мостовенко Раїса Василівна — завідувач інфекційного діагностичного боксованого відділення Національної дитячої спеціалізованої лікарні «Охматдит», к.м.н., головний позаштатний спеціаліст МОЗ України зі спеціальності «Педіатрія»;
Нетяженко Василь Захарович — завідувач кафедри пропедевтики внутрішніх хвороб № 1 Національного медичного університету імені О.О. Богомольця, академік НАМН України, д.м.н., професор, головний позаштатний спеціаліст Міністерства охорони здоров’я України зі спеціальності «Терапія»;
Рябоконь Олена В’ячеславівна — завідувач кафедри інфекційних хвороб Запорізького державного медичного університету, д.м.н., професор;
Степаненко Алла Василівна — радник Міністра охорони здоров’я України, д.м.н., професор;
Фещенко Юрій Іванович — директор ДУ «Національний інститут фтизіатрії і пульмонології імені Ф.Г. Яновського НАМН України», завідувач кафедри фтизіатрії і пульмонології Національної медичної академії післядипломної освіти імені П.Л. Шупика, академік НАМН України, д.м.н., професор, головний позаштатний спеціаліст Міністерства охорони здоров’я України зі спеціальності «Пульмонологія. Фтизіатрія»;
Чернишова Людмила Іванівна — завідувач кафедри дитячих інфекційних хвороб та дитячої імунології Національної медичної академії післядипломної освіти імені П.Л. Шупика, д.м.н., професор, головний позаштатний спеціаліст Міністерства охорони здоров’я України зі спеціальності «Дитяча імунологія»;
Широбоков Володимир Павлович — завідувач кафедри мікробіології та вірусології НМУ імені О.О. Богомольця, академік НАН та НАМН України, д.м.н., професор, головний позаштатний спеціаліст Міністерства охорони здоров’я України зі спеціальності «Мікробіологія і вірусологія»;
Юрченко Володимир Дмитрович — директор державного закладу «Український науково-практичний центр екстреної медичної допомоги та медицини катастроф Міністерства охорони здоров’я України», голова Ради асоціації з невідкладної медичної допомоги, головний позаштатний спеціаліст Міністерства охорони здоров’я України зі спеціальності «Медицина невідкладних станів», радник Міністра охорони здоров’я;
Ячнік Анатолій Іванович — провідний науковий співробітник державної установи «Національний інститут фтизіатрії і пульмонології імені Ф.Г. Яновського Національної академії медичних наук України».
Методичний супровід та інформаційне забезпечення
Горох Євгеній Леонідович — начальник відділу якості медичної допомоги та інформаційних технологій Департаменту стандартизації медичних послуг державного підприємства «Державний експертний центр Міністерства охорони здоров’я України», к.т.н.;
Мельник Євгенія Олександрівна — начальник відділу доказової медицини Департаменту стандартизації медичних послуг державного підприємства «Державний експертний центр Міністерства охорони здоров’я України»;
Мігель Олександр Володимирович — завідувач сектора економічної оцінки медичних технологій Департаменту стандартизації медичних послуг державного підприємства «Державний експертний центр Міністерства охорони здоров’я України»;
Шилкіна Олена Олександрівна — начальник відділу методичного забезпечення новітніх технологій у сфері охороні здоров’я Департаменту стандартизації медичних послуг державного підприємства «Державний експертний центр Міністерства охорони здоров’я України».
Державний експертний центр МОЗ України є членом
Guidelines International Network (Міжнародна мережа настанов)
ADAPTE (Франція) (Міжнародний проект з адаптації клінічних настанов)
Рецензенти
Федорченко Сергій Валерійович — завідувач наукового відділу вірусних гепатитів та ВІЛ-інфекції державної установи «Інститут епідеміології та інфекційних хвороб ім. Л.В. Громашевського Академії медичних наук України», д.м.н., професор;
Дорошенко Віталій Олександрович — професор кафедри дитячих інфекційних хвороб Національного медичного університету імені О.О. Богомольця, д.м.н.
Зміст
Скорочення
Синтез настанови
Резюме
Актуальність гострих респіраторних інфекцій
Вступ
Клінічна настанова
Методи
Результати пошуку літератури
Діагностика, лікування, хіміопрофілактика та ведення спалаху грипу в закладах закритого типу
Питання діагностики
Кого слід вважати хворим на грип?
Кого необхідно тестувати на підозрюваний грип?
Які зразки необхідно брати для тестів на грип у людей з підозрою на грип?
Які тести на грип повинні використовуватися в осіб з підозрою на грип?
Як інтерпретуються результати тестів на грип?
Противірусні лікарські засоби
Хто повинен проходити лікування противірусними лікарськими засобами?
Які противірусні препарати слід використовувати для лікування?
Застосування інших лікарських засобів
Киснева терапія
Антибіотикотерапія
Кортикостероїди
Попередня допоміжна штучна вентиляція легень
Противірусні лікарські засоби для хіміопрофілактики
Кому слід призначати противірусну хіміопрофілактику для запобігання грипу?
Коли слід розпочинати противірусну хіміопрофілактику?
Як довго повинна тривати хіміопрофілактика?
Які противірусні препарати слід застосовувати для хіміопрофілактики?
Управління спалахами інфекції в закладах
У якому випадку слід запідозрити спалах грипу у закладі закритого типу?
Яка роль тестування мешканців закладів закритого типу з грипоподібним захворюванням після того, як діагноз грипу вже було встановлено в одного мешканця?
Кого слід лікувати противірусними препаратами під час спалахів?
Хто повиннен отримувати противірусну хіміопрофілактику під час спалахів?
Які медичні працівники повинні отримувати противірусну хіміопрофілактику під час спалахів?
Як довго повинна тривати противірусна хіміопрофілактика у мешканців і медичного персоналу під час спалахів?
Nice clinical guideline 69 «respiratory tract infections-antibiotic prescribing» (2008)
1. Резюме
1.1. Перелік усіх рекомендацій
1.2. Маршрут медичної допомоги з приводу інфекцій дихальних шляхів (NICE clinical guideline 69 «Respiratory tract infections-antibiotic prescribing», 2008)
1.3. Огляд
2. Огляд доказової бази і рекомендацій
2.1. Огляд ефективності застосування антибіотиків для респіраторних інфекцій при первинній медичній допомозі
2.2. Стратегії введення антибіотиків при респіраторних інфекціях
2.3. Виявлення пацієнтів з респіраторними інфекціями, які, імовірно, будуть схильні до ризику розвитку ускладнень
2.4. Вподобання пацієнтів та їх батьків/опікунів щодо стратегій призначення антибіотиків при респіраторних інфекціях (непризначення антибіотиків, відкладене призначення антибіотиків і негайне призначення антибіотиків)
2.5. Питання, підняті даними дослідженнями
Обмеження літератури та поточні й майбутні дослідження
Індикатори якості
Члени експертної групи з розробки настанови з грипу IDSA
Глосарій
Посилання
Література, використана в процесі адаптації клінічної настанови
Список скорочень
NICE Національний інститут досконалості медичної допомоги
БГСА Бета-гемолітичний стрептокок групи А
АКН Адаптована клінічна настанова
ВДШ Верхні дихальні шляхи
ВДЯЖ Втрачені дні якісного життя
ВООЗ Всесвітня організація охорони здоров’я
ВР Відносний ризик
ГРВЗ Гостре респіраторне вірусне захворювання
ГРІ Гостра респіраторна інфекція
ГРН Група з розробки настанови
ГСО Гострий середній отит
ДІ Довірчий інтервал
ДНК Дезоксирибонуклеїнова кислота
ЗТ-ПЛР Зворотнотранскриптазна полімеразна ланцюгова реакція
ІВДШ Інфекція верхніх дихальних шляхів
ІНДШ Інфекція нижніх дихальних шляхів
ІФА Імуноферментний аналіз
ККВ Коефіцієнт корисності втрат
КП Коефіцієнт правдоподібності
КППЛ Кількість пацієнтів, які потребують лікування
МІДП Метааналіз індивідуальних даних пацієнта
НПЦ Негативна прогностична цінність
ПЛР Полімеразна ланцюгова реакція
ППЦ Позитивна прогностична цінність
РДСД Респіраторний дистрес-синдром дорослих
РІ Респіраторна інфекція
РКВ Рандомізоване плацебо-контрольоване випробування
РНК Рибонуклеїнова кислота
РЯЖ Роки якісного життя
СШ Співвідношення шансів
США Сполучені Штати Америки
ХОЗЛ Хронічне обструктивне захворювання легень
ЦНС Центральна нервова система
Синтез настанови
За прототип Адаптованої клінічної настанови «Грип та гострі респіраторні інфекції» взято клінічну настанову «Seasonal Influenza in Adults and Children — Diagnosis, Treatment, Chemoprophylaxis, and Institutional Outbreak Management: Clinical Practice Guidelines of the Infectious Diseases Society of America» (2009) http://www.uphs.upenn.edu/bugdrug/ antibiotic_manual/idsainfluenza2009.pdf
Додаткові докази включені з джерел:
1. NICE clinical guideline 69 «Respiratory tract infections-antibiotic prescribing» (2008) http://www.nice.org.uk/nicemedia/pdf/CG69FullGuideline.pdf
2. WHO Guidelines for Pharmacological Management of Pandemic Influenza A (H1N1) 2009 and other Influenza Viruses (February 2010) http://www.who.int/csr/resources/publications/swineflu/h1n1_guidelines_pharmaceutical_mngt.pdf
3. Клинические методы ведения больных, инфицированных новым вирусом гриппа A (H1N1): предварительное руководство (2009) http://www.who.int/csr/resources/publications/swineflu/clinical_managementH1N1_21_May_2009–ru.pdf
4. WHO Regional office for Europe «Сезонний грип: ключові аспекти клінічного ведення тяжких форм хвороби (2011)» (http://www.euro.who.int/__data/assets/pdf_file0007/154888/flu_ case_management_rus.pdf)
Запропонована адаптована клінічна настанова (АКН) не повинна розцінюватися як стандарт медичного лікування. Дотримання положень АКН не гарантує успішного лікування в конкретному випадку; її не можна розглядати як посібник, що включає всі необхідні методи діагностики та лікування або виключає інші. Остаточне рішення стосовно вибору конкретної клінічної процедури або плану лікування повинен приймати лікар з урахуванням клінічного стану пацієнта та можливостей для проведення діагностики та лікування в конкретному закладі охорони здоров’я.
Дана клінічна настанова носить рекомендаційний характер.
Seasonal Influenza in Adults and Children — Diagnosis, Treatment, Chemoprophylaxis, and Institutional Outbreak Management: Clinical Practice Guidelines of the Infectious Diseases Society of America (2009)
Настанова з лікування пацієнтів із сезонним грипом підготована групою експертів Американського товариства з інфекційних хвороб. Настанова на засадах доказової медицини охоплює питання діагностики, лікування та хіміопрофілактики противірусними препаратами, а також питання, що пов’язані з веденням спалаху сезонного (міжпандемічного) грипу в закладах закритого типу. Вона призначена для використання лікарями всіх медичних спеціальностей, які безпосередньо залучені до надання медичної допомоги пацієнтам, оскільки інфекція вірусу грипу поширюється в громаді під час епідемії грипу і з нею можуть стикатися лікарі-практики, які надають допомогу широкому колу пацієнтів.
Резюме
З історії питання
Щороку в США грип викликає значну захворюваність та смертність [1, 2]. Більшість осіб, які інфіковані вірусом грипу, мають безсимптомний перебіг хвороби та неускладнені гострі гарячкові респіраторні симптоми, для яких характерний самообмежувальний перебіг. Проте тяжка хвороба й ускладнення, що пов’язані з інфекцією, у тому числі госпіталізація та смерть, можуть бути в осіб похилого віку, у дуже молодих людей, в осіб із супутніми хворобами, у тому числі з хворобами легенів і серця, діабетом та імуносупресією, та у здорових людей. Своєчасне лікування противірусними препаратами може полегшити тяжкість і тривалість симптомів, госпіталізації й ускладнень (середній отит, бронхіт, пневмонія) і може знизити користування амбулаторними послугами та застосування антибіотиків, ступінь та об’єм виділення вірусу і, можливо, смертність серед певної категорії населення. Щеплення є кращим методом для профілактики грипу, але противірусні препарати також можуть використовуватися як первинний чи вторинний засіб профілактики поширення грипу в певних закладах.
Центри з контролю і профілактики хвороб (англ. CDC’s) і Консультативний комітет з практики імунізації та Американська академія педіатрії надають рекомендації щодо належного застосування тривалентних інактивованих і живих ослаблених вакцин проти грипу, а також інформацію щодо діагностики та противірусних препаратів для лікування і хіміопрофілактики [3–5]. На веб-сайті CDC’s з грипу (http://www.cdc.gov/flu) також узагальнюється остання актуальна інформація щодо поточних рекомендацій із діагностичних тестів на грип і застосування противірусних препаратів. Настанова Американського товариства з інфекційних хвороб (англ. IDSA) щодо грипу становить собою низку рекомендацій на засадах доказової медицини та довідкову інформацію щодо грипу за матеріалами з багатьох джерел, у тому числі CDC, Американської академії педіатрії, Американської колегії лікарів, Американської академії сімейних лікарів, Товариства дитячих інфекційних захворювань, Товариства з епідеміології США, лікарів-практиків та IDSA щодо прийняття рішень із цих питань. Процес розробки нинішньої настанови передбачає систематичне зважування якості доказів і градацію рекомендацій (див. табл. 1) [6].
Ця настанова стосується сезонного (міжпандемічного) грипу, а не пташиного грипу або пандемічного грипу. Настанова з клінічного ведення спорадичних інфекцій людини через вірус пташиного грипу А (H5N1) була опублікована Всесвітньою організацією охорони здоров’я [7, 8].
Актуальність гострих респіраторних інфекцій
Печінка А.М., Дземан М.І. Гострі респіраторні захворювання: питання клінічної діагностики та лікування // Укр. мед. часопис. — 2010. — № 5(79). — С. 94–103.
ГРІ — найбільш поширені інфекційні хвороби, що уражають усі вікові групи населення. Серед причин тимчасової втрати працездатності вони посідають перше місце — навіть у міжепідемічний період на них хворіє 1/6 частина населення планети. В Україні щорічно на ГРІ хворіють 10–14 млн осіб, що становить 25–30 % від усієї та близько 75–90 % інфекційної захворюваності. Експерти ВООЗ відзначають, що ця найпоширеніша в людській популяції група захворювань в останні роки має постійну тенденцію до збільшення. Соціальні причини, що пов’язані з глобальним процесом постійного зростання урбанізації, більш тісні контакти людей практично в будь-якій точці земної кулі та посилення міжконтинентальних міграційних процесів сприятимуть подальшому поширенню ГРІ.
Для ГРІ властиві 2 форми епідемічного процесу — спорадичні захворювання та епідемічні спалахи. У період епідемічного спалаху відзначається переважання певної нозології, однак ніколи етіологічна структура не буває однорідною. Дана група хвороб постійно поповнюється новими представниками, що можуть стати причиною тяжкої патології.
Повітряний шлях передавання збудника, висока сприйнятливість населення практично до всіх збудників ГРІ зумовлює основну епідеміологічну особливість — швидкість та широту їхнього розповсюдження. ГРІ практично необмежені, суттєво зростають в умовах у періоди сезонного імунодефіциту, що виникає в зимовий та зимово-весняний періоди. Іноді спалахи можуть виникати й у більш ранній період, хоча це швидше виняток, ніж правило.
Неодноразові випадки ГРІ навіть під час сезонного підвищення захворюваності зумовлені відсутністю перехресного імунітету не лише між представниками окремих груп, а й між окремими сероварами в межах одного збудника. Суттєвим є також те, що ці збудники досить стійкі в зовнішньому середовищі.
Більшості ГРІ властива сезонність, максимальний рівень захворюваності реєструється в осінньо-зимову, зимово-весняну, а ентеровірусної — у весняно-літню пори року.
На епідемічний процес ГРІ впливають біологічні, соціальні, природні фактори, що на сьогодні вивчені ще недостатньо. Ландшафтні, біоценотичні, кліматичні та інші умови впливають на нього, сприяють або протидіють життєдіяльності респіраторних збудників.
Епідемічний процес при ГРІ, спричинених невірусними збудниками, значно складніший унаслідок не стільки великого етіологічного розмаїття, скільки різного рівня контагіозності, меншої сприйнятливості людини, можливості збереження збудників не лише в людській популяції, а й серед тварин.
Відсутність можливості застосування на практиці методів специфічної діагностики для етіологічного розшифрування кожного випадку захворювання не дозволяє виявити справжній рівень поширеності як ГРВІ, так і ГРІ іншої етіології (легіонельозні, мікоплазмові, кокові, рикетсійні тощо). Поширеність цих хвороб на земній кулі, залучення в епідемічний процес великої кількості людей, інколи тяжкі наслідки, значні економічні збитки зумовлюють актуальність респіраторних інфекцій для людства.
В етіологічній структурі ГРІ найбільша частка належить вірусам, і на сьогодні відома значна кількість збудників ГРВІ, що переважно належать до 9 різних груп вірусів, — грип, парагрип, адено-, РС- (респіраторно-синцитіальний), пікорна-, корона-, рео-, ентеро- та герпес-віруси.
Серед бактеріальних збудників ГРІ у дорослих найчастіше зустрічаються такі мікроорганізми: переважно умовно-патогенна кокова мікрофлора (гострі фарингіти, бронхіти). Як особливо небезпечні та висококонтагіозні виокремлюють менінгококову інфекцію, дифтерію, легіонели, мікоплазми, хламідії.
Вони спричиняють появу різноманітних клінічних проявів — назофарингітів, ангін, бронхітів. Збудники цієї групи частіше, ніж віруси, викликають пневмонії. У патогенезі частини з них (мікоплазмози, хламідіози, рикетсіози) велике значення має клітинний імунітет, певні порушення якого часто призводять до персистенції цих збудників, особливо в дітей. Відтак у багатьох випадках ми маємо справу не з черговим інфікуванням, а з реактивацією персистентної інфекції, що необхідно враховувати при лікуванні.
ГРІ, що спричиняються умовно-патогенною мікрофлорою, насамперед коковою, мають переважно ознаки циклічного інфекційного процесу, що здатен до самоліквідації.
Можна виокремити такі етапи патогенезу ГРВІ:
— Ураження чутливого епітелію. Для частини ГРВІ існує певна «вибірковість» ураження ВДШ, пов’язана з рецепторно-лігандними взаємовідносинами, що дозволяє клінічно запідозрити етіологію ГРВІ.
— Розмноження вірусів в епітелії ВДШ та його ушкодження.
— Генералізація процесу, вірусемія, ураження судинної стінки з розвитком вторинних процесів.
— Формування системної клітинної імунної відповіді, стимуляція розвитку серологічного захисту.
— Усунення інфекційного процесу, розвиток серологічного захисту, репаративні процеси відновлення.
Важливим наслідком вивчення патогенезу ГРВІ є розуміння того, що одужання від них відбувається за рахунок активізації клітинного захисту, антитіла з’являються пізно, вже в період ранньої реконвалесценції, і мають значення переважно для профілактики повторного зараження.
Seasonal Influenza in Adults and Children – Diagnosis, Treatment, Chemoprophylaxis, and Institutional Outbreak Management: Clinical Practice Guidelines of the Infectious Diseases Society of America (2009).
Вступ
Захворювання на грип викликається інфекцією одного з трьох типів циркулюючих РНК-вірусів: вірусу грипу A, B або C [10]. Вірус грипу C викликає респіраторні захворювання, що дещо м’якші, ніж викликані вірусом грипу А і В [11], і тому, як правило, не потребують діагностики, лікування та профілактики. Ця настанова фокусується на клінічних питаннях, пов’язаних із вірусною інфекцією сезонного грипу А і В.
Під час сезону грипу віруси грипу поширюються серед населення. Щороку в США 5–20 % населення інфікується вірусами грипу і, за оцінками, щорічна смертність у середньому становить 36 000 летальних випадків і понад 200 000 випадків госпіталізацій, пов’язаних із вірусом грипу [1, 2]. Окрім того, навантаження хворих на грип пацієнтів на амбулаторні послуги є значним [12, 13]. Хоча більшість хворих мають гострий самообмежувальний гарячковий респіраторний синдром, деякі групи мають підвищений ризик ускладнення у вигляді тяжкого перебігу хвороби або смерті. Ці групи включають літніх людей, дуже молодих людей, а також осіб із супутніми хворобами, наприклад із серцево-легеневими хворобами, пацієнтів із цукровим діабетом, осіб з ослабленим імунітетом та вагітних [5].
Існують різні моделі практики і діагностики грипу та лікування [14–16]. Належне використання діагностичних тестів, а також своєчасне призначення противірусних засобів можуть поліпшити клінічний перебіг грипу, зменшити непотрібне діагностичне тестування, зменшити тривалість необхідної медичної допомоги і знизити як доречне (з приводу можливих бактеріальних ускладнень), так і недоречне застосування антибактеріальних лікарських засобів [17–23]. Дана настанова розглядає використання діагностичних тестів на грип, у тому числі ЗТ-ПЛР, імунофлуоресцентних тестів, наявних комерційних діагностичних експрес-тестів на грип та культури вірусних клітин тканини. Настанова також розглядає використання противірусних препаратів проти грипу як для лікування, так і для хіміопрофілактики, і використання діагностичного тестування і противірусних препаратів у контексті спалахів у закладах закритого типу.
Клінічна настанова
Клінічна настанова — це систематично розроблені твердження для допомоги лікарям і хворим у прийнятті рішень щодо відповідної медичної допомоги в конкретних клінічних обставинах [6]. Атрибути належної настанови включають обґрунтування, надійність, відтворюваність, можливість застосування в клінічній практиці, клінічну гнучкість, ясність, мультдисциплінарний процес, огляд доказів і документацію [6].
Методи
Склад експертної групи. Комітет стандартів і клінічних настанов IDSA залучив фахівців у сфері діагностики, лікування, хіміопрофілактики та управління спалахами сезонного грипу в закладах закритого типу, включали представників таких партнерських організацій: Американської академії сімейних лікарів, Американської академії педіатрії, Американського коледжу лікарів, CDC, Товариства дитячих інфекційних хвороб і Товариства епідеміології Америки. Члени групи наведені в кінці тексту.
Огляд літератури та аналіз. Пошук у базах даних літератури Medline проводили серед відповідної англомовної літератури в період з 1966 по 2008 рік. Були використані такі терміни: «грип» або «грип і вірус», «грип та інфекція», «грип і лікування», «грип і профілактика», «хіміопрофілактика грипу» і «грип і спалах». Пошуки зосереджувалися на дослідженнях у людей.
Процес огляду. При оцінці доказів із діагностики, лікування, хіміопрофілактики та спалахів сезонного грипу в закладах закритого типу експертна група дотримувалася процесу, що використовувався при розробці інших настанов IDSA. Процес включав систематичне зважування якості доказів і класу рекомендацій (табл. 1) [6].
Консенсус при розробці, заснований на доказах. Експертна група зустрічалася 11 разів шляхом телеконференцій та особисто, щоб завершити роботу над настановою. Метою зустрічі було обговорити питання, що розглядатимуться, підготувати письмові завдання та обговорити рекомендації. Всі члени групи брали участь у підготовці та розгляді проекту настанови. Зворотний зв’язок із зовнішніми експертами був отриманий. Всім партнерським організаціям також було запропоновано висловити свою думку і схвалити настанову. Наступні організації зробили внесок у настанову: Американська академія сімейних лікарів, Американська академія педіатрії, CDC, Товариство дитячих інфекційних хвороб, Товариство епідеміології Америки. Настанова була розглянута й затверджена Комітетом стандартів і клінічних настанов IDSA і радою директорів IDSA до її розповсюдження.
Настанова і конфлікт інтересів. Всі члени експертної ради і Група експертів дотримувалися вимог IDSA щодо конфлікту інтересів, що вимагають розкриття інформації про будь-які фінансові або інші інтереси, які можуть розглядатися як фактичні, потенційні або явні конфлікти. Членам Групи експертів були надані заяви про розкриття конфліктів інтересів IDSA і було запропоновано визначити зв’язки з компаніями, що розробляють продукти, котрі можуть вплинути на прийняття настанови. Отримувана інформація щодо зайнятості, консультацій, володіння акціями, гонорарів, фінансування наукових досліджень, експертних висновків, а також членства в консультативних комітетах компаній. Група представила рішення в кожному конкретному випадку на індивідуальній основі щодо обмеження індивідуальної ролі в результаті конфлікту. Потенційні конфлікти зазначені у розділі «Подяки».
Дати перегляду. Щороку Голова Комітету експертної групи, Радник зі зв’язків Комітету стандартів і клінічних настанов IDSA та Голова Комітету стандартів і клінічних настанов IDSA визначають необхідність перегляду настанови на основі перегляду сучасної літератури. При необхідності скликається вся Група експертів для обговорення можливих змін. За необхідності Група експертів буде рекомендувати перегляд настанови Комітету стандартів і клінічних настанов IDSA і Раді IDSA для розгляду та затвердження.
Результати пошуку літератури
У раніше здорових дорослих і підлітків клінічний діагноз грипу може бути досить точним (чутливість > 70 %) у періоди циркуляції вірусу грипу в громаді. Проте чутливість і специфічність поліпшуються із застосуванням певних тестів для лабораторної діагностики грипу, особливо у дітей і госпіталізованих осіб, оскільки багато інших збудників респіраторних інфекцій можуть проявляти подібну симптоматику. Отримання результатів діагностичних тестів може сприяти своєчасному противірусному лікуванню інфікованих пацієнтів, а своєчасна інформація допомагає запобігти передачі вірусу шляхом початку хіміопрофілактики противірусними препаратами та інших заходів контролю.
WHO Regional office for Europe «Сезонний грип: ключові аспекти клінічного ведення тяжких форм хвороби (2011)»
Клінічна характеристика грипу: імовірні сценарії
Неускладнений грип
— Симптоми грипоподібного захворювання: гарячка, кашель, подразнення слизової глотки (фарингіт), риніт, головний біль, біль у м’язах, загальне нездужання без задишки та утрудненого дихання.
— Шлунково-кишкові порушення, такі як діарея та/або блювання, особливо у дітей, однак без ознак зневоднення.
Симптоми прогресуючої хвороби
— Ознаки серцево-дихальної недостатності: задишка, утруднене дихання, кровохаркання чи забарвлене мокротиння, біль у грудях, артеріальна гіпотензія. У дітей на користь прогресуючої хвороби може свідчити прискорене чи утруднене дихання без іншої симптоматики. Ознаки гіпоксії за даними пульсоксиметрії.
— Симптоми, що свідчать про ураження з боку ЦНС: порушення чи втрата свідомості, сонливість чи труднощі при пробудженні після сну; періодичні чи постійні судоми, різка м’язова слабкість чи паралічі.
— Діагностичний висновок про реплікацію вірусу, що триває, чи про вторинну бактеріальну інфекцію, що ґрунтується на результатах лабораторних досліджень чи на клінічних ознаках (наприклад, тривалість високої гарячки та іншої симптоматики більше ніж три дні, сепсис, стрімке погіршення загального стану).
— Швидке зневоднення організму: зниження активності, головокружіння, зниження діурезу, психічна загальмованість.
Ускладнення чи тяжкі форми грипу
— Найбільш часті прояви: задишка, утруднене дихання, гіпоксія, ціаноз, зміни з боку ЦНС, рентгенологічні ознаки пневмонії, різке зневоднення чи ознаки вторинних ускладнень, таких як ниркова чи мультиорганна недостатність, септичний шок.
— Загострення супутніх хронічних захворювань, таких як астма, ХОЗЛ, хронічний гепатит чи ниркова недостатність, діабет чи серцево-судинні порушення, може стати причиною тяжких ускладнень.
Діагноз грипу
— На індивідуальному рівні за наявності циркуляції вірусу грипу в громаді неускладнений грип можна діагностувати, спираючись на клінічну симптоматику.
— Найбільш чутливим методом, що забезпечує точне та швидке виявлення інфекції, є зворотнотранскриптазна полімеразна ланцюгова реакція (ЗТ-ПЛР).
— Експрес-тести на грип (тести за місцем надання медичної допомоги) можуть давати швидкі результати впродовж 15 хвилин чи менше, однак має місце значний відсоток хибно-негативних тестів.
— Негативні результати експрес-тестів не повинні впливати на лікування та прийняття рішень щодо інфекційного контролю.
Коментар робочої групи: в Україні прийнятна практика встановлення клінічного діагнозу грипу в епідемічний сезон та за наявності в пацієнта характерної клінічної картини.
Seasonal Influenza in Adults and Children – Diagnosis, Treatment, Chemoprophylaxis, and Institutional Outbreak Management: Clinical Practice Guidelines of the Infectious Diseases Society of America (2009) (табл. 2)
WHO Regional office for Europe «Сезонний грип: ключові аспекти клінічного ведення тяжких форм хвороби (2011)»
Застосування противірусних лікарських засобів:
— Пацієнтам із груп високого ризику з неускладненим перебігом хвороби чи госпіталізованим пацієнтам із підозрою на грип слід призначати озельтамівір чи занамівір. Не відкладайте початок лікування озельтамівіром до отримання результатів лабораторного дослідження на грип.
— Починайте лікування якомога раніше, оскільки корисний ефект виражений тим більше, чим раніше від початку інфікування його починають. Лікування слід починати навіть після 48 годин від появи перших клінічних проявів, якщо хвороба перебігає в тяжкій формі чи стан пацієнта погіршується.
— Амантадин та римантадин неефективні проти всіх циркулюючих у даний час вірусів.
— Звичайна доза озельтамівіру становить 75 мг двічі на добу впродовж 5 днів (див. табл. 3).
— Комбінована противірусна терапія може бути корисна при лікуванні тяжких, ускладнених випадків грипу та для зниження ймовірної появи стійкості до противірусних засобів.
— В осіб з імунодефіцитними станами може спостерігатися подовжений період вірусної реплікації (від тижнів до місяців); вони схильні до підвищеного ризику розвитку стійкості до озельтамівіру при призначенні їм цього препарату.
— Стійкість до озельтамівіру в цілому тримається на низькому рівні, однак якщо у пацієнта, який отримує озельтамівір, не настає покращення після 5 днів чи стан погіршується, слід розглядати розвиток стійкості.
Seasonal Influenza in Adults and Children – Diagnosis, Treatment, Chemoprophylaxis, and Institutional Outbreak Management: Clinical Practice Guidelines of the Infectious Diseases Society of America (2009)
Противірусні препарати 2 класів мають активність проти вірусів грипу: адамантани (амантадин і римантадин), що активні тільки проти вірусів грипу А, та інгібітори нейрамінідази (озельтамівір і занамівір), що активні проти вірусів грипу А і B. На підставі даних вірусологічного спостереження, отриманих протягом останніх сезонів грипу, значна частина вірусів грипу А (H3N2) резистентна до адамантанів (але чутлива до обох інгібіторів нейрамінідази), а також значна частина вірусів грипу A (H1N1) резистентна до озельтамівіру (але чутлива до занамівіру і адамантанів). Моніторинг місцевих моделей циркуляції грипу у співпраці з місцевими органами охорони здоров’я і CDC (http://www.cdc.gov/flu) має першорядне значення, оскільки триває світовий епіднагляд щодо нових моделей резистентності до противірусних препаратів.
Коментар робочої групи: в Україні моніторинг циркулюючих штамів вірусу грипу здійснюється вірусологічними лабораторіями лабораторних центрів Державної санітарно-епідеміологічної служби України та референс-лабораторією Центру грипу та гострих респіраторних вірусних інфекцій ДУ «Український центр з контролю та моніторингу захворювань Міністерства охорони здоров’я України» (http://ucdc.gov.ua/uk). Поточну інформацію, яка щотижнево оновлюється, щодо захворюваності на грип та чутливості вірусу грипу до противірусних лікарських засобів можна отримати на веб-сайті http://www.euroflu.org
За певних обставин як дорослі, так і діти повинні приймати противірусні препарати, якщо вони інфіковані вірусами грипу. Всіх госпіталізованих пацієнтів із вірусом грипу слід лікувати противірусними препаратами. Призначення противірусних препаратів рекомендується протягом 48 год після появи симптомів у всіх інфікованих дорослих і дітей із високим ризиком розвитку ускладнень унаслідок інфекції (див. табл. 5). Слід розглянути призначення противірусних препаратів через > 48 год після появи симптомів за певних обставин у госпіталізованих пацієнтів. Противірусні препарати можуть бути розглянуті в амбулаторних пацієнтів із діагностованим грипом через 48 год після появи симптомів, якщо вони належать до групи високого ризику розвитку ускладнень грипу і якщо їх симптоми не поліпшуються. Призначення противірусних препаратів також може бути розглянуте протягом 48 год після появи симптомів в інфікованих амбулаторних пацієнтів без високого ризику розвитку ускладнень у результаті інфекції, але які бажають скоротити тривалість хвороби і знизити відносно низький ризик ускладнень. Призначення противірусних препаратів амбулаторним хворим, у яких симптоми з’явилися за > 48 год до звернення по допомогу та у яких зберігається хвороба від помірного до тяжкого ступеня, також можуть отримувати лікування, але безпека й ефективність у цієї популяції не була проаналізована відповідним чином. Проте лікарі повинні розглядати можливість супутніх бактеріальних інфекцій і необхідності застосування антибіотикотерапії у грип-позитивних пацієнтів.
Щеплення залишається основним інструментом для профілактики грипу. Через високу частоту резистентності вірусів грипу A (H3N2), що циркулюють у даний час, до адамантану і високу частоту резистентності вірусів грипу A (H1N1), які циркулюють у даний час, до озельтамівіру необхідно розглядати місцеві моделі циркуляції вірусів грипу за типами і підтипами, якщо такі є, при призначенні противірусної хіміопрофілактики грипу. Групи, які мають отримувати противірусну хіміопрофілактику грипу, включають пацієнтів, які не можуть отримати вакцини проти грипу: дорослих і дітей віком від 1 року з високим ризиком розвитку ускладнень внаслідок інфекції (див. табл. 5); при тісних контактах з особами високого ризику; співробітників закладів, де є спалах грипу; всіх щеплених і нещеплених мешканців, які проживають у закладах, де є спалах грипу. Не всі особи з високим ризиком розвитку ускладнень мають однаковий ризик, тож увага повинна приділятися призначенню хіміопрофілактики тим, хто піддається найбільшому ризику (наприклад, реципієнти трансплантації стовбурових клітин). Нарешті, противірусну хіміопрофілактику слід розглядати у певних осіб під час сезонного грипу, якщо вакцина проти вірусів грипу не відповідає циркулюючим вірусам або якщо вакцина не доступна через її нестачу.
У дітей віком старше 9 років, які отримують хіміопрофілактику, коли вводиться інактивована вакцина проти грипу, тривалість лікування має становити 2 тижні. Діти віком до 9 років, які отримують інактивовану вакцину проти грипу перший раз, потребують другої дози вакцини принаймні через 4 тижні після першої дози. Піки імунної відповіді припадають на другий тиждень після введення другої дози. Таким чином, необхідно мінімум 6 тижнів хіміопрофілактики (тобто хіміопрофілактика протягом принаймні 4 тижнів після першої дози вакцини й додаткові 2 тижні хіміопрофілактики після другої дози) залежно від тривалості затримки між першою та другою дозою вакцини. Живі ослаблені вакцини проти грипу не повинні використовуватися в осіб, які отримували противірусні препарати, через можливість зниження ефективності вакцини. Прийом препаратів проти вірусу грипу необхідно припинити за 48 год до введення живих ослаблених вакцин проти грипу, і, якщо це можливо, противірусні препарати не слід призначати протягом 2 тижнів після введення живих ослаблених вакцин проти грипу. Особи, які отримують живі ослаблені вакцини проти грипу, продемонстрували швидкий захист від інфекції грипу [24–26]. Якщо хіміопрофілактику призначають особам, які мають контакти з інфікованими грипом на побутовому рівні, противірусні препарати слід приймати протягом 10 днів. Під час спалаху грипу хіміопрофілактику в закладах закритого типу слід проводити протягом 14 днів або протягом 7 днів після появи симптомів у останньої інфікованої особи.
Спалахи грипу в закладах закритого типу сприяють значному поширенню вірусу, захворюваності та смертності. Тестування на грип необхідно проводити в будь-якому з таких закладів, у якому щонайменше у двох мешканців виникли нові респіраторні симптоми протягом 72 год у період сезону грипу. У періоди, коли віруси грипу поширюються в громаді, виникнення лабораторно підтвердженого випадку грипу більше ніж у 2 осіб із симптомами, що нагадують симптоми грипу, повинно викликати запровадження заходів контролю спалаху грипу.
Діагностика, лікування, хіміопрофілактика та ведення спалаху грипу в закладах закритого типу
Питання діагностики
Кого слід вважати хворим на грип?
Рекомендація 1. Під час сезону грипу (визначається як період, коли є поширення вірусів у громаді) діагноз грипу слід розглядати у таких пацієнтів незалежно від вакцинального статусу:
А. Імунокомпетентних осіб та осіб з ослабленим імунітетом (як дорослих, так і дітей), у тому числі медичних працівників, пацієнтів із гарячкою і гострим початком респіраторних симптомів і ознак (A II).
Б. Осіб із гарячкою і загостренням хронічних хвороб легень (A II).
В. Немовлят і маленьких дітей із гарячкою без інших ознак або симптомів (A II).
Г. Літніх людей із новими або погіршеними респіраторними симптомами, у тому числі з загостренням застійної серцевої недостатності або зі змінами психічного стану, з гарячкою або без неї (A II).
Д. Тяжкохворих осіб із гарячкою або гіпотермією (A II).
Е. Госпіталізованих дітей, які надійшли до стаціонару без гарячки і гострих респіраторних симптомів, у яких згодом після госпіталізації розвивається гарячка або гарячкове респіраторне захворювання (A II).
Є. Госпіталізованих дорослих, які надійшли до стаціонару без гарячки і гострих респіраторних симптомів, у яких згодом після госпіталізації розвиваються гарячкові респіраторні захворювання (A II).
Рекомендація 2. У будь-яку пору року грип слід розглядати в імунокомпетентних осіб та осіб з ослабленим імунітетом і з гострими гарячковими респіраторними симптомами, які епідеміологічно пов’язані зі спалахом грипу (наприклад, у персоналу закладів охорони здоров’я; мешканців або відвідувачів закладів, де є спалах грипу; при побутових та тісних контактах із людьми з підозрою на грип; мандрівників, які повернулися з країн, де можуть циркулювати віруси грипу; учасників міжнародних масових заходів, а також пасажирів круїзних суден) (A II).
Резюме доказів. У періоди активності грипу в громаді часто виникають епідемії. Раптова гарячка та кашель є загальними ознаками неускладненого грипу в дорослих амбулаторних пацієнтів із чутливістю > 70 % у період сезону грипу [27–29]. Грип асоціюється з низкою ознак і симптомів, що можуть відрізнятися залежно від віку, хронічних захворювань, ускладнень та імунного статусу. Новонароджені можуть мати гарячку і підозру на сепсис [30, 31]. Діарея може виникнути у 28 % інфікованих немовлят і дітей молодшого віку [32–34]. Хоча симптоми ураження верхніх дихальних шляхів із системними симптомами є найбільш частим проявом, тяжкі нелегеневі прояви (наприклад, міокардит [35, 36], рабдоміоліз [37–39], енцефаліт [40–44], гіповолемічний шок із гіпертермією або гіпотермією [45–50] з можливою одночасною бактеріальною інфекцією (зі Staphylococcus aureus, Streptococcus pneumoniae, стрептококами групи A та ін.) [35, 51–53]. Вторинна бактеріальна пневмонія, викликана метицилін-резистентним S.aureus, все більш поширюється і є причиною дитячих смертей, пов’язаних із грипом [45, 52, 54, 55]. Загострення хронічної хвороби є поширеним (наприклад, ХОЗЛ, астми і застійної серцевої недостатності) [36, 56–59]. У літніх людей із грипом не завжди є гарячка [60–64]. Група пацієнтів із найбільшим ризиком розвитку ускладнень, яких госпіталізують у зв’язку з грипом, включає маленьких дітей, літніх людей, осіб з ослабленим імунітетом, а також осіб із певними хронічними хворобами, такими як серцеві, легеневі або неврологічні хвороби [1, 5, 65–76]. Найвищі показники смертності через грип спостерігаються серед літніх людей [2]. Ефективність вакцини проти грипу залежить від віку, імунного статусу й відповідності між циркулюючим і вакцинальним штамом вірусу [77]. Оскільки вакцини проти грипу не є на 100 % ефективними, щеплені і нещеплені люди можуть мати грипоподібні симптоми або через грип, або через одночасно циркулюючі негрипозні збудники (наприклад, риновіруси, аденовіруси, респіраторно-синцитіальні віруси, парагрипозні віруси, бокавіруси, нетяжкий гострий респіраторний коронавірусний синдром, людські метапневмовіруси, Bordetella pertussis, Mycoplasma pneumoniae, Chlamydia pneumoniae і бактеріальні збудники позалікарняних пневмоній). Нозокоміальний грип необхідно розглядати в осіб, у яких гарячка почалася через більше ніж 48 год після госпіталізації під час сезону грипу [78–83]. Протягом літніх місяців діагноз грипу необхідно розглядати у хворих людей, які повернулися з міжнародних мандрівок або мали контакти з хворими на грип [84–89], оскільки віруси грипу циркулюють круглий рік у тропіках, а також у цей час циркулюють у протилежній півкулі планети. Окрім того, мандрівники, які повертаються з країн, що постраждали від пташиного грипу, у яких є гарячкові респіраторні симптоми та які контактували з хворими, вмираючими або мертвими птахами в цих країнах, повинні звернутися за консультацією до місцевого відділу охорони здоров’я з питання можливого тестування на пташиний грип. Поточну й оновлену інформацію щодо пташиного грипу можна знайти на веб-сайті CDC’s Avian Influenza (Bird flu) (http://www.cdc.gov/flu/avian/index) і на веб-сайті ВООЗ, присвяченому пташиному грипу (http://www.who.int/csr/disease/avian_influenza/en/). Інфекції свинячого грипу також можуть бути у людей; більшість інфікованих свинячим грипом людей були в безпосередній близькості до свиней. Свинячий грип є ендемічним захворюванням у стадах свиней у Північній Америці і в усьому світі.
Кого необхідно тестувати на підозрюваний грип?
Рекомендація 3. Якщо результат буде впливати на клінічне ведення (рішення щодо початку противірусного лікування, вплив на інші діагностичні тести, рішення про лікування антибіотиками і заходи боротьби з інфекцією) з урахуванням чутливості і специфічності використовуваного тесту та інформації про місцеве поширення вірусів грипу, такі особи повинні розглядатися для тестування на грип (див. табл. 4).
Під час сезону грипу
А. Амбулаторні імунокомпетентні пацієнти будь-якого віку з високим ризиком розвитку ускладнень грипу (наприклад, госпіталізації або смерті) (див. табл. 5) з проявами гострих респіраторних симптомів з високою температурою протягом 5 днів після початку хвороби, коли вірус зазвичай виділяється (A II).
Б. Амбулаторні особи з ослабленим імунітетом будь-якого віку з респіраторними симптомами, з високою температурою незалежно від часу з початку захворювання, оскільки особи з ослабленим імунітетом можуть виділяти віруси грипу впродовж від декількох тижнів до місяців (A II).
В. Госпіталізовані особи будь-якого віку (імунокомпетентні або з ослабленим імунітетом) із високою температурою й симптомами респіраторного захворювання, у тому числі з діагнозом позалікарняної пневмонії, незалежно від часу з початку захворювання (A II).
Г. Літні люди й діти з підозрою на сепсис або з високою температурою невідомого походження незалежно від часу з початку захворювання (A III).
Д. Діти з високою температурою і респіраторними симптомами, які госпіталізовані для медичної оцінки, незалежно від часу з початку захворювання (A II).
Е. Особи будь-якого віку, у яких розвивається гарячка і респіраторні симптоми після госпіталізації, незалежно від часу з початку захворювання (A II).
Є. Імунокомпетентні особи з гострими респіраторними симптомами з високою температурою без ризику розвитку ускладнень, вторинних відносно інфекції грипу, можуть бути протестовані з метою отримання даних місцевого спостереження (A III).
WHO Guidelines for Pharmacological Management of Pandemic Influenza A (H1N1) 2009 and other Influenza Viruses (February 2010)
У цій настанові до осіб із високим ризиком розвитку ускладнень грипу, у яких розглядається противірусна терапія, зараховують також осіб із хронічними хворобами нирок, хронічними хворобами печінки, певними неврологічними хворобами (у тому числі нервово-м’язовими, нейрокогнітивними хворобами та епілепсією, не включаючи аутизм).
Більш високий ризик серйозних ускладнень від пандемічного вірусу грипу (H1N1) 2009 року також спостерігається у людей, які страждають від ожиріння (особливо надмірного ожиріння), та серед соціально знедолених верств населення і корінного населення.
Робоча група має такі додаткові коментарі щодо осіб із високим ризиком розвитку ускладнених і тяжких форм грипу, що мають бути прийняті до уваги при застосуванні цих рекомендацій:
— Двотижневий післяпологовий період.
— Існують обмежені дані стосовно ступеня, до якого ВІЛ-інфіковані пацієнти мають вищий ризик ускладнених або тяжких форм грипу, хоча є деякі дані щодо сезонного грипу, що вказують на більш високий ризик і обмежені дані про смертність від пандемічного грипу. Рішення щодо призначення противірусних лікарських засобів для таких пацієнтів залежатиме від місцевих пріоритетів і наявності таких противірусних препаратів.
Seasonal Influenza in Adults and Children – Diagnosis, Treatment, Chemoprophylaxis, and Institutional Outbreak Management: Clinical Practice Guidelines of the Infectious Diseases Society of America (2009)
У будь-яку пору року
Ж. Медичні працівники, мешканці або відвідувачі закладів закритого типу, де є спалах грипу, у яких спостерігаються респіраторні симптоми і висока температура впродовж 5 днів з початку хвороби (A II).
З. Особи, які епідеміологічно пов’язані зі спалахом грипу (наприклад, побутові та тісні контакти людей з підозрою на грип, мандрівники, які повернулися з країн, де можуть циркулювати віруси грипу, учасники міжнародних масових заходів і пасажири круїзних суден), які звертаються за медичною допомогою впродовж 5 днів після початку хвороби (A II).
Резюме доказів. Тестування слід проводити, якщо результати можуть вплинути на клінічне ведення або процедури контролю інфекцій. Проте при інтерпретації результатів клініцисти повинні враховувати чутливість діагностичних досліджень, клінічну картину в пацієнта і наявну інформацію про циркуляцію вірусу грипу в регіоні. Більшість людей матимуть можливість виявити вірус грипу протягом 5 днів після початку хвороби [65, 79]. Немовлята можуть виділяти віруси грипу впродовж 10 днів [90, 91]. Особи з ослабленим імунітетом можуть виділяти віруси впродовж декількох тижнів або місяців після зараження [92, 93]. Ідентифікація вірусу грипу в госпіталізованих пацієнтів або в пацієнтів із нозокоміальним грипом може сприяти впровадженню заходів контролю інфекції, щоб запобігти і контролювати поширення грипу в лікарнях [78–83, 94]. Виявлення вірусу грипу може зменшити недоречне застосування антибіотиків, полегшити противірусне лікування і знизити тривалість візитів до кабінетів невідкладної допомоги, використання інших лабораторних тестів і витрат на охорону здоров’я [17, 19, 20, 22, 23]. Проте наявність супутньої бактеріальної інфекції і потреба в антибіотиках повинні бути розглянуті у грип-позитивних пацієнтів, а також у грип-негативних пацієнтів. Грип може також виникати в осіб, які побували в районах, охоплених спалахами грипу [84–89], у тому числі пташиного або свинячого грипу, як зазначалося вище.
ВООЗ Клінічні методи ведення хворих, які інфіковані новим вірусом грипу A (H1N1): попередня настанова (21 травня 2009 р.)
Фактори ризику тяжкого перебігу хвороби
Конкретні фактори ризику, які б вказували на підвищений ризик розвитку прогресуючої хвороби, чітко не встановлені. Клінічні працівники та особи, які здійснюють догляд за хворими, повинні слідкувати за ознаками імовірного клінічного погіршання (наприклад, утруднене дихання, біль у грудях, забарвлена мокрота при кашлі, зміна рівня свідомості та стан сплутаності) та негайно направляти таких пацієнтів у лікарню. Клінічні працівники повинні також брати до уваги будь-які супутні хвороби: стани, пов’язані з порушенням імунітету, діабет, передуючі легеневі, серцево-судинні хвороби.
Вагітність
Відомо, що в разі захворювання на сезонний грип, пташиний грип H5N1 та попередньої інфекції пандемічного грипу вагітні жінки мають підвищений ризик ускладнень. Повідомлялося про деякі випадки госпіталізації вагітних жінок, які були інфіковані новим вірусом H1N1, у тому числі і з летальними випадками. У зв’язку з цим вагітні жінки з підозрою на інфекцію нового грипу А (H1N1) або у випадку підтвердження цієї інфекції повинні підлягати більш частому спостереженню та лікуванню противірусними лікарськими засобами, якщо це передбачено національними стандартами.
Seasonal Influenza in Adults and Children – Diagnosis, Treatment, Chemoprophylaxis, and Institutional Outbreak Management: Clinical Practice Guidelines of the Infectious Diseases Society of America (2009)
Які зразки необхідно брати для тестів на грип у людей із підозрою на грип?
Рекомендації
4. В імунокомпетентних осіб зразки з дихальних шляхів беруть якнайшвидше, бажано впродовж 5 днів від початку захворювання. Взяття зразків пізніше 5-го дня після початку захворювання може призвести до хибно-негативних результатів через суттєве ослаблення вірусу, особливо у дітей старшого віку і дорослих. Немовлята і маленькі діти часто виділяють вірус грипу протягом 1 тижня. У немовлят та дітей молодшого віку оптимальними зразками є носові аспірати і мазки з носоглотки. У дітей старшого віку і дорослих аспірати і мазки з носоглотки є переважними зразками. Зразки з ротоглотки (наприклад, мазки з горла) і зразки мокротиння можуть бути недостатніми для виявлення вірусів грипу людини, але все ще можуть давати позитивні результати (A II).
5. Хворі на грип будь-якого віку з ослабленим імунітетом можуть мати вірус грипу від декількох тижнів до місяців, навіть без високої температури або респіраторних симптомів. Тому взяття зразків з верхніх і нижніх дихальних шляхів (наприклад, за допомогою бронхоальвеолярного лаважу) протягом 5 днів з початку захворювання все ще може бути корисним для тестування цих осіб на грип (A II).
6. Зразки з верхніх і нижніх дихальних шляхів слід брати у пацієнтів, які піддаються механічній вентиляції протягом 5 днів після початку захворювання, хоча результати аналізів можуть виявитися позитивними навіть після цього періоду. Зразки з нижніх дихальних шляхів включають ендотрахеальні аспірати, змиви і рідину бронхоальвеолярного лаважу (A II).
7. Зразки з дихальних шляхів повинні тестуватися на грип якомога швидше після взяття і повинні зберігатися в холодильнику (але не заморожені) в очікуванні тесту (A II).
8. Клініцисти повинні дотримуватися інструкції тесту щодо рекомендованих клінічних зразків для кожного конкретного тесту на грип (A II).
9. З діагностичною метою зразки сироватки в гострій фазі не слід брати. Для визначення титрів антитіл (шляхом інгібування гемаглютиніну, ІФА або фіксації комплементу, доступних тільки через референтні лабораторії) необхідні парні зразки сироватки гострої фази і фази одужання, але результати не можна отримати своєчасно, тому вони не будуть впливати на клінічне ведення (A II).
Резюме доказів. Для максимального виявлення вірусів грипу людини зразки з дихальних шляхів необхідно взяти у хворих якомога раніше з початку захворювання. Хоча носоглоткові зразки або аспірація є оптимальними, назальний мазок, аспірація або змиви, особливо в маленьких дітей, такі ж ефективні, як і зразки з носоглотки для виявлення вірусів грипу [95–99]. Зразки з горла мають нижчу результативність у виявленні вірусів грипу людини [100], але виявилися кращими, ніж назальні зразки для виявлення спорадичної інфекцій пташиного грипу A (H5N1) в організмі людини [8]. Тип зразка, імовірно, має найбільше значення для експрес-тестів і прямих флуоресцентних антитіл; вища чутливість ПЛР може поліпшити результативність [97]. Індуковане мокротиння було протестоване за допомогою ПЛР, але не порівнювалося з іншими респіраторними зразками для виявлення вірусу грипу [101]. Вірус грипу в мокроті також може виявлятися за допомогою виділення вірусу [102], а зразки з нижніх дихальних шляхів, отримані в осіб з ослабленим імунітетом, можуть бути позитивними на вірус грипу, навіть якщо зразки, отримані з верхніх дихальних шляхів, не дали позитивних результатів. Жоден серологічний тест не був затверджений для діагностики інфекції вірусу грипу з використанням зразків сироватки в гострій фазі.
Коментар робочої групи: важливо, щоб отриманий зразок мокротиння включав слиз, що продукується бронхіальними, а не слинними залозами. Для тих, у кого бронхіальний секрет виділяється в недостатній кількості, щоб можна було здобути зразок для дослідження, можна провести стимуляцію шляхом інгаляції гіпертонічного розчину NaCl (може бути концентрацією від 1 до 23,4 %). Це посилює бронхіальну секрецію і стимулює кашель. Найкраще цю процедуру проводити натще. Це той час, коли доступна найбільша кількість бронхіального секрету, накопиченого протягом нічного сну, а шлунок майже не містить шлункового соку, що зменшує шанси домішок шлункового соку до бронхіального секрету під час процедури отримання мокротиння.
Які тести на грип повинні використовуватися в осіб із підозрою на грип?
Рекомендація 10. Для ведення хворих рекомендуються тести, котрі дають результати у короткі строки, що може впливати на клінічне ведення (рішення про початок противірусного лікування, вплив на інші діагностичні тести, рішення про лікування антибіотиками і методи боротьби з інфекцією). Результати тестування повинні враховувати теоретичну імовірність інфекції грипу на основі ознак і симптомів у пацієнта, чутливості і специфічності тесту, що використовується, і відомостей про епідеміологію грипу в громаді. Детальний опис методів тестування на грип також доступний на веб-сайті «CDC’s Seasonal Flu» (http://www.cdc.gov/flu/professionals/diagnosis/labproced ures.htm).
У порядку черговості за наявності рекомендуються такі тести на грип:
А. ЗТ-ПЛР. У даний час це найбільш чутливий і специфічний метод тестування на грип з отриманням результатів упродовж 4–6 год після подачі зразка. ЗТ-ПЛР показує більш високу чутливість, ніж вірусні культури, може бути використаний як підтверджуючий тест і корисний для швидкого визначення типів і підтипів грипу. ЗТ-ПЛР також є кращим тестом для зразків, отриманих від осіб, які контактують із тваринами, які можуть мати інфекцію грипу в минулому [наприклад, грип A (H5N1) серед домашніх птахів у Євразії та Африці або свинячий грип у будь-якій частині світу, включаючи Північну Америку] (A II).
Б. Імунофлуоресценція. Прямі флуоресцентні антитіла або непрямі мічені антитіла для виявлення антигену грипу використовуються як скринінгові тести. Імунофлуоресценція демонструє дещо нижчу чутливість і специфічність, ніж виділення вірусу в культурі клітин, але результати доступні протягом декількох годин після подачі зразка. Виконання цих аналізів значною мірою залежить від можливостей лабораторії і якості зібраного зразка (тобто зразки повинні включати клітини епітелію дихальних шляхів) (A II).
В. Комерційні швидкі тести для діагностики грипу. Доступні на даний час тести виявлення антигену надають результати впродовж 10–30 хв, але демонструють знижену чутливість (70–90 % у дітей і 40–60 % у дорослих) порівняно з ЗТ-ПЛР та вірусною культурою (див. табл. 6). Результативність цих аналізів значною мірою залежить від віку пацієнта, тривалості захворювання, типу зразка і, можливо, типу вірусу. Враховуючи низьку чутливість імунофлуоресценції і комерційних експрес-тестів, слід розглядати подальше тестування з ЗТ-ПЛР та/або вірусними культурами, щоб підтвердити негативні результати тестів (A II).
Рекомендація 11. Виділення вірусу (у стандартній культурі клітин і моношаровій культурі) не є скринінг-тестом, але в періоди низької активності грипу (пізно навесні, влітку і рано восени) воно повинне бути виконане на зразках із дихальних шляхів, отриманих від осіб із підозрою на грип, які звертаються по медичну допомогу протягом 5 днів від початку хвороби, особливо якщо такі особи, як відомо, епідеміологічно пов’язані зі спалахом грипу. Впродовж сезону грипу повинне проводитися вірусологічне (культуральне) обстеження групи пацієнтів, це особливо актуально для закладів закритого типу. Мета цієї процедури – вірусологічне спостереження та перевірка деяких негативних результатів експрес-діагностики (ІФА) (A II).
Рекомендація 12. Серологічне тестування, як правило, не рекомендується для підтвердження інфікування людини вірусом грипу з метою лікування гострих захворювань. Дані однієї проби сироватки серологічних тестів на грип не можуть бути надійно інтерпретовані. Для визначення титрів антитіл (шляхом інгібування гемаглютиніну, ІФА або фіксації комплементу, доступних тільки через референтні лабораторії) необхідні парні зразки сироватки гострої фази і фази одужання, але результати не можна отримати своєчасно, тому вони не будуть впливати на клінічне ведення. Парні зразки сироватки корисні тільки для ретроспективної діагностики з дослідницькою метою (A II).
Резюме доказів
Для впливу на клінічне ведення рекомендуються тести на грип, що забезпечують точні і своєчасні результати. ЗТ-ПЛР має високу чутливість і є надзвичайно точним для виявлення вірусу грипу А і В у клінічних зразках із дихальних шляхів, і може забезпечити результати протягом декількох годин, але в багатьох клінічних закладах своєчасні результати не можуть бути доступні. Мультиплексний ЗТ-ПЛР може бути використаний у деяких умовах для виявлення цілого спектра респіраторних вірусних патогенів.
Експрес-тести на антигени мають більш низьку точність для виявлення інфекції вірусу грипу порівняно з ЗТ-ПЛР або вірусною культурою; таким чином, негативні результати тестів може бути тяжко інтерпретувати [103–109], хоча ці тести можуть дати результати протягом від декількох хвилин до декількох годин. Імунофлуоресценція часто доступна в лабораторіях лікарень і має помірно високу чутливість і високу специфічність порівняно з вірусною культурою, але це вимагає якісної техніки збору зразків, флуоресцентного мікроскопу і навченого клінічного персоналу лабораторії [99]. Імунофлуоресцентне фарбування центрифугованих секрецій дихальних шляхів може забезпечити більш високу чутливість, ніж стандартні прямі флуоресцентні антитіла, непрямі антитіла або експрес-тести на грип [110]. Імунофлуоресцентні респіраторні вірусні набори кількох антигенів, що доступні в деяких закладах, також виявляють віруси парагрипу 1–3, респіраторно-синцитіальний вірус, аденовірус і людський метапневмовірус. Комерційні швидкі тести для діагностики грипу широко доступні, прості у використанні, можуть використовуватися як тести на місці спостереження за пацієнтом і можуть надати результати за 10–30 хв. Однак не всі клінічні зразки підходять для експрес-тестів на грип і також слід дотримуватися інструкції виробника, вкладеної в упаковку. Окрім того, хоча швидкі тести на грип мають допустимі особливості, їх чутливість варіюється від слабкої до середньої порівняно з ЗТ-ПЛР або вірусною культурою [99, 106, 107, 111, 112]. Ні експрес-тести на антиген, ні імунофлуоресцентні аналізи не визначають підтип вірусу грипу А. Найголовніше, слід враховувати обмеження інтерпретації результатів (див. «Як інтерпретуються результати тестів на грип?» нижче). Традиційно вірусна культура (у тому числі одношарова культура) вважається золотим стандартом для виявлення інфекції вірусу грипу в людини. Хоча вірусні культури не забезпечують своєчасні результати, вони важливі як джерело вірусологічних даних про характеристики штаму, такі як порівняння антигену зі штамами вакцини грипу і чутливість до противірусних препаратів, які мають важливе значення для лікарів та охорони здоров’я. Результати можуть не бути корисними при прийнятті клінічних рішень, але можуть бути корисними для виявлення інфекції вірусу грипу, коли інші скринінг-тести дають хибно-негативні результати і як підтвердження ряду негативних результатів швидких тестів на грип, зокрема, в контексті інституційних спалахів. Характеристика і докладний аналіз вірусів грипу, виділених під час позасезонної активності, особливо важливі для цілей спостереження за здоров’ям населення (для моніторингу антигенного дрейфу, вибору вакцини для штаму грипу, ефективності вакцини проти грипу і появи нових штамів грипу) і можуть надати можливість діагностування інших вірусів, що можуть мати особливе значення для людей з ослабленим імунітетом. Тестування противірусної чутливості, імовірно, матиме все більше значення з часом, але зараз доступне лише в обмеженому числі референтних лабораторій. Результати тестування противірусної чутливості в даний час не доступні своєчасно, аби зробити свій внесок у клінічне лікування.
Як інтерпретуються результати тестів на грип?
Рекомендація 13. Щоб правильно інтерпретувати результати тестів, лікарі повинні знати й розуміти обмеження тестів на грип, особливо у випадку скринінг-тестів, таких як імунофлуоресценція і наявні комерційні експрес-тести на грип, а також рівень активності грипу серед населення, яке проходить тестування (див. табл. 7). Клініцисти мають також розуміти, що позитивний результат тесту на грип не виключає бактеріальну коінфекцію та оцінку потенційної потреби в антибіотиках (A II).
А. Позитивний результат скринінг-тесту, швидше за все, буде істинно позитивним в періоди піку активності грипу в протестованій популяції.
Б. Позитивний результат скринінг-тесту, швидше за все, буде хибно-позитивним у періоди низької активності грипу в протестованій популяції, у тому числі в ранні та пізні сезони грипу. Необхідно розглянути можливість проведення підтверджуючого тесту, такого як ПЛР або вірусної культури.
В. Негативний результат скринінг-тесту, швидше за все, буде істинно негативним у періоди низької активності грипу в протестованій популяції.
Г. Негативний результат скринінг-тесту, швидше за все, буде хибно-негативним у періоди пікової активності грипу в протестованій популяції. Необхідно розглянути можливість проведення підтверджуючого тесту, такого як ПЛР або вірусної культури.
Резюме доказів
На результати тестів на грип впливають рівень активності грипу в популяції, яка проходить тестування (тобто поширеність), характеристики тесту порівняно із золотим стандартом, імовірність попереднього діагнозу, чи має людина ознаки і симптоми грипу, чи вірус грипу активно відтворюється в організмі, правильний збір та транспортування зразків і належні процедури тесту [99]. Інтерпретація результатів тесту залежить від прогностичних значень тесту (тобто позитивні і негативні прогностичні значення). Позитивна й негативна прогностична цінність знаходиться під впливом насамперед поширення вірусу грипу в протестованій популяції й чутливості і специфічності тесту для виявлення інфекції вірусу грипу порівняно з золотим стандартом [99, 105]. Чутливість і специфічність тесту грипу є фіксованими параметрами, у той час як поширеність циркулюючих вірусів грипу з часом змінюється в будь-якому суспільстві (див. табл. 7). Хибно-позитивні і хибно-негативні результати можливі при наявних скринінг-тестах залежно від характеристик тесту, якості зразка, рівня активності грипу в популяції та інших факторів [99]. Наприклад, хоча малоймовірно, що особи, які отримують живі ослаблені вакцини, забажають тестування на грип незабаром після введення вакцини, ці особи можуть бути носіями вакцинальних зразків вірусу у верхніх дихальних шляхах протягом 7 днів після щеплення інтраназально і можуть дати позитивні результати на грип протягом цього періоду [113, 114].
Противірусні лікарські засоби
Хто повинен проходити лікування противірусними лікарськими засобами?
Рекомендація 14. Лікування противірусними лікарськими засобами призначається дорослим і дітям із вірусом грипу, що відповідають таким критеріям:
А. Особи з лабораторно підтвердженим вірусом або високою підозрою на інфекцію вірусу грипу з високим ризиком розвитку ускладнень (див. табл. 5) протягом 48 год після появи симптомів. Переваги були найкраще оцінені в основному серед здорових дорослих із неускладненим грипом, лікування яких було розпочато протягом 48 год після появи симптомів, хоча й менша кількість осіб з умовами, що підвищують ризик розвитку ускладнень грипу, також були включені у випробування. Для розробки рекомендацій щодо ведення осіб через > 48 год після появи симптомів доступно менше даних. Лікування рекомендується незалежно від статусу щеплення проти грипу й незалежно від тяжкості хвороби (A II).
Б. Особи, які потребують госпіталізації з лабораторно підтвердженим вірусом або високою підозрою на грип, незалежно від основної хвороби або статусу щеплення проти грипу, якщо лікування може бути розпочато протягом 48 год після появи симптомів (A II). Проте особи, які потребують госпіталізації з лабораторно підтвердженим грипом, чий позитивний результат лабораторного тесту на грип отриманий від зразків, що були отримані пізніше 48 год від початку захворювання, також можуть отримувати лікування (B II).
Рекомендація 15. Слід розглядати можливість лікування дорослих і дітей із грипом, які відповідають таким критеріям:
А. Амбулаторні хворі, стан яких не покращується і які мають високий ризик розвитку ускладнень (див. табл. 5) і в яких є позитивний результат тесту на грип зі зразка, отриманого пізніше 48 год після появи симптомів (C III).
Б. Амбулаторні хворі з лабораторно підтвердженим вірусом або високою підозрою на грип, які не мають підвищеного ризику розвитку ускладнень, симптоми яких проявилися впродовж 48 год до звернення і які бажають скоротити тривалість хвороби і в подальшому скоротити ризик ускладнень (A I) або які знаходяться в тісному контакті з людьми, які мають високий ризик розвитку ускладнень [вторинних щодо інфекції грипу (див. табл. 5)]. Ті, у кого симптоми тривають довше 48 год і зберігається помірний чи тяжкий стан, також можуть отримувати лікування, але безпека й ефективність у цієї популяції не були проаналізовані проспективно (B III).
WHO Guidelines for Pharmacological Management of Pandemic Influenza A (H1N1) 2009 and other Influenza Viruses (February 2010)
Рекомендація 1. Пацієнти, які мають тяжку або прогресуючу хворобу, повинні розпочати лікування озельтамівіром якомога швидше (сильна рекомендація, низька якість доказів).
Ця рекомендація стосується всіх груп пацієнтів, включаючи вагітних, жінок у післяпологовому періоді (до 2 тижнів після пологів) і матерів.
Seasonal Influenza in Adults and Children – Diagnosis, Treatment, Chemoprophylaxis, and Institutional Outbreak Management: Clinical Practice Guidelines of the Infectious Diseases Society of America (2009)
Які противірусні препарати слід використовувати для лікування?
Рекомендація 16. Віруси грипу та їх чутливість до наявних противірусних препаратів стрімко розвиваються. Клініцисти повинні бути обізнаними в місцевих моделях циркуляції грипу в своїх громадах протягом усього сезону грипу. Поточну й оновлену інформацію про стійкість до противірусних препаратів та рекомендації щодо противірусних препаратів можна знайти на веб-сайті «CDC’s influenza» (http://www.cdc.gov/flu). На основі даних щодо чутливості до противірусних препаратів станом на березень 2009 року інфекцію грипу А (H1N1) слід лікувати занамівіром або адамантаном (переважно римантадин через його більш сприятливі побічні реакції); озельтамівір не повинен використовуватися для лікування інфекції вірусу грипу A (H1N1). Інфекцію вірусу грипу A (H3N2) слід лікувати озельтамівіром або занамівіром; адамантан не повинен використовуватися для лікування грипу А (H3N2). Якщо інформація про підтип недоступна, грип повинен лікуватися занамівіром або комбінацією озельтамівіру й римантадину. Вірус грипу В слід лікувати тільки озельтамівіром або занамівіром. Табл. 2 містить детальну інформацію про противірусні препарати у відповідних вікових групах (A II).
Коментар робочої групи: поточну й оновлену інформацію про стійкість до противірусних препаратів можна знайти на веб-сайті www.euroflu.org
WHO Guidelines for Pharmacological Management of Pandemic Influenza A (H1N1) 2009 and other Influenza Viruses (February 2010)
Рекомендація 2. У ситуації, коли озельтамівір недоступний або його не можна використовувати, хворим із тяжкою або прогресуючою хворобою слід давати, якщо можливо, інгаляційний занамівір (сильна рекомендація, дуже низька якість доказів).
Рекомендація 3. Пацієнти, які мають тяжку або прогресуючу хворобу, повинні розпочати лікування озельтамівіром якомога швидше. Слід звернути увагу на використання більш високих доз, наприклад, 150 мг двічі на день (для дорослих) і більш тривале лікування залежно від клінічної реакції (сильна рекомендація, низька якість доказів).
Рекомендація 5. Пацієнти, які мають неускладнену хворобу, викликану підтвердженою або підозрюваною вірусною інфекцією, та знаходяться у групі високого ризику розвитку тяжкої або ускладненої хвороби, повинні розпочати лікування озельтамівіром або занамівіром якомога швидше (сильна рекомендація, низька якість доказів).
Ця рекомендація стосується всіх груп пацієнтів, включаючи вагітних, жінок у післяпологовому періоді (до 2 тижнів після пологів) і матерів-годувальниць.
Пацієнти, які мають неускладнену хворобу, але не знаходяться у групі високого ризику розвитку тяжкої або ускладненої хвороби, можливо, не будуть потребувати лікування противірусними препаратами. Рішення про лікування залежатиме від клінічної оцінки й наявності противірусних препаратів. Пацієнтів, які звертаються по медичну допомогу, але не отримують противірусне лікування, слід проконсультувати щодо ознак прогресування або погіршення хвороби і їм слід порадити негайно звернутися до лікаря, якщо їх стан погіршиться або залишиться таким же.
Рекомендація 6. Діти, які мають тяжку або прогресуючу хворобу, повинні розпочати лікування озельтамівіром якомога швидше (сильна рекомендація, низька якість доказів)
Ця рекомендація стосується всіх дітей, включаючи новонароджених та дітей молодшого віку, зокрема до 2 років.
Рекомендація 8. Діти, які мають неускладнену хворобу, викликану підтвердженою або підозрюваною вірусною інфекцією, та знаходяться у групі високого ризику розвитку тяжкої або ускладненої хвороби, повинні розпочати лікування озельтамівіром або занамівіром якомога швидше (сильна рекомендація, низька якість доказів).
Ця рекомендація стосується всіх немовлят і маленьких дітей (зокрема, віком до 2 років), оскільки вони, як відомо, схильні до вищого ризику розвитку тяжкої або ускладненої хвороби.
Рекомендація 9. Пацієнти, які мають тяжку або прогресуючу хворобу, стійку до озельтамівіру, але точно чутливу або ймовірно чутливу до занамівіру, повинні лікуватися занамівіром (сильна рекомендація, дуже низька якість доказів).
Рекомендація 10. Вагітні жінки і діти віком до 1 року з неускладненим захворюванням через сезонний грип A (H1N1) не повинні лікуватися амантадином або римантадином (сильна рекомендація, дуже низька якість доказів).
Рекомендація 12. Пацієнтам із підтвердженим або підозрюваним грипом не слід призначати рибавірин у вигляді монотерапії. Якщо рибавірин повинен використовуватися в поєднанні з іншими методами лікування, це має бути зроблено тільки в контексті проспективних клінічних випробувань та вірусологічного збору даних у рамках затвердженого протоколу дослідження.
Рекомендація 13. Вагітним жінкам із підтвердженим або підозрюваним грипом не слід призначати рибавірин у вигляді лікування або хіміопрофілактики (сильна рекомендація, нормативне протипоказання).
Що стосується всіх досліджуваних, регіональних та інших недозволених методів лікування, включаючи всі противірусні препарати і препарати на їх основі, як зазначено вище, група з розробки настанови надає наступну рекомендацію:
Рекомендація 14. Пацієнтам з підтвердженою або підозрюваною інфекцією вірусу грипу не слід призначати досліджувані, регіональні та інші несанкціоновані методи лікування, окрім як у контексті проспективних клінічних випробувань та вірусологічного збору даних у рамках затвердженого протоколу дослідження.
Рекомендація 16 також повинна застосовуватися до використання комбінації противірусних препаратів (у тому числі дозволених ліків), оскільки існують дані кількох опублікованих клінічних випробувань щодо безпеки та ефективності таких комбінацій.
Рекомендація 15. У пацієнтів із підтвердженим або підозрюваним грипом досліджувані інгібітори нейрамінідази повинні використовуватися тільки в контексті клінічних випробувань або згідно з відповідними положеннями використання в надзвичайній ситуації.
Рекомендація 16. Занамівір, що містить лактозу (порошок для інгаляцій), не повинен вводитися через небулайзер (сильна рекомендація, нормативне попередження).
Лікування загострення супутніх захворювань (основних захворювань) і супутніх інфекцій повинно здійснюватися відповідно до стандартів лікування таких станів за винятком випадків, кваліфікованих нижче.
Seasonal Influenza in Adults and Children – Diagnosis, Treatment, Chemoprophylaxis, and Institutional Outbreak Management: Clinical Practice Guidelines of the Infectious Diseases Society of America (2009)
Противірусні препарати, доступні для лікування грипу
Історично склалося, що адамантани (амантадин і римантадин) були інгібіторами для більшості типів грипу, але не для вірусів грипу B. Проте значне поширення високих рівнів стійкості до амантадину і римантадину серед вірусу грипу A (H3N2) і обмежена стійкість серед вірусу грипу A (H1N1) були зареєстровані з 2006 року [115–117].
Інгібітори нейрамінідази (озельтамівір і занамівір) мають активність проти вірусів грипу А і B. Зниження ефективності озельтамівіру іноді повідомлялося для лікування грипу B [118, 119]. Хоча показники стійкості до інгібіторів нейрамінідази були загалом низькими до 2007 року [120, 121], з 2007–2008 років у багатьох країнах повідомлялося про появу стійкості до озельтамівіру серед штамів вірусу грипу A (H1N1) [122–131]. Занамівір і адамантани обидва активні щодо стійких до озельтамівіру типів грипу (H1N1). Римантадину віддають більшу перевагу, ніж амантадину, через його більш сприятливі побічні реакції. У лабораторіях усього світу в даний час відслідковують стійкість до противірусних препаратів. Лікарі, які лікують пацієнтів із грипом, повинні бути інформовані про місцеві публічні дані про стан здоров’я, якщо це можливо, про тип і підтипи грипу, які циркулюють у їх районі. Поточну й оновлену інформацію щодо стійкості до противірусних препаратів та рекомендації щодо противірусних препаратів можна знайти на веб-сайті «CDC’s influenza» (http://www.cdc.gov/flu).
Коментар робочої групи: актуальну інформацію щодо грипу в Україні можна знайти на сайті www.moz.gov.ua.
Обидва в даний час ліцензовані інгібітори нейрамінідази дозволені до застосування у дорослих і дітей. Озельтамівір схвалений для лікування грипу у немовлят і дітей віком від 1 року у формі таблеток і суспензії, а занамівір призначений для лікування грипу в дітей віком від 7 років у такій же інгаляційній формі порошку, що застосовують у дорослих. Озельтамівір не схвалений для терапії в дітей віком до 1 року через відсутність адекватних даних про безпеку та ефективність і через побоювання щодо токсичності для ЦНС у новонароджених щурів. Проте обмежені ретроспективні дані про безпеку та ефективність озельтамівіру в цій молодій вікової групи на сьогодні не продемонстрували вікової токсичності, що пов’язана з ліками [132, 133]. В одному додатковому неопублікованому дослідженні безпека озельтамівіру у дітей віком до 1 року ретроспективно розглядалася спільною дослідницькою групою з противірусних препаратів Національного інституту здоров’я у 15 педіатричних закладах охорони здоров’я. Були визначені 180 дітей віком до 1 року, які отримували противірусну терапію грипу озельтамівіром або адамантаном. 64 % отримували озельтамівір; одна третина (62 дитини) були віком до 6 місяців. Неврологічні події під час і через 1 місяць після завершення терапії порівнювалися між озельтамівіром і адамантаном у немовлят, причому статистично або клінічно значущих відмінностей між групами відзначено не було [134]. Проспективні оцінки безпеки та ефективності озельтамівіру в цій віковій групі ведуться в даний час.
Коментар робочої групи: станом на грудень 2013 року занамівір дозволений для використання в Україні з 5 років.
Віруси грипу А і B є чутливими до рибавірину in vitro. Аерозольний рибавірин був використаний для лікування грипу, хоча дані в людей обмежені, й аерозольний рибавірин може розглядатися для тяжкохворих пацієнтів, які не можуть отримати ліки перорально або за допомогою дискхалера [135–139]. Пероральний рибавірин також був ефективним при неускладнених захворюваннях, хоча необхідні більш високі дозування [140]. Внутрішньовенний рибавірин, хоча і перебуває на стадії дослідження, також може мати клінічне застосування у випадках тяжких хвороб, особливо в поєднанні з іншими противірусними агентами [141–143].
Дані про користь лікування інгібіторами нейрамінідази в дорослих
У метааналізі рандомізованих контрольованих випробувань раннє лікування неускладненого грипу у здорових в іншому відношенні дорослих інгібіторами нейрамінідази скоротило як ускладнення (СШ залежно від лікування 0,43), так і титри вірусу грипу у зразках зі слизової носа впродовж 24 год [144]. Озельтамівір значно знижує показник госпіталізацій (з усіх причин) протягом 30 днів, що було показано в одному узагальненому аналізі рандомізованих контрольованих випробувань, що включали дорослих і підлітків, які були або раніше здорові, або з високим ризиком розвитку ускладнень на рівні 1,7–0,7 % (відносне зниження 59 %) загалом [145]. Ретроспективний аналіз претензій виявив значне зниження випадків госпіталізації (1,3 проти 0,9 %), коли озельтамівір був використаний для лікування грипоподібних захворювань [146]. Ретроспективний огляд графіків визначив скорочену тривалість перебування в стаціонарі серед госпіталізованих літніх пацієнтів і грипом при лікуванні протягом 48 год після появи симптомів [147].
Результати рандомізованих досліджень, що включали лише осіб, яких лікували протягом 48 год після появи симптомів, показали, що інгібітори нейрамінідази зменшують тривалість симптомів неускладненого грипу на ~ 1 день серед амбулаторних хворих. Лікування також скорочує час полегшення симптомів грипу (зниження ризику для аналізу залежно від лікування) і час, щоб повернутися до нормальної діяльності (зниження ризику для аналізу залежно від лікування) [148]. В одному метааналізі було показано, що використання симптоматичних препаратів та антибіотиків не було зменшене в лікованих пацієнтів [148]. На противагу цьому сукупний аналіз рандомізованих контрольованих випробувань занамівіру й озельтамівіру різними дослідниками виявив значне абсолютне скорочення використання антибіотиків на 5 % для кожного (18 проти 13 % [149], 10 проти 5 % для частоти пов’язаних із грипом ускладнень нижніх дихальних шляхів у результаті застосування антибіотиків [145]). Інший сукупний аналіз ефективності застосування занамівіру виявив значне 9 % (тобто 25 проти 16 %) зниження темпів ускладнень від застосування антибіотиків серед осіб із груп високого ризику [150]. Ретроспективний аналіз претензій виявив значне зниження використання антибіотиків на 2,4 % (19,4 проти 17 %), пов’язане з використанням озельтамівіру [146]. Інші спостережні дослідження показали, що застосування озельтамівіру пов’язане зі скороченням госпіталізацій і меншою частотою ускладнень нижніх дихальних шляхів в окремих групах високого ризику з грипом, у тому числі мешканців будинків для людей літнього віку, хворих на лейкоз і реципієнтів гемопоетичних стовбурових клітин [151–154]. Ретроспективний аналіз із використанням великих баз даних страхування осіб із клінічним діагнозом «грип» повідомив про скорочення госпіталізацій серед амбулаторних хворих віком від 1 року з грипоподібним захворюванням, які лікувалися озельтамівіром (26 %, 95% ДІ 10–39 %) [146], менше госпіталізацій серед раніше здорових осіб віком від 13 років, які лікувалися не довше 1 дня (22 %; 95% ДІ 9–33 %) [155], і менше госпіталізацій з усіх причин серед хворих на цукровий діабет віком понад 18 років, які знаходилися на лікуванні не довше 1 дня (30 %; 95% ДІ 6–48 %) [156].
Дослідження серед осіб із високими ризиками є більш обмеженими в розмірах. В об’єднаному аналізі рандомізованих контрольованих випробувань по озельтамівіру, що згадувалися вище, озельтамівір був пов’язаний зі значним зниженням темпів госпіталізації з грипом з 3,2 до 1,6 % (відносне зниження — 0 %) в осіб із високими ризиками. В об’єднаному аналізі серед осіб із високим ризиком використання занамівіру було пов’язано зі значно скорішим поверненням до діяльності за 3 дні і зниженням частоти використання антибіотиків на 9 % [150]. У метааналізі досліджень за участю осіб із високим ризиком занамівір (але не озельтамівір) був асоційований зі скороченням часу полегшення симптомів [157]. Обсерваційне дослідження продемонструвало поліпшення результатів у пацієнтів із лейкозом, які проходили лікування грипу [152].
Важливо відзначити, що всі рандомізовані дослідження, проведені до теперішнього часу, включали лише пацієнтів, які отримували лікування протягом 48 год після появи симптомів. У більшості осіб грип є самообмежувальною хворобою. Для здорових в іншому відношенні дорослих амбулаторних пацієнтів вірусні титри вже зменшуються через 48 год після початку захворювання [158–160]. Як і очікувалося, у таких хворих переваги противірусних препаратів найбільші, якщо їх призначати якомога раніше [161, 162]. У проспективному відкритому дослідженні терапії озельтамівіром, розпочатої протягом 48 год після появи симптомів, лікування, що розпочалося не пізніше ніж через 6 год після появи симптомів, скоротило тривалість симптомів на 3,1 дня порівняно з початком терапії пізніше 36 год після початку хвороби [161]. Таким чином, для здорових в іншому відношенні дорослих пацієнтів, які не є тяжко хворими, початок лікування пізніше 48 год після початку хвороби може мати мало користі.
У даний час є мало даних, щоб оцінити, чи є користь у разі початку лікування пацієнтів із тяжкою хворобою, у тому числі тих, хто вимагає госпіталізації з приводу грипу або його ускладнень пізніше 48 год після появи симптомів. Жодне проспективне адекватно контрольоване клінічне випробування за участю пацієнтів, хворих на тяжку форму грипу, або за участю тих, хто має документальне підтвердження, що виділяє вірус грипу пізніше 48 год після появи симптомів, не було завершено. Одне когортне дослідження серед госпіталізованих дорослих із грипом повідомило, що лікування озельтамівіром, включаючи початок лікування осіб пізніше 48 год після початку хвороби, призвело до значного зниження смертності протягом 15 днів після початку хвороби [163]. Слід зазначити, що майже 90 % пацієнтів, які лікувалися озельтамівіром, мали позитивні результати експрес-тестів на антигени. Лікування озельтамівіром, навіть із затримкою, було пов’язане з поліпшенням виживаності у хворих на грип A (H5N1), багато з яких мали вірусну пневмонію [8]. Профілі вартості й безпеки озельтамівіру досить сприятливі, так що багато експертів рекомендують, щоб пацієнти, які потребують госпіталізації з приводу грипу, регулярно отримували терапію противірусними препаратами [163].
Дані про користь лікування інгібіторами нейрамінідази у дітей
Озельтамівір досліджували у здорових дітей віком від 1 до 12 років із неускладненим грипом у проспективному рандомізованому подвійному сліпому плацебо-контрольованому дослідженні, у якому відповідно до критеріїв включення було обов’язковим, щоб діти мали симптоми грипу впродовж 48 год [164]. П’ятиденний курс лікування озельтамівіром порівняно з плацебо був пов’язаний зі зменшенням медіани часу до регресії клінічної картини хвороби до 36 год. Значне зниження виділення вірусу було також відзначене у дітей, які отримували лікування, з майже повною регресією виділення вірусу протягом 4 днів для дітей, які отримували лікування, порівняно з 6 днями для контрольної групи дітей. Ускладнення грипу також були скорочені у групі озельтамівіру; захворюваність діагностованого лікарем гострого середнього отиту (ГСО) була скорочена на 44 % порівняно з частотою серед пацієнтів, які отримували плацебо.
У дослідженнях дітей віком від 6 до 12 років з астмою, які отримували озельтамівір або плацебо при неускладненій грипозній інфекції, значне поліпшення функції легень було відзначено на 6-й день після лікування, хоча жодної різниці в медіані часу до регресії хвороби виявлено не було [165]. Один ретроспективний огляд використання медичних послуг дітьми, яким було виставлено клінічний діагноз грипу, повідомив, що діти віком від 1 до 12 років, яким був призначений озельтамівір протягом 24 годин після встановлення діагнозу, зазнали 52% зниження частоти наступних звернень із клінічно діагностованою пневмонією порівняно з дітьми, що не отримували лікування (відносний ризик 0,483, 95% ДІ 0,326–0,717). Окрім того, спостерігалося також значне скорочення використання антибіотиків в амбулаторних відділеннях і відділеннях невідкладної допомоги [166].
Рандомізоване подвійне сліпе проспективне дослідження інгаляційного занамівіру, який вводився двічі на день протягом 5 днів дітям віком від 4 до 12 років, показало, що тривалість симптомів хвороби була знижена на 1,25 дня в інфікованих грипом дітей, які отримували занамівір, порівняно з плацебо [167]. У 3 дослідженнях осіб віком старше 12 років лікування занамівіром зменшило тривалість симптомів на 1–2,5 дня у грип-позитивних хворих [168–170]. У багатоцентровому проспективному дослідженні суб’єктів, терапія яких була розпочата протягом 30 год після появи симптомів, регресія основних симптомів відбулася на 3 дні раніше в групі лікування порівняно з контрольною групою [162]. Одне нерандомізоване відкрите дослідження занамівіру порівняно з озельтамівіром не виявило різниці в часі щодо скорочення гарячкового періоду в дитячих амбулаторних відділеннях у пацієнтів, інфікованих грипом A (H1N1), грипом A (H3N2) або грипом B [171]. У госпіталізованих дітей лікування озельтамівіром або занамівіром значно знизило тривалість гарячки порівняно з плацебо у дітей, інфікованих циркулюючими вірусами A (H3N2) і B, причому зменшення було аналогічним для противірусних препаратів. Хоча використання ні озельтамівіру, ні занамівіру не зменшило тривалість існування позитивної культури при циркулюючих вірусах А (H3N2) у цьому дослідженні, занамівір зменшив тривалість виділення вірусу В порівняно з відсутністю лікування [91].
Одне дослідження порівнювало занамівір і озельтамівір і не виявило жодної різниці між двома препаратами стосовно часу до скорочення гарячкового періоду в дитячих амбулаторних відділеннях у хворих на грип A (H3N2) або В [171].
Стійкість до противірусних препаратів
Значно поширені високі рівні стійкості до амантадину і римантадину вірусів грипу A (H3N2) й обмежена стійкість грипу A (H1N1) були засвідчені з 2006 року [115–117]. Для лікування або хіміопрофілактики зараження вірусом грипу A (H3N2) повинні використовуватися тільки інгібітори нейрамінідази. Стійкість до інгібіторів нейрамінідази виникає через однокрокові мутації, й ізоляція стійкого до озельтамівіру вірусу була відмічена під час і після лікування, особливо у дітей [164, 172, 173]. У пацієнтів з ослабленим імунітетом поява стійких штамів була пов’язана з відсутністю вірусологічної відповіді і прогресуючим захворюванням [174, 175]. Виявлення стійких до озельтамівіру вірусів грипу А або B серед циркулюючих ізолятів громад раніше були рідкістю, навіть у таких країнах, як Японія, де є високий рівень використання озельтамівіру [121, 176]. Проте починаючи з 2007–2008 років стійкі до озельтамівіру штами грипу A (H1N1), пов’язані з певною мутацією в гені H274Y нейрамінідази, були зареєстровані в багатьох країнах [122–131]. Циркуляція цих резистентних варіантів не була пов’язана з використанням озельтамівіру, а пов’язані інфекції мали клінічні особливості та результати, аналогічні інфекціям, викликаним чутливим до озельтамівіру вірусом грипу А (H1N1). Проте прогресивна вірусна реплікація і летальний результат, незважаючи на отримання озельтамівіру, були зареєстровані в пацієнтів, інфікованих стійким вірусом грипу А (H1N1) [177]. Ці штами зберегли чутливість до занамівіру та адамантану. Поточну й оновлену інформацію щодо стійкості до противірусних препаратів та рекомендації щодо противірусних препаратів можна знайти на веб-сайті «CDC’s influenza» (http://www.cdc.gov/flu).
Побічні реакції
В одному метааналізі противірусного лікування грипу в дорослих зазначається, що інгібітори нейрамінідази не були пов’язані з будь-якими значними побічними реакціями [148]. Нудота та блювання є найбільш поширеними побічними реакціями лікування озельтамівіром і були зареєстровані в 9–10 % дорослих, які отримували лікування [178]. У дітей побічні реакції після введення озельтамівіру також переважно були шлунково-кишковими, причому 14 % дітей, які приймали озельтамівір, повідомили про блювоту порівняно з 8 % заражених грипом дітей, які приймали плацебо [164]. У Японії психоневрологічні побічні реакції були зареєстровані в ~ 1 на 100 000 призначень озельтамівіру, в основному у підлітків [179]. Поки не ясно, чи були ці події пов’язані з озельтамівіром, грипом або певною комбінацією, яка може включати в себе генетичну схильність до цих побічних реакцій. Зовсім недавно японське дослідження, котре не було опубліковане, оцінило використання озельтамівіру в 10 000 чоловік віком молодше 18 років і не виявило жодних доказів психоневрологічних побічних реакцій у цій групі населення [180]. Психоневрологічні побічні реакції час від часу відмічалися у дорослих, які приймали озельтамівір [181]. Вкладиші для озельтамівіру й занамівір у США містять попередження про потенційні несприятливі психоневрологічні побічні реакції [178, 182].
В 11 % пацієнтів, які отримували занамівір, не було зареєстровано жодних побічних реакцій [162, 183, 184]. Проте занамівір є пероральним інгаляційним порошком і є повідомлення про випадки бронхоспазму, пов’язані з лікуванням занамівіром [185]. Через стурбованість стосовно бронхоспазмів і зниження легеневої функції після інгаляції занамівіру у дітей та дорослих пацієнтів із супутнім захворюванням дихальних шляхів, у тому числі астмою та хронічним обструктивним захворюванням легень, занамівір цим особам не призначається [182]. Одне проспективне рандомізоване дослідження пацієнтів з грипом, які мали астму (від легкого до помірного ступеня) або хронічне обструктивне захворювання легень, не виявило жодних відмінностей у побічних реакціях або спірометричних вимірюваннях між занамівіром і плацебо; у пацієнтів, які отримували занамівір, скоротився час боротьби з хворобою і пришвидшилося поліпшення самостійно перевірених значень максимальної швидкості видиху [186].
Коментар робочої групи: передбачувані побічні реакції на інгібітори нейрамінідази (відповідно до п’ятого випуску Державного формуляру лікарських засобів):
озельтамівір: нудота і блювання, бронхіт, безсоння, запаморочення, слабкість, головний біль, носові кровотечі, кон’юнктивіт, біль у животі, діарея, диспепсія, кашель, ринорея, пневмонія, синусит, середній отит, лімфаденопатія, порушення слуху, дерматит, порушення зору;
занамівір: набряк ротоглотки та обличчя, бронхоспазм, утруднене дихання, висипання і кропив’янка, поліморфна еритема, синдром Стівенса — Джонсона, токсичний епідермальний некроліз, судоми, психічні розлади, пригнічення свідомості, ненормальна поведінка, галюцинації, делірій.
У дорослих та дітей із грипом можуть розвинутися потенційно серйозні ускладнення, пов’язані з бактеріальними коінфекціями. Особливу увагу слід звернути на можливість пов’язаних із грипом ускладнень в уразливих групах населення, які зазвичай проживають у спеціалізованих закладах. Осіб із високим ризиком розвитку таких ускладнень (див. табл. 5) слід ретельно перевірити на вторинну бактеріальну пневмонію — поширену причину смерті в цій групі населення. Медичні співробітники також повинні бути поінформовані про значне збільшення коінфекції золотистого стафілокока (у першу чергу метицилінрезистентна коінфекція золотистого стафілокока) серед дітей із тяжким або смертельним грипом у США [45, 52, 54, 55]. Противірусне лікування може бути недостатнім для лікування тяжкохворих пацієнтів з ускладненнями грипу, тому відповідне лікування антибіотиками має здійснюватися згідно з результатами мікробіологічних досліджень і науково обґрунтованих рекомендацій, якщо є докази або підозри щодо серйозної бактеріальної інфекції в госпіталізованих пацієнтів [187]. Коли пацієнти лікуються від грипу, лікарі повинні бути готові до можливості того, що тривалі симптоми або погіршення можуть свідчити про бактеріальну інфекцію, і повинні консультувати своїх пацієнтів належним чином.
Застосування інших лікарських засобів
WHO Guidelines for Pharmacological Management of Pandemic Influenza A (H1N1) 2009 and other Influenza Viruses (February 2010)
Рекомендація 17. Пацієнтам, які мають тяжку або прогресуючу хворобу, включаючи вірусні пневмонії, дихальну недостатність і РДСД через грип, не слід призначати системні кортикостероїди, якщо їх не призначено за іншими показаннями або лише в якості частини затвердженого протоколу дослідження (сильна рекомендація, низька якість доказів).
Рекомендація 18. У дітей і підлітків (молодше 18 років) з підтвердженою або підозрюваною інфекцією вірусу грипу не слід розпочинати лікування препаратами, що містять саліцилову кислоту (наприклад, ацетилсаліцилова кислота) (сильна рекомендація, нормативне попередження).
ВООЗ Клінічні методи ведення хворих, які інфіковані новим вірусом грипу A (H1N1): попередня настанова (21 травня 2009 року)
Киснева терапія
Під час прийому чи сортування та на регулярній основі під час подальшого лікування госпіталізованих пацієнтів необхідно, якщо можливо, контролювати ступінь насичення крові пацієнтів киснем за допомогою пульсоксиметра. З метою усунення гіпоксемії має проводитись додаткове насичення киснем. При пневмонії ВООЗ рекомендує використовувати кисневу терапію для підтримки рівня насичення киснем понад 90 %, але в деяких клінічних ситуаціях ця межа може сягати 92–95 %, наприклад, протягом вагітності. У випадку груп населення, які мешкають на висоті, необхідно застосовувати інші критерії діагностики гіпоксемії, але у випадку пневмонії чи гострого респіраторного дистрес-синдрому вони будуть також більшою мірою чутливими до тяжкої гіпоксемії.
Пацієнтам із тяжкою гіпоксемією необхідний значний потік кисню (близько 10 л/хв), що подається через маску. Деякі пацієнти, які мають утруднення з дотриманням цього призначення (наприклад, діти), можуть потребувати більш прицільної уваги з боку молодшого медперсоналу та членів родини. У тому випадку, якщо централізована система подачі кисню відсутня, необхідно передбачити наявність кисневих подушок. ВООЗ внесла кисень у свій Перелік основних лікарських засобів у 1979 році, але в деяких країнах наявність кисню поки що всюди не забезпечена. Якщо немає медичного кисню, можна використовувати промисловий кисень. Кисневу терапію слід проводити згідно з настановами.
Антибіотикотерапія
Хіміопрофілактика за допомогою антибіотиків неприпустима. Лікування пневмонії антибіотиками повинно проводитись, як правило, з дотриманням рекомендацій, що містяться в опублікованих настановах, розроблених на фактичних даних для лікування позалікарняних пневмоній. Але сезонний грип асоціюється з підвищеним ризиком вторинних інфекцій, що викликані Staphylococcus aureus, котрі можуть мати тяжкий перебіг, швидкопрогресуючий характер, призводити до некрозу та в деяких районах викликатися штамами, стійкими до метициліну. У разі використання антибіотиків при підозрі на супутню бактеріальну інфекцію пацієнтів у поєднанні з новою вірусною інфекцією грипу А (H1N1) необхідно за можливості дотримуватися мікробіологічних досліджень. У деяких пацієнтів у Мексиці розвивалась вентиляційно-асоційована пневмонія чи госпітальна пневмонія, викликана типовими нозокоміальними патогенами.
Кортикостероїди
Застосування кортикостероїдів, як правило, для лікування пацієнтів, інфікованих вірусом грипу А (H1N1), не допускається. Застосування кортикостероїдів у малих дозах можливо розглядати у випадку пацієнтів із септичним шоком, які потребують судинозвужуючих препаратів та з підозрою на наднирникову недостатність. У випадку інфікування вірусом грипу тривалий прийом кортикостероїдів або прийом у великих дозах може призвести до серйозних негативних наслідків, включаючи опортуністичну інфекцію та можливу реплікацію вірусу протягом тривалого часу.
Попередня допоміжна штучна вентиляція легень
Лікування гострого респіраторного дистрес-синдрому, асоційованого з новим вірусом грипу А (H1N1), має відповідати опублікованим настановам, розробленим на підставі фактичних даних, для випадків гострого респіраторного дистрес-синдрому, що став наслідком сепсису. Потрібно використовувати методи механічно захищеної вентиляції легень.
Коментар робочої групи: клас респіраторів N95 — стандарт США; клас респіраторів FFP2 — європейський стандарт.
Seasonal Influenza in Adults and Children — Diagnosis, Treatment, Chemoprophylaxis, and Institutional Outbreak Management: Clinical Practice Guidelines of the Infectious Diseases Society of America (2009)
Противірусні лікарські засоби для хіміопрофілактики
Кому слід призначати противірусну хіміопрофілактику для запобігання грипу?
Рекомендація 17. Щеплення проти грипу є основним інструментом для запобігання захворюванню на грип, і противірусна хіміопрофілактика не є заміною щепленню проти грипу. Коли віруси грипу циркулюють у громаді, хіміопрофілактику можна призначати особам із високим ступенем ризику протягом 2 тижнів після щеплення, перш ніж виробиться адекватна імунна відповідь на інактивовану вакцину (6 тижнів для дітей, які не були раніше вакциновані і які потребують 2 дози вакцини) (A I).
Рекомендація 18. Противірусну хіміопрофілактику слід розглядати для дорослих і дітей віком від 1 року, які мають високий ризик розвитку ускладнень грипу, для яких щеплення проти грипу протипоказане, недоступне або матиме низьку ефективність (наприклад, особи зі значно ослабленим імунітетом) (B II). Протипоказання до щеплення включають анафілактичну гіперчутливість на яйця або інші компоненти вакцини, гарячкові захворювання — від помірних до тяжких і, як застереження, синдром Гієна — Барре в анамнезі протягом 6 тижнів після отримання попереднього щеплення проти грипу [5].
Рекомендація 19. Противірусну хіміопрофілактику (у поєднанні зі швидким введенням інактивованої вакцини) слід розглядати для дорослих і дітей віком від 1 року, які мають високий ризик розвитку ускладнень від грипу (див. табл. 5) і ще не отримали вакцини проти грипу, коли активність грипу вже виявлена у громаді. Щоразу, коли можливо, повинна бути введена вакцина проти грипу, і щеплення рекомендованим особам повинно тривати до припинення поширення вірусу грипу у громаді (B II).
Рекомендація 20. Противірусну хіміопрофілактику можна розглядати для нещеплених дорослих, у тому числі медичних працівників, та для дітей віком від 1 року, які знаходяться в тісному контакті з особами з високим ризиком розвитку ускладнень грипу в періоди активності грипу. Щоразу, коли можливо, повинна бути введена вакцина проти грипу; через 2 тижні після введення хіміопрофілактика може бути припинена (6 тижнів для дітей, які не були раніше щеплені і які потребують 2 дози вакцини) (B III).
Рекомендація 21. Противірусна хіміопрофілактика рекомендується для всіх мешканців (щеплених і нещеплених) у закладах, таких як будинки престарілих та заклади тривалого догляду, в яких виникають спалахи грипу (A I).
Рекомендація 22. Найбільшу увагу стосовно використання противірусної хіміопрофілактики слід приділяти особам із найвищим ризиком пов’язаних з грипом ускладнень. Ризик пов’язаних із грипом ускладнень не ідентичний серед усіх осіб із високим ризиком, і противірусна хіміопрофілактика, ймовірно, буде найефективнішою серед групи пацієнтів із найбільшим ризиком ускладнень від грипу та смерті, таких як реципієнти гемопоетичних стовбурових клітин (B III).
Рекомендація 23. Противірусну хіміопрофілактику слід розглядати для осіб із високим ризиком розвитку ускладнень від грипу, якщо вакцина проти грипу недоступна через недостатню кількість. Якщо вакцина доступна, для цих осіб має здійснюватися щеплення (A I).
Рекомендація 24. Противірусну хіміопрофілактику можна розглядати для осіб із високим ризиком розвитку ускладнень грипу (див. табл. 5) у ситуаціях, коли існує документальне підтвердження низької клінічної ефективності вакцини проти грипу у зв’язку з циркуляцією штамів вірусів грипу, які антигенно відрізняються від штамів вакцини, так що очікується істотне збільшення невдач щеплення, як визначається федеральними, державними і місцевими органами охорони здоров’я (C II).
WHO Guidelines for Pharmacological Management of Pandemic Influenza A (H1N1) 2009 and other Influenza Viruses (February 2010)
Рекомендація 4. Коли людина з вірусом грипу звертається до служби невідкладної допомоги, пацієнтам з тяжкою імуносупресією слід запропонувати хіміопрофілактику озельтамівіром або занамівіром (сильна рекомендація, дуже низька якість доказів).
Рекомендація 11. Якщо особи з високим ризиком розвитку ускладнень грипу контактували з пацієнтом із грипом, розгляньте пробне лікування озельтамівіром або занамівіром (сильна рекомендація, дуже низька якість доказів).
В інших ситуаціях, коли ризик інфікування є причиною для занепокоєння, медичним працівникам рекомендується вести моніторинг пацієнтів із високим ризиком, які контактували з пацієнтом із грипом, на предмет ранніх ознак і симптомів гострої респіраторної інфекції і грипоподібних захворювань (див. розділ 2. Опис випадків) і почати противірусне лікування якомога швидше, як описано в рекомендаціях 5 і 8.
Коментар робочої групи: розділ 2 (Опис випадків) представлений в оригінальному документі WHO Guidelines for Pharmacological Management of Pandemic Influenza A (H1N1) 2009 and other Influenza Viruses (February 2010).
Seasonal Influenza in Adults and Children — Diagnosis, Treatment, Chemoprophylaxis, and Institutional Outbreak Management: Clinical Practice Guidelines of the Infectious Diseases Society of America (2009)
Коли слід розпочинати противірусну хіміопрофілактику?
Рекомендація 25. В осіб із високим ризиком розвитку ускладнень, які не захищені належним чином у результаті поганої імунної відповіді (наприклад, особи зі значно ослабленим імунітетом), відсутності вакцини проти грипу або неефективної вакцини (наприклад, при антигенно відмінних циркулюючих штамах), противірусну хіміопрофілактику слід проводити з початком стійкої активності грипу в громаді, визначеної місцевими органами охорони здоров’я (B II).
Рекомендація 26. Застосування противірусних препаратів для хіміопрофілактики відповідних осіб у домашніх умовах слід розпочати, коли один член сім’ї має підозру на грип або підтверджений грип і будь-який інший член сім’ї має високий ризик розвитку ускладнень у результаті інфекції, у тому числі діти віком до 6 місяців (див. табл. 5). У цих умовах усі неінфіковані члени сім’ї повинні проходити противірусну хіміопрофілактику. В ідеалі в таких умовах всі придатні члени сім’ї повинні бути щеплені, що робить непотрібною хіміопрофілактику (A I).
Рекомендація 27. Противірусну хіміопрофілактику та інші заходи контролю слід розпочати в спеціалізованих закладах, таких як лікарні і медичні заклади довготривалої допомоги (наприклад, будинки престарілих), коли виявлені спалахи грипу або коли є вагомі підстави для підозри на грип, але етіологія спалаху досі не визначена (A II).
Як довго повинна тривати хіміопрофілактика?
Рекомендація 28. Якщо вводиться інактивована грипозна вакцина, противірусна хіміопрофілактика в принципі може бути припинена через 2 тижні після щеплення осіб у неінституціональних закладах. Діти віком до 9 років, які отримують інактивовану грипозну вакцину в перший раз, потребують 2 доз вакцини, причому друга доза вводиться принаймні через 4 тижні після першої дози; пік імунної відповіді виникає через 2 тижні після отримання другої дози. Таким чином, необхідно мінімум 6 тижнів хіміопрофілактики (тобто хіміопрофілактика протягом принаймні 4 тижні після першої дози вакцини та додатково 2 тижні хіміопрофілактики після другої дози) залежно від тривалості затримки до прийому другої дози вакцини (B II).
Рекомендація 29. Коли противірусна хіміопрофілактика здійснюється в домашніх умовах після постановки діагнозу грипу в одного члена сім’ї, хіміопрофілактику слід продовжувати протягом 10 днів (A I).
Рекомендація 30. В осіб із високим ризиком розвитку ускладнень грипу, для яких щеплення проти грипу протипоказане, недоступне або матиме низьку ефективність (наприклад, особи зі значно ослабленим імунітетом), хіміопрофілактику слід продовжувати протягом усього терміну циркуляції вірусу грипу в громаді під час сезону грипу (B III).
Які противірусні препарати слід застосовувати для хіміопрофілактики?
Рекомендація 31. Віруси грипу та їх чутливість до наявних противірусних препаратів стрімко розвиваються. Клініцисти повинні бути обізнаними в місцевих моделях циркуляції грипу у своїх громадах протягом усього сезону грипу. Поточну й оновлену інформацію про стійкість до противірусних препаратів та рекомендації щодо противірусних препаратів можна знайти на веб-сайті «CDC’s influenza» (http://www.cdc.gov/flu). На основі даних по чутливості до противірусних препаратів станом на березень 2009 року, для хіміопрофілактики грипу A (H1N1) слід використовувати або занамівір, або адамантан (переважно римантадин через його більш сприятливі побічні реакції); озельтамівір не слід використовувати для хіміопрофілактики грипу А (H1N1). Озельтамівір або занамівір повинні використовуватися для хіміопрофілактики грипу A (H3N2); адамантан не повинен використовуватися для хіміопрофілактики грипу A (H3N2). Якщо інформація про підтип недоступна, для хіміопрофілактики грипу А слід використовувати або занамівір, або комбінацію озельтамівіру і римантадину. Для хіміопрофілактики грипу B слід використовувати лише озельтамівір або занамівір. Табл. 2 містить детальну інформацію про противірусні препарати у відповідних вікових групах (A I).
Резюме доказів
Інгібітори нейрамінідази (занамівір і озельтамівір) і адамантани (амантадин і римантадин) були ретельно оцінені і продемонстрували свою ефективність у запобіганні грипу при використанні для профілактики в домашніх умовах, будинках для літніх людей та медичних закладах для літніх людей із постійним медичним наглядом [188, 189]. Ефективність була продемонстрована як для профілактики протягом усього сезону грипу, так і для профілактики після контакту. Проте корисність амантадину й римантадину обмежена високою поширеністю резистентності до цих агентів серед циркулюючих штамів грипу А — особливо H3N2 і, рідше, H1N1 [116, 117], а також внутрішньою відсутністю активності відносно грипу B. Більше того, коли амантадин або римантадин використовувалися для лікування поодиноких випадків у сім’ях, не було жодної профілактичної ефективності через швидке виникнення і передачу резистентного вірусу [190]. Адамантани можуть розглядатися для профілактичного застосування, тільки якщо є підозра на резистентний до озельтамівіру вірус грипу А (H1N1). Коли занамівір вводили протягом 10–14 днів здоровим дорослим і дітям після побутового впливу, ефективність у запобіганні лабораторно підтвердженого грипу становила 79–81 % незалежно від супутнього лікування, наданого хворим [191, 192]. Ефективність профілактики з озельтамівіром після контакту становила 68–89 % серед членів сімей, які зазнали впливу грипу [193, 194].
На сьогодні розвиток резистентності до інгібіторів нейрамінідази в імунокомпетентних осіб, які використовують озельтамівір для профілактики, не спостерігається [192, 193]. Резистентність може розвиватися при лікуванні будь-якими препаратами проти вірусу грипу, й майбутні тенденції у стійкості повинні бути взяті до уваги. Спалах грипозної інфекції серед осіб, які отримували профілактику озельтамівіром більше ніж 72 год, повинен спонукати до обговорення з місцевим відділом охорони здоров’я можливості стійкості до інгібіторів нейрамінідази. На сьогодні більшість клінічних ізолятів стійкого до озельтамівіру грипу A (H1N1) залишилися повністю чутливими до занамівіру й адамантану [129]. Вибір противірусного препарату повинен визначатися за віковими групами, місцевими даними противірусної стійкості, а також доцільності прийому пероральним (озельтамівір) або інгаляційним (занамівір) шляхом. Поточну й оновлену інформацію щодо стійкості до противірусних препаратів та рекомендації щодо противірусних препаратів можна знайти на веб-сайті «CDC’s influenza» (http://www.cdc.gov/flu).
Кілька досліджень показали ефективність противірусної хіміопрофілактики в будинках для інвалідів як протягом сезону грипу, так і для боротьби зі спалахами інфекції [94, 195]. Одна дослідницька група вводила озельтамівір літнім людям у закладах тривалого догляду протягом усього сезону грипу і продемонструвала 92-відсоткову ефективність і зниження ускладнень [196]. Інші дослідники повідомили про здійснення профілактики для всіх жителів у 8 будинках для інвалідів зі спалахами грипу в Онтаріо (Канада) [151]; спалахи були швидко взяті під контроль у всіх закладах. Інше дослідження повідомило про подібний досвід під час спалахів серед інтенсивно щеплених мешканців будинків для інвалідів у штаті Мічиган [197]. Одне порівняльне дослідження показало значно вищий захист серед мешканців будинку для інвалідів, які отримували занамівір у формі інгаляцій, ніж серед тих, хто отримував римантадин внутрішньо, частково через появу стійкості до адамантанів [198]. Грип пов’язаний з високими показниками смертності серед пацієнтів після трансплантації гемопоетичних стовбурових клітин [199]. Жодних проспективних досліджень хіміопрофілактики не проводилося в цій групі населення, але ретроспективне дослідження «випадок — контроль» показало, що хіміопрофілактика озельтамівіром була пов’язана з оперативним управлінням спалахом грипу серед реципієнтів гемопоетичних стовбурових клітин [200].
Всі особи з високим ризиком розвитку ускладнень грипу, а також особи, які були в тісному контакті з ними, повинні отримувати щорічне щеплення проти грипу. Якщо віруси грипу циркулюють у громаді, можна розглядати хіміопрофілактику протягом 2 тижнів після щеплення, перш ніж розвинеться адекватна імунна відповідь на інактивовану вакцину (принаймні 6 тижнів для дітей, які не були раніше щеплені і які потребують 2 дози вакцини, враховуючи щонайменше 4 тижні перерви і даючи можливості для адекватної імунної відповіді через 2 тижні після введення другої дози). Особам, які отримують противірусну хіміопрофілактику, слід давати тільки інактивовану грипозну вакцину, тому що противірусні препарати можуть знижувати ефективність живих ослаблених вакцин проти грипу. Титри антитіл до грипу в цілому зростають до захисних рівнів, і ефективність проти підтвердженого грипу може бути виявлена протягом 2 тижнів після щеплення. Нижча імуногенність та ефективність вакцин проти грипу були продемонстровані в літнього населення [201, 202]. В осіб із ВІЛ-інфекцією вакцини проти грипу проявляють імуногенність та ефективність, як було визначено на основі обмежених випробувань. Тим не менше нижча імуногенність та ефективність були продемонстровані серед осіб із кількістю CD4-клітин < 200 клітин/мл [203–205]. Інші особи, у яких щеплення проти грипу може мати низьку ефективність, включають осіб з імунодефіцитами, викликаними препаратами для запобігання відторгнення трансплантата, та осіб із тяжким уродженим імунодефіцитом (наприклад, гіпогаммаглобулінемія, тяжкий комбінований імунодефіцит, синдром Ді Джорджі і загальноваріабельний імунодефіцит).
Управління спалахами інфекції в закладах
У якому випадку слід запідозрити спалах грипу у закладі закритого типу?
Рекомендація 32. Під час сезону грипу, коли двоє мешканців закладу закритого типу проявляють ознаки і симптоми грипоподібних захворювань у проміжку 72 години один від одного, необхідно провести тестування на грип. Коли віруси грипу циркулюють у громаді, навіть один позитивний лабораторний результат у поєднанні з іншими супутніми хворобами в закладі показує, що існує спалах грипу (A II).
Резюме доказів
Заклади закритого типу — це заклади для догляду за особами, які піддаються підвищеному ризику розвитку пов’язаних із грипом ускладнень, і в яких віруси грипу можуть більш легко передаватися між людьми. Заклади можуть включати лікарні, заклади довготривалого догляду для дорослих і дітей, в’язниці та інші подібні місця скупчення людей. Співробітники в таких закладах повинні зберігати пильність щодо випадків респіраторних інфекцій цілий рік, і має бути збережений тісний зв’язок з місцевими та державними департаментами охорони здоров’я щодо термінів та місцевих особливостей циркуляції грипу та інших респіраторних патогенів, таких як респіраторно-синцитіальний вірус і вірус парагрипу [206–208].
Враховуючи високий показник спалахів грипу в закладах [209], під час сезону грипу доцільно розглядати кожен випадок лабораторно підтвердженої хвороби в контексті 2 випадків грипоподібних захворювань, що виникають протягом 72 годин, як спалах в інституційному середовищі, що призводить до швидкого здійснення заходів контролю, у тому числі щеплення й використання противірусних препаратів [94, 195, 210–213]. Через більш низьку чутливість експрес-тестів на грип негативні результати таких тестів повинні спонукати до подальшого тестування шляхом ЗТ-ПЛР та/або вірусної культури, щоб підтвердити, що спалах виник не через грип. Для групи грипоподібних захворювань, що виникають, коли віруси грипу циркулюють у громаді, в очікуванні лабораторного підтвердження діагнозу слід використовувати низький поріг (2 випадки грипоподібних захворювань, що виникають протягом 72 годин) для започаткування заходів у боротьбі зі спалахом у закладах. У періоди, коли віруси грипу не циркулюють у громаді, менш імовірно, що випадки грипоподібних захворювань являють собою інфекції з вірусами грипу, тому використання вакцин та антивірусної хіміопрофілактики може бути відкладене до остаточного отримання діагнозу з лабораторії. Тим не менше в таких контекстах інші заходи інфекційного контролю, такі як ізоляція і групування (сортування) хворих мешканців, обмеження для хворого персоналу і відвідувачів, скринінг хворих членів персоналу та активне спостереження за новими випадками, мають бути реалізовані і можуть допомогти контролювати спалахи, поки очікуються підтвердження етіології [5, 213, 214].
Яка роль тестування мешканців закладів закритого типу з грипоподібним захворюванням після того, як діагноз грипу вже було встановлено в одного мешканця?
Рекомендація 33. Після виявлення одного лабораторно підтвердженого випадку грипу серед мешканців закладу цілком імовірно, що подальші випадки тимчасово пов’язаних грипоподібних захворювань також можуть бути викликані вірусом грипу, хоча можуть також виникнути змішані захворювання, викликані іншими патогенними мікроорганізмами. Хоча може бути таке, що неможливо отримати зразки від усіх хворих мешканців для тестування на грип в умовах спалаху, особи із подібними симптомами, що розвиваються через понад 72 години після противірусної хіміопрофілактики, або особи із подібними симптомами, які проживають у раніше не інфікованих закладах, повинні бути перевірені на грип та інші респіраторні патогени. Якщо результати тесту на грип позитивні, незважаючи на противірусне лікування, розгляньте можливість медикаментозно резистентного вірусу; поширення грипу в раніше не інфікованих частинах закладів, де противірусні препарати не були використані; або відбувалося багаторазове занесення грипу мешканцями закладу ззовні (B III).
Резюме доказів
Існує мало даних, щоб визначити, чи проведення діагностичних тестів кожного мешканця, хто має грипоподібні захворювання в умовах спалаху грипу, призводить до більш своєчасного інфекційного контролю. Однак як тільки випадок грипоподібного захворювання в закладі підтверджується як грип, наступні виявлені випадки грипоподібних захворювань також можуть бути викликані грипом, хоча це і не завжди справджується (наприклад, грип та інші респіраторні віруси можуть циркулювати одночасно в одному і тому ж закладі, й іноді може відбуватися коінфекція) [215]. Оскільки існує висока імовірність того, що такі пацієнти інфіковані вірусом грипу [64], залежно від наявності тестів у даному закладі може бути непрактичним тестувати кожного пацієнта з грипоподібним захворюванням на вірус грипу в умовах спалаху грипу. Літні пацієнти можуть мати атипові симптоми грипу; тестування на грип може бути важливим для афебрильних мешканців із симптомами респіраторних інфекцій або вперше виявленим зміненим психічним статусом. Мешканці закладів закритого типу часто мають високий ризик розвитку ускладнень грипу. Якщо клінічні підозри на захворювання на грип високі, розумно розпочинати противірусну терапію та здійснювати заходи інфекційного контролю в очікуванні результатів тестів діагностики грипу.
Кого слід лікувати противірусними препаратами під час спалахів?
Рекомендація 34. Всі мешканці з лабораторно підтвердженим грипом повинні приймати відповідні противірусні лікарські засоби. Після виявлення одного випадку лабораторно підтвердженого грипу в закладі всі особи, у яких згодом розвиваються грипоподібні захворювання або інші ознаки або симптоми грипу (наприклад, ізольовані зміни психічного стану в літніх осіб), повинні лікуватися противірусними лікарськими засобами (A III). Див. розділ «Противірусні лікарські засоби» і табл. 2 для інформації щодо режимів.
Резюме доказів
Існує мало даних, щоб припустити, що лікування осіб з підтвердженим грипом під час інституційного спалаху без реалізації широкомасштабної противірусної хіміопрофілактики і щеплення проти грипу призводить до більш швидкого контролю спалаху. Тим не менш, такі люди, імовірно, будуть схильні до ризику розвитку ускладнень грипу [5, 216] і повинні лікуватися відповідними противірусними лікарськими засобами, як обговорювалося в розділі «Противірусні лікарські засоби». Раннє лікування (протягом 2 днів після початку захворювання) було пов’язане з більш значним скороченням ризику розвитку ускладнень, ніж відкладене лікування, в одному ретроспективному дослідженні [151].
Хто повинен отримувати противірусну хіміопрофілактику під час спалахів?
Рекомендація 35. Під час задокументованих спалахів грипу в закладах тривалого догляду всі мешканці повинні отримувати хіміопрофілактику проти вірусу грипу, незалежно від статусу вакцинації грипу. В ідеалі хіміопрофілактика повинна бути реалізована на всіх поверхах і палатах, тому що випадки спалахів часто відбуваються, коли противірусні препарати вводяться тільки особам з інфікованих блоків або палат, а не всім мешканцям у закладі (A I).
Резюме доказів
Існують деякі розбіжності щодо того, чи повинні мешканці в закладах отримувати хіміопрофілактику проти вірусу грипу в умовах інституційних спалахів грипу. Спостережні дані [151, 195, 197, 198, 217–221] рандомізованих досліджень [219, 222] та рекомендацій експертів і медичних товариств [5, 94, 188, 206, 211, 223, 224] підтримують використання противірусних препаратів проти грипу для мешканців у таких закладах. Хіміопрофілактика в закладах також демонструє економічну вигоду для інфікованого закладу [225]. Проте противірусні препарати часто вводяться для хіміопрофілактики лише мешканців, які займають палати на інфікованому поверсі або у блоці. Така практика часто призводить до продовження спалаху й появи випадків захворювання на інших поверхах або блоках після реалізації контрольних заходів на вихідній ділянці. У світлі цього досвіду, якщо це можливо, під час спалаху має відбуватися широкомасштабна хіміопрофілактика всіх мешканців незалежно від того, чи були вони раніше щеплені [5, 214, 218].
Які медичні працівники повинні отримувати противірусну хіміопрофілактику під час спалахів?
Див. інформацію про режими з розділу «Противірусні лікарські засоби».
Рекомендація 36. Для всіх співробітників закладу, які не можуть отримати вакцину проти грипу або для яких вакцина протипоказана, або якщо вакцина буде неефективною (наприклад, у зв’язку з циркуляцією штамів вірусів грипу, які антигенно відрізняються від штамів вакцини, так що очікується істотне збільшення невдач щеплення), противірусні лікарські засоби повинні використовуватися для хіміопрофілактики (B III). Протипоказання до щеплення включають анафілактичну гіперчутливість на білок або інші компоненти вакцини, гарячкові захворювання від помірних до тяжких і як запобіжний захід синдром Гієна — Барре в анамнезі протягом 6 тижнів після отримання попереднього щеплення проти грипу [5].
Резюме доказів
Хоча існують докази, що щеплення медичних працівників знижує смертність у пацієнтів [226, 227], жодні дослідження не оцінювали вплив серед мешканців противірусної хіміопрофілактики медичних працівників. Слід докласти всіх зусиль до того, щоб весь медичний персонал щепився кожен сезон. Нещеплені працівники можуть бути носіями вірусу грипу ззовні до закладу, і співробітники також можуть заразитися і служити джерелом передачі інфекції в закладах [228]. З цих причин нещеплені медичні працівники повинні отримувати хіміопрофілактику проти вірусу грипу під час спалаху грипу. Під час сезонів, коли віруси, що циркулюють, не збігаються з вірусами вакцини, слід розглянути проведення противірусної хіміопрофілактики, у тому числі щепленому персоналу. Противірусну хіміопрофілактику слід розглядати для щепленого персоналу з ослабленим імунітетом, тому що вакцина може мати значно нижчу ефективність [205]. Якщо працівник отримує вакцину проти грипу під час інституційного спалаху, противірусна хіміопрофілактика повинна тривати протягом 14 днів після щеплення, поки не виробляться захисні антитіла. В ідеалі хіміопрофілактика повинна здійснюватися для нещепленого персоналу усього закладу, тому що спалах може виникнути, якщо противірусні препарати вводяться тільки тим особам, які працюють в інфікованих блоках. Належне здійснення противірусної хіміопрофілактики серед персоналу сприятиме швидкому виявленню спалаху в поєднанні з інформацією про циркуляцію антигенно віддалених штамів, що навряд чи стримуватимуться поточним щепленням.
Як довго повинна тривати противірусна хіміопрофілактика у мешканців і медичного персоналу під час спалахів?
Рекомендація 37. В умовах інституційного спалаху слід продовжувати противірусну хіміопрофілактику протягом 14 днів або протягом 7 днів після появи симптомів в останньої інфікованої людини залежно від того, що триває довше (A II).
Резюме доказів
CDC, численні державні й місцеві органи охорони здоров’я та експерти з боротьби з грипом рекомендують, аби противірусна хіміопрофілактика під час інституційних спалахів грипу тривала не менше ніж 14 днів, і якщо спостереження показують, що нові випадки продовжують мати місце, хіміопрофілактика повинна тривати протягом 7 днів після останнього виявленого випадку [5, 94, 214, 229]. Одне рандомізоване дослідження, що порівнювало два протоколи противірусної хіміопрофілактики, що використовувалися в будинках для інвалідів під час спалаху грипу, дійшло висновку, що введення противірусних лікарських засобів мешканцям протягом як мінімум 14 днів (і протягом 7 днів після останнього підтвердженого випадку грипу) достатньо для запобігання загостренню спалаху [229].
Nice Clinical Guideline 69 «Respiratory Tract Infections – Antibiotic Prescribing», (2008)
1. РЕЗЮМЕ
1.1. Перелік усіх рекомендацій
Клінічна та економічна ефективність стратегій призначення антибіотиків при респіраторних інфекціях (РІ) наводиться в підрозділі 2.2.3.
NICE clinical guideline 69 «Respiratory tract infections – antibiotic prescribing» (2008)
1.3. Огляд
1.3.1. Призначення антибіотиків проти самообмежувальних респіраторних інфекцій у дорослих і дітей при первинній медичній допомозі
Респіраторна інфекція визначається як будь-яка інфекційна хвороба верхніх або нижніх дихальних шляхів. Інфекції верхніх дихальних шляхів (ІВДШ) включають застуду, ларингіт, фарингіт/тонзиліт, гострий риніт, гострий риносинусит і гострий середній отит. Інфекції нижніх дихальних шляхів (ІНДШ) включають гострий бронхіт, бронхіоліт, пневмонію та трахеїт. Як правило, антибіотики прописуються для лікування РІ у дорослих та дітей при первинній медичній допомозі. Дані загальної практики в Англії та Уельсі показують, що чверть населення щороку відвідує своїх сімейних лікарів через РІ (Ешворт і співавт., 2005). РІ є причиною 60 % випадків призначення антибіотиків у загальній практиці, і це становить значне економічне навантаження для національної системи охорони здоров’я. Річні витрати на призначення лише проти гострого кашлю перевищують 15 мільйонів фунтів (Lindbaek, 2006).
Існують дані рандомізованих плацебо-контрольованих випробувань (РКВ), що антибіотики мають обмежену ефективність у лікуванні більшої частини РІ у дорослих і дітей (див. розділ 2). До таких належать гострий середній отит, гострий кашель/гострий бронхіт, гострий біль у горлі/гострий фарингіт/гострий тонзиліт, гострий риносинусит та застуди. Ці стани значною мірою самообмежувальні, а ускладнення за відсутності антибіотичної терапії малоймовірні. Таким чином, ці п’ять загальних РІ знаходяться в центрі уваги даної настанови. Нераціональне призначення антибіотиків має потенціал для збудження медикаментозно індукованих побічних реакцій, призводить до поширення стійких до антибіотиків організмів у суспільстві і збільшення кількості первинних медичних консультацій через захворювання легкого ступеня (Постійний медичний консультативний комітет, 1998).
Для пацієнтів із РІ при первинній медичній допомозі або першому контакті з медичним співробітником (наприклад, спеціалістом невідкладної допомоги або швидкої медичної допомоги) може бути використано три різні стратегії лікування антибіотиками: відмова від лікування антибіотиками; відстрочене в часі (або відкладене) призначення антибіотиків (при якому застосування антибіотиків дозволяється через певний часовий проміжок у випадку симптоматичного погіршення), а також негайне призначення антибіотиків. Рішення, погоджене лікарем і пацієнтом, залежить як від оцінки фахівцем-медиком ризику ускладнень у разі утримання від прийому антибіотиків, так і від очікувань пацієнтів щодо призначення антибіотиків (Britten N. та ін., 2008; Butler та ін., 1998). Перевага відстроченого призначення порівняно зі стратегією відмови від призначення полягає в тому, що вона передбачає «запобіжне лікування» для незначної кількості пацієнтів, у яких можуть розвиватися ускладнення, і тому, що пацієнти, які очікують призначення антибіотиків, можуть бути більш схильними погодитися з таким курсом лікування, ніж із повною відмовою від застосування антибіотиків. Саме тому відкладене призначення є важливою стратегією лікування з метою скорочення кількості призначення недоречних антибіотиків (Little, 2005).
Схеми призначення антибіотиків для РІ широко варіюють у загальній практиці. Хоча схеми з затримкою призначення й відмовою від призначення активно лобіювались із кінця 1990-х років (Little, 2005), не ясно, якою мірою вони були прийняті на рівні первинної медичної допомоги в Англії та Уельсі.
У даний час немає національних клінічних рекомендацій у Великобританії щодо застосування антибіотиків у первинній медичній допомозі для РІ, які можуть мати самообмежувальний характер. Отже, існує потреба в рекомендаціях для первинної медичної допомоги та інших медичних працівників першого контакту (сімейних лікарів, медсестер-практиків, фармацевтів і тих, хто працює у відділеннях невідкладної допомоги) щодо:
— того, які РІ не потребують негайного лікування;
— того, яка стратегія лікування антибіотиками може бути запропонована після прийняття рішення, що пацієнт не вимагає негайного лікування антибіотиками;
— клінічної та економічної ефективності відкладеної антибіотикотерапії або терапії без антибіотиків під час медичної допомоги для забезпечення належного використання антибіотиків при РІ.
Ця коротка клінічна настанова спрямована на поліпшення якості надання медичних послуг дорослим та дітям (від 3 місяців і старше), для яких негайне призначення антибіотиків не є клінічним показанням, шляхом напрацювання науково-обґрунтованих рекомендацій щодо стратегії застосування антибіотиків. Однак ця настанова не поширюється на деталі режимів антибіотикотерапії вищезазначених п’яти РІ. Медичні працівники повинні звертатись до Британської національної рецептурної книги при виборі антибіотика і його дозування.
1.3.2. Програма короткої клінічної настанови NICE
«Призначення антибіотиків проти самообмежувальних інфекцій дихальних шляхів у дорослих і дітей при первинній медичній допомозі» (клінічна настанова NICE 69) — це коротка клінічна настанова NICE.
Для повного пояснення цього процесу див. www.nice.org.uk/guidelinesmanual.
1.3.3. Використання даної настанови
Цей документ призначений для працівників первинної медичної допомоги та місцевих закладів охорони здоров’я, де відбувається особистий контакт між пацієнтом і медичним працівником. Ці заклади включають заклади загальної практики (поліклініки), місцеві аптечні заклади, центри вільної медичної допомоги, чергові заклади охорони здоров’я та відділення невідкладної допомоги, де надається первинна медична та сестринська допомога. Цільова група населення — дорослі та діти (від 3 місяців і старше), які не потребують негайного призначення антибіотиків.
Це повна версія настанови. Вона доступна на www.nice.org.uk/CG069. Видається також зведена версія даної настанови: «Розуміння настанови NICE» (версія для пацієнтів і піклувальників) і короткий посібник (для медичних працівників). Вони також доступні за адресою www.nice.org.uk/CG069.
1.3.4. Використання рекомендацій та супутня доказова база
ГРН зробила огляд доказів із кожного клінічного питання, з якого отримала звіт по клінічних даних і, за необхідності, економічні обґрунтування, отримані під час дослідження та оцінки подібної інформації. Виходячи з цієї інформації, ГРН змогла сформувати рекомендації настанови. Зв’язок між доказами й рекомендаціями ГРН явно висвітлений і супроводжується клінічними доказами.
2. ОГЛЯД ДОКАЗОВОЇ БАЗИ І РЕКОМЕНДАЦІЙ
2.1. Огляд ефективності застосування антибіотиків для респіраторних інфекцій при первинній медичній допомозі
2.1.1. Вступ
Ця коротка клінічна настанова прагне оптимізувати використання антибіотиків для РІ у дорослих і дітей при наданні первинної медичної допомоги. Умови, що є предметом дослідження, включають загальні випадки РІ, які лікуються у закладах первинної медичної допомоги, де призначення антибіотиків часто вважається ефективним засобом боротьби з симптомами і запобігання ускладненням. П’ять РІ досліджуються в цій короткій клінічній настанові: гострий середній отит, гострий біль у горлі/гострий фарингіт/гострий тонзиліт, застуда, гострий риносинусит та гострий кашель/гострий бронхіт. Ці п’ять РІ є найбільш поширеними причинами звернень до медичних закладів загальної практики у Великобританії1.
Мета цього оглядового розділу полягає в узагальненні даних про ефективність антибіотиків для вищезгаданих п’яти РІ. Це дає підстави для створення цієї короткої клінічної настанови, яка має на меті визначення клінічної та економічної ефективності конкретної стратегії антибіотикотерапії при РІ (див. розділ 2). ГСО є діагнозом, що заснований на симптомах і дослідженні барабанної перетинки. Двома загальними симптомами гострого середнього отиту є вушний біль (гострий біль у вусі) і оторея.
Огляд заснований на нещодавно опублікованих систематичних оглядах (бібліотека Кокрейна) та інших відповідних дослідженнях. Виявлені докази узагальнені і наведені в описовій формі.
Цей огляд має на меті демонстрацію ефективності антибіотиків при лікуванні РІ (ГСО, гострого болю в горлі/гострого фарингіту/гострого тонзиліту, застуди, гострого риносинуситу та гострого кашлю/гострого бронхіту) у дорослих і дітей, які звернулись до закладів охорони здоров’я, що надають первинну медичну допомогу. Термін «гострий риносинусит» використовується замість терміна «гострий синусит» для відповідності в цій настанові, з огляду на те, що «гострий риносинусит» є міжнародно визнаним у даний час терміном. Тим не менше в деякій медичній літературі в дослідженнях до цих пір зустрічається термін «гострий синусит».
2.1.2. Огляд
Гострий середній отит (ГСО)
Був визначений один систематичний огляд Кокрейна щодо ефективності антибіотиків при ГСО (Glasziou і співавт., 2004). Цей огляд Кокрейна включив 8 рандомізованих контрольованих випробувань (РКВ) за участю 2287 дітей, які страждають від ГСО (від 6 місяців до 15 років) обох статей, без тимпанотомії, з різних закладів охорони здоров’я. Дослідження розглядало будь-яку антибактеріальну терапію порівняно з плацебо. Дослідження проводились у первинному закладі (лікарні загальної практики) (4) і лікарні (1) (рандомізовано лікарняною аптекою). Заклади, у яких здійснювались інші 3 дослідження, не уточнювались.
У цьому огляді проведений метааналіз на основі сукупного відносного ризику (ВР) щодо важливих для пацієнта (симптоми або проблеми, що впливають на добробут пацієнта) та інших важливих результатів. Тривалість і тяжкість болю і проблем зі слухом (середньо- та довгострокових), викликаних рідиною в середньому вусі, були визначені як два ключових фактори для пацієнтів. Було зазначено два інших ключових результати: побічні реакції (блювання, діарея, висип) і прогресування симптомів (ускладнення — двосторонній отит).
Результат 1: тривалість і тяжкість болю
У метааналізі тривалість та інтенсивність болю не була суттєво знижена антибіотиками протягом перших 24 годин (ВР = 1,02, 95% ДІ від 0,85 до 1,22, р = 0,91) (4 дослідження), але була значно скорочена антибіотиками в період з 2-го по 7-й день лікування (сукупний ВР = 0,70, 95% ДІ від 0,60 до 0,81, р < 0,00001, кількість пацієнтів, які потребують лікування2 (КППЛ) = 15, 95% ДІ від 11 до 24) (8 досліджень).
Узагальнення для закладів первинної медичної допомоги
Серед 4 досліджень, які вивчали тривалість і тяжкість больового синдрому протягом перших 24 годин, тільки 1 проводилось у закладі первинної медичної допомоги. Ця вибірка дослідження включала 229 дітей. Результат цього окремого дослідження становив ВР = 0,99, 95% ДІ від 0,75 до 1,30, що не було значним. У 8 дослідженнях, які розглядали результати з 2-го по 7-й день, тільки 3 дослідження були проведені в закладах загальної практики. Загальна вибірка цих 3 досліджень становила 586 дітей. Результати цих 3 окремих первинних досліджень лікування були такими: ВР = 0,89; 95% ДІ від 0,41 до 1,93, ВР = 0,71, 95% ДІ від 0,43 до 1,18, і ВР = 0,82, 95% ДІ від 0,68 до 0,98 відповідно (2 з 3 досліджень показали незначні результати).
Результат 2: проблеми зі слухом
Оскільки результати зміни слуху не показали жодних істотних відмінностей у метааналізі через 1 місяць (3 дослідження) або 3 місяці (2 дослідження) після випадку загострення, це свідчить про відсутність позитивного ефекту антибіотиків на слух (1 місяць: сукупний ВР = 0,94, 95% ДІ від 0,75 до 1,19, р = 0,6; 3 місяці: сукупний ВР = 0,80, 95% ДІ від 0,55 до 1,16, р = 0,2).
Узагальнення для закладів первинної медичної допомоги
Два дослідження з цього аналізу (протягом 1 місяця) проводились у закладах загальної практики із загальною вибіркою 323 дитини (ВР = 0,74, 95% ДІ від 0,49 до 1,13; ВР = 1,05, 95% ДІ від 0,74 до 1,48 відповідно), а 1 з двох досліджень проводилось протягом 3 місяців у закладі первинної медичної допомоги з вибіркою, що включала 221 дитину (ВР = 0,65, 95% ДІ від 0,40 до 1,07).
Результат 3: побічні реакції
Чотири дослідження в систематичному огляді Кокрейна, так само, як і в дослідженні реакції пацієнтів на відповідні результати, повідомили про побічні реакції в окремих дітей (побічні реакції антибіотиків, такі як нудота, діарея і висип). Коли всі 4 дослідження були об’єднані, результати показали, що діти, які приймали антибіотики, були під великим ризиком побічних реакцій порівняно з групою плацебо (сукупний ВР = = 1,60, 95% ДІ від 1,19 до 2,16, р = 0,002).
Узагальнення для закладів первинної медичної допомоги
З цих 4 досліджень 2 були зареєстровані в закладах первинної медичної допомоги із загальною вибіркою дослідження, що включала 472 дитини. ВР для 2 окремих досліджень становив 1,52 (95% ДІ від 1,09 до 2,13) і 1,75 (95% ДІ від 0,90 до 3,42).
Результат 4: прогресування симптомів
З точки зору прогресування симптомів метааналіз не показав позитивного ефекту антибіотиків у зниженні двостороннього отиту (3 дослідження) (сукупний ВР = 0,48, 95% ДІ від 0,17 до 1,33, р = 0,2).
Узагальнення для закладів первинної медичної допомоги
Тільки 1 дослідження було проведене в закладі первинної медичної допомоги (ВР = 0,91, 95% ДІ від 0,60 до 1,38). З групи дітей (трохи більше 2000), досліджених у цьому огляді Кокрейна, тільки в одному випадку був зафіксований мастоїдит, що свідчить про те, що мастоїдит є рідкісним ускладненням гострого середнього отиту.
Метааналіз індивідуальних даних пацієнтів (МІДП)
Крім систематичного огляду Кокрейна (Glasziou і співавт., 2004) був також визначений ще один метааналіз з індивідуальними даними по хворих на ГСО, які приймали антибіотики (Rovers і співавт., 2006), для включення до даного огляду. На відміну від огляду Кокрейна (Glasziou і співавт., 2004), який мав широкий віковий діапазон (від 6 місяців до 15 років), цей МІДП виокремив підгрупи дітей, які більшою мірою експоновані до позитивних і негативних впливів антибіотиків. У загальній сукупності в метааналіз були включені 6 рандомізованих досліджень, й індивідуальні дані по 1643 дітях віком від 6 місяців до 12 років були валідовані та повторно проаналізовані. Первинним результатом дослідження був затяжний випадок гострого середнього отиту (що супроводжувався болем, гарячкою або обома симптомами одразу протягом від 3 до 7 днів).
Результати показали, що порівняно з плацебо сукупний ВР по симптомах протягом 3–7 днів з антибіотиками становив 0,83 (95% ДІ від 0,78 до 0,89; КППЛ = 8). Коли біль і гарячка були проаналізовані окремо, результати для обох результатів показали незначну дію антибіотиків у питанні зменшення болю впродовж від 3 до 7 днів (ВР = 0,86, 95% ДІ від 0,81 до 0,91, КППЛ = 10) і зниження температури впродовж від 3 до 7 днів (ВР = 0,95, 95% ДІ від 0,92 до 0,98, КППЛ = 20).
Подальший аналіз для первинного результату (біль, гарячка або обидва симптоми від 3 до 7 днів) також показав, що дія антибіотиків була модифікована за віком, двостороннім ГСО та отореєю. У дітей віком до 2 років із двостороннім ГСО 30 % у групі антибіотиків і 55 % у контрольній групі все ще мали біль, гарячку або обидва симптоми впродовж від 3 до 7 днів (ВР = 0,64, 95% ДІ від 0,62 до 0,80; КППЛ = 4). Навпаки, у дітей 2 років і старше не було жодних істотних відмінностей між двома групами по болю, лихоманці або обох симптомах упродовж 3–7 днів (ВР = 0,80, 95% ДІ від 0,70 до 1,02). Про біль, гарячку або обидва симптоми і раніше повідомлялось в інтервалі від 3 до 7 днів у 24 % дітей з отореєю у групі з антибіотиком і в 60 % дітей з отореєю в контрольній групі (ВР = 0,52, 95% ДІ від 0,37 до 0,73; КППЛ = 3). Різниця ризиків, що становила 36 %, була набагато більшою, ніж різниця ризиків для дітей, які не зазнали отореї в обох групах (14 %). Це свідчить про те, що діти з отореєю отримували більше користі від лікування антибіотиками незалежно від інших характеристик.
Підсумкові висновки огляду Кокрейна і МІДП полягають у наступному. Антибіотики проти ГСО ефективні тільки в зменшенні тривалості болю в дітей віком від 6 місяців до 15 років. КППЛ для запобігання певного болю в однієї дитини через 2 дні становила 15 пацієнтів, а діти, які приймали антибіотики, були набагато більше експоновані до ризику побічних реакцій. Однак, незважаючи на можливі побічні реакції, антибіотики, скоріше за все, були корисними для дітей віком до 2 років з двостороннім ГСО (КППЛ = 4), а також для дітей із двостороннім ГСО та отореєю (КППЛ = 3). Тим не менше біль на 3-й день для тих дітей, які його мали, був помірним, при цьому більшість батьків використовували субоптимальні дози анальгетиків (Little і співавт., 2001). Таким чином, це спірно, чи варто для лікування дітей застосовувати антибіотики, особливо коли для полегшення болю не були застосовані оптимальні дози анальгетиків.
Гострий кашель/гострий бронхіт
Був визначений один систематичний огляд Кокрейна щодо ефективності антибіотиків при гострому бронхіті (Fahey і співавт., 2004). Автори цього огляду дослідили 9 РКВ серед 750 дітей і дорослих (у віці 8 років і старше) із гострим бронхітом або гострим кашлем, які не супроводжуються хворобами легенів. Як курці, так і ті, хто не курить, були включені в первинний аналіз, тривалість захворювання при надходженні пацієнтів була менше 30 днів. Втручанням у дослідженні була будь-яка антибактеріальна терапія порівняно з плацебо. В огляді не розглядались пацієнти з раніше діагностованим хронічним бронхітом (тобто пацієнти із загостренням хронічного бронхіту). Всі 9 досліджень проводились у первинному закладі охорони здоров’я (лікарні загальної практики) (5), лікарні амбулаторного спостереження (1) і лікарняних амбулаторіях (3).
У цьому огляді Кокрейна проводився метааналіз із використанням сукупного ВР наявності кашлю, поліпшення загальної оцінки лікаря, виявлення патології легенів, тривалості кашлю, тривалості самовизначення себе хворим і побічних реакцій.
Результат 1: пацієнти з кашлем
У цілому цей огляд Кокрейна показав, що пацієнти, які отримували антибіотики, мали кращий результат стосовно кашлю, ніж пацієнти, які отримували плацебо. Результати метааналізу показали, що пацієнти, які отримують антибіотики, менш імовірно мають кашель протягом 7–14 днів після початку лікування (4 дослідження) (сукупний ВР = 0,64, 95% ДІ від 0,49 до 0,85, р = 0,002).
Узагальнення для закладів первинної медичної допомоги
Всі 4 дослідження, що фіксують кашель протягом 7–14 днів після початку лікування, були проведені в закладі первинної медичної допомоги. КППЛ для запобігання цьому результату в одного пацієнта, який має кашель, дорівнює 5 (95% ДІ від 3 до 14).
Результат 2: поліпшення загальної оцінки лікаря
Результати метааналізу показали, що пацієнти, які отримують антибіотики, більш імовірно продемонструють поліпшення загальної оцінки лікаря (6 досліджень) (сукупний ВР = 0,52, 95% ДІ від 0,31 до 0,87, р — не надано), але КППЛ була відносно високою (КППЛ = 14, 95% ДІ від 8 до 50).
Узагальнення для закладів первинної медичної допомоги
З 6 досліджень 4 були проведені в закладах первинної медичної допомоги із загальною вибіркою з 473 пацієнтів. 4 дослідження індивідуально не показали відмінності між антибіотиками і плацебо (ВР = 0,46, 95% ДІ від 0,18 до 1,16, ВР = 0,42, 95% ДІ від 0,11 до 1,57, ВР = 0,52, 95% ДІ від 0,25 до 1,09, ВР = 1,73, 95% ДІ від 0,16 до 18,20 відповідно).
Результат 3: виявлення патології легенів
Метааналіз щодо виявлення патології легенів показав, що пацієнти, які отримують антибіотики, менш імовірно експоновані до виявлення патології легенів (5 досліджень) (сукупний ВР = 0,54, 95% ДІ від 0,41 до 0,70, р < 0,00001; КППЛ = 11, 95% ДІ від 6 до 50) порівняно з групою плацебо.
Узагальнення для закладів первинної медичної допомоги
З 5 досліджень 4 були проведені в закладах первинної медичної допомоги із загальною вибіркою у 270 пацієнтів. Об’єднані результати метааналізу 5 досліджень були сильно викривлені одним великим випробуванням із лікарні, що становило 77,8 % від ваги метааналізу. Коли 4 дослідження у первинних медичних закладах були розглянуті окремо, жодне не показало відмінностей між антибіотиками і плацебо.
Результат 4: тривалість кашлю, мокрий кашель і нездужання
Подальший метааналіз показав, що пацієнти, які отримують антибіотики, мали коротшу тривалість кашлю (5 досліджень) (середньозважена = –0,58 дня, 95% ДІ від –1,16 до –0,01 дня), менш тривалий мокрий кашель (5 досліджень) (середньозважена = –0,52 дня, 95% ДІ від –1,03 до –0,01 дня) та коротшу тривалість відчуття нездужання (4 дослідження) (середньозважена = –0,58 дня, 95% ДІ від –1,16 до 0,00 дня).
Узагальнення для закладів первинної медичної допомоги
Загалом 4 з 5 досліджень із тривалості кашлю і 4 з 5 досліджень із тривалості мокрого кашлю були проведені на базі закладів первинної медичної допомоги, так само як і всі 4 дослідження з тривалості відчуття нездужання були проведені на базі закладів первинної медичної допомоги. Хоча результати показали статистично значуще зниження тривалості хвороби, на практиці фактичний розмір скорочень був невеликим: у всіх випадках менше ніж на 1 день.
Результат 5: побічні реакції
Відмінність у кількості побічних реакцій (тобто побічних реакцій від антибіотиків) (9 досліджень) не була статистично значущою між групою, яка отримувала антибіотики, і контрольною групою з сукупним ВР = 1,22, 95% ДІ від 0,94 до 1,58, р = 0,1.
Узагальнення для закладів первинної медичної допомоги
Сім із 9 досліджень були проведені на базі закладів первинної медичної допомоги із загальною вибіркою з 643 пацієнтів. Жодне з 7 досліджень не показало будь-яких відмінностей між групою, яка отримувала антибіотики, і контрольною групою.
Підсумкові висновки огляду Кокрейна полягають у наступному. Пацієнти, які отримують антибіотики, менш схильні мати кашель (КППЛ = 5). Тим не менше показники КППЛ для покращення загальної оцінки лікаря та ймовірності виявлення патології легенів були значно вищими (14 і 11 відповідно). Більше того, коли ці дослідження з первинної медичної допомоги були розглянуті індивідуально, жодне не показало значного впливу антибіотиків на поліпшення загальної оцінки лікаря і на зниження імовірності виявлення патології легенів. Хоча й було виявлено суттєвий вплив антибіотиків на тривалість кашлю та мокрого кашлю і покращення самопочуття, він був невеликий — різниця в 1 день для хвороби, що триває кілька тижнів.
Гострий біль у горлі/гострий фарингіт/гострий тонзиліт
Був визначений один систематичний огляд Кокрейна, у якому розглядалася ефективність антибіотиків при болі в горлі (Del Mar і співавт., 2006). Автори цього огляду розглянули 27 РКВ із загальною кількістю випадків болю в горлі 2835 (у дорослих і дітей). З цих РКВ 17 не розрізняють бактеріальну та вірусну етіології (тобто лікар/дослідник припускав, що пацієнт може мати фарингіт, індукований бета-гемолітичним стрептококом групи А (БГСА); діагностичних досліджень не проводилося). Тим не менше 8 досліджень включали БГСА-позитивних пацієнтів, у той час як 2 дослідження виключали БГСА-позитивних пацієнтів. Дослідження вивчало будь-яку антибіотикотерапію порівняно з плацебо. Усі 27 досліджень проводились у наступних закладах: базах військово-повітряних сил США (8), лікарнях загальної практики (10), дитячих поліклініках (4), лікарнях (2) або без зазначення місця проведення (3). З 10 досліджень, проведених у закладах первинної допомоги, 2 дослідження використовували БГСА-позитивність як критерій включення/виключення з дослідження: 1 дослідження не включало пацієнтів із БГСА-негативним мазком із зіва, а 1 дослідження включало лише пацієнтів із БГСА-негативним мазком із зіва. Інші 8 досліджень, проведених у закладах первинної допомоги, не використовували БГСА як критерій включення або виключення до загальної вибірки, замість цього були включені пацієнти, які за клінічними оцінками лікарів мали простий біль у горлі/фарингіт або якщо у них було три чи більше критерії Сентора (критерії Сентора були розроблені для прогнозування бактеріальних інфекцій за наявністю ексудату мигдалин, гарячки, шийної лімфаденопатії і відсутності кашлю). Деякі дослідження передбачали проведення повторних мазків із зіва при наступному відвідуванні для підтвердження етіології болю в горлі.
В огляді проведений метааналіз із використанням сукупного ВР по двох групах критеріїв оцінки результату — частоті ускладнень (гнійних і негнійних) і симптомах болю в горлі.
Результат 1: гостра ревматична гарячка
Для негнійних ускладнень результати метааналізу (16 досліджень) показали, що антибіотики знижують частоту гострої ревматичної гарячки протягом 2 місяців (сукупний ВР = 0,29, 95% ДІ від 0,18 до 0,44, р < 0,00001).
Узагальнення для закладів первинної медичної допомоги
Коли метааналіз було додатково проаналізовано, тільки 7 із 16 досліджень зареєстрували ревматичну гарячку, і ці 7 досліджень проводилися в період між 1954 і 1961 роками, коли ревматизм був набагато більш поширеним, ніж у наступні роки. Крім того, тільки 6 із 16 досліджень були проведені в закладах первинної медичної допомоги із загальною вибіркою дослідження з 2267 дорослих і дітей. Жодне з досліджень не повідомляло про випадки ревматизму.
Результат 2: гострий гломерулонефрит
Іншим негнійним ускладненням у метааналізі був гострий гломерулонефрит до 1 місяця (10 досліджень). Результати показали, що застосування антибіотиків не знижує частоту гострого гломерулонефриту (сукупний ВР = 0,22, 95% ДІ від 0,02 до 2,02, р = 0,2). Знову ж таки, тільки 2 дослідження з 10 зафіксували частоту гострого гломерулонефриту (обидва дослідження проводилися до 1960 року).
Узагальнення для закладів первинної медичної допомоги
З 8 досліджень, які не виявили випадків гострого гломерулонефриту, 4 були проведені в закладах первинної медичної допомоги із загальною вибіркою дослідження з 2186 дорослих і дітей.
Показники частоти ревматичної гарячки і гострого гломерулонефриту постійно знижуються в західному суспільстві. Нещодавнє групове ретроспективне дослідження з використанням даних із бази даних досліджень загальної лікарської практики (англ. GPRD) у період з 1991 по 2001 рік (за цей час було 3,36 млн випадків РІ) (Петерсен та ін., 2007) стверджує, що тяжко вивчати ревматичну гарячку та гострий гломерулонефрит як можливі ускладнення болю в горлі через дуже незначну кількість випадків цих ускладнень. Таким чином, будь-яке повідомлення про зниження відносного ризику у випробуваннях щодо ефективності повинні розглядатися в контексті вкрай малого абсолютного ризику розвитку обох цих ускладнень у закладах первинної медичної допомоги після випадків болю в горлі.
Результат 3: гострий середній отит, ангіна та гострий риносинусит
Для гнійних ускладнень результати показали, що антибіотики знижують частоту гострого середнього отиту протягом 14 днів (11 досліджень) (сукупний ВР = 0,28, 95% ДІ від 0,15 до 0,52, р = 0,00005) і ангіни протягом 2 місяців (8 досліджень) (сукупний ВР = 0,14, 95% ДІ від 0,05 до 0,39, р < 0,0002), але антибіотики не знижують частоту гострого риносинуситу (дослідження використовували термін «гострий синусит») протягом 14 днів (8 досліджень) (сукупний ВР = 0,53, 95% ДІ від 0,18 до 1,55, р = 0,2).
Узагальнення для закладів первинної медичної допомоги
При дослідженні ГСО лише 4 з 11 досліджень проводились у закладах первинної медичної допомоги із загальною вибіркою дослідження 1612 дорослих і дітей. З 1612 пацієнтів тільки в одному випадку був зареєстрований ГСО (у контрольній групі). При аналізі ангіни 6 із 8 досліджень були проведені в закладах первинної медичної допомоги із загальною вибіркою дослідження з 1810 дорослих і дітей. З 1810 пацієнтів було зареєстровано дев’ять випадків ангіни (вісім випадків у контрольних групах і один випадок у групі, яка отримувала терапію). Однак подальший аналіз систематичного огляду показав, що КППЛ ГСО була майже 200 осіб. У дослідженні Little і співавт. (2002) медіана щорічної кількості госпіталізацій із діагнозом «ангіна» (міжквартильний розмах) серед пацієнтів органів охорони здоров’я, які мали гострі неускладнені РІ, була низькою — на рівні 1,66 на 10 000.
Результат 4: симптоми болю в горлі
Результати метааналізу показали, що антибіотики знизили симптом болю в горлі на 3-й день (15 досліджень) (сукупний ВР = 0,72, 95% ДІ від 0,68 до 0,76, р < 0,00001) і через 1 тиждень (13 досліджень) (сукупний ВР = 0,65, 95% ДІ від 0,55 до 0,76, р < 0,00001). Антибіотикотерапія також знизила симптоми головного болю (3 дослідження) (сукупний ВР = 0,47, 95% ДІ від 0,38 до 0,58, р < 0,00001) і гарячку на 3-й день (7 досліджень) (сукупний ВР = 0,69, 95% ДІ від 0,53 до 0,88, р = 0,003). Жодного випадку гарячки (3 дослідження) не було зареєстровано через 1 тиждень.
Узагальнення — аналіз підгруп і заклади первинної медичної допомоги
При подальшому дослідженні підгруп, які були включені до метааналізу (БГСА-позитивні порівняно з БГСА-негативними, порівняно з необстеженими/нерозділеними), результати показали іншу картину. Наприклад, для симптомів болю в горлі на 3-й день усі три підгрупи (БГСА-позитивна, БГСА-негативна і необстежена/нерозділена) показали позитивну дію антибіотиків порівняно з плацебо (ВР = 0,59, 95% ДІ від 0,54 до 0,64, ВР = 0,79, 95% ДІ від 0,71 до 0,88, ВР = 0,89, 95% ДІ від 0,80 до 0,99 відповідно). З 11 досліджень, проведених у БГСА-позитивних підгрупах, 4 були проведені в закладах первинної медичної допомоги, з 6 досліджень серед БГСА-негативних підгруп 3 були проведені у закладах первинної медичної допомоги, і всі 3 дослідження у підгрупах необстежених/нерозділених були проведені в закладах первинної медичної допомоги.
Однак для симптомів болю в горлі після 1 тижня тільки БГСА-позитивні підгрупи показали позитивну дію антибіотиків порівняно з плацебо (ВР = 0,28, 95% ДІ від 0,17 до 0,44), але цього не виявлено у БГСА-негативних і необстежених/нерозділених підгрупах. З цих 7 досліджень 3 були проведені в закладах первинної медичної допомоги.
Дослідження, що використовували три або чотири критерії бактеріальної інфекції Сентора для визначення придатності (Dagnelie та ін., 1996; Zwart та ін., 2000) в огляді Кокрейна, показали трохи більшу корисність антибіотиків при полегшенні симптомів (від 1 до 2 днів більш раннє пом’якшення симптомів) і при профілактиці ускладнень (КППЛ = 60). Тим не менше потрібно бути обережним при узагальненні цих досліджень, які проводились у закладах, де рівень призначення антибіотиків традиційно був дуже низьким. Низький рівень призначення антибіотиків може призвести до зниження кількості консультацій і більшого спектра тяжких хвороб при первинній медичній допомозі.
Систематичний огляд гострого фарингіту у дорослих
Окрім огляду Кокрейна (Del Mar та ін., 2006), був проведений систематичний огляд правильного використання антибіотиків при гострому фарингіті у дорослих (Купер і співавт., 2001). У цьому огляді результати показали, що лікування антибіотиками протягом 2–3 днів після появи симптомів пришвидшує симптоматичне полегшення на 1–2 дні раніше в пацієнтів із трьома і більше критеріями Сентора (Сентор і співавт., 1981) (при цьому мазок із зіва у значної частки цих пацієнтів у кінцевому рахунку був БГСА-позитивним). Однак антибіотики не показали цього ефекту в БГСА-негативних пацієнтів. Критерії Сентора включають у себе наявність ексудату мигдалин, передніх шийних лімфоаденопатій або лімфаденітів, гарячку в анамнезі і відсутність кашлю.
Короткі висновки огляду Кокрейна полягають у наступному. Існує клінічне підтвердження на базі певних груп населення, яке проводилось у 1950-х і 1960-х роках, що припускає сприятливу дію антибіотиків у зниженні ревматичної гарячки і гострого гломерулонефриту після реєстрації болю в горлі. Тим не менше дослідження показують, що ці два ускладнення в даний час надзвичайно рідкісні в сучасному західному суспільстві. Таким чином, абсолютний ризик розвитку цих ускладнень після болю в горлі зараз вкрай малий. Дані з огляду Кокрейна також указують, що антибіотики надають відносні переваги в запобіганні ГСО та перитонзилярному абсцесу (ангіні), але КППЛ дуже висока.
Дані огляду Кокрейна також припускають, що антибіотики мають певний позитивний ефект у зниженні симптомів болю в горлі, гарячки і головного болю. Тим не менше майже половина групи дослідження в огляді була БГСА-позитивною. Оскільки в даний час у загальній практиці у Великобританії не використовуються мазки з горла або діагностичні експрес-тести для визначення наявності або відсутності БГСА, лікарі первинної допомоги покладаються на симптоми та критерії для прийняття рішення про початок лікування антибіотиками. Дослідження в умовах, коли використання антибіотиків є низьким, за умови використання трьох або чотирьох критеріїв бактеріальної інфекції Сентора для визначення придатності, дійсно показують деякі переваги від антибіотиків як для полегшення симптомів (приблизно 1–2 дні), так і для профілактики ускладнень. Симптоматичні переваги від антибіотиків у цій підгрупі пацієнтів (з трьома і більше критеріями Сентора) були також підтверджені результатами систематичного огляду (Cooper і співавт., 2001).
Застуда
Існує один систематичний огляд Кокрейна щодо ефективності антибіотиків при застуді та гострому гнійному риніті (Arroll і Kenealy, 2005). У цей огляд було включено 13 РКВ за участю 2467 дорослих і дітей (віком від 2 місяців), у яких було діагностовано інфекції верхніх дихальних шляхів із симптомами протягом 7 днів або гострий гнійний риніт, який продовжувався менше 10 днів. Дослідження вивчало будь-яку антибактеріальну терапію порівняно з плацебо. В огляд не були включені пацієнти з діагнозом «фарингіт» і «бронхіт» відповідно до визначення Міжнародної класифікації проблем, пов’язаних зі здоров’ям, у закладах первинної медичної допомоги 1986 року (англ. ICHPPC).
Серед закладів, де проводились 13 досліджень, були: лікарні загальної практики (4), військові бази (4), лікарняні амбулаторії (2), без зазначення дослідницького підрозділу (співробітників фабрик і службовців) (1), відділення невідкладної допомоги (1) і не зазначено (1).
В огляді проведений метааналіз із використанням сукупних ВР по ряду результатів. Основними результатами були відсутність лікування або збереження симптомів запалення носоглотки у дні з 1-го по 7-й (риніт, біль у горлі і чхання), протяжний гострий гнійний риніт і побічні реакції.
Результат 1: відсутність лікування або збереження симптомів
Результати метааналізу показали, що не було виявлено жодних досліджень із приводу відсутності лікування або збереження симптомів запалення носоглотки (6 досліджень) (сукупний ВР = 0,89, 95% ДІ від 0,77 до 1,04, р = 0,1).
Узагальнення для закладів первинної медичної допомоги
Тільки 1 із цих 6 досліджень було проведене в закладі первинної медичної допомоги (з вивченням зразків 188 дітей віком від 2 до 10 років). ВР збереження симптомів в цьому дослідженні становив 1,83 (95% ДІ від 0,54 до 6,24), що не є статистично значущим.
Результат 2: протяжний гострий гнійний риніт
Результати метааналізу (5 досліджень) також свідчать про значні переваги використання антибіотиків (сукупний ВР = 0,62, 95% ДІ від 0,38 до 1,01, р = 0,06) для затяжного гострого гнійного риніту.
Узагальнення для закладів первинної медичної допомоги
З цих 5 досліджень 3 були проведені в закладах первинної медичної допомоги із загальною вибіркою дослідження 554 дорослих і дитини.
Результат 3: побічні реакції
На додаток до збереження симптомів протяжного гострого гнійного риніту 6 досліджень у систематичному огляді також повідомляють про побічні реакції в окремих пацієнтів. Після зведення всіх 6 досліджень результати показали, що пацієнти, які приймали антибіотики, були експоновані до високих ризиків побічних реакцій (несприятливих побічних реакцій від антибіотиків) порівняно з контрольною групою (сукупний ВР = 1,80, 95% ДІ від 1,01 до 3,21, р = 0,05). Однак також була відмічена висока гетерогенність. При аналізі підгруп дорослих і дітей було виявлено, що тільки дорослі пацієнти, які приймали антибіотики, були експоновані до високих ризиків розвитку побічних реакцій порівняно з контрольною групою (4 дослідження) (сукупний ВР = 2,62, 95% ДІ від 1,32 до 5,18, р < 0,00001), жодних відмінностей не було знайдено для підгруп дітей (2 дослідження) (сукупний ВР = 0,91, 95% ДІ від 0,51 до 1,63, р = 0,8).
Узагальнення для закладів первинної медичної допомоги
В аналізі дорослої підгрупи 2 з 4 досліджень були проведені в закладах первинної медичної допомоги із загальною вибіркою дослідження 946 пацієнтів. При аналізі підгруп дітей 1 з 2 досліджень було проведене в закладі первинної медичної допомоги із загальною вибіркою дослідження лише з 188 пацієнтів.
Підсумкові висновки цього систематичного огляду Кокрейна полягають у тому, що антибіотики неефективні в зниженні затяжних симптомів застуди, а дорослі пацієнти можуть зазнати побічних реакцій від застосування антибіотиків.
Затяжний риніт
Існує ще 1 систематичний огляд Кокрейна3, що розглядає ефективність антибіотиків при стійкому риніті (Морріс і Ліч, 2002). Цей огляд включав 6 РКВ та 562 дітей (віком від 0 місяців до 18 років), які мали стійкий риніт не менше 10 днів. Для включення дослідження в огляд риніт повинен був бути первинним станом, що вимагав медичного втручання. Дослідження, у яких порівнювались або комбінувались антибіотики з хірургією або пункцією і промиванням приносових пазух (синусів), були виключені. Дослідження, у яких порівнювали два або більше антибіотики без контрольної групи, що не отримувала антибіотики, були також виключені з систематичного огляду. Типом втручання в шістьох дослідженнях вважалась будь-яка антибактеріальна терапія порівняно з плацебо або стандартною терапією (стандартна терапія включала протинабрякові або назальні сольові краплі). Шість досліджень проводились у дитячій лікарні алергічного профілю (1), алергічній лікувально-діагностичній клініці (1), лікарні загального профілю (2), дитячому закладі первинної медичної допомоги (1) і лікарні, що спеціалізується на хворобах вуха, горла і носа (1). Дослідження первинного педіатричного догляду були із США.
У цьому огляді Кокрейна проведений метааналіз із використанням змішаної ВР по ряду результатів. Двома основними результатами були відсутність позитивної клінічної динаміки (частка пацієнтів із ринітом при подальшому спостереженні або тих, хто не мав істотного поліпшення в разі ненадання результатів лікування) і побічні реакції.
Результат 1: відсутність позитивної клінічної динаміки
Результати метааналізу відсутності позитивної клінічної динаміки (6 досліджень) показали, що антибіотики малоефективні щодо зниження симптомів риніту в дітей, що тривають понад 10 днів (сукупний ВР = 0,75, 95% ДІ від 0,61 до 0,92, р = 0,005; КППЛ = 8, 95% ДІ від 5 до 29).
Узагальнення для закладів первинної медичної допомоги
Тільки 1 з 6 досліджень було проведене в закладі первинної медичної допомоги з дослідженням зразків 161 дитини. Результати цього дослідження свідчать про неефективність антибіотиків у зменшенні проявів риніту (ВР = 0,91, 95% ДІ від 0,48 до 1,07). Той факт, що цей результат знаходиться в протиріччі з сукупним ВР, може бути пояснений тим, що пацієнти, які були досліджені у лікарні або клініці з лікування алергії, були більш хворі або мали більш серйозні симптоми, ніж пацієнти, які зверталися за допомогою до закладів первинної допомоги.
Результат 2: побічні реакції
Що стосується побічних реакцій, результати метааналізу (4 дослідження) також показали, що не було жодних значних шкідливих побічних реакцій антибіотиків в основній групі порівняно з контрольною групою (сукупний ВР = 1,75, 95% ДІ від 0,63 до 4,82, р = 0,3).
Узагальнення для закладів первинної медичної допомоги
Одне з 4 досліджень, що розглядали побічні реакції, було проведене в закладі первинної медичної допомоги при вибірці дослідження з 157 дітей. В огляді Кокрейна також спробували провести аналіз підгрупи дуже маленьких дітей. Однак тільки 1 невелике дослідження включало дітей віком до 8 років, і, отже, не було достатніх доказів, щоб визначити, чи впливає вік на ефективність антибіотиків у дітей зі стійким ринітом.
Короткі висновки цього огляду Кокрейна полягають у тому, що для дітей зі стійким ринітом дані свідчать про те, що антибіотики ефективні у зниженні ймовірності продовження риніту в короткостроковій і середньостроковій перспективі тільки в дітей із ринітом, що триває довше 10 днів. Однак переваги здаються незначними й зокрема для виліковування 1 пацієнта необхідно здійснити лікування восьми дітей. Довгострокові переваги не були зареєстровані в огляді. Оскільки тільки 1 дослідження з 6 було проведено у закладі первинної медичної допомоги і це конкретне дослідження не показало жодної користі антибіотиків, узагальнення результатів метааналізу для первинної медичної допомоги дітям є невизначеним.
Гострий риносинусит
Термін «гострий риносинусит» використовується замість терміна «гострий синусит» для цілей цієї настанови, тому що настанова щодо гострого риносинуситу використовує термінологію, що в даний час є міжнародно визнаною. Тим не менше в деякій медичній літературі та дослідженнях до цих пір цей стан називається гострим синуситом. Був визначений один (Вільямс мол. та співавт., 2003) систематичний огляд Кокрейна, що був присвячений ефективності застосування антибіотиків при гострому риносинуситі (дослідження використовували термін «гострий верхньощелепний синусит»). В огляд увійшли 49 досліджень за участю 13 660 пацієнтів. Однак тільки 3 з 49 досліджень мали порівняння антибіотиків із плацебо (у той час як інші дослідження порівнювали один антибіотик з іншим). Отже, тільки ці 3 дослідження обговорюються в цьому огляді. Три дослідження були РКВ і охоплювали 416 дорослих (віком від 18 років і старше) з гострим риносинуситом, підтвердженим рентгенологічно або аспіраційно. Додатковим критерієм включення було те, що випробування повинні мати розмір вибірки не менше 30 учасників із гострим риносинуситом. Тип втручання в метааналізі було визначено як будь-яку антибактеріальну терапію порівняно з плацебо або місцевим протинабряковим засобом. Тривалість лікування коливалася від 3 до 15 днів, а серед закладів, де проводились 3 дослідження, були: заклади первинної медичної допомоги (2), не наводиться даних (1).
Результат 1: клінічно вилікувані або клінічно вилікувані/зі значним покращенням
Результати метааналізу показали, що пацієнти, які отримували амоксицилін, одужували ймовірніше (2 дослідження) (сукупний ВР = 1,49, 95% ДІ від 1,18 до 1,88, р = 0,001) або більш імовірно клінічно одужають або матимуть значне покращення (2 дослідження) (сукупний ВР = 1,20, 95% ДІ від 1,05 до 1,37, р = 0,007). Аналогічним чином метааналіз показав, що пацієнти, які отримували пеніцилін V, одужували ймовірніше (2 дослідження) (сукупний ВР = 1,79, 95% ДІ від 1,05 до 3,05, р = 0,03) або більш імовірно клінічно одужають або матимуть значне покращення (2 дослідження) (сукупний ВР = 1,25, 95% ДІ від 1,01 до 1,54, р = 0,04).
Узагальнення для закладів первинної медичної допомоги
Обидва дослідження з використанням амоксициліну проводились у закладах первинної медичної допомоги із загальною вибіркою дослідження з 303 дорослих пацієнтів. Однак тільки 1 з 2 досліджень із пеніциліном було проведене в закладі первинної медичної допомоги з вивченням зразків 85 дорослих пацієнтів.
Хоча результати значні як для амоксициліну, так і пеніциліну, вони повинні бути інтерпретовані дуже обережно, тому що ані рентгенівське, ані аспіраційне дослідження не використовувалось у плановому порядку й не зазначалося в закладах первинної медичної допомоги. Таким чином, ці результати не можуть бути узагальнені для пацієнтів зі скаргою на синусит у закладах первинної медичної допомоги, де дія антибіотиків, імовірно, буде меншою. Група піддослідних у даному огляді також була відносно невеликою — тільки 375 дорослих пацієнтів.
З метою вирішення питання щодо маленького розміру вибірки та узагальнення дослідження в огляді Кокрейна (Вільямс мол. і співавт., 2003) також був визначений поточний МІДП, заснований на первинній медичній допомозі (Янг і співавт., 2008), який досліджував 2547 пацієнтів віком від 12 років і старше (у 9 РКВ) із клінічними ознаками та симптомами риносинуситу. З цього МІДП були виключені пацієнти, якщо вони були хоча б частково діагностовані на підставі результатів візуального огляду, лабораторних випробувань або бактеріальної культури, тому що в закладах первинної медичної допомоги такі методи зазвичай не використовуються і не рекомендуються.
Результати цього МІДП показали, що 15 пацієнтів повинні були отримати призначення антибіотиків для одужання додаткового пацієнта [95% ДІ КППЛ (користь) 7 до КППЛ (шкода) 190]. У цьому аналізі індивідуальних даних пацієнтів СШ загального ефекту лікування антибіотиками порівняно з плацебо становив 1,37 (95% ДІ від 1,13 до 1,66). Подальший аналіз підгрупи також показав, що у пацієнтів із симптомом гнійних виділень у глотці захворювання мало триваліший перебіг із КППЛ = 8 [95% ДІ КППЛ (користь) 4 до КППЛ (шкода) 47]. Було також проаналізовано приріст окремих базових ознак або симптомів, що свідчать про одужання, якщо пацієнт не отримував лікування, і СШ для одужання, якщо отримував лікування. Аналіз показав, що пацієнти, які були старші, які повідомляли про довші симптоми або більш тяжкі симптоми, потребували більше часу для одужання, але при цьому вони не мали більше переваг від використання антибіотиків, ніж інші пацієнти [вік: шанси на одужання за відсутності лікування дорівнювали 0,88 (95% ДІ від 0,81 до 0,96), СШ одужання, якщо проводилось лікування, дорівнювало 1,04 (95% ДІ від 0,92 до 1,18); тривалість симптомів: шанси на одужання за відсутності лікування дорівнювали 0,90 (95 % ДІ від 0,81 до 0,99), СШ одужання, якщо проводилось лікування, дорівнювало 0,95 (95% ДІ від 0,82 до 1,10); тяжкість симптомів: шанси на одужання за відсутності лікування дорівнювали 0,93 (95% ДІ від 0,90 до 0,91), СШ одужання, якщо проводилось лікування, дорівнювало 0,99 (95% ДІ від 0,93 до 1,05)]. Цей МІДП показав, що антибіотики не виправдані для дорослих пацієнтів зі скаргами на риносинусит, навіть якщо пацієнт повідомляє про продовження симптомів протягом понад 7–10 днів. Хоча гнійні виділення в глотці мали деяке прогностичне значення, все ще необхідно пролікувати вісім пацієнтів із цим симптомом додатково для одужання одного пацієнта.
Короткі висновки цього огляду Кокрейна свідчать, що для гострого риносинуситу (визначений як гострий гайморит у Вільяма мол. і співавт., 2003), підтвердженого за допомогою рентгенографії або аспірації, антибіотики збільшують клінічну імовірність одужання. Тим не менше ці результати не можуть бути узагальнені для пацієнтів у Великобританії в закладах первинної медичної допомоги, де ані аспірація, ані рентгенографія не використовуються і не рекомендуються. Ця думка була підтримана МІДП (Янг Дж. і співавт., 2008) (у якого критерієм включення було лікування в закладах первинної медичної допомоги), де результати показали, що антибіотики не виправдані для лікування дорослих пацієнтів зі скаргою на риносинусит, навіть якщо пацієнт повідомляє про продовження симптомів протягом більше 7–10 днів.
2.2. Стратегії введення антибіотиків при респіраторних інфекціях
2.2.1. Вступ
У попередньому розділі були наведені докази, що лежать в основі обґрунтування розробки цієї короткої клінічної настанови. Існують вірогідні докази того, що антибіотики мають обмежену ефективність у лікуванні більшості РІ, що лікуються у дорослих та дітей в закладах первинної медичної допомоги.
Стратегію невикористання антибіотиків або їх відкладеного призначення для скорочення неналежного призначення антибіотиків при РІ активно лобіювали з кінця 1990-х років (Little, 2005). Потенційною перевагою стратегії відкладеного призначення є те, що вона передбачає «гарантоване лікування» — набір швидких заходів для незначної кількості пацієнтів, у яких виникли ускладнення чи значно погіршуються симптоми. Пацієнти, які розраховують на призначення антибіотиків, можуть більш імовірно погодитися з такою схемою, ніж зі стратегію непризначення, і це може сприяти збереженню відносин лікаря і пацієнта.
Коментар робочої групи: у Шотландії «гарантоване лікування» — програма медичного обслуговування — одна із програм соціально-економічного захисту незахищених верств населення. Цією програмою передбачається, що пацієнту може бути виписаний рецепт на антибіотик, скористатися яким він може впродовж декількох днів, якщо для цього буде потреба. При такому варіанті пацієнту не потрібно повторно відвідувати лікаря.
Отже, існує необхідність визначити, чи є використання стратегій непризначення або відкладеного призначення антибіотиків клінічно й економічно ефективним порівняно з використанням стратегії призначення антибіотиків. Важливо також визначити переваги від використання поліграфічних інформаційних буклетів або структурованих усних інформаційних повідомлень для висвітлення обраної стратегії застосування антибіотика. Стратегія відкладеного призначення антибіотиків може бути реалізована в закладах первинної медичної допомоги декількома способами: рецепт може видаватися під час консультацій із рекомендацією використання, тільки якщо симптоми зберігатимуться або погіршуватимуться, або ж видати рецепт пацієнту при повторному візиті у приймальні загальної практики (хірургії). Важливо визначити, який із цих методів реалізації є найбільш ефективним.
Для того, щоб зробити рекомендації якомога більш корисними для лікарів, було необхідно надати конкретну інформацію про можливу тривалість хвороби для кожного з п’яти розглянутих станів. Очікувана тривалість хвороби є фактором у прийнятті рішення про те, коли почати відкладене призначення. Проведення систематичного огляду тривалості захворювань виходить за рамки цієї короткої клінічні настанови. Тим не менше дані з клінічних випробувань та інших відповідних досліджень були використані на підтримку узгоджених рекомендацій ГРН у цій галузі.
2.2.2. Огляд
Ми виявили 2 систематичних огляди і 12 опублікованих досліджень про ефективність стратегій непризначення та відкладеного призначення антибіотиків при лікуванні РІ порівняно зі стратегією негайного призначення антибіотиків. У 2 систематичних оглядах не проводилось жодного метааналізу через значну гетерогенність між дослідженнями. Гетерогенність полягала у варіюванні лікування та симптомів різних РІ і способів та тривалості відкладеного призначення. Обидва ці огляди таким чином забезпечили систематичний описовий огляд. Огляд Кокрейна (Сперлінг і співавт., 2007) включав 9 РКВ і 1 огляд (Arroll та співавт., 2003), 4 РКВ і 1 контрольоване дослідження до і після. Всі 4 РКВ в огляді Arroll та співавт. (2003) були також включені в огляд Кокрейна.
Крім 2 систематичних оглядів 29 окремих опублікованих досліджень були також залучені на основі вивчення абстрактів. З цих 29 досліджень тільки 12 були включені в огляд доказів (12 досліджень не були актуальними, 4 були виключені, оскільки вони не мали РКВ, й одному не вистачало узагальнення, тому що воно було проведене в одній із країн, що розвиваються). З 12 включених РКВ 8 дублювали 8 РКВ, представлених у систематичному огляді Кокрейна; було виявлено 1 додаткове дослідження, що не було включено в огляд Кокрейна, і ще 3 дослідження розглядали використання конкретних інформаційних буклетів або структурованих роз’яснень щодо стратегій призначення антибіотиків при РІ. Усі 12 досліджень були індивідуально оцінені й наведені в таблицях і профілях GRADE (Робочої групи з розробки, оцінки та експертизи рівня обґрунтованості клінічних рекомендацій). Щодо методології GRADE, див. розділ 4.2.7.
З 12 включених РКВ 3 були з ГСО (1 був із Великобританії із закладу загальної практики, 1 — зі США з педіатричного відділення невідкладної допомоги і 1 — із педіатричного клінічного університету США), 2 були з кашлю (обидва з британських закладів загальної практики); 3 були з болю в горлі (1 із Великобританії із закладу загальної практики та 2 зі США з приватних педіатричних практик) і 1 стосувалося застуди (із закладу загальної практики з Нової Зеландії). Дослідження не розглядали гострий риносинусит. З цих 9 досліджень 4 були відкритими державними РКВ. Відкритим державним випробуванням не вистачало внутрішньої валідності, але вони прагнули до максимальної зовнішньої валідності для того, щоб результати відображали повсякденну практику більш реально та більш узагальнено (Франсен та ін., 2007; Годвін та ін., 2003). Відкриті прагматичні випробування підходять для відповіді на питання, що стосуються ефективності та оцінки результатів у ситуації, коли сприйняття і поведінка у повсякденній практиці і знання пацієнта про лікування є важливими чинниками. Решта 3 РКВ (з 12) стосувалися використання конкретних інформаційних буклетів або структурованих пояснень щодо стратегій призначення антибіотиків при РІ (2 проведені у Великобританії у закладах загальної практики і 1 — у закладі первинної медичної допомоги в Ізраїлі).
Інформація щодо перебігу хвороб або звичайної тривалості перебігу п’яти РІ була визначена різними джерелами. Середня тривалість гострого середнього отиту становить близько 4 днів (Little та ін., 2001); середня тривалість гострого кашлю/гострого бронхіту становить близько 3 тижнів (Little та ін., 2005); симптоми, що супроводжують гострий біль у горлі/гострий фарингіт/гострий тонзиліт, тривають у середньому 1 тиждень (Little та ін., 1997); середня тривалість симптомів застуди становить близько 1,5 тижня (Хайкінен та Ярвінен, 2003), а середня тривалість гострого риносинуситу становить близько 2,5 тижня (Вільямсон та співавт., 2007).
У цілому якість доказів була хорошою, і ці дослідження надали доказову базу, що формує основу рекомендацій настанови. Були певні труднощі в узагальненні та доведенні ефективності відкладеного призначення антибіотиків або непризначення як стратегії лікування самообмежувальних РІ. Це було спричинене значними розбіжностями в таких факторах, як популяції пацієнтів, методи відкладення призначення антибіотиків, тривалість відкладення призначення антибіотиків і критерії оцінки. Використання підходу GRADE у підсумовуванні доказів виявилося корисним у вирішенні цих проблем. Щодо повних профілів доказів GRADE див. додаток 4.
Коментар робочої групи: додатки до NICE clinical guideline 69 «Respiratory tract infections — antibiotic prescribing» (2008) у вигляді окремих документів можна знайти на веб-сайті NICE: http://www.nice.org.uk/nicemedia/live/12015/41307/41307.pdf.
2.2.3. Клінічна та економічна складові ефективності стратегій призначення антибіотиків при респіраторних інфекціях
Рекомендація 1.1.1. При першому особистому контакті з пацієнтом у закладі первинної медичної допомоги та відділенні невідкладної допомоги дорослим і дітям (від 3 місяців і старше) з історією, яка потенційно передбачає розвиток наступних станів, необхідно провести клінічне обстеження:
— гострий середній отит;
— гострий біль у горлі/гострий фарингіт/гострий тонзиліт;
— застуда;
— гострий риносинусит;
— гострий кашель/гострий бронхіт.
Клінічне обстеження повинно включати анамнез (симптоми, використання безрецептурних препаратів або самолікування, попередню історію хвороби, відповідні фактори ризику, відповідні супутні хвороби) і, якщо необхідно, слід провести експертизу для виявлення відповідних клінічних ознак.
Рекомендація 1.1.2. Побоювання та очікування пацієнтів або їх батьків/опікунів повинні бути визначені та враховуватися при узгодженні використання однієї з трьох стратегій призначення антибіотиків (без призначення, із відкладеним призначенням і з негайним призначенням).
Рекомендація 1.1.3. Стратегії непризначення антибіотиків або стратегія відкладеного призначення антибіотиків повинна бути узгоджена з пацієнтом при таких станах:
— гострий середній отит;
— гострий біль у горлі/гострий фарингіт/гострий тонзиліт;
— застуда;
— гострий риносинусит;
— гострий кашель/гострий бронхіт.
Залежно від клінічної оцінки тяжкості стану для пацієнтів у наступних підгрупах може також розглядатися стратегія негайного призначення антибіотиків (разом зі стратегією непризначення антибіотиків або відкладеного призначення антибіотиків):
— двосторонній ГСО у дітей віком до 2 років;
— ГСО у дітей з отореєю;
— гострий біль у горлі/гострий фарингіт/гострий тонзиліт за наявності трьох або більше критеріїв Сентора4.
Рекомендація 1.1.4. При всіх стратегіях призначення антибіотиків пацієнти повинні отримати:
— поради щодо звичайного природного перебігу хвороби, у тому числі щодо середньорічної загальної тривалості хвороб (до і після спостереження лікаря):
– гострий середній отит: 4 дні;
– гострий біль у горлі/гострий фарингіт/гострий тонзиліт: 1 тиждень;
– застуда: 1,5 тижня;
– гострий риносинусит: 2,5 тижня;
– гострий кашель/гострий бронхіт: 3 тижні;
— поради про лікування симптомів, включаючи гарячку (зокрема, анальгетики та жарознижуючі засоби). Для отримання інформації про гарячку у дітей молодше 5 років див. «Гарячкові захворювання у дітей» (клінічна настанова NICE 47).
Коментар робочої групи: лікування симптомів може включати нестероїдні протизапальні засоби; препарати, що стимулюють альфа- та альфа- + бета-адренорецептори; анальгетики та антипіретики; блокатори Н1-рецепторів; засоби, що застосовуються при захворюваннях порожнини носа; антисептичні засоби; препарати, що стимулюють відхаркування; ненаркотичні протикашльові препарати; протикашльові препарати центральної дії; муколітичні препарати; бета-адреностимулятори; ферментні препарати та ін. У терапію можуть включатися комбінації препаратів з перерахованих груп.
Рекомендація 1.1.5. Якщо буде прийнята стратегія непризначення антибіотиків, пацієнт повинен отримати:
— підтвердження того, що антибіотики не потрібні негайно, тому що вони, скоріше за все, матимуть незначний вплив на симптоми і можуть мати побічні реакції, наприклад, діарею, блювання і висип;
— клінічний огляд, якщо стан погіршується або затягується.
Рекомендація 1.1.6. Якщо буде прийнята стратегія відкладеного призначення антибіотиків, пацієнт повинен отримати:
— підтвердження того, що антибіотики не потрібні негайно, тому що вони, скоріше за все, матимуть незначний вплив на симптоми і можуть мати побічні реакції, наприклад, діарею, блювання і висип;
— поради про використання відкладеного призначення, якщо симптоми не згасають відповідно до передбаченого перебігу хвороби або якщо відбувається значне погіршення симптомів;
— рекомендацію щодо повторного візиту, якщо спостерігатиметься значне погіршення симптомів, незважаючи на використання відкладеного призначення.
Рецепт при відкладеному призначенні може бути виданий пацієнту або залишений в узгодженому місці, щоб пацієнт забрав його пізніше.
Огляд доказів
Гострий середній отит (ГСО)
Три дослідження були включені в огляд ГСО (Little та ін., 2001; МакКормік та ін., 2005; Спіро та ін., 2006). Пацієнти, які вивчалися в дослідженні Спіро, були дітьми з діагнозом ГСО віком від 6 місяців до 12 років; у дослідженні Little брали участь діти з ГСО віком від 6 місяців до 10 років. У дослідженні МакКорміка брали участь діти віком від 6 місяців до 12 років з ГСО (визначені з використанням моніторингового індексу тяжкості ГСО).
Три дослідження проводились у різних закладах: дослідження Спіро було проведене в педіатричному відділенні швидкої допомоги у США, дослідження МакКорміка було проведене в медичному відділенні педіатричної клініки Техаського університету, а дослідження Little було проведено в 42 закладах загальної практики в південно-західній Англії.
Дослідження відрізнялися за критеріями включення. У дослідження Спіро діти були включені, якщо вони мали клінічний діагноз ГСО у відділенні невідкладної допомоги, у дослідження Little були включені діти з гострим болем у вусі (оталгією) та отоскопічними ознаками гострого запалення барабанної перетинки (приглушеність або помутніння з еритемою, опуклість або перфорація). Однак, якщо діти були занадто малими для фіксування болю у вусі, то отоскопічних доказів було достатньо для включення в дослідження. Діти в дослідженні МакКорміка були включені до спостереження, якщо в них були симптоми інфекції вуха, отоскопічні докази ГСО, включаючи виділення з середнього вуха, і нетяжкий ГСО (табл. 9).
Коментар робочої групи: станом на 05.12.2013 р. в Україні зареєстрований один лікарський засіб, що містить антипірен.
В Україні як анальгетики в комплексній терапії інфекційних захворювань використовують парацетамол, ібупрофен, мефенамінову кислоту, кислоту ацетилсаліцилову, метамізол натрію, бензокаїн, лідокаїн, флурбіпрофен та комбінації цих препаратів (табл. 10).
Доказові дані
Три великих випробування обґрунтовують доцільність відкладеного призначення антибіотиків як стратегії лікування пацієнтів із підозрою на ГСО.
— У дітей із ГСО, які використали стратегію відкладеного призначення антибіотиків, застосування антибіотиків скоротилося на 63 % порівняно з дітьми, до яких застосували стратегію негайного призначення.
— Одне велике дослідження хорошої якості встановило, що не було жодних істотних відмінностей між стратегіями негайного і відкладеного призначення антибіотиків щодо зниження «тяжкості» вушного болю в дітей. Об’єднані результати 2 інших досліджень дозволяють припустити, що стратегія негайного призначення мала помірну ефективність у зниженні числа дітей із болем у вусі порівняно зі стратегією відкладеного призначення. Тим не менше дія антибіотиків може бути перебільшена за рахунок проведення знеболення шляхом призначення лікарських засобів з ефектом системного знеболення (парацетамол, ібупрофен) у першому випробуванні, так і поєднання знеболення шляхом призначення лікарських засобів з ефектом системного знеболення та знеболюючих вушних крапель.
— Діти з підозрою на ГСО на 12 % менш схильні до розвитку діареї при застосуванні стратегії відкладеного призначення порівняно зі стратегією негайного призначення (КППЛ = 8).
— Стратегія негайного призначення знижує кількість нічних ускладнень у дітей із підозрою на ГСО порівняно зі стратегією відкладеного призначення.
— Два дослідження свідчать про задоволеність пацієнтів (батьків/опікунів). У цілому батьки/опікуни дітей у першому дослідженні (у якому їх попросили повернутися, щоб взяти відкладений рецепт) були задоволені обома стратегіями (77 % — відкладеним призначенням; 91 % — негайним). В іншому дослідженні (у якому відкладений рецепт був наданий під час консультації), з огляду на результати, батьки/опікуни дітей з ГСО були однаково задоволені як стратегією відстроченого, так і негайного призначення.
— На 30 % більше батьків/опікунів дітей, яким була запропонована стратегія негайного призначення, вважали, що антибіотики ефективні, порівняно з батьками/опікунами дітей, яким було запропоновано стратегію відкладеного призначення.
Обґрунтування рекомендацій
ГРН визнала, що 3 включені дослідження мали досить хорошу якість, окрім того, що кількість дітей у них була обмеженою. Виходячи з доказів, поданих вище, ГРН дійшла висновку, що порівняно зі стратегією відкладеного призначення стратегія негайного призначення за умови незначних вигод у вигляді скорочення болю у вусі і скорочення кількості нічних ускладнень збільшила застосування антибіотиків і, скоріше за все, лише медикаментозно обтяжує перебіг самообмежувальних хвороб. Тим не менше ГРН також вважає, що переваги негайного призначення антибіотиків були дуже обмежені, бо на 3-й день у дітей ще був слабкий вушний біль, і виглядає сумнівним, що ці невеликі позитивні ефекти переважають наявність діареї при застосуванні стратегії негайного призначення антибіотиків. ГРН також розглядала результати задоволеності батьків/опікунів і зазначила, що загальний рівень задоволеності був високим для обох стратегій. Тим не менше ГРН вважає, що високий рівень задоволеності стратегією негайного призначення порівняно з використанням стратегії відкладеного призначення в першому випробувані (Спіро і співавт., 2006) може бути результатом способу реалізації такої стратегії (у цьому випробуванні батькам дали відкладене призначення під час консультації, замість того щоб попросити їх повернутися за ним до хірургічної приймальні). ГРН погодилась, що цей висновок є попереднім і залишається місце для обговорення і що подальші дослідження повинні проводитися з урахуванням способу надання допомоги в рамках стратегій відкладеного призначення з метою уточнення результатів консультування з приводу відповідної стратегії. У цілому шляхом зважування невеликих вигод і ризиків діареї ГРН вважає, що стратегія непризначення або відкладеного призначення має бути запропонована дітям із ГСО, які мають нижчі ризики розвитку ускладнень. Однак через відсутність випробувань серед важливих підгруп порівняння стратегій негайного та/або відкладеного призначення зі стратегією непризначення ГРН вважає, що повинні бути розроблені консенсусні рекомендації про ймовірні симптоматичні переваги від використання антибіотиків для конкретних підгруп пацієнтів. ГРН вирішила, що на основі метааналізу даних окремих хворих (Роверс і співавт., 2006), представленого в розділі 2.1.2, стратегії негайного призначення можуть бути розглянуті для двох підгруп хворих залежно від клінічної оцінки тяжкості та вподобань пацієнтів. Дві підгрупи становлять діти віком до 2 років із двостороннім ГСО і діти з ГСО та отореєю.
Гострий кашель/гострий бронхіт
Два дослідження були включені в огляд гострого кашлю/гострого бронхіту: Доуель та ін. (2001) та Little та ін. (2005). Група в дослідженні Доуеля складалася з пацієнтів віком понад 16 років із гострим кашлем як основною скаргою. Популяція пацієнтів у дослідженні Little складалася з дітей віком від 3 років і старше з неускладненими гострими інфекціями нижніх дихальних шляхів (тривалістю 21 день або менше). Обидва дослідження були проведені у Великобританії в закладах первинної медичної допомоги (загальної практики): дослідження Доуеля було проведене у 22 загальних практиках із 48 в Шотландії; дослідження Little охопило 37 закладів на південному заході Англії.
Критерії включення відрізнялися в дослідженнях. У дослідження Доуеля були включені пацієнти з гострим кашлем з ринітом, задишкою, харкотинням, гарячкою, болем у горлі або відчуттям тяжкості у грудях або без них. У дослідження Little були включені пацієнти з кашлем (з тривалістю 21 день або менше) як основним симптомом і принаймні одним симптомом або ознакою локалізації інфекції в нижніх дихальних шляхах (мокрота, біль у грудях, задишка, хрипи).
Доказові дані
Одне велике і одне трохи менше випробування забезпечили хороші дані щодо ефективності відкладеного призначення антибіотиків і/або їх непризначення як стратегії боротьби з гострим кашлем.
— Немає істотних відмінностей у скороченні тривалості симптомів (кашлю) і тяжкості симптомів між трьома стратегіями використання антибіотиків (без призначення, із відкладеним призначенням і з негайним призначенням) у дорослих і дітей.
— Порівняно зі стратегією негайного призначення як стратегія відкладеного призначення, так і стратегія непризначення значно знизили вживання антибіотиків при гострому кашлі в дорослих і дітей (на 76 і 80 % відповідно). Немає істотної різниці у застосуванні антибіотиків між групами стратегії відкладеного призначення і стратегії непризначення.
— Частота діареї у пацієнтів, яким запропонована стратегія негайного застосування антибіотиків і стратегія відкладеного призначення, така ж, як і у пацієнтів, до яких застосована стратегія непризначення антибіотиків.
— Загалом дорослих пацієнтів і батьків/опікунів дітей із гострим кашлем задовольняють усі три стратегії (негайного призначення, з відкладеним призначенням і непризначення) (86, 77 і 72 % задоволених відповідно). Порівняно зі стратегією негайного призначення дорослі пацієнти і батьки/опікуни дітей, яким запропонували стратегії відкладеного призначення або непризначення антибіотиків, були значно менш задоволені (на 9 і 14 % відповідно). Однак немає жодної істотної відмінності в задоволеності між стратегією непризначення і стратегією відкладеного призначення.
— Дорослі пацієнти і батьки/опікуни дітей, яким були запропоновані стратегії непризначення або відкладеного призначення, менше схильні вважати, що антибіотики ефективні, порівняно з тими, кому була запропонована стратегія негайного призначення (35 і 28 % відповідно менш схильні вірити). Тим не менше немає жодних істотних відмінностей у сприйнятті ефективності антибіотиків між тими, кому запропонували стратегію непризначення, і тими, кому запропонували стратегію відкладеного призначення.
— Зафіксовано менше повторних візитів протягом наступного місяця зі скаргами на гострий кашель серед пацієнтів, яким запропонували стратегію негайного або відкладеного призначення, порівняно з тими, до кого застосовувалась стратегія непризначення. Немає жодних відмінностей у повторній відвідуваності при застосуванні стратегій відкладеного і негайного призначення.
Обґрунтування рекомендацій
ГРН визнала, що обидва включених дослідження були хорошої якості. З огляду на наведені вище доказові дані ГРН дійшла висновку, що стратегії непризначення і відкладеного призначення антибіотиків значно знизили застосування антибіотиків і розвіяли переконання, що антибіотики були ефективними в пацієнтів із гострим кашлем. Не було виявлено жодних істотних відмінностей у тривалості терапії і тяжкості симптомів порівняно зі стратегією негайного призначення. ГРН також вважає, що доказові дані щодо задоволеності пацієнтів показали, що в цілому пацієнти з кашлем задоволені всіма трьома стратегіями призначення (задоволення від усіх стратегій вище рівня 70 %). ГРН вважає, що відмінності в рівнях задоволеності між стратегією непризначення/відкладеного призначення і стратегією негайного призначення можуть бути викривлені способом реалізації (наприклад, способом отримання відкладеного рецепту, наданою усною консультацією або кількістю інформації, поданої щодо симптоматичного лікування) і не відображають відмінності в стратегіях призначення антибіотиків як таких. Проте ГРН визначила, що в даний час не існує спеціальних досліджень із приводу кращого способу реалізації стратегії відкладеного призначення. Зрештою, ГРН вважає, що стратегії непризначення або відкладеного призначення повинні бути запропоновані пацієнтам із гострим кашлем, якщо вони не експоновані до високого ризику розвитку ускладнень.
Гострий біль у горлі/гострий фарингіт/гострий тонзиліт
Три дослідження були включені в огляд гострого болю в горлі (з підозрою на фарингіт або тонзиліт): Гербер та ін. (1990), Little та ін. (1997) і Пічічеро та ін. (1987). Усі 3 включених дослідження працювали з різними групами пацієнтів. У дослідженні Little основну масу становили пацієнти віком від 4 років і старше з болем та аномальними фізичними ознаками у горлі (84 % мали тонзиліт або фарингіт). На противагу цьому інші 2 дослідження включали лише пацієнтів із гострим фарингітом, які були позитивними на культуру БГСА: у Пічічеро досліджувались пацієнти віком від 4 до 18 років, а у Гербера — від 2 до 22 років.
З точки зору місця проведення дослідження тільки одне (Little) було проведене у Великобританії в закладах первинної медичної допомоги (лікарні загальної практики — 25). 2 інших дослідження базувались в одній дитячій клініці в США. Існують також відмінності у способах дослідження між трьома дослідженнями: в одному дослідженні відкладеного призначення (Little та ін., 1997) пацієнтів попросили повернутися через 3 дні, щоб забрати рецепт, який був залишений у хірургічній приймальні. У 2 дослідженнях відкладеного призначення таблетки плацебо були використані як метод відкладення протягом перших 48 годин, а потім проводився 10-денний курс антибіотиків.
Критеріями включення в дослідження Little були біль у горлі як основний або допоміжний симптом та ненормальні фізичні ознаки, локалізовані в горлі (запалення мигдаликів або горла, гнійний ексудат, запалення глотки або піднебіння або шийний лімфаденіт). Для дітей віком до 12 років, які були менш схильні скаржитися на біль у горлі, ненормальні фізичні ознаки в горлі вважались достатніми для включення.
Критерієм включення дітей у дослідження Пічічеро була наявність трьох із нижче наведених ознак або симптомів, притаманних діагнозу БГСА-позитивного фарингіту:
— біль у горлі при ковтанні;
— ексудат на мигдалинах або насичене почервоніння горла;
— біль у передніх шийних лімфатичних вузлах;
— гарячка 100,6 °F (38,1 °С) або вище ректально чи 99,6 °F (37,6 °С) або вище перорально в анамнезі;
— системна токсичність, що характеризується безсонням, нездужанням, млявістю та іншими симптомами;
— результат за шкалою Бріза 32 або вище.
Критеріями включення в дослідження Гербера були позитивний результат Q-тесту стрептокока і позитивна культура зразків з горла.
Доказові дані
Два великих випробування і одне невелике дослідження забезпечили дані змішаної якості щодо ефективності відкладеного призначення і/або непризначення антибіотиків як стратегії лікування гострого болю в горлі. Наявні дані свідчать про наступне.
— Як стратегія непризначення, так і стратегія відкладеного призначення скорочують споживання антибіотиків при болі у горлі у дорослих і дітей у порівнянні зі стратегією негайного призначення (на 13 і 31 % відповідно). Крім того, стратегія непризначення додатково зменшує споживання антибіотиків на 18 % порівняно зі стратегією відкладеного призначення.
— Немає відмінностей щодо полегшення симптомів на 3-й день між трьома стратегіями призначення антибіотиків при лікуванні болю в горлі у дорослих і дітей.
— Велике дослідження високої якості показує, що немає жодних відмінностей у скороченні тривалості болю в горлі між трьома стратегіями призначення антибіотиків у дорослих і дітей.
— Одне невелике дослідження надає докази середньої якості, що стратегія негайного призначення справляє помірно позитивний вплив на зниження тяжкості симптомів болю в горлі порівняно зі стратегією відкладеного призначення у дітей із більш тяжким (БГСА-підтвердженим) фарингітом.
— Дані свідчать про те, що немає жодних істотних відмінностей у випадках діареї між трьома стратегіями призначення антибіотиків у дорослих і дітей при використанні антибіотиків вузького спектра.
— Більшість дорослих пацієнтів та батьків/опікунів дітей із болем у горлі задоволені трьома стратегіями призначення антибіотиків (з рівнем задоволеності понад 90 %). Дорослі пацієнти і батьки/опікуни дітей, які обирають стратегію непризначення, трохи менше (на 6 %) задоволені, ніж ті, які обрали стратегію негайного призначення. Тим не менше немає жодних відмінностей між стратегією відкладеного і негайного призначення або між стратегією відкладеного призначення і стратегією непризначення з точки зору задоволеності пацієнтів.
— Дорослі пацієнти і батьки/опікуни дітей із болем у горлі менше схильні вважати, що антибіотики ефективні, якщо їм пропонують стратегію відкладеного призначення або стратегію непризначення, порівняно зі стратегією негайного призначення (на 27 і 32 % рідше відповідно). Однак немає жодної різниці між стратегіями відкладеного призначення і непризначення з точки зору очікуваної ефективності антибіотиків.
— Одне велике випробування з високою якістю даних показує, що немає жодних істотних відмінностей у повторному консультуванні зі скаргою на біль у горлі протягом 1 місяця між трьома стратегіями призначення антибіотиків у дорослих і дітей. Тим не менше дорослі та діти, яким пропонується стратегія негайного призначення, вірогідніше повторно звертаються зі скаргами на біль у горлі протягом 1 року порівняно з тими, кому пропонуються стратегія відкладеного призначення або непризначення (на 31 і 14 % частіше відповідно), а дорослі та діти, яким пропонується стратегія непризначення, на 17 % більш імовірно повторно консультуються зі скаргами на біль у горлі протягом 1 року порівняно з тими, яким пропонується стратегія відкладеного призначення.
Обґрунтування рекомендацій
ГРН визнала, що 3 включених дослідження були змішаної якості. Виходячи з наведених вище доказових даних, ГРН дійшла висновку, що у пацієнтів з гострим болем у горлі стратегії відстроченого призначення і непризначення значно скоротили споживання антибіотиків і зменшили переконаність, що антибіотики були б ефективніші. ГРН також розглянула ефективність різних стратегій призначення антибіотиків і дійшла висновку, що стратегії відкладеного призначення і непризначення не показали істотних відмінностей у тривалості лікування симптомів або їх подолання порівняно зі стратегією негайного призначення. ГРН вважає, що єдине дослідження, що свідчить про певні позитивні ефекти негайного призначення антибіотиків для зменшення тяжкості симптомів гострого болю в горлі, пов’язане тільки з досліджуваною групою пацієнтів з підтвердженим БГСА-фарингітом. ГРН вважає, що це не підлягає узагальненню для закладів первинної медичної допомоги у Великобританії, тому що діагностичні тести, що визначають причину болю в горлі, у даний час зазвичай не використовуються. Тим не менше ГРН розглянула результати аналізу двосторонньої чутливості, проведеного в рамках економічної оцінки (див. розділ 4.2.9 та додаток 5). У цьому аналізі базова ймовірність розвитку ангіни й ефективність негайного призначення антибіотиків (як визначено імовірність усунення симптомів після 3 днів) одночасно змінювались у моделі. ГРН відзначила, що відносний ризик розвитку ускладнень залишався незмінним (тобто на базовому рівні) в аналізі. У той час як аналіз показав, що існують ситуації, у яких негайне призначення антибіотиків можна вважати економічно ефективним, ці ситуації залежали від сміливих спірних припущень. ГРН також вважає, що ці результати слід інтерпретувати з обережністю з двох основних причин. По-перше, відсутність відповідної оцінки корисності була важливим обмеженням економічного аналізу. По-друге, відсутність даних про частоту ускладнень унаслідок стратегії відкладення призначення антибіотиків зробила інтерпретацію результатів проблематичною. Отже, ГРН вважала, що можуть існувати виняткові ситуації, в яких негайне призначення може бути опцією на додаток до стратегії відкладеного призначення або непризначення антибіотиків. У таких ситуаціях вибір стратегії повинен бути обговорений із лікарем і пацієнтом/піклувальником. На основі двох досліджень з огляду Кокрейна (Dagnelie та співавт., 1996); Цварт та співавт., 2000) і систематичного огляду (Купер та співавт., 2001) у розділі 2.1.2, який розглядає симптоматичні переваги антибіотиків для підгруп пацієнтів з болем в горлі, ГРН вважає, що критерії Сентора можуть бути корисним засобом для виявлення осіб з гострим болем у горлі, які можуть отримати користь від негайного призначення антибіотиків. У той же час ГРН визнає, що ця стратифікація ризику не була вивчена в економічній моделі через обмеженість даних.
На закінчення ГРН дійшла консенсусу, що стратегії відкладеного призначення або непризначення повинні бути запропоновані пацієнтам із гострим болем у горлі, які не мають підвищених ризиків розвитку ускладнень. Проте залежно від уподобань пацієнта та клінічної оцінки тяжкості стратегії негайного призначення можуть бути розглянуті для підгрупи пацієнтів з трьома і більше критеріями Сентора на додаток до обґрунтування стратегій відкладеного призначення і непризначення антибіотиків.
Економічні аспекти сфери охорони здоров’я
Опубліковані роботи щодо економічних аспектів охорони здоров’я
Огляд літератури було проведено з метою визначити докази економічної ефективності по п’яти відповідних РКВ (докладніше див. розділ 2).
Були визначені декілька потенційно корисних досліджень (Анзай та ін., 2007; Балк та ін., 2001; Коко, 2007; Деві, 1994; Де Бок та ін., 2001; Діппель та ін., 1992; Хілнер і Сентор, 1987; Коскінен та ін., 2006; Нойнер та ін., 2003; Сингх та ін., 2006; Цеват і Котагал, 1999; Ван Хоу і Куснієр, 2006). У трьох дослідженнях вивчали економічну ефективність стратегій лікування синуситу (Анзай та ін., 2007; Балк та ін., 2001; Де Бок та ін., 2001), а два дослідження вивчали стратегії лікування середнього отиту (Коко, 2007; Коскінен та ін., 2006). Хільнер і Сентор (1987), Нойнер та ін. (2003) та Сінгх та ін. (2006) вивчали економічну ефективність діагностики та лікування дорослих хворих із фарингітом. Діппель та співавт. (1992), Цеват та Котагал (1999) та Ван Хоу і Куснієр (2006) досліджували діагностику та лікування дітей із фарингітом.
Тільки одне дослідження особливо ретельно вивчало стратегію відкладеного призначення порівняно зі стратегією непризначення у повному аналізі корисності витрат (Коко, 2007). Це дослідження було оцінене з якістю даних, а дані були зведені у таблицю доказів (див. додаток 6). Більшість досліджень розглядали стратегії діагностики РІ і не стежили за пацієнтами після отримання результатів. Немає жодного британського дослідження, яке б порівнювало відкладене призначення з негайним призначенням чи непризначенням антибіотиків при РІ, і не було виявлено жодних досліджень, які б розглядали застуду або гострий кашель/гострий бронхіт.
Коко (2007) досліджував економічну ефективність лікування ГСО. Метою цього дослідження, що базувалося в США, було оцінити витрати і їх корисність при використанні чотирьох варіантів лікування для дітей з ГСО віком від 6 місяців до 12 років.
Дослідження проводилось в закладах первинної медичної допомоги. Досліджувались чотири стратегії втручання: вичікувальна тактика, відкладене призначення, негайний курс п’ятиденного амоксициліну і негайний курс від 7 до 10 днів введення амоксициліну. Аналітична модель оцінки рішень була використана для оцінки ефективності додаткових витрат при чотирьох стратегіях шляхом порівняння короткострокових результатів і витрат на одну з 4 стратегій. Аналіз включив соціологічну складову і врахував немедичні втрати, пов’язані з втратою робочого часу батьками і транспортуванням. Часовий горизонт аналізу становив 30 днів. Автори стверджують, що це пов’язано з відсутністю доказів довгострокових порушень при середньому отиті, таких як повторні ГСО та пошкодження барабанної перетинки.
Оцінки ефективності клінічних параметрів, в тому числі недотримання, клінічні невдачі при дотриманні, неефективність лікування без дотримання, імовірність ускладнень (мастоїдиту), імовірність виникнення шлунково-кишкових побічних реакцій унаслідок застосування амоксициліну і ймовірність зазнати дерматологічних побічних реакцій, були взяті з різних джерел. Рівні недотримання були засновані на даних із міжнаціональних досліджень і клінічних випробувань. Клінічні дані щодо невдач були отримані з РКВ, прагматичних РКВ і міжнаціональних досліджень. Імовірності розвитку мастоїдиту були засновані на національній статистиці, а імовірності несприятливих подій були отримані з 4 досліджень, 3 з яких були клінічними випробуваннями. Дизайн четвертого дослідження був неясним. Спостережна вичікувальна стратегія розглянула поточну практику в Нідерландах і включила оцінку відсотку батьків, які не уникають консультації, а також розглянула вірогідність клінічної невдачі, заснованої на дослідженні, проведеному в Нідерландах.
Оцінки корисності були отримані з аналізу корисності витрат на антибіотики другого ряду, що проводилася в Канаді Охом та співавт. (1996). Корисність була оцінена при опитуванні лікарів при стандартизованому сценарії ГСО з комбінаціями побічних реакцій, виміряна за візуальною аналоговою шкалою, на якій 1 відповідає бездоганному здоров’ю, а 0 — смерті. Корисність із цього документа відповідає 1 дню перебування в кожному конкретному стані здоров’я. Втрачені дні якісного життя (ВДЯЖ, англ. QALD) були наведені окремо для кожного сценарію в моделі шляхом об’єднання питомої ваги корисності в дослідженні Оха та співавт. з кількістю днів, проведених у кожному стані здоров’я. Роки якісного життя (РЯЖ, англ. QALY) також були подані з використанням корисності з дослідження Оха та співавт.
Витрати розраховувалися для антибіотиків, включаючи амоксицилін, амоксицилін/клавуланат і цефтріаксон (тільки для мастоїдиту). Використання ресурсів і витрати розраховувалися для лікування мастоїдиту і включали госпіталізацію, амбулаторне лікування та витрати на медикаменти. Також була включена вартість амбулаторного консультування. Немедичні витрати, такі як витрати на няню, денний нагляд, пересування, паркування, та інші витрати, пов’язані з випадками простого ГСО, були виключені.
Стратегія використання амоксициліну протягом 7–10 днів була визначена як найбільш вигідна з погляду РЯЖ. Ця стратегія мала додаткове співвідношення витрат і результатів [коефіцієнт корисності витрат (ККВ, англ. ICUR)] у розмірі $ 55 900 за РЯЖ (£ 42 7005) порівняно з найменш витратним варіантом, яким було відкладене призначення. Спостережна вичікувальна стратегія була перевершена стратегією відкладеного призначення антибіотиків і стратегією 7–10-денного застосування антибіотиків. Стратегія 5 днів застосування амоксициліну була перевершена (за більшими витратами і меншим ефектом) стратегією 7–10-денного застосування антибіотиків. В односторонньому аналізі чутливості стратегія 7–10-денного застосування антибіотиків порівнювалась зі стратегією відкладеного призначення антибіотиків; факторами, що справили найбільший вплив на ККВ, були призначення амоксициліну, не пов’язані з охороною здоров’я фактори, клінічні консультації та витрати робочого часу. Іншими змінними, що справили найбільший вплив на ККВ, були імовірність невдачі лікування, імовірність шлунково-кишкових розладів, імовірність невідвідування, імовірність невикористання рецепту та корисність пропуску дня лікування. Автори повідомляють, що імовірнісний аналіз чутливості був проведений та продемонстрував, що 7–10 днів прийому амоксициліну були пов’язані з 61% вірогідністю утримання ККВ на рівні до $ 50 000 на РЯЖ порівняно зі стратегією відкладеного призначення антибіотиків. Жодних кривих прийнятності рентабельності представлено не було.
Важливим обмеженням цього дослідження є те, що воно не розглядає фінансові наслідки резистентності до антибіотиків. Автори дійшли висновку, що відкладене призначення є найменш витратним варіантом. Прийняття такої стратегії, як стверджувалося, призведе до істотної економії для платника і сприятиме зниженню використання антибіотиків при звичайних первинних самообмежувальних РІ, потенційно знижуючи вплив резистентності до антибіотиків.
Таким чином, існує явна нестача фактичних даних про ефективність стратегії відкладеного призначення антибіотиків порівняно зі стратегіями негайного призначення і непризначення антибіотиків для всіх розглянутих РІ. Зокрема, повністю відсутні докази щодо болю в горлі, кашлю, синуситу і застуди.
Економічна оцінка з нуля
Враховуючи брак порівняльних економічних оцінок стратегій відкладеного призначення і непризначення антибіотиків при РІ в закладах первинної медичної допомоги, було визнано доцільним здійснити економічний аналіз з нуля. Була розроблена модель для оцінки економічної ефективності стратегії відкладеного призначення антибіотиків порівняно зі стратегією негайного призначення чи непризначення антибіотиків для лікування одного з РІ, висвітленого в короткій настанові, — гострого болю в горлі. Рішення використовувати біль у горлі як основу економічного аналізу відображає той факт, що біль у горлі має високу поширеність та наявна достатня кількість клінічних доказів.
Економічна оцінка складалася з аналізу на основі дерева рішень, включаючи здійснення догляду при лікуванні пацієнтів із болем у горлі. Вона була заснована на відкритому рандомізованому дослідженні Little та ін. (1997). Це дослідження розглядало три стратегії призначень при болі в горлі. Пацієнти віком від 4 років і старше (без зазначення верхньої вікової межі) були рандомізовані на три групи: з призначенням антибіотиків, без призначення антибіотиків та з відкладеним призначенням антибіотиків у випадку, якщо симптоми не починають зменшуватись через 3 дні. Дерево рішень було побудовано і проаналізовано з використанням програми TreeAge Pro 2007 Suite (TreeAge Software, Inc.) і включало 1-річний горизонт. Дослідження було проведено у Великобританії в закладах первинної медичної допомоги (лікарні загальної практики) і тому надає прямі докази, на основі яких будується економічна модель. З огляду на те, що відмінності в корисності, імовірно, будуть дуже малі через гострий характер болю в горлі, заснований на випадках аналіз передбачає, що всі стратегії призначення антибіотиків були рівними за ефективністю з точки зору корисності, і тому проводиться як аналіз мінімізації витрат. Повна інформація про моделювання наведена в додатку 5.
Коментар робочої групи: додатки до NICE clinical guideline 69 «Respiratory tract infections – antibiotic prescribing» (2008) у вигляді окремих документів можна знайти на веб-сайті NICE: http ://www.nice.org.uk/nicemedia/live/12015/41307/41307.pdf.
Модель передбачає, що найменш витратним варіантом є стратегія відкладеного призначення антибіотиків. Ця стратегія пов’язана з очікуваною вартістю £ 14 на одного пацієнта порівняно з £ 16 і £ 45,50 для стратегій непризначення і негайного призначення антибіотиків відповідно. Різниця була в основному пов’язана зі скороченням витрат на призначення антибіотиків при застосуванні стратегії відкладеного призначення та ефективністю антибіотиків при зниженні рівня ускладнень. Імовірність ускладнень вважалась однаковою при відкладеному і негайному призначенні антибіотиків. У базовому варіанті деякі пацієнти, які розглядалися в групі непризначення антибіотиків, отримували негайне призначення антибіотиків, як це відображено в результатах випробування, на яких ця модель була заснована. Це було розглянуто в аналізі чутливості.
Коли в моделі розглядається корисність, додаткові вигоди між стратегіями незначні. Докази корисності для болю в горлі слабкі, і тому при аналізі базового випадку не враховується вплив на якість життя, пов’язану зі здоров’ям. Один аналіз чутливості застосовує корисність, що використовувалася Нойнером та співавт. (2003) щодо фарингіту. Результати показали, що не було жодних відмінностей у РЯЖ вище 0,0001 і, отже, результати не були клінічно значущими. ККВ для стратегії негайного призначення антибіотиків порівняно зі стратегією відкладеного призначення становила £ 3 628 772 на 1 РЯЖ. Стратегія відкладеного призначення антибіотиків перевершила стратегію непризначення антибіотиків (була менш дорогою і більш ефективною) в базовому варіанті.
В аналізі чутливості результати найбільш чутливі до базового ризику розвитку ангіни. Аналіз односторонньої чутливості проводився з метою оцінки впливу на результати моделі різних вихідних ризиків ускладнень. Цей аналіз показує, що вихідний ризик розвитку в пацієнтів ангіни має бути приблизно в 6 разів вище, щоб стратегію негайного призначення антибіотиків можна було вважати економічно ефективною. Двосторонній аналіз, що поєднує вихідний ризик ускладнень і ймовірність зняття симптомів після призначення антибіотиків, показує, що якщо імовірність зникнення симптомів через 3 дні після призначення антибіотиків становить від 30 і 60 %, базова ймовірність розвитку ангіни має бути більше ніж 0,12 (12 %) для визнання негайного призначення антибіотиків більш оптимальною стратегією (потрібно шестиразове збільшення вихідного ризику ускладнень).
Проводився окремий аналіз для з’ясування потенційної різниці в економічній ефективності кожної зі стратегій у групі дорослих і дітей, оскільки ймовірність розвитку ускладнень і фінансові наслідки терапії можуть різнитися між цими групами.
Обґрунтування рекомендацій
ГРН вважає, що наведений аналіз економічної ефективності показав, що економічно доцільно пропонувати стратегію відкладеного призначення для дорослих і дітей із гострим болем у горлі. Було також відзначено, що стратегія непризначення є прийнятною альтернативою для пацієнта/опікуна пацієнта, який не хоче вживати антибіотики. ГРН вважає, що стратегію негайного призначення можна вважати економічно ефективною для пацієнтів з високим вихідним ризиком ангіни.
Застуда
Тільки 1 дослідження було включене в огляд із застуди (Arroll і співавт., 2002). Група пацієнтів складалася з пацієнтів будь-якого віку із застудою, які просили призначення антибіотиків або чиї лікарі вважали, що пацієнти хотіли, щоб їм були призначені антибіотики. Дослідження було проведене в закладах первинної медичної допомоги: 15 сімейних терапевтів (лікарень загальної практики) із сімейних практик у Новій Зеландії.
Критерієм включення для даного конкретного дослідження був діагноз застуди (ІВДШ), заснований на ICHPPC-2 (Міжнародна класифікація проблем, пов’язаних зі здоров’ям, у закладах первинної медичної допомоги): наявність гострого запалення слизової оболонки глотки або носа за відсутності інших спеціально визначених респіраторних інфекцій.
Доказові дані
Дані свідчать про те, що стратегія відкладеного призначення знижує вживання антибіотиків на 46 % порівняно зі стратегією негайного призначення у дорослих і дітей із застудою.
Дані свідчать про те, що немає жодних клінічно значущих відмінностей у температурі й частоті симптомів застуди між дорослими й дітьми, яким запропонували стратегію відкладеного призначення і стратегію негайного призначення.
Немає відмінностей у ступені задоволеності пацієнтів і вірі в ефективність антибіотиків у дорослих та батьків/опікунів дітей із застудою між стратегіями відкладеного призначення і стратегією негайного призначення.
Обґрунтування рекомендацій
ГРН визнала, що докази були лише середньої якості. Виходячи з наведених вище доказових даних, ГРН дійшла висновку, що антибіотики не впливають на застуду позитивно; що застуда є самовиліковним станом. Тому стратегія негайного призначення не повинна пропонуватися пацієнтам без підвищеного ризику розвитку ускладнень.
Гострий риносинусит
Немає досліджень, що стосуються клінічної ефективності трьох різних стратегій призначення антибіотиків при гострому риносинуситі.
Обґрунтування рекомендацій
ГРН вважає, що хоча не було жодних доказів ефективності стратегій призначення антибіотиків при гострому риносинуситі, є обмежені докази ефективності антибіотиків при гострому риносинуситі (який у відповідному досліджені називається гострим верхньощелепним синуситом) із систематичного огляду рандомізованих плацебо-контрольованих випробувань (Вільямс мол. і співавт., 2003). Тим не менше на підставі метааналізу індивідуальних даних пацієнтів із риносинуситом (Янг і співавт., 2008) (див. розділ 2.1.2) ГРН досягла консенсусної думки, що ця умова повинна розглядатися таким же чином, як і інші чотири види РІ, включені до цієї настанови, тобто пацієнтам із гострим риносинуситом треба пропонувати стратегію відкладеного призначення антибіотиків, якщо вони не піддаються підвищеному ризику розвитку ускладнень.
Інформаційний буклет чи структуровані усні роз’яснення
Чотири дослідження були також включені в огляд використання конкретних інформаційних буклетів або структурованих роз’яснень щодо реалізації стратегій призначення антибіотиків. У буклетах містилася інформація про імовірний розвиток грудного кашлю, про те, що мається на увазі під «грудним кашлем», коли пацієнт повинен використовувати рецепт, чого пацієнти повинні уникати і щодо чотирьох способів полегшити грудний кашель (багато рідини, анальгетики, мікстура від кашлю або льодяники і лікування парами або інгаляція). При ГСО структуроване пояснення було коротким і включало опис розвитку ГСО, підтвердження того, що в більшості випадків діти відновлюються незалежно від призначення антибіотиків, інформацію про те, які ускладнення можуть виникнути пізніше незалежно від того, чи застосовуються антибіотики, і що батькам рекомендується у випадках високої температури або сильного болю давати дітям парацетамол відповідно до маси тіла дитини.
Було 5 досліджень (Гербер та ін., 1990; Little та ін., 2005; Макфарлейн та ін., 2002; Макфарлейн та ін., 1997; Пшетицький та ін., 2003). Дослідження Little стосувалося кашлю, Макфарлейн (2002) досліджував гострий бронхіт, Пшетицький вивчав ГСО, і Макфарлейн (1997) вивчав ІНДШ.
Група пацієнтів у дослідженні Little складалася з дітей віком від 3 років і старше з неускладненими гострими ІНДШ (тривалістю 21 день або менше), які звернулися до закладу первинної медичної допомоги. Група пацієнтів у дослідженні Макфарлейна складалася з дорослих від 16 років і старше з симптомами гострого бронхіту, який визначався як «нове гостре захворювання нижніх дихальних шляхів у дорослих, які до того були здорові» (у тому числі курці). Дослідження Пшетцького охоплювало дітей віком від 3 місяців до 4 років, які відвідали клініку сімейної практики та отримали діагноз ГСО; дослідження Макфарлейна (1997) включало раніше здорових дорослих (16 років і старше, включаючи курців), чия хвороба визначалась як ІНДШ. Три дослідження (Little і співавт., 2005, Макфарлейн і співавт., 2002, Макфарлейн і співавт., 1997) були проведені в закладах первинної медичної допомоги у Великій Британії. Дослідження Пшетицького проводилось на базі двох клінік первинної медичної допомоги в Ізраїлі.
Критеріями включення в дослідження кашлю Little були кашель (тривалістю 21 день або менше) як основний симптом і хоча б один симптом або ознака локалізації інфекції в нижніх дихальних шляхах (мокрота, біль у грудях, задишка або хрип). Критеріями включення в дослідження Макфарлейна (по гострому бронхіту) були: вік від 16 років і старше, раніше здорові і не під наглядом або лікуванням основної хвороби (наприклад, відсутність раніше діагностованої астми, ХОЗЛ, хвороби серця або діабету). Додатковими вимогами для включення були кашель як основний симптом, принаймні один інший симптом ІНДШ (мокротиння, задишка, хрип, дискомфорт у грудях або біль) за відсутності альтернативного пояснення (наприклад, діагноз синуситу, фарингіту або поява астми у пацієнта).
Критеріями включення в дослідження Макфарлейна (1997) щодо ІНДШ були: раніше здорові дорослі (не під спостереженням або лікуванням основного захворювання), які звернулися з ІНДШ (визначеного як новий кашель і принаймні один інший симптом ІНДШ, у тому числі мокротиння, задишка, хрип або біль у грудях, для яких не було жодного іншого пояснення). У дослідженні ГСО Пшетицького включенню підлягали діти віком від 3 місяців до 4 років з діагнозом ГСО (наприклад, гарячка 38 °С або вище, гнійні виділення з вуха і непрозорість або випинання барабанної перетинки).
Доказові дані
Одне велике випробування з високою якістю доказів припускає, що використання інформаційного буклету в цілому (при використанні будь-якої з трьох стратегій призначення антибіотиків) не впливає на споживання антибіотиків. Два менших випробування показують, що при стратегії відкладеного призначення використання інформаційних буклетів та структурованих усних роз’яснень скоротило споживання антибіотиків.
Використання інформаційних буклетів при стратегії негайного призначення зменшило повторні звернення в одному дослідженні, але не в іншому великому дослідженні, де всі пацієнти отримували структуровані усні роз’яснення.
Обґрунтування рекомендацій
ГРН вважає, що докази з використання інформаційних буклетів або структурованих усних роз’яснень при реалізації обраної стратегії призначення антибіотиків залишилися безрезультатними, оскільки залучені дослідження показали суперечливі результати різних стратегій у різних порівняннях (тобто використання буклетів порівняно з їх відсутністю за всіма трьома стратегіями призначення; використання буклетів у групі відкладеного призначення порівняно з відсутністю буклетів у групі негайного призначення; дослідження впливу буклетів та усних роз’яснень тільки в групі відкладеного призначення без надання такої інформації в інших групах). ГРН вирішила, що через суперечливість даних жодних рекомендацій не може бути зроблено висновків щодо ефективності інформаційних буклетів порівняно зі структурованими словесними роз’ясненнями.
2.3. Виявлення пацієнтів із респіраторними інфекціями, які, ймовірно, будуть схильні до ризику розвитку ускладнень
2.3.1. Введення
Як видно з попереднього огляду ефективності антибіотиків і огляду ефективності стратегій антибактеріальної терапії, антибіотики, як правило, неефективні в лікуванні РІ. Тим не менше антибіотики все ще можуть бути корисними для підгрупи пацієнтів, які звертаються з ГСО в заклади первинної медичної допомоги, якщо є ймовірність ризику розвитку ускладнень.
До першої групи належать дорослі і діти з ознаками інфекційного ускладнення, такого як пневмонія. Діагностика та лікування складних РІ виходять за рамки цієї короткої клінічної настанови. Тим не менше важливо, що ця настанова ясно визначає, що при таких інфекційних ускладненнях не повинні використовуватись стратегії непризначення або відкладеного призначення антибіотиків.
Друга група включає дорослих і дітей, які звертаються з неускладненими інфекціями, але мають високий ризик розвитку ускладнень. Для цієї групи використання стратегії відкладеного призначення або непризначення антибіотиків може привести до підвищеного ризику розвитку ускладнень, хоча у випадку застосування стратегії відкладеного призначення цей ризик може бути зменшений з обов’язковим наданням пацієнту поради про те, коли неодмінно треба починати прийом антибіотиків. Тому важливо, що для кожної з РІ, зазначених у даній настанові, слід отримати докази щодо специфічних клінічних симптомів, ознак і чинників ризику, що допоможе передбачити, які пацієнти серед оглянутих у закладах первинної медичної допомоги та при іншому першому контакті з медичним співробітником є більш схильними до розвитку ускладнень. Для мети цієї настанови наступні ускладнення РІ вважалися такими, що призводять до значної захворюваності, і тому знаходились у центрі уваги огляду.
— Для болю в горлі/гострого фарингіту/гострого тонзиліту: ангіна, флегмона/імпетиго, гострий ГСО, двосторонній ГСО, гострий риносинусит.
— Для гострого середнього отиту: мастоїдит, глухота, двосторонній ГСО.
— Для гострого кашлю/гострого бронхіту: пневмонія.
— Для гострого риносинуситу та застуди: фронтальний абсцес.
2.3.2. Огляд
Ми визначили 24 опубліковані дослідження на основі вивчення тезисів. Після подальшої оцінки тільки 6 досліджень, що подали докази клінічних симптомів, ознак та факторів ризику, що передбачають, у яких пацієнтів з РІ більш імовірно розвиваються ускладнення, були включені в огляд доказів (15 досліджень були невідповідними, 1 дослідження мало невідповідну групу дослідження, 1 було виключено як таке, що не відповідає статистичним вимогам). Всі 6 досліджень були оцінені окремо за допомогою листів оцінки прогностичних досліджень NICE (див. додаток 4) і представлені в доказових таблицях та описових резюме.
Коментар робочої групи: додатки до NICE clinical guideline 69 «Respiratory tract infections – antibiotic prescribing» (2008) у вигляді окремих документів можна знайти на сайті http://www.nice.org.uk.
З 6 включених досліджень одне дослідження («випадок — контроль») стосувалося гострого болю в горлі/гострого фарингіту/гострого тонзиліту (з Великобританії з баз даних первинної медичної допомоги) (рівень доказовості +), 2 проспективних дослідження та 1 когортне ретроспективне дослідження стосувалися гострого кашлю/гострого бронхіту (2 із закладів первинної медичної допомоги у Великобританії з рівнем доказовості + та + + відповідно і 1 з закладу первинної медичної допомоги з Нідерландів із рівнем доказовості ++). Одне проспективне когортне дослідження і один аналіз РКВ когорти стосувалися ГСО (1 із закладів первинної медичної допомоги в Нідерландах та 1 із Великої Британії із закладів первинної медичної допомоги, обидва з рівнем доказовості +). Не було визначено досліджень щодо гострого риносинуситу або застуди.
У цілому якість доказів була хорошою. Проте 3 з 6 включених досліджень повинні інтерпретуватись з обережністю, оскільки докази клінічних критеріїв, передбачен в цих 3 дослідженнях, не були підтверджені на інших групах, які отримували первинну медичну допомогу.
2.3.3. Виявлення пацієнтів із респіраторними інфекціями, які, імовірно, будуть схильні до ризику розвитку ускладнень
Рекомендація 1.1.7. Негайне призначення антибіотиків і/або подальше належне спостереження та лікування повинні бути запропоновані для пацієнтів (дорослих і дітей) тільки в таких ситуаціях:
— якщо пацієнт систематично нездужає;
— якщо у пацієнта є потенційні симптоми та ознаки серйозної хвороби та/або ускладнень (зокрема, пневмонія, мастоїдит, перитонзилярний абсцес, перитонзилярна флегмона, внутрішньоочні і внутрішньочерепні ускладнення);
— якщо пацієнт має високі ризики серйозних ускладнень через уже існуючі супутні хвороби. Це включає пацієнтів із серйозними хворобами серця, легенів, нирок, печінки або нервово-м’язовими хворобами, імуносупресією, муковісцидозом, а також маленьких дітей, які народилися передчасно;
— якщо пацієнт віком понад 65 років із гострим кашлем і має два чи більше наступних критерії або віком понад 80 років із гострим кашлем і має один наступний критерій або більше:
– госпіталізація у попередньому році;
– цукровий діабет 1-го або 2-го типу;
– гостра серцева недостатність в анамнезі;
– поточне застосування пероральних глюкокортикоїдів.
Для таких пацієнтів стратегії непризначення або відкладеного призначення антибіотиків не повинні розглядатися.
Огляд доказів
Гострий біль у горлі/гострий фарингіт/гострий тонзиліт
Досить непоганої якості ретроспективне дослідження «випадок — контроль» було взяте за основу для рекомендацій (Данн та співавт., 2007). Воно проходило по всій Великобританії та спиралося на дані первинних медичних закладів із Бази даних загальної практики (англ. GPRD) у період між 1995 і 1997 роками. Метою даного дослідження було виявлення клінічних симптомів, ознак і факторів ризику, що були пов’язані з розвитком ангіни після первинного виявлення неускладненого болю в горлі. Дослідження виявило 606 випадків ангіни в період дослідження, тільки для 192 з цих 606 випадків задокументовано скарги на первинний неускладнений біль у горлі. Ці 192 пацієнти з ангіною сформували основну групу, а інші 198 124 пацієнти з болем у горлі без ангіни сформували контрольну групу. Поширеність ангіни в період дослідження становила 96 випадків на 100 000 пацієнтів із болем у горлі (у період між 1995 і 1997 роками).
Результат 1: розвиток ангіни після первинного неускладненого болю у горлі
Логістична регресія використовується для розрахунку співвідношення шансів (СШ) для ризику ангіни після болю в горлі для різних змінних, таких як вік, стать, куріння, тип діагнозу, вплив антибіотиків і хвороба легень. Результати аналізу показали, що тільки вік (від 21 до 40 років) (скореговане СШ = 3,4, 95% ДІ від 2,1 до 5,5), куріння (скореговане СШ = 2,5, 95% ДІ від 1,8 до 3,5) і чоловіча стать (скореговане СШ = 1,6, 95% ДІ від 1,1 до 2,2) були значно пов’язані з розвитком ангіни після болю в горлі.
Результат 2: застосування антибіотиків і розвиток ангіни після різних видів діагнозу
Подальший аналіз також було проведено на основі різних діагнозів болю в горлі, таких як тонзиліт і біль у горлі/фарингіт (із поправкою на вік, стать, куріння, хвороби легенів на рівні пацієнта і кластеризація на практичному рівні). Інтервал між діагностуванням болю в горлі та розвитком ангіни був у середньому 2 дні (міжквартильний діапазон від 1 до 6 днів) при лікуванні тонзиліту і 3 дні (міжквартильний діапазон від 2 до 5 днів) для болю в горлі/фарингіту. Результати цього подальшого аналізу показали, що призначення антибіотиків після реєстрації діагностування болю в горлі взагалі навряд чи зменшить ризик розвитку ангіни [призначення антибіотика після будь-якого діагнозу (скореговане СШ = 1,2, 95% ДІ від 0,7 до 1,8); призначення антибіотика після діагностування тонзиліту (скореговане СШ = 0,6, 95% ДІ від 0,3 до 1,3); призначення антибіотика після болю в горлі/фарингіту (скореговане СШ = 1,2, 95% ДІ 0,7– 2,2)]. Однак необхідно проявляти значну обачність при оцінці ефекту антибіотиків у даному дослідженні внаслідок змішування значень у звичайних базах даних (особи з більш тяжкою хворобою, більш імовірно, будуть отримувати антибіотики, ніж люди з менш тяжкою хворобою).
Доказові дані
Пацієнти віком від 21 до 40 років чоловічої статі, які курять, значно більш схильні до розвитку ангіни після першого виявлення неускладненого болю в горлі в закладах первинної медичної допомоги.
Обґрунтування рекомендацій
ГРН відзначила і те, що ангіна є рідкісним ускладненням болю в горлі у Великобританії (з щорічною захворюваністю 96 випадків на 100 000 хворих) і, отже, абсолютний ризик розвитку ангіни низький (Данн та співавт., 2007), і те, що прогностичних значень факторів ризику для розвитку ангіни було недостатньо, щоб давати рекомендації до негайного призначення антибіотиків. Було також відзначено, що включене дослідження не забезпечене підтвердженим клінічним прогностичним правилом, хоча дослідження дійсно фіксувало такі ж фактори ризику у тих, хто мав первинний діагноз РІ, і тих, хто звернувся з уперше виявленою ангіною. ГРН дійшла висновку, що пацієнти з болем у горлі не повинні бути виключені із застосування стратегії відкладеного призначення або непризначення, навіть за наявності трьох виявлених факторів ризику (вік від 21 до 40 років, чоловік і курець). Отже, як свідчить доказова база, немає рекомендацій щодо критеріїв виключення зі стратегій призначення антибіотиків для пацієнтів із болем у горлі. Проте ГРН визнає, що ангіна є серйозним ускладненням, і дійшла спільного висновку, що негайне призначення антибіотиків і/або подальші відповідні спостереження та терапія повинні бути запропоновані дорослим та дітям, які виглядають хворими і мають симптоми та ознаки перитонзилярного абсцесу (ангіни).
Огляд доказів
Гострий кашель/гострий бронхіт
Три якісних дослідження були включені як основа рекомендацій. Два з них були проспективними когортними дослідженнями однієї команди дослідників (первинне дослідження і подальша валідація). Дослідження базувалися у Великобританії в закладах первинної медичної допомоги (Данн та ін., 2007; Хей, 2004; Сіно та ін., 2007) та було спрямоване на виявлення й перевірку клінічних правил для прогнозування ускладнень гострого кашлю в дітей дошкільного віку. Третє дослідження було ретроспективним когортним, заснованим на даних Мережі досліджень загальної практики у Нідерландах та другого Національного Голландського обстеження загальної практики (Бонт, 2007). Метою даного дослідження було визначити і затвердити правила для передбачення ускладнень ІНДШ у літніх пацієнтів при первинній допомозі.
Результат 1: ускладнення та госпіталізації до зникнення кашлю
Були визначені первинне дослідження та подальша валідація (Хей, 2004; Хей та ін., 2007) щодо клінічного правила для прогнозування ускладнень гострого кашлю в дітей дошкільного віку (від 0 до 4 років). Ускладнення в цих двох дослідженнях були визначені як нова ознака/симптом/умова, визначена після первинної консультації, до яких належали бронхіоліт, потенційна астма, блювота, бронхіт, вірусна хвороба, кашель і хрипи, кон’юнктивіт, ІНДШ, дитяча астма, ураження нижніх дихальних шляхів, вітряна віспа, вірус-індуковані хрипи, фарингіт та отит. Госпіталізація була визначена як госпіталізація до зникнення кашлю через наявність бронхіоліту, пневмонії, коклюшу і вірус-індукованих хрипів.
При первинному дослідженні (Хей, 2004) багатовимірний аналіз показав, що тільки наявність патологічних симптомів у грудній клітці (СШ = 2,78, 95% ДІ від 1,04 до 7,35, р = 0,048) і гарячка (СШ = 4,65, 95% ДІ від 1,63 до 13,3, р = 0,007) були значними незалежними прогностичними симптомами ускладнень та госпіталізації до зникнення кашлю в дітей дошкільного віку. Подальші логістичні регресії також показали, що відсутність гарячки і патологічних симптомів у грудній клітці були хорошими прогностичними симптомами виключення ускладнень у дітей із кашлем, з коефіцієнтом правдоподібності (КП) у розмірі 0,56 (95% ДІ від 0,35 до 0,91). КП лише гарячки або гарячки й симптомів у грудній клітці дорівнює 3,54 (95% ДІ від 1,62 до 7,68), а лише гарячки й симптомів у грудній клітці дорівнює 5,39 (95% ДІ від 0,95 до 30,6), і це було визнано як хороші прогностичні симптоми розвитку ускладнень у дітей із кашлем. Тим не менше дискримінаційна здатність даної моделі передбачення була слабкою, з площею під кривою співвідношення правильних та хибних виявлених симптомів (ROC-кривою) нижче 0,70 (ROC = 0,68). Подальше валідаційне дослідження Хея (2007) більш раннього первинного дослідження (Хей, 2004) було також визначене. У подальшому валідаційному дослідженні патологічні симптоми у грудній клітці і гарячка не були визнані істотними прогностичними симптомами ускладнень і госпіталізацій у дітей із кашлем. Замість цього симптоми у грудній клітці і гарячка були зараховані до симптомів, що свідчать про відсутність ускладнень та необхідності в госпіталізації [пост-тестова ймовірність: ані гарячки, ані симптомів у грудній клітці — 13,7 (95% ДІ від 7,5 до 22,3); тільки грудні симптоми — 13,8 (95% ДІ від 3,9 до 32,0); тільки гарячка — 9,1 (95% ДІ від 0,0 до 41,0), як гарячка, так і симптоми у грудній клітці — 0,0 (95% ДІ від 0,0 до 37,0)]. Зовсім інший набір змінних був визнаний істотними незалежними прогностичними симптомами ускладнень та госпіталізації: вік (СШ = 0,95, 95% ДІ від 0,90 до 0,99, р = 0,03); депривація (СШ = 0,79, 95% ДІ від 0,64 до 0,97, р = 0,02), кількість відвідувань загальної практики у попередньому році (СШ = 1,14, 95% ДІ від 1,02 до 1,27, р = 0,02). Автори відзначили, що суперечливі результати валідаційного дослідження порівняно з первинним дослідженням можуть бути результатом зміщення спектра (тобто соціально-демографічні відмінності, можливе зниження рівня циркулюючих грипоподібних захворювань між первинним і валідаційним контингентом) і змішування призначень (тобто клініцисти призначають антибіотики, як правило, дітям або з грудними симптомами, або з гарячкою). Таким чином, докази, наведені в цих двох дослідженнях, потребують обережної інтерпретації.
Результат 2: 30-денна госпіталізація або смерть
Інше ретроспективне когортне дослідження (Бонт, 2007), що виробило та провело валідацію правила передбачення для ускладнень ІНДШ у літніх пацієнтів із первинної допомоги, було також визначене. Первинне когортне дослідження було засновано на даних Мережі досліджень загальної практики у Нідерландах та другого Національного Голландського обстеження загальної практики. Пацієнти, включені у дослідження, були віком від 65 років і старше. Логістична регресія при первинному дослідженні когорти показала, що після початкового діагнозу наступні змінні були значущими прогностичними ознаками 30-денної госпіталізації та смерті (див. табл. 18) і система підрахунку балів була отримана на основі коефіцієнтів регресії.
/tirag/176/176.jpg)
Система підрахунку балів була розподілена на три групи ризику: низький ризик (оцінка ≤ 2), середній ризик (оцінка 3–5) і високий ризик (число балів ≥ 7). Дискримінаційними характеристиками цієї системи передбачення при первинному дослідженні когорти були: низький ризик — чутливість 0,82, специфічність 0,52, відсоток ризику очікуваного результату 3,2 %; середній ризик — чутливість/специфічність не повідомляється, ризик очікуваного результату 9,9 %; високий ризик — чутливість 0,35, специфічність 0,92, ризик очікуваного результату 30,9 % з хорошою дискримінаційною силою [площа під кривою ROC = 0,75 (95% ДІ від 0,72 до 0,78)].
/tirag/177/177.jpg)
Система оцінки прогностичності була також підтверджена в окремому когортному досліджені з аналогічними результатами: низький ризик — чутливість 0,42, специфічність 0,81, ризик очікуваного результату 5,3 %; середній ризик — чутливість/специфічність не повідомляється, ризик очікуваного результату 14,5 %; високий ризик — чутливість 0,06, специфічність 0,98, ризик очікуваного результату 22,0 %, з хорошою дискримінаційною здатністю [площа під ROC = 0,74 (95% ДІ від 0,71 до 0,78)]. Однак обмеження валідаційного дослідження було в тому, що воно не включало до прогностичних ознак загострення ХОЗЛ.
Доказові дані
Є суперечливі дані про корисність клінічних правил для прогнозування ускладнень гострого кашлю в дітей дошкільного віку.
Наступні клінічні ознаки/симптоми і чинники ризику є значущими прогностичними ознаками розвитку ускладнень у літніх людей з ІНДШ при первинній медичній допомозі:
— підозра або діагноз пневмонії за наявності консультацій;
— наявність в анамнезі: застійної серцевої недостатності; діабету; ХОЗЛ або загострення ХОЗЛ;
— вік понад 80 років;
— поточне застосування пероральних глюкокортикоїдів;
— госпіталізація у попередньому році;
— використання антибіотиків у попередньому місяці.
Обґрунтування рекомендацій
ГРН обговорила дані про прогнозування ускладнень у літніх пацієнтів при первинній допомозі при ІНДШ. ГРН погодила доказові дані, але поставили під сумнів валідність моделі прогнозу, наведеної в досліджені, оскільки ця модель була заснована на одному дослідженні, крім того, була велика частина включених у дослідження пацієнтів із супутніми захворюваннями. Крім того, дослідження було проведене в Нідерландах, де рівень призначення антибіотиків є низьким і, отже, пацієнти, більш імовірно, мали ознаки більш тяжкої хвороби.
ГРН також визначила непослідовність та недостатність доказів для прогнозування того, у яких дітей з гострим кашлем, імовірно, розвиваються ускладнення.
Огляд доказів
Гострий середній отит (ГСО)
Два якісні дослідження були взяті за основу для рекомендацій. Одне з них було проспективним когортним дослідженням (Дамуазо та співавт., 2006) щодо довгострокового прогнозування гострого середнього отиту у дітей (від 6 місяців до 24 місяців) із моделлю прогнозування ускладнення (рецидивуючого ГСО). Закладами для проведення цього дослідження були заклади сімейної практики в Нідерландах. Інше дослідження було подальшим вторинним дослідженням результатів когортного РКВ (Little і співавт., 2006). Воно було проведене в закладах первинної медичної допомоги у Великобританії і шукало клінічні прогностичні ознаки ускладнень (рецидивуючий ГСО і порушення слуху) отиту у дітей (віком від 6 місяців до 10 років). Жодних досліджень не було визначено стосовно ускладнень мастоїдиту. На основі статистики випадків, зафіксованих у лікарнях (2006–2007), було отримано 952 готових випадки виявленого мастоїдиту і порівняно зі всією кількістю зареєстрованих пацієнтів загальної практики (зареєстровані пацієнти загальної практики 2007 року) було 50 542 505 в Англії. Це становить загалом 144 випадки мастоїдиту на 1 млн пацієнтів на рік, що свідчить про те, що мастоїдит є рідкісним ускладненням. Велике голландське когортне дослідження також показало, що мастоїдит, імовірно, буде дуже рідкісним при застосуванні політики 72-годинного спостереження перед призначенням антибіотиків (ван Бюхем та співавт., 1985).
Результат 1: рецидивуючий ГСО/повторювані випадки болю у вусі (оталгія) і функціональні порушення слуху
У дослідженні Дамуазо (2006) логістична регресія показала, що змінні, перераховані в табл. 19, були значущими прогностичними ознаками рецидивуючого ГСО протягом 6 місяців у дітей. Бальна система була отримана на основі коефіцієнтів регресії (див. табл. 19).
Система підрахунку балів була потім розділена на три точки відсікання: нижче –8, нижче –1 і нижче 5. Дискримінаційні характеристики цієї системи балів передбачення становили: нижче –8 — чутливість 93 %, специфічність 23 %, позитивна прогностична цінність (ППЦ) 54 %, негативна прогностична цінність (НПЦ) 77 %); нижче –1 — чутливість 72 %, специфічність 56 %, ППЦ 62 %, НПЦ 67 %; нижче 5 — чутливість 51 %, специфічність 76 %, ППЦ 68 %, НПЦ 61 %. Дискримінаційна сила моделі була слабкою, з площею під ROC 0,69 (95% ДІ від 0,62 до 0,76), і дана модель не була валідована на різних групах первинної допомоги.
У дослідженні Little логістична регресія показала, що розлади слуху (оторея) (КП = 7,04, р = 0,004) й опуклість барабанної перетинки (КП = 5,50, р = 0,019) були значущими прогностичними ознаками повторюваності випадків оталгії протягом 3 місяців у дітей віком від 6 місяців до 10 років, у той час як минулі або попередні випадки ГСО (КП = 8,04, р = 0,005) були значущими прогностичними ознаками повторюваності випадків оталгії протягом 1 року.
Little (2006) також досліджував прогностичні ознаки функціональних порушень слуху після первісного гострого середнього отиту у дітей. Функціональні порушення слуху в даному дослідженні були виміряні дитячою системою оцінки (у якій оцінка 9 або вище вказує на порушення слуху) на основі 14 описів того, як проявляються порушення слуху в парі з хронічним секреторним середнім отитом. Результати логістичної регресії показали, що тільки попередні випадки середнього отиту були значущими прогностичними ознаками функціональних порушень слуху в дітей віком від 6 місяців до 10 років у рамках 3 місяців (КП = 4,95, р = 0,026) та 1 року (КП = 4,56, р = 0,033) після первинного діагностування ГСО. Подальший аналіз також показав, що порівняно зі стратегією негайного призначення антибіотиків стратегія відкладеного призначення антибіотиків суттєво не збільшує ризик рецидивуючого ГСО через 3 місяці (СШ = 0,89, 95% ДІ від 0,48 до 1,65) або через 1 рік (СШ = 1,03, 95% ДІ від 0,60 до 1,78). Окрім того, не було жодного істотного збільшення ризику розвитку функціональних порушень слуху у дітей після 3 місяців (СШ = 1,37, 95% ДІ від 0,72 до 2,60) або через 1 рік (СШ = 1,16, 95% ДІ від 0,61 до 2,23). Окрім того, дослідження показало, що стратегія відкладеного призначення антибіотиків істотно не збільшує ризик оталгії через 3 місяці (СШ = 0,89, 95% ДІ від 0,48 до 1,65) або 1 рік (СШ = 1,03, 95% ДІ від 0,60 до 1,78), так само як і не збільшує ризик дитячих функціональних розладів (слуху) через 3 місяці (СШ = 1,37, 95% ДІ від 0,72 до 2,60) або 1 рік (СШ = 1,16, 95% ДІ від 0,61 до 2,23). Однак, як відзначають автори, це вторинний аналіз, і не було жодного валідаційного дослідження. Крім того, з огляду на те, що рецидивуючий ГСО або повторні випадки оталгії не є серйозними ускладненнями, докази вимагають обережної інтерпретації.
Доказові дані
У дітей віком від 6 місяців до 10 років розлади слуху й опуклість барабанної перетинки є значущими прогностичними ознаками повторюваності випадків оталгії протягом наступних 3 місяців після первинного консультування. Тим не менше прогностичність не є значущою після 1 року.
У дітей віком від 6 місяців до 10 років історія попередніх випадків ГСО є значущою прогностичною ознакою повторюваності випадків оталгії тільки через 1 рік після первинної консультації.
У дітей віком від 6 місяців до 24 місяців чоловіча стать, пасивне куріння, зимовий сезон і стійкі симптоми є значущими прогностичними ознаками рецидивуючого ГСО протягом 6 місяців після первинної консультації.
Відкладене призначення істотно не збільшує ризик оталгії або дитячих функціональних розладів (слуху) через 3 місяці або 1 рік.
Обґрунтування рекомендацій
Мастоїдит був визначений ГРН як рідкісне, але потенційно серйозне ускладнення гострого середнього отиту, але жодних досліджень щодо мастоїдиту, які би задовольняли критерії включення в даний огляд, не виявлено. ГРН зазначила, що результати, повідомлені у включених дослідженнях (рецидивуючий ГСО і повторювані випадки оталгії), не вважаються серйозними ускладненнями гострого середнього отиту. Окрім того, ГРН вважає, що докази потребують обережної інтерпретації, оскільки це був вторинний аналіз попереднього РКВ. ГРН вважає, що ці три фактори не дозволяють використовувати ці дані в якості основи для вироблення рекомендацій. ГРН дійшла висновку, що не було можливо визначити підгрупи пацієнтів з ГСО, яким не треба пропонувати стратегії непризначення або відкладеного призначення.
Проте ГРН визнала, що мастоїдит є серйозним ускладненням гострого середнього отиту і дійшла консенсусного висновку, що цей стан потребує негайного призначення антибіотиків і/або подальшого відповідного розслідування і лікування в дорослих і дітей, які виглядають хворими і мають симптоми та ознаки мастоїдиту.
Огляд доказів
Гострий риносинусит
Не було визначено досліджень щодо гострого риносинуситу.
Доказові дані
Не було визначено жодних доказів щодо гострого риносинуситу.
Обґрунтування рекомендацій
ГРН відзначила відсутність доказів у цій галузі і дійшла висновку, що було неможливо визначити підгрупи пацієнтів із гострим риносинуситом, яким не можна пропонувати стратегії непризначення або відкладеного призначення.
Проте ГРН визнала, що внутрішньоочні та внутрішньочерепні ускладнення є серйозними ускладненнями гострого риносинуситу. Отже, ГРН дійшла консенсусного висновку, що негайне призначення антибіотиків і/або подальші відповідні спостереження і лікування повинні бути запропоновані дорослим та дітям, які виглядають хворими і мають симптоми та ознаки внутрішньоочних і внутрішньочерепних ускладнень.
Огляд доказів
Застуда
Не було знайдено досліджень щодо застуди.
Доказові дані
Не було визначено жодних доказів щодо застуди.
Обґрунтування рекомендацій
ГРН відзначила відсутність доказів у цій галузі і дійшла висновку, що було неможливо визначити підгрупи пацієнтів із застудою, яким не можна пропонувати стратегії непризначення або відкладеного призначення.
2.4. Вподобання пацієнтів та їх батьків/опікунів щодо стратегій призначення антибіотиків при респіраторних інфекціях (непризначення антибіотиків, відкладене призначення антибіотиків і негайне призначення антибіотиків)
2.4.1. Вступ
Одне з центральних завдань лікаря під час консультації пацієнта полягає в оцінці міркувань пацієнта, його побоювань та очікувань стосовно лікування, перш ніж погоджувати план лікування (Фразер, 1999). Це особливо важливо в консультаціях при РІ, коли з боку пацієнта можуть бути очікування, що антибіотик необхідний для лікування, у той час як на думку лікаря призначення антибіотиків не є клінічним показанням. Навпаки, з боку лікаря можуть бути очікування, що пацієнт прийшов спеціально з метою отримання призначення антибіотиків, у той час як пацієнт прагне лише поради та/або пересвідчення (Батлер і співавт., 1998). Справді, є свідчення, що лікарі загальної практики переоцінюють частку пацієнтів, які приходять на огляд із РІ з очікуванням призначення антибіотиків (Алтінер, 2004). Очевидною перевагою відстроченого призначення як стратегії порівняно зі стратегією непризначення є те, що пацієнт, який очікує на антибіотик, може бути більш схильним погодитися з такою схемою лікування, ніж зі стратегією непризначення.
Тому питання про переваги для пацієнтів трьох стратегій призначення антибіотиків (негайного, відкладеного призначення або непризначення) є надзвичайно важливим. В огляді, наведеному в розділі 2.4.2, включені РКВ оцінювали переваги для пацієнтів із застосуванням шкали задоволеності і результати подані у відповідних таблицях GRADE і доказових даних по кожному стану. Пацієнти повідомили про високий рівень задоволеності (понад 70 % від загальної кількості) при використанні стратегій непризначення або відкладеного призначення антибіотиків. Включені дослідження, однак, не повідомили, чи вподобання пацієнтів щодо трьох стратегій призначення антибіотиків відрізнялися в різних етнічних і соціально-економічних групах.
Існує маса літератури, яка припускає, що різниці в стратегіях призначення в закладах первинної медичної допомоги можуть бути результатом, принаймні частково, етнічної приналежності та соціально-економічного статусу пацієнта. Вторинний аналіз (Джил та співавт., 1996) даних із Генерального обстеження сімей, які вивчали зв’язок між отриманням рецепту та етнічною приналежністю, виявив, що пацієнти пакистанського або індійського походження значно більш імовірно отримують рецепт від лікаря загальної практики, ніж хворі білого або вест-індійського походження. Інше дослідження (Джил та Роальф, 2001) виявило, що пацієнти з робочого класу і пацієнти з найбільш бідних районів отримали значно більше антибіотиків під час первинної консультації, ніж пацієнти з інших соціально-економічних класів. Існують також докази того, що знання людей і ставлення до антибіотиків може варіюватись залежно від їх етнічної приналежності. Повномасштабне дослідження домашніх господарств у Великобританії (Макналті та співавт., 2007) щодо обізнаності громадськості та ставлення до антибіотиків показало, що люди азіатського/британського азіатського походження або карибського (темношкірі) британського походження були менш обізнані про антибіотики і мали різне ставлення до антибіотиків порівняно з білошкірими людьми британського походження.
Враховуючи вищевикладені висновки, важливо визначити, чи є додаткові доказові дані щодо вподобань пацієнтів щодо трьох стратегій призначення антибіотиків, зокрема, чи є докази, що стосуються конкретних темношкірих та етнічних меншин та соціально-економічних груп.
2.4.2. Огляд
Ми визначили 10 окремих опублікованих якісних досліджень на основі абстрактів. Після подальшої оцінки тільки 2 дослідження, які представили інформацію про вподобання пацієнтів відносно стратегій призначення антибіотиків при РІ, були включені в огляд (8 виключених не відповідали критеріям включення). Обидва дослідження були оцінені індивідуально і наведені в таблиці доказів та описових резюме.
Обидва включені дослідження були анкетуваннями. Одне (Едвардс та співавт., 2003) вивчало реакцію пацієнтів на стратегію відкладеного призначення антибіотиків при гострих ІВДШ у Великобританії в закладах первинної медичної допомоги. Інше (Кучман та співавт., 2000) вивчало персональну оцінку задоволеності пацієнтів, які отримали стратегію відкладеного призначення при поширених респіраторних симптомах. Якісні дослідження, включаючи опитувальники, отримали рівень доведеності первинних даних 3 (три) згідно з методологічною настановою NICE.
2.4.3. Вподобання пацієнтів та їх батьків/опікунів щодо стратегій призначення антибіотиків при РІ
Див. рекомендацію номер 1.1.2.
Огляд доказів
Задоволеність та очікування пацієнтів/батьків
В анкетному дослідженні Едвардса, що досліджувало реакцію пацієнтів на стратегію відкладеного призначення антибіотиків для гострих ІВДШ, результати показали, що з 256 пацієнтів, які отримали відстрочений рецепт, 92,5 % були задоволені і вирішили отримувати рецепт із затримкою знову в майбутньому. Подальший аналіз дослідження Едвардса показав, що з 256 пацієнтів, які отримали відстрочений рецепт, приблизно дві третини (65,2 %) розраховували отримати негайне призначення антибіотиків, 37 % очікували отримати консультацію, 2,0 % очікували тести чи спеціалізовані обстеження і 4,7 % прийшли за лікарняним листом. Очікування пацієнтів не були пов’язані з тим, чи вони використали відстрочений рецепт чи ні.
Дослідження Кучмана, що включало 286 пацієнтів, які отримали відстрочений рецепт при загальних респіраторних симптомах, виявило, що самостійна оцінка задоволеності пацієнтів становила 96,1 %. Загальне використання відстроченого рецепта становило 50,2 % та істотно не відрізнялося залежно від характеристик пацієнтів або їх самостійної оцінки задоволеності від отриманого догляду.
Доказові дані
Для пацієнтів, які очікували отримати негайне призначення антибіотиків під час консультації, понад 90 % із тих, хто отримав відстрочений рецепт при гострій ІВДШ, були задоволені і вирішили отримувати відстрочений рецепт знову в майбутньому.
Не виявлено жодних досліджень, які б повідомляли про вподобання пацієнтів щодо трьох стратегій призначення антибіотиків у темношкірих та етнічних меншинах і різних соціально-економічних групах.
Обґрунтування рекомендацій
ГРН відзначила, що наведені тут докази узгоджуються з тими, що подані в РКВ щодо різних стратегій призначення антибіотиків (див. розділ 2.2.2). Вона також відзначила, що не було виявлено жодних конкретних доказів щодо вподобань пацієнтів з конкретних темношкірих та етнічних меншин або соціально-економічних груп.
У зв’язку з відсутністю достатніх доказів у цій галузі ГРН вважає, що загальні рекомендації повинні спиратися на потреби пацієнта з огляду на його проблеми та очікування щодо використання антибіотиків, котрі будуть визначені під час медичної консультації у дорослих та дітей з РІ в закладах первинної медичної допомоги. Це повинно стосуватися всіх етнічних і соціально-економічних груп.
2.5. Питання, порушені даними дослідженнями
— Які підгрупи дорослих і дітей з РІ, представлені в закладах первинної медичної допомоги, швидше за все виграють від стратегії негайного призначення антибіотиків з точки зору симптоматичного лікування і профілактики ускладнень?
— Яку клінічну та економічну ефективність має стратегія відкладення прийому антибіотиків порівняно з варіантом лікування без антибіотиків і з негайним призначенням антибіотиків при гострому риносинуситі?
— Яка клінічна та економічна ефективність застосування різних способів відкладеного призначення антибіотиків у закладах первинної медичної допомоги для дорослих і дітей з РІ?
— Якими є темпи призначення, дозування препарату та ускладнення в дорослих і дітей з РІ, коли застосовуються різні стратегії (відкладання або непризначення ліків) і чи є будь-яка потенційна різниця в ризику розвитку ускладнень, що впливають на економічну ефективність відкладеного призначення або непризначення антибіотиків?
— Які клінічні особливості дітей і дорослих, які були діагностовані у закладах первинної медичної допомоги з РІ, пов’язані з розвитком серйозних ускладнень і потреби в госпіталізації?
— Чи розрізняється метод лікування пацієнтів та батьків/опікунів з РІ (негайне, відкладене втручання або стратегія непризначення антибіотиків) залежно від етнічної приналежності та соціально-економічного статусу?
Економічні показники лікування
— Як стратегія відкладеного призначення антибіотиків впливає на ризик розвитку ускладнень у пацієнтів після першого випадку РІ і як ця потенційна різниця ризику впливає на економічну ефективність стратегії відкладеного призначення антибіотиків?
— Необхідно проводити дослідження оцінки якості життя, пов’язаної зі здоров’ям, серед людей з РІ, зокрема, при використанні загальних заходів, таких як EQ-5D (Європейський опитувальник з якості життя EQ-5D). Окрім того, потрібне подальше дослідження застосовуваності зважених показників пов’язаної зі здоров’ям якості життя, вивчаючи втручання з приводу короткочасних хвороб, таких як, наприклад, РІ.
Seasonal Influenza in Adults and Children — Diagnosis, Treatment, Chemoprophylaxis, and Institutional Outbreak Management: Clinical Practice Guidelines of the Infectious Diseases Society of America (2009)
Обмеження літератури та поточні й майбутні дослідження
При підготовці цих рекомендацій експертна група намагалася виділити галузі, у яких літературні дані надають обмежені докази. Багато що з них виділено в резюме доказів. Тим не менше ми хотіли б підкреслити кілька важливих потреб у наукових дослідженнях. Необхідні додаткові дослідження, щоб продемонструвати роль діагностичного тестування в поліпшенні лікування дорослих із грипоподібними хворобами, як в амбулаторних умовах, так і в умовах стаціонару. Одним із головних результатів є здатність знижувати недоречне використання антибіотиків і появу стійкості до антибіотиків. Існують обмежені дані про ефективність чи оптимальну тривалість лікування з інгібіторами нейрамінідази серед госпіталізованих пацієнтів і серед дітей віком до 1 року. Нещодавню появу циркулюючих штамів грипу A (H1N1) із високим рівнем стійкості до озельтамівіру необхідно чітко відстежувати. Поширеність стійкості і наявність альтернативних агентів впливатиме на ці рекомендації в майбутньому.
Індикатори якості
Індикатори є інструментом, що допомагають користувачам вимірювати ступінь і наслідки запровадження даних рекомендацій. Такі інструменти і заходи можуть бути показниками самого процесу та/чи результатів. Відхилення від рекомендацій очікуються в певній кількості випадків, а також дотримання очікується у 80–95% випадків, як правило, залежно від показника.
Чотири показники були відібрані для даної настанови:
1. Тестування на грип має проводитися для всіх осіб, які надійшли до лікарні з гострими гарячковими респіраторними симптомами в періоди активності грипу в громаді.
2. Противірусні препарати слід призначати всім особам, які потребують госпіталізації з приводу лабораторно підтвердженого грипу.
3. Всі медичні працівники повинні отримувати щорічне щеплення проти грипу, якщо для цього не існує медичних протипоказань. Протипоказання до щеплення включають анафілактичну гіперчутливість на білок або інші компоненти вакцини, гарячкові захворювання від помірних до тяжких і, як запобіжний захід, синдром Гієна — Барре в анамнезі (протягом 6 тижнів після отримання попередньої вакцинації проти грипу). Якщо медичні працівники відмовляються від щеплення, вони повинні підписати відмову від щеплення, аби засвідчити своє розуміння ризику, який вони становлять для пацієнтів на своїх робочих місцях.
4. Заклади охорони здоров’я (у тому числі лікарні, заклади тривалого догляду та інші заклади, де проживають люди з потенційно високим ризиком ускладнень, вторинних щодо інфекції грипу) повинні запропонувати протигрипозне щеплення для персоналу й відслідковувати статус щеплення всіх співробітників.
Члени експертної групи з розробки настанови з грипу IDSA
Scott A. Harper (Chairman; CDC; New York, NY; and Atlanta, GA), John S. Bradley (Rady Children’s Hospital and the University of California San Diego School of Medicine and Children’s Hospital and Health Center), Janet A. Englund (University of Washington School of Medicine and Seattle Children’s Hospital; Seattle), Thomas M. File (Summa Health System and Northeastern Ohio Universities Colleges of Medicine & Pharmacy; Akron), Stefan Gravenstein (Alpert Medical School of Brown University and Quality Partners of Rhode Island; Providence, RI), Frederick G. Hayden (University of Virginia School of Medicine; Charlottesville), Allison J. McGeer (University of Toronto and Mt. Sinai Hospital; Toronto, Ontario, Canada), Kathleen M. Neuzil (University of Washington School of Medicine and Program for Appropriate Technology in Health; Seattle), Andrew T. Pavia (University of Utah School of Medicine and Primary Children’s Hospital; Salt Lake City), Michael L. Tapper (Lenox Hill Hospital; New York), Timothy M. Uyeki (CDC; Atlanta, GA), and Richard K. Zimmerman (University of Pittsburgh School of Medicine; Pittsburgh, PA).
Подяка
Експертна група хотіла б висловити свою вдячність Kathryn Edwards, William P. Gleazen, Isaac Weisfuse, Marci Layton, Annie Fine, Carolyn Bridges, Joe Bresee, Anthony Fiore, Beth Nivin і Jennifer Padberg за їх рецензування проекту документу.
Фінансування. IDSA.
Потенційні конфлікти інтересів. J.A.E. отримав грант/підтримку дослідження від Sanofi Pasteur та MedImmune, працює доповідачем для Sanofi Pasteur та є консультантом Sanofi Pasteur, Roche, Novartis та GlaxoSmithKline. T.M.F. отримав грант/підтримку дослідження від Cerexa, Ortho-McNeil та Pfizer; був консультантом для Advanced Life Sciences, Forrest, Ortho-McNeil, Merck, Nabriva, Oscient, Pfizer, Schering Plough и Wyeth; є доповідачем для Merck, Ortho-McNeil, Oscient, Pfizer, Schering Plough та Wyeth. K.M.N. є співробітником Консультативної ради з імунізації дорослих при Американському коледжі лікарів. M.L.T. був доповідачем на засіданні Безперервної медичної освіти, спонсором якого були Roche та Gilead. S.G. має угоду на послуги консультанта з Juvaris, GlaxoSmithKline, Sanofi Pasteur и Merck; працює доповідачем для GlaxoSmithKline. A.T.P. є консультантом для NexBio та GlaxoSmithKline. A.J.M. отримав грант/підтримку дослідження від Roche та GlaxoSmithKline; був доповідачем та консультантом для Sanofi Pasteur, Gilead Biosciences та Bioсryst Pharmaceuticals. R.K.Z. виступає як консультант для MedImmune. Всі інші автори: не мали конфлікту інтересів.
Глосарій
Ангіна — у даній настанові термін «ангіна» (англ. quincy) має таку дефініцію: гостре бактеріальне захворювання, що, як правило, є ускладненням гострого тонзиліту, в основі має гнійно-рідке запалення (абсцес) піднебінного мигдалика і часто супроводжується больовим синдромом.
Внутрішня валідність — властивість наукових досліджень, що відображає, якою мірою виправданий висновок про причини (випливає з результатів наукового дослідження); відображає, якою мірою мінімізована систематична помилка.
Заклади закритого типу — організовані колективи, що пов’язані із закладом, установою (англ. institutional).
ЗТ-ПЛР — метод полімеразної ланцюгової реакції ампліфікації послідовності нуклеїнових кислот, у якому використовується РНК як шаблон для розшифровки відповідної ДНК з використанням зворотної транскриптази (англ. RT-PCR).
Літні люди — особи віком понад 65 років, які мають функціональні порушення органів та/чи систем, або особи віком понад 75 років (англ. elderly persons).
Немовлята — термін застосовується до дітей віком до 1 року (англ. infants).
Проспективне дослідження (випробовування) — дослідження (випробовування), у якому група формується сьогодні, а досліджується в майбутньому (групу спостереження формують до того, як отримано результати). Головною перевагою проспективних досліджень є повна визначеність групи, що спостерігається, станів, що виявляються, методів дослідження та інших деталей до початку клінічного дослідження.
Самообмежувальні хвороби — хвороби, що тривають певний строк та можуть завершитися без лікування (англ. self-limited).
Співвідношення шансів (СШ) — відношення кількості учасників дослідження, у яких виявлено той чи інший клінічний результат, до кількості учасників дослідження, у яких даного результату не виявлено (не було досягнуто). У більшості випадків СШ та відносний ризик (ВР) приблизно однакові, через це багато хто, фактично розраховуючи СШ, надають результати у вигляді ВР. Іноді це може призводити до помилкових висновків.
Шкала Бріза — шкала призначена для оцінки ймовірності БГСА-фарингіту у дітей. Шкала була розроблена B.B. Breese в 1977 році. Шкала включає місяць року, вік пацієнта, кількість лейкоцитів у крові, симптоми (гарячка, біль у горлі, кашель, головний біль), зміни в глотці, зміни в шийних лімфовузлах. Кожному показнику відповідають певні бали. Набраним балам відповідають певні відсотки імовірності у пацієнта БГСА-фарингіту.
1. Thompson W.W., Shay D.K., Weintraub E. et al. Influenza-associated hospitalizations in the United States // JAMA 2004; 292: 1333–40.
2. Thompson W.W., Shay D.K., Weintraub E. et al. Mortality associated with influenza and respiratory syncytial virus in the United States // JAMA 2003; 289: 179–86.
3. Antiviral therapy and prophylaxis for influenza in children // Pediatrics 2007; 119: 852–60.
4. Bocchini J.A. Jr, Bradley J.S., Brady M.T. et al.; American Academy of Pediatrics Committee on Infectious Diseases. Prevention of influenza: recommendations for influenza immunization of children, 2008–2009 // Pediatrics 2008; 122: 1135–41.
5. Fiore A.E., Shay D.K., Broder K. et al. Prevention and control of influenza: recommendations of the Advisory Committee on Immunization Practices (ACIP), 2008 // MMWR Recomm Rep 2008; 57(RR–7):1–60.
6. Canadian Task Force on the Periodic Health Examination. The periodic health examination // CMAJ 1979; 121: 1193–254.
7. World Health Organization. Clinical management of human infection with avian influenza A (H5N1) virus. 15 August 2007. Available at: http://www.who.int/csr/disease/avian_influenza/guidelines/clinical manage07/en/index.html. Accessed 4 March 2009.
8. Abdel-Ghafar A.N., Chotpitayasunondh T., Gao Z. et al. Update on avian influenza A (H5N1) virus infection in humans // N. Engl. J. Med. 2008; 358: 261–73.
9. Hall C.B., Dolin R., Gala C.L. et al. Children with influenza A infection: treatment with rimantadine. Pediatrics 1987; 80: 275–82.
10. Palese P., Shaw M. Orthomyxoviridae: the viruses and their replication // Knipe D.M., Howley P.M., eds. Fields virology. 5th ed. Lippincott: Williams & Wilkins, 2007; Vol. 2: 1647–90.
11. Matsuzaki Y., Katsushima N., Nagai Y. et al. Clinical features of influenza C virus infection in children // J. Infect. Dis. 2006; 193: 1229–35.
12. Lee P.Y., Matchar D.B., Clements D.A., Huber J., Hamilton J.D., Peterson E.D. Economic analysis of influenza vaccination and antiviral treatment for healthy working adults // Ann. Intern. Med. 2002; 137: 225–31.
13. Sullivan K.M., Monto A.S., Longini I.M. Jr. Estimates of the US health impact of influenza // Am. J. Public Health 1993; 83: 1712–6.
14. Evans C.T., Lavela S.L., Smith B., Miskevics S., Weaver F.M., Goldstein B. Influenza diagnosis and treatment in veterans with spinal cord injury // Arch. Phys. Med. Rehabil. 2006; 87: 291–3.
15. Linder J.A., Bates D.W., Platt R. Antivirals and antibiotics for influenza in the United States, 1995–2002 // Pharmacoepidemiol. Drug Saf. 2005; 14: 531–6.
16. Rothberg M.B., Bonner A.B., Rajab M.H., Kim H.S., Stechenberg B.W., Rose D.N. Effects of local variation, specialty, and beliefs on antiviral prescribing for influenza // Clin. Infect. Dis. 2006; 42: 95–9.
17. Abanses J.C., Dowd M.D., Simon S.D., Sharma V. Impact of rapid influenza testing at triage on management of febrile infants and young children // Pediatr. Emerg Care 2006; 22: 145–9.
18. Blitz S.G., Cram P., Chernew M.E., Monto A.S., Fendrick A.M. Diagnostic testing or empirical neuraminidase inhibitor therapy for patients with influenza-like illness: what a difference a day makes // Am. J. Manag. Care 2002; 8: 221–7.
19. Bonner A.B., Monroe K.W., Talley L.I., Klasner A.E., Kimberlin D.W. Impact of the rapid diagnosis of influenza on physician decision-making and patient management in the pediatric emergency department: results of a randomized, prospective, controlled trial // Pediatrics 2003; 112: 363–7.
20. D’Heilly S.J., Janoff E.N., Nichol P., Nichol K.L. Rapid diagnosis of influenza infection in older adults: influence on clinical care in a routine clinical setting // J. Clin. Virol 2008; 42: 124–8.
21. Falsey A.R., Murata Y., Walsh E.E. Impact of rapid diagnosis on management of adults hospitalized with influenza // Arch. Intern. Med. 2007; 167: 354–60.
22. Poehling K.A., Zhu Y., Tang Y.W., Edwards K. Accuracy and impact of a point-of-care rapid influenza test in young children with respiratory illnesses // Arch. Pediatr. Adolesc. Med. 2006; 160: 713–8.
23. Sharma V., Dowd M.D., Slaughter A.J., Simon S.D. Effect of rapid diagnosis of influenza virus type A on the emergency department management of febrile infants and toddlers // Arch. Pediatr. Adolesc. Med. 2002; 156: 41–3.
24. Halloran M.E., Piedra P.A., Longini I.M. Jr et al. Efficacy of trivalent, cold-adapted, influenza virus vaccine against influenza A (Fujian), a drift variant, during 2003–2004 // Vaccine 2007; 25: 4038–45.
25. Piedra P.A., Gaglani M.J., Kozinetz C.A. et al. Trivalent live attenuated intranasal influenza vaccine administered during the 2003–2004 influenza type A (H3N2) outbreak provided immediate, direct, and indirect protection in children // Pediatrics 2007; 120: e553–64.
26. Whitaker-Dowling P., Maassab H.F., Youngner J.S. Dominant-negative mutants as antiviral agents: simultaneous infection with the coldadapted live-virus vaccine for influenza A protects ferrets from disease produced by wild-type influenza A // J. Infect. Dis. 1991; 164: 1200–2.
27. Boivin G., Hardy I., Tellier G., Maziade J. Predicting influenza infections during epidemics with use of a clinical case definition // Clin. Infect. Dis. 2000; 31: 1166–9.
28. Call S.A., Vollenweider M.A., Hornung C.A., Simel D.L., McKinney W.P. Does this patient have influenza? // JAMA 2005; 293: 987–97.
29. Monto A.S., Gravenstein S., Elliott M., Colopy M., Schweinle J. Clinical signs and symptoms predicting influenza infection // Arch. Intern. Med. 2000; 160: 3243–7.
30. Quach C., Piche-Walker L., Platt R., Moore D. Risk factors associated with severe influenza infections in childhood: implication for vaccine strategy // Pediatrics 2003; 112: e197–201.
31. Rojo J.C., Ruiz-Contreras J., Fernandez M.B., Marin M.A., Folgueira L. Influenza–-elated hospitalizations in children younger than three years of age // Pediatr. Infect. Dis. J. 2006; 25: 596–601.
32. Wang Y.H., Huang Y.C., Chang L.Y. et al. Clinical characteristics of children with influenza A virus infection requiring hospitalization // J. Microbiol. Immunol. Infect. 2003; 36: 111–6.
33. Wootton S.H., Scheifele D.W., Mak A., Petric M., Skowronski D.M. Detection of human influenza virus in the stool of children // Pediatr. Infect. Dis. J. 2006; 25: 1194–5.
34. Meury S., Zeller S., Heininger U. Comparison of clinical characteristics of influenza and respiratory syncytial virus infection in hospitalised children and adolescents // Eur. J. Pediatr. 2004; 163: 359–63.
35. Guarner J., Paddock C.D., Shieh W.J. et al. Histopathologic and immunohistochemical features of fatal influenza virus infection in children during the 2003–2004 season // Clin. Infect. Dis. 2006; 43: 132–40.
36. Mamas M.A., Fraser D., Neyses L. Cardiovascular manifestations associated with influenza virus infection // Int. J. Cardiol. 2008; 130: 304–9.
37. Abe M., Higuchi T., Okada K., Kaizu K., Matsumoto K. Clinical study of influenza-associated rhabdomyolysis with acute renal failure // Clin. Nephrol. 2006; 66: 166–70.
38. Annerstedt M., Herlitz H., Molne J., Oldfors A., Westberg G. Rhabdomyolysis and acute renal failure associated with influenza virus type A // Scand. J. Urol. Nephrol. 1999; 33: 260–4.
39. Naderi A.S., Palmer B.F. Rhabdomyolysis and acute renal failure associated with influenza virus type B infection // Am. J. Med. Sci. 2006; 332: 88–9.
40. Maricich S.M., Neul J.L., Lotze T.E. et al. Neurologic complications associated with influenza A in children during the 2003–2004 influenza season in Houston, Texas // Pediatrics 2004; 114: e626–33.
41. Morishima T., Togashi T., Yokota S. et al. Encephalitis and encephalopathy associated with an influenza epidemic in Japan // Clin. Infect. Dis. 2002; 35: 512–7.
42. Nagao T., Morishima T., Kimura H. et al. Prognostic factors in influenza-associated encephalopathy // Pediatr. Infect. Dis. J. 2008; 27: 384–9.
43. Newland J.G., Laurich V.M., Rosenquist A.W. et al. Neurologic complications in children hospitalized with influenza: characteristics, incidence, and risk factors // J. Pediatr. 2007; 150: 306–10.
44. Steininger C., Popow-Kraupp T., Laferl H. et al. Acute encephalopathy associated with influenza A virus infection // Clin. Infect. Dis. 2003; 36: 567–74.
45. Bhat N., Wright J.G., Broder K.R. et al. Influenza-associated deaths among children in the United States, 2003–2004 // N. Engl. J. Med. 2005; 353: 2559–67.
46. Chang L.Y., Lee P.I., Lin Y.J., Chiu H.H., Huang L.M., Lee C.Y. Influenza B virus infection associated with shock in a two-month-old infant // J. Formos. Med. Assoc. 1996; 95: 703–5.
47. Conway E.E. Jr, Haber R.S., Gumprecht J., Singer L.P. Toxic shock syndrome following influenza A in a child // Crit. Care Med. 1991; 19: 123–5.
48. MacDonald K.L., Osterholm M.T., Hedberg C.W. et al. Toxic shock syndrome: a newly recognized complication of influenza and influenzalike illness // JAMA 1987; 257: 1053–8.
49. Sharkey R., Mulloy E., O’Neill G., Walker F., O’Neill S. Toxic shock syndrome following influenza A infection // Intensive Care Med. 1999; 25: 335–6.
50. Tolan R.W. Jr. Toxic shock syndrome complicating influenza A in a child: case report and review // Clin. Infect. Dis. 1993; 17: 43–5.
51. Brundage J.F. Interactions between influenza and bacterial respiratory pathogens: implications for pandemic preparedness // Lancet Infect Dis. 2006; 6: 303–12.
52. Hageman J.C., Uyeki T.M., Francis J.S. et al. Severe community-acquired pneumonia due to Staphylococcus aureus, 2003–04 influenza season // Emerg. Infect. Dis. 2006; 12: 894–9.
53. Peltola V.T., McCullers J.A. Respiratory viruses predisposing to bacterial infections: role of neuraminidase // Pediatr. Infect. Dis. J. 2004; 23(Suppl. 1): S87–97.
54. Centers for Disease Control and Prevention. Severe methicillin-resistant Staphylococcus aureus community-acquired pneumonia associated with influenza — Louisiana and Georgia, December 2006 — January 2007 // MMWR Morb. Mortal. Wkly. Rep. 2007; 56: 325–9.
55. Finelli L., Fiore A., Dhara R. et al. Influenza-associated pediatric mortality in the United States: increase of Staphylococcus aureus coinfection // Pediatrics 2008; 122: 805–11.
56. Davis M.M., Taubert K., Benin A.L. et al. Influenza vaccination as secondary prevention for cardiovascular disease: a science advisory from the American Heart Association/American College of Cardiology // J. Am. Coll Cardiol. 2006; 48: 1498–502.
57. Mamas M.A., Nair S., Fraser D. Cardiac tamponade and heart failure as a presentation of influenza // Exp. Clin. Cardiol. 2007; 12: 214–6.
58. Miller E.K., Griffin M.R., Edwards K.M. et al. Influenza burden for children with asthma // Pediatrics 2008; 121: 1–8.
59. Varkey J.B., Varkey B. Viral infections in patients with chronic obstructive pulmonary disease // Curr. Opin. Pulm. Med. 2008; 14: 89–94.
60. Babcock H.M., Merz L.R., Fraser V.J. Is influenza an influenza-like illness? Clinical presentation of influenza in hospitalized patients // Infect. Control Hosp. Epidemiol. 2006; 27: 266–70.
61. Govaert T.M., Dinant G.J., Aretz K., Knottnerus J.A. The predictive value of influenza symptomatology in elderly people // Fam. Pract. 1998; 15: 16–22.
62. Monmany J., Rabella N., Margall N., Domingo P., Gich I., Vazquez G. Unmasking influenza virus infection in patients attended to in the emergency department // Infection 2004; 32: 89–97.
63. Nicholson K.G., Kent J., Hammersley V., Cancio E. Acute viral infections of upper respiratory tract in elderly people living in the community: comparative, prospective, population based study of disease burden // BMJ 1997; 315: 1060–4.
64. Walsh E.E., Cox C., Falsey A.R. Clinical features of influenza A virus infection in older hospitalized persons // J. Am. Geriatr. Soc. 2002; 50: 1498–503.
65. Carrat F., Leruez-Ville M., Tonnellier M. et al. A virologic survey of patients admitted to a critical care unit for acute cardiorespiratory failure // Intensive Care Med. 2006; 32: 156–9.
66. Izurieta H.S., Thompson W.W., Kramarz P. et al. Influenza and the rates of hospitalization for respiratory disease among infants and young children // N. Engl. J. Med. 2000; 342: 232–9.
67. Keren R., Zaoutis T.E., Bridges C.B. et al. Neurological and neuromuscular disease as a risk factor for respiratory failure in children hospitalized with influenza infection // JAMA 2005; 294: 2188–94.
68. Louie J.K., Schechter R., Honarmand S. et al. Severe pediatric influenza in California, 2003–2005: implications for immunization recommendations // Pediatrics 2006; 117: e610–8.
69. Mullooly J.P., Bridges C.B., Thompson W.W. et al. Influenza- and RSV-associated hospitalizations among adults // Vaccine 2007; 25: 846–55.
70. Neuzil K.M., Mellen B.G., Wright P.F., Mitchel E.F. Jr, Griffin M.R. The effect of influenza on hospitalizations, outpatient visits, and courses of antibiotics in children // N. Engl. J. Med. 2000; 342: 225–31.
71. Neuzil K.M., Reed G.W., Mitchel E.F. Jr, Griffin M.R. Influenza–associated morbidity and mortality in young and middle-aged women // JAMA 1999; 281: 901–7.
72. Neuzil K.M., Reed G.W., Mitchel E.F., Simonsen L., Griffin M.R. Impact of influenza on acute cardiopulmonary hospitalizations in pregnant women // Am. J. Epidemiol. 1998; 148: 1094–102.
73. Neuzil K.M., Wright P.F., Mitchel E.F. Jr, Griffin M.R. The burden of influenza illness in children with asthma and other chronic medical conditions // J. Pediatr. 2000; 137: 856–64.
74. Neuzil K.M., Zhu Y., Griffin M.R. et al. Burden of interpandemic influenza in children younger than 5 years: a 25-year prospective study // J. Infect. Dis. 2002; 185: 147–52.
75. O’Brien M.A., Uyeki T.M., Shay D.K. et al. Incidence of outpatient visits and hospitalizations related to influenza in infants and young children // Pediatrics 2004; 113: 585–93.
76. Schrag S.J., Shay D.K., Gershman K. et al. Multistate surveillance for laboratory-confirmed, influenza-associated hospitalizations in children: 2003–2004 // Pediatr. Infect. Dis. J. 2006; 25: 395–400.
77. Nichol K.L., Treanor J.J. Vaccines for seasonal and pandemic influenza // J. Infect. Dis. 2006; 194(Suppl. 2): S111–8.
78. Horcajada J.P., Pumarola T., Martinez J.A. et al. A nosocomial outbreak of influenza during a period without influenza epidemic activity // Eur. Respir. J. 2003; 21: 303–7.
79. Leekha S., Zitterkopf N.L., Espy M.J., Smith T.F., Thompson R.L., Sampathkumar P. Duration of influenza A virus shedding in hospitalized patients and implications for infection control // Infect. Control. Hosp. Epidemiol. 2007; 28: 1071–6.
80. Sagrera X., Ginovart G., Raspall F. et al. Outbreaks of influenza A virus infection in neonatal intensive care units // Pediatr. Infect. Dis. J. 2002; 21: 196–200.
81. Salgado C.D., Farr B.M., Hall K.K., Hayden F.G. Influenza in the acute hospital setting // Lancet Infect. Dis. 2002; 2: 145–55.
82. Sartor C., Zandotti C., Romain F. et al. Disruption of services in an internal medicine unit due to a nosocomial influenza outbreak // Infect. Control. Hosp. Epidemiol. 2002; 23: 615–9.
83. Slinger R., Dennis P. Nosocomial influenza at a Canadian pediatric hospital from 1995 to 1999: opportunities for prevention // Infect. Control. Hosp. Epidemiol. 2002; 23: 627–9.
84. Camps M., Vilella A., Marcos M.A. et al. Incidence of respiratory viruses among travelers with a febrile syndrome returning from tropical and subtropical areas // J. Med. Virol. 2008; 80: 711–5.
85. Luna L.K., Panning M., Grywna K., Pfefferle S., Drosten C. Spectrum of viruses and atypical bacteria in intercontinental air travelers with symptoms of acute respiratory infection // J. Infect. Dis. 2007; 195: 675–9.
86. Miller J.M., Tam T.W., Maloney S. et al. Cruise ships: high–risk passengers and the global spread of new influenza viruses // Clin. Infect. Dis. 2000; 31: 433–8.
87. Mutsch M., Tavernini M., Marx A. et al. Influenza virus infection in travelers to tropical and subtropical countries // Clin. Infect. Dis. 2005;40: 1282–7.
88. Ortiz J.R., Wallis T.R., Katz M.A. et al. No evidence of avian influenza A (H5N1) among returning US travelers // Emerg. Infect. Dis. 2007; 13: 294–7.
89. Uyeki T.M., Zane S.B., Bodnar U.R. et al. Large summertime influenza A outbreak among tourists in Alaska and the Yukon Territory // Clin. Infect. Dis. 2003; 36: 1095–102.
90. Frank A.L., Taber L.H., Wells C.R., Wells J.M., Glezen W.P., Paredes A. Patterns of shedding of myxoviruses and paramyxoviruses in children // J. Infect. Dis. 1981; 144: 433–41.
91. Sato M., Hosoya M., Kato K., Suzuki H. Viral shedding in children with influenza virus infections treated with neuraminidase inhibitors // Pediatr. Infect. Dis. J. 2005; 24: 931–2.
92. Klimov A.I., Rocha E., Hayden F.G., Shult P.A., Roumillat L.F., Cox N.J. Prolonged shedding of amantadine-resistant influenza A viruses by immunodeficient patients: detection by polymerase chain reaction-restriction analysis // J. Infect. Dis. 1995; 172: 1352–5.
93. Weinstock D.M., Gubareva L.V., Zuccotti G. Prolonged shedding of multidrug-resistant influenza A virus in an immunocompromised patient // N. Engl. J. Med. 2003; 348: 867–8.
94. Hota S., McGeer A. Antivirals and the control of influenza outbreaks // Clin. Infect. Dis. 2007; 45: 1362–8.
95. Frayha H., Castriciano S., Mahony J., Chernesky M. Nasopharyngeal swabs and nasopharyngeal aspirates equally effective for the diagnosis of viral respiratory disease in hospitalized children // J. Clin. Microbiol. 1989; 27: 1387–9.
96. Heikkinen T., Marttila J., Salmi A.A., Ruuskanen O. Nasal swab versus nasopharyngeal aspirate for isolation of respiratory viruses // J. Clin. Microbiol. 2002; 40: 4337–9.
97. Lambert S.B., Whiley D.M., O’Neill N.T. et al. Comparing nose-throat swabs and nasopharyngeal aspirates collected from children with symptoms for respiratory virus identification using realtime polymerase chain reaction // Pediatrics 2008; 122: e615–20.
98. Sung R.Y., Chan P.K., Choi K.C. et al. Comparative study of nasopharyngeal aspirate and nasal swab specimens for diagnosis of acute viral respiratory infection // J. Clin. Microbiol. 2008; 46: 3073–6.
99. Uyeki T.M. Influenza diagnosis and treatment in children: a review of studies on clinically useful tests and antiviral treatment for influenza // Pediatr. Infect. Dis. J. 2003; 22: 164–77.
100. Robinson J.L., Lee B.E., Kothapalli S., Craig W.R., Fox J.D. Use of throat swab or saliva specimens for detection of respiratory viruses in children // Clin. Infect. Dis. 2008; 46: e61–4.
101. Simpson J.L., Moric I., Wark P.A., Johnston S.L., Gibson P.G. Use of induced sputum for the diagnosis of influenza and infections in asthma: a comparison of diagnostic techniques // J. Clin. Virol. 2003; 26: 339–46.
102. Kimball A.M., Foy H.M., Cooney M.K., Allan I.D., Matlock M., Plorde J.J. Isolation of respiratory syncytial and influenza viruses from the sputum of patients hospitalized with pneumonia // J. Infect. Dis. 1983; 147: 181–4.
103. Agoritsas K., Mack K., Bonsu B.K., Goodman D., Salamon D., Marcon M.J. Evaluation of the Quidel QuickVue test for detection of influenza A and B viruses in the pediatric emergency medicine setting by use of three specimen collection methods // J. Clin. Microbiol. 2006; 44: 2638–41.
104. Dale S.E., Mayer C., Mayer M.C., Menegus M.A. Analytical and clinical sensitivity of the 3M rapid detection influenza A + B assay // J. Clin. Microbiol. 2008; 46: 3804–7.
105. Grijalva C.G., Poehling K.A., Edwards K.M. et al. Accuracy and interpretation of rapid influenza tests in children // Pediatrics 2007; 119: e6–11.
106. Hurt A.C., Alexander R., Hibbert J., Deed N., Barr I.G. Performance of six influenza rapid tests in detecting human influenza in clinical specimens // J. Clin. Virol. 2007; 39: 132–5.
107. Rashid H., Shafi S., Haworth E. et al. Value of rapid testing for influenza among Hajj pilgrims // Travel Med. Infect. Dis. 2007; 5: 310–3.
108. Uyeki T.M., Prasad P.P., Vukotich C. et al. Low rapid influenza diagnostic test sensitivity // Clin. Infect. Dis. (in press).
109. McGeer A.J. Diagnostic testing or empirical therapy for patients hospitalized with suspected influenza: what to do? // Clin. Infect. Dis. 2009; 48(Suppl. 1): S14–9.
110. Landry M.L., Cohen S., Ferguson D. Real-time PCR compared to Binax NOW and cytospin-immunofluorescence for detection of influenza in hospitalized patients // J. Clin. Virol. 2008; 43: 148–51.
111. Cruz A.T., Cazacu A.C., Greer J.M., Demmler G.J. Rapid assays for the diagnosis of influenza A and B viruses in patients evaluated at a large tertiary care children’s hospital during two consecutive winter seasons // J. Clin. Virol. 2008; 41: 143–7.
112. Rahman M., Kieke B.A., Vandermause M.F., Mitchell P.D., Greenlee R.T., Belongia E.A. Performance of Directigen flu A + B enzyme immunoassay and direct fluorescent assay for detection of influenza infection during the 2004–2005 season // Diagn. Microbiol. Infect. Dis. 2007; 58: 413–8.
113. Ali T., Scott N., Kallas W. et al. Detection of influenza antigen with rapid antibody-based tests after intranasal influenza vaccination (FluMist) // Clin. Infect. Dis. 2004; 38: 760–2.
114. Vesikari T., Karvonen A., Korhonen T. et al. A randomized, double-blind study of the safety, transmissibility and phenotypic and genotypic stability of cold-adapted influenza virus vaccine, SLH // Pediatr. Infect. Dis. J. 2006; 25: 590–5.
115. Bright R.A., Medina M.J., Xu X. et al. Incidence of adamantane resistance among influenza A (H3N2) viruses isolated worldwide from 1994 to 2005: a cause for concern // Lancet 2005; 366: 1175–81.
116. Bright R.A., Shay D.K., Shu B., Cox N.J., Klimov A.I. Adamantane resistance among influenza A viruses isolated early during the 2005–2006 influenza season in the United States // JAMA 2006; 295: 891–4.
117. Deyde V.M., Xu X., Bright R.A. et al. Surveillance of resistance to adamantanes among influenza A(H3N2) and A(H1N1) viruses isolated worldwide // J. Infect. Dis. 2007; 196: 249–57.
118. Kawai N., Ikematsu H., Iwaki N. et al. A comparison of the effectiveness of zanamivir and oseltamivir for the treatment of influenza A and B // J. Infect. 2008; 56: 51–7.
119. Sato M., Saito R., Sato I. et al. Effectiveness of oseltamivir treatment among children with influenza A or B virus infections during four successive winters in Niigata City, CZH, Japan // Tohoku J. Exp. Med. 2008; 214: 113–20.
120. Monto A.S., McKimm-Breschkin J.L., Macken C. et al. Detection of influenza viruses resistant to neuraminidase inhibitors in global surveillance during the first 3 years of their use // Antimicrob. Agents Chemother 2006; 50: 2395–402.
121. Neuraminidase Inhibitor Susceptibility Network. Monitoring of neuraminidase inhibitor resistance among clinical influenza virus isolates in Japan during the 2003–2006 influenza seasons // Wkly Epidemiol. Rec. 2007; 82: 149–50.
122. Centers for Disease Control and Prevention. CDC issues interim recommendations for the use of influenza antiviral medications in the setting of oseltamivir resistance among circulating influenza A (H1N1) viruses, 2008–09 influenza season. 2008. Available at: http://www2a.cdc.gov/HAN/ArchiveSys/ViewMsgV.asp?AlertNump00279. Accessed 28 January 2009.
123. Hauge S.H., Dudman S.G., Borgen K., Lackenby A., Hungnes O. Oseltamivir-resistant influenza viruses A (H1N1), Norway, 2007–08 // Emerg. Infect. Dis. 2009; 15: 155–62.
124. Hayden F. Developing new antiviral agents for influenza treatment: what does the future hold? // Clin. Infect. Dis. 2009; 48(Suppl. 1): S3–13.
125. Besselaar T.G., Dhamari N., Buys A. et al. Widespread oseltamivir resistance in influenza A viruses (H1N1), South Africa // Emerg. Infect. Dis. 2008; 14: 1809–10.
126. Centers for Disease Control and Prevention. Update: influenza activity — United States, September 30, 2007 — February 9, 2008 // MMWR Morb. Mortal. Wkly. Rep. 2008; 57: 179–83.
127. Ciancio B., Fernandez de la Hoz K., Kreidl P. et al. Oseltamivir resistance in human seasonal influenza viruses (A/H1N1) in EU and EFTA countries: an update // Euro Surveill. 2008; 13: 8032.
128. Lackenby A., Hungnes O., Dudman S.G. et al. Emergence of resistance to oseltamivir among influenza A(H1N1) viruses in Europe // Euro Surveill. 2008; 13: 8026.
129. Lackenby A., Thompson C.I., Democratis J. The potential impact of neuraminidase inhibitor resistant influenza // Curr. Opin. Infect. Dis. 2008; 21: 626–38.
130. Nicoll A., Ciancio B., Kramarz P. Observed oseltamivir resistance in seasonal influenza viruses in Europe interpretation and potential implications // Euro Surveill. 2008; 13: 8025.
131. Sheu T.G., Deyde V.M., Okomo-Adhiambo M. et al. Surveillance for neuraminidase inhibitor resistance among human influenza A and B viruses circulating worldwide from 2004 to 2008 // Antimicrob. Agents Chemother. 2008; 52: 3284–92.
132. Okamoto S., Kamiya I., Kishida K., Shimakawa T., Fukui T., Morimoto T. Experience with oseltamivir for infants younger than 1 year old in Japan // Pediatr. Infect. Dis. J. 2005; 24: 575–6.
133. Tamura D., Miura T., Kikuchi Y. Oseltamivir phosphate in infants under 1 year of age with influenza infection // Pediatr. Int. 2005; 47: 484.
134. Shalabi M., Abughali N., Abzug M. et al., for the NIAID Collaborative Antiviral Study Group (CASG). Safety of osetamivir vs. adamantane or rmiantadine in children under 1 year of age // Program and abstracts of the 45th Annual Meeting of the Infectious Diseases Society of America (San Diego). — Alexandria, VA: Infectious Diseases Society of America, 2007.
135. Gilbert B.E., Wilson S.Z., Knight V. et al. Ribavirin small-particle aerosol treatment of infections caused by influenza virus strains A/Victoria/7/83 (H1N1) and B/Texas/1/84 // Antimicrob. Agents Chemother. 1985; 27: 309–13.
136. Knight V., McClung H.W., Wilson S.Z. et al. Ribavirin small-particle aerosol treatment of influenza // Lancet 1981; 2: 945–9.
137. McClung H.W., Knight V., Gilbert B.E., Wilson S.Z., Quarles J.M., Divine G.W. Ribavirin aerosol treatment of influenza B virus infection // JAMA 1983; 249: 2671–4.
138. Wilson S.Z., Gilbert B.E., Quarles J.M. et al. Treatment of influenza A (H1N1) virus infection with ribavirin aerosol // Antimicrob. Agents Chemother. 1984; 26: 200–3.
139. Rodriguez W.J., Hall C.B., Welliver R. et al. Efficacy and safety of aerosolized ribavirin in young children hospitalized with influenza: a double-blind, multicenter, placebo-controlled trial // J. Pediatr. 1994; 125: 129–35.
140. Stein D.S., Creticos C.M., Jackson G.G. et al. Oral ribavirin treatment of influenza A and B // Antimicrob. Agents Chemother. 1987; 31: 1285–7.
141. Hayden F.G., Sable C.A., Connor J.D., Lane J. Intravenous ribavirin by constant infusion for serious influenza and parainfluenzavirus infection // Antivir. Ther. 1996; 1: 51–6.
142. Ilyushina N.A., Hay A., Yilmaz N., Boon A.C., Webster R.G., Govorkova E.A. Oseltamivir-ribavirin combination therapy for highly pathogenic H5N1 influenza virus infection in mice // Antimicrob. Agents Chemother. 2008; 52: 3889–97.
143. Madren L.K., Shipman C., Hayden F.G. In vitro inhibitory effects of combinations of anti-influenza agents // Antivir. Chem. Chemother. 1995; 6: 109–13.
144. Jefferson T.O., Demicheli V., Di Pietrantonj C., Jones M., Rivetti D. Neuraminidase inhibitors for preventing and treating influenza in healthy adults // Cochrane Database Syst. Rev. 2006; 3: CD001265.
145. Kaiser L., Wat C., Mills T., Mahoney P., Ward P., Hayden F. Impact of oseltamivir treatment on influenza-related lower respiratory tract complications and hospitalizations // Arch. Intern. Med. 2003; 163: 1667–72.
146. Nordstrom B.L., Sung I., Suter P., Szneke P. Risk of pneumonia and other complications of influenza-like illness in patients treated with oseltamivir // Curr. Med. Res. Opin. 2005; 21: 761–8.
147. Lee N., Chan P.K., Choi K.W. et al. Factors associated with early hospital discharge of adult influenza patients // Antivir. Ther. 2007; 12: 501–8.
148. Jefferson T., Demicheli V., Rivetti D., Jones M., Di Pietrantonj C., Rivetti A. Antivirals for influenza in healthy adults: systematic review // Lancet 2006; 367: 303–13.
149. Monto A.S., Webster A., Keene O. Randomized, placebo-controlled studies of inhaled zanamivir in the treatment of influenza A and B: pooled efficacy analysis // J. Antimicrob. Chemother. 1999; 44(Suppl. B): 23–9.
150. Lalezari J., Campion K., Keene O., Silagy C. Zanamivir for the treatment of influenza A and B infection in high-risk patients: a pooled analysis of randomized controlled trials // Arch. Intern. Med. 2001; 161: 212–7.
151. Bowles S.K., Lee W., Simor A.E. et al. Use of oseltamivir during influenza outbreaks in Ontario nursing homes, 1999–2000 // J. Am. Geriatr. Soc. 2002; 50: 608–16.
152. Chemaly R.F., Torres H.A., Aguilera E.A. et al. Neuraminidase inhibitors improve outcome of patients with leukemia and influenza: an observational study // Clin. Infect. Dis. 2007; 44: 964–7.
153. Nichols W.G. Combating infections in hematopoietic stem cell transplant recipients // Expert. Rev. Anti Infect. Ther. 2003; 1: 57–73.
154. Nichols W.G. Management of infectious complications in the hematopoietic stem cell transplant recipient // J. Intensive Care Med. 2003; 18: 295–312.
155. Blumentals W.A., Schulman K.L. Impact of oseltamivir on the incidence of secondary complications of influenza in adolescent and adult patients: results from a retrospective population-based study // Curr. Med. Res. Opin. 2007; 23: 2961–70.
156. Orzeck E.A., Shi N., Blumentals W.A. Oseltamivir and the risk of influenza-related complications and hospitalizations in patients with diabetes // Clin. Ther. 2007; 29: 2246–55.
157. Cooper N.J., Sutton A.J., Abrams K.R., Wailoo A., Turner D., Nicholson K.G. Effectiveness of neuraminidase inhibitors in treatment and prevention of influenza A and B: systematic review and meta-analyses of randomised controlled trials // BMJ 2003; 326: 1235.
158. Carrat F., Vergu E., Ferguson N.M. et al. Time lines of infection and disease in human influenza: a review of volunteer challenge studies // Am. J. Epidemiol. 2008; 167: 775–85.
159. Hayden F.G., Treanor J.J., Fritz R.S. et al. Use of the oral neuraminidase inhibitor oseltamivir in experimental human influenza: randomized controlled trials for prevention and treatment // JAMA 1999; 282: 1240–6.
160. Treanor J.J., Hayden F.G., Vrooman P.S. et al. Efficacy and safety of the oral neuraminidase inhibitor oseltamivir in treating acute influenza: a randomized controlled trial. US Oral Neuraminidase Study Group // JAMA 2000; 283: 1016–24.
161. Aoki F.Y., Macleod M.D., Paggiaro P. et al. Early administration of oral oseltamivir increases the benefits of influenza treatment // J. Antimicrob. Chemother. 2003; 51: 123–9.
162. Hayden F.G., Osterhaus A.D., Treanor J.J. et al. Efficacy and safety of the neuraminidase inhibitor zanamivir in the treatment of influenzavirus infections. GG167 Influenza Study Group // N. Engl. J. Med. 1997; 337: 874–80.
163. McGeer A., Green K.A., Plevneshi A. et al. Antiviral therapy and outcomes of influenza requiring hospitalization in Ontario, Canada // Clin. Infect. Dis. 2007; 45: 1568–75.
164. Whitley R.J., Hayden F.G., Reisinger K.S. et al. Oral oseltamivir treatment of influenza in children // Pediatr. Infect. Dis. J. 2001; 20: 127–33.
165. Johnston S.L., Ferrero F., Garcia M.L., Dutkowski R. Oral oseltamivir improves pulmonary function and reduces exacerbation frequency for influenza-infected children with asthma // Pediatr. Infect. Dis. J. 2005; 24: 225–32.
166. Barr C.E., Schulman K., Iacuzio D., Bradley J.S. Effect of oseltamivir on the risk of pneumonia and use of health care services in children with clinically diagnosed influenza // Curr. Med. Res. Opin. 2007; 23: 523–31.
167. Hedrick J.A., Barzilai A., Behre U. et al. Zanamivir for treatment of symptomatic influenza A and B infection in children five to twelve years of age: a randomized controlled trial // Pediatr. Infect. Dis. J. 2000; 19: 410–7.
168. Randomised trial of efficacy and safety of inhaled zanamivir in treatment of influenza A and B virus infections. The MIST (Management of Influenza in the Southern Hemisphere Trialists) Study Group // Lancet 1998; 352: 1877–81.
169. Makela M.J., Pauksens K., Rostila T. et al. Clinical efficacy and safety of the orally inhaled neuraminidase inhibitor zanamivir in the treatment of influenza: a randomized, double-blind, placebo-controlled European study // J. Infect. 2000; 40: 42–8.
170. Monto A.S., Fleming D.M., Henry D. et al. Efficacy and safety of the neuraminidase inhibitor zanamivirin the treatment of influenza A and B virus infections // J. Infect. Dis. 1999; 180: 254–61.
171. Sugaya N., Tamura D., Yamazaki M. et al. Comparison of the clinical effectiveness of oseltamivir and zanamivir against influenza virus infection in children // Clin. Infect. Dis. 2008; 47: 339–45.
172. Kiso M., Mitamura K., Sakai-Tagawa Y. et al. Resistant influenza A viruses in children treated with oseltamivir: descriptive study // Lancet 2004; 364: 759–65.
173. Stephenson I., Democratis J., Lackenby A. et al. Neuraminidase inhibitor resistance after oseltamivir treatment of acute influenza A and B in children // Clin. Infect. Dis. 2009 (Epub ahead of print).
174. Baz M., Abed Y., McDonald J., Boivin G. Characterization of multidrug-resistant influenza A/H3N2 viruses shed during 1 year by an immunocompromised child // Clin. Infect. Dis. 2006; 43: 1555–61.
175. Ison M.G., Gubareva L.V., Atmar R.L., Treanor J., Hayden F.G. Recovery of drug-resistant influenza virus from immunocompromised patients: a case series // J. Infect. Dis. 2006; 193: 760–4.
176. Hatakeyama S., Sugaya N., Ito M. et al. Emergence of influenza B viruses with reduced sensitivity to neuraminidase inhibitors // JAMA 2007; 297: 1435–42.
177. Van der Vries E., van den Berg B., Schutten M. Fatal oseltamivir-resistant influenza virus infection // N. Engl. J. Med. 2008; 359: 1074–6.
178. Roche. Oseltamivir (package insert). — Nutley, NJ: Roche, 2008. Available at: http://www.rocheusa.com/pro-ducts/tamiflu/pi.pdf.
179. US Food and Drug Administration. FDA Pediatric Advisory Committee meeting on adverse event reports, focusing on neuropsychiatric and behavioral events, for Tamiflu (oseltamivir) (FDA transcript).2007.
180. Schnirring L. Japanese study finds no behavioral effects from Tamiflu. 2008. Available at: http://www.cidrap.umn.edu/cidrap/content/influenza/panflu/news/jul1108tamiflu-br.html. Accessed 21 November 2008.
181. McGeer A.J., Lee W., Loeb M. et al. Adverse effects of amantadine and oseltamivir used during respiratory outbreaks in a center for developmentally disabled adults // Infect. Control. Hosp. Epidemiol. 2004; 25: 955–61.
182. GSK. Zanamivir (package insert). Philadelphia: GSK, 2008. Available at: http://us.gsk.com/products/assets/us_relenza.pdf.
183. Monto A.S., Fleming D.M., Henry D. et al. Efficacy and safety of the neuraminidase inhibitor zanamivir in the treatment of influenza A and B virus infections // J. Infect. Dis. 1999; 180: 254–61.
184. Moscona A. Neuraminidase inhibitors for influenza // N. Engl. J. Med. 2005; 353: 1363–73.
185. Williamson J.C., Pegram P.S. Respiratory distress associated with zanamivir // N. Engl. J. Med. 2000; 342: 661–2.
186. Murphy K.R., Elvindson A., Pauksens K., Stein W.J. Efficacy and safety of inhaled zanamivir for the treatment of influenza in patients with asthma or chronic obstructive pulmonary disease: a double-blind, randomised, placebo-controlled, multicentre study // Clin. Drug. Investig. 2000; 20: 337–49.
187. Mandell L.A., Wunderink R.G., Anzueto A. et al. Infectious Diseases Society of America/American Thoracic Society consensus guidelines on the management of community-acquired pneumonia in adults // Clin. Infect. Dis. 2007; 44(Suppl. 2): S27–72.
188. Hayden F.G., Pavia A.T. Antiviral management of seasonal and pandemic influenza // J. Infect. Dis. 2006; 194(Suppl. 2): S119–26.
189. Oseltamvir, amantadine (review) and zanamivir for the prophylaxis of influenza // London: National Institute for Health and Clinical Excellence, 2008.
190. Hayden F.G., Belshe R.B., Clover R.D., Hay A.J., Oakes M.G., Soo W. Emergence and apparent transmission of rimantadine-resistant influenza A virus in families // N. Engl. J. Med. 1989; 321: 1696–702.
191. Hayden F.G., Gubareva L.V., Monto A.S. et al. Inhaled zanamivir for the prevention of influenza in families. Zanamivir Family Study Group // N. Engl. J. Med. 2000; 343: 1282–9.
192. Monto A.S., Pichichero M.E., Blanckenberg S.J. et al. Zanamivir prophylaxis: an effective strategy for the prevention of influenza types A and B within households // J. Infect. Dis. 2002; 186: 1582–8.
193. Hayden F.G., Belshe R., Villanueva C. et al. Management of influenza in households: a prospective, randomized comparison of oseltamivir treatment with or without postexposure prophylaxis // J. Infect. Dis. 2004; 189: 440–9.
194. Welliver R., Monto A.S., Carewicz O. et al. Effectiveness of oseltamivir in preventing influenza in household contacts: a randomized controlled trial // JAMA 2001; 285: 748–54.
195. Rubin M.S., Nivin B., Ackelsberg J. Effect of timing of amantadine chemoprophylaxis on severity of outbreaks of influenza A in adult long-term care facilities // Clin. Infect. Dis. 2008; 47: 47–52.
196. Peters P.H. Jr, Gravenstein S., Norwood P. et al. Long-term use of oseltamivir for the prophylaxis of influenza in a vaccinated frail older population // J. Am. Geriatr. Soc. 2001; 49: 1025–31.
197. Monto A.S., Rotthoff J., Teich E. et al. Detection and control of influenza outbreaks in well-vaccinated nursing home populations // Clin. Infect. Dis. 2004; 39: 459–64.
198. Gravenstein S., Drinka P., Osterweil D. et al. Inhaled zanamivir versus rimantadine for the control of influenza in a highly vaccinated long-term care population // J. Am. Med. Dir. Assoc. 2005; 6: 359–66.
199. Chemaly R.F., Ghosh S., Bodey G.P. et al. Respiratory viral infections in adults with hematologic malignancies and human stem cell transplantation recipients: a retrospective study at a major cancer center // Medicine (Baltimore) 2006; 85: 278–87.
200. Vu D., Peck A.J., Nichols W.G. et al. Safety and tolerability of oseltamivir prophylaxis in hematopoietic stem cell transplant recipients: a retrospective case-control study // Clin. Infect. Dis. 2007; 45: 187–93.
201. Gross P.A., Hermogenes A.W., Sacks H.S., Lau J., Levandowski R.A. The efficacy of influenza vaccine in elderly persons: a meta-analysis and review of the literature // Ann. Intern. Med. 1995; 123: 518–27.
202. Nichol K.L., Margolis K.L., Wouremna J., von Sternberg T. Effectiveness of influenza vaccine in the elderly // Gerontology 1996; 42: 274–9.
203. Tasker S.A., Treanor J.J., Paxton W.B., Wallace M.R. Efficacy of influenza vaccination in HIV-infected persons: a randomized, double–blind, placebo–controlled trial // Ann. Intern. Med. 1999; 131: 430–3.
204. Yamanaka H., Teruya K., Tanaka M. et al. Efficacy and immunologic responses to influenza vaccine in HIV-1-infected patients // J. Acquir Immune Defic. Syndr. 2005; 39: 167–73.
205. Kroon F.P., van Dissel J.T., de Jong J.C., Zwinderman K., van Furth R. Antibody response after influenza vaccination in HIV-infected individuals: a consecutive 3-year study // Vaccine 2000; 18: 3040–9.
206. Smith P.W., Bennett G., Bradley S. et al. SHEA/APIC guideline: infection prevention and control in the long-term care facility, July 2008 // Infect. Control Hosp. Epidemiol. 2008; 29: 785–814.
207. Bradley S.F. Prevention of influenza in long-term-care facilities. Long-Term-Care Committee of the Society for Healthcare Epidemiology of America // Infect. Control. Hosp. Epidemiol. 1999; 20: 629–37.
208. Sneller V.P., Izurieta H., Bridges C.B. et al. Prevention and control of vaccine-preventable diseases in long-term care facilities // J. Am. Med. Dir. Assoc. 2000: S1–37.
209. Drinka P.J., Krause P., Nest L., Goodman B.M., Gravenstein S. Risk of acquiring influenza A in a nursing home from a culture-positive roommate // Infect. Control. Hosp. Epidemiol. 2003; 24: 872–4.
210. Bridges C.B., Kuehnert M.J., Hall C.B. Transmission of influenza: implications for control in health care settings // Clin. Infect. Dis. 2003; 37: 1094–101.
211. Gomolin I.H., Leib H.B., Arden N.H., Sherman F.T. Control of influenza outbreaks in the nursing home: guidelines for diagnosis and management // J. Am. Geriatr. Soc. 1995; 43: 71–4.
212. Siegel J., Rhinehart E., Jackson M., Chiarello L.; the Healthcare Infection Control Practices Advisory Committee. 2007 Guideline for isolation precautions: preventing transmission of infectious agents in healthcare settings. 2007. Available at: http://www.cdc.gov/ncidod/dhqp/pdf/ guidelines/isolation2007pdf. Accessed 4 March 2009.
213. Zadeh M.M., Buxton Bridges C., Thompson W.W., Arden N.H., Fukuda K. Influenza outbreak detection and control measures in nursing homes in the United States // J. Am. Geriatr. Soc. 2000; 48: 1310–5.
214. Bridges C.B., Harper S. The full-court press for influenza prevention in elderly persons // Clin. Infect. Dis. 2004; 39: 465–7.
215. Drinka P.J., Gravenstein S., Krause P. et al. Non-influenza respiratory viruses may overlap and obscure influenza activity // J. Am. Geriatr. Soc. 1999; 47: 1087–93.
216. Ellis S.E., Coffey C.S., Mitchel E.F. Jr, Dittus R.S., Griffin M.R. Influenza- and respiratory syncytial virus-associated morbidity and mortality in the nursing home population // J. Am. Geriatr. Soc. 2003; 51: 761–7.
217. Lee C., Loeb M., Phillips A. et al. Zanamivir use during transmission of amantadine-resistant influenza A in a nursing home // Infect. Control. Hosp. Epidemiol. 2000; 21: 700–4.
218. Parker R., Loewen N., Skowronski D. Experience with oseltamivir in the control of a nursing home influenza B outbreak // Can. Commun. Dis. Rep. 2001; 27: 37–40.
219. Schilling M., Povinelli L., Krause P. et al. Efficacy of zanamivir for chemoprophylaxis of nursing home influenza outbreaks // Vaccine 1998; 16: 1771–4.
220. Van der Sande M.A., Ruijs W.L., Meijer A., Cools H.J., van der Plas S.M. Use of oseltamivir in Dutch nursing homes during the 2004–2005 influenza season // Vaccine 2006; 24: 6664–9.
221. Cohen N.J., Morita J.Y., Plate D.K. et al. Control of an outbreak due to an adamantane-resistant strain of influenza A (H3N2) in a chronic care facility // Infection 2008; 36: 458–62.
222. Monto A.S., Ohmit S.E., Hornbuckle K., Pearce C.L. Safety and efficacy of long-term use of rimantadine for prophylaxis of type A influenza in nursing homes // Antimicrob. Agents Chemother. 1995; 39: 2224–8.
223. Ong A.K., Hayden F.G., John F. Enders lecture 2006: antivirals for influenza // J. Infect. Dis. 2007; 196: 181–90.
224. Whitley R.J., Monto A.S. Prevention and treatment of influenza in high-risk groups: children, pregnant women, immunocompromised hosts, and nursing home residents // J. Infect. Dis. 2006; 194(Suppl. 2): S133–8.
225. Risebrough N.A., Bowles S.K., Simor A.E., McGeer A., Oh P.I. Economic evaluation of oseltamivir phosphate for postexposure prophylaxis of influenza in long-term care facilities // J. Am. Geriatr. Soc. 2005; 53: 444–51.
226. Carman W.F., Elder A.G., Wallace L.A. et al. Effects of influenza vaccination of healthcare workers on mortality of elderly people in long-term care: a randomised controlled trial // Lancet 2000; 355: 93–7.
227. Potter J., Stott D.J., Roberts M.A. et al. Influenza vaccination of health care workers in long-term-care hospitals reduces the mortality of elderly patients // J. Infect. Dis. 1997; 175: 1–6.
228. Pachucki C.T., Pappas S.A., Fuller G.F., Krause S.L., Lentino J.R., Schaaff D.M. Influenza A among hospital personnel and patients: implications for recognition, prevention, and control // Arch. Intern. Med. 1989; 149: 77–80.
229. Drinka P.J., Gravenstein S., Schilling M., Krause P., Miller B.A., Shult P. Duration of antiviral prophylaxis during nursing home outbreaks of influenza A: a comparison of 2 protocols // Arch. Intern. Med. 1998; 158: 2155–9.
Посилання [Who Guidelines for Pharmacological Management of Pandemic Influenza A (H1N1) 2009 and Other Influenza Viruses (February 2010)]
1. Abdel-Ghafar A.N., Chotpitayasunondh T., Gao Z., Hayden F.G., Nguyen D.H., de Jong M.D. et al. Update on avian influenza A (H5N1) virus infection in humans // N. Engl. J. Med. 2008; 358(3): 261–73.
2. Alves Galvao M.G., Rocha Crispino Santos M.A., Alves da Cunha A.J. Amantadine and rimantadine for influenza A in children and the elderly // Cochrane Database Syst. Rev. 2008(1): CD002745.
3. Barr C.E., Schulman K., Iacuzio D., Bradley J.S. Effect of oseltamivir on the risk of pneumonia and use of health care services in children with clinically diagnosed influenza // Curr. Med. Res. Opin. 2007; 23(3): 523–31.
4. Belay E.D., Bresee J.S., Holman R.C., Khan A.S., Shahriari A., Schonberger L.B. Reye’s syndrome in the United States from 1981 through 1997 // N. Engl. J. Med. 1999; 340(18): 1377–82.
5. Beliaev A.L., Burtseva E.I., Slepushkin A.N., Beliaeva N.A., Nosik N.N., Lavrukhina L.A. et al. [Arbidole — a new drug for prevention of influenza and acute viral respiratory infections in children] // Vestn. Ross. Akad. Med. Nauk. 1996(8): 34–7.
6. Bell M., Hunter J.M., Mostafa S.M. Nebulised ribavirin for influenza B viral pneumonia in a ventilated immunocompromised adult // Lancet 1988; 2(8619): 1084–5.
7. Bernard G.R., Luce J.M., Sprung C.L., Rinaldo J.E., Tate R.M., Sibbald W.J. et al. High-dose corticosteroids in patients with the adult respiratory distress syndrome // N. Engl. J. Med. 1987; 317(25): 1565–70.
8. Bernstein D.I., Reuman P.D., Sherwood J.R., Young E.C., Schiff G.M. Ribavirin small-particleaerosol treatment of influenza B virus infection // Antimicrob. Agents Chemother. 1988; 32(5): 761–4.
9. Birnkrant D., Cox E. The Emergency Use Authorization of peramivir for treatment of 2009 H1N1 influenza // N. Engl. J. Med. 2009; 361(23): 2204–7.
10. Blumentals W.A., Song X. The safety of oseltamivir in patients with influenza: analysis of healthcare claims data from six influenza seasons // Med. Gen. Med. 2007; 9(4): 23.
11. Boriskin Y.S., Leneva I.A., Pecheur E.I., Polyak S.J. Arbidol: a broad-spectrum antiviral compound that blocks viral fusion // Curr. Med. Chem. 2008; 15(10): 997–1005.
12. Bowles S.K., Lee W., Simor A.E., Vearncombe M., Loeb M., Tamblyn S. et al. Use of oseltamivir during influenza outbreaks in Ontario nursing homes, 1999–2000 // J. Am. Geriatr. Soc. 2002; 50(4): 608–16.
13. Burch J., Paulden M., Conti S., Stock C., Corbett M., Welton N.J. et al. Antiviral drugs for the treatment of influenza: a systematic review and economic evaluation // Health Technol. Assess 2009; 13(58): 1–265, III–IV.
14. Burch J., Conti for the CRD/CHE Technology Assessment Group (Centre for Reviews and Dissemination/Centre for Health Economics), University of York. Influenza-zanamivir, amantadine and oseltamivir (review): assessment report. http://www.nice.org.uk/Guidance/TA168, 2008.
15. Cao B., Li X.W., Mao Y., Wang J., Lu H.Z., Chen Y.S. et al. Clinical features of the initial cases of 2009 pandemic influenza A (H1N1) virus infection in China // N. Engl. J. Med. 2009; 361(26): 2507–17.
16. Carter M.J. A rationale for using steroids in the treatment of severe cases of H5N1 avian influenza // J. Med. Microbiol. 2007; 56(Pt 7): 875–83.
17. Casscells S.W., Granger E., Kress A.M., Linton A., Madjid M., Cottrell L. Use of oseltamivir after influenza infection is associated with reduced incidence of recurrent adverse cardiovascular outcomes among military health system beneficiaries with prior cardiovascular diseases // Circ. Cardiovasc. Qual. Outcomes 2009; 2(2): 108–15.
18. CDC, Update: drug susceptibility of swine-origin influenza A (H1N1) viruses, April 2009 // MMWR Morb. Mortal. Wkly. Rep. 2009; 58(16): 433–5.
19. CDC, Reye syndrome-Ohio, Michigan // MMWR Morb. Mortal. Wkly. Rep. 1980; 29.
20. Chan-Tack K.M., Murray J.S., Birnkrant D.B. Use of ribavirin to treat influenza // N. Engl. J. Med. 2009; 361(17): 1713–4.
21. Cole J.A., Loughlin J.E., Ajene A.N., Rosenberg D.M., Cook S.E., Walker A.M. The effect of zanamivir treatment on influenza complications: a retrospective cohort study // Clin. Ther. 2002; 24(11): 1824–39.
22. Denholm J.T., Gordon C.L., Johnson P.D., Hewagama S.S., Stuart R.L., Aboltins C. et al. Hospitalised adult patients with pandemic (H1N1) 2009 influenza in Melbourne, Australia // Med. J. Aust. 2010; 192(2): 84–6.
23. De Serres G., Shedding of novel 2009 pandemic H1N1 (nH1N1)v Virus at one week post illness onset, Abstract K-1918a. 49th Interscience Conference on Antimicrobial Agents and Chemotherapy (ICAAC) 2009 12–15th Sept; San Francisco, CA.
24. Dominguez-Cherit G., Lapinsky S.E., Macias A.E., Pinto R., Espinosa-Perez L., de la Torre A. et al. Critically Ill patients with 2009 influenza A(H1N1) in Mexico // JAMA 2009; 302(17): 1880–7.
25. Drinevskii V.P., Osidak L.V., Natsina V.K., Afanas’eva O.I., Mil’kint K.K., Danini G.V. et al. [Chemotherapeutics for treatment of influenza and other viral respiratory tract infections in children] // Antibiot. Khimioter. 1998; 43(9): 29–34.
26. Dutkowski R. et al. High-Dose Oseltamivir Regimens Are Well Tolerated by Healthy Adults. Abstract V-1062. 49th Interscience Conference on Antimicrobial Agents and Chemotherapy (ICAAC) 2009 12–15th Sept; San Francisco, CA.
27. Echevarria-Zuno S., Mejia-Arangure J.M., Mar-Obeso A.J., Grajales-Muniz C., Robles-Perez E., Gonzalez-Leon M. et al. Infection and death from influenza A H1N1 virus in Mexico: a retrospective analysis // Lancet 2009 [epub in print].
28. Electronic Medicines Compendium, Copegus 200 mg Film-coated Tablets-Summary of Product Characteristics (SPC)-electronic Medicines Compendium (eMC). Accessed 6th Nov 2009 at http://emc.medicines.org.uk/document.aspx?documentId=11755.
29. Englund J., Zerr D., Heath J. et al. Oseltamivir-resistant novel influenza A (H1N1) virus infection in two immunosuppressed patients – Seattle, Washington, 2009 // MMWR Morb. Mortal. Wkly. Rep. 2009; 58(32): 893–6.
30. Freemantle N., Calvert M. What can we learn from observational studies of oseltamivir to treat influenza in healthy adults? // BMJ 2009; 339: b5248.
31. French D.D., Margo C.E. Postmarketing surveillance of corneal edema, Fuchs dystrophy, and amantadine use in the Veterans Health Administration // Cornea 2007; 26(9): 1087–9.
32. Gagarinova V.M., Ignat’eva G.S., Sinitskaia L.V., Ivanova A.M., Rodina M.A., Tur’eva A.V. [The new chemical preparation arbidol: its prophylactic efficacy during influenza epidemics] // Zh. Mikrobiol. Epidemiol. Immunobiol. 1993(5): 40–3.
33. Gooskens J., Jonges M., Claas E.C., Meijer A., van den Broek P.J., Kroes A.M. Morbidity and mortality associated with nosocomial transmission of oseltamivir-resistant influenza A(H1N1) virus // JAMA 2009; 301(10): 1042–6.
34. Gums J.G., Pelletier E.M., Blumentals W.A. Oseltamivir and influenza-related complications, hospitalization and healthcare expenditure in healthy adults and children // Expert. Opin. Pharmacother. 2008; 9(2): 151–61.
35. Guskova T.A., Leneva I.A., Fedyakina I.T., Chistyakov V.V., Glushkov R.G. // Chem. Pharm. J. (Russian), 1999, 6, 14.
36. Halpin T.J., Holtzhauer F.J., Campbell R.J., Hall L.J., Correa-Villasenor A., Lanese R. et al. Reye’s syndrome and medication use // JAMA 1982; 248(6): 687–91.
37. Hanshaoworakul W., Simmerman J.M., Narueponjirakul U., Sanasuttipun W., Shinde V., Kaewchana S. et al. Severe human influenza infections in Thailand: oseltamivir treatment and risk factors for fatal outcome // PLoS One 2009; 4(6): e6051.
38. Hayden F.G., Sable C.A., Connor J.D., Lane J. Intravenous ribavirin by constant infusion for serious influenza and parainfluenzavirus infection // Antivir. Ther. 1996; 1(1): 51–6.
39. Hayden F.G. Prevention and treatment of influenza in immunocompromised patients // Am. J. Med. 1997; 102(3A): 55–60; discussion 75–6.
40. Hedrick J.A., Barzilai A., Behre U., Henderson F.W., Hammond J., Reilly L. et al. Zanamivir for treatment of symptomatic influenza A and B infection in children five to twelve years of age: a randomized controlled trial // Pediatr. Infect. Dis. J. 2000; 19(5): 410–7.
41. Jain S., Kamimoto L., Bramley A.M., Schmitz A.M., Be–noit S.R., Louie J. et al. Hospitalized patients with 2009 H1N1 influenza in the United States, April–June 2009 // N. Engl. J. Med. 2009; 361(20): 1935–44.
42. Jamieson D.J., Honein M.A., Rasmussen S.A., Williams J.L., Swerdlow D.L., Biggerstaff M.S. et al. H1N1 2009 influenza virus infection during pregnancy in the USA // Lancet 2009; 374(9688): 451–8.
43. Jefferson T., Demicheli V., Di Pietrantonj C., Rivetti D. Amantadine and rimantadine for influenza A in adults // Cochrane Database Syst. Rev. 2006(2): CD001169.
44. Jefferson T., Jones M., Doshi P., Del Mar C. Neuraminidase inhibitors for preventing and treating influenza in healthy adults: systematic review and meta-analysis // BMJ 2009; 339: b5106.
45. Kaiser L., Keene O.N., Hammond J.M., Elliott M., Hayden F.G. Impact of zanamivir on antibiotic use for respiratory events following acute influenza in adolescents and adults // Arch. Intern. Med. 2000; 160(21): 3234–40.
46. Kaiser L., Wat C., Mills T., Mahoney P., Ward P., Hayden F. Impact of oseltamivir treatment on influenza-related lower respiratory tract complications and hospitalizations // Arch. Intern. Med. 2003; 163(14): 1667–72.
47. Kawai N., Ikematsu H., Iwaki N., Maeda T., Kawashima T., Hirotsu N. et al. Comparison of the effectiveness of Zanamivir and Oseltamivir against influenza A/H1N1, A H3N2, and B // Clin. Infect. Dis. 2009; 48(7): 996–97.
48. Kawai N., Ikematsu H., Hirotsu N., Maeda T., Kawashima T., Tanaka O. et al. Clinical effectiveness of oseltamivir and zanamivir for treatment of influenza A virus subtype H1N1 with the H274Y mutation: a Japanese, multicenter study of the 2007–2008 and 2008–2009 influenza seasons // Clin. Infect. Dis. 2009; 49(12): 1828–35.
49. Keyser L.A., Karl M., Nafziger A.N., Bertino J.S., Jr. Comparison of central nervous system adverse effects of amantadine and rimantadine used as sequential prophylaxis of influenza A in elderly nursing home patients // Arch. Intern. Med. 2000; 160(10): 1485–8.
50. Khazeni N., Hutton D.W., Garber A.M., Hupert N., Owens D.K. Effectiveness and costeffectiveness of vaccination against pandemic influenza (H1N1) 2009 // Ann. Intern. Med. 2009; 151(12): 829–39.
51. Kidd I.M., Down J., Nastouli E., Shulman R., Grant P.R., Howell D.C. et al. H1N1 pneumonitis treated with intravenous zanamivir // Lancet 2009; 374(9694): 1036.
52. Kimberlin D.W., Shalabi M., Abzug M.J., Lang D., Jacobs R.F., Storch G. et al. Safety of Oseltamivir Compared With the Adamantanes in Children Less Than 12 Months of Age // Pediatr. Infect. Dis. J. 2009. [epub ahead of print].
53. Kitching A., Roche A., Balasegaram S., Heathcock R., Maguire H. Oseltamivir adherence and side effects among children in three London schools affected by influenza A(H1N1)v, May 2009-an internet-based cross-sectional survey // Euro Surveill. 2009; 14(30): 19287.
54. Knight V., McClung H.W., Wilson S.Z., Waters B.K., Quarles J.M., Cameron R.W. et al. Ribavirin Small-particle aerosol treatment of influenza // Lancet 1981; 2(8253): 945–9.
55. Kolobukhina L.V., Merkulova L.N., Shchelkanov M., Burtseva E.I., Isaeva E.I., Malyshev N.A. et al. [Efficacy of ingavirin in adults with influenza] // Ter. Arkh. 2009; 81(3): 51–4.
56. Kramarev S.A., Palatnaya L.A., Litus V.I. // Rus. Med. J. (Russian), 2003, 21, 1050.
57. Kubar O.I., Stepanova L.A., Safonova L.S., Rosaeva N.R. IV Russian National Congress «Man and Medicine», Moscow, 1997, p. 269.
58. Lee N., Chan P.K., Hui D.S., Rainer T.H., Wong E., Choi K.W. et al. Viral loads and duration of viral shedding in adult patients hospitalized with influenza // J. Infect. Dis. 2009; 200(4): 492–500.
59. Lee N., Chan P.K., Choi K.W., Lui G., Wong B., Cockram C.S. et al. Factors associated with early hospital discharge of adult influenza patients // Antivir. Ther. 2007; 12(4): 501–8.
60. Li I.W., Hung I.F., To K.K., Chan K.H., Wong S.S., Chan J.F. et al. The natural viral load profile of patients with pandemic swine–origin influenza A H1N1 2009 (pH1N1) and the effect of oseltamivir treatment // Chest 2010 [epub ahead of print].
61. Libster R., Bugna J., Coviello S., Hijano D.R., Dunaiewsky M., Reynoso N. et al. Pediatric hospitalizations associated with 2009 pandemic influenza A (H1N1) in Argentina // N. Engl. J. Med. 2010; 362(1): 45–55.
62. Liem N.T., Tung C.V., Hien N.D., Hien T.T., Chau N.Q., Long H.T. et al. Clinical features of human influenza A (H5N1) infection in Vietnam: 2004–2006 // Clin. Infect. Dis. 2009; 48(12): 1639–46.
63. Louie J.K., Acosta M., Jamieson D.J., Honein M.A. Severe 2009 H1N1 influenza in pregnant and postpartum women in California // N. Engl. J. Med. 2010; 362(1): 27–35.
64. Louie J.K., Acosta M., Winter K., Jean C., Gavali S., Schechter R. et al. Factors associated with death or hospitalization due to pandemic 2009 influenza A(H1N1) infection in California // JAMA 2009; 302(17): 1896–902.
65. Lye D. Oseltamivir therapy and viral shedding in pandemic (H1N1) 2009. Abstract V-1269c. 49th Interscience Conference on Antimicrobial Agents and Chemotherapy (ICAAC) 2009 12–15th Sept; San Francisco, CA.
66. Madjid M., Curkendall S., Blumentals W.A. The influence of oseltamivir treatment on the risk of stroke after influenza infection // Cardiology 2009; 113(2): 98–107.
67. MEDA. Position paper: Ribavirin for treatment of influenza. — Virazole 12. June 2009.
68. McGeer A., Green K.A., Plevneshi A., Shigayeva A., Siddiqi N., Raboud J. et al. Antiviral therapy and outcomes of influenza requiring hospitalization in Ontario, Canada // Clin. Infect. Dis. 2007; 45(12): 1568–75.
69. Nichols W.G., Guthrie K.A., Corey L., Boeckh M. Influenza infections after hematopoietic stem cell transplantation: risk factors, mortality, and the effect of antiviral therapy // Clin. Infect. Dis. 2004; 39(9): 1300–6.
70. Nordstrom B.L., Oh K., Sacks S.T., L Italien G.J. Skin reactions in patients with influenza treated with oseltamivir: a retrospective cohort study // Antivir. Ther. 2004; 9(2): 187–95.
71. Nordstrom B.L., Sung I., Suter P., Szneke P. Risk of pneumonia and other complications of influenza-like illness in patients treated with oseltamivir // Curr. Med. Res. Opin. 2005; 21(5): 761–8.
72. Orzeck E.A., Shi N., Blumentals W.A. Oseltamivir and the risk of influenza-related complications and hospitalizations in patients with diabetes // Clin. Ther. 2007; 29(10): 2246–55.
73. Osterlund P., Pirhonen J., Ikonen N., Ronkko E., Strengell M., Makela S.M. et al. Pandemic H1N1 2009 influenza A virus induces weak cytokine responses in human macrophages and dendritic cells and is highly sensitive to the antiviral actions of interferons // J. Virol. 2010; 84(3): 1414–22.
74. Peters P.H., Moscona A., Schulman K.L., Barr C.E. Study of the impact of oseltamivir on the risk for pneumonia and other outcomes of influenza, 2000–2005 // Medscape J. Med. 2008; 10(6): 131.
75. Piedra P.A., Schulman K.L., Blumentals W.A. Effects of oseltamivir on influenza-related complications in children with chronic medical conditions // Pediatrics 2009; 124(1): 170–8.
76. Quispe-Laime A.M., Bracco J.D., Barberio P.A., Campagne C.G., Rolfo V.E., Umberger R. et al. H1N1 influenza A virus-associated acute lung injury: response to combination oseltamivir and prolonged corticosteroid treatment // Intensive Care Med. 2010; 36(1): 33–41.
77. Rello J., Rodriguez A., Ibanez P., Socias L., Cebrian J., Marques A. et al. Intensive care adult patients with severe respiratory failure caused by Influenza A (H1N1)v in Spain // Crit. Care 2009; 13(5): R148.
78. Riner A., Chan-Tack K.M., Murray J.S. Original research: Intravenous ribavirin-review of the FDA’s Emergency Investigational New Drug Database (1997–2008) and literature review // Postgrad. Med. 2009; 121(3): 139–46.
79. Rodriguez W.J., Hall C.B., Welliver R., Simoes E.A., Ryan M.E., Stutman H. et al. Efficacy and safety of aerosolized ribavirin in young children hospitalized with influenza: a double–blind, multicenter, placebo-controlled trial // J. Pediatr. 1994; 125(1): 129–35.
80. Sessler C.N., Gray N.D. Intensive care management of life–threatening avian influenza A (H5N1) // Respirology 2008; 13 Suppl. 1: S27–32.
81. Shun-Shin M., Thompson M., Heneghan C., Perera R., Harnden A., Mant D. Neuraminidase inhibitors for treatment and prophylaxis of influenza in children: systematic review and meta-analysis of randomised controlled trials // BMJ 2009; 339: b3172.
82. Shuster A.M., Shumilov V.I., Shevtsov V.A., Mar’in G.G., Kozlov V.N. [Arbidol used in the prophylaxis of acute respiratory viral infections and their complications in servicemen] // Voen. Med. Zh. 2004; 325(9): 44–5, 80.
83. Slopen M.E., Mosquera M.C., Balter S., Kerker B.D., Marx M.A., Pfeiffer M.R. et al. Patients hospitalized with 2009 pandemic influenza A (H1N1) – New York City, May 2009 // MMWR Morb. Mortal. Wkly. Rep. 2010; 58(51): 1436–40.
84. Smith C.B., Charette R.P., Fox J.P., Cooney M.K., Hall C.E. Lack of effect of oral ribavirin in naturally occurring influenza A virus (H1N1) infection // J. Infect. Dis. 1980; 141(5): 548–54.
85. Starko K.M., Ray C.G., Dominguez L.B., Stromberg W.L., Woodall D.F. Reye’s syndrome and salicylate use // Pediatrics 1980; 66(6): 859–64.
86. Steel J., Staeheli P., Mubareka S., Garcia–Sastre A., Palese P., Lowen A.C. Transmission of pandemic H1N1 influenza virus and impact of prior exposure to seasonal strains or interferon treatment // J. Virol. 2010; 84(1): 21–6.
87. Stein D.S., Creticos C.M., Jackson G.G., Bernstein J.M., Hayden F.G., Schiff G.M. et al. Oral ribavirin treatment of influenza A and B // Antimicrob. Agents Chemother. 1987; 31(8): 1285–7.
88. Steinberg K.P., Hudson L.D., Goodman R.B., Hough C.L., Lanken P.N., Hyzy R. et al. Efficacy and safety of corticosteroids for persistent acute respiratory distress syndrome // N. Engl. J. Med. 2006; 354(16): 1671–84.
89. Sugaya N., Mitamura K., Yamazaki M., Tamura D., Ichikawa M., Kimura K. et al. Lower clinical effectiveness of oseltamivir against influenza B contrasted with influenza A infection in children // Clin. Infect. Dis. 2007; 44(2): 197–202.
90. Tanaka T., Nakajima K., Murashima A., Garcia-Bournissen F., Koren G., Ito S. Safety of neuraminidase inhibitors against novel influenza A (H1N1) in pregnant and breastfeeding women // CMAJ 2009; 181(1–2): 55–8.
91. Tang B.M., Craig J.C., Eslick G.D., Seppelt I., McLean A.S. Use of corticosteroids in acute lung injury and acute respiratory distress syndrome: a systematic review and metaanalysis // Crit. Care Med. 2009; 37(5): 1594–603.
92. Tappenden P., Jackson R., Cooper K., Rees A., Simpson E., Read R. et al. Amantadine, oseltamivir and zanamivir for the prophylaxis of influenza (including a review of existing guidance no. 67): a systematic review and economic evaluation // Health Technol Assess 2009; 13(11): III, IX–XII, 1–246.
93. Uchaikin V.F., Kharlamova S.G., Cheshik S.G. // Pediatrics (Russian), 2004, 5, 73.
94. Van der Vries E., van den Berg B., Schutten M. Fatal oseltamivir-resistant influenza virus infection // N. Engl. J. Med. 2008; 359(10): 1074–6.
95. Waldman R.J., Hall W.N., McGee H., Van Amburg G. Aspirin as a risk factor in Reye’s syndrome // JAMA 1982; 247(22): 3089–94.
96. Wallensten A., Oliver I., Lewis D., Harrison S. Compliance and side effects of prophylactic oseltamivir treatment in a school in South West England // Euro Surveill. 2009; 14(30): 19285.
97. Wentges van Holthe N., van Eijkeren M., van der Laan J.W. Oseltamivir and breastfeeding // Int. J. Infect. Dis. 2008; 12(4): 451.
98. WHO Guidelines for Pharmacological Management of Pandemic (H1N1) 2009 Influenza and other Influenza Viruses. 20 August 2009 ed. Geneva: WHO, 2009.
99. WHO, Oseltamivir-resistant pandemic (H1N1) 2009 influenza virus, October 2009 // Wkly. Epidemiol. Rec. 2009; 84(44): 453–9.
100. Witkop C.T., Duffy M.R., Macias E.A., Gibbons T.F., Escobar J.D., Burwell K.N. et al. Novel Influenza A (H1N1) Outbreak at the U.S. Air Force Academy Epidemiology and Viral Shedding Duration // Am. J. Prev. Med. 2009 [Epub ahead of print].
101. Woo P.C., Tung E.T., Chan K.H., Lau C.C., Lau S.K., Yuen K.Y. Cytokine profiles induced by the novel swine-origin influenza A/H1N1 virus: implications for treatment strategies // J. Infect. Dis. 2010; 201(3): 346–53.
102. Yi Z., Ke X., Yuan X., Bao X. // Medline PMID: 15266832 (Chinese), 2004, 26, 289.
103. Zarychanski R., Stuart T.L., Kumar A., Doucette S., Elliott L., Kettner J. et al. Correlates of severe disease in patients with 2009 pandemic influenza (H1N1) virus infection // CMAJ 2010; 182(3): 257–64.
Література, використана в процесі адаптації клінічної настанови
1. Seasonal Influenza in Adults and Children — Diagnosis, Treatment, Chemoprophylaxis, and Institutional Outbreak Management: Clinical Practice Guidelines of the Infectious Diseases Society of America (2009).
2. NICE clinical guideline 69 «Respiratory tract infections — antibiotic prescribing», 2008.
3. WHO Guidelines for Pharmacological Management of Pandemic Influenza A (H1N1) 2009 and other Influenza Viruses (February 2010).
4. ВООЗ Клінічні методи ведення хворих, які інфіковані новим вірусом грипу A(H1N1): попередня настанова 21 травня 2009 року.
5. Печінка А.М., Дземан М.І. Гострі респіраторні захворювання: питання клінічної діагностики та лікування // Укр. мед. часопис. — № 5(79). — 2010. — С. 94–103.
6. WHO Regional office for Europe «Сезонний грип: ключові аспекти клінічного ведення тяжких форм хвороби (2011)» (http://www.euro.who.int/_data/assets/pdf_file/0007/154888/flu_case_management_rus.pdf

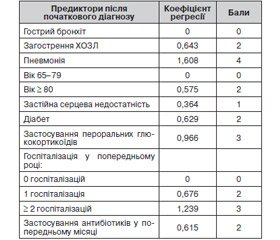
/tirag/127/127.jpg)
/tirag/130/130.jpg)
/tirag/133/133.jpg)
/tirag/136/136.jpg)
/tirag/137/137.jpg)
/tirag/143/143.jpg)
/tirag/162/162.jpg)
/tirag/163/163.jpg)
/tirag/149/149.jpg)
/tirag/164/164.jpg)
/tirag/165/165.jpg)
/tirag/167/167.jpg)
/tirag/168/168.jpg)
/tirag/171/171.jpg)
/tirag/172/172.jpg)
/tirag/173/173.jpg)