Журнал «Актуальная инфектология» 4 (5) 2014
Вернуться к номеру
Патогенетичні механізми ушкодження мозку при нейроінфекціях у дітей
Авторы: Пипа Л.В., Свістільник Р.В., Сердюк Т.В., Лисиця Ю.М. — Вінницький національний медичний університет ім. М.І. Пирогова
Рубрики: Инфекционные заболевания
Разделы: Клинические исследования
Версия для печати
У статті показано значення нейронспецифічної енолази та автоантитіл до фрагментів глутаматних рецепторів NR2A як маркерів ішемії і нейродеструкції при гострих менінгітах у дітей. Наявність автоантитіл до продуктів розпаду глутаматних NMDA-рецепторів, які пошкоджуються в умовах ішемії, вказує на залучення автоімунного компоненту в патогенез розвитку нейроінфекцій у дітей. Показано, що рівень нейронспецифічної енолази в крові при гострих менінгітах може виступати як маркер глибини деструкції нервової тканини і розвитку енцефаліту, а також ефективності та тривалості проведення нейропротективної терапії.
В статье представлено значение нейронспецифической энолазы и аутоантител к фрагментам глутаматных рецепторов NR2A как маркеров ишемии и нейродеструкции при острых менингитах у детей. Наличие аутоантител к продуктам распада глутаматных NMDA-рецепторов, которые повреждаются в условиях ишемии, указывает на вовлечение аутоиммунного компонента в патогенез развития нейроинфекций у детей. Показано, что уровень нейронспецифической энолазы в крови при острых менингитах может выступать в качестве маркера глубины деструкции нервной ткани и развития энцефалита, а также эффективности и длительности проведения нейропротективной терапии.
The article presents the value of neuron-specific enolase and autoantibodies to glutamate receptor NR2A subunits as markers of ischemia and neurodestruction at acute meningitis in children. Presence of autoantibodies to the decay products of NMDA glutamate receptors, that are damaged in ischemia, indicates involvement of autoimmune component in the pathogenesis of neuroinfection development in children. It is shown that the level of neuron-specific enolase in the blood at acute meningitis may act as a marker of the depth of nerve tissue destruction and encephalitis development, as well as effectiveness and duration of neuroprotective therapy.
менінгіт, діти, нейронспецифічна енолаза, феномен ексайтотоксичності.
менингит, дети, нейронспецифическая энолаза, феномен эксайтотоксичности.
meningitis, children, neuron-specific enolase, excitotoxicity phenomenon.
Статья опубликована на с. 64-69
Вступ
Хвороби центральної нервової системи (ЦНС) інфекційної природи займають друге місце серед причин первинної інвалідизації населення, поступаючись лише судинній патології головного мозку [17]. В структурі загальної патології нервової системи питома вага нейроінфекцій становить близько 40 % [10]. Частота менінгітів серед всіх органічних уражень нервової системи становить 27–29 % [14]. Менінгіт є найбільш поширеною формою нейроінфекцій у дітей, особливо віком до 5 років [15, 35].
Незважаючи на сучасні досягнення в лікуванні менінгітів із застосуванням сучасної етіологічної та патогенетичної терапії, летальність від них залишається досить високою (10–60 %) і за останні 20 років суттєво не змінилась [15, 16, 22, 35]. За даними M. Emonts et al. (2004), летальність від менінгококового менінгіту становить 4–6 %, тоді як від ускладненого септичним шоком — до 40 %. Але найбільша летальність спостерігається при пневмококовому менінгіті і становить, за даними J.B. Robbins et al. (2005), 43 %, за даними Г.В. Белощицкого та iн. (2007) — 53,6 %, а на тлі пневмококового сепсису — 87,5 %.
Незважаючи на сучасні досягнення в дослідженні та розумінні механізмів виникнення нейроінфекцій, патогенез їх розвитку залишається досить актуальною проблемою і потребує подальшого вивчення. Глибоке розуміння цих механізмів дасть можливість покращити патогенетичну терапію та запобігти розвитку тяжких ускладнень та їх наслідків.
Сучасні погляди на патогенез гострих нейроінфекцій свідчать про залучення великої кількості патогенетичних механізмів у їх розвиток. Більшість з цих механізмів як прямо, так і опосередковано призводять до пошкодження нервових клітин, розвитку запалення мозкових оболонок та субарахноїдального простору, а також неконтрольованої системної запальної відповіді організму і, як наслідок, розвитку тяжких ускладнень та незворотних змін у центральній нервовій системі.
На цей час у нейроімунології активно вивчаються функції нейронспецифічних білків як маркерів ураження нервової системи, основними з яких є білок S-100 (маркер астроцитарної активації), нейронспецифічна енолаза (НСЕ), матрична металопротеїназа-9, фактор von Willebrand, нейтрофільний фактор росту В-типу та ін. [21].
Нейронспецифічні білки, особливо НСЕ і білок S-100, виконують одночасно декілька функцій: беруть участь в утворенні мієліну, синаптичній передачі нервового імпульсу, каталізують специфічний метаболізм, забезпечують роботу в клітинах транспортних систем іонних каналів [20, 21, 36]. В імуногістохімічних дослідженнях на основі моноклональних антитіл до НСЕ цей антиген виявлено тільки в нейронах, що дозволяє розглядати НСЕ як високоспецифічний маркер нейронів [36]. Білок S-100 — це астрогліальний білок, який міститься в особливо великій кількості в білій речовині мозку, шваннівських клітинах, у м’язах серця [25].
НСЕ (2-phospho-D glycerate hydrolasе або phosphopyruvate hydratase) — гліколітичний нейронспецифічний ізофермент енолази з молекулярною масою 80 000 дальтон, що має три ізоферменти: y, yy i ay, був відкритий Мoore і McGregor у 1965 році [28, 30, 36]. Період біологічного напівжиття НСЕ дорівнює 2 доби [36]. У високих концентраціях НСЕ знайдена в сірій речовині головного мозку, особливо в корі, у більш низьких концентраціях — у білій речовині. НСЕ використовується як маркер нейронального пошкодження при черепно-мозковій травмі (ЧМТ), епілепсії, енцефалітах, аноксичній енцефалопатії, пухлинах у дорослих [25, 36]. Дослідженнями E.A. Konstantinou et al. (2008) було визнано НСЕ як простий і надійний маркер післяопераційного нейронального пошкодження при операціях на серці зі штучним кровообігом. Є поодинокі роботи, присвячені дослідженню НСЕ в перинатології. R.P. Berger et al. (2002) у своїх дослідженнях показали, що НСЕ є надійним маркером як гострої (під час травми), так і віддаленої (за рахунок апоптозу) нейрональної деструкції при ЧМТ у дітей. У роботах Z. Kecskes et al. (2005) НСЕ було визначено надійним маркером гіпоксичного пошкодження ЦНС у дослідах на тваринах, а М.И. Баканова та ін. (2001) — як маркер перинатального ураження ЦНС у дітей. Т.М. Клименко та ін. (2007) визначали НСЕ як маркер нейронального пошкодження при респіраторному дистрес-синдромі у дітей.
В Україні не проводились дослідження рівнів НСЕ у дітей з нейроінфекціями.
Важливе значення в складних механізмах загибелі нервової тканини при різних захворюваннях і патологічних станах надається ексайтотоксичності, пов’язаній iз накопиченням в екстрацелюлярному просторі збуджуючих нейротрансмітерів, насамперед глутамату [11, 24]. Цей медіатор відповідає за перезбудження уражених нейронів, що визначає розвиток ексайтотоксичності або нейротоксичності (англ. to excite — «збуджувати») [7, 38].
Разом iз глутаматом як нейромедіатор ЦНС виступає аспартат. Аспартат, як і глутамат, належить до збуджуючих амінокислот у ЦНС і здатний також активувати рецептори N-метил-D-аспартату (NMDA), беручи участь в ексайтотоксичності [26].
Глутаматергічні механізми представлені приблизно в 40 % нервових клітин [23]. Після вивільнення глутамату в синаптичну щілину відбувається зв’язування його з рецепторами. У цей час виділено два типи глутаматергічних рецепторів — іонотропні і метаботропні [4, 24, 39]. Метаботропні структурно не пов’язані з іонними каналами; вони керують метаболічними процесами в клітині через спеціальні сигнальні молекули-інформатори. Іонотропні з’єднані з іонними каналами і відкривають їх після активації відповідними молекулами (лігандами). Виділяють три групи іонотропних рецепторів: NMDA з відповідними субодиницями (NR1; NR2A-NR2D; NR3A-NR3B), КА (каїнатні) з субодиницями (GluR5-GluR7; KA1-KA2) і AMPA (а-аміно-3-гідроксі-5-етилізоксазол-4-пропіонат) з субодиницями (GluR1-GluR4), названих відповідно з лігандами, що забезпечують їх активацію [6, 24, 31]. Найбільш небезпечним є перезбудження NMDA-рецепторів.
Рецептор NMDA складається з двох NR1 і двох NR2 субодиниць, які є трансмембранними білками і формують разом іонний канал [12, 31, 32].
Відмінною особливістю NMDA-рецепторів є те, що вони блокуються іонами магнію за потенціалзалежним типом. Інша специфічна риса NMDA-рецепторів полягає в тому, що як коагоніст глутамату для активації їм необхідний гліцин. Останній посилює відповідь рецептора, збільшуючи частоту відкривання каналу. За повної відсутності гліцину рецептор не активується глутаматом [27, 37].
NMDA-рецептори — основні збуджуючі нейрорецептори, які регулюють електричну активність нейронів. Кожна субодиниця несе по два сайта зв’язування гліцину і глутамату [27]. Ці рецептори локалізуються також на поверхні епітелію мікросудин, які формують гематоенцефалiчний бар’єр (ГЕБ), і беруть участь у регуляції тонусу мікросудин [24, 37].
При звичайному функціонуванні NMDA-рецептори беруть участь у таких функціях мозку, як пам’ять, успішність у навчанні, поведінкові та інші реакції [32], у формуванні синапсів [34].
Гостра ішемія зумовлює надмірне продукування нейронами глутамату та інших збуджувальних ексайтотоксинів, що викликає розвиток глутаматної ексайтотоксичності. Зв’язування глутамату з рецепторами NMDA призводить до «шокового» відкриття кальцієвих каналів, виникає масивне входження всередину нейронів іонів кальцію, що зумовлює Са2+-індуковану ексайтотоксичність.
Через моновалентні іонні канали і осмотичним шляхом нейрони вбирають воду, виникає цитотоксичний набряк тканини мозку, порушуються механізми синаптичної передачі [2, 13]. У цих умовах нейротоксичність NMDA-рецепторів може призводити до клітинної смерті — некрозу або апоптозу [9]. Слід відзначити, що нейрональне пошкодження, обумовлене ексайтотоксичністю при бактеріальному менінгіті, не залежить від стану ГЕБ і може відбуватись при його нормальній функції [29].
Нещодавно також було описано нову форму тяжкого енцефаліту, у тому числі і в дітей, пов’язаного з антитілами проти NR1-NR2 гетеромерів рецепторів NMDA, викликаного багатьма чинниками, включаючи вакцинацію [18]. Дослідження цього захворювання тривають.
Вивчення ролі NMDA-рецепторів у роботі клітин імунної системи отримало цікаве продовження. Виявилось, що продукція yінтерферону (відповідаючого за взаємодію лімфоцитів iз макрофагами) регулюється NMDA-рецепторами: активація NMDA-рецепторів пригнічує, а метаботропних рецепторів — активує його утворення Т-лімфоцитами людини. Ці результати прямо доказують, що глутамат у крові здатен регулювати активність клітинного імунітету [5].
Цереброваскулярні ускладнення роблять значний внесок у пошкодження нейронів при менінгіті. Ішемія, яка виникає, в першу чергу призводить до ексайтотоксичності.
Отже, не виключено, що ексайтотоксичність відіграє значну і, можливо, найпершу роль у розвитку нейронального пошкодження при менінгіті у дітей і тому потребує подальшого вивчення для більш широкого розуміння патогенезу розвитку нейрональної смерті при нейроінфекціях та її попередження шляхом використання антагоністів NMDA-рецепторів.
Проблема пошуку антагоністів NMDA-рецепторів є однією з найбільш актуальних у сучасній фармакології. На цей час клінічно ефективних антагоністів NMDA-рецепторів немає. У зв’язку з високою кількістю неврологічних порушень у гострий період нейроінфекцій та резидуальними наслідками після них у дітей, що виникають, незважаючи на застосування сучасних методів лікування, пошук можливостей впливу на феномен ексайтотоксичності з використанням первинної нейропротективної терапії для попередження і зменшення ураження ЦНС при гострих менінгітах у дітей є надзвичайно актуальною проблемою дитячої інфектології, педіатрії і неврології.
Метою цiєї роботи було дослідити значення НСЕ та автоантитіл до фрагментів глутаматних рецепторів NR2A як маркерів нейродеструкції та ішемії при гострих менінгітах у дітей, довести наявність автоімунного компоненту в патогенезі розвитку нейроінфекцій.
Матеріали і методи обстеження
Вміст НСЕ визначали за допомогою імуноферментного методу з використанням тест-систем NSE ELISA фірми DAI (США) у 40 хворих дітей з гнійними менінгітами (ГМ).
Рiвень автоантитіл до фрагментів глутаматних рецепторів NR2A в сироватці крові визначали, використовуючи метод імуноферментного аналізу. Дослідження виконувались на приладі «Аналізатор імуноферментний ІФА Stat Fax 303 Plus», який є відкритою системою. Кількість антитіл до NR2 субодиниці рецептора NMDA в сироватці крові визначали за допомогою імуноферментного методу (ELISA) з використанням тест-систем Gold Dot NR2 Antibody Test Glutamat Kit фірми BCM Diagnostics (США).
Концентрація антитіл до NR2 у здорових дорослих людей становить < 1,7 нг/мл. Підвищення концентрації антитіл NR2 (> 2,0 нг/мл) корелює з наявною ізольованою або множинною ішемією головного мозку.
Дослідження проводилось в науково-дослідній клініко-діагностичній лабораторії Вінницького національного медичного університету ім. М.І. Пирогова.
Результати обстеження
Рівень НСЕ досліджували у 40 дітей, хворих на гнійний менінгіт, які знаходились на стаціонарному лікуванні у Хмельницькій інфекційній лікарні. Отримані значення порівнювали з групою здорових дітей (30 осіб). На рис. 1 показано вміст НСЕ у дітей контрольної групи та у хворих дітей.
/66/66_2.jpg)
Дослідження інтегрального показника нейродеструкції — НСЕ вказує, що переважна кількість гострих бактеріальних менінгітів перебігає з ушкодженням речовини головного мозку. Рівень НСЕ у хворих дітей був у 7,6 рази вищим, ніж у здорових, а в деяких дітей його концентрація була більшою в 12,5 раза (p < 0,001).
Рівень НСЕ у сироватці крові в дітей з ускладненим перебігом менінгіту був вірогідно вищим вже на початку захворювання (p < 0,01), ніж у дітей, менінгіт у яких протікав без ускладнень.
У табл. 1 показано вміст НСЕ у дітей з ускладненим перебігом менінгіту порівняно з дітьми, в яких ускладнень не було.
Враховуючи вірогідну різницю в концентраціях НСЕ у хворих з ускладненнями менінгіту і без ускладнень, можна використовувати НСЕ не тільки як маркер глибини нейронального пошкодження, але і як прогностичний маркер розвитку ускладнень з боку ЦНС. Значне підвищення рівня НСЕ в сироватці крові вже на початку захворювання вказує на необхідність призначення нейропротективних засобів з перших днів хвороби.
Нами виявлено вірогідне підвищення рівнів NR2A автоантитіл до фрагментів NMDA-рецепторів глутамату в сироватці крові дітей iз гострими менінгітами в першу добу захворювання порівняно зi здоровими дітьми (рис. 2).
/67/67.jpg)
Так, у здорових дітей рівень автоантитіл NR2A становив 2,15 ± 0,79 нг/мл, у хворих на ГМ — 9,35 ± 5,96 нг/мл (p < 0,001) (95% довiрчий інтервал (ДІ), 3,27–11,12 нг/мл). У середньому рівень автоантитіл NR2A у хворих на ГМ дітей був в 4,3 рази вищим, ніж у здорових.
Рівень NR2A автоантитіл до фрагментів NMDA-рецепторів глутамату у хворих на серозний менінгіт (СМ) дітей у першу добу захворювання становив 5,48 ± ± 3,03 нг/мл і був вірогідно вищим порівняно зі здоровими дітьми (p < 0,001) (95% ДІ, 1,32–5,34 нг/мл), що зображено на рис. 3.
У середньому рівень автоантитіл до фрагментів рецепторів глутамату у хворих на СМ був у 2,5 раза вищим, ніж у здорових.
Серед деяких дітей з тяжким перебігом хвороби, розвитком ускладнень з боку ЦНС концентрація автоантитіл до фрагментів рецепторів глутамату у хворих на СМ була більшою від рівня здорових дітей у 7 разів, а у хворих на ГМ — у 9 разів.
Рівень автоантитіл до фрагментів рецепторів глутамату NR2A у хворих на ГМ вірогідно перевищував їх рівень у хворих на СМ у перші дні захворювання (95% ДІ, 0,83–6,90 нг/мл) (p < 0,05), що свідчило про більшу вираженість феномену ексайтотоксичності у хворих на ГМ, що також корелювало з більш тяжким перебігом і в подальшому з більшою кількістю ускладнень з боку ЦНС у хворих на ГМ.
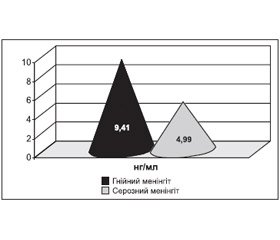
Порівняно з першою добою захворювання рівень автоантитіл NR2A до фрагментів NMDA-рецепторів глутамату на 6-ту — 7-му добу у хворих на ГМ незначно зростав від 9,35 ± 5,96 нг/мл до 9,41 ± 5,08 нг/мл (p > 0,05) і також вірогідно відрізнявся від рівня здорових дітей (p < 0,001) (95% ДІ, 3,92–10,56 нг/мл), що зображено на рис. 4. У цей період рівень автоантитіл NR2A до фрагментів NMDA-рецепторів глутамату у хворих перевищував рівень автоантитіл до фрагментів рецепторів глутамату NR2A у здорових дітей більше ніж в 4,4 раза, а у деяких хворих — майже у 9 разів.
Рівень автоантитіл до фрагментів рецепторів глутамату NR2A на 6-ту — 7-му добу захворювання у дiтей iз СМ зменшувався від 5,48 ± 3,03 нг/мл до 4,99 ± 1,98 нг/мл (p > 0,05), хоча залишався вірогідно і значно вищим від рівня автоантитіл NR2A до фрагментів NMDA-рецепторів глутамату у здорових дітей (p < 0,001) (95% ДІ, 1,49–4,18 нг/мл), що зображено на рис. 5.
Рівень автоантитіл NR2A до фрагментів NMDA-рецепторів глутамату у хворих на ГМ вірогідно і значно перевищував рівень автоантитіл NR2A до фрагментів NMDA-рецепторів глутамату у хворих на СМ на 6-ту — 7-му добу захворювання (95% ДІ, 1,95–6,88 нг/мл) (p < 0,001), що свідчило про значно більшу вираженість церебральної ішемії і її прогресування у хворих на ГМ у цей період захворювання на відміну від хворих на СМ, у яких спостерігалась тенденція до зниження вираженості церебральної ішемії (рис. 6).
/68/68.jpg)
Виявлено збільшення рівнів автоантитіл до субодиниць NMDA-рецепторів NR2A у дітей, хворих на ГМ з ускладненнями, порівняно з дітьми без ускладнень з боку ЦНС (11,09 ± 6,68 нг/мл та 6,10 ± 2,04 нг/мл відповідно) (95% ДІ, –0,50… 10,48 нг/мл; р > 0,05). На 6-ту — 7-му добу рівень NR2A автоантитіл у дітей з ускладненнями був вірогідно більшим порівняно з дітьми без ускладнень (11,82 ± 4,56 нг/мл та 4,93 ± 2,03 нг/мл відповідно) (95% ДІ, 38,76–175,99 нг/мл; p < 0,01).
Установлено також збільшення рівнів автоантитіл до субодиниць NMDA-рецепторів NR2A у дітей iз СМ з ускладненнями порівняно з хворими без ускладнень з боку ЦНС (6,35 ± 3,56 нг/мл та 3,78 ± 1,03 нг/мл відповідно) (95% ДІ, –0,35… 5,49 нг/м; р > 0,05). На 6-ту — 7-му добу рівень NR2A автоантитіл у дітей з ускладненнями був вірогідно вищим порівняно з дітьми без ускладнень (5,97 ± 1,90 нг/мл та 3,51 ± 0,93 нг/мл відповідно) (95% ДІ, 0,84–4,07 нг/мл; p < 0,01).
Висновки
1. Рівень НСЕ у хворих дітей iз гнійними менінгітами може виступати лабораторним критерієм вираженості нейронального пошкодження. Динаміка НСЕ може слугувати критерієм успішності та завершеності проведеної нейропротективної терапії.
2. Про значну церебральну ішемію у хворих на менінгіт дітей свідчать високі рівні NR2A автоантитіл до фрагментів NMDA-рецепторів у перші дні захворювання.
3. Утворення автоантитіл до фрагментів глутаматних рецепторів у результаті руйнування NMDA-рецептора виникає за рахунок утворених пептидних фрагментів рецептора (NR2-пептид), які, потрапивши в кровотік через пошкоджений ГЕБ, викликають утворення специфічних NR2-антитіл.
4. Поява специфічних NR2A автоантитіл до субодиниць глутаматних рецепторів у хворих на гострий менінгіт свідчить про наявність автоімунного компонента в патогенезі розвитку нейроінфекцій.
1. Баканов М.И. Новые биохимические критерии диагностики и прогноза перинатальных поражений ЦНС у новорожденных детей / М.И. Баканов, В.В. Алатырцев, В.Н. Подкопаев // Медицинский научный и учебно-методический журнал. — 2001. — № 1. — С. 126–141.
2. Беленичев И.Ф. Современные подходы к терапии острого нарушения мозгового кровообращения, основные стратегии нейропротекции / И.Ф. Беленичев, Н.В. Бухтиярова, Д.А. Середа // Новости медицины и фармации. — 2008. — № 5(237). — С. 1–7.
3. Белошицкий Г.В. Клинико-эпидемиологические особенности пневмококковых менингитов / Г.В. Белошицкий, И.С. Королева // Эпидемиология и инфекционные заболевания. — 2007. — № 2. — С. 20–23.
4. Болдырев А.А. Нейрональные рецепторы / А.А. Болдырев // Природа. — 2005. — № 7. — С. 2–10.
5. Болдырев А.А. Нейрональные рецепторы в клетках иммунной системы / А.А. Болдырев // Природа. — 2005. — № 7. — С. 1–10.
6. Беспалов А.Ю. Нейропсихофармакология антагонистов NMDA-рецепторов / А.Ю. Беспалов, Э.Э. Звартау. — СПб.: Невский диалект, 2000. — 297 с.
7. Зайцев О.С. Нейрореаниматология. Выход из комы (терапия посткоматозных состояний) / О.С. Зайцев, С.В. Царенко. — М.: Литасс, 2012. — 120 с.: ил.
8. Клименко Т.М. Критерии дифференциальной диагностики различных вариантов респираторного дистресс-синдрома у недоношенных новорожденных / Т.М. Клименко, С.В. Водяницкая // Здоровье ребенка. — 2007. — № 1 (4). — С. 81–84.
9. Клигуненко Е.Н. Нейропротекция: настоящее и будущее / Е.Н. Клигуненко, Е.А. Емельянова // Нейронауки: теор. клин. асп. — 2008. — Т. 4, № 1. — С. 75–81.
10. Лобзин Ю.В. Менингиты и энцефалиты / Ю.В. Лобзин, В.В. Пилипенко, Ю.Н. Громыко. — СПб.: Фолиант, 2006. — 128 с.
11. Матвеев А.Г. Феномен цитотоксичности и механизмы повреждения нейронов новой коры при гипоксии и ишемии / А.Г. Матвеев // Тихоокеанский медицинский журнал. — 2004. — № 2. — С. 18–23.
12. Молекулярные механизмы воздействия аминокислот в составе церебролизина на нейротрансмиссию. Нейротрофические и нейропротективные эффекты аминокислот / О.А. Громова, И.Ю. Торшин, Е.И. Гусев [и др.] // Трудный пациент. — 2010. — № 4. — С. 25–31.
13. Рациональная нейропротекция / И.Ф. Беленичев, В.И. Черний, Ю.М. Колесник и др. — Донецк: Издатель Заславский А.Ю., 2009. — 262 с.
14. Руководство по детской неврологии / Гузева В.И., Чухловина М.Л., Савельева-Васильева Е.А. и др.; Под ред. В.И. Гузевой. — СПб.: Фолиант, 2004. — 496 с.
15. Сорокина М.Н. Бактериальные менингиты у детей / Сорокина М.Н., Иванова В.В., Скрипченко Н.В. — М.: Медицина, 2003. — 320 с.
16. Цинзерлинг В.А. Инфекционные поражения нервной системы: Руководство [для врачей многопроф. стац.] / В.А. Цинзерлинг, М.Л. Чухловина. — СПб.: Элби-СПб, 2005. — 448 с.
17. Ярош О.О. Деякі актуальні проблеми нейроінфекцій / О.О. Ярош // Інфекційні хвороби. — 2003. — № 1. — С. 5–9.
18. Anti-NMDA-receptor encephalitis: case series and analysis of the effects of antibodies / J. Dalmau, A.J. Gleichman, E.G. Hughes [et al.] // The Lancet Neurology. — 2008. — Vol. 7, № 12. — P. 1091–1098.
19. Cerebral haemodynamics in acute bacterial meningitis in adults / C.-H. Lu, H.-W. Chang, C.-C. Lui [et al.] // Q. J. Med. — 2006. — Vol. 99. — P. 863–869.
20. Correlation between serum level of neuron-specific enolase and long-term functional outcome after acute cerebral infarction: prospective study / Y.C. Wu, Y.B. Zhao, C.Z. Lu [et al.] // Hong Kong Med. J. — 2004. — Vol. 10, № 4. — P. 251–254.
21. Early biomarkers of stroke / M.A. Reynolds, H.J. Kirchick, J.R. Dahlen [et al.] // Clinical Chemistry. — 2003. — Vol. 49, № 10. — P. 1733–1739.
22. Emonts M. Genetic susceptibility to Neisseria meningitidis infections / M. Emonts, R. de Grot, P.W.M. Hermans // The Netherlands Journal of medicine. — 2004. — Vol. 62, № 3. — P. 28–37.
23. Harukuni I. Mechanisms of brain injury after global cerebral ischemia / I. Harukuni, A. Bhardwaj // Neurol. Clin. — 2006. — Vol. 24. — P. 1–21.
24. Kalia L.V. NMDA receptors in clinical neurology excitatory times ahead / L.V. Kalia, S.K. Kalia, M.W. Salter // Lancet neurol. — 2008. — Vol. 7. — P. 742–755.
25. Kecskes Z. NSE and S100 after hypoxia in the newborn pig / Z. Kecskes, K.R. Dunster, P.B. Colditz // Pediatr. Res. — 2005. — Vol. 58. — P. 953–957.
26. Marcaggi P. Release of L-aspartate by reversal of glutamate transporters / P. Marcaggi, N. Hirji, D. Attwell // Neuropharmacology. — 2005. — Vol. 49. — P. 843–849.
27. Meldrum B.S. Glutamate as a Neurotransmitter in the Brain: Review of Physiology and Pathology / B.S. Meldrum // Journal of Nutrition. — 2000. — Vol. 130. — P. 1007–1015.
28. Neuron specific enolase (NSE): A valuable prognostic factor of central nervous system dysfunction following cardiac surgery / E.A. Konstantinou, K. Venetsanou, A.P. Mitsos [et al.] // British Journal of Anaesthetic & Recovery Nursing. — 2008. — Vol. 9, № 1. — P. 22–28.
29. Neuroprotective Therapies after Perinatal Hypoxic–Ischemic Brain Injury / F.G. de Cerio, I. Lara–Celador, A. Alvarez, E. Hilario // Brain Sci. — 2013. — Vol. 3. — P. 191–214.
30. Neuron–Specific Enolase and S100B in cerebrospinal fluid after severe traumatic brain injury in infants and children / R.P. Berger, M.C. Pierce, S.R. Wisniewski [et al.] // Pediatrics. — 2002. — Vol. 109, № 2. — P. 31.
31. Potential role of N-methyl-D-aspartate receptors as executors of neurodegeneration resulting from diverse insults: focus on memantine / G.L. Wenka, C.G. Parsonsb, W. Danysz // Behavioural Pharmacology. — 2006. — Vol. 17. — 411–424.
32. Popescu G.K. Allosteric Inhibitors of NMDA Receptor Functions / G.K. Popescu, S. Murthy, W.F. Borschel // Pharmaceuticals. — 2010. — Vol. 3. — P. 3240–3257.
33. Robbins J.B. Surveillance for bacterial meningitis by means of polymerase chain reaction / J.B. Robbins, R. Schneersonn, E.C. Gotschlich // Clin. Infect. Dis. — 2005. — Vol. 40. — P. 26–27.
34. The Effects of NMDA Receptor Activation on Synaptogenesis / A. Punnoose, F. Miskevich, M. Townsend, M. Constantine-Paton // MURJ. — 2004. — Vol. 10. — P. 48–51.
35. Tunkel A.R. Bacterial meningitis / A.R. Tunkel, W.M. Scheld. — Philadelphia: Lippincott Williams & Wilkins, 2001. — 266 p.
36. Use of neuron-specific enolase for assessing the severity and outcome in patients with neurological disorders / J.E. Lima, O.M. Takayanagui, L.V. Garcia [et al.] // Braz. J. Med. Biol. Res. — 2004. — Vol. 37. — P. 19–26.
37. Yang Y.-C. Ionic flow enhances low-affinity binding: a revised mechanistic view into Mg2+ block of NMDA receptors / Y.-C. Yang, C.-H. Lee, C.-C. Kuo // J. Physiol. — 2010. — Vol. 588, № 4. — P. 633–650.
38. Zhang X.-M. Kainic acid-induced neurotoxicity: targeting glial responses and glia-derived cytokines / X.-M. Zhang, J. Zhu // Current Neuropharmacology. — 2011. — Vol. 9. — P. 388–398.
39. Zito K. NMDA Receptor Function and Physiological Modulation / K. Zito, V. Scheuss // Squire L.R. (ed.) Encyclopedia of Neuroscience. — Oxford: Academic Press, 2008. — Vol. 6. — P. 1157–1164.

/66/66.jpg)
/67/67_2.jpg)