Журнал «Здоровье ребенка» 7 (58) 2014
Вернуться к номеру
Особливості запального процесу у дітей раннього віку з різними формами гострих бронхітів
Авторы: Абатуров О.Є., Русакова О.О. - ДЗ «Дніпропетровська медична академія МОЗ України»
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
У статті показано особливості деяких молекулярних механізмів запального процесу у дітей раннього віку залежно від клінічної форми гострого бронхіту.
В статье показаны особенности некоторых молекулярных механизмов воспалительного процесса у детей раннего возраста в зависимости от клинической формы острого бронхита.
The article describes features of some molecular mechanisms of inflammatory process in infants depending on the clinical form of acute bronchitis.
діти раннього віку, гострий бронхіт, γ-інтерферон, інтерлейкіни, IgЕ, фактор транскрипції NF-κB.
дети раннего возраста, острый бронхит, γ-интерферон, интерлейкины, IgЕ, фактор транскрипции NF-κB.
infants, acute bronchitis, interferon-γ, interleukins, IgE, transcription factor NF-κB.
Статья опубликована на с. 5-8
Гострі бронхіти займають провідне місце в нозологічній структурі гострих інфекційно-запальних захворювань нижніх дихальних шляхів у дітей протягом останніх десятиліть [3, 7]. На сьогодні гострий бронхіт є достатньо частою причиною госпіталізації дітей перших трьох років життя, що обумовлено особливостями перебігу захворювання на сучасному етапі, а саме тяжким та затяжним перебігом, частим (у 20–25 % випадків) розвитком синдрому бронхіальної обструкції [6, 7]. Незважаючи на досягнуті успіхи педіатричної науки, існують об’єктивні труднощі при виборі раціональної фармакотерапії гострих бронхітів у дітей раннього віку у зв’язку з недостатнім вивченням механізмів розвитку запалення при різних клінічних формах захворювання.
Мета: дослідити особливості деяких молекулярних механізмів запального процесу у дітей раннього віку залежно від клінічної форми гострого бронхіту.
Матеріали та методи
Під нашим спостереженням знаходилось 60 дітей віком від 6 місяців до 3 років з гострим бронхітом, які перебували на стаціонарному лікуванні в умовах інфекційного відділення № 3 КЗ «Дніпропетровська МДКЛ № 1» ДОР. Верифікація діагнозу та надання медичної допомоги були стандартизованими відповідно до наказу № 18 МОЗ України (2005 р.). На підставі клініко-анамнестичних даних, загально-клінічних та рентгенологічних досліджень у 40 пацієнтів діагностовано гострий обструктивний бронхіт (ГОБ) з проявами дихальної недостатності I–II ст. (перша група спостереження). Другу групу спостереження становили 20 дітей з гострим простим бронхітом (ГПБ). За віком, статтю та обсягом проведених досліджень групи обстежених дітей були порівнянними.
Забір крові для імунологічного та молекулярно-генетичного обстежень проводили за наявності інформованої згоди з боку батьків чи опікунів обстежених дітей. Дослідження проводились відповідно до основних положень GСP ICH і Гельсінської декларації, повністю відповідали біоетичним вимогам.
Визначення концентрації загального IgE у сироватці крові проводилось методом електрохемілюмінесцентного імуноаналізу ECLIA з використанням набору реактивів «Elecsys IgE» REF 04827031 190 (Roche Diagnostics). Уміст γ-інтерферону (IFN-γ), інтерлейкіну-4 (IL-4) та -13 (IL-13) у сироватці крові визначали з використанням відповідних моноклональних антитіл тест-систем Human IFN-γ Platinum ELISA BMS228 (eBioscience), «А-8754 ИЛ-4-ИФА-БЕСТ» (ЗАТ «ВЕКТОР-БЕСТ», Росія) та Human IL-13 Platinum ELISA BMS231/3 (eBioscience) за допомогою твердофазного «сендвіч»-варіанта імуноферментного аналізу. Молекулярно-генетичні дослідження включали в себе визначення рівня експресії транскрипційного фактора NF-kB у лімфоцитах периферійної крові методом проточної цитометрії [2]. Згідно з поставленою метою всі дослідження проводили двічі — на початку захворювання та в періоді реконвалесценції.
Імунологічні дослідження проводились у сертифікованій центральній науково-дослідницькій лабораторії ДЗ «Дніпропетровська медична академія МОЗ України», молекулярно-генетичні — на базі НДІ генетичних та імунологічних основ розвитку патології та фармакогенетики ВДНЗУ «УМСА», м. Полтава.
Математична обробка результатів дослідження проводилась з використанням статистичних програм Statgraf, Matstat, Microsoft Excel для Windows, оцінка значущості відмінностей показників — за допомогою пара– та непараметричних методів статистики. Для виявлення взаємозв’язків між визначуваними показниками застосовувався кореляційний аналіз Спірмена [4].
Результати дослідження та їх обговорення
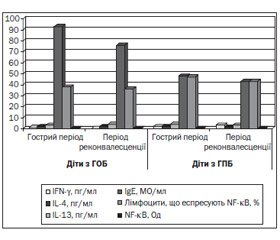
Результати досліджень дітей обох груп спостереження в динаміці перебігу ГОБ та ГПБ узагальнені на рис. 1.
/6/6.jpg)
За даними нашого дослідження, гострий період захворювання у дітей першої групи спостереження характеризувався вірогідно низькими рівнями IFN-γ у сироватці крові порівняно з показниками дітей другої групи спостереження (1,12 ± 0,45 пг/мл у дітей з ГОБ проти з 1,92 ± 1,03 пг/мл у дітей із ГПБ; р ≤ 0,05), характер змін яких зберігався до періоду реконвалесценції (0,79 ± 0,36 пг/мл у дітей з ГОБ проти 3,43 ± 1,79 пг/мл у дітей із ГПБ; р ≤ 0,05). У динаміці перебігу захворювання у дітей першої та другої груп спостереження середні показники вмісту інших цитокінів у сироватці крові вірогідно не змінювались. Отримані нами результати дозволяють стверджувати, що у дітей раннього віку з ГОБ мало місце значне зниження продукції IFN-γ як у гострому, так і в періоді реконвалесценції захворювання, що може свідчити про неспроможність Th1-асоційованої відповіді у цих дітей [5, 9, 10].
60 % дітей, хворих на ГПБ (половина з них — діти до року), та 54,5 % дітей з ГОБ (серед них біля третини дітей першого року життя) на початку захворювання мали вищу за вікову концентрацію основного маркера алергічного запалення IgE у сироватці крові, а в періоді реконвалесценції питома вага таких дітей становила відповідно 50 та 31,6 % (кожна друга дитина — першого року життя). Отримані нами результати можна пояснити віковими фізіологічними особливостями імунітету у дітей раннього віку, що визначають істотне підвищення їх чутливості як до інфекційних факторів середовища, так і до експозиції алергенів [9, 10].
Аналіз стану гуморальної відповіді у дітей раннього віку з інфекційним ураженням бронхіального дерева показав, що незалежно від фази розвинення гострого бронхіту середнє значення вмісту IgE у дітей раннього віку з ГОБ було вірогідно вищим, ніж у дітей з ГПБ (р ≤ 0,05): на початку захворювання 96,0 ± 27,5 MO/мл (у дітей першого року життя — 36,4 ± 13,6 MO/мл, у дітей старше року — 130,1 ± 35,5 MO/мл) проти 50,5 ± 18,6 MO/мл (у дітей першого року життя — 22,0 ± 6,2 MO/мл, у дітей старше року — 69,4 ± 31,1 MO/мл) та 79,0 ± 28,1 MO/мл (у дітей першого року життя — 49,2 ± 23,3 MO/мл, у дітей старше року — 96,4 ± 40,4 MO/мл) проти 45,6 ± 17,7 MO/мл (у дітей першого року життя — 15,5 ± 4,7 MO/мл, у дітей старше року — 65,7 ± 26,4 MO/мл) в періоді реконвалесценції. Порівняльний аналіз змін середнього вмісту сироваткового IgE у всіх обстежених дітей першої групи спостереження на початку та в періоді реконвалесценції ГОБ показав відсутність вірогідних змін, що співпадає з динамікою концентрації IgE у дітей з ГПБ (р > 0,05; рис. 1).
Імуногенетичні дослідження у дітей раннього віку з різними формами гострих бронхітів показали, що відносна кількість лімфоцитів, що експресують фактор транскрипції NF-kB, та рівень експресії NF-kB не залежали від клінічної форми гострого бронхіту. Це, можливо, свідчить про подібність молекулярно-генетичних характеристик запального процесу при інфекційному ураженні бронхіального дерева, що збігається з даними інших дослідників [1, 11]. Відсутність динаміки молекулярно-генетичних показників залежно від періоду розвинення різних клінічних форм гострого бронхіту, на наш погляд, може свідчити про наявність субклінічної активності цих механізмів у дітей раннього віку.
Для оцінки та характеристики активності запального процесу у дітей раннього віку з гострими бронхітами нами окремо були побудовані кореляційні дерева імунологічних та молекулярно-генетичних показників запалення в динаміці ГПБ та ГОБ (рис. 2–4).
Так, за нашими даними, у гострому періоді ГПБ рівень експресії транскрипційного фактора NF-kB визначав концентрацію IgE у сироватці крові (r = +0,58; р ≤ 0,05), що свідчить про наявність алергічного механізму розвитку запалення, яке контролювалося сильним оберненим зв’язком NF-kB з умістом протизапального IL-13 (r = –0,52; р ≤ 0,05), що і знижувало в цілому активність запального процесу (рис. 2).
При ГОБ (рис. 3) рівень експресії транскрипційного фактора NF-kB визначав рівень вмісту прозапального цитокіну IFN-γ (r = +0,40; р ≤ 0,05) та концентрацію IgE у сироватці крові (r = +0,59; р ≤ 0,05), що у сукупності і формувало активність запальної реакції, характер якої мав алергічну спрямованість, що підкріплювалося виявленими кореляційними взаємозв’язками концентрації IgE та вмісту IL-4 у сироватці крові (r = +0,32; р ≤ 0,05), жорсткість зв’язків між якими підсилювалась досить сильною кореляцією між умістом IL-4 та IFN-γ (r = +0,42; р ≤ 0,05).
Наявність обернено-пропорційного зв’язку між концентрацією протизапального IL-13 та рівнем активності NF-kB (r = –0,33; р ≤ 0,05), а також умісту IFN-γ (r = –0,36; р ≤ 0,05) пояснюється тим, що IL-13 є одним з основних факторів, що інгібують активність NF-kB [1, 8].
Таким чином, у дітей з ГПБ, на відміну від дітей з ГОБ, на початку захворювання кількість залучених у кореляційні відносини параметрів була меншою, внутрішні зв’язки між вивченими параметрами не визначались.
Період реконвалесценції гострого простого бронхіту характеризувався відсутністю кореляційних зв’язків між досліджуваними показниками, але реєструвались зв’язки з клініко-анамнестичними характеристиками обстежених дітей, що наведено вище.
У дітей з ГОБ у періоді реконвалесценції структура взаємовідносин визначуваних параметрів змінювалась (рис. 4) за рахунок зникнення зв’язків між рівнем експресії транскрипційного фактора NF-kB та вмістом IFN-γ у сироватці крові, а також між концентраціями IFN-γ та IL-13.
Крім того, підсилювалась обернена залежність між рівнем експресії NF-kB та вмістом IL-13 та з’являвся зв’язок між концентраціями Th2-асоційованих інтерлейкінів-4 та –13 (r = +0,40; р ≤ 0,05).
Таким чином, можна сказати, що у дітей раннього віку, незалежно від клінічної форми гострого бронхіту, на початку захворювання має місце алергічний компонент запалення, який контролюється протизапальними механізмами при простому бронхіті та підкріплюється розвитком активного запального процесу з формуванням Th2-асоційованої відповіді при обструктивному бронхіті. Період реконвалесценції ГПБ характеризується відсутністю взаємовідносин між основними маркерами запалення, тоді як при ГОБ змінюється їх структура.
Висновки
1. Більшість дітей перших трьох років життя, хворих на гострі бронхіти, мають вищу за вікову концентрацію IgE у сироватці крові, при цьому середнє значення вмісту IgE, незалежно від фази розвинення захворювання, вірогідно вище у пацієнтів із ГОБ, ніж у дітей з ГПБ.
2. Порівняно з ГОБ гострий період простого бронхіту у дітей раннього віку характеризується меншою кількістю залучених у кореляційні відносини маркерів запалення та відсутністю внутрішніх зв’язків між ними.
3. У дітей перших трьох років життя на початку ГОБ визначається розвиток активного запального процесу з формуванням Th2-асоційованої відповіді.
4. Період реконвалесценції гострого обструктивного бронхіту характеризується посиленням інгібування транскрипційного фактора NF-kB та розривом його зв’язку з прозапальним IFN-γ, гострого простого бронхіту — відсутністю взаємовідносин між основними маркерами запалення.
1. Абатуров А.Е., Волосовец А.П., Юлиш Е.И. Индукция молекулярных механизмов неспецифической защиты респираторного тракта. — К.: Приватна друкарня ФОП Сторожук О.В., 2012. — 240 с.
2. Абатуров О.Є. Молекулярні особливості розвитку запалення слизової оболонки шлунку у дітей з хелікобактерною інфекцією, асоційованою з CagA (+) штамами Н.pylori / О.Є. Абатуров, О.М. Герасименко // Гастроентерологія. — 2014. — № 1. — С. 13–17.
3. Антипкин Ю.Г. Рецидивирующий бронхит у детей: дискуссионные вопросы / Ю.Г. Антипкин, В.Ф. Лапшин // Здоровье Украины. — 2008. — № 18(1). — С. 19–21.
4. Антомонов М.Ю. Математическая обработка и анализ медико–биологических данных [Текст] / М.Ю. Антомонов. — К.: Фірма малого друку, 2006. — 558 с.
5. Белан Ю.Б. Возможности ранней иммунокоррекции бронхообструктивных состояний у детей с отягощенным аллергологическим анамнезом / Ю.Б. Белан, М.В. Старикович, Л.А. Безрукова // Лечащий врач. — 2011. — № 6 . — С. 12–15.
6. Германова О.Н. Обструктивные бронхиты у детей с инфекциями респираторного тракта / О.Н. Германова // Педиатрическая фармакология. — 2010. — Т. 7, № 2. — С. 106.
7. Сміян О.І. Особливості клінічного перебігу гострого обструктивного бронхіту в дітей раннього віку / О.І. Сміян, В.А. Плахута // Проблеми безперервної медичної освіти та науки. — 2014. — № 2. — С. 38–41.
8. Fan J. Transcriptional mechanisms of acute lung injury [Text] / J. Fan, R.D. Ye, A.B. Malik // Am. J. Physiol. Lung Cell Mol. Physiol. — 2001. — V. 281, Issue 5. — P. L1037–L1050.
9. Martin J.G. Immune reponses to viral infections: relevance for asthma / J.G. Martin, S. Siddiqui, M. Hassan // Pediatric. Respir. Rev. — 2006. — V. 7, Suppl. 1. — P. S125–S127.
10. Tregoning J.S. Respiratory Viral Infections in Infants: Causes, Clinical Symptoms, Virology, and Immunology / J.S. Tregoning, J. Schwarze // Clin. Microbiol. Rev. — 2010. — V. 23, № 1. — P. 74–98.
11. Wullaert A. NF–B in the regulation of epithelial homeostasis and inflammation / A. Wullaert, M.C. Bonnet, M. Pasparakis // Cell. Res. — 2011. — V. 21, № 1. — P. 146–158.

/7/7.jpg)