Журнал «Медицина неотложных состояний» 8 (63) 2014
Вернуться к номеру
Нутритивна підтримка в періопераційному періоді у дітей
Авторы: Дмитрієв Д.В., Касперович Т.А. — Вінницький національний медичний університет ім. М.І. Пирогова
Рубрики: Медицина неотложных состояний, Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
У статті відображено роль трофічного лікування в практичній медицині, вплив стресового фактора на трофічний гомеостаз, проблеми нутритивної недостатності в ранньому післяопераційному періоді. Розглянуто способи, завдання, принципи та стандарти нутритивної підтримки в ранньому післяопераційному періоді. Показано переконливу перевагу раннього ентерального харчування у хворих після перенесених оперативних втручань. Проаналізовано проблеми нутритивної недостатності, зокрема ятрогенного генезу, та нутритивної підтримки в онкологічних хворих. У статті описаний вплив ентерального та парентерального харчування на метаболізм онкохворих, наведені дані численних досліджень із питань нутритивної підтримки в онкології. Окремо розглянуто питання впливу «імунного» ентерального харчування на метаболічні процеси та імунний статус онкологічних хворих. У роботі подані методи оцінки нутритивного статусу.
В статье отражены роль трофического лечения в практической медицине, влияние стрессового фактора на трофический гомеостаз, проблемы нутритивной недостаточности в раннем послеоперационном периоде. Рассмотрены способы, задачи, принципы и стандарты нутритивной поддержки в раннем послеоперационном периоде. Показано убедительное преимущество раннего энтерального питания у больных после перенесенных оперативных вмешательств. Проанализированы проблемы нутритивной недостаточности, в том числе ятрогенного генеза, и нутритивной поддержки у онкологических больных. В статье описано влияние энтерального и парентерального питания на метаболизм онкобольных, приведены данные многочисленных исследований по вопросам нутритивной поддержки в онкологии. Отдельно рассмотрен вопрос влияния «иммунного» энтерального питания на метаболические процессы и иммунный статус онкологических больных. В работе представлены методы оценки нутритивного статуса.
The article shows the role of trophic treatment in practical medicine, the effects of stress factors on trophic homeostasis, nutritional deficiency problems in the early postoperative period. The methods, objectives, principles and standards for nutritional support in the early postoperative period are examined. The advantages of early enteral nutrition in patients after previous surgery are demonstrated. The problems of nutritional deficiency, including that of iatrogenic origin, and nutritional support for cancer patients are analyzed. The article describes the impact of enteral and parenteral nutrition on the metabolism of cancer patients, the data of numerous studies on the issues of nutritional support in oncology are provided. The issues of immune enteral nutrition impact on metabolic processes and immune status of cancer patients are considered separately. The work presented methods for evaluation of nutritional status.
трофічне харчування, нутритивна недостатність, ентеральне харчування.
трофическое питание, нутритивная недостаточность, энтеральное питание.
trophic nutrition, nutritional deficiency, enteral nutrition.
Статья опубликована на с. 40-52
Одним із важливих факторів, які характеризують ступінь адаптації до зовнішнього світу, є харчування, що забезпечує організм енергією, необхідною для процесів життєдіяльності, сприяє відновленню клітин і тканин в організмі за рахунок надходження з їжею пластичних речовин — білків, жирів, вуглеводів, вітамінів, мінеральних речовин та є джерелом утворення ферментів, гормонів та інших регуляторів обміну речовин в організмі. Харчування є важливим компонентом лікування багатьох захворювань і травматичних пошкоджень. Не випадково ще Гіппократ говорив про те, що харчові продукти мають бути одночасно і лікувальними речовинами, а лікувальні препарати — харчовими інгредієнтами.
Важливе значення у практичній медицині має трофічне харчування (ТХ), що допомагає нормалізувати ряд процесів в організмі, підсилити ефект лікування, зменшити побічні дії багатьох препаратів, покращити обмінні процеси, допомогти організму побороти захворювання. Основою ТХ є знання фізіології обмінних процесів в організмі та біохімічних перетворень, а також розуміння причин, механізмів і форм перебігу різних захворювань, особливостей травлення та обміну речовин у хворої людини. Безумовно, ТХ не є єдиним способом для боротьби з хворобою, але є необхідним компонентом для лікування захворювання [1].
На сьогодні досить актуальною залишається проблема недостатності харчування у ранньому післяопераційному періоді. Значну роль у порушенні трофічного гомеостазу відіграє стресовий стан організму людини, у якому вона продовжує перебувати, особливо в перші дні, після оперативного втручання. Стрес зумовлює масивний викид катехоламінів, глюкокортикоїдів, медіаторів запалення і є причиною виникнення двох тяжких патофізіологічних синдромів: гіперметаболізму та гіперкатаболізму. Внаслідок таких змін можливі втрата маси тіла, анорексія, зниження імунореактивності, а також сповільнене загоєння ран. Недостатність енергетичних матеріалів призводить до зростання катаболічних процесів в організмі, що проявляються протеолізом скелетних м’язів, глюконеогенезом, інсулінорезистентністю, гіперглікемією, продукцією гострофазових білків і цитокінів та порушенням функцій насамперед кишечника, печінки, легень, нирок. Власне, зазначені проблеми певною мірою дозволяє вирішити рання нутритивна підтримка (НП), що займає чільне місце поряд з етіотропною та патогенетичною терапією [2–4].
Ефективність ранньої НП наведена в працях високого рівня доказовості (А, В). Відмічено:
— Скорочення частоти нозокоміальних (госпітальних) пневмоній на 20–25 %.
— Зниження частоти ранових інфекцій на 15–40 %.
— Скорочення термінів перебування у відділенні реанімації й інтенсивної терапії на 3–4 доби.
— Зменшення строків перебування в стаціонарі на 25 %.
— Скорочення витрат препаратів крові на 15–30 %.
— Зниження післяопераційної і реанімаційної летальності на 8–15 % [5, 6].
Власне, під НП хворих слід розуміти комплекс діагностичних та лікувальних заходів, спрямованих на виявлення та корекцію порушень трофічного статусу з метою підтримання відповідного гомеостазу й адаптаційних резервів пацієнтів. Виділення НП як виду спеціалізованого лікування зумовлено певними обґрунтованими причинами. По-перше, порівняно з іншими нозологіями трофічна недостатність не завжди своєчасно діагностується та лікується. Незважаючи на великий арсенал клінічних, лабораторних і інструментальних методів обстеження хворих, практикуючі лікарі не завжди можуть виділити критерії недостатності харчування. По-друге, НП суттєво відрізняється від фармакотерапії, що також не завжди враховується. По-третє, при здійсненні НП хворим слід дотримуватись визначених стандартів:
1. Стандарт дії:
— діагностика трофічної недостатності і її ступеня;
— визначення показань для штучного харчування.
2. Стандарт вмісту:
— розрахунок потреб організму в нутрієнтах;
— вибір виду штучного харчування (ентеральне, парентеральне, змішане);
— вибір харчових сумішей і розчинів;
— складання програми добового раціону штучного харчування.
3. Стандарт забезпечення:
— проведення штучного харчування;
— моніторинг ефективності НП;
— профілактика і лікування ускладнень власне НП.
Основною метою НП є забезпечення фізіологічних потреб хворого в основних макро- і мікронутрієнтах, що може здійснюватись природним (пероральним) або штучним (парентеральним або ентеральним) шляхом.
Основними завданнями НП є: забезпечення пластичних потреб організму в амінокислотах, легкозасвоюваних білках, структуроутворюючих жирах і енергетичному гомеостазі за рахунок введення жирових і вуглеводних, так званих небілкових калорій; корекція порушень водно-сольового балансу; задоволення потреб організму пацієнта в макро- і мікроелементах, а також у вітамінах.
НП характеризується такими принципами: своєчасністю початку її проведення (тобто при появі перших ознак трофічної недостатності або при загрозі розвитку останньої); адекватністю призначеної НП фактичним потребам конкретного пацієнта (з урахуванням гендерних особливостей, віку, величини основного обміну, наявності стресу, дефіциту певних нутрієнтів); оптимальністю тривалості термінів проведення НП (до повної нормалізації соматометричних і клініко-лабораторних показників трофічного статусу пацієнта, зокрема індексу маси тіла, окружності плеча, товщини підшкірно-жирової складки над трицепсом (ТПЖСТ), вмісту жиру в організмі, концентрації загального білка, альбуміну та трансферину сироватки крові).
Слід зазначити, що НП характеризується певними протипоказаннями, основними з них є такі:
— гостра стадія пошкодження (захворювання) — ebb phase (1-ша доба);
— шоковий стан;
— гемодинамічні розлади;
— дефіцит глобулярного об’єму, плазми, об’єм циркулюючої крові;
— реологічні порушення крові;
— порушення макро- і мікроциркуляції;
— гіпоксемія — рО2 менше 50 мм рт.ст.;
— гіперлактатемія — понад 4 ммоль/л;
— ацидоз — рН менше 7,2;
— гіперкапнія — рСО2 понад 80 мм рт.ст. [7, 8].
Оскільки природне харчування є основною метою лікаря, який виконує функції нутриціолога на період НП хворого, ентеральне штучне харчування можна розглядати як проміжний етап у період реабілітації. Парентеральне харчування (ПХ) (введення необхідних поживних речовин, готових для засвоєння організмом, внутрішньовенно, інколи внутрішньоартеріально, оминаючи травлення і всмоктування у шлунково-кишковому тракті (ШКТ)) застосовують у тих випадках, коли неможливе природне (пероральне) та штучне (ентеральне) харчування (ЕХ) унаслідок порушення травної і всмоктувальної функції ШКТ або при необхідності його функціонального розвантаження, внаслідок критичних станів, що супроводжуються вираженим гіперметаболізмом (сепсис, черепно-мозкова травма, політравма, перитоніт, гнійні рани, ШВЛ, поліорганна недостатність), інфекційних захворювань у гострому періоді, гострої печінкової недостатності, онкологічної патології і наслідків хіміо- і променевої терапії, щелепно-лицевої патології, трансплантології, психічних захворювань з анорексією і кахексією. ПХ дозволяє вибірково компенсувати водно-електролітні, енергетичні, пластичні порушення для підтримки метаболізму і гомеостазу. Повне внутрішньовенне харчування на сучасному рівні дозволяє компенсувати гіперметаболічну реакцію організму на стрес, усунути або зменшити прояви недостатності харчування, що обумовлені хірургічною патологією, наркозом і операцією.
Таким чином, ПХ є методом вибору при корекції метаболічних порушень в інтенсивній терапії критичних станів у хірургії. Основною перевагою ПХ є можливість вибіркового забезпечення організму необхідними нутрієнтами, навіть при наявності у пацієнта органічних і функціональних порушень роботи ШКТ. У багатьох випадках упродовж певного часу хворому може бути протипоказаний ентеральний прийом їжі і ПХ залишається єдиним джерелом поживних речовин. Абсолютні протипоказання до ПХ відсутні, серед відносних протипоказань — індивідуальна непереносимість певних компонентів, а також наявність деяких патологій, при яких певні інгредієнти є небажаними (наприклад, деякі амінокислоти при гострій печінковій недостатності, вуглеводи при гострій дихальній недостатності). Обмеженнями для ПХ є тяжкі порушення кислотно-основного стану, водно-електролітної рівноваги, гіпергідратація, порушення гемодинаміки. ПХ повинно бути збалансованим за кількістю, якістю інгредієнтів, містити азотисті речовини, електроліти, мікроелементи, вітаміни. Увесь набір нутрієнтів можна представити двома основними групами: джерелами енергії (вуглеводи, ліпіди) і пластичним матеріалом для синтезу білка (розчини амінокислот). Фоновими компонентами є вода, електроліти, вітаміни й мікроелементи, оскільки останні не синтезуються в організмі [9–11].
На думку багатьох дослідників у галузі нутриціології, при призначенні НП перевагу слід віддавати ентеральному доступу як більш фізіологічному, що меншою мірою, ніж ПХ, призводить до інфекційних ускладнень. ЕХ у 4–6 разів дешевше за ПХ і не потребує суворо стерильних умов. Важливими перевагами ЕХ також є низький рівень ускладнень, простота доставки нутрієнтів. ЕХ є найважливішим компонентом допомоги пацієнтам у критичних станах, як правило, у ранньому післяопераційному періоді, коли звичайне харчування неефективне, неможливе фізично або ШКТ не спроможний сприймати природне харчування внаслідок функціональної неповноцінності. ЕХ на відміну від перорального проводиться через зонд (катетер), безпосередньо в тонку кишку, оминаючи ротову порожнину, стравохід, шлунок і дванадцятипалу кишку. Це дозволяє забезпечити функціональний спокій верхніх відділів ШКТ. Нутрієнти не проходять обробку в ротовій порожнині, не підлягають впливу слини, жовчі, травних соків шлунка, підшлункової залози, а потрапляють у тонку кишку, функція якої порушена більшою або меншою мірою. Перераховані умови визначають вимоги до строків, фізичних властивостей, складу, об’єму і режиму введення продуктів і препаратів для ЕХ [12, 13].
Слід враховувати, що тонка кишка живиться за рахунок субстратів, що знаходяться в її просвіті, на 50 %, а товста кишка — на 80 %. У разі відсутності субстрату в кишечнику порушується регенерація епітеліоцитів слизової оболонки, втрачається бар’єрна функція. Тривала відсутність ентерального прийому їжі призводить до атрофії слизової оболонки ШКТ, зниження мезентеріального і печінкового кровообігу, утворення гострих виразок ШКТ. ЕХ здатне підтримувати структурну цілісність і багатоманітну функцію ШКТ, забезпечуючи збереження бар’єра, що відокремлює кишкову мікрофлору від системної циркуляції, сприяє відновленню мікробіоценозу, що також допомагає підтримувати гомеостаз і імунітет [14, 15].
ЕХ повинне відповідати трьом основним критеріям:
— бути безпечним і не викликати побічних ефектів;
— цілком задовольняти потреби організму в макро- і мікронутрієнтах;
— допускати модифікацію в складі поживних сумішей для задоволення специфічних потреб організму хворого залежно від характеру патології.
Показаннями до ЕХ є виражена білково-енергетична недостатність, що не компенсується звичайним пероральним харчуванням, і органічне ураження ШКТ, що становить труднощі для надходження необхідної кількості поживних речовин до організму. Як і ПХ, ЕХ може бути повним або частковим. У першому випадку ЕХ забезпечує добову потребу організму в нутрієнтах, а в другому — доповнює пероральне або парентеральне харчування. ЕХ можливе лише в умовах збереження всмоктувальної і моторної функції кишкової стінки щодо нутрієнтів і залежить від ступеня даних порушень. Таким чином, суміші для ЕХ повинні повністю всмоктуватись у тонкій кишці, не викликати диспептичних реакцій, також їх склад повинен визначатись функціональним станом травлення і всмоктування в тонкій кишці. Вибір поживних сумішей, режиму й об’єму їх введення визначається на підставі об’єктивної оцінки тяжкості метаболічних розладів, ступеня трофічної недостатності й характеру функціональних порушень у тонкій кишці [9, 10, 16, 17].
Абсолютними протипоказаннями до ЕХ є:
— паралітична і механічна кишкова непрохідність;
— безперервне блювання;
— тривала кровотеча із ШКТ;
— гострий деструктивний панкреатит;
— неспроможність міжкишкового анастомозу;
— порушення порожнинного і пристінкового травлення.
До відносних протипоказань належать:
— індивідуальна непереносимість різних компонентів харчових сумішей;
— функціональна неспроможність кишечника [2, 18].
Переважним шляхом доставки ЕХ в тонку кишку є гнучкі катетери малого діаметра, які не викликають ускладнень, що характерні для звичайних ентеральних зондів, і легко переносяться хворими упродовж тривалого часу. Як правило, катетери малого діаметра використовують у поєднанні з портативними інфузійними насосами. Такі катетери звичайно використовують після видалення назоентеральних зондів і при відсутності показань до зондової декомпресії і лаважу кишечника. Катетери для ЕХ повинні бути стійкими до агресії травних соків, тривалий час зберігати еластичність і міцність, не викликати місцевого подразнення і пролежнів слизових оболонок верхніх дихальних шляхів, глотки, стравоходу, шлунка і кишечника. Їх застосування є профілактикою аспірації й регургітації поживних сумішей, розвитку синуситів, фарингітів і пролежнів слизової оболонки в дихальних шляхах і ШКТ, а також надлишкової секреції шлунка, підшлункової залози і печінки, що особливо важливо при лікуванні кишкових нориць [9, 18, 19].
Поживні суміші або дієти для ЕХ можуть бути стандартними (полімерними), збалансованими за добовою потребою в білках, жирах і вуглеводах (1 : 1–2 : 2–3), напівелементними (на основі гідролізатів білка), спеціального призначення (імуномодулюючі та метаболічно орієнтовані), тобто селективні та зі спеціальними харчовими модулями (білкові, жирові, вуглеводні). Стандартні дієти містять усі необхідні макро- і мікронутрієнти і вітаміни відповідно до добових потреб організму при патологічних станах. Вони призначені для корекції або запобігання білково-енергетичній недостатності у всіх ситуаціях, коли природне харчування неможливе або недостатнє. Стандартні дієти містять: як джерела азоту — казеїнат кальцію, казеїнат натрію, молочний білок, концентрат сироваткових білків, ізолят соєвого білка; як джерела вуглеводів — мальтодекстрин, глюкозний сироп, крохмаль; як ліпіди — рослинні олії, середньоланцюгові тригліцериди, омега-3 і омега-6 жирні кислоти. Полімерні дієти мають певні обмеження, причиною яких є недостатність ферментативного гідролізу полімерів у тонкій кишці. Спеціалізовані дієти застосовують для корекції метаболізму хворих із порушеннями обміну. Наприклад, хворим на цукровий діабет рекомендовані дієти зі зниженим рівнем вуглеводів і підвищеним умістом жирів (для компенсації метаболічних потреб вони містять 16–17 % білка, 32,2–45 % вуглеводів, 42–50,9 % жирів; збагачені харчовими волокнами, у першу чергу пектинами). Спеціальне харчування для хворих із тяжкою хронічною патологією легень характеризується високим умістом калорій жиру й обмеженням вуглеводів, що сприяє зниженню утворення СО2 і зменшує його затримку в тканинах (розподіл калорій: білки — 16,7 %, вуглеводи — 28,2 %, жири — 55,1 %; співвідношення небілкових калорій і азоту становить 125 : 1). Спеціальне харчування для пацієнтів із хронічною нирковою патологією, які знаходяться на гемодіалізі, а також при гострій печінковій недостатності ґрунтується на великих втратах білка. Так, при сеансі гемодіалізу втрачається від 10 до 13 г амінокислот, у тому числі 30–40 % незамінних. Таким чином, харчування призначається з розрахунку підтримання альбумінів плазми крові не нижче 35 г/л [9, 20].
При виборі суміші для ЕХ необхідно звернути увагу на її енергоцінність (для дітей до 1 року повинна становити не менше 0,67 ккал/мл, старших 1 року — 1 ккал/мл), відсутність або низький вміст лактози, осмолярність (не вище 300 мосмоль/л), в’язкість (суміш повинна вільно проходити через зонд). Харчова суміш повинна бути повноцінною за інгредієнтним складом; метаболічно орієнтованою на основне захворювання; легко засвоюватися; не посилювати кишкову перистальтику.
В Україні на сьогодні зареєстровано декілька сумішей спеціального призначення (альфаре, пептамен, модулен IBD, клінутрен юніор, клінутрен оптимум), що застосовуються в ентеральній нутриціології. Усі вони безлактозні й не містять глютену. При збереженій цілісності шлунково-кишкового тракту застосовуються суміші клінутрен юніор та клінутрен Ооптимум, при порушеній — усі інші [22, 23].
Водночас в Україні ЕХ використовується в педіатричній практиці недостатньо широко, що може бути обумовлено значною кількістю ускладнень ЕХ, серед яких:
— порушення прохідності зонда (обтурація або перегин у процесі експлуатації);
— міграція зонда в шлунок або в товсту кишку;
— регургітація суміші, коли вона переповнює кишечник через несвоєчасне засвоєння, парез кишечника або передозування суміші;
— аспірація (основні причини — попередня пневмонія, неврологічні порушення, відсутність кашльового або блювотного рефлексів, подовжена ШВЛ);
— діарея в разі неадекватного вибору компонентів дієти і її об’єму;
— мікробне обсіменіння й інфекції по ходу зонда (катетера);
— метаболічні ускладнення внаслідок гіпер- або гіпоосмолярного стану сумішей, гіперглікемія, ренальна азотемія, глюкозурія.
Таким чином, ускладнення ЕХ можуть бути механічними, шлунково-кишковими й метаболічними. Ретельний контроль за станом зондів, катетерів та догляд за ними, лабораторний моніторинг пацієнтів, адекватний вибір поживних сумішей дозволяє запобігти подібним ускладненням і покращити результати комплексного лікування хворих [9, 21].
У відділенні проблем харчування та соматичних захворювань дітей раннього віку ДУ «Інститут педіатрії, акушерства і гінекології НАМН України» накопичено великий досвід застосування сумішей ентерального харчування при різноманітній патології органів травлення, гіпотрофіях, ферментопатіях, тяжких пневмоніях, септичних станах. При цьому спостерігаються позитивна динаміка клінічного перебігу захворювань та більш швидке одужання дітей, що скорочує терміни їх перебування в стаціонарі та прискорює реабілітаційний процес [22].
Численними дослідженнями встановлено, що порушення харчування може призводити до різних структурно-функціональних змін в організмі і, як наслідок цього, до порушень метаболізму, гомеостазу та адаптаційних резервів. Існує прямий кореляційний зв’язок між трофічним забезпеченням тяжкохворих пацієнтів і їх летальністю: чим вищий енергетичний дефіцит, тим частіше спостерігаються тяжка поліорганна дисфункція і летальний кінець. Дана закономірність прослідковується і в онкохворих внаслідок розвитку в них вираженої нутритивної недостатності (НН) [24]. НН, досягаючи максимальних проявів у вигляді синдрому анорексії-кахексії, може бути безпосередньою причиною смерті у 4 із 20 онкологічних хворих. У середньому частота синдрому анорексії-кахексії становить 60–80 %. Найчастіше в клінічній практиці користуються терміном «кахексія», під яким переважна більшість онкологів розуміють лише крайній ступінь виснаження (втрата понад 15–20 % маси тіла) онкологічного хворого, хоча термін «кахексія» в перекладі з грецької мови означає «поганий стан пацієнта», тобто це і втрата маси тіла, і зниження фізичної активності, і втрата м’язової та жирової тканини. Сучасний погляд на даний комплекс симптомів дозволяє об’єднати їх у єдиний синдром, що досить чітко відображає суть змін, які відбуваються в організмі онкологічного хворого. Патогенез синдрому анорексії-кахексії є поліфакторним і остаточно не вивченим. Ключовими ланками патогенезу даного синдрому є:
1. Порушення лептинової регуляції (лептин у нормі синтезується адипоцитами і клітинами кишечника й сигналізує про адекватне надходження до організму калорій і достатній запас у депо жиру).
2. Аберантна передача сигналів.
3. Порушення регуляції нейропептиду Y.
4. Продукція цитокінів.
5. Гіперметаболізм із порушенням білкового, вуглеводного, жирового обміну.
6. Дисфункція ШКТ: пухлинного та ятрогенного генезу.
7. Продукція пухлиною спеціальних субстанцій — ліпід- і протеїнмобілізуючого факторів.
8. Убіквітинзалежний шлях деградації м’язової тканини.
У патогенезі НН, окрім синдрому анорексії-кахексії, виділяють ще ряд тяжких синдромів, що варто своєчасно діагностувати та лікувати, зокрема синдром гіперметаболізму-гіперкатаболізму та синдром кишкової недостатності. Дані синдроми, як правило, поєднуються в онкохворих, і тому лікування, що проводиться, повинно бути комплексним. Синдром гіперметаболізму-гіперкатаболізму супроводжується прогресуючою білково-енергетичною недостатністю (БЕН), що є характерною не лише для пухлинного процесу, але й для неспецифічного синдрому гострої системної запальної відповіді на пошкодження або гострий патологічний процес, що в тяжких випадках призводить до поліорганної недостатності. Особливістю даного синдрому є невідповідність між надходженням енергії до організму та енерговитратами, унаслідок чого відбувається різке зростання енергетичних потреб і виражений розпад білків, зниження швидкості окислення глюкози з одночасним підвищенням окислення жирів, що зрештою зумовлює патологічну толерантність організму до натуральних (природних) продуктів. Недостатність нутрієнтів (білків, жирів, вуглеводів) призводить до вивільнення власних резервів за рахунок деструкції тканин організму («автоканібалізм»). У розпаді беруть участь практично всі тканини й імунна система. Синдром кишкової недостатності ґрунтується на теорії розвитку поліорганної недостатності в результаті змін проникності слизової оболонки кишечника, що призводить до транслокації бактерій і токсинів у систему циркуляції. Це пов’язано з тим, що кишечник є також «критичним» органом, що потребує захисту й лікування, як і серце, легені й нирки. Кишечник також має власну автономну енергію подібно до серця. Необхідність даного процесу пояснюється тим, що в ранньому післяопераційному періоді автономна енергія витрачається на підтримку амплітуди скорочень кишечника, тому парез кишечника — симптом клінічний, а не фізіологічний. Щоправда, слід відмітити, що парез кишечника може стати симптомом і фізіологічним, якщо не проводиться адекватна НП, метою якої є відновлення запасів автономної енергії кишечника та захист від абдомінального сепсису [25–27].
У сучасних умовах досить актуальною залишається проблема НН ятрогенного генезу в онкохворих. Ятрогенна НН може виникати внаслідок хірургічного лікування, променевої терапії та хіміотерапії. Хірургічне лікування пухлин може ускладнюватись розвитком диспептичного синдрому, синдрому мальабсорбції, демпінг-синдрому, панкреатобіліарної недостатності, анемії, порушенням засвоєння вітаміну В12 та порушенням водно-електролітного балансу. Променева терапія (ПТ) на ділянку голови та шиї інколи супроводжується пошкодженням мікроворсинок смакового поля, і тому хворі можуть відчувати зміну смаку. Варто зазначити, що в перші 3–4 доби ПТ дуже часто виникають нудота, дисфагія, карієс. Мукозити й ураження слизової оболонки розвиваються на 2–3-му тижні лікування. Застосування ПТ при пухлинах органів грудної клітки може зумовити розвиток дисфагії, що, як правило, зберігається впродовж тривалого часу після припинення ПТ. ПТ на ділянку живота й малого таза може сприяти розвитку двох типів нутритивних порушень: обмеження прийому натуральних продуктів унаслідок анорексії, нудоти, блювання та хронічного променевого ентериту (з клінікою синдрому короткої кишки). Варто пам’ятати, що в 70–80 % пацієнтів ПТ на органи черевної порожнини клінічно супроводжується розвитком мальабсорбції глюкози, жирів, електролітів і протеїнів (через дефіцит пептидаз). Морфологічні зміни слизової оболонки тонкої кишки проявляються зменшенням числа мітозів і висоти мікроворсинок, причому в 1/3 хворих розвивається гострий ентерит із переходом у латентний. Хіміотерапія може призводити до анорексії внаслідок зміни смаку і нюху, появи металевого присмаку, дисфагії, виразок на слизовій оболонці губ, язика, ротової порожнини і стравоходу, появи нудоти, блювання, а також розвитку запорів або паралітичного ілеусу. Поліхіміотерапія часто є причиною виникнення неопластичної ентеропатії, що характеризується синдромом мальабсорбції, стрімким розвитком відчуття швидкого насичення та гіпоальбумінемією [21, 28, 37].
Таким чином, розвиток злоякісної пухлини і протипухлинне лікування — причина розвитку тяжкої НН в онкологічних хворих. НН призводить до незадовільних результатів протипухлинної терапії і навіть до передчасного її припинення й відповідно знижує якість життя. Основним методом профілактики, лікування НН є адекватна якісна нутритивна підтримка, адаптована під специфічні розлади метаболізму онкологічних хворих.
Впродовж багатьох років онкологів турбувало питання, чи варто проводити інтенсивне харчування онкохворих, чи не призводить це до росту пухлини: Вважалось, що, добре харчуючись, онкологічний хворий годує свою пухлину, сприяючи тим самим її зростанню. Ґрунтувались ці погляди на тому, що в працях В.С. Шапота (1975 р.) було зазначено: «пухлина — пастка глюкози», «пухлина — пастка азоту», однак указані постулати стосуються лише глюкози й азоту пацієнта, а не штучно введених субстратів. Водночас є дані, отримані в експерименті на щурах, які свідчать про те, що активна аліментація може посилювати явища проліферації пухлинних клітин (Daly J.M. et al., 1981; Kinsella J.E., 1990). Проте, погано харчуючись, хворий ослаблює свій організм, створюючи умови для більш ранньої генералізації пухлинного процесу та розвитку ускладнень, що, власне, також відмічено і доведено у працях В.С. Шапота, основними положеннями яких є:
1. Голодування стимулює канцерогенез.
2. Голодування призводить до атрофічних змін у залозах внутрішньої секреції, до порушення гомеостазу й послаблення резистентності організму онкологічного хворого.
3. При голодуванні значна кількість альбумінів втрачається через кишечник.
4. Тривала гіперглікемія стримує ріст пухлини.
5. Гіперглікемія гальмує ріст пухлини і її дисемінацію.
Таким чином, в онкології НП показана більше, ніж в інших галузях медицини. Велике значення проведеної адекватної і своєчасної НП в онкологічних хворих підтверджується багатьма дослідженнями. Наприклад, дані, наведені в працях De Wys, R. Fein, M.M. Meguid, B.F. Smale, K.B. Harvey, G. Bonadonna, підтвердили взаємозв’язок між втратою маси тіла і погіршенням якості життя, більш високою смертністю. Взаємозв’язок між недостатністю нутритивного статусу й виживанням показаний у працях S.S. Donaldson. У 7 рандомізованих дослідженнях (Issel I.B.F. et al., Rickard K.A. et al., Ghavimi F. et al., Hays D.M. et al., Van Eys J. et al., Kinsella T.J. et al., Clamon G.H. et al.) показано зниження частоти: променевих ентеритів, гематологічної токсичності, нудоти і блювання під час хіміопроменевої терапії в онкологічних хворих. Дані дослідження також довели, що в онкологічних хворих, які отримували хіміотерапію при пухлинах ШКТ у поєднанні з адекватною НП, покращувалися апетит, маса тіла, імунний статус, відповідь на хіміотерапію, зменшувалась токсичність проведеного лікування [29, 30].
НП в онкології подібно до фармакотерапії має доказову базу (переважно середній рівень доказовості). Доказовими ефектами НП є такі:
1. Задоволення потреб організму в макронутрієнтах (білки, жири, вуглеводи), мікронутрієнтах (вітаміни, мікроелементи) і фармаконутрієнтах (антиоксиданти, глутамін, аргінін, омега-3 жирні кислоти та ін.) (В).
2. Відновлення азотистого балансу в організмі (В).
3. Скорочення частоти ранової інфекції і нозокоміальних інфекційних ускладнень (В).
4. Скорочення частоти й тяжкості післяопераційних ускладнень, включаючи поліорганну недостатність (С).
5. Зменшення тривалості перебування хворого в палаті інтенсивної терапії, а також тривалості ШВЛ (В).
6. Зменшення тривалості госпіталізації (В).
7. Зниження летальності (В).
8. Підвищення якості життя (С).
9. Зменшення витрат дорогих ліків і препаратів крові (С).
10. Профілактика і лікування асоційованої з раком недостатності харчування (С).
11. Профілактика і лікування недостатності харчування на фоні хіміо- і хіміопроменевої терапії (С).
12. Можливість проведення повноцінної цитотоксичної хіміотерапії і/або променевої терапії, а також покращення їх переносимості (С) [6, 25].
Абсолютними показаннями для призначення онкологічним хворим активної НП є:
1. Швидка і прогресуюча втрата маси тіла внаслідок онкологічного захворювання:
— 10 % і більше за 1 місяць або 20 % і більше за 3 місяці.
2. Наявність у пацієнта початкових ознак гіпотрофії:
— індекс маси тіла (ІМТ) < 19 кг/м2;
— окружність плеча (ОП) < 90 % від стандарту (чоловіки — < 26 см, жінки — < 25 см);
— гіпопротеїнемія < 60 г/л і/або гіпоальбумінемія < 30 г/л;
— абсолютна лімфопенія < 1200.
3. Загроза розвитку прогресуючої недостатності харчування:
— відсутність можливості оптимального природного харчування (коли хворі не можуть, не хочуть або не повинні приймати їжу природним шляхом);
— зростання потреби в нутрієнтах унаслідок наявності гіперметаболізму і гіперкатаболізму.
Також слід враховувати, що активна НП повинна, якщо можливо, проводитися на всіх етапах хірургічного лікування онкологічних хворих, у передопераційний, ранній і пізній післяопераційний періоди.
Основними цілями НП в онкологічних хворих є:
— Підтримання оптимальної маси тіла.
— Запобігання або корекція дефіциту нутрієнтів.
— Підтримання вісцерального пулу білка.
— Підвищення переносимості різних методів протипухлинної терапії.
— Мінімізація проявів побічних ефектів радіо- і хіміотерапії.
— Профілактика і лікування імунодепресії.
— Підвищення рівня якості життя.
Для підтримання адекватного трофічного статусу онкологічного пацієнта потрібна правильна організація лікувально-діагностичного процесу і правильна науково обґрунтована організація лікувального харчування, вид якого обирається залежно від локалізації, стадії онкологічного процесу, протипухлинного лікування, що проводиться, ступеня вираженості НН [29].
Показання до призначення виду НП, визначення енергетичних потреб, вибір виду поживної суміші і її дозування здійснюються на підставі оцінки нутритивного статусу (НС). Оцінка НС і тяжкості захворювання проводиться за анамнестичними даними, антропометричними показниками, біохімічними та імунологічними показниками.
Анамнестичні дані використовуються для визначення темпів і ступеня втрати маси тіла. Аналіз таких даних відображений у табл. 1.
Антропометрія відображає зміни виміряних анатомічних параметрів, пов’язаних із порушенням НС.
Основні антропометричні параметри:
1. Маса тіла. Короткочасні зміни маси тіла відображають в основному коливання водного балансу. Тривалі зміни маси тіла, як правило, свідчать про зміни у тканинній масі, але не пояснюють структурні зміни. Довільна втрата маси тіла за період понад 3 місяці є повноцінним критерієм оцінки трофічного статусу від легкого (< 5 %) до тяжкого (> 7,5 %) ступеня недостатності харчування.
2. Індекс маси тіла. Даний показник розраховується за формулою: ІМТ = маса тіла (кг) / зріст (м2). НС за даними ІМТ оцінюється таким чином (табл. 2).
3. Окружність плеча. Низькі значення (менше 90 % від стандарту відповідної вікової категорії) даного показника співвідносяться з високою летальністю. Водночас застосування даного критерію є малоінформативним при наявності патологічних станів, що проявляються набряковим синдромом.
4. Товщина підшкірно-жирової складки над трицепсом. ТПЖСТ є інтегральним показником стану жирових депо організму.
5. Окружність м’язів плеча (ОМП). ОМП характеризує соматичний пул білка. ОМП (см) = ОП (см) – 0,314 • ТПЖСТ (мм).
До функціональних тестів можна зарахувати дослідження функції зовнішнього дихання (ФЗД). Показники ФЗД, такі як, наприклад, об’єм форсованого видиху на 1-й секунді і піковий об’єм швидкості видиху, змінюються за наявності недостатності харчування, відображаючи силу дихальних м’язів. Дані показники корелюють із рівнем загального білка в організмі і швидко знижуються при втраті організмом понад 20 % білка.
Лабораторні параметри:
1. Сироватковий альбумін — переважно відображає тяжкість захворювання, а не ступінь НН, оскільки має тривалий період напіврозпаду (18 днів). За даними показників альбуміну крові та маси тіла можна розрахувати індекс нутритивного ризику (ІНР) за G.P. Buzby et al.: ІНР = 1,519 • рівень альбуміну + 0,417 • (маса тіла вих./маса тіла акт.). ІНР > 97,5 — немає нутритивної недостатності; ІНР = 83,5–97,5 — середній ступінь нутритивної недостатності; ІНР < 83,5 — тяжкий ступінь нутритивної недостатності.
2. Білки з коротким періодом напіврозпаду: трансферин (8 діб), транстиретин і ретинолзв’язуючий білок (із періодами напіврозпаду 2 доби і 12 годин). Дані транспортні білки використовуються для ранньої діагностики БЕН (табл. 3).
3. Креатинін. Його концентрація відображає не лише адекватність функції нирок, але й стан м’язової маси. Для оцінки соматичного пулу білка в організмі розраховують креатинін-ростовий індекс (КРІ), який визначають за відношенням фактичної екскреції креатиніну (ФЕК) до ідеальної або стандартної екскреції креатиніну (ІЕК). КРІ (%) = ФЕК (мг/добу) / ІЕК (мг/добу) • 100 %. (ІЕК для чоловіків — 23 мг/кг, для жінок — 18 мг/кг).
Біоімпедансний аналіз. Даний метод ґрунтується на відмінностях між провідністю різних тканин. Такі тканини, як м’язи або кров (містять велику кількість води та електролітів), є хорошими провідниками, а жирова тканина і кістки — навпаки. Шляхом математичних розрахунків біоімпедансний метод дозволяє визначити склад тіла.
Імунна функція. НН позначається на стані клітинного імунітету. Лімфоцити в кількості 900–1500 кл/мм2 вказують на помірну недостатність харчування, а значення < 900 кл/мм2 свідчить про тяжкий ступінь недостатності харчування [10, 33, 34].
Нутритивну підтримку слід проводити за таким алгоритмом:
1. Крок І — розрахунок фактичної потреби організму в пластичних нутрієнтах та енергії.
2. Крок ІІ — формування добового раціону харчування з урахуванням наявної патології і тяжкості стану хворого.
3. Крок ІІІ — визначення темпу і шляху введення харчових сумішей.
Крок I
Для оцінки фактичної потреби організму в нутрієнтах та енергії необхідно враховувати, по-перше, базисні потреби в умовах основного обміну, по-друге, додаткові потреби, пов’язані з наявністю стресу.
Для визначення енергетичних потреб організму в умовах основного обміну використовують таблиці або формули Харріса і Бенедикта:
ЕОО (у чол.) = 66 + (13,7 • МТ) + (5 • Р) – (6,8 • В);
ЕОО (у жін.) = 655 + (9,6 • МТ) + (1,8 • Р) – (4,7 • В),
де ЕОО — енергетична потреба основного обміну (ккал/добу); МТ — фактична маса тіла (кг); Р — зріст (см); В — вік (років).
Для розрахунку фактичних витрат енергії (ФВЕ) необхідно враховувати декілька факторів — фактор активності (ФА), фактор стресу (ФС) і термінальний фактор (ТФ) (табл. 4). Звідси:
ФВЕ = ЕОО • ФА • ФС • ТФ.
/47/47.jpg)
Для визначення реальних потреб організму пацієнта в основних нутрієнтах (білках, жирах, вуглеводах, макро- і мікроелементах, вітамінах), крім того, орієнтуються на вираженість азотистого катаболізму, а також на ознаки дефіциту тих чи інших поживних речовин.
Крок II
Оскільки катаболічні втрати суттєво відрізняються в рамках однієї нозологічної форми, для визначення потреб організму в поживних речовинах потрібно орієнтуватися на ступінь вираженості НН, а також на припустимий рівень катаболізму. Це виправдано, якщо врахувати, що більш значний катаболізм призводить до більш чітко вираженої НН, що визначається за допомогою соматометричних і клініко-лабораторних методів дослідження.
Крок III
У перші 3–5 діб для запобігання розвитку ускладнень унаслідок надмірного швидкого початку штучного харчування пацієнти повинні отримувати не більше 50–70 % від розрахованих фактичних потреб організму в поживних речовинах. У процесі активної НП повинен здійснюватися безперервний клініко-лабораторний моніторинг стану пацієнтів, метою якого є, по-перше, оцінка ефективності й адекватності НП і, по-друге, рання діагностика вірогідних ускладнень НП [31, 32].
Серед усіх заходів, направлених на профілактику або на корекцію порушень трофічного статусу в онкологічних хворих, найбільш ефективними з точки зору доказової медицини є такі:
— НП хворим із групи високого ризику із формування недостатності харчування впродовж 10–14 днів до запланованого оперативного втручання.
— Інтенсивний моніторинг НС під час проведення ПТ та хіміотерапії.
— Перевага ентерального шляху (по можливості) надходження нутрієнтів.
— Використання есенціальних харчових речовин (аргінін, омега-3 жирні кислоти, нуклеотиди) упродовж 5–7 днів передопераційного періоду хворих, які готуються до великих оперативних втручань на органах черевної порожнини [6].
Загальне правило: ентеральному шляху надходження нутрієнтів повинна надаватись перевага у всіх можливих випадках.
Своєчасний початок і правильне проведення ЕХ на етапах хірургічного та інших варіантів протипухлинного лікування онкологічного хворого забезпечує його білково-енергетичні потреби в у мовах нутритивної недостатності, припинення або обмеження харчування природним шляхом, запобігає порушенням метаболізму, моторної, секреторної та всмоктувальної функцій ШКТ, покращує його кровопостачання, знижує ризик утворення стресових виразок, інфекційних або інших післяопераційних ускладнень, сприяє підтриманню імунітету, покращує ефективність лікування і наслідки захворювання, а також прискорює реабілітацію хворих після лікування.
Таким чином, ЕХ — це найбільш оптимальна форма нутритивної терапії. Відсутність потреби у венозному доступі знижує ризик розвитку катетер-асоційованих інфекційних ускладнень. Проведення ЕХ можливе per os, а також за допомогою назогастрального або назоєюнального доступу. Вибір доступу визначається наявністю у хворого можливості самостійно харчуватися або відсутністю ознак дисфагії. Харчування per os, як правило, можливе у пацієнтів із НН легкого, рідше середнього ступеня тяжкості, коли прояви анорексії помірно виражені. Якщо проведення адекватної НП per os є неможливим, використовують назогастральний або назоєюнальний доступ. Тривалий час вважалось, що варто застосовувати назоєюнальний доступ, оскільки зменшується ризик розвитку аспіраційної пневмонії. Проте G.P. Zaloga et al., проводячи метааналіз 112 досліджень, не виявив переконливих відмінностей у частоті виникнення ускладнень при використанні того чи іншого доступу для ЕХ. На сучасному етапі застосування назоєюнального доступу є виправданим за наявності у хворого стенозу пілоричного відділу шлунка, вираженого ураження шлунка пухлинним процесом або його парезу. Ефективність ЕХ в онкологічних хворих доведена численними дослідженнями. ЕХ як компонент передопераційної підготовки здатне сприятливо впливати на стан НС та перебіг раннього післяопераційного періоду. Запобігання наростанню ознак НН на фоні ЕХ було відмічено A.C. Campos et al. у хворих на рак стравоходу. Аналогічні результати були отримані L. Ovesen et al., які вивчали вплив ЕХ на НС хворих на рак легені і яєчників. Доведено, що проведення ЕХ у післяопераційному періоді сприяє зниженню тривалості госпіталізації в онкологічних хворих. Найбільш оптимальними термінами для початку ЕХ з метою профілактики дистрофічних змін слизової оболонки кишечника є 12–24 години після операції. При цьому хворим, прооперованим із приводу злоякісних новоутворень верхніх відділів ШКТ, інтраопераційно для раннього початку ЕХ слід встановити зонди, заведені дистальніше анастомозу, оскільки було показано, що раннє ЕХ не підвищує ризик розвитку неспроможності швів анастомозів і виникнення аспіраційної пневмонії [18, 25, 33–35].
Окремо варто розглянути питання впливу «імунного» ЕХ на метаболічні процеси та імунний статус онкологічних хворих. На сьогодні існує велика кількість досліджень, присвячених впливу сумішей для ЕХ, збагачених омега-3 жирними кислотами, аргініном, нуклеотидами, глутаміном. У дослідженнях було показано, що використання в передопераційному періоді таких сумішей сприяє зниженню летальності, частоти виникнення інфекційних ускладнень і тривалості госпіталізації онкологічних хворих. Так, H. Takeuchi et al. повідомили про зменшення частоти виникнення інфекційних ускладнень у післяопераційному періоді у хворих на рак стравоходу, які отримували в передопераційному періоді ентеральні суміші, що містили у своєму складі омега-3 жирні кислоти, аргінін, нуклеотиди. M. Kemen et al. у своїй роботі продемонстрував, що використання «імунного» харчування сприяє більш швидкій нормалізації імунної відповіді в онкологічних хворих у післяопераційному періоді. U. Giger et al. виявили зменшення вираженості запальної реакції і частоти виникнення ускладнень у післяопераційному періоді у хворих, які отримували суміші, збагачені аргініном, омега-3 жирними кислотами і нуклеотидами. Враховуючи отримані дані, при проведенні ЕХ в післяопераційному періоді варто використовувати суміші, що містять вищевказані компоненти, впродовж 5–7 днів до і після оперативного втручання. Також варто пам’ятати, що рутинне використання «імунного» харчування (понад 4 тижні) з метою корекції БЕН не рекомендовано у зв’язку з відсутністю достатньої доказової бази щодо його ефективності [25, 36].
Основним показанням для проведення парентерального харчування в онкологічних хворих є виражені порушення функції ШКТ, через які впродовж 10–14 днів неможливо повноцінно забезпечити хворого необхідними поживними речовинами.
Існує велика кількість досліджень, метою яких було вивчення впливу ПХ на метаболізм онкохворих. Більшість таких досліджень виявили позитивний вплив даного виду НП, показали зниження частоти летальності й розвитку ускладнень у післяопераційному періоді. J.M. Muller et al. у своєму дослідженні показали зниження частоти летальності та післяопераційних ускладнень у групі хворих зі злоякісними пухлинами ШКТ, які впродовж 10 днів отримували повне передопераційне ПХ. Зниження частоти ускладнень у післяопераційному періоді, враховуючи розвиток сепсису, виявив також і S.T. Fan у хворих після гемігепатектомії.
Також варто зазначити, що існує певна кількість досліджень, у яких не виявлено позитивного впливу ПХ на метаболізм. Так, у хворих, яким проводились різні курси хіміотерапії, на фоні ПХ не спостерігалось зниження летальності, крім того, спостерігалось деяке збільшення частоти інфекційних ускладнень.
Основним недоліком ПХ є розвиток дистрофічних змін слизової оболонки кишечника внаслідок відсутності надходження поживних речовин. Це збільшує ризик виникнення інфекційних ускладнень на фоні синдрому транслокації бактерій. Можливим вирішенням даної проблеми є використання комбінованої форми нутритивної терапії, коли на фоні повного ПХ зберігається незначне надходження поживних речовин через ШКТ, для запобігання розвитку атрофічних змін слизової оболонки кишечника [39].
Наводимо клінічний випадок, який викликає інтерес своїм перебігом, анатомічними особливостями подвоєння тонкої кишки та відносною рідкістю даної патології.
Дитина Ш., МКСХ № 13885, віком 2 роки, була госпіталізована в онкогематологічне відділення ВДОКЛ зі скаргами на збільшення живота в об’ємі 29.11.2013 р. Зі слів батьків, збільшення живота помітили близько 14 днів тому. Звернулись по медичну допомогу в поліклініку за місцем проживання, де було виконано УЗД органів черевної порожнини, на якому виявлено пухлинне утворення. До моменту захворювання дитина розвивалась відповідно до віку, травму батьки заперечують. Спадковий онкологічний анамнез не обтяжений, щеплення — згідно з віком.
Загальний стан хворого при госпіталізації тяжкий за рахунок основного захворювання. Свідомість збережена. Положення в ліжку активне. Шкіра та слизові оболонки блідо-рожевого кольору, чисті. Периферичні лімфатичні вузли не збільшені. ЧСС 90 за 1 хв, ЧД 19 за 1 хв. Живіт значно збільшений в об’ємі, шароподібної форми, бере участь в акті дихання, симетричний. Пальпаторно: живіт м’який, безболісний. При пальпації визначається щільно-еластичної консистенції утворення розмірами 15 х 15 см, що займає всю черевну порожнину. Пухлиноподібне утворення безболісне, має гладку, однорідну поверхню. Симптоми подразнення очеревини негативні в усіх відділах. Аускультативно: перистальтика звичайна, патологічні шуми не вислуховуються. Печінка та селезінка не пальпуються. Гази відходять. Випорожнення 1 раз на добу. Сечовиділення вільне, діурез достатній. Ректально: на висоті пальця визначається щільно-еластичне, безболісне пухлинне утворення, верхній полюс якого не досягається. На рукавичці сліди випорожнення жовто-коричневого кольору.
За тяжкістю стану дитина переведена у відділення реанімації з діагнозом «кістозне утворення черевної порожнини» для дообстеження та передопераційної підготовки. Загальний аналіз крові при госпіталізації: Hb — 124 г/л, ер. — 4,2 • 1012/л, лейк. — 5,3 • 109/л, п. — 1, с. — 69, е. — 1, м. — 3, л. — 27, ШОЕ — 5 мм/год. При УЗД органів черевної порожнини визначено кістозне об’ємне утворення розмірами 170 х 200 мм з умістом у вигляді дрібнодисперсної зависі та перегородками. Дитині проведено мультиспіральну комп’ютерну томограму органів черевної порожнини та порожнини малого таза нативно та з внутрішньовенним підсиленням ультравістом 370 22,0 мл, при якому виявлено, що ліва половина верхніх відділів черевної порожнини і вся нижня половина черевної порожнини, порожнина малого таза заповнена кістозним утворенням загальними розмірами 180 х 78 х 146 мм (краніокаудальний, поперечний, передньозадній). Капсула та перетинки утворення не сплощені, товщина їх рівномірна та не перегородки декількох міліметрів. Внутрішній уміст утворення відповідає рідині та не змінюється після контрастування. Передньолівим контуром утворення впритул прилягає до внутрішньої поверхні передньої черевної стінки, поперечної ободової кишки. Заднім контуром утворення прилягає до хвоста підшлункової залози, воріт селезінки, низхідного відділу товстої кишки, петель тонкої кишки, здавлюючи їх, судин позаочеревинного простору. Правим контуром утворення прилягає до петель тонкої кишки, у нижніх відділах — до сигмоподібної кишки. Нижнім контуром утворення прилягає до сечового міхура, здавлюючи його та ректосигмоїдний відділ. Верхній контур утворення значною мірою здавлює шлунок. Практично всі петлі тонкої кишки та брижа зміщені в праву половину черевної порожнини. У верхніх відділах кістозного утворення між камерами виявляється міхурець повітря та потовщення — імовірно, скомпресована петля порожньої кишки (рис. 1).
Після відповідної передопераційної підготовки 04.12.2013 р. проведена лівобічна поперечна лапаротомія довжиною до 6 см. На операції при розкритті черевної порожнини в рані виявлено два кістозних утворення великих розмірів. Проведена пункція кістозних утворень, при якій евакуйовано до 2,5 л серозно-геморагічної рідини з домішками замазкоподібної речовини жовтого кольору (залишки калових мас). Під час ревізії тонкої кишки на відстані 1 м від зв’язки Трейца виявлено, що кістозні утворення (дублікатури) поширюються на обидва боки брижі порожньої кишки та інтимно з нею зв’язані. Виконана резекція скомпрометованої ділянки кишки з клиноподібним висіченням зміненої ділянки її брижі та кістозними утвореннями. Накладений тонко-тонкокишковий анастомоз «кінець у кінець» дворядним швом. Виявлено спільну брижу тонкої та товстої кишки. Санація черевної порожнини. Післяопераційна рана пошарово ушита наглухо.
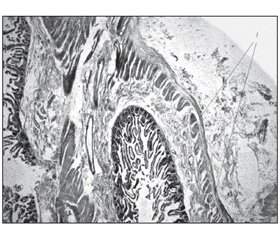
При гістологічному дослідженні видаленого макропрепарату (рис. 2) виявлено локальне потоншення м’язової оболонки порожньої кишки (рис. 3), у якій визначаються різноспрямовані дисоційовані жмутки гладеньких міозитів м’язової оболонки, нерівномірно розширені кровоносні судини та виразкування слизової оболонки (рис. 4).
06.12.2013 р. пацієнт переведений у соматичне відділення. У післяопераційному періоді, як і в доопераційному, застосовувалась методика Fast Tract Surgery. Ентеральне харчування розпочато на 12-ту годину після операції сумішшю Фрезубін ВП Енергія за алгоритмом, зазначеним вище. Післяопераційний період мав задовільний перебіг, гази в пацієнта відійшли через 36 годин після операції, ходити почав через 48 годин після операції. Післяопераційна рана зажила первинним натягом. 09.12.2013 р. дитина виписана в задовільному стані. Загальний аналіз крові при виписці: Hb — 125 г/л, ер. — 4,0 • 1012/л, лейк. — 4,4 • 109/л, ШОЕ — 7 мм/год.
Дитина оглянута через 1 місяць. Скарги відсутні, сон та апетит збережені, набирає вагу, фізіологічні випорожнення не порушені. Показники крові в межах норми.
1. Нутритивная поддержка в ранних фазах острого панкреатита: модный тренд и необходимая реальность / Е.Е. Ачкасов и др. // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. — 2013. — Т. 23, № 3. — С. 16–23.
2. Интенсивная терапия: Руководство для врачей / Под ред. В.Д. Малышева, С.В. Свиридова. — 2-е изд., перераб. и доп. — М.: Медицинское информационное агентство, 2009. — 712 с.
3. Интенсивная терапия: Национальное руководство: в 2 т. / Федерация анестезиологов и реаниматологов, Российская ассоциация специалистов по хирург. инфекциям / Под ред. Б.Р. Гельфанда, А.И. Салтанова. — М.: ГЭОТАР-Медиа, 2009. — Т. 1.
4. Анестезиология и интенсивная терапия: практическое руководство / Под ред. чл.-корр. РАМН проф. Б.Р. Гельфанда. — 2-е изд., испр. и доп. — М.: Литтерра, 2010. — 640 с.
5. Основы нутритивной поддержки в онкологической клинике / А.И. Салтанов, В.Ю. Сельчук, А.В. Снеговой. — М.: МЕДпресс-информ, 2009. — 240 с.
6. Развитие принципов доказательной медицины в области клинического питания: новые клинические рекомендации / Е.В. Полевиченко // Лечащий врач. — 2009. — № 9. — С. 63–65.
7. Луфт В.М. Клинические аспекты нутритивной поддержки больных в интенсивной медицине: идеология, возможности, стандарты / В.М. Луфт, А.В. Луфт // Российский медицинский журнал. — 2009. — № 5. — С. 8–14.
8. Принципы нутритивной поддержки // Детская онкология: Национальное руководство / А.И. Салтанов. — Москва: Издат. группа РОНЦ, 2012. — C. 312–329.
9. Дибиров М.Д. Парентеральное и энтеральное питание в послеоперационном периоде / М.Д. Дибиров // Conclusion medicum. — 2009. — Том 11, № 8. — С. 80–84.
10. Парентеральное и энтеральное питание: национальное руководство / Под ред. М.Ш. Хубутия, Т.С. Поновой, А.И. Салтанова. — М.: ГЭОТАР-Медиа, 2014. — 800 с.
11. Интенсивная терапия (национальное руководство). Краткий вариант / Б.Р. Гельфанд, А.И. Салтанов. — Москва: ГЭОТАР-Медиа, 2012. — 800 с.
12. Роль раннего энтерального питания в мультимодальной программе «fast track» хирургии у детей / Дмитриев Д.В., Катилов О.В., Калинчук О.В. // Клінічна хірургія. — 2014. — № 9.
13. Концепция ранней реабилитации («fast track») в абдоминальной хирургии / З.А. Коваленко // Вопросы курортологии, физиотерапии и лечебной физической культуры. — 2013. — № 4. — С. 53–56.
14. Хірургія: підручник / В.І. Бондарєв, Р.В. Бондарєв, О.О. Васильєв та ін.; за ред. проф. П.Г. Кондратенка. — К.: Медицина, 2009. — 968 с.
15. Профілактика кишкових ускладнень ентерального зондового харчування в ранній післяопераційний період / І.В. Колосович // Біль, знеболювання і інтенсивна терапія. — 2012. — № 1. — С. 48–52.
16. Энтеральное питание у детей в критическом состоянии: ориентация на ведущий патологический синдром определяет программу / Н.П. Шень // Российский медицинский журнал. — 2009. — № 5. — С. 14–18.
17. Энтеральное питание у детей в критическом состоянии: выделение ведущего патологического синдрома / Н.П. Шень, Ю.Х. Сайфитдинов, Д.В. Сучков // Анестезиология и реаниматология. — 2009. — № 1. — С. 63–66.
18. Опыт энтерального питания через еюнальный зонд у детей в критических состояниях / А.У. Лекманов и др. // Анестезиология и реаниматология. — 2012. — № 1. — С. 41–43.
19. Ентеральне зондове харчування в ранньому післяопераційному періоді та профілактика його кишкових ускладнень / В.М. Короткий, І.В. Колосович, П.В. Чемоданов // Клінічна хірургія. — 2012. — № 4. — С. 23.
20. Лечебное питание детей с хирургической патологией в раннем послеоперационном периоде / Ю.В. Ерпулева // Лечащий врач. — 2010. — № 6. — С. 78–79.
21. Интенсивная терапия: монография / П.М. Марино; пер. с англ. под общ. ред. А.П. Зильбера. — М.: ГЭОТАР-Медиа, 2010. — 768 с.
22. Організація ентерального харчування в дітей / О.Г. Шадрін, С.В. Дюкарева-Бєздєнєжних, А.А. Ковальчук // Дитячий лікар. — 2012. — № 6. — С. 16–18.
23. Харчування в педіатрії: монографія / Пер. з англ. З. Городенчук; ред. П.К. Самур, К. Кінг. — 4–те вид. — Львів: Медицина світу, 2012.
24. Нутритивная недостаточность и методы ее лечения у онкологических больных / А.В. Снеговой, А.И. Салтанов, Л.В. Манзюк, В.Ю. Сельчук // Практическая онкология. — 2009. — Т. 10, № 1.
25. Основы нутритивной поддержки в онкологической клинике / Под ред. чл.-корр. РАМН А.И. Салтанова. — Москва, 2009. — 239 с.
26. Дослідження всмоктувальної здатності початкового відділу тонкого кишечнику як критерію для визначення строків для проведення ентерального харчування в ранньому післяопераційному періоді / Короткий В.М., Сидоренко Р.А., Солярик С.А.// Біль, знеболювання і інтенсивна терапія. — 2009. — № 4. — С. 45–47.
27. Раннє ентеральне зондове харчування та внутрішньочеревна гіпертензія / В.Н. Короткий, Р.А. Сидоренко // Клінічна хірургія. — 2009. — № 7/8. — С. 77–79.
28. Рекомендации по нутритивной поддержке при химиотерапии и/или лучевой терапии / Совет экспертов онкологов-химиотерапевтов (RUSSCO) / А.И. Салтанов, С.А. Тюляндин. — Москва, 2012. — 18 c.
29. Основные принципы и технологии клинического питания в онкологии: Руководство для врачей / А.И. Салтанов, А.В. Снеговой, В.Ю. Сельчук. — М., 2009. — 48 c.
30. Искусственное питание в поддерживающей терапии онкологических больных / А.И. Салтанов, И.Н. Лейдерман, А.В. Снеговой. — М.: Медицинское информационное агентство, 2012. — 408 c.
31. Современная диетология: организационно-правовые основы: учебно-методическое пособие / А.Ю. Барановский, Н.В. Семенов. — 2-е изд., испр. и доп. — СПб.: Издательский дом СПбМАПО, 2010. — 380 с.
32. Энтеральное искусственное питание в клинической медицине. — Петрозаводск: Интел Тек, 2001. — 208 с.
33. Раннее энтеральное питание при критических состояниях / А.У. Лекманов, Ю.В. Ерпулева // Вестник интенсивной терапии. — 2012. — № 1. — С. 65–67.
34. Раннее энтеральное питание: эффективность и безопасность применения у хирургических больных / Д.С. Цветков // Хирургия. Журн. им. Н.И. Пирогова. — 2011. — № 11. — С. 74–81.
35. Методы коррекции трофологического статуса у больных раком желудка в послеоперационном периоде / Т.К. Макеева, А.А. Галкин // Вестник Санкт-Петербургского университета. — 2009. — Сер. 11, вып. 2.
36. Раннее энтеральное питание детей с хирургической патологией / Ю.В. Ерпулева // Русский медицинский журнал. — 2009. — Т. 17, № 25. — С. 1636–1638.
37. Беляев А.М. Ранняя энтеральная терапия и нутриционная поддержка больных с колоректальным раком, осложненным острой кишечной непроходимостью // Вестник хирургии им. И.И. Грекова. — 2010. — Том 169, № 6. — С. 36–39.
38. Бондарев В.І., Бондарев Р.В., Орєхов О.А. Досвід використання раннього ентерального харчування у комплексному лікуванні гострого панкреатиту // Шпитальна хірургія. — 2009. — № 1. — С. 55–57.
39. Интенсивная терапия в ранний послеоперационный период // Детская онкология (национальное руководство) / А.И. Салтанов, Н.В. Матинян, З.С. Ордуханян, А.В. Сотников. — Москва: Издат. группа РОНЦ, 2012.

/46/46.jpg)
/48/48.jpg)
/50/50.jpg)