Журнал «Здоровье ребенка» 8 (59) 2014
Вернуться к номеру
Эндогенные оксиданты и антиоксидантная система человеческого организма
Авторы: Абатуров А.Е. — ГУ «Днепропетровская медицинская академия Министерства здравоохранения Украины»; Волосовец А.П. — Национальный медицинский университет им. А.А. Богомольца, г. Киев; Юлиш Е.И. — Донецкий национальный медицинский университет им. М. Горького
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
В обзоре даны общие современные представления об эндогенных оксидантах и антиоксидантной системе человеческого организма, показано их участие в неспецифической защите организма от инфекционных агентов.
В огляді дані загальні сучасні уявлення про ендогенні оксиданти та антиоксидантну систему людського організму, показано їх участь у неспецифічному захисті організму від інфекційних агентів.
The review presents general modern conception of endogenous oxidants and antioxidant system in human body, shows their participation in non-specific protection of the body against infectious agents.
оксиданты, антиоксидантная система.
оксиданти, антиоксидантна система.
oxidants, antioxidant system.
Статья опубликована на с. 88-93
Введение
Основным источником энергии в клетках является процесс окисления определенных субстратов. Этот процесс может быть осуществлен тремя основными путями: присоединением кислорода к атому углерода, отщеплением водорода или потерей электрона. В клетках животных и человека окисление протекает в форме последовательного переноса водорода и электронов от субстрата к конечному акцептору электронов — молекулярному кислороду. Этот вид окисления называют аэробным окислением. Кислород играет в этом случае роль окислителя, т.е. восстанавливающегося соединения. Окислительно-восстановительные реакции играют исключительную роль в обмене веществ и энергии живых организмов. Первые представления о сущности окислительно-восстановительных реакций были введены в 1914 году выдающимся русским ученым Львом Владимировичем Писаржевским. Окислительно-восстановительными реакциями называются такие химические реакции, в результате которых изменяется степень окисления элементов за счет переноса электронов от атомов одного элемента к атомам другого элемента. Атомы или ионы, отдающие электроны в ходе окислительно-восстановительного процесса, называются восстановителями; атомы или ионы, присоединяющие к себе электроны, называются окислителями. Окислительно-восстановительные реакции с участием кислорода составляют электрон-транспортную цепь [7, 8]. Молекула кислорода O2 в основном состоянии находится в форме триплетного кислорода. Триплетная форма кислорода, для которой характерно наличие на p*-разрыхляющей молекулярной орбитали двух неспаренных электронов с параллельными спинами, практически инертна по отношению к органическим молекулам. В отличие от молекулы кислорода для большинства органических молекул в основном состоянии характерна синглетная электронная конфигурация (нулевой суммарный спин), при которой спины парных электронов на внешней орбитали ориентированы антипараллельно [6].
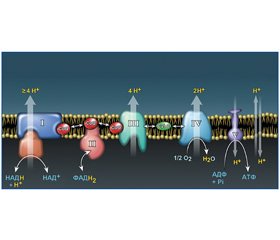
Последовательный перенос четырех электронов на молекулу кислорода приводит к высвобождению энергии и образованию воды. В результате реакций образуется энергия, аккумулируемая в макроэргических фосфатных связях аденозинтрифосфата (АТФ). Использование молекулярного кислорода при окислительном фосфорилировании глюкозы позволяет получить 38 молекул АТФ, а при анаэробном метаболизме — всего лишь 2 молекулы АТФ. Перенос электронов на молекулу кислорода осуществляется электрон-транспортной цепью (дыхательной цепью) митохондрии клетки. Электрон-транспортная цепь состоит из четырех трансмембранных белковых мультиферментных комплексов (I–IV), двух переносчиков электронов между комплексами (коэнзима Q/убихинона и цитохрома C) и АТФ-синтазы (комплекс V) (рис. 1). Комплекс I и II катализируют окисление НАДH и ФАДH2, соответственно, коэнзимом Q (CoQ). В последующем комплекс III принимает электроны от CoQ и передает их на цитохром С (CytC), который переносит электроны на комплекс IV (цитохром-оксидазный комплекс). Комплекс IV использует электроны для редукции кислорода. Перенос четырех электронов на молекулярный кислород обусловливает образование воды. Комплексы I, III, IV электрон-транспортной цепи выкачивают протоны из матрикса митохондрий в межмембранное пространство, что создает разность электрохимических потенциалов ионов водорода (μH+) на сопрягающей мембране митохондрий. Энергия электрохимического потенциала используется АТФ-синтазами (комплексом V) для образования АТФ [25, 28].
В случаях одно-, двух- и трехэлектронного переноса функционирование электрон-транспортной цепи сопровождается образованием целого ряда промежуточных и побочных продуктов, большинство из которых являются радикалами, содержащими на внешней орбите непарный электрон [18, 29]. Биорадикалы при химическом взаимодействии с другими молекулами или атомами стремятся к переносу электрона, в связи с чем для них характерна высокая химическая активность. Они способны инициировать быстрые, цепные реакции окисления различных биосубстратов, обусловливая модификацию органических молекул и деградацию надмолекулярных клеточных структур. Свободнорадикальное окисление — наиболее известный, но не единственный процесс, протекающий с участием биорадикалов [6].
Оксиданты
Впервые предположение о существовании свободных радикалов было высказано Моисеем Гомбергом в середине XIX века, когда он исследовал возможность образования гексафенилэтана из трифенилметил-хлорида. В результате исследования Моисей Гомберг получил желтый компаунд, реактивность которого значительно превышала гексафенилэтан, что позволило ему предложить наличие радикалов трифенилметила как промежуточных продуктов реакции. Биологические свободные радикалы впервые были определены в 1968 году профессором биомедицинского центра университета штата Колорадо Джо Мак-Кордом и профессором Ирвином Фридовичем [27].
Barry Halliwell [17] в зависимости от генеза предлагает различать три основные группы оксидантов: активированные кислородсодержащие (АКМ), азотсодержащие (ААМ) и хлорсодержащие (АХМ) метаболиты. В настоящее время среди АКМ, ААМ, АХМ различают: 1) свободные радикалы (одноэлектронные оксиданты): супероксид-анион-радикал, гидроксильный радикал, гидропероксидный радикал, нитроксид, CCl3•; 2) нерадикальные оксиданты: перекись водорода, озон, синглетный кислород, перекиси липидов, альдегиды, семихиноны, пероксинитрит, гипохлорная (хлорноватистая) кислота, дисульфиды. Особое место занимают и нерадикальные тиол-активные формы: 4-гидроксиноненал (4-HNE), малоновый диальдегид, эпоксиды, конъюгированные альдегидные группы, Zn2+, Hg2+ и ионы других металлов [12, 19, 20].
Согласно предложенной Ю.А. Владимировым классификации [1], большинство кислород- и азотсодержащих метаболитов, которые образуются в организме человека, условно можно разделить на природные: первичные, то есть генерируемые ферментными системами (супероксид-анион-радикал, нитроксид); вторичные, образуемые в результате действия первичных активных метаболитов (гидроксильный, гидропероксидный, липидные радикалы) и третичные (радикалы биоантиоксидантов) и чужеродные оксиданты, образование которых связано с действием факторов внешней среды, в частности радиации.
Образование первичных радикалов осуществляется при участии определенных ферментных систем. Эти радикалы участвуют во множестве различных физиологических реакций организма (табл. 1).
Образование радикалов обусловлено недостаточным переносом электронов для полного восстановления акцептора. Так, в тех случаях, когда молекула кислорода принимает один электрон, образуется супероксид-анион-радикал. Он может функционировать в качестве восстановителя и окислителя. Его реакционная способность относительно низкая, но он может принимать протон водорода и образовывать гидропероксидный радикал, который является более сильным окислителем, супероксид-анион-радикал. Перекись водорода образуется в результате реакции двух супероксид-анион-радикалов, данная реакция может происходить спонтанно и под влиянием супероксиддисмутазы. Взаимодействие супероксид-анион-радикала с перекисью водорода в присутствии ионов железа сопровождается образованием очень реактивного гидроксильного радикала. В результате реакции Габер — Вейса образуется высокореактивная синглетная форма молекулярного кислорода. В результате взаимодействия супероксид-анион-радикала с монооксидом азота образуется сильный окислитель пероксинитрит. Взаимодействие перекиси водорода с ионами хлора, катализируемое миелопероксидазой, образует исключительно высокоактивный окислитель — гипохлорную кислоту [21].
Первичный радикал — супероксидный анион-радикал (O2–•) — принимает участие в генерации весьма активных молекулярных соединений: перекиси водорода, гипохлорита и гидроперекисей липидов. Под действием ионов металлов переменной валентности, в первую очередь ионов Fe2+, из этих веществ образуются вторичные свободные радикалы, такие как радикал гидроксила и радикалы липидов, которые оказывают разрушительное действие на клеточные структуры [1, 2, 11].
Эпителий респираторного тракта постоянно подвергается воздействию высокими уровнями концентрации кислорода, и в то же время сами эпителиальные клетки содержат механизмы для генерации АКМ. В течение долгого времени считали, что только электрон-транспортная цепь митохондрий является генератором АКМ. После идентификации НАДФН оксидазы и других представителей семейства NOX, которые генерируют во внеклеточное пространство супероксид-анион-радикал, появилось представление о рецептор-зависимой генерации АКМ, которую выполняют не только фагоцитирующие клетки, но и непосредственно эпителиоциты слизистой оболочки респираторного тракта [15, 23].
Эпителий респираторного тракта является сложным функциональным физическим барьером, который защищает органы дыхания от воздействия потенциально вредных веществ и патогенных микроорганизмов, находящихся во вдыхаемом воздухе. Эпителиальные клетки, покрывающие всю поверхность слизистой оболочки, являются центральным компонентом физического барьера, состояние межклеточных контактов, особенно тесных контактов, определяет вероятность проникновения инфекционных агентов во внутренний континуум организма [10]. Эпителиоциты слизистой оболочки респираторного тракта играют ключевую роль в индукции механизмов неспецифической защиты. Эпителиоциты слизистой оболочки респираторного тракта экспрессируют образ-распознающие рецепторы (PRR) – TLR (Toll-like receptors), NLR (NOD (nucleotide binding and oligomerization domain)-like receptors), RLR (RIG I (retinoic acid-inducible gene I)-like receptors), CLR (C-type lectin receptors), ДНК-сенсоры, которые распознают некоторые структурные элементы микроорганизмов — патоген-ассоциированные молекулярные структуры (pathogen-associated molecular patterns — РАМР), протеаз-активированные рецепторы (protease-activated receptor — PAR), взаимодействующие с определенными компонентами аллергенов. PRR-ассоциированное возбуждение обусловливает активацию механизмов неспецифической защиты и адаптивного иммунитета, индуцируя дендритные клетки и антигенспецифические Т-лимфоциты. Эпителиальные клетки также реагируют на такие ирританты и поллютанты, как компоненты выхлопных газов дизельных двигателей, твердые частицы, сигаретный дым и др. Активация эпителиоцитов первично индуцирует развитие ранних процессов неспецифической защиты, обусловливая генерацию АКМ, ААМ (рис. 2), а также продукцию противовирусных, противогрибковых и антимикробных пептидов, провоспалительных цитокинов, и возбуждает системные механизмы иммунной системы [16, 17, 22, 26, 30, 33, 35, 36].
/91/91.jpg)
Активированные кислород- и азотсодержащие метаболиты являются важнейшими компонентами защиты респираторного тракта от патогенных инфекционных агентов и участвуют во многих пато- и физиологических процессах. Они играют ключевую роль в регуляции жизнедеятельности клетки. Физиологические уровни содержания АКМ и ААМ функционируют в качестве сигнальных агентов, индуцирующих пролиферацию и процессы выживания клеток, в то время как очень быстрое и/или пролонгированное повышение уровня их содержания приводят к проявлению их цитотоксического эффекта, способствуя развитию патологического процесса. АКМ и ААМ при физиологических уровнях концентрации принимают участие в ремоделировании экстрацеллюлярного матрикса, стимулируют секрецию слизи, репаративные процессы, модулируют иммунный ответ в легочной ткани. Они участвуют в регуляции различных клеточных процессов, в частности пролиферации, дифференцировке, апоптозе клеток, влияя на активность апоптотической сигнал-регулируемой киназы 1 (ASK-1), PI3-киназы (PI3K), тирозиновой протеинфосфатазы (PTP). АКМ и ААМ активируют транскрипционные факторы, в частности NF-B и AP-1, что приводит к усилению экспрессии генов провоспалительных медиаторов (рис. 3) [3, 17, 32, 34].
Антиоксидантная система
В физиологических условиях низкий уровень внутриклеточного содержания первичных радикалов кислорода и продуктов свободнорадикального окисления обеспечивается функционированием антиоксидантной системы организма. Различают несколько физиологических механизмов инактивирующих АКМ и ААМ. Первый барьер антиоксидантной защиты респираторного тракта представляет собой трахеобронхиальную жидкость, которая содержит гликопротеины, сахара, биоантиоксиданты неферментативного действия (биофлавоноиды, витамины, ионы металлов, аминокислоты, глутатион, церулоплазмин, трансферрин и другие вещества), способные инактивировать перекись водорода и гидроксильный радикал. Вторым барьером являются экстрацеллюлярные ферменты, обладающие антиоксидантным действием, и третьим — внутриклеточные антиоксидантные системы [4, 5, 13, 16, 31].
Оксидантный стресс
Избыточная продукция активированных кислород- и азотсодержащих метаболитов или дефицит функционирования антиоксидантной системы приводят к развитию оксидантного стресса, следствием которого может стать гибель клеток тканей органов дыхания [20, 24]. Термин «оксидантный стресс» был введен Хельмутом Зисом в 1991 г. и официально вошел в словарь Mesh Pubmed в 1995 г. Неопределенность термина «оксидантный стресс» связана как с тем, что оба понятия — «прооксиданты» и «антиоксиданты» — весьма расплывчаты, так и с тем, что неясно, где кончается баланс и начинается дисбаланс [2].
Заключение
В последнее время показано, что АКМ и ААК не только обладают бактерицидной, противовирусной, антифунгальной активностью, но и являются мощными модуляторами воспалительного и иммунного ответа организма. Компоненты антиоксидантной системы инактивируют активные радикалы и модулируют активность воспалительной реакции: АКМ индуцируют продукцию провоспалительных цитокинов, хемокинов, инактивируют нейротрансмиттеры и гормоны; ААМ инактивируют рецепторы стероидных гормонов, энзимов; АКМ и ААМ обладают цитотоксическим действием [13, 14, 37]. В связи с этим медикаментозные возможности управления окислительно-восстановительным балансом организма открывают новые направления в терапии инфекционных и соматических заболеваний.
1. Владимиров Ю.А. Свободные радикалы в биологических системах // Соросовский образовательный журнал. — 2000. — Т. 6, № 12. — С. 13-19.
2. Владимиров Ю.А. Свободные радикалы и клеточная хемилюминесценция / Ю.А. Владимиров, Е.В. Проскурнина // Успехи биологической химии. — 2009. — Т. 49. — С. 341-388.
3. Власов Б.Я. Сигнальная роль активных форм кислорода в клетках животных (мини-обзор) / Б.Я. Власов, А.Г. Булавинцев, А.К. Подшивалова // Вестник Иркутской государственной сельскохозяйственной академии. — 2009. — № 35. — С. 24-29.
4. Габитова Д.М. Антиоксидантная защитная система организма / Д.М. Габитова, В.О. Рыжикова, М.А. Рыжикова // Башкирский химический журнал. — 2006. — Т. 13, № 2. — С. 94-96.
5. Габитова Д.М. Антиоксидантная защитная система органов дыхания / Д.М. Габитова, В.О. Рыжикова, М.А. Рыжикова // Башкирский химический журнал. — 2006. — Т. 13, № 4. — С. 118-119.
6. Костюк В.А., Потапович А.И. Биорадикалы и биоантиоксиданты. — Минск: БГУ, 2004. — 174 с.
7. Меньщикова Е.Б., Зенков Н.К., Ланкин В.З. Окислительный стресс. Патологические состояния и заболевания. — Новосибирск: АРТА, 2008. — 284 c.
8. Хисматуллина З.Н. Сущность, направление и роль окислительно-восстановительных реакций в биологии и медицине // Вестник Казанского технологического университета. — 2011. — № 19. — С. 35-41.
9. Bartz R.R. Clinical review: oxygen as a signaling molecule / R.R. Bartz, C.A. Piantadosi // Crit. Care. — 2010. — Vol. 14, № 5. — P. 234. — doi: 10.1186/cc9185.
10. Bergelson J.M. Intercellular junctional proteins as receptors and barriers to virus infection and spread // Cell. Host Microbe. — 2009. — Vol. 5, № 6. — P. 517-521. — doi: 10.1016/j.chom.2009.05.009.
11. Cadet J. Biologically relevant oxidants and terminology, classification and nomenclature of oxidatively generated damage to nucleobases and 2-deoxyribose in nucleic acids / J. Cadet, S. Loft, R. Olinski, M.D. Evans, K. Bialkowski, J. Richard Wagner, P.C. Dedon, P. Müller, M.M. Greenberg, M.S. Cooke / Free Radic. Res. — 2012. — Vol. 46, № 4. — P. 367-381. — doi: 10.3109/10715762.2012.659248.
12. Cadet J. Measurement of oxidatively generated base damage in cellular DNA / J. Cadet, T. Douki // Ravanat Mutat. Res. — 2011. — Vol. 711, № 1–2. — P. 3-12. — doi: 10.1016/j.mrfmmm.2011.02.004.
13. Droge W. Free radicals in the physiological control of cell function // Physiol. Rev. — 2002. — Vol. 82. — P. 47-95. — doi: 10.1152/physrev.00018.2001.
14. Ferrari C.K. Oxidative and nitrosative stress on phagocytes’ function: from effective defense to immunity evasion mechanisms / C.K. Ferrari, P.C. Souto, E.L. Franςa, A.C. Honorio-Franςa // Arch. Immunol. Ther. Exp. (Warsz). — 2011. — Vol. 59, № 6. — P. 441-448. — doi: 10.1007/s00005-011-0144-z.
15. Fischer H. Developmental regulation of DUOX1 expression and function in human fetal lung epithelial cells / H. Fischer, L.K. Gonzales, V. Kolla, C. Schwarzer, F. Miot, B. Illek, P.L. Ballard // Am. J. Physiol. Lung Cell. Mol. Physiol. — 2007. — Vol. 292, № 6. — P. L1506-L1514. — doi: 10.1152/ajplung.00029.2007.
16. Halliwell B. Free radicals and antioxidants: updating a personal view // Nutr. Rev. — 2012. — Vol. 70, № 5. — P. 257-265. — doi: 10.1111/j.1753-4887.2012.00476.x.
17. Halliwell B. Free radicals in biology and medicine / Halliwell B., Gutteridge J.M.C. — 4th ed. — Oxford: Oxford University Press, 2007. — 851 p.
18. Jastroch M. Mitochondrial proton and electron leaks / M. Jastroch, A.S. Divakaruni, S. Mookerjee, J.R. Treberg, M.D. Brand // Essays Biochem. — 2010. — Vol. 47. — P. 53-67. — doi: 10.1042/bse0470053.
19. Jones D.P. Mapping the cysteine proteome: analysis of redox-sensing thiols / D.P. Jones, Y.M. Go // Curr. Opin. Chem. Biol. — 2011. — Vol. 15, № 1. — P. 103-112. — doi: 10.1016/j.cbpa.2010.12.014.
20. Jones D.P. Radical-free biology of oxidative stress // Am. J. Physiol. Cell. Physiol. — 2008. — Vol. 295, № 4. — P. C849-C868. — doi: 10.1152/ajpcell.00283.2008.
21. Kanta J. The role of hydrogen peroxide and other reactive oxygen species in wound healing // Acta Medica (Hradec Kralove). — 2011. — Vol. 54, № 3. — P. 97-101. — PMID: 22250477.
22. Kato A. Beyond inflammation: airway epithelial cells are at the interface of innate and adaptive immunity / A. Kato, R.P. Schleimer // Curr. Opin. Immunol. — 2007. — Vol. 19, № 6. — P. 711-720. — doi: 10.1016/j.coi.2007.08.004.
23. Katsuyama M. Physiological roles of NOX/NADPH oxidase, the superoxide-generating enzyme / M. Katsuyama, K. Matsuno, C. Yabe-Nishimura // J. Clin. Biochem. Nutr. — 2012. — Vol. 50, № 1. — P. 9-22. — doi: 10.3164/jcbn.11-06SR.
24. Kinnula V.L. Superoxide dismutases in the lung and human lung diseases/ V.L. Kinnula, J.D. Crapo // Am. J. Respir. Crit. Care Med. — 2003. — Vol. 167, № 12. — P. 1600-1619. — doi: 10.1164/rccm.200212-1479SO.
25. Liu Y. The specificity of neuroprotection by antioxidants / Y. Liu, D.R. Schubert // J. Biomed. Sci. — 2009. — Vol. 16. — P. 98. — doi: 10.1186/1423-0127-16-98.
26. Mayer A.K. Regulation of local immunity by airway epithelial cells / A.K. Mayer, A.H. Dalpke // Arch. Immunol. Ther. Exp. (Warsz). — 2007. — Vol. 55, № 6. — P. 353-362. — doi: 10.1007/s00005-007-0041-7.
27. McCord J.M. The reduction of cytochrome c by milk xanthine oxidase / J.M. McCord, I. Fridovich // J. Biol. Chem. — 1968. — Vol. 243, № 21. — P. 5753-5760. — PMID: 4972775.
28. Murphy M.P. How mitochondria produce reactive oxygen species // Biochem. J. — 2009. — Vol. 417, № 1. — P. 1-13. — doi: 10.1042/BJ20081386.
29. Nathan A.T. The oxygen trail: tissue oxygenation / A.T. Nathan, M. Singer // Br. Med. Bull. — 1999. — Vol. 55, № 1. — P. 96-108. — PMID: 10695081.
30. Parker D. Innate immunity in the respiratory epithelium / D. Parker, A. Prince // Am. J. Respir. Cell. Mol. Biol. — 2011. — Vol. 45, № 2. — P. 189-201. — doi: 10.1165/rcmb.2011-0011RT.
31. Robinson M.A. Oxygen-dependent regulation of nitric oxide production by inducible nitric oxide synthase / M.A. Robinson, J.E. Baumgardner, C.M. Otto // Free Radic. Biol. Med. — 2011. — Vol. 51, № 11. — P. 1952-1965. — doi: 10.1016/j.freeradbiomed.2011.08.034.
32. Rutkowski R. Reaktywnych form tlenu i związków azotu w procesie zapalnym / R. Rutkowski, S.A. Pancewicz, K. Rutkowski, J. Rutkowska // Pol. Merkur. Lekarski. — 2007. — Vol. 23, № 134. — P. 131-136.
33. Ryu J.H., Kim C.H., Yoon J.H. Innate immune responses of the airway epithelium // Mol. Cells. — 2010. — Vol. 30, № 3. — P. 173-183.
34. Trachootham D. Redox regulation of cell survival/ D. Trachootham, W. Lu, M.A. Ogasawara, R.D. Nilsa, P. Huang // Antioxid. Redox Signal. — 2008. — Vol. 10, № 8. — P. 1343-1374. — doi: 10.1089/ars.2007.1957.
35. Van Tongeren J. Interactions between epithelial cells and dendritic cells in airway immune responses: lessons from allergic airway disease / J. van Tongeren, S.M. Reinartz, W.J. Fokkens, E.C. de Jong, C.M. van Drunen // Allergy. — 2008. — Vol. 63, № 9. — P. 1124-1135. — doi: 10.1111/j.1398-9995.2008.01791.x.
36. Vareille M. The airway epithelium: soldier in the fight against respiratory viruses / M. Vareille, E. Kieninger, M.R. Edwards, N. Regamey // Clin. Microbiol. Rev. — 2011. — Vol. 24, № 1. — P. 210-229. — doi: 10.1128/CMR.00014-10.
37. Willcox J.K. Antioxidants and prevention of chronic disease / J.K. Willcox, S.L. Ash, G.L. Catignani // Crit. Rev. Food Sci. Nutr. — 2004. — Vol. 44, № 4. — P. 275-295. — doi: 10.1080/10408690490468489.

/89/89.jpg)
/90/90.jpg)
/91/91_2.jpg)