Журнал «Медицина неотложных состояний» 3 (66) 2015
Вернуться к номеру
Вплив високої грудної епідуральної блокади на гемодинаміку при операціях аортокоронарного шунтування зі штучним кровообігом
Авторы: Собокарь В.О., Гриценко С.М. - ДЗ «Запорізька медична академія післядипломної освіти МОЗ України», кафедра анестезіології і інтенсивної терапії
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Актуальність. Використання високої грудної епідуральної блокади (ВГЕБ) при кардіохірургічних операціях може стримуватись побоюванням її негативних гемодинамічних ефектів. Мета: оцінити вплив ВГЕБ на гемодинаміку при операціях аортокоронарного шунтування (АКШ) зі штучним кровообігом (ШК). Методи. У 85 пацієнтів під час АКШ зі ШК визначали серцевий індекс (СІ), ударний індекс, фракцію викиду (ФВ) і індекс загального периферичного судинного опору (ІЗПСО). Результати. Після індукції встановлювався гіподинамічний тип кровообігу: СІ — 2,27 ± 0,69 л•хв–1•м–2, ІЗПСО — 2618 (2064; 3032) дін•с•см–5•м–2, при цьому систолічна функція покращувалась, про що свідчило зростання ФВ. Після ШК встановився гіпердинамічний тип кровообігу: СІ зростав до 3,72 ± 0,96 л•хв–1•м–2 за рахунок частоти серцевих скорочень і систолічної функції серця, а ІЗПСО знижувався. Висновки. При проведенні ВГЕБ під час операцій аортокоронарного шунтування зі ШК більшість гемодинамічних параметрів зберігалась у межах референтних значень, а після індукції показники глобальної систолічної функції міокарда зростали, що свідчило про покращення умов роботи серця.
Актуальность. Использование высокой грудной эпидуральной блокады (ВГЭБ) при кардиохирургических операциях может сдерживаться опасением ее негативных гемодинамических эффектов. Цель: оценить влияние ВГЭБ на гемодинамику при операциях аортокоронарного шунтирования (АКШ) с искусственным кровообращением (ИК). Методы. У 85 пациентов во время АКШ с ИК определяли параметры гемодинамики, включая сердечный индекс (СИ), ударный индекс, фракцию выброса (ФВ) и индекс общего периферического сосудистого сопротивления (ИОПСС). Результаты. После индукции устанавливался гиподинамический тип кровообращения: СИ — 2,27 ± 0,69 л•мин–1•м–2, ИОПСС — 2618 (2064; 3032) дин•с•см–5•м–2, при этом систолическая функция улучшалась, о чем свидетельствовало повышение ФВ. После ИК установился гипердинамический тип кровообращения: СИ повышался до 3,72 ± 0,96 л•мин–1•м–2 за счет частоты сердечных сокращений и систолической функции сердца, а ИОПСС снижался. Выводы. При проведении ВГЭБ во время операций аортокоронарного шунтирования с ИК большинство гемодинамических параметров сохранялось в пределах референтных значений, а после индукции показатели глобальной систолической функции миокарда повышались, что свидетельствовало об улучшении условий работы сердца.
Background. The use of high thoracic epidural anesthesia (HTEA) in cardiac surgeries may be deterred by fear of its adverse hemodynamic effects. Objective: to evaluate the impact of HTEA on hemodynamics during coronary artery bypass grafting (CABG). Methods. In 85 patients during CABG we have evaluated cardiac index (CI), stroke volume index, ejection fraction (EF) and total peripheral vascular resistance index (TPVRI). Results. After induction, there was a hypodynamic type of circulation: CI — 2.27 ± 0.69 L•min–1•m–2, TPVRI — 2,618 (2,064; 3,032) din•s•cm–5•m–2, with improved systolic function, as evidenced by increased EF. After bypass, there was а hyperdynamic type of circulation: CI increased up to 3.72 ± 0.96 L•min–1•m–2, due to heart rate and systolic function of the heart, and TPVRI reduced. Conclusions. When carrying out HTEA during coronary artery bypass grafting, the majority of hemodynamic parameters were within reference values, and after induction the parameters of the global systolic myocardial function increased indicating an improvement of cardiac performance.
висока грудна епідуральна блокада, гемодинаміка, аортокоронарне шунтування, штучний кровообіг.
высокая грудная эпидуральная блокада, гемодинамика, аортокоронарное шунтирование, искусственное кровообращение.
high thoracic epidural anesthesia, hemodynamics, coronary artery bypass grafting, bypass.
Статья опубликована на с. 168-172
Актуальність
Анестезіологічне забезпечення є важливою складовою хірургічного втручання, особливо при операціях зі штучним кровообігом (ШК), що відрізняються найбільш об’ємним втручанням майже в усі системи життєдіяльності організму. У 90-х роках ХХ ст. загальновизнаним методом вибору в кардіохірургії була анестезія на основі високої дози опіатів. Але під впливом економічних чинників почався інтенсивний пошук нових методів, націлених на скорочення термінів перебування хворих на койках інтенсивної терапії і зниження вартості лікування. Такі методи поєднують загальним терміном fast-track anesthesia [1, 2], і одним із них є анестезія на основі високої грудної епідуральної блокади (ВГЕБ). Її перевагами вважають найкращій захист від операційного стресу і можливість надійного післяопераційного знеболювання [3, 4]. Тим не менше використання ВГЕБ як компонента анестезіологічного забезпечення кардіохірургічних втручань на цей час не набуло поширення в Україні. Не виключено, що стримуючим фактором є побоювання негативних гемодинамічних ефектів епідуральної блокади у пацієнтів із захворюваннями серця.
Мета роботи: оцінити перебіг комбінованої анестезії на основі ВГЕБ з точки зору її впливу на гемодинаміку хворих при операціях аортокоронарного шунтування (АКШ) зі ШК.
Матеріал і методи
У роботі проведено аналіз перебігу анестезії у 85 хворих на ішемічну хворобу серця, яким на базі Запорізького кардіохірургічного центру виконали операції АКШ в умовах ШК і які дали згоду на участь в дослідженні згідно з формою, затвердженою етичним комітетом. Серед оперованих 73 чоловіки (86 %) і 12 жінок (14 %) віком за медіаною 59 (52; 63) років, із них 25 (29 %) — з діагнозом стенокардії напруження III функціонального класу (ФК), 20 — IV ФК (24 %), 39 — з нестабільною стенокардією (46 %), один хворий (1 %) прооперований з приводу гострого інфаркту міокарда (ІМ); 36 пацієнтів основної групи мали в анамнезі ІМ (42 %), із них 11 (13 %) — протягом менше ніж 3 місяців напередодні операції. У 7 хворих (8 %) перенесений ІМ привів до формування хронічної аневризми лівого шлуночка. Середня фракція викиду (ФВ) перед операцією становила 53,9 ± 8,8 %. При проведенні АКШ в середньому виконано 2,6 ± 0,9 шунта в умовах ШК протягом 110 ± 36 хв і тривалістю перетиску аорти 73 ± 31 хв.
Усім хворим призначали глибоку премедикацію. Напередодні операції пацієнти отримували внутрішньом’язово 1 мл 1% розчину морфіну і 2 мл 0,5% розчину сибазону. За 30 хвилин до надходження в операційну внутрішньом’язово вводили морфін 1% — 2 мл, сибазон 0,5% — 4 мл, димедрол 1% — 2 мл і атропін 0,1% — 1 мл.
Епідуральний простір пунктирували на рівні Т5–Т6 голкою Туохі 18-го чи 16-го розміру за стандартною методикою втрати опору, катетер повільно проводили на 5 см у краніальному напрямі, щоб розташувати його кінчик на рівні Т2–Т4. Вводили тест-дозу 2 мл 2% розчину лідокаїну і фіксували катетер. Аналгезію починали болюсним введенням 5–6 мл 0,5% розчину бупівакаїну і переходили на безперервне введення 0,25% бупівакаїну зі швидкістю до 6–8 мл на годину. Ознаками вдалої блокади були стійка тенденція до брадикардії (60 хв–1), помірна артеріальна гіпотензія (систолічний артеріальний тиск (АТ) 90–110 мм рт.ст. у нормотоників), відсутність реакції частоти серцевих скорочень (ЧСС) на зміни положення тіла, а в подальшому — відсутність реакції гемодинаміки на хірургічну стимуляцію.
Свідомість виключали за допомогою тіопенталу натрію, діазепаму, оксибутирату натрію, орієнтуючись на показник BIS-монітора (BIS-індекс 40–60). Перед інтубацією трахеї вводили 0,5 мг фентанілу, стільки ж додавали перед розрізом. В подальшому при вдало виконаній ВГЕБ потреби в додатковому введенні фентанілу не виникало.
Після індукції робили забір крові хворого в кількості 1000–1500 мл для подальшої автогемотрансфузії після ШК. Одночасно проводили випере–джаючу інфузію кристалоїдами і колоїдами в темпі, необхідному для підтримання позитивного балансу 0,5–1 л.
Критеріями артеріальної гіпотензії вважали зниження систолічного АТ менше ніж 90 мм рт.ст. у пацієнтів, які мали нормотензію перед операцією (у тому числі медикаментозно керовану), або більше ніж на 30 % від передопераційного рівня у пацієнтів з підвищеним АТ. Артеріальну гіпотензію коригували пришвидшенням інфузії кристалоїдних і колоїдних розчинів. При недостатньому темпі відновлення рівня АТ вводили фенілефрин болюсом в 50 мкг і з подальшим збільшенням дози залежно від гемодинамічної відповіді. Якщо реакція на введення фенілефрину була швидкоплинною і його доводилося використовувати багаторазово (більше ніж 5 болюсів), переходили до безперервної інфузії нор–епінефрину в концентрації 400 мкг/мл з початковою швидкістю 0,02 мкг•кг–1•хв–1.
ШК проводили за допомогою апарата Jostra (Німеччина) і фіброволоконного оксигенатора Hillite 7000 фірми Medtronic (США) в умовах нормоперфузії (перфузійній індекс 2,4 л/м2•хв), помірної гіпотермії (центральна температура 32–34 °С) і гемодилюції (Нt 20–25 %). Гепарин перед ШК вводили з розрахунку 300 Од/кг. Проміжок часу між катетеризацією епідурального простору і введенням гепарину був більше 1 години. Кардіоплегічний розчин сustadiol (Німеччина) вводили в корінь аорти одноразово об’ємом 25–30 мл/кг після її перетиску.
Вихідні параметри гемодинаміки отримували з передопераційного електрокардіографічного і ехокардіографічного дослідження. Гемодинамічне спостереження під час операції здійснювали хірургічним монітором ЮТАС ЮМ-200 (Україна). ЧСС, середній АТ (САТ) і центральний венозний тиск (ЦВТ) фіксували після надходження в операційну, індукції, стернотомії, ШК та при закінченні операції. Ці дані доповнювали інтраопераційним ультра–звуковим обстеженням серця за допомогою трансстравохідного датчика з частотою 2,5; 3,5 і 5 МГц на апараті Sonoscape (Китай). Внутрішньосерцеві структури локалізували зі стандартних ехографічних доступів. Після індукції, стернотомії, ШК і в кінці операції визначали кінцево-діастолічний, кінцево-систолічний, ударний об’єм і ФВ лівого шлуночка. Шляхом інтегрування цих даних і даних гемодинамічого моніторингу обчислювали кінцево-діастолічний індекс (КДІ), кінцево-систолічний індекс (КСІ), ударний індекс (УІ), серцевий індекс (СІ) і індекс загального периферичного судинного опору (ІЗПСО).
Статистичну обробку даних проводили за допомогою програми Statistica v. 6 фірми StatSoft (США). Для аналізу виду розподілу застосували критерій Шапіро — Уїлка. При нормальному розподілі даних використовували t-тест Стьюдента для залежних вибірок, а в разі асиметричного розподілу — критерій Вілкоксона. Нульову гіпотезу про відсутність різниці між показниками, отриманими на суміжних етапах, відкидали при p < 0,05. Дані виражали як середнє та стандартне відхилення (М ± s) в разі нормального, і як медіану верхнього та нижнього квартиля (Me (25; 75)) у разі асиметричного розподілу.
Результати
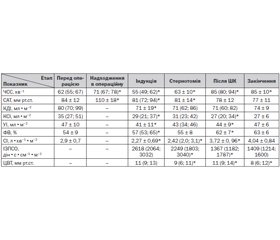
Напередодні операції хворі були у стані нормодинамії: СІ становив 2,9 ± 0,7 л•хв–1•м–2, САТ — 84 ± 12 мм рт.ст., а ЧСС — 62 хв–1. Згідно з даними передопераційного ультразвукового обстеження, глобальна систолічна функція міокарда не була порушеною, про що свідчили нормальні значення УІ і ФВ — відповідно 47 ± 10 мл•м–2 і 54 ± 9 %.
Після прибуття в операційну САТ і ЧСС залишались у межах референтних значень, але статистично вірогідно перевищували аналогічні показники напередодні операції. ЧСС становила за медіаною 71 (67; 78) хв–1, тобто була на 14 % більшою порівняно з передопераційним показником (р < 0,01), а САТ, що в середньому становив 110 ± 18 мм рт.ст., перевищував передопераційний рівень майже на третину (р < 0,01).
Після катетеризації епідурального катетера і введення початкової дози бупівакаїну починали загальну анестезію. Індукція в наркоз призводила до зниження САТ на 26 %, а ЧСС — на 23 %, що в абсолютних цифрах становило відповідно 81 (72; 94) мм рт.ст. і 55 (49; 62) хв–1 і було статистично вірогідним для обох показників (р < 0,01). КДІ, КСІ і УІ також знижувалися — відповідно 71 ± 19; 31 (23; 42) і 41 ± 11 мл•м–2 (р < 0,01 для всіх показників). Паралельно зростала ФВ — 57 (53; 65) % (р < 0,05). Завдяки зниженню ЧСС і УІ закономірно зменшувався СІ, який після індукції становив 2,27 ± 0,69 л•хв–1•м–2, тобто майже на чверть менше, ніж перед операцією (р < 0,01). ІЗПСО після індукції був помірно підвищеним — 2618 (2064; 3032) дін•с•см–5•м–2, а ЦВТ знаходився в межах норми — 11 (9; 13) мм рт.ст.
Після стернотомії САТ не змінювався і становив 81 ± 14 мм рт.ст. Спостерігали незначне, але статистично вірогідне зростання ЧСС на 6 % (р < 0,01), що не зазнавало різких коливань і мало характер закономірної тенденції. Зростання ЧСС пояснювали компенсаторною реакцією на відносну гіповолемію, поступовим зростанням видатності серця за рахунок відновлення хроно- та інотропних властивостей міокарда, а можливо, комбінацією обох причин. Це підтверджувало зниження показників периферійного судинного опору та ЦВТ. ІЗПСО після стернотомії був на 14 % менше, ніж на попередньому етапі (р < 0,01). ЦВТ також зменшився на 18 % (р < 0,01). Але на фоні негативної тенденції зміни ЦВТ не відбувалося зниження СІ, більше того, він зростав до 2,42 (2,0; 3,1) л•хв–1•м–2 (р < 0,05). Враховуючи відсутність статистично значущих змін інших показників, можна вважати, що зростання ЧСС відбувалося первинно, завдяки відновленню хронотропних властивостей міокарда.
Після закінчення ШК ЧСС зростала на 37 % (р < 0,01) і становила 85 (80; 94) хв–1, СІ збільшився в 1,5 раза — до 3,72 ± 0,96 л•хв–1•м–2, а ІЗПСО зменшився на 39 % (р < 0,01) — до 1367 (1182; 1787) дін•с•см–5•м–2. Закономірно не відбулося статистично вірогідних змін САТ, що на зазначеному етапі становив 78 ± 12 мм рт.ст. Завдяки нагнітанню крові з апарата ШК ЦВТ після закінчення перфузії став більше на 22 % (р < 0,01). Внаслідок змін, що відбулися, у хворих встановився помірно гіпердинамічний тип кровообігу. СІ зростав не тільки за рахунок ЧСС, але і завдяки збільшенню продуктивності міокарда. Так, на тлі КДІ, що залишився незмінним відносно попереднього етапу і становив за медіаною 71 (60; 82) мл•м–2, КСІ знизився до 27 (20; 34) мл•м–2 (р < 0,01). Як наслідок, УІ також збільшився до 44 ± 9 мл•м–2 (р < 0,05). ФВ після перфузії підвищилась на 13 % і в середньому становила 62 ± 7 % (р < 0,01).
У кінці операції показники центральної гемодинаміки (ЦГ) відображали подальше покращення її стану в оперованих пацієнтів. Незважаючи на зниження ЦВТ на 27 %, 8 (6; 12) проти 11 (9; 14) мм рт.ст. на попередньому етапі (р < 0,01), мало місце подальше зростання СІ, що досяг свого найвищого значення протягом операції — 4,04 ± 0,84 л•хв–1•м–2 (р = 0,363). На відміну від двох попередніх етапів головним чинником зростання СІ було покращення показників глобальної систолічної функції міокарда. Так, ЧСС у кінці операції змін не зазнала, а УІ та ФВ, навпаки, стали більшими і досягли своїх найвищих за операцію значень — відповідно 47 ± 6 мл•м–2 і 63 ± 6 %. Вперше протягом операції це відбувалося завдяки зростанню КДІ до 74 ± 9 мл•м–2 при незмінному КСІ — 27 ± 6 мл•м–2. Взяті в комплексі зміни вказували на покращення гемодинаміки хворих, але на останньому етапі їм бракувало статистичної вірогідності у зв’язку з відносно невеликою кількістю обстежених. Не відмічали також змін показників САТ та ІЗПСО, які в кінці операції становили відповідно 77 ± 11 мм рт.ст. і 1409 (1214; 1600) дін•с•см–5•м–2. Отримані дані підсумовані в табл. 1.
З метою корекції артеріальної гіпотензії і/або синдрому низького серцевого викиду застосовували адреноміметичні препарати. Після індукції фенілефрін вводили у 13 % пацієнтів, потреби у введенні b-агонистів у передперфузійному періоді не виникало. Після виходу з ШК підтримку гемодинаміки допаміном проводили в 33 % пацієнтів в дозі за медіаною 8,3 (6,8; 11,4) мкг•кг–1•хв–1 і у 23 % — нор–епінефрином в дозі 0,17 (0,15; 0,33) мкг•кг–1•хв–1. Загальна частота застосування адреноміметиків становила 56 % (табл. 2).
Обговорення
Незважаючи на отриману глибоку премедикацію, під час прибуття в операційну пацієнти перебували в стані певного емоційного напруження, про що свідчило зростання САТ і ЧСС відповідно на 30 і 14 %. Індукція в загальну анестезію призводила до перебудови гемодинаміки, що характеризувалася помірною гіподинамію. В основі зазначених змін могли лежати ефекти загальної анестезії і проведеної епідуральної блокади. Це, по-перше, зменшення видатності серця за рахунок негативного хроно- і інотропного ефекту введених препаратів (бупівакаїну і загальних анестетиків) і, по-друге, відносна гіповолемія на фоні розширення ємкісних судин грудної і черевної порожнин. Показники глобальної систолічної функції серця (УІ і ФВ) не виходили за межі референтних значень, тому немає підстави не пов’язувати зниження СІ з погіршенням контрактильної спроможності міокарда. Зниженню СІ у першу чергу сприяв негативний хронотропний ефект загальних анестетиків і епідуральної блокади, поєднаний зі зниженням притоку крові до серця внаслідок розширення ємкісних судин. Про це свідчило паралельне зменшення показників КДІ, КСІ (на 11 %) та УІ (на 13 %), незважаючи на те, що рівень ЦВТ залишався нормальним. Останньому сприяло помірне підвищення ІЗПСО, що вказувало на посилення тонусу резистивних судин як компенсаторної реакції на відносну гіповолемію. Таким чином, більшість гемодинамічних параметрів, САТ, ЦВТ, КДІ, КСІ, УІ та ФВ після індукції залишилися в межах референтних значень, а відхилення СІ і ІЗПСО від норми були вкрай незначними. Показово, що паралельно зі зниженням СІ покращувалась систолічна функція міокарда. Останнє вказувало на поліпшення умов роботи серця після проведення ВГЕБ і введення хворих в загальну анестезію.
Отримані при дослідженні результати узгоджуються з даними інших авторів, які вивчали гемодинаміку кардіохірургічних пацієнтів, оперованих в умовах анестезії на основі ВГЕБ [5, 6]. В одній з цих робіт порівнювали гемодинамічні параметри у 60 пацієнтів низького та середнього ризику при виконанні АКШ в умовах ШК. Основну групу становили пацієнти, яким загальну анестезію доповнювали проведенням ВГЕБ. Автори відмічали значне зниження УІ і СІ після проведення ВГЕБ і індукцію в загальну анестезію, причому ці показники статистично вірогідно відрізнялись на користь основної групи: УІ — 38 проти 32 мл•м–2, а СІ — 2,35 проти 2,18 л•хв–1•м–2 [6].
Серединна стернотомія — етап операції, пов’язаний з максимальною хірургічною стимуляцією. На цьому етапі не відмічали значних коливань гемодинамічних параметрів, але спостерігали тенденцію до підвищення ЧСС і СІ на фоні зниження ЦВТ і ІЗПСО. СІ зростав, незважаючи на зниження ЦВТ, тому це зростання можна трактувати як первинну ланку в послідовності гемодинамічних змін, що мали місце, і відбувалося воно в першу чергу завдяки відновленню хронотропних властивостей міокарда. Заслуговує на увагу той факт, що під час найбільш травматичного етапу операції АТ не зазнавав різких коливань.
Особливістю післяперфузійного періоду була чергова перебудова ЦГ і перехід її до гіпердинамічного типу. Найбільші зміни торкнулися СІ, що збільшився в 1,5 раза (54 %), а ІЗПСО, навпаки, знизився більше як на третину (39 %). Останнє пов’язано з включенням серця в кровообіг в поєднанні з залишковим впливом ШК і гіпотермії. Як відомо, після реперфузії міокарда в кровообіг потрапляє значна кількість вазоактивних субстанцій, накопичених під час тимчасової ішемії. Крім того, після зігрівання хворого та закінчення ШК відбувається відкриття ділянок мікроциркуляторного русла, раніше виключених з кровообігу, що в результаті призводить до зниження судинного опору. Але як бачимо, після відновлення коронарного кровообігу серце здатне значно збільшити продуктивність у відповідь на підвищені метаболічні запити. В результаті зазначених різноспрямованих рухів показників СІ (до збільшення) і ІЗПСО (до зменшення) після закінчення ШК не відбувалося статистично вірогідних змін САТ. Ще однією особливістю зазначеного етапу було те, що СІ зростав не тільки за рахунок підвищення ЧСС, а і завдяки покращенню систолічної функції серця. Останнє підтверджувалось статистично вірогідним зростанням показників УІ та ФВ.
Дані, отримані наприкінці операції, вказують на подальшу нормалізацію гемодинаміки оперованих хворих, хоча зафіксовані зміни і не мали статистично вірогідного характеру. Тим не менше вони відображають тенденцію до покращення систолічної функції міокарда, яка може підтвердитися при більшій кількості обстежених.
Висновки
1. При проведенні комбінованої анестезії на основі ВГЕБ під час операцій аортокоронарного шунтування зі штучним кровообігом більшість гемодинамічних параметрів зберігалась в межах референтних значень і не коливались на травматичних етапах.
2. Після індукції в загальну анестезію за рахунок відносної брадикардії встановлювався помірно гіподинамічний тип кровообігу, але показники глобальної систолічної функції міокарда зростали, що свідчило про покращення умов роботи серця під впливом ВГЕБ.
1. Fast-track practice in cardiac surgery: results and predictors of outcome / M. Haanschoten, A. van Straten, J. Woorst еt al. // Interact. Cardiovasc. Thorac. Surg. — 2012. — Vol. 15. — P. 989-994. — Doi: 10.1093/icvts/ivs393.
2. The impact of immediate extubation in the operating room after cardiac surgery onintensive care and hospital lengths of stay / D. Chamchad, J. Horrow, L. Nachamchik et al. // J. Cardiothorac. Vasc. Anesth. — 2010. — Vol. 24. — P. 780-784. — Doi: 10.1053/j.jvca.2010.04.002.
3. High thoracic epidural analgesia decreases stress hyperglycemia and insulin need in cardiac surgery patients / J. Greisen, D. Nielsen, E. Sloth, C. Jakobsen // Acta Anaesthesiol. Scand. — 2013. — Vol. 57. — P. 171-177. — Doi: 10.1111/j.1399-6576.2012.02731.x.
4. Effects of high thoracic epidural anesthesia on mixed venous oxygen saturation in coronary artery bypass grafting surgery / E. Gurses, D. Berk, H. Sungurtekin // Med. Sci. Monit. — 2013. — Vol. 19. — P. 222-229. — Doi: 10.12659/MSM.883861.
5. High Thoracic Epidural Analgesia in Cardiac Surgery: Part 1 — High Thoracic Epidural Analgesia Improves Cardiac Performance in Cardiac Surgery Patients / C.-J. Jakobsen, R. Bhavsar, D. Nielsen, P. Ryhammer, E. Sloth // Journal of Cardiothoracic and Vascular Anesthesia. — 2012. — Vol. 26. — P. 1039-1047. — Doi: 10.1053/j.jvca.2012.05.007.
6. Effect of thoracic epidural anasthesia on oxygen delivery and utilization in cardiac surgery patients scheduled to undergor off-pump coronary artery bypass surgery: A prospective study / S. Suryapracash, M. Chakravarthy, A. Gandhi, V. Jawali // Ann. Card. Anaesth. — 2011. — Vol. 14. — P. 192-196. — Doi: 10.4103/0971-9784.83997.
1. Haanschoten MC, van Straten AH, ter Woorst JF, Stepaniak PS, van der Meer AD, van Zundert AA, Soliman Hamad MA. Fast-track practice in cardiac surgery: results and predictors of outcome. Interact Cardiovasc Thorac Surg. 2012; 15(6):989-94. doi: 10.1093/icvts/ivs393
2. Chamchad D, Horrow JC, Nachamchik L, Sutter FP, Samuels LE, Trace CL, Ferdinand F, Goldman SM. The impact of immediate extubation in the operating room after cardiac surgery on intensive care and hospital lengths of stay.J Cardiothorac Vasc Anesth. 2010; 24:780-784. doi: 10.1053/j.jvca.2010.04.002
3. Greisen J1, Nielsen DV, Sloth E, Jakobsen CJ. High thoracic epidural analgesia decreases stress hyperglycemia and insulin need in cardiac surgery patients. Acta Anaesthesiol Scand. 2013; 57(2):171-7. doi: 10.1111/j.1399-6576.2012.02731.x.
4. Ercan Gurses, Derviş Berk, Hülya Sungurtekin, Asli Mete,and Simay Serin. Effects of high thoracic epidural anesthesia on mixed venous oxygen saturation in coronary artery bypass grafting surgery. Med Sci Monit. 2013; 19:222–229. doi: 10.12659/MSM.883861
5. Jakobsen CJ, Bhavsar R, Nielsen DV, Ryhammer PK, Sloth E, Greisen J. High Thoracic Epidural Analgesia in Cardiac Surgery: Part 1—High Thoracic Epidural Analgesia Improves Cardiac Performance in Cardiac Surgery Patients. Journal of Cardiothoracic and Vascular Anesthesia. 2012; 26:1039-1047. doi: 10.1053/j.jvca.2012.05.007.
6. Suryaprakash S, Chakravarthy M, Gautam M, Gandhi A, Jawali V, Patil T, Jayaprakash K, Pandey S, Muniraju G. Effect of thoracic epidural anasthesia on oxygen delivery and utilization in cardiac surgery patients scheduled to undergor off-pump coronary artery bypass surgery: A prospective study. Ann Card Anaesth. 2011; 14:192 - 196. doi: 10.4103/0971-9784.83997.

/171/171.jpg)