Резюме
Дослідження EPHES (Evaluation of influence of fixed dose combination Рerindopril/Amlodipine on target organ damage in patients with arterial HypErtension with or without iSchemic heart disease) мало за мету оцінити ефективність фіксованої комбінації периндоприл + амлодипін щодо зниження артеріального тиску (АТ) та динаміки вираженості ураження органівмішеней у хворих на артеріальну гіпертензію (АГ) з ішемічною хворобою серця (ІХС) та без такої.
У первинний аналіз включено дані 30 пацієнтів з АГ без ІХС віком понад 30 років. Рівень систолічного (САТ) і/або діастолічного (ДАТ) АТ у хворих, що до цього не лікувалися, на момент включення мав бути ≥ 160 та/або 100 мм рт.ст., але < 200/120 мм рт.ст.; у тих, хто знаходився на монотерапії або подвійній комбінованій терапії, — ≥ 140/90 мм рт.ст., але < 200/120 мм рт.ст. Усім пацієнтам у день рандомізації призначали фіксовану комбінацію периндоприл + амлодипін у початковій дозі 5/5 мг один раз на добу. При необхідності (АТ > 140/90 мм рт.ст.) дози компонентів фіксованої комбінації збільшували поступово кожні 2 тижні до 10/10 мг, а після 6 тижнів лікування додавали індапамід 1,5 мг, бетаадреноблокатори або альфаадреноблокатори. Усім пацієнтам проводили: вимірювання маси тіла та зросту, офісних рівнів САТ, ДАТ та частоти серцевих скорочень, добове моніторування АТ, визначення швидкості поширення пульсової хвилі в артеріях еластичного (ШППХе) та м’язового типів, центрального САТ, біохімічне дослідження крові, електрокардіографію, ехокардіографію з Дграфією, вимірювання гомілковоплечового індексу, визначення товщини комплексу інтимамедіа. Тривалість спостереження становила 12 місяців.
Лікування за допомогою фіксованої комбінації периндоприл + амлодипін забезпечувало досягнення цільового рівня і САТ, і ДАТ у 60 % випадків на етапі 6 тижнів. Додавання індапаміду 1,5 мг на добу (n = 12) та бісопрололу (n = 1) забезпечило контроль офісного САТ і ДАТ у 100 % пацієнтів на етапі 6 місяців лікування. Зниження офісного АТ супроводжувалося достовірним зменшенням середньодобового, денного та нічного АТ відповідно на 22,3 ± 0,1 мм рт.ст., 19,6 ± 0,4 мм рт.ст., 26,1 ± 0,2 мм рт.ст. та 8,2 ± 0,2 мм рт.ст., 8,4 ± 0,1 мм рт.ст., 7,9 ± 0,1 мм рт.ст. і досягненням цільового середньодобового АТ у 98,7 % пацієнтів. Достовірно зменшилася частка пацієнтів, які характеризувалися як «нондіппери», з 50 до 23,3 % та варіабельність денних САТ/ДАТ та нічного САТ. Частка пацієнтів із величиною ранкового підйому САТ понад 55 мм рт.ст. достовірно зменшилася з 60 до 20 %. Центральний САТ достовірно знизився з 142,8 ± 2,5 мм рт.ст. до 118,3 ± 2,7 мм рт.ст. (Р < 0,001). Паралельно відбулося достовірне (Р < 0,001) зменшення індексу приросту з 26,8 ± 1,9 % до 11,2 ± 1,7 %. Ефективна щодо зниження АТ терапія протягом року призводила до достовірного регресу ураження органівмішеней: зменшення гіпертрофії лівого шлуночка (індекс маси міокарда зменшився з 108,8 ± 5,5 г/м2 до 88,3 ± 5,3 г/м2, індекс Корнелла — з 2440,1 ± 67,9 мм • мс до 1987,2 ± 66,8 мм • мс, розмір лівого передсердя — з 41,1 ± 0,2 мм до 38,1 ± 0,3 мм), рівня альбумінурії (з 53,3 ± 5,6 мг/добу до 15,8 ± 3,2 мг/добу), покращенню діастолічної функції лівого шлуночка та пружноеластичних властивостей аорти (ШППХе зменшилася з 11,9 ± 0,7 м/с до 9,4 ± 0,8 м/с). Зміни діастолічної функції лівого шлуночка та рівня альбумінурії достовірно та незалежно від змін рівня АТ (і офісного, і центрального) корелювали зі змінами ШППХе та індексу приросту. Проведена антигіпертензивна терапія на основі фіксованої комбінації периндоприл + амлодипін добре переносилася хворими (частота побічних реакцій 6,5 %).
Исследование EPHES (Evaluation of influence of fixed dose combination Рerindopril/Amlodipine on target organ damage in patients with arterial HypErtension with or without iSchemic heart disease) имело целью оценить эффективность фиксированной комбинации периндоприл + амлодипин в отношении снижения артериального давления (АД) и динамики выраженности поражения органовмишеней у больных с артериальной гипертензией (АГ) с ишемической болезнью сердца (ИБС) и без таковой.
В первичный анализ включены данные 30 пациентов с АГ без ИБС в возрасте старше 30 лет. Уровень систолического (САД) и/или диастолического (ДАД) АД у пациентов, которые до этого не лечились, на момент включения должен был быть ≥ 160 мм рт.ст. и/или 100 мм рт.ст., но < 200/120 мм рт.ст.; у тех, кто находился на терапии, — ≥ 140/90 мм рт.ст., но < 200/120 мм рт.ст. Всем пациентам в день рандомизации назначали фиксированную комбинацию периндоприл + амлодипин в начальной дозе 5/5 мг один раз в сутки. При необходимости (АД > 140/90 мм рт.ст.) дозы компонентов фиксированной комбинации увеличивали постепенно каждые 2 недели до 10/10 мг, а после 6 недель лечения добавляли индапамид 1,5 мг, бетаадреноблокаторы или альфаадреноблокаторы. Всем пациентам проводили: измерение массы тела и роста, офисных уровней САД, ДАД и частоты сердечных сокращений, суточное мониторирование АД, определение скорости распространения пульсовой волны по артериям эластического (СРПВэ) и мышечного типов, центрального САД, биохимическое исследование крови, электрокардиографию, эхокардиографию с Дграфией, измерение лодыжечноплечевого индекса, определение толщины комплекса интимамедиа. Длительность наблюдения составила 12 месяцев.
Лечение с помощью фиксированной комбинации периндоприл + амлодипин обеспечивало достижение целевого уровня и САД, и ДАД в 60 % случаев на этапе 6 недель. Добавление индапамида 1,5 мг в сутки (n = 12) и бисопролола (n = 1) обеспечило контроль офисного САД и ДАД у 100 % пациентов на этапе 6 месяцев лечения. Снижение офисного АД сопровождалось достоверным уменьшением среднесуточного, дневного и ночного АД соответственно на 22,3 ± 0,1 мм рт.ст., 19,6 ± 0,4 мм рт.ст., 26,1 ± 0,2 мм рт.ст. и 8,2 ± 0,2 мм рт.ст., 8,4 ± 0,1 мм рт.ст., 7,9 ± 0,1 мм рт.ст. и достижением целевого среднесуточного АД у 98,7 % пациентов. Достоверно уменьшилась доля пациентов, которые характеризовались как «нондипперы», с 50 до 23,3 % и вариабельность дневных САД/ДАД и ночного САД. Доля пациентов с величиной утреннего подъема САД больше 55 мм рт.ст. достоверно уменьшилась с 60 до 20 %. Центральное САД достоверно снизилось с 142,8 ± 2,5 мм рт.ст. до 118,3 ± 2,7 мм рт.ст. (Р < 0,001). Параллельно наблюдалось достоверное (Р < 0,001) уменьшение индекса прироста с 26,8 ± 1,9 % до 11,2 ± 1,7 %. Эффективная в отношении снижения АД терапия на протяжении года приводила к достоверному регрессу поражения органовмишеней: уменьшилась гипертрофия левого желудочка (индекс массы миокарда уменьшился с 108,8 ± 5,5 г/м2 до 88,3 ± 5,3 г/м2, индекс длительности Корнелла — с 2440,1 ± 67,9 мм • мс до 1987,2 ± 66,8 мм • мс, размер левого предсердия — с 41,1 ± ± 0,2 мм до 38,1 ± 0,3 мм), уровня альбуминурии (с 53,3 ± ± 5,6 мг/сутки до 15,8 ± 3,2 мг/сутки), улучшилась диастолическая функция левого желудочка и упругоэластические свойства аорты (СРПВэ уменьшилась с 11,9 ± 0,7 м/с до 9,4 ± 0,8 м/с). Изменения диастолической функции левого желудочка и уровня альбуминурии достоверно и независимо от изменений уровня АД (и офисного, и центрального) коррелировали с изменениями СРПВэ и индекса прироста. Проведенная антигипертензивная терапия на основе фиксированной комбинации периндоприл + амлодипин хорошо переносилась больными (частота побочных реакций составила 6,5 %).
EPHES trial (Evaluation of influence of fixed dose combination Рerindopril/Amlodipine on target organ damage in patients with arterial HypErtension with or without iSchemic heart disease) had aim to evaluate the efficacy of fixed-dose combination of perindopril + amlodipine in terms of blood pressure (BP) decrease and the dynamics of target organ damage patterns in patients with arterial hypertension (AH) with and without ischemic heart disease (IHD).
Primary analysis included the data from 30 patients with AH and without IHD, aged over 30 years. The levels of systolic (SBP) and/or diastolic BP (DBP) in treatment-naive patients at baseline should be ≥ 160 and/or 100 mmHg, but < 200/120 mmHg;
in those who received monotherapy or dual combination therapy — ≥ 140/90 mmHg, but < 200/120 mmHg. All patients in randomization day were administered fixed-dose combination of perindopril/amlodipine in the initial dose of 5/5 mg once daily. If it is necessary (BP > 140/90 mmHg), doses of fixed-dose combination components increased gradually every 2 weeks up to 10/10 mg, and after 6 weeks of treatment, indapamide 1.5 mg, beta-blockers or alpha blockers were added. All patients underwent: measurement of body weight and height, office levels of SBP, DBP, and heart rate, ambulatory BP monitoring, determination of pulse wave velocity in elastic (PWVe) and muscular arteries, central SBP, biochemical blood count, electrocardiography, echocardiography with D-graphy, measurement of ankle-brachial index, intima-media thickness. The duration of follow-up was 12 months.
Treatment with fixed-dose combination of perindopril + amlodipine ensured achieving target levels of both SBP and DBP in 60 % of cases at the stage of 6 weeks. Addition of indapamide 1.5 mg daily (n = 12) and bisoprolol (n = 1) provide control of office SBP and DBP in 100 % of patients at 6 months of treatment phase. Reduction of office BP was accompanied by a significant decrease in average daily, daytime and nighttime BP, respectively, by 22.3 ± 0.1 mmHg, 19.6 ± 0.4 mmHg, 26.1 ± 0.2 mmHg and 8.2 ± 0.2 mmHg, 8.4 ± 0.1 mmHg, 7.9 ± 0.1 mmHg and the achievement of target average daily in 98.7 % of patients. The ratio of patients characterized as non-dippers decreased significantly from 50 to 23.3 %, as well as the variability of daytime SBP/DBP and nighttime SBP. The proportion of patients with morning rise of SBP over 55 mmHg significantly decreased from 60 to 20 %.
Central SBP significantly decreased from 142.8 ± 2.5 mmHg to 118.3 ± 2.7 mmHg (P < 0.001). In parallel, there was a significant (P < 0.001) reduction in growth index from 26.8 ± 1.9 % to 11.2 ± 1.7 %. The therapy effective in terms of blood pressure reduction resulted during the year in a probable regression of target organ damage: decrease in left ventricular hypertrophy (myocardial mass index reduced from 108.8 ± 5.5 g/m2 to 88.3 ± 5.3 g/m2, Cornell index — from 2,440.1 ± 67.9 mm • ms to 1,987.2 ± 66.8 mm • ms, left atrial size — from 41.1 ± 0.2 mm to 38.1 ± 0.3 mm), the level of albuminuria (from 53.3 ± 5.6 mg/day
to 15.8 ± 3.2 mg/day), improvement of left ventricular diastolic function and the elastic properties of the aorta (PWVe decreased from 11.9 ± 0.7 m/s to 9.4 ± 0.8 m/s). Changes in left ventricular diastolic function and the level of albuminuria significantly and independently of changes in BP (both office and central) correlated with the changes of PWVe and growth index. Antihypertensive therapy based on a fixed combination of perindopril + amlodipine was well tolerated by patients (incidence of adverse reactions was 6.5 %).
Статья опубликована на с. 27-41
Добре відомо, що ураження органів мішеней корелює з тривалим прогнозом у пацієнтів з артеріальною гіпертензією (АГ). Так, у достатній кількості проспективних досліджень було показано взаємозв’язок між наявністю гіпертрофії лівого шлуночка (ГЛШ) та ризиком виникнення серцево-судинних ускладнень і смерті [8, 24, 30, 34, 35]. Особливо переконливо було доведено вплив ГЛШ, виявленої за допомогою ехокардіографії (ЕхоКГ), на подальший прогноз АГ в Фремінгемському дослідженні та роботах групи R.B. Devereux [11, 24, 25]. Наявність ГЛШ удвічі збільшувала частоту виникнення серцево-судинних ускладнень незалежно від наявності інших факторів ризику. А збільшення товщини стінки лівого шлуночка (ЛШ) у хворих на АГ на 1 мм може асоціюватися зі зростанням ризику смерті майже у 7 разів. Крім того, було показано, що наявність ГЛШ призводила до збільшення загальної смертності, смертності від серцево-судинних захворювань, частоти інфаркту міокарда та необхідності проведення операцій реваскуляризації.
Діастолічна дисфункція ЛШ, за даними деяких авторів, виявляється у пацієнтів з АГ дуже часто — кожен четвертий пацієнт похилого віку має порушення діастолічної функції [27, 50, 71]. До 50 % випадків виявлення ознак серцевої недостатності пов’язано з діастолічною серцевою недостатністю. При цьому наявність діастолічної дисфункції ЛШ збільшує ризик виникнення фібриляції передсердь [64, 67] та смерті від усіх причин [7], є предиктором виникнення серцевої недостатності. У дослідженні A. Pritchett і співавт., що включало понад 2000 пацієнтів, було показано, що чим більше порушена діастолічна функція ЛШ та більший розмір лівого передсердя, тим гірший прогноз [52].
Підвищений артеріальний тиск (АТ) є як причиною, так і наслідком хронічних захворювань нирок. Поширеність АГ серед хворих із нирковою патологією становить близько 50 %, а приблизно 20–25 % хворих на ниркову недостатність мають так званий гіпертензивний нефросклероз [46, 65]. Наявність ураження нирок при АГ визначається як за рівнем швидкості клубочкової фільтрації (ШКФ), так і за рівнем альбумінурії. У дослідженні N. Anavekar і співавт. було показано, що чим нижчою є ШКФ, тим вищим є ризик виникнення таких ускладнень, як інсульт, інфаркт міокарда, серцево-судинна смерть, серцева недостатність [5]. Аналогічно: чим вищим є рівень альбумінурії як у хворих на цукровий діабет [20], так і без нього [59], тим вищим є ризик виникнення серцево-судинних ускладнень та смерті.
Ураження судин при АГ оцінюється за декількома показниками: пульсовий АТ, товщина комплексу інтима-медіа (ТКІМ), гомілково-плечовий індекс та швидкість поширення пульсової хвилі (ШППХ). Для всіх цих показників існують докази їх незалежного від інших факторів зв’язку із прогнозом [9, 40, 43, 45].
Зважаючи на те, що наявність та ступінь ураження органів-мішеней корелює з перебігом АГ, можна було б припустити, що зворотний розвиток цього ураження буде асоціюватися з покращенням прогнозу. Це доведено для ГЛШ (зменшення індексу маси міокарда ЛШ (ІММЛШ) на кожні 25 г/м2 забезпечувало зменшення вірогідності виникнення комбінованої кінцевої точки на 22 %, серцево-судинної смерті — на 38 %, інфаркту міокарда — на 15 %, інсульту — на 24 %, загальної смерті — на 28 %) та для мікроальбумінурії (пацієнти, у яких і на початку, і через рік терапії зберігалася висока протеїнурія, мали значно більшу частоту ускладнень, ніж пацієнти, які на початку дослідження мали високу протеїнурію, а через рік терапії — низький рівень) у дослідженні LIFE [14, 22]. У дослідженні ADVANCE призначення комбінації периндоприл + індапамід хворим на цукровий діабет достовірно знижувало загальну смертність на 14 % та зменшувало рівень альбумінурії [49]. У дослідженні з хворими із нирковою недостатністю продемонстровано, що зниження величини ШППХ по аорті на 1 м/с супроводжується зменшенням ризику смерті на 29 % [13].
Першою умовою для запобігання виникненню, прогресуванню та зворотного розвитку ураження органів-мішеней є забезпечення жорсткого контролю АТ за допомогою антигіпертензивних засобів. У ряді досліджень було показано прямий кореляційний зв’язок між ступенем зниження АТ та регресом ГЛШ [38, 44, 47], альбумінурії [17, 29], жорсткості аорти [60]. Вважається, що всі препарати, які знижують АТ, a priorі зменшують ураження органів-мішеней, але ступінь цього зменшення може залежати від вибору терапії. І, крім того, виявляється, що на фоні не всіх антигіпертензивних засобів даний регрес асоціюється з покращенням прогнозу. Так, у дослідженні ROADMAP олмесартан запобігав виникненню мікроальбумінурії, але не призводив до зменшення частоти виникнення кінцевих точок [53]. У дослідженні ELSA лацидипін попереджав збільшення величини ТКІМ достовірно більшою мірою, ніж атенолол, але не було різниці за кінцевими точками [72].
Таким чином, оцінка ураження органів-мішеней при АТ може застосовуватися для стратифікації ризику пацієнта, оцінки клінічного перебігу захворювання (згідно з класифікацією, що є в Україні, АГ має стадії розвитку) і для оцінки ефективності лікування. Пошуки найбільш оптимальної терапії, що б запобігала виникненню та прогресуванню, сприяла регресу змін в органах при АГ і при цьому супроводжувалася покращенням прогнозу щодо розвитку ускладнень, є актуальною проблемою сучасної медицини. Окрім того, існує не так багато досліджень, які б оцінювали це у пацієнтів з АГ та супутніми захворюваннями.
Наше дослідження EPHES (Evaluation of influence of fixed dose combination Рerindopril/Amlodipine on target organ damage in patients with arterial HypErtension with or without iSchemic heart disease — Оцінка впливу фіксованої комбінації периндоприл + амлодипін на ураження органів-мішеней у пацієнтів з АГ з ішемічною хворобою серця та без такої) мало за мету оцінити ефективність фіксованої комбінації периндоприл + амлодипін щодо зниження АТ та динаміки вираженості ураження органів-мішеней у пацієнтів із АГ з ішемічною хворобою серця (ІХС) та без такої. Вибір цієї комбінації базувався на двох основних критеріях. По-перше, для того, щоб оцінити особливості регресу органів-мішеней у різних когортах хворих, необхідно, щоб пацієнти отримували відносно схожу (краще однакову) антигіпертензивну терапію. По-друге, у великих дослідженнях ALLHAT, ASCOT та EUROPA було доведено високу ефективність периндоприлу, амлодипіну та їх комбінації як при АГ, так і при ІХС. Тому фіксована комбінація периндоприл + амлодипін показана як хворим тільки з АГ, так і при поєднанні АГ з ІХС. Ця стаття є результатом первинного аналізу отриманих даних лише у пацієнтів з АГ без клінічних ознак ІХС.
Матеріали та методи
Матеріали. У дослідження EPHES було включено 60 пацієнтів з АГ віком понад 30 років. Рівень систолічного (САТ) та/або діастолічного (ДАТ) АТ у хворих, що до цього не лікувалися, на момент включення мав бути ≥ 160 та/або 100 мм рт.ст., але < 200/120 мм рт.ст.; у тих, хто знаходився на монотерапії або подвійній комбінованій терапії, — ≥ 140/90 мм рт.ст., але < 200/120 мм рт.ст. Кожен пацієнт підписував інформовану згоду на участь у даному дослідженні. Протокол дослідження був схвалений локальною комісією з етики ДУ «ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України».
В аналіз, результати якого наведено у даній статті, було включено лише 30 пацієнтів, які не мали клінічних ознак ІХС та завершили однорічне спостереження згідно з протоколом. Характеристика пацієнтів подана у табл. 1.
/29.jpg)
У дослідження не включали пацієнтів із рівнем САТ та/або ДАТ ≥ 200 та/або 120 мм рт.ст., інфарктом міокарда та інсультом в анамнезі, вродженими або набутими вадами серця, неконтрольованими порушеннями ритму, серцевою недостатністю III–IV функціонального класу за NYHA або фракцією викиду ЛШ < 50 %, хронічною обструктивною хворобою легень, неконт-рольованим цукровим діабетом, хронічною хворобою нирок 3В стадії (ШКФ < 45 мл/хв), печінковою недостатністю або підвищенням рівнів печінкових ферментів більше як у 3 рази порівняно з верхньою межею норми, симптоматичною АГ, білатеральним стенозом ниркових артерій або стенозом артерії єдиної нирки, онкологічними та психічними захворюваннями, ті, які мали побічні явища на фоні прийому амлодипіну (або інших антагоністів кальцію) або інгібіторів ангіотензинперетворюючого ферменту (АПФ), ті, які відмовилися підписати форму інформованої згоди або брали участь в іншому клінічному дослідженні. Критерієм виключення також був вік молодше за 30 років, адже групи з ІХС та без такої мали бути порівнянними за віком, а у віці до 30 років ІХС зустрічається рідко.
Пацієнт виключався з дослідження у випадках: відкликання інформованої згоди, при недосягненні цільового АТ протягом 6 місяців лікування, виникненні побічних явищ, що не дозволяли продовжувати участь у спостереженні, погіршення стану пацієнта, що не було пов’язане з терапією, проте була необхідність проведення додаткових обстежень або призначення супутніх препаратів, які не дозволені протоколом.
Методи лікування. Всім пацієнтам: і тим, які до цього не лікувалися, і тим, які приймали антигіпертензивну терапію — у день рандомізації відразу призначали фіксовану комбінацію периндоприл + амлодипін (Бі-Престаріум®, виробництво компанії «Серв’є», Франція) у початковій дозі 5/5 мг один раз на добу. У подальшому при недостатній ефективності терапії (АТ > 140/90 мм рт.ст.) дози компонентів фіксованої комбінації збільшували поступово кожні 2 тижні до 10/10 мг. При недосягненні цільового рівня АТ протягом 6 тижнів лікування додавався індапамід 1,5 мг (Арифон® ретард, виробництво компанії «Серв’є», Франція) строком на 4 тижні. За необхідності дозволялося також додавати бета-адреноблокатори або альфа-адреноблокатори. Усі препарати пацієнти купували в аптеках самостійно.
Якщо протягом 6 місяців не вдавалося досягнути цільового рівня АТ, пацієнт виключався з дослідження для додаткового більш розширеного обстеження і встановлення причин резистентності. На місце виключеного через побічні явища або недостатню ефективність терапії рандомізували іншого пацієнта, який відповідав критеріям включення і не мав критеріїв виключення.
Дозволеними супутніми препаратами були: статини, препарати поліненасичених жирних кислот, бета-адреноблокатори, ацетилсаліцилова кислота у профілактичних дозах (75–100 мг/добу).
Методи дослідження. Усім пацієнтам проводили такі дослідження: вимірювання маси тіла та зросту, офісних рівнів САТ, ДАТ та частоти серцевих скорочень (ЧСС), добове моніторування АТ (ДМАТ), визначення швидкості поширення пульсової хвилі в артеріях еластичного (ШППХе) та м’язового (ШППХм) типів, центрального САТ (цСАТ), біохімічне дослідження крові (рівні калію, натрію, креатиніну, сечової кислоти, АЛТ, АСТ, білірубіну, глюкози, загального холестерину, тригліцеридів, холестерину високої та низької щільності сироватки крові), електрокардіографію (ЕКГ), ехокардіографію (ЕхоКГ) з Д-графією, вимірювання гомілково-плечового індексу, визначення ТКІМ. Протокол дослідження подано у табл. 2. Тривалість спостереження становила 12 місяців, адже у багатьох дослідженнях показано, що зворотний розвиток ураження органів-мішеней відбувається, як правило, у термін понад 6 місяців лікування [11].
/30.jpg)
Офісні рівні САТ і ДАТ реєстрували на початку дослідження за допомогою автоматичного осцилометричного апарата OMRON-705IT (виробництво компанії Omron Health care Co., Японія). Вираховували середнє з трьох вимірювань. ЧСС визначали після другого вимірювання.
Антропометричні вимірювання проводили з використанням ростоміра та ваг SECA (виробництво компанії SECA, Німеччина). Індекс маси тіла (ІМТ) обчислювали за формулою: ІМТ = маса тіла/зріст2.
Реєстрацію ЕКГ у пацієнтів до та наприкінці лікування проводили на шестиканальному самописці «Юнікард» (Україна). Визначали наявність загальноприйнятих ознак ГЛШ: індекс Соколова (SV1 + RV5/RV6 > 35 мм), вольтажний індекс Корнелла (R aVL + S V3 > 28 мм у чоловіків та > 20 мм — у жінок), індекс тривалості Корнелла (вольтаж помножити на тривалість) > 2400 мм • мс, індекс Romhilt — Estes > 5 балів та порушення ритму.
ДМАТ проводили на портативному апараті АВРМ-04 (Meditech, Угорщина). При цьому вивчали такі показники: середньодобовий (24), денний (д), нічний (н) САТ і ДАТ, ЧСС; варіабельність САТ (вар.САТ) і ДАТ (вар.ДАТ), що вираховувалася за допомогою офісного забезпечення приладу як стандартне відхилення від середнього значення; добовий індекс (ДІ) для САТ — ступінь зниження нічного САТ порівняно з денним, що відображався у відсотках. Залежно від ДІ для САТ пацієнти розподілялися на «діпперів» (зниження нічного САТ порівняно з денним більше ніж 10 %) та «нон-діпперів» (зниження нічного САТ порівняно з денним менше ніж 10 %). Величину ранкового підйому САТ визначали як різницю між максимальним САТ у період з 6:00 до 12:00 та мінімальним САТ у нічний час. За нормальне значення показника вважали його величину, меншу за 55 мм рт.ст. [26]. Моніторування відбувалося у режимі кожні 15 хв у денний час та кожні 30 хв у нічний, уночі (з 22:00 до 6:00) — кожні 30 хв. Хворі вели звичайний спосіб життя, з побутовими фізичними й психоемоційними навантаженнями [70].
Біохімічні аналізи проводили на автоматичному фотометрі Livia (Сormay, Польща) в лабораторії ДУ «ННЦ «Інститут кардіології імені академіка М.Д. Стражеска НАМН України». Визначали рівень креатиніну, електролітів (калію та натрію), глюкози, загального холестерину та тригліцеридів. ШКФ розраховували за формулою CKD-EPI, затвердженою рекомендаціями KDIGO, 2013 [33]:
ШКФ = 141 • мін. (креатинін/k, 1)α • макс. (креатинін/k, 1)1,209 • 0,993вік • 1,018 (якщо жінка) × 1,159 (якщо належить до негроїдної раси),
де ШКФ — швидкість клубочкової фільтрації, креатинін — концентрація креатиніну в сироватці крові в мг/дл (для переведення показник поділено на 88,4), k = 0,7, якщо жінка, k = 0,8, якщо чоловік, α = 0,329, якщо жінка, α = 0,411, якщо чоловік, мін. — мінімальне значення показника креатинін/k або 1, макс. — максимальне значення показника креатинін/k або 1.
Альбумінурію визначали за допомогою методу імунотурбометрії на аналізаторі Siemens (Німеччина — США) у добовій порції сечі.
ШППХ, цСАТ та індекс приросту (Aix75), стандартизований до ЧСС 75 за 1 хв, визначали на апараті Sphygmocor-PVx (AtCor Medical Pty Ltd, Австралія), з’єднаному з персональним комп’ютером. П’єзодатчики встановлювали на загальній правій сон-ній, стегновій артеріях та на радіальній артерії правого передпліччя під візуальним (на моніторі) та автоматичним контролем якості, що здійснювався за відповідної програми приладу. Час запізнювання пульсової хвилі та ШППХ, центральний АТ визначалися автоматично за допомогою програмного забезпечення приладу після введення величини відстані між датчиками, що вимірювалася сантиметровою смужкою. Для оцінки пружно-еластичних властивостей артерій еластичного типу ШППХе реєстрували на сегменті «сонна артерія — стегнова артерія», для оцінки пружно-еластичних властивостей артерій м’язового типу (ШППХм) — на сегменті «сонна артерія — радіальна артерія». Центральний АТ визначали за допомогою програмного забезпечення приладу на підставі АТ на плечовій артерії та форми отриманої пульсової хвилі у висхідній аорті (формула визначена виробником, проведена стандартизація при інтрааортальному вимірюванні АТ), а також з урахуванням даних епідеміологічних досліджень, на підставі яких розроблено індивідуальні норми тиску в аорті, визначення яких також було закладено в алгоритмі програми.
Вимірювання ТКІМ проводили згідно з консенсусом Американського товариства з ехокардіографії (2008) [61] тричі з розрахунком середнього значення почергово у правій (ПСА) та лівій (ЛСА) сонній артерії.
Гомілково-плечовий індекс визначали за допомогою автоматичного приладу OMRON-705IT (виробництво компанії Omron Health care Co., Японія). Вираховували середнє з трьох вимірювань.
ЕхоКГ з Д-графією проводили на апараті Sonos 5500 (Hewlett Packard, США) за розширеним протоколом, відповідно до рекомендацій Європейської асоціації фахівців із візуалізації серцево-судинної системи та з визначенням основних розмірів і об’ємів камер серця й магістральних судин, фракції викиду ЛШ, діастолічної функції та ІММЛШ за формулою Американського товариства з ехокардіографії [18], використання якої було рекомендовано Європейським товариством з артеріальної гіпертензії (2013) [2, 3].
Діастолічну функцію ЛШ досліджували за допомогою постійної допплерехокардіографії спектра трансмітрального діастолічного потоку із визначенням швидкості кровотоку в систолу лівого передсердя (А), інтегралу швидкості кровотоку раннього діастолічного наповнення (Е). Як основні критерії використовували відношення Е/А, час сповільнення раннього трансмітрального потоку, пікову швидкість хвиль Е і А та час ізоволюмічного розслаблення. Використовували тканинну допплерографію з розміщенням контрольного об’єму на септальній частині мітрального кільця з визначенням амплітуди E’ та відношення Е/Е’.
Усі інструментальні методи дослідження проводилися лікарями, які є спеціалістами у своїй галузі й які не були зацікавлені у результатах дослідження. Дослідження проводили на одному і тому самому апараті, одним і тим же фахівцем.
Кінцеві точки дослідження. Первинними кінцевими точками дослідження були: ступінь зниження АТ (офісного, амбулаторного, центрального); достовірна динаміка показників, що характеризують ураження органів-мішеней; переносимість призначеної терапії. За вторинні кінцеві точки вважали: частку пацієнтів, які досягли цільового офісного АТ; зміни показників ДМАТ (ранковий підйом, ДІ, варіабельність); нормалізацію цСАТ; зміни біохімічних показників; динаміку скарг хворого.
Методи статистичної обробки. Статистичну обробку результатів проводили за допомогою програмного забезпечення IBM Statistics SPSS 21.0 з розрахунком середньої арифметичної величини (М) та середньої абсолютної похибки (m). Достовірність різниці показників на етапах лікування визначали за допомогою парного тесту для середніх. Для встановлення зв’язку динаміки параметрів, що вивчалися, проводили кореляційний аналіз за Spearman та мультирегресійний аналіз.
Результати дослідження
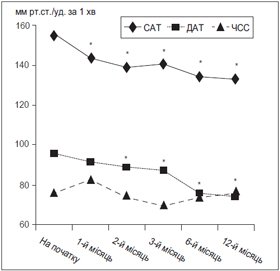
Зниження офісного АТ. Динаміка офісного САТ, ДАТ та ЧСС подана на рис. 1. Спостерігалося значне зниження офісних САТ/ДАТ вже на першому місяці лікування з 156,4 ± 2,8/96,3 ± 2,2 мм рт.ст. до 144,8 ± ± 1,1/92,2 ± 0,7 мм рт.ст. (Р < 0,01/НД). У подальшому на етапах 2, 3, 6 та 12 місяців лікування АТ продовжував знижуватися до 140,7 ± 1,0 мм рт.ст., 142,4 ± 1,1 мм рт.ст., 136,2 ± 1,3 мм рт.ст., 135,3 ± 1,3 мм рт.ст. та 90,1 ± 0,8 мм рт.ст., 88,3 ± 0,9 мм рт.ст., 78,1 ± 0,7 мм рт.ст. та 76,2 ± 1,1 мм рт.ст. відповідно для САТ і ДАТ (Р < 0,001 порівняно з початком для всіх показників). Офісна ЧСС достовірно не змінилася, лише на першому місяці прийому спостерігалася тенденція до збільшення ЧСС, що, ймовірно, пов’язано з активацією симпатоадреналової системи на фоні прийому амлодипіну. Проте вже на 2-му та 3-му місяцях терапії цей показник знизився и залишався майже на одному рівні до кінця спостереження.
/31.jpg)
Тільки фіксовану комбінацію периндоприл + амлодипін було призначено 18 (60 %) хворим. 12 пацієнтів (40 %) потребували додаткової терапії індапамідом та один — додатково бісопрололом для кращого конт-ролю АТ. Загалом цільовий АТ було досягнуто в усіх пацієнтів, включених у дослідження.
Динаміка показників ДМАТ подана у табл. 3, де показано, що на фоні лікування достовірно знизилися рівні САТ та ДАТ за добу, день та ніч відповідно на 22,3 ± ± 0,1 мм рт.ст., 19,6 ± 0,4 мм рт.ст., 26,1 ± 0,2 мм рт.ст. та 8,2 ± 0,2 мм рт.ст., 8,4 ± 0,1 мм рт.ст., 7,9 ± 0,1 мм рт.ст. ЧСС достовірно не змінилася. Цільовий середньодобовий АТ було досягнуто у 29 (98,7 %) пацієнтів.
На початку дослідження 50 % пацієнтів характеризувалися як «нон-діппери». Під впливом призначеної терапії спостерігалося достовірне зниження кількості таких пацієнтів до 23,3 % та середній рівень ДІ для САТ достовірно підвищився з 10,6 ± 0,8 % до 17,8 ± 1,9 % (р < 0,005). Варіабельність денних САТ/ДАТ та нічного САТ достовірно зменшилася на фоні лікування, що у подальшому, як показало дослідження ASCOT, може позитивно вплинути на прогноз у даних пацієнтів [56].
Середня величина ранкового підйому САТ достовірно зменшилася під впливом терапії, що, поряд зі зниженням варіабельності, свідчить про жорсткий та достатній 24-годинний контроль АТ. Кількість пацієнтів із величиною ранкового підйому САТ понад 55 мм рт.ст. достовірно зменшилася з 60 до 20 %.
Динаміка центрального АТ. На початку дослідження цСАТ був дещо нижчим за офісний — 142,8 ± 2,5 мм рт.ст. проти 156,4 ± 2,8 мм рт.ст. Через 12 місяців лікування відбулося достовірне зниження його рівня до 118,3 ± 2,7 мм рт.ст. (Р < 0,001). Нормального рівня (згідно з номограмами, інтегрованими у прилад) досягнули всі пацієнти. Паралельно відбулося достовірне (Р < 0,001) зменшення індексу приросту з 26,8 ± 1,9 % до 11,2 ± 1,7 %.
Динаміка показників, що характеризують ураження органів-мішеней, наведена у табл. 4, де серед показників, що характеризують ураження судин (ТКІМ, ШППХе, гомілково-плечовий індекс) достовірної позитивної зміни зазнала лише середня величина ШППХе, що можливо як внаслідок ефективного зниження АТ, так і через прямий вплив препаратів на еластичні властивості аорти.
Функція нирок, яку оцінювали за величиною ШКФ, достовірно не змінилася, але значно зменшилася протеїнурія. При цьому кількість пацієнтів, які на початку дослідження мали рівень альбуміну у добовій сечі, більший за норму (для чоловіків понад 20 мг/добу, для жінок понад 30 мг/добу), достовірно (Р < 0,05) зменшилася з 12 (40 %) до 5 (16,7 %).
Значні позитивні зміни відбувалися і з показниками, що характеризують ураження серця: достовірно зменшилися на 18,8 та 18,6 % відповідно середні величини ІММЛШ та індексу тривалості Корнелла (тобто спостерігався регрес ГЛШ), збільшився показник Е/А та зменшилося відношення Е/Е’ (покращилася діастолічна функція ЛШ), що призвело до зменшення розмірів лівого передсердя.
Динаміка біохімічних показників. Ми не спостерігали достовірної зміни жодного показника, що конт-ролювалися у наших пацієнтів (табл. 5), окрім достовірного зменшення рівня загального холестерину та тригліцеридів, що, скоріше за все, було обумовлено призначенням статинів пацієнтам, які на початку дослідження мали дисліпідемію (n = 19).
Оцінка безпеки терапії. Загалом до дослідження були залучені 34 пацієнти. В одного пацієнта виник кашель, що призвело для виключення його з дослідження. Три пацієнти не прийшли на повторне обстеження через місяць і тому були виключені з дослідження як такі, що відкликали свою інформовану згоду. На їх місце було взято інших пацієнтів, які мали критерії включення і не мали критеріїв виключення. На фоні лікування в 1 пацієнтки виникли периферичні набряки, але це не призвело до припинення її участі у дослідженні. Таким чином, серед 31 пацієнта, які приймали фіксовану комбінацію периндоприл + амлодипін та закінчили участь у дослідженні згідно з протоколом, побічні явища зареєстровано у 2 (6,5 %).
На фоні лікування спостерігалося зменшення кількості пацієнтів із такими скаргами, як головний біль (з 17 (56,7 %) до 2 (6,7 %) осіб, Р < 0,001), запаморочення (з 5 (16,7 %) до 0 осіб, P < 0,05) та болі в ділянці серця (з 7 (23,3 %) до 1 (3,3 %) особи, P < 0,05).
Кореляція показників, що характеризували ураження органів-мішеней, зі зниженням АТ. При проведенні кореляційного аналізу за Spearman виявилося, що зниження ШППХе, ІММЛШ, Е/А, Е/Е’ та рівня мікроальбумінурії достовірно корелює зі зниженням як офісного АТ (r = 0,68, P = 0,001; r = 0,48, P = 0,01; r = –0,56, P = 0,01; r = 0,47, P = 0,03, r = 0,62, P = 0,001 відповідно), так і цСАТ (r = 0,44, P = 0,02; r = 0,48, P = 0,01; r = –0,68, P = 0,005; r = 0,52, P = 0,03, r = 0,72, P = 0,001 відповідно). Окрім того, виявилося, що показники, які характеризують діастолічну функцію ЛШ, мають кореляційний достовірний зв’язок (табл. 6) із ШППХе та індексом Аіх75: Е/А достовірно збільшувалася та Е/Е’ достовірно зменшувалася при зменшенні показників жорсткості аорти. Ступінь зменшення рівня альбумінурії також корелював зі зниженням величин ШППХе та Аіх75%.
При проведенні мульваріантного регресійного аналізу виявилося (табл. 6), що Е/А, Е/Е’ та рівень альбумінурії незалежно корелювали зі зменшенням величини ШППХе. При зменшенні величини ШППХе достовірність зростання Е/А збільшувалася на 48 %, зменшення Е/Е’ — в 1,52 раза, зменшення альбумінурії — у 2,78 раза. Окрім того, Е/А та ступінь зменшення рівня альбумінурії мали незалежний від ступеня зниження АТ зв’язок з індексом Аіх75. Зменшення Аіх75 асоціювалося зі збільшенням достовірності зростання Е/А на 40 %, зменшення альбумінурії — у 2,52 раза.
Результати та їх обговорення
Сучасні рекомендації з лікування АГ свідчать про необхідність забезпечення перш за все контролю офісного АТ [2, 3]. Проте дані деяких досліджень демонструють, що при однаковому зниженні рівня офісного АТ різні препарати або комбінації впливають по-різному на ураження органів-мішеней та прогноз. Частіше це пов’язано з існуванням відмінностей у впливі препаратів на додаткові показники контролю АТ — на середньодобовий, денний, нічний АТ, на варіабельність та величину ранкового підйому АТ, на центральний АТ. Так, у дослідженні ASCOT лікування на основі амлодипіну (+ периндоприл) забезпечувало зниження ризику інсульту на 23 %, смертності від серцево-судинних захворювань на 24 %, загальної смерті на 11 % порівняно з лікуванням на основі атенололу (+ тіазид) [12, 62]. При цьому виявилося, що перша комбінація забезпечувала кращий контроль нічного АТ протягом майже всього періоду спостереження, зменшувала ранковий підйом САТ та варіабельність АТ. Різниця в 4,3 мм рт.ст. у рівнях центрального САТ наприкінці також була на користь терапії амлодипіном (+ периндоприл). Тобто при однаковому зниженні офісного АТ комбінація антагоністу кальцію та інгібітору АПФ виявилася більш ефективною як щодо контролю всіх параметрів АТ, так і щодо впливу на прогноз, що забезпечило у подальшому більш широке застосування її в клінічній практиці.
Проте недоліком дослідження ASCOT було те, що на етапі рандомізації (коли ще пацієнти не отримували досліджувані препарати) не проводили додаткові обстеження (ДМАТ та оцінка центрального АТ), їх почали застосовувати лише через 6 та 12 місяців терапії відповідно. Тому залишилося невідомим, чи пов’язана така різниця у рівнях нічного та центрального АТ саме з дією препаратів, чи вона існувала ще до включення пацієнта у дослідження. У нашому дослідженні обстеження робилися і на момент рандомізації, і через 12 місяців спостереження. При цьому чітко продемонстровано, що саме під впливом фіксованої комбінації периндоприл + амлодипін поряд із достатнім зниженням офісного АТ відбувається достовірна та значна корекція параметрів ефективного контролю АТ, що визначалися при додаткових обстеженнях. У дослідженні ASCOT офісний САТ та ДАТ достовірно знизився з 165,2 до 136,1 мм рт.ст. та з 94,8 до 77,4 мм рт.ст. у групі амлодипіну (+ периндоприл), що порівнянне з даними нашого дослідження (зниження з 156,4/96,3 до 135,3/76,2) та свідчить про валідність отриманих нами результатів. Вважається, що в популяції оптимальним рівнем центрального САТ є його величина < 110 мм рт.ст. (ближче до 100 мм рт.ст.), що еквівалентно тиску на плечовій артерії < 120 мм рт.ст. [39]. У той же час цСАТ < 120 мм рт.ст. відповідає тиску на плечовій артерії < 140 мм рт.ст. У наших пацієнтів середній рівень цСАТ наприкінці становив 118,3 ± 2,7 мм рт.ст. і це свідчить про те, що наші пацієнти досягли цільового цСАТ < 120 мм рт.ст.
Вважається, що практично всі антигіпертензивні препарати знижують центральний АТ. Проте ступінь цього зниження може відрізнятися та не завжди корелювати зі ступенем зменшення офісного АТ. Так, за даними одного з перших мета-аналізів [42], антагоністи кальцію та діуретики однаково знижують центральний та периферичний АТ. Інгібітори АПФ знижують центральний тиск більшою мірою, ніж периферичний. Тому інколи говорять про недооцінку ефективності інгібіторів АПФ. Бета-блокатори, особливо без вазодилатуючого ефекту, знижують центральний АТ меншою мірою, ніж АТ на плечовій артерії. Зважаючи на це, можна говорити, що найбільш вигідними подвійними комбінаціями антигіпертензивних препаратів щодо зниження аортального АТ є антагоніст кальцію + діуретик або блокатор ренін-ангіотензинової системи. У нашому дослідженні ми тестували саме таку ефективну фіксовану комбінацію периндоприл + амлодипін. Нами підтверджено, що при призначенні цієї комбінації можна бути впевненим і без спеціального вимірювання, що ступінь зниження офісного АТ відповідає ступеню зниження центрального. Найбільш невигідною подвійною комбінацією є комбінація, що включає бета-блокатор без вазодилатуючих властивостей. Вважається, що ці препарати, сповільнюючи ЧСС, сприяють поверненню відбитої пульсової хвилі в систолу та додатковому збільшенню систолічного центрального АТ.
Ефективний та всебічний контроль АТ, безумовно, міг позитивно вплинути на динаміку показників, що характеризують ураження органів-мішеней. Так, відомо, що у дослідженні LIFE лікування на основі лозартану забезпечувало регрес ГЛШ більшою мірою, ніж лікування на основі атенололу, при однаковому зниженні офісного АТ [11]. Проте виявилося, що контроль пульсового офісного АТ був кращим саме у групі лозартану. Величина індексу Аіх достовірно зменшилася на фоні прийому блокатора рецепторів ангіотензину ІІ, тоді як на фоні бета-блокатора вона збільшилася. Індекс Аіх вважається показником, що залежить часткового від рівня центрального АТ, а частково — від пружно-еластичних властивостей артерій. Отже, позитивний вплив лозартану на ГЛШ можна було б частково пояснити кращим контролем центрального АТ.
Останнім часом вважається, що центральний АТ має більше значення для ураження органів-мішеней та виникнення кардіоваскулярних ускладнень, ніж АТ, виміряний на плечовій артерії [32, 39, 54, 62]. Дійсно, адже саме тиск в аорті безпосередньо діє на органи-мішені. Перелік деяких досліджень, в яких саме центральному АТ віддавалася провідна роль у виникненні ураження органів-мішеней, наведено у табл. 7. Наш кореляційний аналіз підтвердив, що зменшення ступеня гіпертрофії та діастолічної дисфункції ЛШ, ураження нирок та жорсткості артерій пов’язано з позитивним впливом фіксованої комбінації периндоприл + амлодипін на рівень аортального САТ (табл. 6). Збережена достовірна кореляція з рівнем офісного САТ пояснюється тим, що визначення аортального САТ відбувається непрямим методом на підставі калібрування кривої пульсової хвилі за даними вимірювання АТ на плечовій артерії. Однак ця кореляція зникала при проведенні мультирегресійного аналізу.
Проте не тільки кращий контроль АТ є відповідальним за регрес ознак ураження органів-мішеней. Можливо, що мають значення і так звані плейотропні ефекти препаратів, що призначаються. Так, у дослідженні LIVE порівнювали ефекти індапаміду ретард у дозі 1,5 мг/добу з еналаприлом у дозі 20 мг/добу [21]. При однаковому зниженні АТ індапамід ретард забезпечував достовірно більший регрес ГЛШ. У спостереженні MARVAL валсартан краще, ніж амлодипін, зменшував рівень альбумінурії при однаковому впливі на рівень АТ [68]. При цьому позитивний ефект на альбумінурію був відзначений як у гіпертензивних, так і нормотензивних пацієнтів. У дослідженні PREMIER комбінація периндоприл + індапамід забезпечувала зниження альбумінурії значно більшою мірою, ніж монотерапія еналаприлом [41]. Ця різниця залишалася достовірною після стандартизації за рівнем АТ.
До плейотропних ефектів периндоприлу зараховують: ренопротективний (розширюючи еферентну артеріолу, зменшує внутрішньоклубочковий тиск), протизапальний, антипроліферативний, антиоксидантний, зменшення вираженості апоптозу ендотелію, підвищення чутливості тканин до інсуліну, антиатеросклеротичний, зменшення ремоделювання артеріол, антифібринолітичний та ін. [15, 31]. Амлодипін має підтверджені дослідженнями ефекти: вазодилатуючий, антиатеросклеротичний, антипроліферативний, антиоксидантний [51, 69]. Комбінація цих препаратів може значно посилювати дію кожного з компонентів і, таким чином, позитивні зміни в органах мішеней відбуваються значно більшою мірою, ніж це було б якщо АТ просто знижувався.
У нашому дослідженні ми виявили зв’язок змін показників, що характеризують діастолічну функцію ЛШ, та рівня альбумінурії зі змінами показників, які характеризують пружно-еластичні властивості артерій — ШППХе та Аіх75. Існують дані про те, що збільшення жорсткості артерій може бути самостійним фактором, який призводить до порушення діастолічної функції ЛШ незалежно від наявності або ступеня ГЛШ та рівня АТ [4, 23]. Незалежне значення величини ШППХе для виникнення мікроальбумінурії було продемонстровано у декількох дослідженнях [16, 28, 57, 66]. При цьому ураження аорти розглядається і як ознака ураження органа-мішені при АГ (тобто йде паралельний процес змін і в судинах, і в серці, і в нирках), і як патогенетичний фактор для збільшення ступеня ураження інших органів-мішеней.
/35.jpg)
Антагоністи кальцію та інгібітори АПФ позитивно впливають на жорсткість артерій незалежно від їх впливу на тиск розтягування (залежить від рівня АТ) [36, 37, 48 58, 63]. Ступінь впливу інгібіторів АПФ на артерії може бути частково генетично детермінованим. Так, поліморфізм гена ангіотензину ІІ типу 1 рецепторів впливає на можливість периндоприлу знижувати АТ та ШППХ [6, 58]. У пацієнтів із кінцевою стадією ниркової недостатності периндоприл і нітрендипін однаково знижували АТ, ШППХ та Аіх, але тільки периндоприл зменшував ГЛШ [36, 55].
Відсутність впливу комбінації на ТКІМ та гомілково-плечовий індекс пояснюються декількома факторами. По-перше, дані показники є маркерами не тільки ураження судин при АГ, але і маркерами атеросклерозу, а викликати переконливий зворотний розвиток атеросклеротичного ураження до сих пір вдавалося тільки статинам. Інші препарати лише запобігають його прогресуванню. У дослідженні ELSA було показано, що лацидипін порівняно з атенололом зміг лише сповільнити збільшення величини ТКІМ, але не викликав її зменшення [72]. По-друге, ТКІМ залежить від віку, індексу маси тіла, фізичної активності, особливостей харчування, наявності шкідливих звичок та дисліпідемії. Відповідно, вплинути на цей показник можливо через зміни усіх цих факторів. По-третє, можливо, через вищеперераховані причини наразі немає на відміну від ураження інших органів-мішеней даних, згідно з якими регрес величини ТКІМ асоціюється зі зменшенням частоти виникнення кардіоваскулярних ускладнень. Це підтверджують результати дослідження ELSA і метааналізу Р. Costanzo і співавт. [10, 72]. Тобто збільшення ТКІМ корелює з прогнозом, а зменшення — ні. Тому важливим результатом нашого дослідження було те, що величина ТКІМ не збільшувалася на фоні лікування. По-четверте, визначення товщини стінки сонних артерій за допомогою ультразвуку у В-режимі не є дуже чутливим методом для визначення тонких змін, що знаходять при проведенні експериментальних досліджень [19].
Отже, можна констатувати, що наше дослідження підтвердило високу ефективність фіксованої комбінації периндоприл + амлодипін щодо всебічного контролю АТ та забезпечення регресу таких показників ураження органів-мішеней, як гіпертрофія та діастолічна дисфункція ЛШ, ШППХе і мікроальбумінурія.
Обмеження дослідження
Проведене дослідження мало певні обмеження. По-перше, воно було одноцентровим і включало невелику кількість пацієнтів. Проте статистичні методи обробки результатів були валідними для даної кількості пацієнтів. По-друге, дослідження не було сліпим щодо прийому препарату, однак участь усіх фахівців, які проводили інструментальні методи дослідження, обмежувалася тільки проведенням конкретного дослідження, і вони не були прямо зацікавлені у позитивних результатах і не призначали антигіпертензивну терапію. По-третє, ми не мали групи порівняльної терапії. Можливо, що призначення іншої терапії також призводило б до регресу ураження органів-мішеней та забезпечувало якісний контроль АТ. Але ці результати є даними лише частини дослідження EPHES, метою якого було не просто оцінити ефективність фіксованої комбінації периндоприл + амлодипін, а порівняти, як відбувається регрес ураження органів-мішеней у хворих на АГ з ІХС або без неї. Для цього пацієнти мали отримувати відносно схожу антигіпертензивну терапію. Такою терапією стало застосування фіксованої комбінації периндоприл + амлодипін, що показана як хворим на АГ, так і хворим на ІХС [1].
Спеціальна подяка та конфлікт інтересів
Проведення дослідження стало можливим завдяки освітньому гранту, наданому компанією «Серв’є Україна» (Франція). Автори цієї статі не отримували грошової винагороди при проведенні даного дослідження. Автори Г.Д. Радченко та Ю.М. Сіренко отримували грошові винагороди від компанії «Серв’є Україна» (Франція) за проведення освітніх лекцій для лікарів.
Висновки
1. Лікування за допомогою фіксованої комбінації периндоприл + амлодипін (у дозах від 5/5 мг/добу до 10/10 мг/добу) пацієнтів із помірною або тяжкою АГ, уперше виявленою або на фоні недостатньо ефективної попередньої терапії, забезпечувало досягнення цільового рівня САТ і ДАТ у 60 % випадків на етапі 6 тижнів. Додавання індапаміду 1,5 мг/добу (n = 12) та бісопрололу (n = 1) забезпечило контроль офісного САТ і ДАТ у 100 % пацієнтів на етапі 6 місяців лікування.
2. Зниження офісного АТ супроводжувалося достовірним зменшенням середньодобового, денного та нічного АТ відповідно на 22,3 ± 0,1 мм рт.ст., 19,6 ± 0,4 мм рт.ст., 26,1 ± 0,2 мм рт.ст. та 8,2 ± 0,2 мм рт.ст., 8,4 ± 0,1 мм рт.ст., 7,9 ± 0,1 мм рт.ст. і досягненням цільового середньодобового АТ у 98,7 % пацієнтів. При цьому зменшилась частка пацієнтів, які характеризувалися як «нон-діппери», із 50 до 23,3 % та варіабельність денних САТ/ДАТ та нічного САТ. Частка пацієнтів із величиною ранкового підйому САТ понад 55 мм рт.ст. достовірно зменшилося з 60 до 20 %.
3. Центральний САТ на фоні призначеного лікування, що базувалося на фіксованій комбінації периндоприл + амлодипін, достовірно знизився з 142,8 ± 2,5 мм рт.ст. до 118,3 ± 2,7 мм рт.ст. (Р < 0,001). Паралельно відбулося достовірне (Р < 0,001) зменшення індексу приросту з 26,8 ± 1,9 % до 11,2 ± 1,7 %.
4. Ефективна щодо зниження офісного, амбулаторного та центрального АТ терапія протягом року сприяла достовірному регресу ураження органів-мішеней: зменшенню гіпертрофії ЛШ, рівня альбумінурії, покращенню діастолічної функції ЛШ та пружно-еластичних властивостей аорти.
5. Зміни діастолічної функції ЛШ та рівня альбумінурії достовірно та незалежно від змін рівня АТ (і офісного, і центрального) корелювали зі змінами таких показників, як ШППХе та Аіх75.
6. Проведена антигіпертензивна терапія на основі фіксованої комбінації периндоприл + амлодипін добре переносилася хворими: частота побічних реакцій становила лише 6,5 %, а кількість пацієнтів із такими скаргами, як головний біль, запаморочення та болі в ділянці серця, достовірно зменшилася з 56,7; 16,7 та 23,3 % до 6,7, 0 та 3,3 % відповідно.
Список литературы
1. Компендіум. Лікарські засоби / За ред. акад. В.М. Коваленка та проф. А.П. Вікторова. — К.: Моріон, 2010. — С. Л219.
2. Настанова та клінічний протокол надання медичної допомоги «Артеріальна гіпертензія». Наказ МОЗ України № 384 від 24.05.2012. — К., 2012. — 107 с.
3. 2013 ESH/ESC Guidelines for the management of arterial hypertension The Task Force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC) // J. Hypertension. — 2013. — Vol. 31. — P. 1281-1357.
4. Agoşton-Coldea L., Mocan T., Bobar C. Arterial stiffness and left ventricular diastolic function in the patients with hypertension // Rom. J. Intern. Med. — 2008. — Vol. 46(4). — P. 313-321.
5. Anavekar N., McMurray J., Velazquez E. et al. Relation between Renal Dysfunction and Cardiovascular Outcomes after Myocardial infarction // N. Engl. J. Med. — 2004. — Vol. 351. — P. 1285-1295.
6. Balkestein E.J., Staessen J.A., Wang J.G. et al. Carotid and femoral artery stiffness in relation to three candidate genes in a white population // Hypertension. — 2001. — Vol. 38. — P. 1190-1197.
7. Bella J., Palmieri V., Roman M. et al. Mitral ratio of peak early to late diastolic filling velocity as a predictor of mortality in middle-aged and elderly adults. The Strong Heart Study // Circulation. — 2002. — Vol. 105. — P. 1928-1933.
8. Brown D., Giles W., Croft J. et al. Left Ventricular Hypertrophy as a Predictor of Coronary Heart Disease Mortality and the Effect of Hypertension // Am. Heart J. — 2000. — Vol. 140. — P. 1212-1223.
9. Сhironi A., Simon A. The prognostic value of carotid intima-media thickness revisited // Archives of Cardiovascular Diseases. — 2013. — Vol. 106. — P. 1-3.
10. Costanzo P.1, Perrone-Filardi P., Vassallo E. et al. Does carotid intima-media thickness regression predict reduction of cardiovascular events? A meta-analysis of 41 randomized trials // J. Am. Coll. Cardiol. — 2010. — 56. — P. 2006-20.
11. Dahlof B., Devereux R., Kjeldsen S. et al. for the LIFE Study Group. Cardiovascular morbidity and mortality in losartan interventional for endpoint reduction in hypertension study (LIFE): a randomized trial against atenolol // Lancet. — 2002. — Vol. 359. — P. 995-1003.
12. Dahlöf B.1, Sever P.S., Poulter N.R. et al. Prevention of cardiovascular events with an antihypertensive regimen of amlodipine adding perindopril as required versus atenolol adding bendroflumethiazide as required, in the Anglo-Scandinavian Cardiac Outcomes Trial-Blood Pressure Lowering Arm (ASCOT-BPLA): a multicentre randomised controlled trial // Lancet. — 2005. — Vol. 366(9489). — P. 895-906.
13. De Loach S.S., Townsend R.R. Vascular stiffness: its measurement and significance for epidemiologic and outcome studies // Clin. J. Am. Soc. Nephrol. — 2008. — Vol. 3(1). — P. 184-192.
14. Devereux R., Wachtell K., Gerdts E. et al. Prognostic significance of left ventricular mass change during treatment of hypertension // JAMA. — 2004. — Vol. 292(19). — P. 2350-2356.
15. Dinicolantonio J.J.1, Lavie C.J., O’Keefe J.H. Not all angiotensin-converting enzyme inhibitors are equal: focus on ramipril and perindopril // Postgrad. Med. — 2013. — Vol. 125(4). — P. 154-168.
16. Dong I. Shin, Ki-Bae Seung, Hye Eun Yoon, Byung-Hee Hwang et al. Microalbuminuria is Independently Associated with Arterial Stiffness and Vascular Inflammation but not with Carotid Intima-Media Thickness in Patients with Newly Diagnosed Type 2 Diabetes or Essential Hypertension // J. Korean Med. Sci. — 2013. — Vol. 28. — P. 252-260.
17. Epstein M., Tobe S. What is the optimal strategy to intensify blood pressure control and prevent progression of renal disease? // Current Hypertension Reports. — 2001. — Vol. 3. — P. 422-428.
18. Foppa M., Duncan B., Rohde L. Echocardiography-based left ventricular mass estimation. How should we define hypertrophy? // Cardiovasc Ultrasound. — 2005. — Vol. 3. — P. 17.
19. Froukje L. Ubels, Willem F. Terpstra and Andries J. Smit Carotid intima-media thickness: influence of drug treatment and clinical implications // Neth. J. Med. — 1999. — Vol. 55. — P. 188-195.
20. Gall M.A. et al. Albuminuria and poor glycemic control predict mortality in NIDDM // Diabetes. — 1995. — Vol. 44. — P. 1303-1309.
21. Gosse Ph., Sheridan D., Zannad F. et al. on behalf of the LIVE investigators. Regression of left ventricular hypertrophy in hypertensive patients treated with indapamide SR 1.5 mg versus enalapril 20 mg: the LIVE study // Journal of Hypertension. — 2000. — Vol. 18. — P. 1465-1475.
22. Ibsen H.1, Olsen M.H., Wachtell K. et al. Reduction in albuminuria translates to reduction in cardiovascular events in hypertensive patients: losartan intervention for endpoint reduction in hypertension study // Hypertension. — 2005. — Vol. 45(2). — P. 198-202.
23. Jaroch J., Łoboz Grudzień K., Bociąga Z. et al. The relationship of carotid arterial stiffness to left ventricular diastolic dysfunction in untreated hypertension // Kardiol. Pol. — 2012. — Vol. 70(3). — P. 223-231.
24. Kannel W., Cobb J. Left ventricular hypertrophy and mortality: results from the Framingham Study // Cardiology. — 1992. — Vol. 81. — P. 291-298.
25. Kannel W., Levy D., Cupples L. Left ventricular hypertrophy and risk of cardiac failure: insights from the Framingham Study // J. Cardiovasc Pharmacol. — 1987. — Vol. 10, Suppl. 6. — P. 135-140S.
26. Kario K., Pickering T., Umeda Y. et al. Morning surge in blood pressure as a predictor of silent and clinical cerebrovascular disease in elderly hypertensives: a prospective study // Circulation. — 2003. — Vol. 107(10). — P. 1401-1416.
27. Kass D., Bronzwaer J., Paulus W. What mechanisms underlie diastolic dysfunction in heart failure// Circulation Resarch. — 2004. — Vol. 94. — P. 1533-1542.
28. Kim B.J., Lee H.A., Kim N.H. et al. The association of albuminuria, arterial stiffness, and blood pressure status in nondiabetic, nonhypertensive individuals // J. Hypertens. — 2011. — Vol. 29(11). — P. 2091-2098.
29. Klag M.J., Whelton P.K., Randall B.L. et al. Blood pressure and end-stage renal disease in men // N. Engl. J. Med. — 1996. — Vol. 334. — P. 13-18.
30. Koren M.J., Devereux R.B., Casale P. et al. Relation of left ventricular mass and geometry to morbidity and mortality in uncomplicated essential hypertension // Ann. Intern. Med. — 1991. — Vol. 114. — P. 345-352.
31. Krysiak R.1, Okopień B. Pleiotropic effects of angiotensin-converting enzyme inhibitors in normotensive patients with coronary artery disease // Pharmacol. Rep. — 2008. — Vol. 60(4). — P. 514-523.
32. Laurent S., Boutouyrie P., Asmar R. et al. Aortic stiffness is an independent predictor of all-cause and cardiovascular mortality in hypertensive patients // Hypertension. — 2001. — Vol. 37. — P. 1236-1241.
33. Levey A., Stevens L., Schmid C. et al. CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration). A new equation to estimate glomerular filtration rate // Ann. Intern. Med. — 2009. — Vol. 150(9). — P. 604-612.
34. Levy D. Prognostic implications of echocardiographically determined left ventricular mass in the Framingham Heart Study // N. Engl. J. Med. — 1990 — Vol. 322. — P. 1561-1566.
35. Levy D., Larson M., Vasan R. et al. The progression from hypertension to congestive heart failure // JAMA. — Vol. 275. — P. 1557-1562.
36. London G.M., Pannier B., Guerin A.P. et al. Cardiac hypertrophy, aortic compliance, peripheral resistance, and wave reflection in end-stage renal disease: comparative effects of ACE inhibition and calcium channel blockade // Circulation. — 1994. — Vol. 90. — P. 2786-2796.
37. Mahmud A., Feely J. Reduction in arterial stiffness with angiotensin II antagonist is comparable with and additive to ACE inhibition // Am. J. Hypertens. — 2002. — Vol. 15. — P. 321-325.
38. Mancia G., Carugo S., Grassi G. et al. Prevalence of Left Ventricular Hypertrophy in Hypertensive Patients Without and With Blood Pressure Control Data From the PAMELA Population // Hypertension. — 2002. — Vol. 39. — P. 744-749.
39. McEniery C., Yasmin, McDonnell B. et al. on behalf of the ACCT Investigators. Central pressure: variability and impact of cardiovascular risk factors. The anglo-cardiff collaborative trial II // Hypertension. — 2008. — Vol. 51. — P. 1476-1482.
40. Mitchell G.F., Hwang S.J., Vasan R.S. et al. Arterial stiffness and cardiovascular events: the Framingham Heart Study // Circulation. — 2010. — Vol. 121(4). — P. 505-511.
41. Mogensen C.E.1, Viberti G., Halimi S. et al. Effect of low-dose perindopril/indapamide on albuminuria in diabetes: preterax in albuminuria regression: PREMIER // Hypertension. — 2003. — Vol. 41(5). — P. 1063-1071.
42. Мorgan T., Lauri J., Bertram D., Anderson A. Effect of diffe-rent antihypertensive drug classes on central aortic pressure // Am. J. Hypertens. — 2004. — Vol. 17. — P. 118.
43. Morillas P., Cordero A., Bertomeu V. et al. Prognostic value of low ankle-brachial index in patients with hypertension and acute coronary syndromes // J. Hypertens. — 2009. — Vol. 27(2). — P. 341-347.
44. Moser M., Herbert P. Prevention of disease progression, left ventricular hypertrophy and congestive heart failure in hypertension treatment trials // J. Am. Coll. Cardiol. — 1996. — Vol. 27. — P. 1214-1218.
45. Nair S., Malik R., Khattar R. Carotid intima-media thickness: ultrasound measurement, prognostic value and role in clinical practice // Postgrad. Med. J. — 2012. — Vol. 88(1046). — P. 694-699.
46. National Kidney Foundation. Clinical Practice Guidelines for Chronic Kidney Disease: evaluation, classification and stratification. Executive summary. — New York: K/DOQI Learning System (KLS) TM, 2002. — 94 p.
47. Palmieri V. Reliability of echocardiographic assessment of left ventricular structure and function: the PRESERVE study. Prospective Randomised Study Evaluating Regression of Ventricular enlargement // J. Am. Coll. Cardiol. — 1999. — Vol. 34. — P. 1625-1632.
48. Pannier B.M., Guerin A.P., Marchais S.J., London G.M. Different aortic reflection wave responses following long-term angiotensin-converting enzyme inhibition and beta-blocker in essential hypertension // Clin. Exp. Pharmacol. Physiol. — 2001. — Vol. 28. — P. 1074-1077.
49. Patel A.; ADVANCE Collaborative Group et al. Effects of a fixed combination of perindopril and indapamide on macrovascular and microvascular outcomes in patients with type 2 diabetes mellitus (the ADVANCE trial): a randomised controlledtrial // Lancet. — 2007. — Vol. 370. — P. 829-840.
50. Poirier P., Bogaty P., Garneau C. Diastolic dysfunction in normotensive men with well-controlled type 2 diabetes // Diabetes Care. — 2001. — Vol. 24. — P. 5-10.
51. Preston Mason R. Pleiotropic Effects of Calcium Channel Blockers // Curr. Hypertens Rep. — 2012. — Vol. 14(4). — P. 293-303.
52. Pritchett A., Mahoney D., Jabsen S. et al. Diastolic Dysfunction and left atrial volume. Population-Based Study // Am. Coll. Cardiol. — 2005. — Vol. 45. — P. 87-92.
53. Ritz E., Menne J., Haller H. Prevalence of microalbuminuria in type 2 diabetes: lessons learnedfrom the ROADMAP study // Nephrol. Dial. Transplant. — 2012. — Vol. 27, Suppl 4. — P. 28-30.
54. Roman M., Devereux R., Kizer J. et al. High Central Pulse Pressure Is Independently Associated With Adverse Cardiovascular Outcome The Strong Heart Study // J. Am. Coll. Cardiol. — 2009. — Vol. 54. — P. 1730-173.
55. Roman M.J., Ganau A., Saba P.S. et al. Impact of arterial stiffening on left ventricular structure // Hypertension. — 2000. — Vol. 36. — P. 489-494.
56. Rothwell P., Howard S.C., Dolan E. et al. ASCOT-BPLA and MRC Trial Investigators Prognostic significance of visit-to-visit variability, maximum systolic blood pressure, and episodic hypertension // Lancet. — 2010. — Vol. 375. — P. 895-905.
57. Ryotaro Bouchi, Tetsuya Babazono, Michino Mugishima et al. Arterial Stiffness Is Associated With Incident Albuminuria and Decreased Glomerular Filtration Rate in Type 2 Diabetic Patients // Diabetes Care. — 2011. — Vol. 34. — P. 2570-2575.
58. Safar M. Macro- and Microcirculation in Hypertension. —London: Lippincott Williams & Wilkins, 2005. — 151 p.
59. Segura J., Campo C., Ruilope L. Effect of proteinuria and glomerular filtration rate on cardiovascular risk in essential hypertension // Kidney International. — 2004. — Vol. 66. — P. S45- S49.
60. Smulyan H., Lieber A., Safar M.E. Hypertension, Diabetes Type II, and Their Association: Role of Arterial Stiffness // Am. J. Hypertens. — 2015. — Jul 8. pii: hpv107. [Epub ahead of print]
61. Stein J., Korcarz C., Hurst R. et al. American Society of Echocardiography Carotid Intima-Media Thickness Task Force. Use of carotid ultrasound to identify subclinical vascular disease and evaluate cardiovas — cular disease risk: a consensus statement from the American Society of Echocardiography carotid intima-media thickness task force endorsed by the society of vascular medicine // J. Am. Society Echoc. — 2008. — Vol. 21(2). — P. 93-111.
62. The CAFE Investigators, for the Anglo-Scandinavian Cardiac Outcomes Trial (ASCOT) Investigators CAFE Steering Committee and Writing Committee. Differential Impact of Blood Pressure-Lowering Drugs on Central Aortic Pressure and Clinical Outcomes Principal Results of the Conduit Artery Function Evaluation (CAFE) Study // Circulation. — 2006. — Vol. 113. — P. 1213-1225.
63. Tomiyama H., Kimura Y., Sakuma Y. et al. Effects of an ACE inhibitor and a calcium channel blocker on cardiovascular autonomic nervous system and carotid distensibility in patients with mild to moderate hypertension // Am. J. Hypertens. — 1998. — Vol. 11. — P. 682-689.
64. Tsang T., Brnes M., Gersh B. et al. Risk for atrial fibrillation and congestive heart failure in patints ≥ 65 years of age with abnormal left ventricular diastolic relaxation // Am. J. Cardiol. — 2004. — Vol. 93. — P. 54-58.
65. United States Renal Data System. Experts from the 200 US Renal Data System Annual Data Report: Atlas of End Stage Renal Disease in the United States // Am. J. Kidney Dis. — 2000. — Vol. 36. — P. 1-279S.
66. Van den Meiracker, Anton H., Mattace-Raso, Francesco U.S. Large artery stiffness and microalbuminuria: a causal relationship? // Journal of Hypertension. — 2009 — Vol. 27 — P. 1355-1357.
67. Verdecchia P., Reboldi G., Gattobigio R. еt al. Atrial fibrillation in hypertension: predictors and outcome // Hypertens. — 2003. — Vol. 41. — P. 218-223.
68. Viberti G.1, Wheeldon N.M.; Microalbuminuria Reduction With VALsartan (MARVAL) Study Investigators. Microalbuminuria reduction with valsartan in patients with type 2 diabetes mellitus: a blood pressure-independent effect // Circulation. — 2002. — Vol. 106(6). — P. 672-678.
69. Vitolina R., Krauze A., Duburs G., Velena A. Aspects of the amlodipine pleiotropy in biochemistry, pharmacology and clinic // IJPSR. — 2012. — Vol. 3(5). — P. 1215-1232.
70. White W. Blood pressure monitoring in Cardiovascular Medicine and Therapeutics // N. Jersy: Humana Press. — 2001. — P. 308.
71. Zanchetti A., Agabiti-Rosei E., Ambrosioni E. et al. Left ventricular diastolic dysfunction in cohort of hypertensive patients attending hospital outpatient clinic in Italy, the APROS-DIADYS project // J. Hypertens. — 2006. — Vol. 24, Suppl. 6. — P. 41.
72. Zanchetti А., Gene Bond М., Hennig М. et al. Calcium Antagonist Lacidipine Slows Down Progression of Asymptomatic Carotid Atherosclerosis Principal Results of the European Lacidipine Study on Atherosclerosis (ELSA), a Randomized, Double-Blind, Long-Term Trial // Circulation. — 2002. — Vol. 106. — P. 2422-2427.

/29.jpg)
/30.jpg)
/31.jpg)
/32.jpg)
/34.jpg)
/33.jpg)
/35.jpg)
/36.jpg)