Журнал «Здоровье ребенка» 2 (61) 2015
Вернуться к номеру
Тоцилізумаб у лікуванні ювенільного ревматоїдного артриту.
Авторы: Бережний В.В., Марушко Т.В., Герман О.Б., Марушко Є.Ю.
Національна медична академія післядипломної освіти ім. П.Л. Шупика, м. Київ
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
У розвитку ревматичних хвороб, особливо при ювенільному ревматоїдному артриті, доведена важлива роль окремих цитокінів, найважливішими серед яких є інтерлейкін-1, інтерлейкін-6 та фактор некрозу пухлини α. Новим словом у лікуванні даної групи хвороб є імунобіологічні препарати. Препарат гуманізованих антитіл проти рецепторів інтерлейкіну-6 тоцилізумаб є високоефективним та безпечним засобом для лікування системної та поліартикулярної форми ювенільного ревматоїдного артриту.
В развитии ревматических болезней, особенно при ювенильном ревматоидном артрите, доказана важная роль отдельных цитокинов, важнейшими среди которых являются интерлейкин-1, интерлейкин-6 и фактор некроза опухоли α. Новым словом в лечении данной группы болезней являются иммунобиологические препараты. Препарат гуманизированных антител против рецепторов интерлейкина-6 тоцилизумаб является высокоэффективным и безопасным средством для лечения системной и полиартикулярной формы ювенильного ревматоидного артрита.
In the development of rheumatic diseases, especially juvenile rheumatoid arthritis, the important role of some cytokines, most important of which are interleukin-1, interleukin-6 and tumor necrosis factor α, has been proved. A step forward in the treatment of this group of diseases is immunobiological products. The preparation of humanized anti-interleukin-6 receptor antibodies tocilizumab is highly effective and safe agent for the treatment of systemic and polyarticular forms of juvenile rheumatoid arthritis.
ювенільний ревматоїдний артрит, лікування, тоцилізумаб.
ювенильный ревматоидный артрит, лечение, тоцилизумаб.
juvenile rheumatoid arthritis, treatment, tocilizumab.
Статья опубликована на с. 151-157
Ювенільний ідіопатичний артрит розглядається як узагальнююче поняття, що об’єднує гетерогенну групу хронічних захворювань суглобів у дітей, які мають різний етіопатогенез та імуногенетичне походження, різну нозологічну приналежність і неодно–значний прогноз (ILAR, 1997).
При класифікації прийнято ювенільні артрити, наведені в рубриці М.08 і М.09-Х, розділяти:
— ювенільний ревматоїдний артрит (ЮРА, М08.0);
— ювенільний псоріатичний артрит (ЮПА, M09.0);
— ювенільний хронічний артрит (ЮХА) неуточненої нозологічної приналежності (серонегативний поліартрит, М08.3);
— ювенільний анкілозуючий спондилоартрит (ЮАС, М08.1);
— артрит при запальних захворюваннях кишечника (неспецифічний ентероколіт, хвороби Крона і Уіппла, M09.1);
— ювенільний артрит із системним початком (М08.2);
— ювенільний артрит із пауціартикулярним початком (М08.4);
— інші ювенільні артрити (М08.8);
— юнацький артрит при хворобах, що класифікуються в інших рубриках (М09).
Ювенільний ревматоїдний артрит є збірним поняттям, що включає в себе всі випадки артриту з дебютом у віці до 16 років, тривалістю понад 6 тижнів та виключеними іншими причинами ураження суглобів.
У 30–50 % хворих після 3–5 років хвороби розвивається інвалідність. Розвиток інвалідності серед дітей, хворих на ЮРА, та зниження працездатності в дорослому віці є найважливішим соціально-економічним наслідком цього захворювання. Залежно від гостроти процесу формування фізичних уражень може відбуватися на ранній стадії захворювання, що потребує вчасного та ефективного лікування. Важливо, щоб дітям із ЮРА діагноз було встановлено на ранній стадії захворювання, початкове лікування було призначено лікарем загальної практики і діти були оперативно скеровані до дитячого кардіоревматолога. Через відносно низьку поширеність ЮРА серед дитячого населення в цілому лікарі часто мають мало досвіду з діагностики або лікування цієї патології. Точна та рання діагностика, а також відповідний менеджмент необхідні для максимізації результатів лікування пацієнтів та підтримання високої якості їхнього життя.
Приблизно у 20 % дітей, хворих на ЮРА, базисна початкова терапія DMARD (протиревматичні лікарські засоби, що модифікують перебіг захворювання) залишається неефективною. Таким хворим потрібна своєчасна зміна лікування залежно від клінічної ситуації та використання ефективних схем лікування із застосуванням сучасних засобів біологічної терапії.
Захворюваність та поширеність ЮРА в різних країнах коливається від 2 до 20 та від 16 до 150 на 100 000 дітей відповідно [15]. У середньому частота даного захворювання становить » 1 : 1000 серед дитячого населення. Серед дітей України віком 0–17 років, за даними МОЗ України, захворюваність та поширеність ЮРА відповідно становлять 0,05 та 0,34 на 1000 дитячого населення [2]. Згідно з класифікацією Міжнародної ліги ревматичних асоціацій (ILAR), ЮРА поділяється на 7 підгруп: олігоартрит персистуючий, олігоартрит поширений, поліартрит із негативним ревматоїдним фактором, поліартрит із позитивним ревматоїдним фактором, ентезит-асоційований артрит, псоріатичний артрит та системна форма ЮРА [14].
Частота системної форми ЮРА серед усіх випадків захворювання становить, за різними даними, від 4 до 17 %. Критеріями хвороби є поєднання артриту, фебрильної лихоманки тривалістю понад 2 тижні, під час яких мінімум протягом 3 днів вона мала інтермітуючий характер, та ³ 1 із таких ознак: еритематозний висип, що з’являється або посилюється на висоті підйому температури тіла та зникає або тьмяніє при її зниженні; серозити (ексудативний плеврит та/або перикардит); полілімфаденопатія, гепатоспленомегалія [14].
Перебіг системної форми ЮРА у 5–8 % випадків характеризується розвитком ускладнення, що загрожує життю хворого, — синдрому активації макрофагів (вторинного гемофагоцитарного лімфогістіоцитозу). Синдром характеризується гіпер–активацією ретикуло-ендотеліальної системи із розвитком гемофагоцитозу незрілих клітин крові в кістковому мозку та низкою клініко-лабораторних проявів: лихоманкою, енцефалопатією, ураженням печінки, поліцитопенією, коагулопатією з кровотечами, гіпертригліцеридемією, гіпертрансферинемією, гіпофібриногенемією і, як наслідок, зниженням або нормалізацією швидкості осідання еритроцитів, яке не вписується в картину загострення системної форми ЮРА [9]. Смертність від даного ускладнення становить, за даними різних авторів, 8–22 % [17].
Крім того, тривалий неконтрольований перебіг системної форми ЮРА може призвести до розвитку реактивного амілоїдозу. Патогенетичним чинником наведеного ускладнення є гіперпродукція печінкою гострофазового реактанту сироваткового амілоїду А під впливом прозапальних цитокінів, який через недостатність розщеплення макрофагами інфільтрує паренхіматозні органи. Перш за все уражаються нирки з розвитком протеїнурії, що при прогресуванні захворювання переходить у хронічну ниркову недостатність. Окрім нирок, відкладання амілоїду АА має місце в міокарді серця, печінці, кишечнику. Біопсія уражених органів, найчастіше нефробіопсія, дозволяє виявити амілоїд у їх інтерстиції при зафарбуванні в конго червоний при поляризованому світлі. Тривалість життя хворих на системну форму ЮРА, ускладнену реактивним амілоїдозом, протягом 5 та 10 років становить 88 та 75 % відповідно [12].
Згідно з сучасними уявленнями, системна форма ЮРА є захворюванням, що кардинально відрізняється від інших представників даної нозології. Так, усі форми ЮРА, окрім наведеної, належать до авто–імунних захворювань, що перебігають за типом автоантиген-стимульованої імунної відповіді та виникають унаслідок патології системи набутого імунітету. Системна ж форма ЮРА за патогенезом являє собою автозапальну хворобу, що виникає через генетично обумовлені відхилення системи вродженої імунної відповіді та, принаймні з боку системних проявів, не пов’язана з автоімунізацією. Патологія каскаду утворення, функціонування та регуляції інфламасоми (особливого білкового комплексу в макрофагах і нейтрофілах, що призводить до запуску запальної реакції при контакті клітини з мікроорганізмами і відіграє важливу роль у системі вродженого імунітету) є центральною ланкою патогенетичного механізму при системній формі ЮРА. Внаслідок недостатності обмежуючих регуляторних механізмів у даних хворих відсутня супресія синтезу прозапальних цитокінів, що призводить до безконтрольної гіперпродукції інтерлейкіну-1 (ІЛ-1) та ІЛ-6 та до так званої цитокінової бурі.
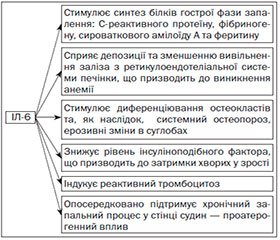
Серед представників цитокінового ряду ІЛ-6 відіграє одну з ключових ролей у патогенезі системної форми ЮРА. Що стосується історичних даних, то ІЛ-6 уперше був описаний у 1980 р. як синтезований Т-клітинами прозапальний цитокін. Єдиною його роллю вважалася індукція диференціювання В-клітин у синтезуючі антитіла плазмоцити, що має вирішальне значення для виникнення гуморальної імунної відповіді при інфекційних захворюваннях. На сьогодні відомо, що ІЛ-6 синтезується Т-хелперами 2-го типу й макрофагами та, крім указаного впливу на В-лімфоцити, має низку інших властивостей, що особливо яскраво реалізуються при автоімунних процесах (рис. 1).
Всі вищезазначені ефекти гіперпродукції ІЛ-6 відповідають клінічним спостереженням за хворими на системну форму ЮРА та є потужним доказом ключової ролі даного цитокіну в екстраартикулярних проявах захворювання. На відміну від ІЛ-1 та фактора некрозу пухлини a (ФНП-a) підвищення рівня ІЛ-6 має часову кореляцію з піками лихоманки у хворих на системний ЮРА. Крім того, підвищені рівні ІЛ-6 спостерігаються в синовіальній рідині хворих на ЮРА, що вказує на роль даного цитокіну у хронічному запаленні синовіальної оболонки [5]. В умовах автоімунного процесу гіперпродукція ІЛ-1 також пояснює деякі клінічні прояви у хворих на системний ЮРА на кшталт лихоманки та лейкемоїдної реакції нейтрофільного типу, що важко пояснити тільки підвищеними рівнями ІЛ-6. Хоча, за даними літератури, у крові хворих на системну форму ЮРА не було виявлено прямої кореляційної залежності між температурними піками та рівнем ІЛ-1. У багатьох дослідженнях доведена здатність цього цитокіну стимулювати синтез ІЛ-6, що вказує на очевидну роль ІЛ-1 у патогенезі даного захворювання [5]. Фактор некрозу пухлини a має ключове значення в патогенезі ураження суглобів при всіх формах ЮРА, проте не має прямого відношення до системних проявів захворювання [5]. Таким чином, ІЛ-6 серед прозапальних цитокінів відіграє найважливішу роль у патогенезі системної форми ЮРА. Крім того, ІЛ-6 відіграє важливу роль у патогенезі запального ураження суглобів при всіх формах ЮРА, а отже, супресія його дії проявляється у зменшенні інтенсивності суглобового синдрому [7].
Лікування системної форми ЮРА проводиться згідно з «Уніфікованим клінічним протоколом медичної допомоги дітям, хворим на ювенільний артрит», затвердженим наказом МОЗ України № 832 від 22.10.12. Так, при легкому перебігу захворювання можна використовувати монотерапію нестероїдними протизапальними препаратами, проте якщо не вдається повністю контролювати захворювання, дана терапія через місяць підлягає ескалації. За наявності системних проявів хвороби (як з артритом, так і без артриту) стандартним стартовим підходом до лікування є призначення глюкокортикоїдів (ГК) та комбінації із метотрексатом [3]. Дана комбінована терапія є ефективною у близько 90 % дітей із системною формою ЮРА. Однак майже в 10 % пацієнтів наведене лікування не дає змоги достатньо контролювати хворобу. Крім того, перебіг основного захворювання призводить до затримки в рості, затримки статевого розвитку та виникнення остеопенічного синдрому, до того ж тривале використання ГК у цих пацієнтів поглиблює відмічені зміни.
Згідно з «Уніфікованим клінічним протоколом медичної допомоги дітям, хворим на ювенільний артрит», пацієнтам із ЮРА, у яких хворобомодифікуючі протиревматичні препарати та протизапальна терапія є недостатньо ефективними, в комплексному лікуванні призначаються імунобіологічні препарати (ІБП). ІБП є ліками, що мають органічне походження та цілеспрямовано направлені на інгібування дії конкретних біологічно активних молекул в організмі людини з метою імуносупресії (так звана «таргетна» імуносупресивна терапія). Діюча речовина представників даної групи може містити аналогічні природним протеїни — інгібітори цитокінів (анакінра); зливні протеїни, отримані шляхом сполучення природного протеїну-інгібітору та Fc-фрагменту людського IgG для збільшення тривалості їх циркуляції (етанерцепт, абатацепт, рилонацепт); химерні антитіла, отримані шляхом сполучення Fab-фрагменту специфічного антитіла з сироватки імунізованих до таргетної сполуки мишей та Fc-фрагменту людського IgG (інфліксимаб, тоцилізумаб, ритуксимаб); рекомбінантні нейтралізуючі людські антитіла (адалімумаб, канакінумаб); пегільовані людські нейтралізуючі антитіла, що мають тривалий період циркуляції (цертолізумаб пегол). За напрямком дії ІБП можна поділити на інгібітори ФНП-a (етанерцепт, інфліксимаб, адалімумаб, голімумаб, цертолізумаб пегол), інгібітори рецепторів ІЛ-1 (анакінра); інгібітори ІЛ-1 (канакінумаб, рилонацепт); інгібітори рецепторів ІЛ-6 (тоцилізумаб); блокатор кофактора стимуляції проліферації Т-лімфоцитів (абатацепт); антитіла до СD20 молекул В-лімфоцитів (ритуксимаб).
Серед імунобіологічних препаратів офіційно дозволеним специфічним для застосування у дітей із системною формою ЮРА є інгібітор рецепторів ІЛ-6 тоцилізумаб. Наведений лікарський засіб являє собою гуманізовані моноклональні антитіла, специфічні до рецепторів ІЛ-6. У клінічній практиці тоцилізумаб відомий під назвою Актемра (Actemra, у країнах Європейського Союзу — RoActemra). Використання тоцилізумабу для терапії ревматоїдного артриту у дорослих почалася з 1997 року. У 2002 році до цих досліджень додалося вивчення застосування препарату при ЮРА. У січні 2009 р. European Medicines Agency, а в січні 2010-го — Food and Drug Administration (FDA, США) ухвалили тоцилізумаб для лікування ревматоїдного артриту у дорослих. У квітні 2011 року тоцилізумаб був затверджений FDA як препарат для терапії системної форми ЮРА у дітей з 2 років. Крім того, нещодавно тоцилізумаб був схвалений FDA як засіб терапії дітей, хворих на ЮРА з поліартритом. Таким чином, на сьогодні тоцилізумаб є першим і єдиним затвердженим засобом у світі для лікування системної форми ЮРА та схвалений для застосування при поліартикулярному перебігу суглобової форми даної нозології.
Що стосується фармакодинаміки препарату, то тоцилізумаб селективно зв’язується з рецепторами до ІЛ-6, як вільно циркулюючими, так і тими, що розташовані на поверхні клітин, та конкурентно інгібує їх. Це призводить до нівелювання ефектів цитокіну, наведених на рис. 1. Наслідком блокування ІЛ-6-опосередкованого сигналу є зникнення системних проявів захворювання, таких як лихоманка та серозити. Під впливом лікування тоцилізумабом блокується гіперактивація ретикулоендотеліальної системи, що проявляється зникненням гепатоспленомегалії, полілімфаденопатії та анемії. Що стосується лабораторних відхилень, то, нівелюючи вплив ІЛ-6 на печінку, даний ІБП сприяє нормалізації показників запалення: швидкості осідання еритроцитів, кількості тромбоцитів, рівня С-реактивного протеїну, фібриногену, феритину крові, сироваткового амілоїду А (останнє вкрай важливо для запобігання розвитку реактивного амілоїдозу) [1]. ІЛ-6 відіграє важливу роль у патогенезі запального ураження суглобів при всіх формах ЮРА, а отже, супресія його дії проявляється у зменшенні інтенсивності суглобового синдрому, це обґрунтовує можливість застосування даного ІБП і при поліартикулярній формі [7].
Призначення тоцилізумабу хворим на ЮРА дає змогу нормалізувати адекватний синтез інсуліноподібного фактора росту 1 печінкою у відповідь на дію соматотропіну гіпофіза, що призводить до запобігання затримці в рості хворого або дає змогу дитині надолужити затримку, яка вже має місце, за умови відкритості зон росту трубчатих кісток скелету. Важливим ефектом лікування тоцилізумабом хворих на ЮРА є блокада гіперактивації остеокластів під дією ІЛ-6, що веде до запобігання остеопорозу або зменшення його вираженості. Наведені ефекти лікування щодо нормалізації процесу росту хворих та збереження мінеральної щільності кісткової тканини є кардинальною перевагою даного ІБП над ГК. На додаток, призначення тоцилізумабу, згідно з даними багатьох досліджень, надає можливість поступово відмінити або зменшити дозу ГК у дітей, хворих на системну форму ЮРА, що само по собі знижує ризик виникнення остеопенічного синдрому та затримки в рості. Поступова відміна ГК на фоні терапії даним ІБП призводить до зникнення ятрогенного синдрому Іценка — Кушинга у цих дітей. Також має місце зменшення вираженості ожиріння та зникнення акне, які на рівні з основним захворюванням та затримкою в рості є додатковими психотравмуючими факторами у хворих, що може призвести до соціальної самоізоляції через почуття неповноцінності навіть за умови повного контролю хвороби за допомогою ГК.
Слід зазначити, що ЮРА, а особливо його системна форма, є потужним фактором ризику раннього розвитку атеросклерозу та його ускладнень унаслідок тривало існуючої ендотеліальної дисфункції на фоні персистуючого запального процесу. Хоча застосування ГК дозволяє зменшити активність хвороби, у той же час дані препарати призводять до ожиріння та дисліпідемії, що мають проатерогенну дію [13]. З іншого боку, лікування тоцилізумабом призводить до зменшення вираженості субклінічного ураження судин у хворих на ЮРА та дає змогу зменшити дозу чи відмінити проатерогенно діючі ГК. Таким чином, додавання тоцилізумабу в комплексну терапію хворих на ЮРА дозволяє запобігти передчасному розвитку серцево-судинних захворювань у цих пацієнтів у дорослому віці.
Фармакокінетика тоцилізумабу в дітей із системною та поліартикулярною суглобовою формами ЮРА була вивчена під час проведення досліджень TENDER та CHERISH. Відомо, що концентрація діючої речовини в плазмі крові, що відповідає ефективній концентрації у дорослих із ревматоїдним артритом, у пацієнтів із ЮРА досягається при внутрішньовенному інфузійному введенні тоцилізумабу в дозі 12 мг/кг при масі тіла дитини менше 30 кг та 8 мг/кг при масі тіла дитини понад 30 кг із частотою 1 раз на 2 тижні. Максимальна разова доза при цьому не перевищує 800 мг. За даними Zhang et al. (2013), концентрація діючої речовини в плазмі крові поступово зростає та досягає плато до 12-го тижня лікування при введенні кожні 2 тижні. Виведення тоцилізумабу включає два механізми: елімінація, пов’язана з утилізацією комплексів «препарат — рецептор до ІЛ-6», що ефективна при низьких сироваткових його концентраціях та є дозозалежною; іншим механізмом є елімінація з кровотоку за допомогою фагоцитозу клітинами ретикулоендотеліальної системи при пересиченні попереднього механізму [21]. Емпірично було визначено, що період виведення Т1/2 тоцилізумабу у хворих на системну форму ЮРА, яким інфузію проводили кожні два тижні, становив 23 дні, тоді як період виведення Т1/2 тоцилізумабу у хворих на поліартикулярну суглобову форму ЮРА, у яких введення препарату відбувалося кожні 4 тижні, становив 16 днів.
Була також вивчена взаємодія тоцилізумабу з іншими препаратами у хворих на ревматоїдний артрит. Так, не було виявлено зміни фармакокінетики метотрексату при одночасному його використанні з тоцилізумабом. Фармакокінетика останнього також не змінювалася при паралельному призначенні нестероїдних протизапальних препаратів, ГК та метотрексату. Оскільки синтез цитохрому Р450 в печінці пригнічується при експозиції до прозапальних цитокінів, лікування тоцилізумабом може підвищувати активність цитохрому, що може проявлятися пришвидшенням виведення ліків, які трансформуються шляхом взаємодії з даною молекулою. Наприклад, упродовж тижня після введення тоцилізумабу у дорослих хворих на ревматоїдний артрит спостерігається на 28 % швидше виведення з організму омепразолу [8, 16].
Клінічна ефективність тоцилізумабу при системній та поліартикулярній суглобовій формах ЮРА була показана в кількох дослідженнях високої якості. Так, подвійне сліпе плацебо-контрольоване рандомізоване дослідження, що включало 56 пацієнтів із системною формою ЮРА, які були рефрактерними до стандартних схем лікування із включенням ГК, при застосуванні тоцилізумабу в дозі 8 мг/кг кожних два тижні, продемонструвало позитивну динаміку із досягненням ACR Pedi 30, 50, 70 у 91, 86 та 68 % пацієнтів відповідно [19]. На основі цих даних японських дослідників тоцилізумаб був затверджений як перший біологічний препарат для лікування ЮРА в Японії.
Найбільш масштабними дослідженнями ефективності та безпечності препарату тоцилізумаб у дітей із ЮРА були клінічні випробування TENDER та CHERISH. Результати першого з них опубліковані De Benedetti et al. у 2012 році. У дослідження увійшли 112 дітей віком 2–17 років, хворих на системну форму ЮРА в активній фазі захворювання тривалістю понад 6 місяців. Дизайн включав фазу І (12 тижнів рандомізованого подвійного сліпого плацебо-контрольованого дослідження), фазу ІІ (92 тижні відкритої фази), фазу ІІІ (3 роки продовження лікування для вивчення відміни препарату у дітей, які досягли фази неактивного захворювання). Тоцилізумаб призначався в дозі 12 мг/кг при масі тіла < 30 кг та 8 мг/кг при масі тіла ³ 30 кг з частотою 1 раз на 2 тижні [6]. Пацієнти були стійкими до стандартних схем лікування, включаючи призначення ГК, у тому числі деякі з них не мали достатнього ефекту від інгібіторів ФНП-a та ІЛ-1.
Значно більш високу відповідь згідно з ACR Pedi 30, 50, 70 відмічали серед основної групи порівняно з групою плацебо (85, 71 та 37 % проти 11, 8 та 5 % відповідно). Особливо показова перевага лікування тоцилізумабом в основній групі порівняно з конт–рольною мала місце при посимптомному порівнянні ефекту на 12-му тижні терапії: персистенція лихоманки — 79 % (контрольна група на плацебо) проти 15 % (основна група на тоцилізумабі), висипання — 89 проти 36 %, анемія — 93 проти 20 % відповідно. При аналізі результатів фази ІІ було встановлено, що ефект від продовження лікування не тільки зберігається, а й покращується на 52-му тижні терапії порівняно з 12-м. Так, значення ACR Pedi 70 було досягнуто у 89 % пацієнтів у кінці ІІ фази дослідження порівняно з 71 % у кінці фази І, ACR Pedi 70 — у 65 порівняно з 37 % на 12-му тижні. Що стосується функціональної спроможності пацієнтів, то вірогідно більша кількість дітей, які отримували тоцилізумаб у комплексній терапії, мали ознаки клінічно значимого підвищення функціональної спроможності згідно з CHAQ-DI порівняно з пацієнтами з групи плацебо (77 проти 19 % відповідно). Слід зазначити, що 31 % дітей із системною формою ЮРА в кінці 104-го тижня комплексної терапії з включенням препарату тоцилізумаб не мали ознак активності захворювання.
Що стосується ГК, то 24 % пацієнтів вже на –12-му тижні було знижено їх дозу не менше ніж на 20 % від вихідного рівня без загострення хвороби згідно з визначенням ACR 30 flare. Дана тенденція зберігалася і протягом фаз ІІ та ІІІ. Так, доза пероральних ГК була знижена в середньому з 0,3 мг/кг/день до 0,06 та 0,04 мг/кг/день за преднізолоном до та в кінці 52-го та 104-го тижня терапії відповідно. При цьому 48 та 60 % хворих на системну форму ЮРА, які отримували тоцилізумаб у комплексній терапії, були повністю відмінені ГК до кінця 52-го та 104-го тижнів лікування відповідно.
Таким чином, дослідження TENDER показало, що застосування тоцилізумабу в комплексній терапії дітей, хворих на системну форму ЮРА, рефрактерних до стандартного лікування, включаючи системну терапію ГК, дозволяє вірогідно знизити активність захворювання, що проявляється значним зменшенням як частоти системних проявів хвороби, так і інтенсивності суглобового синдрому, а в 1/3 дітей — досягти стадії неактивного захворювання. При цьому дане посилення терапії надає змогу вірогідно знизити добову дозу, а в 60 % дітей із системною формою ЮРА — відмінити ГК.
Що стосується довготривалих ускладнень перебігу системної форми ЮРА, то реактивний амілоїдоз з ураженням нирок є стимулом до ескалації терапії для покращення контролю перебігу хвороби та запобігання необоротному ураженню органів-мішеней. Оскільки продукція сироваткового амілоїду А, що є субстратом для утворення амілоїду АА, контролюється ІЛ-6, знижуючи активність даного цитокіну, тоцилізумаб запобігає процесу амілоїдогенезу чи зупиняє його. Три невеликі дослідження типу case-study показали, що даний ІБП може бути адекватним засобом першої лінії в пацієнтів із ревматоїдним артритом та іншими хронічними запальними захворюваннями, ускладненими реактивним амілоїдозом АА, або у хворих із високим ризиком його розвитку [18].
У дослідженні CHERISH увага була сконцентрована на вивченні ефективності та безпечності використання препарату тоцилізумаб у 188 дітей віком 2–17 років, хворих на поліартикулярну суглобову форму ЮРА в стадії активного захворювання, з тривалістю патологічного процесу ³ 6 місяців та недостатнім ефектом від лікування метотрексатом. ІБП призначався в дозі 8 мг/кг при масі тіла ³ 30 кг та 8 або 10 мг/кг при масі тіла < 30 кг 1 раз на 4 тижні. Дослідження складалося з 3 фаз: І фаза — відкрита, тривалістю 16 тижнів; ІІ фаза — подвійне сліпе плацебо-контрольоване дослідження тривалістю 24 тижні; ІІІ фаза — продовження лікування до 64 тижнів [4, 10, 11].
Загалом серед усіх хворих у кінці І фази (16 тижнів) досягли відповіді ACR Pedi 30, 50, 70 та 90 відповідно 89, 83, 62, 26 %. Цікавими виявилися результати визначення частоти досягнення мінімальної відповіді (ACR Pedi 30) при порівнянні дітей, які отримували тоцилізумаб разом із метотрексатом та у монотерапії, що становила 91 та 83 % відповідно, що вказує на ефективність монотерапії тоцилізумабом при лікуванні поліартикулярної суглобової форми ЮРА. Аналіз даних ІІ фази показав, що кількість хворих, які отримували тоцилізумаб та досягли відповіді ACR Pedi 90 на 40-му тижні, зросла з 26 до 45 % порівняно з 16-м тижнем терапії. Кількість пацієнтів, які мали загострення під час ІІ фази дослідження, вірогідно була вищою серед дітей групи плацебо порівняно з хворими, які отримували тоцилізумаб, та становила 48 та 26 % відповідно. Таким чином, згідно з даними дослідження CHERISH, тоцилізумаб у монотерапії або в комбінації з метотрексатом є ефективним засобом у лікуванні дітей, хворих на поліартикулярну суглобову форму ЮРА, які резистентні до терапії метотрексатом.
Останнім часом з’являються дані щодо можливої ефективності тоцилізумабу у хворих з увеїтом автоімунного генезу. Рядом дослідників була показана роль ІЛ-6 у розвитку рефрактерного до стандартного лікування увеїту. За даними T. Yoshimura et al. (2010), у хворих на рефрактерний до лікування увеїт має місце підвищений рівень ІЛ-6 у рідині із склоподібних тіл очей. Крім того, під час експерименту при створенні лабораторних умов, що провокують розвиток увеїту, у мишей із нормальним синтезом ІЛ-6 розвивалося запалення судинної оболонки ока, тоді як у лабораторних мишей з уродженим дефіцитом синтезу ІЛ-6 увеїту не спостерігалося. Як було показано надалі, призначення мишам першої групи з увеїтом інгібітору ІЛ-6 значно покращувало перебіг захворювання. Автори зробили висновок, що ІЛ-6 та його рецептори можуть бути мішенями для терапії у пацієнтів із рефрактерним до стандартного лікування увеїтом [20]. Хоча значущих клінічних досліджень впливу тоцилізумабу на перебіг увеїту на сьогодні бракує, A. Muselier еt al. (2011) у дослідженні типу case-study на прикладі двох пацієнтів із рефрактерним до стандартного лікування та терапії інгібіторами ФНП-a увеїтом показали ефективність тоцилізумабу [19]. Автори даного дослідження припустили, що наведений ІБП може бути використаний у хворих на увеїт, у тому числі ревматоїдний, при неефективності стандартних схем лікування та відсутності достатнього ефекту від призначення інгібіторів ФНП-a, але для рутинної практики це припущення потребує подальшого підтвердження у клінічних дослідженнях високої якості. Проте слід мати на увазі, що у випадках, коли терапія увеїту, заснована на доказовій базі, себе вичерпала, призначення тоцилізумабу може бути шансом таких хворих на запобігання тяжкій непрацездатності, пов’язаній зі сліпотою.
Традиційним питанням для дитячих кардіоревматологів, що не поступається за важливістю питанню ефективності препарату, є його безпечність. Профіль безпеки застосування тоцилізумабу здебільшого отриманий із дослідження TENDER, меншою мірою — з дослідження CHERISH [4, 6, 10, 11]. Найбільш поширеними побічними ефектами були інфекції: гостра респіраторна вірусна інфекція, гастроентерит, середній отит, тонзилофарингіт, стрептококовий сепсис. Що стосується серйозних інфекцій (ті, що потребують госпіталізації), то ризик їх виникнення для дітей, які отримують тоцилізумаб, становить » 11 % на рік. У близько 17 % хворих мала місце нейтропенія (концентрація гранулоцитів < 1 • 109/л) без асоціації з розвитком інфекцій; приблизно у 4 % — тромбоцитопенія (< 100 • 109/л) без виникнення кровотеч. Підвищення рівня печінкових ферментів спостерігалося у 13 % пацієнтів. Загалом, згідно з сучасними уявленнями, при підвищенні рівня АлАТ менше ніж у 3 рази від верхньої межі норми лікування тоцилізумабом не змінюється, при підвищенні в 3–5 разів — доза зменшується наполовину, при підвищенні більше ніж у 5 разів — лікування припиняється до нормалізації показника. У двох дітей мало місце утворення антитоцилізумаб-нейтралізуючих антитіл, в одного з них розвинулась алергічна реакція у вигляді кропив’янки. У трьох випадках під час фази ІІ дослідження TENDER у пацієнтів розвинувся синдром активації макрофагів, проте з огляду на те, що у хворих на системну форму ЮРА даний синдром є характерним ускладненням, вірогідно невідомо, чи існує зв’язок із призначенням тоцилізумабу. Таким чином, профіль безпеки застосування препарату тоцилізумаб є задовільним, а побічні ефекти — здебільшого легкими та середньої тяжкості.
Висновки
1. Призначення препарату тоцилізумаб у комплексному лікуванні дітей, хворих на системну форму ЮРА, які резистентні до стандартної терапії глюкокортикоїдами, у дозі 12 мг/кг при масі тіла < 30 кг та 8 мг/кг при масі тіла ³ 30 кг із частотою 1 раз на 2 тижні дозволяє зменшити активність патологічного процесу, в 1/3 хворих досягти стадії неактивного захворювання, знизити або відмінити глюкокортикоїди та запобігти довготривалим ускладненням.
2. Препарат тоцилізумаб у дозі 8 мг/кг при масі тіла ³ 30 кг та 8 або 10 мг/кг при масі тіла < 30 кг 1 раз на 4 тижні як у монотерапії, так і в комбінації з цитостатиком є ефективним у лікуванні хворих на поліартикулярну форму ЮРА, що резистентні до терапії метотрексатом.
3. Тоцилізумаб може бути засобом першої лінії терапії дітей, у яких перебіг ЮРА ускладнився реактивним амілоїдозом, або в пацієнтів із високим ризиком його виникнення.
4. Профіль безпеки тоцилізумабу є задовільним, переносимість препарату є доброю, а побічні ефекти нечасті та за тяжкістю переважно належать до легких чи середніх. Найчастішими з них є інфекції, гематологічні порушення у вигляді цитопеній та підвищення рівня печінкових ферментів у крові.
Особисті клінічні спостереження
Хлопчик М., 12 років, був направлений на госпіталізацію в кардіоревматологічне відділення в грудні 2013 року. Хворіє на ЮРА з 2006 року. Клінічний діагноз: ЮРА, серонегативний варіант, системна форма з поліартритом, ступінь активності 2–3, помірно-прогресуючий перебіг, рентгенологічна стадія 2, ПФ 2Б. У дебюті хвороби спостерігалась лихоманка, плямиста висипка, поліартрит, високі показники запальної активності (ШОЕ 30–45 мм/год,
СРП +++). Протягом шести років дитина отримувала низькі дози ГК, метотрексат. Але на фоні лікування періодично спостерігалось загострення основної хвороби (після гострої респіраторно-вірусної інфекції) у вигляді підйомів температури, болю та припухлості в суглобах. На УЗД колінних суглобів: залишкові явища ексудативно-проліферативного синовіту з 2 сторін, ерозування дистальних епіфізів стегнових кісток. УЗД тазостегнових суглобів: УЗ-ознаки переважно проліферативного синовіту з 2 сторін, ерозування головок стегнових кісток. Дитина відставала у рості, масі тіла, була постійно пригнічена.
Після обстеження був призначений тоцилізумаб у дозі 320 мг на введення. Протягом місяця спостерігалось покращення самопочуття, зникли скарги на біль у суглобах, нормалізувалась температура тіла. При лабораторному обстеженні показники запальної активності крові — без патологічних змін. Через 6 тижнів від початку введення тоцилізумабу був відмінений ГК. Стан хворого стабільний. Продовжує отримувати тоцилізумаб, метотрексат 12,5 мг/тиждень.
1. Александрова Е.Н., Панасюк Е.Ю., Авдеева А.С. и др. Динамика лабораторных маркеров у больных ревматоидным артритом на фоне терапии тоцилизумабом // Научно-практическая ревматология. — 2011. — № 3. — С. 14-19.
2. Бережний В.В., Марушко Т.В., Роменкевич І.В. Стан надання кардіоревматологічної допомоги дітям України за 2009 р. // Современная педиатрия. — 2010. — № 5(33). — С. 14-18.
3. Уніфікований клінічний протокол медичної допомоги дітям, хворим на ювенільний артрит. Затверджений Наказом МОЗ України № 832 від 22.10.12.
4. Brunner H., Ruperto N., Zuber Z. et al. Efficacy and safety of tocilizumab in patients with polyarticular juvenile idiopathic arthritis: data from a phase 3 trial [abstract no. 1597] // Arthritis Rheum. — 2012. — Vol. 64. — P. S682.
5. Cassidy J.T., Petty R.E. Textbook of Pediatric Rheumatology. 5th ed. — Philadelphia: W.B. Saunders Company, 2005. — 792 p.
6. De Benedetti F., Brunner H.I., Ruperto N. et al. Randomized trial of tocilizumab in systemic juvenile idiopathic arthritis // N. Engl. J. Med. — 2012. — Vol. 367(25). — P. 2385-2395.
7. Frampton F.E. Tocilizumab: A Review of Its Use in the Treatment of Juvenile Idiopathic Arthritis // Pediatric Drugs. — Vol. 15, Issue 6. — P. 515-531.
8. Genentech Inc. Actemra® (tocilizumab) injection, for intravenous infusion. US prescribing information. 2013. http://www.gene.com/ download/pdf/actemra_prescribing.pdf. Accessed 2 Sep 2013.
9. Henter J.I., Horne A., Aricó M., Egeler R.M., Filipovich A.H. et al. Diagnostic and therapeutic guidelines for hemophagocytic lymphohistiocytosis // Pediatric Blood Cancer. — 2007. — Vol. 48. — P. 124-131.
10. Hoffman-La Roche. A study of tocilizumab in patients with active polyarticular-course juvenile idiopathic arthritis [ClinicalTrials.gov identifier NCT00988221]. US National Institutes of Health, ClinicalTrials.gov [online]. 2012. http://clinicaltrials.gov/ct2/show/record/NCT00988221. Accessed 2 Sep 2013.
11. Hoffman-La Roche. Roche trials database. Clinical trial result information. Protocol number: WA19977. 2012. http://www.roche-trials.com/studyResultGet.action?studyResultNumber=WA19977. Accessed 2 Sep 2013. 21.
12. Immonen K., Savolainen A., Kautiainen H., Hakala M. Longterm outcome of amyloidosis associated with juvenile idiopathic arthritis // Journal of Rheumatology. — 2008. — Vol. 35, № 5. — P. 907-912.
13. Packard R., Libby P. Inflammation in Atherosclerosis: From Vascular Biology to Biomarker Discovery and Risk Prediction // Cli–nical Chemistry. — 2008. — Vol. 54. — P. 24-38.
14. Petty R.E., Southwood T.R., Manners P. et al. International League of Associations for Rheumatology classification of juvenile idiopathic arthritis: second revision, Edmonton, 2001 // Journal of Rheumatology. — 2004. — Vol. 31. — P. 390-392.
15. Ravelli A., Martini A. Juvenile idiopathic arthritis // Lancet. — 2007. — Vol. 369. — P. 767-778.
16. Roche Pharma AG. RoActemra 20 mg/mL concentrate for solution for infusion. EU summary of product characteristics 2013. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_Product_Information/human/000955/WC500054890.pdf. Accessed 2 Sep 2013.
17. Stéphan J.L., Koné-Paut I., Galambrun C., Mouy R., Ba–der-Meunier B., Prieur A.M. Reactive haemophagocytic syndrome in children with inflammatory disorders. A retrospective study of 24 patients // Rheumatology. — 2001. — Vol. 40, № 11. — P. 1285-1292.
18. Tanaka T., Ogata A., Narazaki M. Tocilizumab for treatment of rheumatoid arthritis // Expert rewiew in clinical immunology. — 2010. — Vol. 6. — P. 843-854.
19. Yokota S., Imagawa T., Mori M. et al. Efficacy and safety of tocilizumab in patients with systemic onset of juvenile idiopathic arthritis: a randomized, double blind, placebo-controlled, withdrawal phase III trial // Lancet. — 2008. — Vol. 371. — P. 998-1006.
20. Yoshimura T., Sonoda K., Ohguro N. Involvement of Th17 cells and the effect of anti-IL-6 therapy in autoimmune uveitis // Rheumatology. — 2009. — Vol. 48 (4). — P. 347-354.
21. Zhang X., Morcos P.N., Saito T. et al. Clinical pharmacology of tocilizumab for the treatment of systemic juvenile idiopathic arthritis // Expert. Rev. Clin. Pharmacol. — 2013. — Vol. 6(2). — P. 123-137.

/152.jpg)