Статья опубликована на с. 78-82
Захворювання органів дихання у дітей мають найбільшу поширеність серед інших патологій дитячого віку. Пік захворювання припадає на дітей перших років життя, що пов’язано з анатомо-фізіологічними особливостями респіраторної та імунної систем у цьому віковому періоді [1].
У зв’язку з недостатньою активністю противірусного та протимікробного захисту діти раннього віку схильні до рецидивуючого перебігу респіраторних інфекцій, що часто поєднується із синдромом бронхообструкції [3, 10]. Частота розвитку бронхообструктивного синдрому на тлі інфекційних захворювань нижніх дихальних шляхів у дітей раннього віку, за даними різних авторів, становить від 5 до 40 % [4, 11, 13].
До числа вірусів, що найбільш часто викликають обструктивний синдром у дітей перших 3 років життя, відносять респіраторно-синцитіальний вірус, аденовіруси, віруси парагрипу 3-го типу, дещо рідше віруси грипу та ентеровіруси [4]. Разом із тим відомо, що у дітей, схильних до рецидивуючих бронхозапальних захворювань, вже через кілька годин після інфікування знижується колонізаційна резистентність дихальних шляхів. Наявність вірусно-бактеріальної асоціації як етіологічного фактора обструктивного бронхіту часто обумовлює тяжкість перебігу та тривалість захворювання [5].
Провідними збудниками запального процесу при бронхітах у наш час вважаються Haemophilus influenzae, Strеptococcus pneumoniae і Moraxella catarrhalis. Виявлено, що Haemophilus influenzae, Strеptococcus pneumoniae здатні пошкоджувати циліарний епітелій, погіршувати функцію війок. Розмноження мікроорганізмів сприяє подальшому прогресуванню запалення як внаслідок самостійного пошкодження структури бронха, так і через активацію ензимів запальних клітин [8].
На сьогодні відзначається зростання числа хворих, особливо серед дітей раннього віку, з затяжними, рецидивуючими варіантами перебігу бронхолегеневих процесів, частковою ерадикацією збудника, відсутністю повного клініко-рентгенологічного завершення запального процесу [6]. Однією з причин такого перебігу респіраторного захворювання в дитячому віку є зростання резистентності мікрофлори до антибактеріальних препаратів, що використовуються в педіатрії (пеніцилінів, макролідів, цефалоспоринів 1-го покоління), зі збільшенням у популяції числа дітей із персистуючою інфекцією, тобто числа пацієнтів, не здатних до повної ерадикації мікроорганізму [9]. У зв’язку з цим лікування бронхообструктивного синдрому, що розвинувся на тлі гострої респіраторної інфекції, у дітей раннього віку має бути комплексним, суворо диференційованим і за необхідності включати етіотропну антибактеріальну терапію [10].
До госпіталізації у хворих в амбулаторних умовах спостерігались 2–3 епізоди бронхообструктивного синдрому, що виникали на тлі гострої респіраторної інфекції. Кожен епізод бронхообструкції супроводжувався лихоманкою. На амбулаторному етапі як медикаментозну терапію діти отримували противірусні препарати, β2-адреноміметики, антигістаминні препарати, муколітичні засоби, антибіотики за показаннями. У разі неефективності терапії, що проводилося, діти направлялися на стаціонарне лікування.
Бактеріологічне дослідження мазків слизової задньої стінки ротоглотки встановило відсутність росту патогенної мікрофлори у 102 (47,0 %) хворих. В інших 115 (53 %) пацієнтів спостерігалася контамінація слизової верхніх дихальних шляхів патогенною або умовно-патогенною бактеріальною мікрофлорою, видовий склад якої характеризувався достатнім різноманіттям. Усі виділені мікроорганізми мали ступінь обсіменіння слизової верхніх дихальних шляхів в 105–106 КУО, що було розцінено як етіологічний збудник інфекційного процесу. Основними збудниками у дітей, хворих на обструктивний бронхіт, були бактерії роду Haemophillus (41 дитина — 35,6 %) та Streptococcus pneumoniaе (50 дітей — 43,5 %).
У 5,2 % випадків (6 хворих) етіологічним фактором обструктивного бронхіту була Klebsiella pneumoniae, в 7,8 % випадків (9 дітей) — Escherichia coli, в поодиноких випадках зустрічалися ентерококи (3 дитини — 2,6 %), Acinobactes baumannii (3 дитини — 2,6 %), Pseudomonas aeroginosa (2 дитини — 1,7 %) та Staphyllococcus aureus (1 пацієнт — 0,9 %). Слід відзначити, що у 25 (21,7 %) пацієнтів бактеріальна мікрофлора визначалася певною мірою в асоціації з дріжджоподібними грибами роду Candida, що може свідчити про нераціональне застосування антибіотикотерапії раніше в амбулаторних умовах.
Проведений аналіз чутливості Streptococcus pneumoniae до антибіотиків показав, що найбільшу чутливість бактерія виявляє до цефалоспоринів ІІІ покоління, ванкоміцину та левофлоксацину (табл. 1).
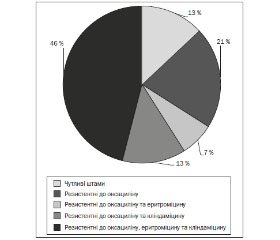
Звертала на себе увагу висока антибіотикорезистентність Streptococcus pneumoniaе до кліндаміцину (67,9 %), макролідів (45,8 %) та пеніцилінів (87,0 %). Слід відзначити, що тільки 13 % штамів Streptococcus pneumoniaе, які належать до «дикої» популяції, тобто позбавленої додаткових детермінант резистентності до антибіотиків, виявилися чутливими до всіх протестованих антибактеріальних препаратів, у той час як 66 % штамів Streptococcus pneumoniaе проявляли мультирезистентність (рис. 1).
Відзначено, що 7 % ізолятів Streptococcus pneumoniaе мали стійкість одночасно до оксациліну та еритроміцину; нечутливість до оксациліну і кліндаміцину встановлено у 13 % штамів, а 46 % штамів, нечутливих до оксациліну, виявилися резистентними одночасно як до еритроміцину, так і кліндаміцину.
Дослідження чутливості мікрофлори до антибактеріальних препаратів (табл. 2) показало, що основна частина бактерій роду Haemophillus (92 %) була здатна до синтезу цефінази, що й обумовлювало резистентність мікроорганізмів до амінопеніцилінів, карбоксипеніцилінів та уреїдопеніцилінів.
У 46,7 % випадків виділені штами гемофільної палички проявляли стійкість до амоксициліну/ клавуланату, та у 46,7 % штамів відзначена резистентність до ампіциліну. При цьому в усіх випадках мікроорганізми, що були виділені, мали високу чутливість до цефалоспоринів ІІІ покоління, лево–флоксацину та хлорамфеніколу.
Отже, за результатами проведених порівнянь чутливості найбільш поширених бактеріальних збудників обструктивного бронхіту у дітей, які перебували під нашим спостереженням, можливо стверджувати, що оптимальний стартовий антибактеріальний засіб у практиці лікаря першого контакту повинен чинити бактерицидну дію щодо як грампозитивної, так і грамнегативної флори. Беручи до уваги отримані дані стосовно чутливості основних збудників, препаратами вибору є цефалоспорини ІІІ покоління.
Препаратом для лікування гострих обструктивних бронхітів у дітей, що відповідає всім вищезазначеним вимогам, є антибіотик цефподоксиму проксетил (Цефодокс), який належить до групи цефалоспоринів ІІІ покоління [2]. Препарат активний щодо грампозитивної і грамнегативної флори. Особливості фармакокінетики препарату забезпечують збереження необхідної концентрації діючої речовини в плазмі крові протягом 12 годин, що обумовлює можливість ерадикації збудників [2, 10]. Його бактерицидний ефект обумовлений пригніченням синтезу компонентів бактеріальної стінки мікроорганізмів. Цефподоксиму проксетил — препарат, створений за технологією prodrug, тобто це проліки, що стають активними лише в стінці тонкої кишки, де вони перетворюються на активну форму, тобто цефподоксим. Зазначена технологія дозволяє підвищити біодоступність препарату та мінімізує низку побічних дій, що притаманні антибактеріальним препаратам, — порушення мікробіоценозу шлунково-кишкового тракту. Крім того, технологія Prodrug дозволяє підвищити пероральну абсорбцію препарату, захистити активну речовину від руйнування, вирішити питання захисту від дії соляної кислоти шлунка, забезпечити високу швидкість всмоктування.
Цефподоксиму проксетил швидко проникає в тканини, в тому числі мигдалини, легені, та рідини організму, де його концентрація швидко досягає максимальних рівнів. Препарат високоактивний щодо грампозитивних мікроорганізмів, включаючи штами, стійкі до пеніциліну, в тому числі Streptococcus pneumoniae, стрептококи групи A (Streptococcus pyogenes), групи B (Streptococcus agalactiae), груп C, F и G, а також Streptococcus mitis, Streptococcus Sanguis, Streptococcus Salivarius i Corynebacterium diphtheriae; грамнегативних мікроорганізмів (Haemophilus influenzae, Haemophilus parainfluenzae, включаючи штами, які продукують і не продукують пеніциліназу, Moraxella (Branhamella) catarrhalis, Neisseria meningitidis, Neisseria gonorrhoeae, включаючи штами, що продукують β-лактамазу, Escherichia coli, Klebsiella spp. (Klebsiella pneumoniae, Klebsiella oxytoca), Proteus mirabilis. Препарат проявляє помірну чутливість до метіцилінчутливих стафілококів, штамів, які продукують та не продукують пеніциліназу (Staphilococcus aureus, Staphilococcus epidermidis). Концентрація цефподоксиму у легеневій тканині через 6–8 годин у багато разів вища МПК 90 для таких респіраторних збудників: Moraxella catarrhalis — у 2 рази, Haemophilus influenzae і Streptococcus pneumoniae — у 20 разів, Streptococcus pyogenes — приблизно у 70 разів [12].
Зважаючи на широкий спектр дії цефподоксиму, його високу активність щодо грампозитивної та грамнегативної флори, бактерицидну дію і високий ступень безпеки, препарат Цефодокс доцільно застосовувати в лікуванні обструктивних бронхітів у дітей раннього віку.
Мета дослідження — оцінка клінічної ефективності перорального цефалоспорину ІІІ генерації Цефодокс у дітей раннього віку, хворих на гострий обструктивний бронхіт.
Матеріали та методи дослідження
Ми проаналізували ефективність застосування в терапії 30 дітей, хворих на гострий обструктивний бронхіт, препарату Цефодокс (основна група). Цефодокс призначався перорально у вигляді суспензії з розрахунку 10 мг на 1 кг маси тіла на добу. Розрахункова доза приймалася у 2 прийоми через 2 години після їжі протягом 7 днів.
Групу порівняння становили 30 хворих на гострий обструктивний бронхіт, які як етіотропну терапію отримували респіраторний антибіотик іншої групи (амінопеніциліни в комбінації з інгібіторами лактамаз, макроліди).
Показаннями до призначення антибактеріальної терапії при обструктивному бронхіті у дітей раннього віку вважали:
— наявність фебрильної лихоманки протягом 3 днів і більше;
— виражений токсикоз, лейкоцитоз понад 12 000 в 1 мкл;
— паличкоядерний зсув лейкоцитарної фор–мули;
— ШОЕ понад 20 мм/год;
— слизово-гнійний або гнійний характер виділень з носа та мокротиння;
— затяжний перебіг захворювання.
Ці ознаки було розцінено як ознаки бактеріальної інфекції. У подальшому це припущення підтверджувалися отриманими даними бактеріологічного дослідження слизової задньої стінки ротоглотки.
Результати дослідження та їх обговорення
Аналіз результатів клінічного дослідження показав, що застосування препарату Цефодокс при обструктивному бронхіті у дітей раннього віку супроводжувалося вираженим терапевтичним ефектом: швидко зникали прояви синдрому загальної інтоксикації, нормалізувалася температура тіла, купірувався бронхообструктивний синдром.
Проведене контрольне бактеріологічне дослідження слизової ротоглотки через 2 тижні після закінчення антибактеріального лікування показало, що на тлі терапії Цефодоксом у більшості хворих спостерігалася санація верхніх дихальних шляхів від патогенної та надмірної кількості умовно-патогенної бактеріальної мікрофлори — 86,7 % випадків (26 дітей). В 4 (13,3 %) пацієнтів при контрольному бактеріологічному дослідженні мікрофлори верхніх дихальних шляхів були виділені бактерії роду Haemophilus, але ступінь обсіменіння слизової верхніх дихальних шляхів не перевищував 105 КУО. У групі порівняння на фоні застосованої терапії також спостерігалася позитивна клінічна динаміка, проте дослідження мікрофлори слизової задньої стінки ротоглотки через 2 тижня після закінчення терапії показало, що нормалізація мікробного пейзажу верхніх дихальних шляхів спостерігалася лише у 16 (53,3 %) хворих. У 9 (30,0 %) дітей було виділено Haemophilus influenzae та у 5 (16,7 %) хворих — Streptococcus pneumoniae у значущих концентраціях (рис. 2).
/81.jpg)
Аналіз профілю безпеки Цефодоксу показав, що препарат добре переносився всіма пацієнтами. Не було відзначено небажаних реакцій або побічних ефектів. У той же час у групі хворих, які отримували інші респіраторні антибіотики, у 6 (20,0 %) пацієнтів розвинувся діарейний синдром на –3–4-й день терапії, у 2 (6,7 %) дітей виникли алергічні реакції, що потребувало зміни антибактеріального препарату.
Катамнестичне спостереження за дітьми, які отримували препарат Цефодокс, протягом подальших 6 місяців свідчило про відсутність розвитку синдрому бронхообструкції при захворюванні на гострі респіраторні інфекції у 25 (83,3 %) пацієнтів, у 4 (13,3 %) частота епізодів бронхообструкції на фоні гострої респіраторної інфекції зменшилася у 2 рази. В 1 (3,3 %) дитини не було відзначено суттєвого поліпшення в перебігу захворювання, що було пов’язано з наявністю у цієї дитини хронічного системного захворювання.
У групі порівняння епізоди бронхообструкції протягом подальших 6 місяців спостерігалися у 12 (40,0 %) хворих, причому у 5 (16,7 %) пацієнтів бронхообструктивний синдром на фоні гострої респіраторної інфекції розвинувся протягом місяця після закінчення терапіїї.
Висновки
1. Контамінація слизової оболонки дихальних шляхів патогенною та умовно-патогенною бактеріальною мікрофлорою є фоном для формування частих епізодів обструктивного бронхіту у дітей раннього віку та потребує проведення диференційованої етіотропної терапії.
2. Висока клінічна ефективність, оптимальний спектр бактерицидної активності, сприятливий профіль безпеки, зручний режим дозування препарату Цефодокс дозволяють розглядати його як стартовий емпіричний лікарський засіб для терапії гострого обструктивного бронхіту бактеріальної етіо–логії у дітей раннього віку.
Список литературы
1. Гаймоленко И.Н. Бронхообструктивный синдром у детей раннего возраста: причины, факторы риска, иммунологические нарушения, лечение / И.Н. Гаймоленко, Е.Г. Бугаенко, Ю.А. Козьминых // Бюллетень ВСНЦ СО РАМН. — 2004. — Т. 1, № 2. — С. 75-79.
2. Диференційоване застосування антибактеріальних препаратів у педіатрії (за матеріалами IX Всеукраїнської науково-практичної конференції «Актуальні питання педіатрії») // Новости медицины и фармации. — 2007. — № 21–22. — С. 230-231.
3. Зайцева О.В. Виферон в терапии детей с бронхиальной астмой / О.В. Зайцева, В.В. Малиновская, Т.Г. Орлова [и др.] // Материалы научно-практической конференции ФУ «Медбиоэкстрем» при МЗ РФ «Медико-биологическая и экстремальная педиатрия». — 2000. — С. 133.
4. Зайцева О.В. Бронхообструктивный синдром у детей / О.В. Зайцева // Педиатрия. — 2005. — № 4. — С. 104-105.
5. Извин А.И. Микробный пейзаж слизистой оболочки верхних дыхательных путей в норме и патологии / А.И. Извин, Л.В. Катаева // Вестн. отоларингол. — 2009. — № 2. — С. 64-68.
6. Коровина Н.А. и др. Часто и длительно болеющие дети: современные возможности иммунореабилитации: Руководство для врачей. — М., 2001. — С. 5-15.
7. Нові перспективи використання пероральних цефалоспоринів у педіатрії (за матеріалами V конгресу педіатрів України, 15–17 жовтня, м. Київ) // Здоров’я України. — 2008. — № 24/1. — С. 36-37.
8. Смирнова М.О. Бронхиты у детей: принципы современной терапии / М.О. Смирнова, Е.В. Сорокина // Трудный пациент. — 2009. — Т. 7, № 8. — С. 16-25.
9. Сорока Н.Д. Особенности иммунотерапии затяжных и рецидивирующих респираторных болезней у детей / Н.Д. Сорока // Педиатрическая фармакология. — 2008. — № 5. — С. 88-92.
10. Blasi F. Chlamydia pneumoniae in respiratory infections / F. Blasi // Pros. 4th Meet. Eur. Soc. Chlam. Res. 20–23 Aug 2000, Helsinki. Finland. — P. 32-36.
11. Cronca P. Wheezing in erly life and ashma in shool age predictors of symptom persistens / P. Cronca, M. Kaila // Abs. 10 Congress ERS. — 2000. — P. 486.
12. Fallon R.M. Pharmacodynamic target attainment of oral beta-lactams for the empiric treatment of acute otitismedia in children / R.M. Fallon, J.L. Kuti, G.V. Doern // Paediatr. Drugs. — 2008. — Vol. 10(5). — Р. 329-354.
13. Kovacevic S. Risk factors associated with wheezing illness in young children / S. Kovacevic, S. Nikolic // Abs. 10 Congress ERS. — 2000. — P. 486.
14. Routine internal quality control as recommended by EUCAST. Version 4.0, valid from 2014-09-05.
/79.jpg)
/81.jpg)

/79_2.jpg)
/80.jpg)