Статья опубликована на с. 9-16
Міжнародна класифікація хвороб 10-го перегляду
B 34.2 Коронавірусна інфекція неуточнена
U 04.9 SARS
Виступаючи на 66-й сесії асамблеї Всесвітньої організації охорони здоров’я (ВООЗ), що проходила в Женеві, глава ВООЗ Маргарет Чен нагадала, що «новий коронавірус MERS-CoV являє собою глобальну загрозу людству. Це тривожний дзвінок, і ми повинні на нього відповісти. Ми знаємо занадто мало про цей вірус. Кожна нова хвороба, що поширюється швидше, ніж наші знання про неї, виходить з-під контролю».
Хоча глава ВООЗ поскаржилася на брак знань про новий вірус, вчені ударними темпами досліджують MERS-CoV, що викликає насампред близькосхідний респіраторний синдром (БСРС-CoV, MERS-CoV). Так, фахівці з Боннського медичного центру стверджують, що коронавірус MERS-CoV має родинні зв’язки з вірусом SARS, збудником атипової пневмонії, і викликає захворювання з подібною клінічною картиною.
Актуальність
Коронавірусні інфекції (КВІ) — це група гострих інфекційних хвороб, що спричинені патогенними для людини і тварин коронавірусами. Клінічно у хворого спостерігаються прояви гострої респіраторної вірусної інфекції (ГРВІ) від безсимптомного перебігу до розвитку тяжкого гострого респіраторного синдрому (ТГРС). У частини хворих можливі прояви за типом гострого інфекційного гастроентериту (до 30 %).
Крім того, КВІ — хвороби переважно новонароджених і молодих сільськогосподарських і домашніх тварин. Вони викликані коронавірусами, що мають переважну тропність до клітин епітелію кишкового тракту і дихальних шляхів. Основною ознакою хвороби у тварин є діарейний синдром.
Близькосхідний респіраторний синдром (MERS-CoV) — це гостра респіраторна вірусна інфекція, спричинена новим бета-коронавірусом, ідентифікованим як MERS-CoV. Клінічні прояви характеризуються високою лихоманкою, ураженням як верхніх, так і нижніх відділів дихальної системи з проявами пневмонії та розвитком гострого респіраторного дистрес-синдрому (ГРДС). Досить часто спостерігається загострення хронічної соматичної патології. Останні дві характеристики є основними причинами летальних наслідків.
На сучасному етапі людство зустрічається з новими хворобами переважно вірусної етіології, що характеризуються непередбачуваним виникненням і тяжким перебігом. У науковому плані часто це загоняє медиків-дослідників у глухий кут. Згадаємо, наприклад, хворобу, спричинену вірусом Ебола. Виникнення таких захворювань зумовлене непрогнозованою антигенною мінливістю вірусів, яка пов’язана зі спонтанними змінами чи якісними змінами їх антигенних детермінант, що виникають під дією популяційного імунітету.
Яскравим підтвердженням вищенаведеного стали випадки захворювань із летальними наслідками, зумовлені коронавірусом близькосхідного респіраторного синдрому.
Актуальність інфекційних захворювань пов’язана із зростанням трудової міграції, кількості туристичних і бізнесових подорожей, зокрема у ті регіони, що раніше були недоступними.
За період вересень 2012 — червень 2015 р. ВООЗ офіційно проінформована про 1289 лабораторно підтверджених випадків близькосхідного респіраторного синдрому, спричиненого MERS-CoV, у світі, із яких 455 випадків були смертельними. Летальність становить 35,3 %.
Найбільший спалах MERS-CoV зафіксовано за межами Аравійського півострова в Південній Кореї. Перше повідомлення до ВООЗ надійшло 21 травня 2015 року. Станом на 15.06.2015 зареєстровано 150 випадків, з яких 17 закінчилися летально (11,3 %). Медичне спостереження проводиться більше ніж за 5 тис. осіб, які перебували в контакті з особами, у яких лабораторно підтверджено наявність MERS-CoV.
На ІХ нараді Комітету з надзвичайних ситуацій ВООЗ, згідно з Міжнародними медико-санітарними правилами (ММСП, 2005), генеральним директором було наголошено, що БСРС-СоV зареєстровано у 25 країнах світу.
Етіологія
Коронавіруси (CoV) — велика і різноманітна група позитивно-полярних РНК вірусів у родині Coronaviridae, що також охоплює групу Torovirus. Разом із родинами Arteriviridae та Roniviridae віруси Coronaviridae згруповані в порядку Nidovirales, базуючись на організації консервативного генома та механізму реплікації.
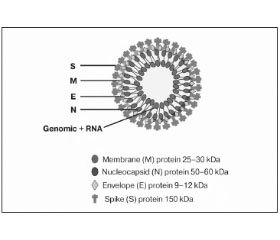
Назва Nidovirus (лат. nidus) походить від унікальної стратегії зчитування генетичної інформації, включаючи формування родинних мРНК молекул з ідентичними 3'-кінцями ланцюга під час інфекції. Часточки коронавірусу сягають від 120 до 160 нм у діаметрі, мають лінійний, одиничний та позитивно-полярний РНК-геном із середньою довжиною від 27 до 31 т.п.н. (рис. 1).
Вірусна РНК сполучається з багатьма копіями нуклеокапсидного протеїну (NP), щоб утворити гнучке ядро в середині вірусної мембрани, яка складається з «шипів» (S), оболонки (E) та мембранних протеїнів (М). В окремих штамів на віріоні присутній додатковий структурний протеїн — гемаглютинін естерази (HE). Високоглікозовані S-протеїни мають вирішальне значення для коронавірусів, щоб встановити та підтримати цикл інфекції при взаємодії зі специфічним клітинним проникненням молекул для злиття вірусу з клітинними мембранами (рис. 2).
Ще у 30-х роках ХХ століття стало відомо про першу ізоляцію коронавірусу — вірус пташиного бронхіту. Відтоді було виявлено багато коронавірусів у широкому діапазоні носіїв, включаючи ссавців і птахів. Коронавіруси передаються респіраторно аерозольним і фекально-оральним шляхом. У першу чергу уражають слизову оболонку респіраторного і кишкового трактів. Зараження певними коронавірусами спричиняє прояви неврологічних, печінкових, ниркових і системних порушень.
Коронавіруси людини (HCoV) спочатку асоціювали з помірними, локальними інфекціями верхніх дихальних шляхів (ВДШ), як прояви ГРВІ/ГРЗ. З 2003 року відновився науковий інтерес до коронавірусів. Було доведено, що етіологічним агентом тяжкого гострого респіраторного синдрому (SARS), що викликав епідемію по всьому світу, є коронавірус людини. Зараження коронавірусом ТГРС призводило до пошкодження нижніх дихальних шляхів, а результатом стали висока захворюваність і смертність протягом короткого періоду часу. Було виявлено численні нові коронавіруси, у тому числі два види, якими може інфікуватися людина, — HCoV-NL63 та HCoV-HKU1.
У квітні 2013 року було ідентифіковано та доведено, що збудником БСРС є абсолютно новий штам коронавірусу, мутація якого відбулася від тваринних коронавірусів.
КВ розподілені на ІІІ антигенні групи:
— І група — людський коронавірус 229Е та віруси, що уражують свиней, собак, котів;
— ІІ група — людський вірус ОС-43 та віруси мишей, крис, великої рогатої худоби, індиків;
— ІІІ група — кишкові коронавіруси людини і віруси кур та індиків.
Некласифіковані раніше — кишкові КВ людини (HECoV), збудники ТГРС (SARS) і БСРС (MERS-CoV).
Основними клітинами-мішенями для коронавірусів є епітеліальні клітини та макрофаги, які мають на своїй поверхні рецептори, що взаємодіють з поверхневим S-білком вірусу.
Епідеміологія
Коронавірусна інфекція поширена на всіх континентах та реєструється протягом цілого року. Найвищі показники захворюваності — зима та рання весна, коли епідеміологічна значимість КВІ коливається в межах від 15 до 33,7 %.
Шляхи передачі КВІ: повітряно-крапельний, фекально-оральний і контактний. Джерело інфекції — хворі з клінічно вираженими чи стертими формами захворювання. Як правило, коронавіруси — лідери серед інших вірусів в етіології внутрішньолікарняних інфекцій.
У листопаді 2002 р. у провінції Гуандун (КНР) вперше зафіксований ТГРС, асоційований із коронавірусом (SARS-CoV). До серпня 2003 р. ВООЗ повідомила про 8422 випадки в 30 державах світу з 916 (10,9 %) смертельними наслідками. До 60 % від усіх летальних випадків припадає на медичних працівників. Найбільшу кількість хворих було зареєстровано в Китаї, Сінгапурі, Канаді.
Природним резервуаром (SARS-CoV) є кажани (Chiroptera: Microchiroptera). Від кажанів у природі заражаються віверові (Viverridae), яких жителі Південно-Східної Азії доглядають як домашніх тварин і часто використовують в їжу. Найбільш вірогідний шлях проникнення SARS-CoV у популяцію людини: кажани → дрібні дикі ссавці (гімалайські, єнотоподібні собаки, бірманські борсуки) → м’ясо неякісної термічної обробки в ресторанах → людина.
З вересня 2012 р. ВООЗ проводить регулярний моніторинг випадків БСРС відповідно до ММСП. У травні 2013 р. на спеціальному засіданні групи експертів Міжнародного комітету з таксономії вірусів збудник БСРС отримав свою сучасну назву — Middle East respiratory syndrome coronavirus (MERS-CoV) — коронавірус близькосхідного респіраторного синдрому (БСРС-КоВ) і місце в таксономічній системі царства Virae (табл. 1).
Природним резервуаром цього коронавірусу, як показали результати молекулярно-генетичного вивчення, є кажани. Дослідження, проведені в Європі, Африці та Азії, у тому числі на Близькому Сході, показали, що коронавірус з подібною РНК-послідовністю часто зустрічається в зразках калу кажанів і що деякі з цих послідовностей тісно пов’язані з послідовністю МERS-CoV [3, 4]. Кажани можуть бути резервуаром МERS-CoV, але малоймовірно, що вони є безпосереднім джерелом для більшості випадків захворювання людини, адже людський контакт з кажанами є рідкістю [20].
Можливі джерела і шляхи передачі. Цілком імовірно, що верблюди (дромадери) — основний господар МERS-CoV серед тварин. Переконливий доказ передачі МERS-CoV від верблюда до людини досліджений у Саудівській Аравії. У процесі повного секвенування генома виявлено, що віруси, виділені від людини та її верблюда, були ідентичними [21]. Результати проведених досліджень показують, що МERS-CoV може передаватися від верблюда до верблюда, а також від них людині при тісному контакті.
Наявність тематичних кластерів, епідеміологічно підтверджених, передбачає, що відбувається передача вірусу від людини до людини при тісних контактах, особливо при наданні медичної допомоги таким хворим [12, 14, 19].
Передача вірусу реалізується повітряно-крапельним і контактним шляхами [26].
Географічний розподіл. З квітня 2012 року зафіксовано понад 1289 лабораторно підтверджених випадків інфікування людей МЕRS-CoV на Близькому Сході, що сталися в низці країн Аравійського півострова, у тому числі Йорданії, Кувейті, Лівані, Омані, Катарі, Саудівській Аравії, Об’єднаних Арабських Еміратах та Ємені. Більшість випадків — у Саудівській Аравії, у тому числі деяких тематичних кластерів [8, 9]. Обмежене число випадків було також зареєстровано в Австрії, Алжирі, Китаї, Єгипті, Франції, Німеччині, Греції, Ірані, Італії, Малайзії, Нідерландах, на Філіппінах, у Південній Кореї, Таїланді, Тунісі, Туреччині, Великобританії, Сполучених Штатах Америки. В європейських та азіатських країнах, а також в Алжирі, Єгипті, Тунісі та США ознаки хвороби розвинулися після повернення з Аравійського півострова.
Спалах у Південній Кореї (травень — червень 2015 р.) підтверджує передачу вірусу від людини до людини [5, 7, 12, 14, 23], зафіксовані вторинні і третинні випадки передачі [17, 18]. Вторинні випадки, як правило, більш м’які за первинні, навіть зафіксовані безсимптомні вторинні випадки [15, 25]. Більше половини всіх лабораторно підтверджених вторинних випадків були пов’язані із закладами охорони здоров’я [27].
Найбільш легко вірус виявляється з нижніх дихальних шляхів у зразках харкотиння або бронхоальвеолярного лаважу (БАЛ) пацієнтів. Виділятися вірус може більше як два тижні [19].
У кінці червня 2013 року проведене дослідження, що оцінювало заразність та епідемічний потенціал МERS-CoV на основі 55 лабораторно підтверджених випадків. Число відтворення — R0; визначається як середнє число інфекцій, що виникнуть від одного зараженого пацієнта в повністю сприйнятливій популяції. За оцінками, R0 становить від 0,60 до 0,69 [28, 29]. Висновок: при R0 < 1 припускається, що МERS-CoV на момент дослідження не має потенціалу пандемії. Інші відзначають, що R0 може бути вищий за відсутності заходів інфекційного контролю [6].
Основні клінічні симптоми
Інкубаційний період КВІ з ураженням ВДШ становить у середньому 2–3 доби. Початок захворювання гострий, із помірно вираженим синдромом інтоксикації, з ознаками ураження верхніх відділів респіраторного тракту. Найчастішим симптомом є риніт із значними серозними виділеннями. Іноді хворі скаржаться на слабкість, міалгії, першіння в горлі, сухий кашель.
При об’єктивному огляді спостерігаються помітні гіперемія та набряк слизової носоглотки. У більшості пацієнтів температура тіла нормальна або субфебрильна. Тривалість хвороби становить 5–7 діб. У 9–24 % випадків спостерігаються лихоманка, виражена інтоксикація, сухий кашель із незначною кількістю харкотиння. При аускультації — над легенями дихання жорстке з сухими хрипами.
У 3–8 % випадків КВІ перебігає з ураженням нижніх дихальних шляхів із розвитком пневмонії, що має тяжкий перебіг, особливо у дітей раннього віку та людей із тяжкою супутньою патологією.
Тяжкий гострий респіраторний синдром. Інкубаційний період триває від 2 до 10 діб, у середньому 7 діб. Початок гострий, з ознобом (97 %), лихоманкою 38–39 °С (100 %).
На початку хвороби переважають такі симптоми інтоксикації:
— риніт (23 %);
— болі в горлі (23 %);
— сухий кашель (39 %);
— біль у м’язах (81 %);
— слабкість (100%);
— головокружіння (61 %);
— головний біль (84 %).
Через 3–7 діб розвивається респіраторна фаза з вираженими ознаками ураження нижніх дихальних шляхів: посилюється кашель, з’являється задишка з відчуттям нестачі повітря. При об’єктивному обстеженні пацієнта в задньонижніх відділах грудної клітки відмічається притуплення перкуторного тону. При аускультації — над легенями дихання ослаблене з вологими дрібнопухирцевими хрипами. Тахікардія. Наростають ознаки гіпоксії та гіпоксемії. На рентгенограмі в легенях відмічаються мультифокальні інфільтрати з тенденцією до злиття, особливо в периферичних відділах. За даними різних авторів, до 30 % випадків зустрічаються симптоми ураження шлунково-кишкового тракту (нудота, блювання, діарея).
При прогресуванні хвороби у 10–20 % випадках на 5-ту — 7-му добу відмічається розвиток гострого респіраторного дистрес-синдрому. При лабораторному обстежені у гемограмі відмічаються лімфопенія, лейкопенія (2,6 • 109/л), тромбоцитопенія (50–150 • 109/л). На рентгенограмі одно- та двобічні щільні інфільтрати за типом «снігової бурі».
У 80–90 % випадків хвороба закінчується одужанням. Летальність становить від 4 до 19,7 % випадків, а в групі хворих, які перебувають на штучній вентиляції легень, — 57,7 %.
Супутні захворювання та похилий вік підвищують ризик тяжкого перебігу з несприятливими наслідками.
Близькосхідний респіраторний синдром. Інкубаційний період МERS-CoV у середньому становив 5,2 дня (95% довірчий інтервал 1,9–14,7 дня) [13]. В одному випадку вторинної передачі, що відбулася в пацієнта у Франції, оцінюється в 9–12 днів [14].
Серед 47 хворих із MERS-CoV-інфекцією у Саудівській Аравії спостерігали такі клінічні прояви [32]:
— патологічні зміни на рентгенограмі (100 %);
— біль у животі (17 %);
— блювота (21 %);
— діарея (26 %);
— міалгії (32 %);
— кровохаркання (17 %);
— задишка (72 %);
— кашель (83 %);
— лихоманка з ознобом (87 %);
— лихоманка > 38 °С (98 %).
Із цих 47 пацієнтів 42 (89 %) був потрібний інтенсивний догляд та 34 (72 %) — механічна вентиляція [32].
Легкі та безсимптомні форми не потребували госпіталізації [30, 32]. Є дані, що в одного пацієнта розвинувся сухий кашель на 10-й день хвороби з подальшим розвитком задухи і гіпоксії на 11-й день хвороби, до цього він мав тільки неспецифічні симптоми (нездужання, міалгії, субфебрильна лихоманка) [17].
Існує тільки один опублікований опис МERS-CoV-інфекції у дітей. З 11 дітей 9 мали безсимптомний перебіг. Ці дані виявлені під час розслідування контактів літніх пацієнтів. Два клінічно явних випадки були у дітей із супутніми хворобами (кістозний фіброз і синдром Дауна) [33].
Серед 47 обстежених із МERS-CoV-інфекцією в Саудівській Аравії лабораторні відхилення включали в себе такі показники [32]:
— лейкопенія — 14 %;
— лімфопенія — 34 %;
— лімфоцитоз — 11 %;
— тромбоцитопенія — 36 %;
— підвищення аспартатамінотрансферази — 15 %;
— підвищення аланінамінотрансферази — 11 %;
— підвищення лактатдегідрогенази — 49 %.
У деяких пацієнтів відмічалася прогресуюча ниркова недостатність із зростанням азоту сечовини в крові та креатиніну [2, 11, 14, 24]. Про розвиток у хворих ДВС і гемолізу повідомляли ряд авторів [12, 31].
Діагностика
ВООЗ розробила та запропонувала анкету, що буде використовуватися для початкового розслідування випадків MERS-CoV. При встановленні діагнозу особливо актуальні лабораторні методи дослідження. Зразки біологічних рідин із нижніх дихальних шляхів повинні бути пріоритетом для збору та дослідження в режимі реального часу зворотної транскриптази з подальшою полімеразною ланцюговою реакцією (РЗТ-ПЛР).
РЗТ-ПЛР-тестування нижніх дихальних зразків більш чутливе для виявлення коронавірусу близько-східного респіраторного синдрому, ніж тестування зразків верхніх дихальних шляхів [30, 34, 35].
Враховуючи потенційну серйозність MERS-CoV-інфекцій, ризик передачі від людини до людини та обмаль даних щодо чутливості кожного діагностичного тесту, необхідно збирати кілька екземплярів зразків із різних місць і в різний час, щоб збільшити ймовірність виявлення МERS-CoV [34]. В ідеалі — з нижніх і верхніх дихальних шляхів, а також досліджувати зразки сироватки.
Пріоритет належить респіраторним зразкам із нижніх відділів дихальної системи. Зразок сироватки повинен бути отриманий для серологічного тестування [35].
Центр США з контролю і профілактики інфекційних захворювань (CDC) та ВООЗ рекомендують такий діагностичний підхід, що був адаптований [34, 35]:
— зразки нижніх дихальних шляхів — мокротиння, аспірат ендотрахеальний або бронхоальвеолярного лаважу слід отримати для тестування РЗТ-ПЛР від усіх пацієнтів із тяжким перебігом хвороби;
— зразки верхніх дихальних шляхів повинні бути отримані для тестування РЗТ-ПЛР та об’єднані (носоглотки і ротоглотки) в одному контейнері для збору або у 2–3 мл аспірату з носоглотки. Отримання зразків особливо важливе, якщо пацієнт не має симптомів захворювання нижніх дихальних шляхів або якщо колекція зразків нижніх дихальних шляхів неможлива.
Полімеразна ланцюгова реакція і секвенування. Дані з відібраних випадків на сьогодні показують, що зразки з нижніх дихальних шляхів (харкотиння, аспірат трахеї, БАЛ) є більш чутливими для виявлення МERS-CoV за допомогою РЗТ-ПЛР-тестування, ніж ті, що зібрані з верхніх дихальних шляхів (у поєднанні із зразками носоглотки і ротоглотки, аспірату носоглотки) [12, 14, 31, 34, 36].
Серологічні методи — розроблені для виявлення антитіл до МERS-CoV, у тому числі реакції імунофлюоресценції та білок-мікрочіпів [37, 39, 40]. CDC розробила двохетапний підхід за допомогою використання імуноферментного аналізу (ELISA) для скринінгу у поєднанні з непрямим тестом імунофлюоресценції або тесту мікронейтралізації для підтвердження [35]. Будь-який позитивний серологічний аналіз на одному тесті повинен бути підтверджений із використанням аналізу нейтралізації. Є обмежені дані щодо чутливості і специфічності тестів на антитіла до МERS-CoV.
За даними ВООЗ, за відсутності тестування з використанням РЗТ-ПЛР випадки з позитивним серологічним тестом вважаються ймовірним випадком у сукупності з іншими елементами, що містять визначення можливого випадку [30, 32]:
— підтверджений випадок — людина з лабораторним підтвердженням інфекції МERS-CoV незалежно від клінічних ознак і симптомів;
— можливий випадок — визначається за такими критеріями:
- гостре респіраторне захворювання з клінічними, радіографічними або гістологічними доказами захворювання паренхіми легенів (пневмонія, гострий респіраторний дистрес-синдром);
- прямий епідеміологічний зв’язок із підтвердженим випадком МЕRS-CoV;
- тестування на МERS-CoV недоступне або негативне на одному зразку чи недоведене.
Також:
- гостре респіраторне захворювання з клінічними, радіографічними або гістологічними доказами захворювання паренхіми легенів (пневмонія, гострий респіраторнийого дистрес-синдром);
- особа проживає або перебувала на Близькому Сході чи в країнах, де реєструвалися випадки МERS-CoV серед тварин і людей;
- тестування на МERS-CoV непереконливе;
Або:
- гострі гарячкові хвороби дихальної системи будь-якого ступеня тяжкості;
- прямий епідеміологічний зв’язок із підтвердженим випадком МERS-CoV;
- тестування на МERS-CoV непереконливе.
За критеріями ВООЗ, для лабораторного підтвердження МERS-CoV необхідно виявити геном вірусу (РНК) або серологічними методами у хворих, які перенесли ГРВІ з наростанням титрів імуноглобулінів G не менше ніж в 4 рази в динаміці (14 днів один від одного), або з використанням щонайменше одного скринінгу (імуноферментний аналіз, імунофлюоресценція) та аналізу нейтралізації.
Лікування
Противірусні препарати не рекомендуються для лікування близькосхідного респіраторного синдрому. ВООЗ випустила рекомендації з управління тяжкими респіраторними інфекціями, що можуть бути викликані МERS-CoV [41].
У культурі клітин і в експериментах на тваринах комбінована терапія інтерфероном альфа-2b та рибавірином — це перспектива [42, 43]. У дослідженнях, де МERS-CoV був вирощений у двох різних клітинних культурах, високі концентрації інтерферону альфа-2b та рибавірину необхідні для інгібування реплікації вірусу [42]. Тим не менше при використанні в більш низьких концентраціях інтерферону альфа-2b і рибавірину відмічається помірне зниження вірусної реплікації. Тяжко інтерпретувати результати ретроспективних досліджень, необхідна подальша оцінка даної комбінації препаратів у рандомізованих плацебо-контрольованих випробуваннях, перш ніж будуть сформульовані рекомендації з лікування.
Глюкокортикостероїди були введені спорадично МERS-інфікованим пацієнтам без будь-яких чітких критеріїв для використання та без чітких висновків щодо їх корисного впливу [24, 44]. Дані препарати були запропоновані для широкого використання в пацієнтів із тяжким гострим респіраторним синдромом, але в огляді цього досвіду відзначена загальна шкода, а не користь [45]. Їх використання не рекомендується при МERS-CoV-інфекціях.
Інші експериментальні методи лікування, такі як використання моноклональних антитіл, інгібітори вірусної протеази, що націлені на S-білок МERS-CoV, що розглядаються [46, 47].
Профілактика
ВООЗ та центри США CDC опублікували рекомендації щодо запобігання МERS-CoV-інфекції і контролю її в медичних установах [48]. Підвищений рівень заходів інфекційного контролю рекомендується при догляді за пацієнтами з передбачуваною або підтвердженою MERS-CoV-інфекцією. ВООЗ стверджує, що стандартні запобіжні заходи щодо профілактики крапельних інфекцій можна використовувати при догляді за пацієнтами з гострими інфекціями дихальних шляхів [37]. Засоби захисту очей повинні бути додані при догляді за передбачуваними або підтвердженими випадками MERS-CoV-інфекції. Бар’єрні запобіжні заходи повинні бути використані при виконанні медичних процедур.
Тимчасовий догляд на дому та ізоляція. CDC рекомендує: хворий, який на даний час оцінюється як можливий носій МERS-CoV-інфекції і не вимагає госпіталізації, може перебувати в ізоляції у своєму будинку [39].
ВООЗ рекомендує людям з високим ризиком тяжких захворювань, таких як імунодефіцитні стани, цукровий діабет, хронічні хвороби легень, раніше відомі ознаки ниркової недостатності, з обережністю відвідувати ферми, сараї, ринки, де присутні верблюди [49]. Ці заходи включають в себе: уникнення контакту з верблюдами, гігієну рук, не слід пити сире верблюже молоко, не споживати сире та погано термічно оброб-лене м’ясо.
Рекомендації для мандрівників. ВООЗ рекомендує країнам за межами постраждалих районів підтримувати високий рівень пильності, особливо країнам із великою кількістю туристів або гастарбайтерів, які повертаються з країн Близького Сходу [37]. Міністерство охорони здоров’я Саудівської Аравії рекомендує у 2015 році таким особам відкласти поїздки в Мекку, Саудівську Аравію для хаджу. Найбільш вразливими групами населення відносно можливості захворіти та небажаних ускладнень є такі:
— літні особи (віком > 65 років);
— особи з хронічними захворюваннями (серцево-судинної системи, нирок, дихальних шляхів, нервової системи, цукровим діабетом та ін.);
— особи з імунодефіцитом (вродженим чи набутим);
— пацієнти із злоякісними пухлинами;
— пацієнти з термінальною стадією захворювання;
— вагітні жінки;
— діти віком ≤ 5 років.
CDC рекомендує, щоб усі мандрівники, які подорожують до країн поблизу Аравійського півострова, часто мили руки й уникали контакту з особами, які хворі [39]. Якщо у мандрівників з’явилася лихоманка з кашлем або задишкою під час поїздки чи протягом 14 днів з моменту повернення у свою країну, вони повинні звернутися по медичну допомогу, попередньо зателефонувавши лікарю для підготовки ізоляції.
Список литературы
1. Pro.Med Mail: Novel coronavirus — Saudi Arabia: human isolate; Archive Number: 20120920.1302733. — http://www.promedmail.org/direct.php?id=20120920.1302733 (Accessed on April 22, 2013).
2. Zaki A.M., van Boheemen S., Bestebroer T.M. et al. Isolation of a novel coronavirus from a man with pneumonia in Saudi Arabia // N. Engl. J. Med. 2012; 367: 1814.
3. Annan A., Baldwin H.J., Corman V.M. et al. Human betacoronavirus 2c EMC/2012-related viruses in bats, Ghana and Europe // Emerg. Infect. Dis. 2013; 19: 456.
4. Memish Z.A., Mishra N., Olival K.J. et al. Middle East respiratory syndrome coronavirus in bats, Saudi Arabia // Emerg. Infect. Dis. 2013; 19: 1819.
5. Drosten C., Muth D., Corman V.M. et al. An observational, laboratory-based study of outbreaks of middle East respiratory syndrome coronavirus in Jeddah and Riyadh, kingdom of Saudi Arabia, 2014 // Clin. Infect. Dis. 2015; 60: 369.
6. Cauchemez S., Fraser C., Van Kerkhove M.D. et al. Middle East respiratory syndrome coronavirus: quantification of the extent of the epidemic, surveillance biases, and transmissibility // Lancet Infect. Dis 2014; 14: 50.
7. World Health Organization. Middle East respiratory syndrome coronavirus (MERS-CoV): Summary of current situation, literature update and risk assessment-as of 5 February 2015. — http://www.who.int/csr/disease/coronavirus_infections/mers-5-february-2015.pdf?ua=1 (Accessed on March 04, 2015).
8. Rha B., Rudd J., Feikin D. et al. Update on the epidemio- logy of Middle East respiratory syndrome coronavirus (MERS-CoV) infection, and guidance for the public, clinicians, and public health authorities — January 2015 // MMWR Morb. Mortal Wkly Rep. 2015; 64: 61.
9. World Health Organization. Middle East respiratory syndrome coronavirus (MERS-CoV) — Republic of Korea. — http://www.who.int/csr/don/16-june-2015-mers-korea/en/ (Accessed on June 17, 2015).
10. Corman V.M., Eckerle I., Bleicker T. et al. Detection of a novel human coronavirus by real-time reverse-transcription polymerase chain reaction // Euro Surveill. 2012; 17.
11. Memish Z.A., Zumla A.I., Al-Hakeem R.F. et al. Fa- mily cluster of Middle East respiratory syndrome coronavirus infections // N. Engl. J. Med. 2013; 368: 2487.
12. World Health Organization. Global alert and response. Novel coronavirus summary and literature update — as of 17 May 2013. — http://www.who.int/csr/disease/coronavirus_infections/update_20130517/en/index.html# (Accessed on May 17, 2013).
13. Assiri A. McGeer A., Perl T.M. et al. Hospital outbreak of Middle East respiratory syndrome coronavirus // N. Engl. J. Med. 2013; 369: 407.
14. Guery B., Poissy J., el Mansouf L. et al. Clinical features and viral diagnosis of two cases of infection with Middle East Respiratory Syndrome coronavirus: a report of nosocomial transmission // Lancet. 2013; 381: 2265.
15. World Health Organization. WHO risk assessment. Middle East respiratory syndrome coronavirus (MERS-CoV). — http://www.who.int/csr/disease/coronavirus_infections/MERS_CoV_RA_20140424.pdf?ua=1 (Accessed on April 24, 2014).
16. Kapoor M., Pringle K., Kumar A. et al. Clinical and la-boratory findings of the first imported case of Middle East respiratory syndrome coronavirus to the United States // Clin. Infect. Dis. 2014; 59: 1511.
17. World Health Organization. Middle East respiratory syndrome coronavirus (MERS-CoV) — Republic of Korea. — http://www.who.int/csr/don/24-may-2015-mers-korea/en/ (Accessed on May 26, 2015).
18. World Health Organization. Middle East respiratory syndrome coronavirus (MERS) in the Republic of Korea — situation assessment. — http://www.who.int/csr/disease/coronavirus_infections/situation-assessment/update-15-06-2015/en/ (Accessed on June 16, 2015).
19. Gulland A. Two cases of novel coronavirus are confirmed in France // BMJ. 2013; 346: f3114.
20. The Lancet Infectious Diseases. Need for global cooperation in control of MERS-CoV // Lancet Infect. Dis. 2013; 13: 639.
21. Azhar E.I., El-Kafrawy S.A., Farraj S.A. et al. Evidence for camel-to-human transmission of MERS coronavirus // N. Engl. J. Med. 2014; 370: 2499.
22. Abroug F., Slim A., Ouanes-Besbes L. et al. Family cluster of Middle East respiratory syndrome coronavirus infections, Tunisia, 2013 // Emerg. Infect. Dis. 2014; 20: 1527.
23. Hui D.S., Perlman S., Zumla A. Spread of MERS to South Korea and China // Lancet Respir. Med. 2015.
24. Arabi Y.M., Arifi A.A., Balkhy H.H. et al. Clinical course and outcomes of critically ill patients with Middle East respiratory syndrome coronavirus infection // Ann. Intern. Med. 2014; 160: 389.
25. Drosten C., Meyer B., Muller M.A. et al. Transmission of MERS-coronavirus in household contacts // N. Engl. J. Med. 2014; 371: 828.
26. Centers for Disease Control and Prevention. Health Alert Network. Notice to health care providers: updated Guidelines for Evaluation of Severe Respiratory Illness Associated with Middle East respiratory syndrome coronavirus (MERS-CoV). — http://emergency.cdc.gov/HAN/han00348.asp (Accessed on June 13, 2013).
27. World Health Organization. Middle East respiratory syndrome coronavirus (MERS-CoV) summary and literature update — as of 20 January 2014. — http://www.who.int/csr/disease/coronavirus_infections/MERS_CoV_Update_20_Jan_2014.pdf (Accessed on January 29, 2014).
28. Breban R., Riou J., Fontanet A. Interhuman transmissibi-lity of Middle East respiratory syndrome coronavirus: estimation of pandemic risk // Lancet. 2013; 382: 694.
29. Bauch C.T., Oraby T. Assessing the pandemic potential of MERS-CoV // Lancet. 2013; 382: 662.
30. Centers for Disease Control and Prevention (CDC). Update: Severe respiratory illness associated with Middle East Respiratory Syndrome Coronavirus (MERS-CoV)-worldwide, 2012–2013 // MMWR Morb. Mortal Wkly Rep. 2013; 62: 480.
31. Drosten C., Seilmaier M., Corman V.M. et al. Clinical features and virological analysis of a case of Middle East respiratory syndrome coronavirus infection // Lancet Infect. Dis. 2013; 13: 745.
32. Assiri A., Al-Tawfiq J.A., Al-Rabeeah A.A. et al. Epidemiological, demographic, and clinical characteristics of 47 cases of Middle East respiratory syndrome coronavirus disease from Saudi Arabia: a descriptive study // Lancet Infect. Dis. 2013; 13: 752.
33. Memish Z.A., Zumla A.I., Assiri A. Middle East respiratory syndrome coronavirus infections in health care workers // N. Engl. J. Med. 2013; 369: 884.
34. Memish Z.A., Al-Tawfiq J.A., Assiri A. et al. Middle East respiratory syndrome coronavirus disease in children // Pediatr. Infect. Dis. J. 2014; 33: 904.
35. World Health Organization. Interim surveillance recommendations for human infection with Middle East respiratory syndrome coronavirus. — http://www.who.int/csr/disease/coronavirus_infections/InterimRevisedSurveillanceRecommendations_nCoVinfection_14July2014.pdf?ua=1 (Accessed on March 23, 2015).
36. Centers for Disease Control and Prevention. Interim guidelines for collecting, handling, and testing clinical specimens from patients under investigation (PUIs) for Middle East respiratory syndrome coronavirus (MERS-CoV) — Version 2.1. — http://www.cdc.gov/coronavirus/mers/guidelines-clinical-specimens.html (Accessed on June 17, 2015).
37. Memish Z.A., Al-Tawfiq J.A., Makhdoom H.Q et al. Respiratory tract samples, viral load, and genome fraction yield in patients with Middle East respiratory syndrome // J. Infect. Dis. 2014; 210: 1590.
38. Corman V.M., Muller M.A., Costabel U. et al. Assays for laboratory confirmation of novel human coronavirus (hCoV-EMC) infections // Euro Surveill. 2012; 17.
39. US Food and Drug Administration. Letter of authorization: CDC novel coronavirus 2012 real-time RT-PCR assay. — http://www.fda.gov/MedicalDevices/Safety/EmergencySituations/ucm355529.htm (Accessed on June 13, 2013).
40. Chan K.H., Chan J.F., Tse H. et al. Cross-reactive antibodies in convalescent SARS patients’ sera against the emerging novel human coronavirus EMC (2012) by both immunofluorescent and neutralizing antibody tests // J. Infect. 2013; 67: 130.
41. Reusken C., Mou H., Godeke G.J et al. Specific serology for emerging human coronaviruses by protein microarray // Euro Surveill. 2013; 18: 20441.
42. World Health Organization. Interim guidance document. Clinical management of severe acute respiratory infections when novel coronavirus is suspected: What to do and what not to do. — http://www.who.int/csr/disease/coronavirus_infections/InterimGuidance_ClinicalManagement_NovelCoronavirus_11Feb13.pdf (Accessed on April 09, 2013).
43. Falzarano D., de Wit E., Martellaro C. et al. Inhibition of novel β coronavirus replication by a combination of interferon-a2b and ribavirin // Sci. Rep. 2013; 3: 1686.
44. Falzarano D., de Wit E., Rasmussen A.L. et al. Treatment with interferon-α2b and ribavirin improves outcome in MERS-CoV-infected rhesus macaques // Nat. Med. 2013; 19: 1313.
45. Al-Tawfiq J.A., Momattin H., Dib J., Memish Z.A. Ribavirin and interferon therapy in patients infected with the Middle East respiratory syndrome coronavirus: an observational study // Int. J. Infect. Dis. 2014; 20: 42.
46. Stockman L.J., Bellamy R., Garner P. SARS: systematic review of treatment effects // PLoS Med. 2006; 3: e343.
47. Guery B., van der Werf S. Coronavirus: need for a therapeutic approach // Lancet Infect. Dis. 2013; 13: 726.
48. Zhao J., Perera R.A., Kayali G. et al. Passive immunotherapy with dromedary immune serum in an experimental animal model for middle East respiratory syndrome coronavirus infection // J. Virol. 2015; 89: 6117.
49. Centers for Disease Control and Prevention. Interim infection prevention and control recommendations for hospitalized patients with Middle East respiratory syndrome coronavirus (MERS-CoV) — http://www.cdc.gov/coronavirus/mers/infection-prevention-control.html.
50. World Health Organization. Middle East respiratory syndrome coronavirus (MERS-CoV) – 13 June 2014. Update on MERS-CoV transmission from animals to humans, and interim recommendations for at-risk groups. — http://www.who.int/csr/disease/coronavirus_infections/MERS_CoV_RA_20140613.pdf?ua=1 (Accessed on June 17, 2014).
/10.jpg)
/10_2.jpg)

/11.jpg)