Статья опубликована на с. 42-47
Известно, что нутритивный дефицит приводит к серьезным нарушениям метаболизма и иммунного статуса, которые в значительной степени снижают эффективность лечения пациентов с критическими состояниями, что увеличивает продолжительность их госпитализации в отделениях интенсивной терапии (ОИТ) и связанные с этим затраты на лечение. Нутритивная поддержка, одним из методов которой является парентеральное питание, сегодня занимает важное место наряду с респираторной, инфузионной и инотропной поддержкой, рациональной антибактериальной терапией в комплексе лечения больных в критических состояниях [4].
Среди большого количества пациентов, неотъемлемой частью лечения которых является адекватная нутритивная поддержка, особого внимания требуют больные сахарным диабетом (СД) [6]. Гипогликемия и гипергликемия являются одними из основных метаболических нарушений у этих больных. И эти состояния, несмотря на успехи современной диабетологии, сохраняют высокую частоту осложнений и летальности [10]. Известно также, что повышение уровня глюкозы приводит к увеличению количества случаев инфекций, системной полиорганной недостаточности вследствие провоспалительных процессов и клеточной токсичности, непосредственно связанных с высоким уровнем глюкозы [9].
Диагностика белково-энергетической недостаточности
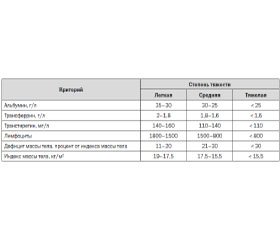
Прежде чем принять решение о необходимости и объеме нутритивной поддержки, необходимо оценить степень белково-энергетической недостаточности. Для этого используют совокупную оценку антропометрических и лабораторных показателей (табл. 1).
Для оценки нутритивного статуса также можно использовать ряд дополнительных показателей:
— толщину кожной складки трицепса;
— окружность плеча;
— расчет тощей массы (функционально активной массы организма);
— уровень активности сывороточной холинэстеразы;
— креатинин-ростовой индекс.
Однако эти методы при тяжелом (критическом) состоянии больного малоинформативны.
Все нутриенты разделяют на донаторы энергетического материала (углеводы, липиды) и донаторы пластического материала (аминокислоты и белки). Классическое правило парентерального питания подчеркивает: только сочетанное применение донаторов энергетического и пластического материала позволяет достичь синтеза белка как окончательного результата нутритивной поддержки [1].
Парентеральное питание у больных сахарным диа–бетом
Парентеральное питание (ПП) (греч. рara — «мимо», enteron — «кишка») — способ введения необходимых организму нутриентов мимо ЖКТ непосредственно в кровь.
Показания к проведению парентерального пи–тания:
— предоперационная подготовка больных для улучшения результатов хирургического вмешательства;
— невозможность введения зонда для энтерального питания (ЭП);
— нефункционирующий ЖКТ (неукротимая рвота, профузная диарея);
— выраженная белковая или белково-энергетическая недостаточность у пациента;
— необходимость временного исключения ЖКТ;
— невозможность адекватного обеспечения питанием через зонд;
— химио- и лучевая терапия по поводу онкологических заболеваний;
— печеночная или почечная недостаточность;
— в послеоперационном периоде, когда невозможно питание через ЖКТ;
— выраженный катаболизм, когда лишь ЭП не позволяет справиться с потерями и дефицитом протеинов.
Противопоказания к проведению парентерального питания:
— рефрактерный шок;
— выраженная сердечная декомпенсация (угроза отека легких);
— неконтролируемая артериальная гипертензия (гипертонический криз);
— значительная дегидратация или гипергидратация;
— значительные нарушения кислотно-щелочного равновесия, ионного баланса и осмолярности крови;
— декомпенсация сахарного диабета;
— анафилаксия на составные компоненты питательных смесей;
— жировая эмболия;
— непереносимость отдельных составляющих питания.
Хотим обратить внимание на то, что выделенные нами жирным шрифтом противопоказания к ПП можно считать относительными и временными. И дегидратация, и нарушение кислотно-щелочного равновесия, ионного баланса и осмолярности крови — все это проявления декомпенсации сахарного диабета. На фоне проведения интенсивной терапии декомпенсации диабета происходит нормализация этих параметров, а значит, уменьшается количество противопоказаний к проведению парентерального питания [5].
Если ЭП противопоказано или цель энтерального питания не достигается и сохраняется необходимость в нутритивной поддержке, целевая группа ASPEN рекомендует использование ПП.
Сосудистый доступ. Если показано ПП, целевая группа ASPEN рекомендует проводить доставку нутриентов с использованием однопросветного центрального катетера, введенного через периферическую вену. Кроме того, возможны следующие варианты доставки питательных веществ:
— периферический катетер для венозного доступа может использоваться для проведения кратковременного питания (не более 5–10 дней) или введения низкоосмолярных смесей (< 900 мОсмоль/л) (рекомендация C);
— центральный венозный доступ используют для назначения продолжительного ПП (более 7–10 дней) или для введения высокоосмолярных смесей (рекомендация C).
ПП может быть дополнительным, когда применяется в сочетании с зондовым или оральным питанием, и полным, когда все нутриенты вводятся лишь внутривенно.
Полное ПП должно быть полноценным: все необходимые нутриенты (аминокислоты, углеводы, жиры, вода, электролиты, витамины и микроэлементы) должны быть представлены в необходимом количестве.
Потребность в основных ингредиентах
Потребность в белках. Не существует достаточных доказательств для определения конкретного источника азота для критически больных пациентов с сахарным диабетом или с гипергликемией. Рекомендуется определять потребность в белке в соответствии с метаболическим уровнем стресса пациента: 1,3–1,7 г белка/кг/сут в зависимости от состояния организма, с тем чтобы предотвратить обострение катаболизма белка. Наиболее точно потребность в белках может быть рассчитана по уровню экскреции азота с мочой. Формула для определения суточной потребности в белке следующая:
Суточная потребность в белке (г/сут) = (мочевина мочи (ммоль/л) • диурез за сутки (л) ×
×0,033 + 4 г вне почечных потерь + 2–4 г на анаболические процессы) • 6,25 [1].
Применение этого метода ограничено при острой или хронической почечной недостаточности, диурезе более 5 л/сут и при циррозе печени.
При невозможности определения потребности в белке по экскреции азота с мочой суточная доза белков должна составлять 1,5–2 г/кг массы тела.
Потребность в углеводах. Минимальное количество углеводов при ПП должно составлять около 2 г/кг глюкозы ежедневно. Процент углеводов в структуре небелковых калорий колеблется в диапазоне 50–70 %. Избыточное введение углеводов приводит к пропорциональному увеличению минутной вентиляции легких, жировой дистрофии печени, гиперосмолярности плазмы. Кроме того, известно, что гипергликемия (глюкоза > 10 ммоль/л) ассоциируется с повышением летальности у больных в критических состояниях и частоты инфекционных осложнений.
Как снижение, так и повышение летальности у пациентов ОИТ наблюдалось при поддержке концентрации глюкозы в крови 4,5–6,1 ммоль/л. Сейчас нет однозначных рекомендаций по этому вопросу. Оказалось, что количество случаев тяжелой гипогликемии (< 2,2 ммоль/л) увеличивалось среди пациентов с жестким контролем гликемии.
Потребность в жирах. Жировые эмульсии должны быть составной частью ПП для обеспечения энергии и для введения эссенциальных жирных кислот у пациентов, которые продолжительно находятся в ОИТ. Жиры должны составлять не меньше 30 % от общего количества небелковых калорий [1].
Основные субстраты для парентерального питания
Растворы аминокислот. Современная концепция ПП предусматривает использование в качестве источника азота лишь растворов кристаллических аминокислот разных концентраций (5, 10, 15%). Аминокислотные растворы, разработанные для использования у взрослых, должны содержать 13–20 аминокислот, включая все незаменимые аминокислоты.
Сбалансированные аминокислотные смеси должны вводиться в количестве 1,3–1,5 г/кг идеальной массы тела каждый день, одновременно с адекватным потреблением энергосубстратов.
Глюкоза — главный энергетический субстрат, который используется большинством клеток тела, включая центральную и периферическую нервную систему, а также клетки крови и клетки основных субстанций заживающих ран. Усвоение глюкозы и ее утилизация значительно ухудшаются под влиянием таких гормонов, как катехоламины, глюкагон, кортизол, которые вызывают повышение уровня глюкозы в плазме, глюкозурию и гиперосмолярную кому.
Таким образом, большая нагрузка глюкозой является дополнительным стрессорным фактором, о чем свидетельствует повышенное высвобождение катехоламинов.
Максимальная скорость инфузии глюкозы для взрослых пациентов составляет 5 г/кг/сут.
Применение глюкозы может приводить к серьезным осложнениям:
— к гипергликемии с гиперосмолярным синдромом;
— риску гипогликемии в связи с добавлением в концентраты глюкозы инсулина;
— активации липогенеза и жировой инфильтрации печени;
— увеличению минутного объема дыхания и изменению респираторного коэффициента [5].
Кроме того, у многих больных СД есть исходная гипергликемия, а часто и субкомпенсированные и декомпенсированные состояния, когда уровень гликемии намного превышает порог в 13,9 ммоль/л. Напомним, что при таком уровне гликемии введение растворов глюкозы не рекомендуется [2, 5].
Все приведенные выше аргументы диктуют необходимость поиска альтернативных глюкозе источников энергии при парентеральном питании у больных СД.
Жировые эмульсии. Для обеспечения организма энергией и основными жирными кислотами в клинической практике используют введение 10 и 20% жировых эмульсий. Состав жировых эмульсий за последние годы регулярно обновлялся благодаря желанию найти оптимальное количество и качество их ингредиентов, ведь жирные кислоты являются не только полноценными источниками энергии, но и веществами, которые позволяют регулировать важные метаболические и иммунные процессы [1]. Тем не менее, назначая больным СД жировые эмульсии, нужно помнить о возможных противопоказаниях к их использованию:
— гиперлипидемии;
— шоке;
— ДВС-синдроме;
— ацидозе (рН < 7,2);
— гипоксемии;
— нарушении микроциркуляции.
К сожалению, больные СД часто имеют состояния и сопутствующую патологию, которые становятся для них противопоказанием к введению жировых эмульсий. Это и гиперлипидемия, которая является одним из симптомов метаболического синдрома. Это и диабетический кетоацидоз, при котором наблюдается тяжелый метаболический ацидоз и рН часто снижается до уровня 7,0–7,1. Это и гиперосмолярная кома, при которой у больных часто развивается ДВС-синдром, гипоксемия и нарушение микроциркуляции. При обоих названных состояниях декомпенсации СД имеется тяжелая дегидратация, которая иногда достигает степени гиповолемического шока.
Таким образом, у многих больных СД, особенно с тяжелым его течением, полноценное парентеральное питание с введением жировых эмульсий невозможно из-за наличия противопоказаний. В таких ситуациях становится актуальным введение растворов, которые можно рассматривать как альтернативные жировым эмульсиям источники энергии.
Микроэлементы и витамины. Все формулы для ПП должны включать суточные дозы мультивитаминов и микроэлементов. Дозы микронутриентов должны быть в сбалансированных пропорциях с другими субстратами в зависимости от этиологии заболеваний. При проведении продолжительной заместительной почечной терапии, когда возможны значительные потери водорастворимых микронутриентов, необходимо взрослым вводить 1–2-кратные более высокие дозы селена, цинка, тиамина каждый день.
Тиамин в дозе 100–300 мг/сут должен вводиться в первые дни парентерального питания при возможном начальном его дефиците, особенно у лиц, которые употребляют алкоголь. Дефицит витамина В1 (тиамина пирофосфата), который является кофактором 4 ключевых ферментов (пируватдегидрогеназы, α-кетоглутаратдегидрогеназы (цикл Кребса), α-кетодегидрогеназы (преобразование разветвленных аминокислот) и транскетолазы (пентозофосфатный путь), вызывает накопление пирувата и лактата, уменьшает образование ацетил-СоА и последующее снижение концентрации ацетилхолина и угнетение активности ЦНС, а снижение активности пентозофосфатного пути приводит к снижению уровня НАДФ, необходимого для синтеза жирных кислот и миелина (периферическая нейропатия).
Не существует никаких доказательств того, что антиоксидантные витамины в повышенных дозах безопасны или приносят какую-то пользу [3, 7]. Вклад окислительного стресса при диабетических осложнениях, и в частности у тяжелобольных, не является очевидным, поскольку повреждение тканей происходит у пациентов с сахарным диабетом, но не у больных с резистентностью к инсулину, которая развивается при критических состояниях. Нет доказательств эффективности антиоксидантов в профилактике и контроле осложнений, связанных с гипергликемией [8, 11].
Таким образом, проведение классического ПП с применением рекомендованных доз глюкозы и жировых эмульсий у многих больных СД оказывается невозможным. Значит, существует необходимость разработки новых схем ПП с привлечением альтернативных липидам и глюкозе источников энергии. Интересной и перспективной схемой ПП является комбинация смеси аминокислот и препаратов с альтернативными источниками энергии (например, ксилитолом). Такую возможность предоставляет введение отечественных растворов Аминол и Глюксил.
Аминол является раствором, который содержит рекомендованное для адекватного ПП количество аминокислот. В частности, 1 мл раствора содержит 13 аминокислот: аланина — 6,4 мг; аргинина гидрохлорида — 6,4 мг; валина — 4,9 мг; гистидина гидрохлорида моногидрата — 3,2 мг; глицина — 8,0 мг; изолейцина — 4,4 мг; лейцина — 9,8 мг; лизина гидрохлорида — 11,5 мг; метионина — 5,7 мг; пролина — 6,4 мг; треонина — 4,3 мг; триптофана — 1,44 мг; фенилаланина — 7,0 мг, в том числе все незаменимые аминокислоты (изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан, валин). Такой состав смеси дает возможность задействовать в строительстве белка все необходимые для этого материалы. При условии обеспечения энергетических нужд аминокислоты включаются в биосинтез белков, способствуют положительному азотному балансу и устраняют белковый дефицит (донатор пластического материала). В качестве дополнительного источника энергии в препарат включен раствор сорбитола.
Основные и дополнительные (альтернативные) источники энергии содержатся во втором препарате анализируемой смеси — растворе Глюксил. Главными действующими веществами в этом препарате являются глюкоза и ксилит. О роли глюкозы в программах ПП уже было сказано, как и о том, что у больных СД использовать растворы глюкозы в полном объеме часто бывает невозможно. Поэтому интересно присмотреться к другим, альтернативным источникам энергии, которые могут частично заменить глюкозу. Одним из таких источников может быть ксилит — пятиатомный спирт, который при внутривенном введении быстро включается в пентозофосфатный цикл метаболизма. Ксилит, в отличие от фруктозы, не приводит к снижению в печени адениннуклеотидов (АТФ, АДФ, АМФ), он безопасен для введения больным с повышенной чувствительностью к фруктозе или дефицитом фермента фруктоза-1,6-дифосфатазы. Считается, что ксилит оказывает большее антикетогенное, азотосохраняющее действие, чем глюкоза, и одинаково хорошо усваивается как в пред-, так и в послеоперационном периоде. С учетом того, что ксилит является источником энергии с независимым от инсулина метаболизмом, действует антикетогенно и липотропно, он может использоваться в комплексе парентерального питания больных.
Собственный опыт
Схема сочетанного использования раствора аминокислот Аминол и комбинированного препарата Глюксил была применена нами у 24 больных сахарным диабетом, которые проходили лечение в отделении интенсивной терапии КУ КОС «Киевская областная клиническая больница». Состояние больных было осложнено сопутствующими заболеваниями (острое нарушение мозгового кровообращения, перитонит, гипергликемическая кома и гиперосмолярное состояние), которые требовали проведения ПП. Причем во всех случаях были абсолютные или относительные противопоказания к введению липидных смесей. Аминол назначали в суточной дозе 400–600 мл (7–8 мл/кг) в течение 5 суток. Раствор Глюксил применяли в дозе 5–10 мл/кг/сут с учетом осмолярности крови и мочи и под контролем содержания сахара в крови, а при необходимости применяли инсулин (из расчета 1 единица инсулина на 4–5 г глюкозы). В качестве липидной составляющей мы использовали раствор Липофундин МСТ/ЛСТ 20% в сниженной дозе 5 мл/кг массы тела в сутки.
Наш первый опыт показал, что на фоне применения указанной программы ПП у больных наблюдалась положительная динамика оценки сознания (по шкале комы Глазго), в неврологическом статусе (уменьшение баллов по шкале NIHSS), происходила быстрая стабилизация гликемии и устранение кетонемии и кетонурии. Первый опыт показал, что интенсивная терапия больных СД с применением комбинации препаратов Аминол и Глюксил в целом переносилась хорошо и не сопровождалась значимыми побочными эффектами. Нужны дополнительные экспериментальные и клинические исследования комбинации этих веществ, для того чтобы окончательно выяснить роль и место указанных препаратов в лечении и программах парентерального питания больных сахарным диабетом.
Выводы
1. Проблема адекватного и полноценного клинического питания больных сахарным диабетом остается в центре внимания многих клиницистов. Проведение комплекса современного парентерального питания позволяет лучше контролировать уровень сахара в крови и предупреждать возникновение осложнений, вызванных гипергликемией, у критических пациентов с сахарным диабетом или у пациентов со стрессовым повышением сахара в крови.
2. У больных сахарным диабетом известные противопоказания к парентеральному питанию (дегидратация, нарушение кислотно-щелочного равновесия, водно-электролитного баланса и осмолярности крови) можно считать относительными и временными. Все это проявления декомпенсации сахарного диабета. На фоне проведения интенсивной терапии декомпенсации происходит нормализация этих параметров, а значит, уменьшается количество противопоказаний к проведению парентерального питания.
3. Общее содержание калорий и пропорции между отдельными элементами питания имеют существенное значение для организации нутритивной поддержки и должны отвечать рекомендациям Европейской и Американской ассоциаций парентерального и энтерального питания (ESPEN, ASPEN).
4. Интенсивная терапия больных СД с применением комбинации препаратов Аминол и Глюксил хорошо переносится больными и не сопровождается значимыми побочными эффектами.
5. Нужны дополнительные экспериментальные и клинические исследования комбинации Аминола и Глюксила, для того чтобы окончательно выяснить роль и место указанных препаратов в лечении и программах парентерального питания больных сахарным диабетом.

/43.jpg)