Резюме
Целью настоящего исследования было изучение эффективности препарата амантадина сульфат (ПК-Мерц) на госпитальном этапе у пациентов с тяжелой черепно-мозговой травмой (ЧМТ) с целью ранней нейропротекции за счет коррекции глутаматной эксайтотоксичности.
Материал и методы исследования. Исследование проводилось в 2012–2014 годах в ДОКТМО на базе кафедры анестезиологии и интенсивной терапии ФПО Донецкого национального медицинского университета им. М. Горького. Обследовано 60 пациентов с диагнозом «тяжелая черепно-мозговая травма».
Дизайн исследования. Открытое проспективное исследование по типу «случай — контроль», которое проводится в группе пациентов с тяжелой ЧМТ. Уровень нарушения сознания при поступлении в стационар от 4 до 8 баллов по шкале комы Глазго (ШКГ); возраст от 20 до 50 лет; 1-я группа состояла из 30 пациентов, получавших терапию по стандартному протоколу, 2-я группа — из 30 больных, получавших, кроме терапии по протоколу, препарат амантадин (ПК-Мерц), который применяли с первых суток после получения травмы в виде инфузионного раствора в дозе 500 мл (200 мг) 2 раза в сутки внутривенно медленно капельно в течение 7 суток. Изучали цереброкардиальные взаимоотношения у больных с тяжелой ЧМТ методами количественной электроэнцефалографии и кросс-корреляционного анализа вариабельности сердечного ритма, исследовали мозговой кровоток с помощью транскраниальной допплерографии, компьютерной томографии головного мозга.
Результаты и обсуждение. Установлены высокие прямые корреляционные связи между повышением уровня сознания по шкале комы Глазго и снижением уровня абсолютной спектральной мощности дельта-диапазона, которые свидетельствовали о том, что после включения в терапию амантадина (ПК-Мерца) именно снижение глутаматергической активности (снижение δ-, рост α- и β1- и β2-ритмов) у пациентов с тяжелой ЧМТ приводит к повышению уровня сознания. Это сочеталось с ростом мощности низкочастотного спектра вариабельности сердечного ритма, что отражало значимую активацию стрессреализующих механизмов адаптации. Снижение глутаматергической активности с помощью амантадина (ПК-Мерца) сопровождалось активацией холинергической активности и умеренной активацией дофаминергической активности, преимущественно в проекции стволовых структур, что способствовало восстановлению уровня сознания. Уже на 3-и сутки терапии шанс восстановления сознания на 5 и более баллов по ШКГ был выше в группе, где применяли дополнительно к стандартному протоколу лечения амантадин (ПК-Мерц).
У больных установлено резкое ослабление межполушарного взаимодействия большинства когерентных связей в основных частотных диапазонах электроэнцефалограммы (ЭЭГ), отражающее степень торможения коры головного мозга. В динамике терапии с применением амантадина происходит усиление межполушарных когерентных связей фоновой ЭЭГ, выход из тормозного состояния коры.
При исследовании реактивности мозга в динамике терапии амантадином во второй группе исследования, в отличие от 1-й, отмечено статистически значимое (χ2, W-W, кКУ — p ≤ 0,05) снижение kfc-1 = (δ + θ + β1)/(α + β2) на обеих половинах мозга, свидетельствующее об уменьшении дезорганизации ЭЭГ-паттерна более чем на 30 %.
По данным транскраниальной допплерографии, на 7-е сутки интенсивной терапии при благоприятном течении заболевания отмечен достоверный (р ≤ 0,05, χ2; Т-W) рост скорости венозного оттока, симметричное снижение линейной скорости кровотока, уменьшение вазоконстрикции интракраниальных сосудов практически до нормальных значений в обеих группах больных без четкой разницы.
Выводы. Уже на 3-и сутки терапии шанс восстановления сознания на 5 и более баллов по ШКГ был выше в группе, в которой применяли дополнительно к стандартному протоколу лечения амантадин (ПК-Мерц) (ОR ± 95% ДИ = 6,5 (1,8–23,2) при S = 0,649).
Риск летального исхода на 7-е сутки был выше в группе, в которой использовали только стандартный комплекс лечения по протоколу (RR ± 95% ДИ = 0,273 (0,084–0,881) при S = 0,598).
Применение амантадина (ПК-Мерца) в острейшем периоде тяжелой ЧМТ обусловливало статистически значимое снижение риска смерти (р = 0,050).
Метою цього дослідження було вивчення ефективності препарату амантадину сульфат (ПК-Мерц) на госпітальному етапі в пацієнтів із тяжкою черепно-мозковою травмою (ЧМТ) з метою ранньої нейропротекції за рахунок корекції глутаматної ексайтотоксичності.
Матеріал і методи дослідження. Дослідження проводилося в 2012–2014 роках в ДОКТМО на базі кафедри анестезіології та інтенсивної терапії ФПО Донецького національного медичного університету ім. М. Горького. Обстежено 60 пацієнтів із діагнозом «тяжка черепно-мозкова травма».
Дизайн дослідження. Відкрите проспективне дослідження за типом «випадок — контроль», яке проводиться в групі пацієнтів із тяжкою ЧМТ. Рівень порушення свідомості при надходженні до стаціонару від 4 до 8 балів за шкалою коми Глазго (ШКГ); вік від 20 до 50 років; 1-ша група — 30 пацієнтів, які отримували терапію за стандартним протоколом, 2-га група — 30 хворих, які отримували, крім терапії за протоколом, препарат амантадин (ПК-Мерц), який застосовували з першої доби після отримання травми у вигляді інфузійного розчину в дозі 500 мл (200 мг) 2 рази на добу внутрішньовенно повільно крапельно протягом 7 діб. Вивчали цереброкардіальні взаємини у хворих із тяжкою ЧМТ методами кількісної електроенцефалографії і крос-кореляційного аналізу варіабельності серцевого ритму, досліджували мозковий кровотік за допомогою транскраніальної допплерографії, комп’ютерної томографії головного мозку.
Результати та обговорення. Установлені високі прямі кореляційні зв’язки між підвищенням рівня свідомості за шкалою коми Глазго і зниженням рівня абсолютної спектральної потужності дельта-діапазону, що свідчили про те, що після включення в терапію амантадину (ПК-Мерца) саме зниження глутаматергічної активності (зниження δ-, зростання α - і β1- і β2-ритмів) у пацієнтів із тяжкою ЧМТ призводить до підвищення рівня свідомості. Це поєднувалося зі зростанням потужності низькочастотного спектра варіабельності серцевого ритму, що відображало значиму активацію стресреалізуючих механізмів адаптації. Зниження глутаматергічної активності за допомогою амантадину (ПК-Мерца) супроводжувалося активацією холинергічної активності й помірною активацією дофамінергічної активності, переважно в проекції стовбурових структур, що сприяло відновленню рівня свідомості. Уже на 3-тю добу терапії шанс відновлення свідомості на 5 і більше балів за ШКГ був вищим в групі, де застосовували додатково до стандартного протоколу лікування амантадин (ПК-Мерц).
У хворих встановлено різке ослаблення міжпівкульної взаємодії більшості когерентних зв’язків в основних частотних діапазонах електроенцефалограми (ЕЕГ), що відображає ступінь гальмування кори головного мозку. У динаміці терапії із застосуванням амантадину відбувається посилення міжпівкульних когерентних зв’язків фонової ЕЕГ, вихід із гальмівного стану кори.
При дослідженні реактивності мозку в динаміці терапії амантадином у другій групі дослідження, на відміну від першої, відзначено статистично значуще (χ2, W-W, ККУ — p ≤ 0, 05) зниження kfc-1 = (δ + θ + β1)/(α + β2) на обох половинах мозку, що свідчить про зменшення дезорганізації ЕЕГ-патерну більше ніж на 30 %.
За даними транскраніальної допплерографії, на 7-му добу інтенсивної терапії при сприятливому перебігу захворювання відзначене вірогідне (р ≤ 0,05, χ2; Т-W) зростання швидкості венозного відтоку, симетричне зниження лінійної швидкості кровотоку, зменшення вазоконстрикції інтракраніальних судин практично до нормальних значень в обох групах хворих без чіткої різниці.
Висновки. Уже на третю добу терапії шанс відновлення свідомості на 5 і більше балів за ШКГ був вищий у групі, в якій застосовували додатково до стандартного протоколу лікування амантадин (ПК-Мерц) (ОR ± 95% ДІ = 6,5 (1,8–23,2) при S = 0,649).
Ризик летального результату на 7-му добу був вищий у групі, в якій використовували тільки стандартний комплекс лікування за протоколом (RR ± 95% ДІ = 0,273 (0,084–0,881) при S = 0,598).
Застосування амантадину (ПК-Мерца) в найгострішому періоді тяжкої ЧМТ обумовлювало статистично значуще зниження ризику смерті (р = 0,050).
The objective of this study was to investigate the efficacy of amantadine sulfate (PK-Merz) during hospital stay in patients with severe traumatic brain injury (TBI) with a view to an early neuroprotection by correction of glutamate excitotoxicity.
Material and methods of the study. The study was conducted in 2012–2014 in Donetsk regional clinical territorial medical association at the department of anesthesiology and intensive care of the faculty of postgraduate education of Donetsk national medical university named after M. Horkyi. The study involved 60 patients with a diagnosis of severe traumatic brain injury.
Design of the study. An open-label, prospective, case-control study carried out in the group of patients with severe TBI. The level of impaired consciousness on admission from 4 to 8 points on the Glasgow Coma Scale (GCS); age 20 to 50 years; group 1 consisted of 30 patients treated with the standard protocol, group 2 — of 30 patients, who received, in addition to treatment protocol, amantadine (PK-Merz), which was used from the first day after the injury in the form of an infusion solution at a dose of 500 ml (200 mg) 2 times a day by slow intravenous infusion, for 7 days. We have studied cerebrocardial relationships in patients with severe TBI using the methods of quantitative electroencephalography (EEG) and cross-correlation analysis of heart rate variability, cerebral blood flow was investigated using transcranial Doppler, computerized tomography of the brain.
Results and discussion. A high direct correlation between the increase in the level of consciousness by Glasgow Coma Scale and the decline in the absolute spectral power of delta-range, which testified that after inclusion of amantadine (PK-Merz) in the therapy, a reduction of glutamatergic activity (decrease of δ-, growth of α-, β1- and β2-rhythms) in patients with severe TBI leads to higher levels of consciousness. This was associated with an increase in the power of low-frequency spectrum of heart rate variability that reflected a significant activation of stress-realizing adaptation mechanisms. A decrease of glutamatergic activity when using amantadine (PK-Merz) was accompanied by the activation of the cholinergic activity and a moderate activation of dopaminergic activity, primarily in the projection of stem structures that helped to restore the level of consciousness. Already on the 3rd day of therapy, a chance to regain consciousness by 5 points or more on the GCS was higher in the group, in which, in addition to standard treatment protocols, amantadine (PK-Merz) was used.
Patients had a sharp weakening of hemispheric interaction in most coherent links in the main frequency bands of the electroencephalogram, which reflects the degree of inhibition of the cerebral cortex. In the dynamics of therapy with amantadine, there is a strengthening of hemispheric coherent relations of background EEG, exit from the inhibitory state of the cortex.
When studying brain reactivity in the dynamics of amantadine therapy, in the 2nd study group, in contrast to the 1st, there was a statistically significant (χ2, W-W, OER p ≤ 0.05) decrease of kfc-1 = (δ + θ + β1)/(α + β2) on both sides of the brain, indicating a reduction in the EEG pattern disruption for more than 30 %.
According to transcranial Doppler, on the 7th day of intensive care, with a favorable course of the disease, there was a significant (p ≤ 0.05, χ2; T-W) growth rate of venous outflow, symmetrical reduction of linear blood flow velocity, reduced vasoconstriction of intracranial vessels to near normal values in both groups of patients, without a clear difference.
Conclusions. Already on the 3rd day of therapy, a chance to regain consciousness by 5 points or more on the GCS was higher in the group, in which, in addition to standard treatment protocols, amantadine (PK-Merz) was used (OR ± 95% CI = 6.5 (1.8–23.2) at S = 0.649).
The risk of death on the 7th day was higher in the group, in which only a standard set of protocol treatment was used (RR ± 95% CI = 0.273 (0.084–0.881) at S = 0.598).
The use of amantadine (PK-Merz) in the peracute phase of severe TBI has determined a statistically significant reduction in risk of death (p = 0.050).
Статья опубликована на с. 81-91
Степень тяжести и прогноз течения черепно-мозговой травмы (ЧМТ) определяются первичным фактором (воздействием травмирующего агента на головной мозг) и вторичными повреждающими факторами, ведущим из которых является гипоксия [1, 2, 24, 28].
Комбинация травматического повреждения мозга и ишемии вызывает острую (быстрая эк–сайтотоксичность) и отсроченную нейрональную гибель [3, 4]. Теория эксайтотоксичности достаточно полно объясняет механизмы гибели нейронов при повреждениях головного мозга различного генеза [5]. Глутамат-кальциевый каскад активируется избыточным высвобождением возбуждающих нейротрансмиттеров глутамата и аспартата из окончаний ишемизированных нейронов в межклеточное пространство [6]. Нейротоксичность глутамата может реализовываться через все под–типы ионотропных рецепторов: N-метил-D-аспартат (NMDA), 2-амино-3-гидрокси-4-изоксазол-5-метил–пропановая кислота (АМРА), каиновая кислота и 2-амино-4-фосфатнобутановая кислота (L-AP4) и метаботропные рецепторы (mGluR) [7]. В повреждении нейронов, обусловленном NMDA-рецепторами, выделяют два компонента: быстрый натрийзависимый компонент, приводящий к немедленному отеку клетки, и медленный кальцийзависимый компонент, обусловливающий отсроченную деструкцию клетки. В условиях низкой интенсивности активации NMDA-рецепторов кальцийзависимый компонент превалирует [9].
Избыточное накопление кальция внутри клетки в ишемизированных нейронах за счет связывания с внутриклеточным рецептором кальмодулином вызывает активацию клеточных ферментов (протеинкиназы, липазы, нуклеазы), обусловливающих образование NO, свободных радикалов, разрушение внутриклеточных белков, фосфолипидов, нуклеиновых кислот. Комбинация этих патобиохимических процессов приводит к гибели нейронов как путем некроза, так и апоптоза [27].
Одним из перспективных направлений пост–ишемической коррекции церебрального гомеостаза является применение препаратов, действие которых направлено на прерывание быстрых реакций глутамат-кальциевого каскада. К препаратам с глутамат-блокирующим действием относится оригинальный амантадина сульфат (ПК-Мерц®), позиционируемый ранее только как противопаркинсоническое средство. Амантадин — неконкурирующий антагонист дофаминовых и NMDA-рецепторов, который увеличивает содержание дофамина в полосатом теле, применяется наряду с другими для улучшения когнитивных функций при вегетативном статусе и синдроме «малого сознания» [8]. На фоне коматозного состояния истощаются резервы эндогенного дофамина, что клинически проявляется брадикинезией и низким когнитивным уровнем. Последующее восстановление сознания и двигательной активности зависит от темпа восстановления концентрации дофамина. Амантадин не только способен активно стимулировать выделение дофамина из нейрональных депо, повышать чувствительность дофаминергических рецепторов к медиатору дофамину и нормализовать нейрофизиологические интрацеребральные процессы, но и одновременно обладает стабилизирующим действием на специфические глутаматергические рецепторы, прерывая нарастание глутаматного выброса и подавляя глутаматную эксайтотоксичность, запускающую последующие патобиохимические механизмы постишемического каскада [8].
Публикации, освещающие нейропротективные свойства оригинального амантадина сульфата (ПК-Мерц®) в терапии инсульта и травмы, содержат доказательства эффективности его применения [9–13].
Представлены результаты двойного слепого плацебо-контролируемого исследования по изучению эффективности амантадина при тяжелой черепно-мозговой травме [11]. Обследовано 35 пациентов с травматическим повреждением мозга вследствие ДТП. Амантадин назначался в дозе 200 мг внутривенно 2 раза в сутки в течение 6 недель. Получены обнадеживающие статистически достоверные результаты в виде существенного улучшения по шкалам функциональной независимости и недееспособности, достоверные различия по шкале комы Глазго (ШКГ). Аналогичные выводы сделаны D. Steube и соавторами [13] в результате открытого проспективного исследования 38 пациентов с травматическим повреждением головного мозга и тяжелыми расстройствами вигильности.
Подтверждены нейропротективные свойства амантадина сульфата [12] в открытом рандомизированном сравнительном ретроспективном исследовании у 68 пациентов в коме после тяжелой черепно-мозговой травмы. Показано, что инфузии ПК-Мерца улучшают прогноз при церебральной коме вследствие травмы: процент больных с восстановленным сознанием был достоверно выше среди получавших амантадин — 60,6 против 33,3 % контрольной группы, а также достоверно уменьшилось число летальных исходов у больных, получавших амантадин (6 % против 51,5 % в контрольной группе).
Поэтому представляется перспективным дальнейшее изучение эффективности препарата амантадин у пациентов с травматическим поражением головного мозга.
Цель: изучение эффективности применения препарата амантадина сульфат (ПК-Мерц®) у больных с тяжелой ЧМТ с целью ранней нейропротекции для коррекции глутаматной эксайтотоксичности.
Материал и методы исследования
Исследование проводилось в 2012–2014 годах в ДОКТМО на базе кафедры анестезиологии, интенсивной терапии (ИТ) и медицины неотложных состояний факультета последипломного образования Донецкого национального медицинского университета им. М. Горького. Всего в исследовании принимали участие 60 пациентов с диагнозом «тяжелая черепно-мозговая травма» (табл. 1).
Дизайн исследования: открытое проспективное исследование по типу «случай — контроль», которое проводилось в группе пациентов с тяжелой ЧМТ.
Критериями включения в исследование являлись: тяжелая черепно-мозговая травма; уровень нарушения сознания при поступлении в стационар от 4 до 8 баллов по шкале комы Глазго; возраст от 20 до 50 лет; согласие родственников пациента на участие в исследовании. К критериям исключения относились: количество баллов по шкале комы Глазго меньше 4 и больше 8; наличие двухстороннего фиксированного мидриаза; САД при поступлении менее 90 мм рт.ст.; SaO2 при поступлении < 93 %; известная гиперчувствительность к препарату амантадин (ПК-Мерц); наличие сопутствующих некомпенсированных заболеваний или острых состояний, способных существенно повлиять на результаты исследования; участие в любом другом клиническом исследовании.
1-я группа состояла из 30 пациентов, получавших терапию по стандартному протоколу [25]. Стандартная терапия включала: гемодинамическую поддержку (Tripple H Therapy), респираторную поддержку, обязательным являлось правило 4 катетеров и стабилизация шейного отдела позвоночника, использовали противосудорожную терапию, нормализовали температуру тела, поддерживали нормогликемию (инфузия инсулина). Проводили профилактику трофических расстройств, развития стрессовых язв в желудочно-кишечном тракте, гнойно-септических осложнений, защиту глаз. Обязательными были аналгоседация, дегидратационная терапия, антиоксидантная терапия, парентеральное и энтеральное питание.
2-я группа включала 30 больных, получавших, кроме терапии по протоколу, оригинальный амантадина сульфат (ПК-Мерц®, Merz Pharma GmbH & Co. KGaA (Германия)) [8, 9], который применяли в первые сутки после получения травмы в виде инфузионного раствора в дозе 500 мл (200 мг амантадина сульфата) 2 раза в сутки внутривенно медленно капельно в течение 7 суток от момента поступления больных в стационар. Скорость инфузии 500 мл амантадина сульфата (ПК-Мерц®) составляла 180 минут.
Для оценки терапевтической эффективности и переносимости исследуемого препарата пациентам проведено обследование с применением следующих методов: физикальный и неврологический –осмотр (очаговая и дислокационная симптоматика, нарушения уровня сознания по шкале комы Глазго); исследование мозгового кровотока с помощью транскраниальной допплерографии; электроэнцефалография (ЭЭГ) с топографическим картированием; вариационная пульсометрия; компьютерная томография (КТ) головного мозга.
Исследование пациентов проводили в специально оборудованном реанимационном зале (лаборатория по исследованию функции мозга). ЭЭГ и ЭКГ регистрировали параллельно у исследуемого в состоянии расслабленного бодрствования на протяжении не менее 30 минут. Наложение –ЭЭГ-электродов согласно международной системе «10–20». В качестве аппаратной составляющей диагностического комплекса применялся компьютерный цифровой энцефалограф NIHON KOHDEN EEG-1200. Схема коммутации 8-канальная, монополярная, с общими ушными референтными электродами. ЭКГ-отведение регистрируется во II стандартном отведении, синхронно ЭЭГ-каналам. Регистрация биосигналов производилась с частотой квантования 500 Гц. Чувствительность ЭЭГ-каналов — 10 мкВ, ЭКГ — 100 мкВ. Фоновая запись ЭЭГ и ЭКГ производилась длительностью 300 секунд. Использовали фотостимуляционные пробы на частотах 2, 5, 10, 15, 20, 25 Гц. Сохраняли исходные записи биосигналов в цифровом формате, без применения программных средств фильтрации в файл с расширением EDF (European Data Format). Обработка биосигналов производилась в программном обеспечении, разработанном в среде графического программирования National Instruments Lab VIEW [23]. Предобработка биосигналов включает в себя процесс программной фильтрации. Применялись сетевые фильтры ЭЭГ- и ЭКГ-каналов с центральной частотой фильтрации 50 Гц. Также для предобработки ЭЭГ-каналов использовали фильтры низких частот, с пороговым значением фильтра в 35 Гц, и фильтры высоких частот, со значением 0,1 Гц.
Спектральный анализ биосигналов производили синхронно в ЭЭГ-отведениях и ЭКГ-канале с помощью математического аппарата быстрого преобразования Фурье. С целью улучшения качества спектрального анализа использовали оконную функцию Ханнинга [22]. Разрешение метода составляет 0,1 Гц. Спектр нативного ЭЭГ-сигнала раскладывается на составляющие диапазоны: дельта — 0,5–3,9 Гц, тета — 4–7,9 Гц, альфа-0 — 8–9 Гц, альфа-1 — 9,5–11 Гц, альфа-2 — 11,5–12,9 Гц, –бета-1 — 13–20 Гц, бета-2 — 20,5–35 Гц. Спектр вариабельности сердечного ритма (ВСР) изучается в диапазонах очень низких частот (VLF) 0–0,41 Гц, низких частот (LF) 0,04–0,15 Гц, высоких частот (HF) 0,15–0,4 Гц. Для оценки динамики нейрофизиологических изменений изучали усредненные показатели спектрального анализа ЭЭГ по 8 отведениям, в частности относительную спектральную мощность (ОСМ). Показатели усредняли путем вычисления медианного значения спектральной плотности в каждом диапазоне в 8 отведениях. В качестве интегрального количественного анализа ЭЭГ применяли интегральный коэффициент, рассчитанный для правой (R) и левой (L) гемисфер соответственно — kfc-1 = (d + q + b1)/(a + b2). Интегральный коэффициент отображает соотношение нормальных и патологических ритмов на фоновой ЭЭГ [14].
В настоящее время существуют клинико-экспериментальные исследования, связывающие активность определенных диапазонов ЭЭГ с функционированием различных медиаторных систем ЦНС [15, 26].
Медленные биоэлектрические процессы мозга частотой ниже 1 Гц рассматриваются как результат деятельности нейроглиальной популяции, с церебральным энергетическим обменом. Коррелят процессов метаболизма. Активность 6–7,5 Гц связана с холинергической системой, активность 5–6 Гц — с серотонинергической системой, активность 4–5 Гц — с адренергической активацией, активность 11–12 Гц — с активацией дофаминергической системы, активность 24–25 Гц (бета-2) — с серо–тонинергической системой.
По данным литературы, основным ЭЭГ-эффектом активации рецепторов глутамата является усиление ритмов в диапазоне 0,5–3 Гц (то есть в диапазонах дельта-активности) и ослабление — в полосе частот 8–26 Гц (в диапазоне альфа- и бета-ритмов) [16].
Анализ ВСР — современная методология и технология исследования и оценки состояния регуляторных систем организма, позволяющая судить о степени напряжения регуляторных систем, разобщении процессов центральной и периферической регуляции [17, 18] в соответствии с рекомендациями Североамериканского кардиологического общества. Из частотных показателей исследовали: TP (мс2) — total power — тотальную мощность (ТМ) спектра. Характеризует только периодические процессы в ритме сердца и не содержит нелинейных и непериодических компонентов. VLF (мс2) — very low frequency — очень низкие частоты (ОНЧ), мощность частот в диапазоне 0,003–0,04 Гц, характеризует надсегментарный уровень регуляции симпатического звена автономной нервной системы (АНС) и влияние высших вегетативных центров на сердечно-сосудистую систему. LF (мс2) — low frequency — низкие частоты (НЧ), мощность частот в диапазоне 0,04–0,15 Гц, характеризует влияние симпатического отдела АНС на сердечный ритм, в частности активность вазомоторного центра продолговатого мозга и барорефлекс. HF (мс2) — high frequency — высокие частоты (ВЧ), мощность частот в диапазоне 0,15–0,4 Гц, показатель вагусной активности. LF/HF (НЧ/ВЧ) — симпатовагусный баланс [17].
Для исследования кровотока по интракраниальным артериям и венам применяли ультразвуковую транскраниальную допплерографию (УЗДГ) с использованием аппарата DWL EZ-Dop V2.1 (Germany).
Результаты и обсуждение
При поступлении в нейрохирургическое отделение ИТ нарушение сознания у 10 (33,3 %) пациентов в 1-й группе и 13 (43,3 %) больных во 2-й группе зафиксировано на уровне 4–5 баллов по шкале комы Глазго, что соответствовало коме-2. У 12 (40 %) пациентов в 1-й группе и 12 (40 %) больных во 2-й группе оно зафиксировано на уровне 6–7 баллов по ШКГ, что соответствовало коме-1. У 8 (26,7 %) пациентов в 1-й группе и 5 (16,7 %) больных во 2-й группе неврологический дефицит зафиксирован на уровне 8–10 баллов по ШКГ, что соответствовало сопору (табл. 2).
При сравнении групп 1 и 2 (χ2, W-W, кКУ) было выявлено, что различия уровней нарушения сознания по ШКГ не являлись статистически значимыми в первые и третьи сутки исследования (p > 0,05) (табл. 2). Только на 7-е сутки во второй группе количество пациентов с уровнем сознания сопор, что соответствовало 11 и более баллам по ШКГ, было значимо выше (χ2, W-W, кКУ — p ≤ 0,05), чем в 1-й группе.
Из 30 пациентов первой группы до 7-х суток дожили 19, 11 (36,7 %) человек умерли в первые 4 суток терапии. Из 30 пациентов второй группы до 7-х суток дожили 27 человек, 3 (10 %) больных умерли в первые трое суток терапии. То есть риск смерти на 7-е сутки терапии у пациентов в 1-й и 2-й группах имеет значимые различия (относительный риск (RR) ± 95% ДИ = 0,273 (0,084–0,881), стандартная ошибка относительного риска S = 0,598), этот риск летального исхода был выше в 1-й группе, где использовали только стандартный комплекс лечения по протоколу.
Следует отметить, что только у 4 (13,3 (3,7–27,6) %) пациентов 1-й группы на 3-и сутки и у 6 (20 (7,9–35,9) %) больных 1-й группы на 7-е сутки было зафиксировано улучшение показателей состояния сознания по ШКГ — увеличение на 5 баллов и более, что свидетельствовало о недостаточной эффективности проводимой терапии по стандартному протоколу. Во 2-й группе исследования было выявлено больше (χ2, W-W, кКУ — p ≤ 0, 05), чем в 1-й, пациентов, у которых уровень неврологического дефицита снизился, а уровень сознания вырос более чем на 5 баллов по ШКГ. На 3-и сутки таких больных было выявлено 15 (50 (32,5–67,5) %), на 7-е — 23 (76,7 (60,2–89,6) %) человека. При вычислении показателя отношения шансов (ОR — odds ratio) [19, 20] выявлено, что шанс восстановления сознания на 5 и более баллов по ШКГ к 3-м суткам терапии у пациентов в 1-й и 2-й группах исследования имеет значимые различия (ОR ± 95% ДИ = 6,5 (1,8–23,2) при стандартной ошибке отношения шансов S = 0,649). Этот шанс выше во 2-й группе, где применяли дополнительно к стандартному протоколу лечения амантадин (ПК-Мерц). Этот шанс увеличивался к 7-м суткам: ОR ± 95% ДИ = 13,143 (3,836–45,024) при стандартной ошибке отношения шансов S = 0,628.
У больных 2-й группы, уровень сознания которых, по данным ШКГ, повышался (15 больных на 3-и сутки и 23 пациента на 7-е сутки), были выявлены следующие статистически значимые (р ≤ 0,05, T-W, кКУ) изменения показателей спектральной мощности ЭЭГ и варибельности сердечного ритма: уменьшение абсолютной спектральной мощности (АСМ) дельта-ритма и относительной спектральной мощности дельта-активности ЭЭГ более чем на 30 %, снижение АСМ тета-ритма; падение показателя VLF%; резкое снижение уровня 1-го интегрального коэффициента в левой гемисфере (рис. 1).
Одновременно было выявлено значимое увеличение (р ≤ 0,05, T-W, кКУ): абсолютной и относительной мощности альфа-, бета-1- и бета-2-активности, что сочеталось с ростом общей мощности ВСР, абсолютной и относительной мощности показателя LF (рис. 2).
Доказано, что основным ЭЭГ-эффектом активации рецепторов глутамата, по данным литературы [18], является усиление ритмов в диапазоне 0,5–3 Гц (то есть в диапазонах дельта-активности) при ослаблении в полосе частот 8–26 Гц (в диапазоне альфа- и бета-ритмов). Поэтому зафиксированные нами в ответ на применение амантадина ЭЭГ-изменения (снижение δ-, рост α- и β1- и β2-ритмов) отражали снижение активности глутаматергической системы. Это сочеталось с ростом (χ2, W-W, кКУ — p ≤ 0,05) низкочастотного (LF) или вегетативного диапазона, отражающего гиперактивность симпатических центров продолговатого мозга и значимую активацию стрессреализующих механизмов адаптации (рис. 2).
При этом были зафиксированы высокие обратные корреляционные связи между повышением уровня сознания по шкале комы Глазго и снижением уровня АСМ дельта-диапазона (ρ = 0,65, τ = 0,8). То есть уменьшение глутаматергической активности у пациентов с тяжелой ЧМТ приводило к повышению уровня сознания.
Также были выявлены высокие прямые корреляционные связи между изменениями (%) АСМ и ОСМ дельта-диапазона и показателем HF ВСР (ρ = 0,74, τ = 0,9) (рис. 3). Снижение (χ2, W-W, кКУ — p ≤ 0,05) уровня дельта-активности высоко обратно коррелировало с повышением уровня LF% (ρ = –0,71, τ = –0, 89). Таким образом, адаптационные возможности ЦНС и организма в целом возрастали при снижении активности глутаматергической системы ЦНС.
Были зафиксированы высокие обратные корреляционные связи между изменениями (%) АСМ и ОСМ дельта-диапазона и изменениями уровней абсолютной и относительной мощности альфа-, бета-1- и бета-2-ритмов (ρ = –0,65, τ = –0,85), что являлось отражением прямого антиглутаматного эффекта [18] оригинального амантадина сульфата (ПК-Мерц®) (рис. 3).
Анализ межполушарной когерентности (МК) на момент поступления больных показал резкое –ослабление межполушарного взаимодействия большинства когерентных связей в основных частотных диапазонах ЭЭГ по сравнению с нормой, отражая тормозное состояние коры [15]. Во 2-й группе исследования в отличие от 1-й был выявлен рост (χ2, W-W, кКУ — p ≤ 0,05) МК в симметричных лобных отделах за счет сочетанности в альфа- и бета-диапазонах (табл. 3) — признак повышения напряженности в ретикулярной и лимбико-гиппокампальной системах [8]. Также был зафиксирован рост (χ2, W-W, кКУ — p ≤ 0,05) МК в симметричных центральных отделах за счет сочетанности в медленноволновом и альфа-1-диапазонах — признаки повышения активности структур среднего мозга и диэнцефальных структур [21].
/87.jpg)
Отмечается рост (χ2, W-W, кКУ — p ≤ 0,05) средней МК в симметричных лобных, центральных и затылочных областях коры в основном за счет сочетанности в альфа S (суммарно) и альфа-1-диапазонах (табл. 3). В динамике терапии с применением амантадина во второй группе исследования происходит усиление межполушарных когерентных связей фоновой ЭЭГ и восстановление характерного для нормы пространственного градиента (доминирование ее в передних областях полушарий) — признаки выхода коры из состояния торможения [29]. В показателях межполушарной когерентности (особенно лобной) интегрированы наряду с корковыми функциональными взаимодействиями активирующие влияния регуляторных структур разного уровня [30].
Был зафиксирован рост (χ2, W-W, кКУ — p ≤ 0,05) МК в симметричных затылочных отделах за счет сочетанности в β2-диапазоне — признаки повышения активности регуляторных структур разного уровня [30].
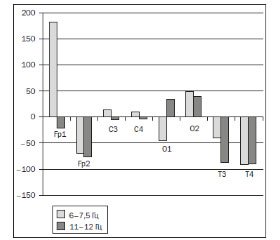
У пациентов 2-й группы исследования в ответ на введение препарата амантадина сульфат (ПК-Мерц®) был зафиксирован рост (χ2, W-W, кКУ — p ≤ 0,05) показателей АСМ в диапазоне 6–7,5 Гц (предиктор активации холинергической системы) в левой лобной и правой окципитальной областях — в проекции т.н. «когнитивной оси» [16]. Также было отмечено увеличение (χ2, W-W, кКУ — p ≤ 0,05) АСМ в диапазоне 11–12 Гц (предиктор активации дофаминергической системы) симметрично в окципитальных отделах, в проекции ствола мозга (рис. 4).
По данным интегрального количественного анализа ЭЭГ-паттернов при исследовании реактивности мозга в динамике терапии амантадином, во второй группе исследования в отличие от 1-й отмечено статистически значимое (χ2, W-W, кКУ — p ≤ 0,05) снижение kfc-1 = (δ + θ + β1)/(α + β2) на обеих гемисферах, свидетельствующее об уменьшении дезорганизации ЭЭГ-паттерна более чем на 30 % уже в первый период исследования (табл. 4).
/88.jpg)
Изучено влияние амантадина на мозговой кровоток у пациентов обеих групп. С помощью УЗДГ у пациентов при поступлении в отделение выявлены следующие изменения цереброваскулярного кровотока: гемодинамически значимая асимметрия (более 30 %) линейной скорости кровотока (ЛСК) по всем исследуемым церебральным артериям, вазоконстрикция интракраниальных сосудов. Прогностически благоприятными изменениями кровотока в интракраниальных сосудах у пациентов в динамике терапии с применением амантадина во второй группе исследования является достоверное уменьшение (р ≤ 0,05, χ2; Т-W) или отсутствие асимметрии кровотока. На 7-е сутки интенсивной терапии при благоприятном течении заболевания отмечен достоверный (р ≤ 0,05, χ2; Т-W) рост скорости венозного оттока, симметричное снижение ЛСК, уменьшение вазоконстрикции интракраниальных сосудов практически до нормальных значений в обеих группах больных без четкой разницы.
Выводы
1. У больных с тяжелой ЧМТ в ответ на применение оригинального амантадина сульфата (ПК-Мерц®) были установлены нейрофизиологические ЭЭГ-предикторы угнетения глутаматной эксайтотоксичности: снижение абсолютной спектральной мощности δ-диапазона, рост α-, β1- и β2-диапазонов, которые были зафиксированы на ЭЭГ на 2–4-е сутки применения инфузионной формы ПК-Мерц®. Данные изменения сочетались с ростом мощности низкочастотного (LF) спектра ВСР, что отражало значимую активацию стрессреализующих механизмов адаптации.
2. После применения оригинального амантадина сульфата (ПК-Мерц®) обнаружены сильные корреляционные связи между снижением уровня спектр-мощности дельта-диапазона и повышением уровня сознания по шкале комы Глазго, между повышением уровня сознания и повышением уровня АСМ α-, β1- и β2-диапазонов, свидетельствующие о том, что снижение глутаматергической активности у пациентов с тяжелой ЧМТ приводит к повышению уровня сознания.
3. Интенсивная терапия с применением инфузионного ПК-Мерца® восстанавливает нейромедиаторный баланс у больных с тяжелой черепно-мозговой травмой: снижает глутаматергическую активность, активирует дофаминергическую активность, преимущественно в проекции стволовых структур, активирует холинергическую активность, преимущественно в проекции так называемой «когнитивной оси», что является одним из механизмов восстановления сознания.
4. При поступлении больных с тяжелой ЧМТ в отделение интенсивной терапии установлено резкое ослабление межполушарного взаимодействия большинства когерентных связей в основных частотных диапазонах ЭЭГ, отражающее высокую степень торможения коры головного мозга. В динамике интенсивной терапии с применением оригинального амантадина сульфата (ПК-Мерц®) было зафиксировано усиление межполушарных когерентных связей на фоновой ЭЭГ и восстановление характерного для нормы пространственного градиента, что является предиктором активации коры головного мозга.
5. Уже на 3-и сутки терапии шанс восстановления сознания на 5 и более баллов по ШКГ был выше в группе, где применяли дополнительно к стандартному протоколу лечения оригинальный амантадина сульфат (ПК-Мерц®) (ОR ± 95% ДИ = 6,5 (1,8–23,2) при S = 0,649). Риск летального исхода на 7-е сутки был выше в группе, где использовали только стандартный комплекс лечения по протоколу (RR ± 95% ДИ = 0,273 (0,084–0,881) при S = 0,598). Применение ПК-Мерца® в острейшем периоде тяжелой ЧМТ обусловливало статистически значимое снижение риска смерти (р = 0,050).
6. Статистически достоверные данные о снижении смертности, динамике регресса неврологической симптоматики, снижении глутаматергической активности аргументируют необходимость использования ПК-Мерца® в инфузионной форме выпуска в дозе 400 мг действующего вещества в сутки на протяжении 7 дней и больше у пациентов с ЧМТ.
Список литературы
1. Bramlett H.M. Патофизиология ишемического травматического поражения мозга: сходство и различия / H.M. Bramlett, W.D. Dietrich // Медицина неотлож. состояний. — 2006. — № 4 (5). — С. 22-34.
2. Siesjo B.K. Basis mechanisms of traumatic brain damage (Review) / B.K. Siesjo // Ann. Emerg. Med. — 2007. — № 22 (6). — Р. 959-969.
3. Candelario J.E. Injury and repair mechanisms in ischemic stroke: considerations for the development of novel neurothera–peutics / J.E. Candelario // Cur. Opin. Investig. Drugs. — 2009. — № 10 (7). — Р. 644-654.
4. Greve M.W. Pathophysiology of traumatic brain injury / M.W. Greve, B.J. Zink // Mt.Sinai J. Med. — 2009. — № 76 (2). — Р. 97-104.
5. Ghosh S. Changes in cytosolic Ca2+ levels correspond to fluctuations of lactate levels in crosstalk of astrocyte neuron cell lines / S. Ghosh, D.K. Kaushik, J. Gomes // Indian J. Exp. Biol. — 2010. — № 48 (6). — Р. 529-537.
6. Гусев Е.И. Ишемия головного мозга / Е.И. Гусев, В.И. Скворцова. — М.: Медицина, 2011. — 321 с.
7. Devi L. Mitochondrial import and accumulation of -synuclein impair complex I in human dopaminergic neuronal cultures and Parkinson disease brain / L. Devi, V. Raghavendran, B.M. Prabhu // J. Biol. Chem. — 2008. — Vol. 283. — P. 9089-9100.
8. Никонов В.В. Роль антагонистов глутаматных рецепторов (ПК-Мерц) в лечении повреждений мозга (обзор литературы) / В.В. Никонов, И.Б. Савицкая // Медицина неотложных состояний. — 2012. — (44) — № 5. — С. 44-48.
9. Кривонос О.В. Применение антагониста глутаматных NMDA-рецепторов ПК-Мерц в остром периоде инсульта / О.В. Кривонос, Н.А. Амосова, И.Г. Смоленцева // Журн. неврологии и психиатрии им. С.С. Корсакова. — 2009. — Т. 109, № 4. — С. 72-74.
10. Румянцева С.А. Новые направления в патогенетической терапии инсульта / С.А. Румянцева, Н.Г. Боневольская // Атмосфера. Нервные болезни: журнал для практич. врачей. — 2006. — № 4. — С. 29-34.
11. Amantadine to improve neurorecovery in traumatic brain injury-associated diffuse axonal injury: a pilot double-blind randomized trial / Meythaler J.M., Brunner R.C., Johnson A., Novack T.A. // J. Head Trauma Rehabil. — 2002. — V. 17 (4). — Р. 300-313.
12. Saniova B. Biochemical and clinical improvement of cytotoxic state by amantadine sulphate / B. Saniova, M. Drobny // Cellular and Molecular Neurobiology. — 2006. — V. 26. — P. 1475-1482.
13. Steube D. The influence of amantadine sulfate on disturbances of arousal after severe traumatic brain injury / D. Steube, R. Gortelmeyer // Neurology. — 2000. — V. 6 (6). — Р. 307-312.
14. Острова Т.В. Алгоритм діагностики реактивності ЦНС методами штучного інтелекту / Т.В. Острова, В.І. Черній, А.І. Шевченко. — Донецьк: ІПШІ МОНУ і НАНУ «Наука і освіта», 2004. — 180 с.
15. Шарова Е.В. Современные возможности ЭЭГ в анализе функциональных нарушений при тяжелых повреждениях головного мозга / Е.В. Шарова // Нейронауки: теоретичні та клінічні аспекти. — 2009. — Т. 5, № 1-2. — С. 49-58.
16. Ахметова Е.Р. Электроэнцефалографический анализ взаимодействия глутамат- и холинергической систем мозга: Автореф. дис… канд. биол. наук: спец. 03.00.13 «Физиология» / Е.Р. Ахметова. — Пущино, 2000. — 99 с.
17. Баевский Р.М. Физиология человека. — 2002. — 28, 2. — 69-82.
18. Михайлов В.Н. Вариабельность ритма сердца. Опыт практического применения метода. — Иваново, 2000. — 182 с.
19. Лапач С.Н. Статистические методы в медико-биологических исследованиях с использованием Excel / Лапач С.Н., Чубенко А.В., Бабич П.Н. — К.: МОРИОН, 2002. — 640 с.
20. Лях Ю.Е. Анализ результатов медико-биологических исследований и клинических испытаний в специализированном статистическом пакете MEDSTAT / Ю.Е. Лях, В.Г. Гурь–янов // Вестник гигиены и эпидемиологии. — 2004. — Т. 8, № 1. — С. 155-167.
21. Межцентральные отношения ЭЭГ как отражение системной организации мозга человека в норме и патологии / Г.Н. Болдырева, Л.А. Жаворонкова, Е.В. Шарова [и др.] // Журн. высшей нервной деятельности. — 2003. — Т. 53, № 6. — С. 1093-1099.
22. Дворкович В.П., Дворкович А.В. Оконные функции для гармонического анализа сигналов. — М.: Техносфера, 2014. — 112 с.
23. Кропотов Ю.Д. Количественная ЭЭГ, когнитивные вызванные потенциалы мозга человека и нейротерапия / Ю.Д. Кропотов. — Донецк: Издатель Заславский А.Ю., 2010. — 512 с.
24. Intracranial hypertension: what additional information can be derived from ICP waveform after head injury? / М. Balestreri, М. Czosnyka, L.A. Steiner [et al.] // Acta Neurochir. (Wien). — 2004. — № 146 (2). — P. 131-141.
25. Черний В.И., Ельский В.Н., Городник Г.А. Острая церебральная недостаточность. — 4-е изд., исправ. и доп. — Донецк, 2010. — 434 с.
26. Андронова И.А., Черний Т.В., Назаренко К.В., Черний В.И., Андронова М.А. Возможности количественной ЭЭГ в исследовании нейромедиаторных систем ЦНС при острой и хронической церебральной недостаточности // Материалы Всероссийской конференции с международным участием «Нейрохимические механизмы формирования адаптивных и патологических состояний мозга, 24–26 июня 2014 г., Санкт-Петербург; Колтуши. — С. 17.
27. Беленичев И.Ф. и др. Нейропротекция и нейропластичность. — К.: Логос, 2015. — 512 с.
28. Park E. An analysis of regional microvascular loss and recovery following two grades of fluid percus sion trauma: a role for hypoxia inducible factors in traumatic brain injury / Е. Park, J.D. Bell, I.P. SPiddiq, A.J. Baker // J. Cereb. Blood Flow Metab. — 2009. — № 29 (3). — P. 575-584.
29. ЭЭГ и ВП в прогнозировании развития посттравматических бессознательных состояний после тяжелой травмы мозга / Е.В. Шарова, О.С. Зайцев, Г.А. Щекутьев [и др.] // Нейро–науки: теоретические и клинические аспекты (Украина). — 2008 (декабрь). — Т. 4, № 2. — С. 82-89.
30. Болдырева Г.Н., Шарова Е.В., Добронравова И.С. Роль регуляторных структур в формировании ЭЭГ человека // Физио–логия человека. — 2000. — № 5. — С. 19-34.
/88_2.jpg)

/83.jpg)
/85.jpg)
/86.jpg)
/87.jpg)
/88.jpg)