Газета «Новости медицины и фармации» 13 (548) 2015
Вернуться к номеру
Фокусування на медикаментозному лікуванні доброякісної гіперплазії передміхурової залози (за матеріалами 15-ї Центральноєвропейської конференції Європейської асоціації урологів: СEM 15)
Рубрики: Урология
Разделы: Справочник специалиста
Версия для печати
Статья опубликована на с. 3-4 (Мир)
2–4 жовтня в м. Будапешті відбулася 15-та Центральноєвропейська конференція –Європейської асоціації урологів (СЕМ 15), що зібрала понад 350 учасників із 25 країн Центральної Європи, Близького Сходу, Центральної та Східної Азії.
Всеохоплююча й глибока наукова програма СЕМ, динамічні дискусії секційних засідань обумовили ефективну платформу для подальших інноваційних досліджень та клінічної роботи учасників заходу.
Особливу увагу привернула лекція проф. H. Лепор (кафедра урології Нью-Йоркського медичного університету) «Фокусування на медикаментозному лікуванні: альфа-блокатори — за і проти» (H. Lepor, New York (US). Focussing on medical treatment: Alphablockers pros and cons).
До 1980-х рр. патофізіологія й лікування доброякісної гіперплазії передміхурової залози (ДГПЗ) виглядали досить просто. Уважалося, що доброякісне збільшення передміхурової залози (ДЗПЗ) призводить до розвитку обструкції вихідного отвору сечового міхура (ОВОСМ), що, у свою чергу, спричиняє простатизм (симптоми нижніх сечових шляхів — СНСШ). Як перша лінія терапії ДГПЗ виступала простатектомія, виконувана відкритим способом або як транс–уретральна резекція передміхурової залози.
Однак із середини 1970-х рр. ситуація почала змінюватися. У 1975 р. Caine і спів–авт. повідомили про те, що феніл–ефрин викликає скорочення передміхурової залози людини, що вказувало на наявність у ній α-адренорецепторів. У 1976 р. та ж група авторів продемонструвала, що феноксибензамін, будучи α-адреноблокатором, поліпшував клінічні прояви простатизму. Результатом подіб–них досліджень стало те, що, наприклад, у період із 1979 по 1985 р. в університеті ім. Джона Хопкінса дуже багато чоловіків із діагнозом ДГПЗ/СНСШ отримали лікування α-адреноблокаторами.
У період із 1982 по 1996 р. у передміхуровій залозі була виявлена велика кількість нейрорецепторів, серед яких були α1- і α2-адренорецептори, мускаринові рецептори, рецептори кальцієвих каналів, ендотелінові рецептори. Особливо важливими були дослідження, які ідентифікували різні підтипи α1-адренорецепторів, що згодом стало основою для створення селективних α1-адреноблокаторів.
Із 1976 по 1986 р. у ряді окремих медичних установ були виконані невеликі за обсягом дослідження низької якості, у яких, однак, було показано, що застосування α-адреноблокаторів є ефективним при лікуванні ДГПЗ. Першим адреноблокатором, що застосовувався для лікування цього захворювання, став неселективний α1- і α2-адреноблокатор феноксибензамін. Однак недоліком цього засобу були виражені побічні ефекти, що виникали при його застосуванні й були пов’язані з блокадою α2-адренорецепторів.
У додаткових дослідженнях, що вивчали зв’язування з рецепторами, а також у функціональних й ауторадіографічних дослідженнях були отримані дані про те, що саме α1-підтип адренорецепторів відповідальний за скорочення гладкої мускулатури передміхурової залози. Це дозволило зосередити увагу клініцистів на застосуванні селективних α1-адреноблокаторів для лікування ДГПЗ. При цьому тривалодіючі α1-адреноблокатори (теразозин) переносилися краще, ніж короткодіючі засоби для лікування артеріальної гіпертензії (празозин).
Із часом завдяки прогресу медичних і фармакологічних знань до уваги лікарів була запропонована велика кількість селективних α1-адреноблокаторів, придатних для лікування ДГПЗ. Їх порівняльна характеристика наведена в табл. 1.
Недоліком доксазозину й теразозину є необхідність у титрації дози. Тамсулозин позбавлений цього недоліку — відповідно до чинних рекомендацій, добова доза становить 400 мг. Альфузозин і силодозин також не вимагають титрації дози. Однак в альфузозину на тлі зменшення частоти побічних ефектів знижена ефективність самого препарату. А для силодозину характерна найбільш висока частота анеякуляції.
На рис. 1 поданий сучасний алгоритм ведення пацієнтів із діагнозом ДГПЗ. У вузькому смислі центральною ланкою цього алгоритму є застосування селективних α1-адреноблокаторів. Однак якщо подивитися ширше, то порівняно з трансуретральною резекцією передміхурової залози фармакологічна терапія менш ефективна в ослабленні ОВОСМ і СНСШ. З огляду на це постають запитання: чи не на помилковому ми шляху? Чи повинні використовувані в майбутньому лікарські засоби для лікування СНСШ/ДГПЗ бути спрямовані на ослаб–лення ОВОСМ?
Щоб відповісти на ці запитання, 26 чоловікам із клінічно вираженою ДГПЗ до ініціювання терапії теразозином була виконана трансректальна УЗД-контрольована біопсія простати. В отриманих зразках був визначений відсоток гладком’язової тканини за допомогою подвійного імуноферментного забарвлення/комп’ютерного кількісного кольорового візуалізаційного аналізу. Під час дослідження було оцінене співвідношення між щільністю гладком’язової тканини, вихідною тяжкістю симптомів, початковою максимальною швидкістю сечовипускання, зміною тяжкості симптомів і максимальною швидкістю сечовипускання під час лікування теразозином.
За результатами цього дослідження були зроблені два важливих висновки. З одного боку, щільність гладком’язової тканини передміхурової залози дійсно впливає на тяжкість ОВОСМ і відповідальна за опосередковане α1-адреноблокаторами зниження ОВОСМ у чоловіків із клінічно маніфестною ДГПЗ. Однак, з іншого боку, щільність гладком’язової тканини передміхурової залози не робить внесок у тяжкість простатизму (СНСШ). Отже, накопичення гладком’язової тканини відповідальне за розвиток ОВОСМ, але не СНСШ.
Подальша відсутність клінічно вірогідного взаємозв’язку між ОВОСМ і СНСШ була підтверджена в дослідженні Veterans Affairs Cooperative Studies Benign Prostatic Hyperplasia Study (Спільні дослідження доброякісної гіперплазії передміхурової залози у ветеранів). Під час цього дослідження зміни за шкалою AUASS (шкала симптомів Американської урологічної асоціації; відображає вираженість СНСШ) і динаміка максимальної швидкості сечовипускання (відображає вираженість ОВОСМ) при лікуванні теразозином корелювали слабко й невірогідно (r2 = 0,093, р = 0,124).
Було також з’ясовано, що виконання трансуретральної резекції передміхурової залози чоловікам із ДГПЗ/СНСШ без ОВОСМ сприяє вираженому поліпшенню СНСШ більше ніж у 80 % випадків. Отже, виконання операції приводило до зменшення СНСШ, незважаючи на відсутність обструкції в доопераційному періоді.
Нарешті, у низці останніх досліджень було продемонстровано, що інгібітори фосфодіестерази 5-го типу зменшували вираженість СНСШ у чоловіків із ДГПЗ, не збільшуючи при цьому максимальну швидкість сечовипускання (тобто не усуваючи обструкцію). Відповідно, результати цих досліджень ще більше розділяють ОВОСМ і СНСШ.
Щоб глибше з’ясувати патофізіологію СНСШ у чоловіків, необхідно взяти до уваги, що в чоловіків і жінок віком понад 50 років загальна частота СНСШ, частота СНСШ, пов’язаних з утрудненням утримувати сечу, й частота СНСШ, пов’язаних з утрудненням вигнання сечі, однакові. Крім того, розмір передміхурової залози не пов’язаний із тяжкістю СНСШ. Природно, що виникає питання, чи залежить розвиток СНСШ у старіючих чоловіків від передміхурової залози.
Для пошуку відповіді на це питання з жовтня 2000 до середини 2015 р. більше ніж 2000 чоловіків із радикальною простатектомією були включені в лонгітюдне дослідження (з оцінкою наслідків), схвалене Комісією з біомедичної етики. Показники за шкалою AUASS були визначені на початку дослідження й у намічені точки часу протягом 15 років. Вік більшості пацієнтів становив 55–65 років.
Дані Sarma і співавт. говорять про те, що середнє збільшення значення за шкалою AUASS у чоловіків у їх 40-ві, 50-ті, 60-ті й 70-ті роки становить 0,13; 0,30; 0,60 й 0,38 бала на рік відповідно. Екстраполюючи ці дані на чоловіків згаданого вище дослідження, які заповнили AUASS початково й через 10 років після радикальної простатектомії, розраховане середнє збільшення за шкалою AUASS повинне було б становити +4,66 бала. Однак на практиці виявилося, що видалення передміхурової залози привело до середнього зменшення показника за шкалою AUASS на 0,48 бала через 10 років після операції. З огляду на це треба зробити висновок, що етіологія СНСШ у чоловіків з інтактною передміхуровою залозою опосередкована головним чином передміхуровою залозою.
Закінчуючи доповідь, професор H. Лепор підсумував усі дані про патофізіологію ДГПЗ, відомі на цей час. У багатьох чоловіків і жінок із віком розвиваються СНСШ. При цьому в чоловіків розвиток зазначеного синдрому опосередкований передміхуровою залозою. Але лише в малого відсотка чоловіків розвиток СНСШ пов’язаний з ОВОСМ — у більшості чоловіків формування СНСШ й ОВОСМ здійснюється через різні механізми, хоча й у тому і в іншому випадку ці механізми почасти пов’язані з α-адренорецепторами.
Фармакологічна терапія, що є сьогодні в арсеналі лікарів, більш слабко впливає на клінічні прояви ДГПЗ/СНСШ порівняно із трансуретральною резекцією передміхурової залози. Подальше вивчення конкретних патогенетичних механізмів, що роблять внесок у патофізіологію ДГПЗ, ОВОСМ і СНСШ, дозволить підвищити ефективність нових лікарських засобів для лікування ДГПЗ.
***
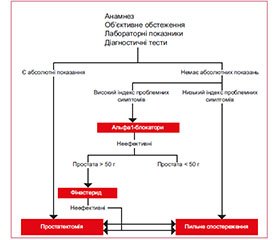
У 2015 р. були опубліковані нові рекомендації Європейської асоціації урологів із ведення пацієнтів із симптомами нижніх сечових шляхів. Алгоритм вибору деяких лікарських засобів та їх комбінації для лікування помірних і виражених СНСШ описаний нижче й поданий на рис. 2.
1. α1-адреноблокатори. Їх ефективність не залежить від розмірів передміхурової залози при курсі лікування менше ніж один рік. Однак при більш тривалих курсах лікування α1-адреноблокатори більш ефективні при розмірах передміхурової залози < 40 мл.
Ефект від лікування α1-адреноблокаторами з’являється вже через кілька годин або кілька днів, досягаючи максимуму протягом декількох тижнів. Вони знижують IPSS на 30–40 %, збільшують Qmax на 20–25 %.
α1-адреноблокатори не зменшують розмір передміхурової залози, не запобігають гострій затримці сечі й не зменшують необхідність в операції.
2. Інгібітори 5α-редуктази більш ефективні при розмірах передміхурової залози > 40 мл.
Ефект від лікування інгібіторами 5α-редуктази з’являється через 6–12 місяців терапії. Дана група засобів зменшує IPSS на 15–30 %, збільшує Qmax на 1,5–2,0 мл/с.
Інгібітори 5α-редуктази зменшують розмір передміхурової залози й циркулюючі рівні PSA. Крім того, інгібітори 5α-редуктази зменшують ризик розвитку гострої затримки сечі й необхідність в операції.
3. Комбінована терапія: α1-адреноблокатори + інгібітори 5α-редуктази. Комбінована терапія є більш ефективною, ніж монотерапія, однак і ризик розвитку побічних ефектів також вищий. Тому комбіновану терапію призначають особам із високим ризиком прогресування хвороби (більший розмір передміхурової залози, більш високий уміст PSA, старший вік пацієнтів тощо).
Ефект від лікування комбінацією — через 12 місяців. Комбінована терапія більш ефективна, ніж монотерапія α1-адреноблокаторами або інгібіторами 5α-редуктази, щодо зменшення IPSS і збільшення Qmax. У чоловіків з помірно вираженими СНСШ через 6 місяців лікування комбінацією α1-адреноблокатор може бути відмінений.
Комбінована терапія більш ефективна, ніж монотерапія α1-адреноблокаторами, і настільки ж ефективна, як монотерапія інгібіторами 5α-редуктази, щодо зменшення ризику розвитку гострої затримки сечі й необхідності в операції.
Матеріал підготовлений
к.м.н. А.В. Савустьяненко

/3_m.jpg)
/4_m2.jpg)
/4_m.jpg)