Статтю опубліковано на с. 120-126
Вступ
Особливе місце в структурі сучасного травматизму посідає тяжка черепно-мозкова травма, поєднана з травмою кісток скелета (ТЧМТпТКС). Перебіг післятравматичного періоду в потерпілих з ТЧМТпТКС практично завжди ускладнений, що обумовлене розвитком синдрому поліорганної дисфункції (СПОД), летальність при розвитку якого досягає 70–100 %. На сьогодні не викликає сумніву той факт, що недостатність гастроінтестинального тракту — одна з провідних ланок патогенезу СПОД [6]. Сучасні погляди базуються на визначенні провідної ролі синдрому гастроінтестинальної дисфункції (СГІД) у прогресуванні ендогенної інтоксикації та виникненні загальної відповіді організму на запалення (SIRS) у хворих з ЧМТпТКС [3, 6] за рахунок того, що основним джерелом ендогенної інтоксикації в даної категорії пацієнтів залишається кишка [5, 18].
Розвиток шоку при тяжкій ЧМТпТКС є передумовою появи порушення спланхнічного кровотоку та функцій шлунково-кишкового тракту (ШКТ), відновлення яких відбувається в останню чергу. Тривале перебування пацієнтів з тяжкою ЧМТ у коматозному стані, проведення респіраторної терапії, застосування седативних засобів та міорелаксантів, вазопресорна підтримка сприяють розвитку та прогресуванню СГІД.
Незважаючи на постійне вдосконалення якості діагностики синдрому гастроінтестинальної дисфункції та його інтенсивної терапії (ІТ) в пацієнтів із черепно-мозковою травмою, поєднаною з травмою кісток скелета, летальність при даній патології залишається високою [6]. Переважно причиною незадовільних результатів лікування хворих з ЧМТпТКС є розвиток ендогенної інтоксикації та гнійно-септичних ускладнень, частота яких коливається в межах 19,3–86,0 % і призводить до високої летальності у 25,0–35,0 % [4, 5].
Матеріал та методи
Нами обстежено 62 хворих із ТЧМТпТКС у яких була поліорганна дисфункція з ознаками гастроінтестинальної дисфункції в стадії компенсації (СГІДК) (1–2 бали). Бальну оцінку дисфункції ШКТ проводили на основі модифікації методики В.Ф. Саєнко і співавт., 2002, і І.В. Люлько і співавт., 2002, Я.М. Підгірного, 2009, В.В. Ніконова і спів-авт., 2011. Хворі були розподілені на дві групи, що не відрізнялися між собою за такими показниками, як вік, стать, тяжкість стану, та вираженістю проявів СГІД і поліорганної дисфункції. Хворі першої групи отримували терапію, що включала хірургічну санацію вогнища, активну волемічну, інотропну й судинну підтримку, респіраторну, антибіотико- та антицитокінову терапію. У хворих другої групи, крім вищенаведеної терапії, застосовували раннє ентеральне харчування (РЕХ).
Для РЕХ використовували ентеральну суміш Nutricomp.
Методика РЕХ. Через назогастральний зонд після аспірації залишкового вмісту шлунка вводили Nutricomp; якщо були великі залишкові об’єми шлунка, суміш вводилось інтестинально через назоінтестинальний зонд. Надавали перевагу постійному безперервному введенню перед болюсним введенням. Швидкість введення ентеральної суміші на початку ентерального харчування становила 0,5 мл/кг/год та при добрій переносимості поступово збільшувалась до належного об’єму, а при непереносимості швидкість зменшувалась в окремих випадках аж до повного припинення ентерального харчування.
Усім хворим проводили загальноклінічні та біохімічні дослідження крові. З метою діагностики ознак SIRS визначали параметри, що характеризують наявність та динаміку загальної відповіді організму на запалення. Інтегральна оцінка тяжкості стану хворих оцінювалася за шкалою АРАСНЕ ІІ, тяжкість поліорганної дисфункції — за шкалою SOFA.
Враховуючи те, що ініціаторами розвитку SIRS є молекулярні медіатори запалення, визначали рівні прозапальних цитокінів — фактора некрозу пухлини (TNF) та інтерлейкін-8 (IL-8). Обидва цитокіни визначали з допомогою твердофазового хемілюмінесцентного імуноферментного аналізу за допомогою тестів Immulite/Immulite1000 TNF-α та Immulite/Immulite1000 IL-8.
З метою контролю та корекції центральної гемодинаміки крім таких показників, як артеріальний тиск (АТ), систолічний АТ, частота серцевих скорочень (ЧСС), центральний венозний тиск, за допомогою ультрасонографії (апарат Aloka SSD-500/SL-450 Siemens, Німеччина) визначали серцевий індекс (СІ).
Дослідження газового складу крові проводили за допомогою апaрата ABL-520 фірми Radiometer Copenhagen (Данія). За величиною СІ та отриманими даними газового складу крові розрахунковим методом (Усенко Л.В., Шифрин Г.А.,1995, 2007; Корячкин В.А., Страшнов В.И., Чуфаров В.Н., 2001) визначали величини постачання та споживання кисню (DO2 — VO2), співвідношення раО2/FiO2. Енергетичний баланс клітини визначали за рівнем глюкози, АТФ, лактату (визначали на біохімічному аналізаторі Doctor Muller, Німеччина), пірувату (аналізатор Accutrend, США).
Рівень ендотоксемії оцінювали за рівнем молекул середньої маси (МСМ) (Андрейчик М.А. і співавт., 1998; Назаренко Г.И., Кишкун А.А., 2002), сорбційною здатністю еритроцитів (СЗЕ) та проникністю еритроцитарних мембран (ПЕМ) (Михайлович В.А. і співавт., 1993). Деструктивні зміни в клітинних мембранах характеризують рівень перекисного окислення ліпідів (ПОЛ). Активність ПОЛ оцінювали за рівнем їх первинних продуктів — дієнових кон’югат (ДК) та вторинних — малонового діальдегіду (МДА). Активність процесів ПОЛ визначали за Р.А. Тімірбулатовим, Є.І. Селезневим (1981). Антиоксидантну активність організму визначали за рівнем каталази крові (Чевари С., Андял Т., Штренир Я., 1991; Назаренко Г.И., Кишкун А.А., 2002).
Дослідження проводили в першу добу (н1) (етап 1), на 3-тю (н3) (етап 2), 5-ту (н5) (етап 3), 7-му (н7) (етап 4 ), 10-ту (н10) (етап 5) добу захворювання.
Результати та їх обговорення
Причиною розвитку загальної відповіді організму на запалення та виникнення СПОД є поява неконтрольованої кількості молекулярних медіаторів запалення, зокрема прозапальних цитокінів. Вихідні значення прозапальних цитокінів та показники SIRS у хворих першої та другої групи були ідентичними (табл. 1). У момент надходження хворих у відділення інтенсивної терапії (ВІТ) рівень прозапальних цитокінів в сироватці крові хворих обох груп вірогідно перевищував норму та становив: TNF-α — 455,5 ± 12,5 пг/мл у пацієнтів першої групи та 445,9 ± 11,1 пг/мл у пацієнтів другої групи (р < 0,05), а IL-8 — 3770,101 ± 12,780 пг/мл та 3820,111 ± 13,73 пг/мл відповідно (р < 0,05) (табл. 1). Вірогідне зниження рівня TNF-α настало у хворих другої групи на п’яту добу інтенсивної терапії (415,9 ± 9,1 пг/мл, р < 0,05), у хворих контрольної групи — лише на 10-ту добу проведення інтенсивної терапії (405,5 ± 7,5 пг/мл, р < 0,05). Ідентичні зміни мали місце при дослідженні рівня IL-8: у хворих другої групи він вірогідно знижувався на н5 етапі дослідження (3420,111 ± 14,530 пг/мл, р < 0,05), а в контрольній групі лише на н10 етапі дослідження (3470,86 ± 11,78, р < 0,05).
У процесі проведення інтенсивної терапії явища SIRS значно швидше регресували у хворих основної групи й відповідали динаміці рівня цитокінів, так, зниження температури тіла у хворих основної групи настало вже на 5-ту добу проведення ІТ (37,2 ± 0,2 °С, р < 0,05), тоді як у хворих конт-рольної групи — на н10 етапі (37,2 ± 0,3 °С, р < 0,05), (табл. 2).
У хворих другої групи швидше регресувала тахікардія (вже на н3 етапі дослідження вона становила 84 ± 5 уд/хв, р < 0,05). У контрольній групі хворих зниження ЧСС настало лише на н7 етапі дослідження (80 ± 8 уд/хв, р < 0,05).
Зменшення ЧД у хворих основної групи настало вже на 5-ту добу проведення ІТ (20 ± 2/хв, р < 0,05). Воно корелювало з вірогідним зростанням співвідношення рaO2/FiO2 (355 ± 10, р < 0,05). У хворих контрольної групи цей процес затягувався до 7–10-ї доби. У пацієнтів з СПОД та компенсованим СГІД, яким проводилось РЕХ, швидше зменшувався лейкоцитоз та регресував зсув лейкоцитарної формули вліво (табл. 2). Уже на п’яту добу проведення ІТ у хворих другої групи мало місце зменшення лейкоцитозу до 8,9 ± 1,1 • 109 (р < 0,05), у хворих першої групи воно настало на н10 етапі дослідження.
РЕХ безпосередньо впливає ні на запальний процес, ні на відповідь організму на цей запальний процес. Позитивний його ефект можна пояснити лише тим, що зменшується транслокація токсинів з кишки в систему кровообігу. Як видно з даних, що наведені в табл. 3, у хворих з компенсованим СГІД не спостерігалося суттєвих зрушень у системі постачання-споживання кисню (DО2 — VO2). Це корелювало з рівнем АТФ еритроцитів (r = 0,63 при р < 0,05) і 2,3-ДФГ (r = 0,63 при р < 0,05), які також були в межах норми. Можна припустити, що в усіх клітинах організму на такій стадії розвитку СПОД (тяжкість поліорганної дисфункції 7–8 балів за шкалою SOFA) ще не сформований енергодефіцит. На підставі цього було зроблено висновок про те, що основною ланкою патогенезу компенсованого СГІД є недостатнє забезпечення ентероцитів нутрієнтами, а отже, нутритивна підтримка хворих з компенсованим СГІД має патогенетичне підґрунтя.
Зменшення рівня прозапальних цитокінів, ознак SIRS корелювало зі зниженням ендотоксемії. Вихідні значення лейкоцитарного індексу інтоксикації (ЛІІ) у хворих обох груп були вірогідно вищими за норму (р < 0,05), але суттєво між собою не відрізнялися й становили 1,4 ± 0,5 ум.од. і 1,5 ± 0,5 ум.од. відповідно, р > 0,05 (табл. 4). На п’яту добу у хворих першої групи динаміка ЛІІ мала невірогідний характер (1,3 ± 0,4 ум.од., р > 0,05). У хворих, яким проводилося РЕХ, зниження ЛІІ було вірогідним (0,9 ± 0,2 ум.од, р < 0,05) як порівняно з вихідним значенням, так і з відповідним показником хворих першої групи. На 7-му добу захворювання у хворих другої групи показник ЛІІ був у межах норми. Зменшення показника ЛІІ до нормального значення у хворих першої групи відбувалося на 10-ту добу проведення інтенсивної терапії.
У хворих із СГІД у результаті катаболізму зростав рівень МСМ (табл. 4).
/46.jpg)
На початку дослідження у хворих обох груп він був майже однаковим і становив 0,470 ± 0,123 ум.од. і 0,489 ± 0,153 ум.од. відповідно (р < 0,05). Уже на третю добу інтенсивної терапії у хворих другої групи виявлено зниження рівня МСМ (0,294 ± 0,120 ум.од., р < 0,05). У хворих, яким РЕХ не застосовувалося, їх рівень знижувався на п’яту добу захворювання (0,320 ± 0,123, р < 0,05). Наприкінці дослідження у хворих, яким проводилося РЕХ, рівень МСМ був у межах норми, у хворих першої групи — все ще перевищував її (0,260 ± 0,100 ум.од., р > 0,05). Ймовірно, РЕХ сприяє зменшенню катаболічних процесів в організмі хворих з компенсованим СГІД. Динаміка інших маркерів ендогенної токсемії, зокрема СЗЕ та ПЕМ, була аналогічною. Вихідні показники СЗЕ у хворих обох груп були підвищені (р < 0,05) і суттєво між собою не відрізнялися (табл. 4). На третю добу цей показник знизився у хворих другої групи — 39,6 ± 1,2 % (р < 0,05), з п’ятої доби він знижувався до нормального значення і таким утримувався протягом усього періоду дослідження. У хворих контрольної групи рівень СЗЕ залишався підвищеним до 10-ї доби, коли вперше досягав значення верхньої межі норми (38,1 ± 1,4 %, р = 0,01). ПЕМ у хворих обох груп на початку дослідження була вища за норму (р < 0,05) і становила 22,6 ± 0,6 ум.од. і 22,3 ± 0,6 ум.од. відповідно. На п’яту добу дослідження у хворих, яким в протокол інтенсивної терапії було включено РЕХ, ПЕМ була в межах норми (18,6 ± 0,4 ум.од., р < 0,05), у хворих контрольної групи цей показник досягав нормальних значень лише на 10-ту добу захворювання (18,5 ± 0,1 ум.од., р < 0,05), що можна пояснити довшим періодом ендотоксикозу, не останню роль у підтриманні якого відігравав ШКТ.
Ендотоксикоз призводить до деструктивних процесів клітинних мембран, тяжкість яких оцінювали за активністю перекисних процесів та антиоксидантного захисту. Оцінюючи систему перекисного окислення ліпідів — антиоксидантної активності (ПОЛ — АОА) у хворих з компенсованим СГІД, виявили, що вихідні значення показників МДА, ДК та каталази у хворих обох груп майже не відрізнялися (табл. 5).
/47_2.jpg)
У всіх хворих було виявлено підвищення активності ПОЛ та пригнічення антиоксидантної активності. Рівень МДА у хворих обох груп був вищим за норму і становив 165 ± 5 мкмоль/мл і 169 ± 6 мкмоль/мл відповідно (р < 0,05). У процесі лікування у хворих другої групи цей показник значно швидше наближався до норми (табл. 5). Уже на 5-ту добу захворювання рівень МДА у хворих цієї групи був на верхній межі норми (125 ± 6 мкмоль/мл, р < 0,05), у хворих першої групи він все ще перевищував норму (140 ± 5 мкмоль/мл, р < 0,05) і наближався до норми лише наприкінці 7-ї доби перебування хворого у відділенні анестезіології, реанімації та інтенсивної терапії (120 ± 5 мкмоль/мл, р < 0,05). При надходженні у ВІТ рівень дієнових кон’югат у хворих обох груп також перевищував норму та становив 2,8 ± 0,2 ум.од. та 2,9 ± 0,3 ум.од. відповідно (р < 0,05). Але вже на третю добу ІТ в алгоритм якої було включено РЕХ, рівень ДК знижувався до норми (2,0 ± 0,2 ум.од., р < 0,05), у хворих першої групи він все ще перевищував її (2,5 ± 0,2 ум.од., р < 0,05). У даної категорії хворих показник ДК зменшувався до норми лише на 7-му добу (2,0 ± 0,1 ум.од., р < 0,05). Тривале підвищення первинних продуктів ПОЛ вказує на тяжкість деструктивних процесів клітинних мембран. Включення РЕХ в комплекс ІТ приводило до зростання рівня антиоксидантної активності сироватки крові хворих з компенсованим СГІД. Рівень каталази у хворих обох груп на момент початку захворювання був нижчим за норму. Але вже на третю добу захворювання у хворих другої групи рівень каталази зростав (р < 0,05) і становив 0,102 ± 0,010 мкм/мл/год. Між динамікою показників МДА та каталази було встановлено прямий кореляційний зв’язок — r = 0,58 при р < 0,05. У хворих першої групи рівень каталази зростав до нормального значення лише на сьому добу проведення ІТ (0,101 ± 0,015 мкм/мл/год, р < 0,05).
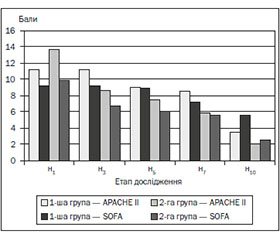
На момент надходження у ВІТ тяжкість стану у хворих обох груп була практично однаковою, за шкалою АРАСНЕ ІІ вона оцінювалася в 11,22 ± 1,61 бала (р < 0,05) і 13,61 ± 1,10 бала (р < 0,05) відповідно. У процесі лікування тяжкість стану хворих швидше регресувала у хворих 2-ї групи (рис. 1). Уже на третій день захворювання тяжкість стану хворих цієї групи зменшилася й становила 8,61 ± 0,85 бала (р < 0,05). Зниження тяжкості стану пацієнтів за шкалою АРАСНЕ ІІ у 1-й групі хворих було досягнуто на сьому добу ІТ — 8,5 ± 1,0 бала (р < 0,05). Наприкінці дослідження ці величини становили 3,5 ± 1,5 бала (р < 0,05) і 2,0 ± 1,0 бала (р < 0,01) відповідно.
На початок обстеження тяжкість СПОД у хворих першої та другої групи становила 9,2 ± 0,5 бала і 9,8 ± 0,5 бала відповідно (р < 0,05) і швидше регресувала у хворих, яким у комплекс ІТ було включено РЕХ. Тяжкість поліорганної дисфункції у хворих контрольної групи протягом перших семи днів майже не змінювалася (рис. 1), у хворих другої групи вона вірогідно зменшилася на п’яту добу проведення ІТ — 6,9 ± 0,4 бала (р < 0,05). У хворих першої групи вірогідне зниження поліорганної дисфункції було на сьому добу проведення ІТ — 7,2 ± 0,3 бала (р < 0,05) (рис. 1).
Вихідний стан тяжкості СГІД у хворих першої групи оцінювався у 2,0 ± 0,2 бала, у хворих другої групи — у 2,2 ± 0,2 бала (рис. 2).
На третій день ІТ зменшення тяжкості СГІД мало вірогідний характер — 1,6 ± 0,2 бала (р < 0,05) у хворих основної групи, тяжкість дисфункції ШКТ у хворих першої групи знижувалася на 7-му добу лікування (1,3 ± 0,2 бала, р < 0,05), хоча все ще залишалася вищою, ніж у хворих другої групи (0,8 ± 0,2 бала, р < 0,05). Така ситуація була й на 10-ту добу перебування хворих у ВІТ.
Показник інтрамукозного рН (рНі) на початку дослідження у хворих обох груп був низьким (рис. 3). Застосування РЕХ у хворих з компенсованим СГІД приводило до більш швидкого зростання цього показника на відміну від хворих, яким проводилася стандартна ІТ. Так, у хворих, яким РЕХ було включено в комплекс ІТ, на п’яту добу захворювання, було зростання цього показника до 7,26 ± 0,03 (р < 0,05), у хворих першої групи цей показник зростав на 7-му добу ІТ.
/48.jpg)
Безпосередню ефективність РЕХ оцінювали за рівнем альбуміну в сироватці крові хворого, абсолютною кількістю лімфоцитів і рівнем сечовини крові. РЕХ позитивно впливає на імунний статус організму. Так, кількість лімфоцитів у хворих, у комплекс ІТ яких було включено РЕХ, зростала значно швидше, ніж у хворих контрольної групи (табл. 6). На кінцевому етапі дослідження у хворих контрольної групи все ще була виражена лімфопенія (3,0 ± 0,5 • 103, р < 0,05), у хворих другої групи кількість лімфоцитів у периферичній крові сягала меж норми (4,2 ± 0,5 • 103, р < 0,05).
Незважаючи на те, що альбумін не може бути ідеальним маркером ефективності РЕХ через його тривалий період напіврозпаду і через те, що на його синтез впливає такий показник, як функціональний стан печінки, його перевагою як маркера ефективності РЕХ є доступна методика визначення. Як видно з даних, наведених у табл. 7, у хворих обох груп на момент надходження у ВІТ була виражена гіпоальбумінемія (21 ± 2 г/л та 20 ± 1 г/л відповідно, р < 0,05). У хворих 2-ї групи рівень альбуміну зростав набагато швидше, ніж у хворих контрольної групи. На кінцевому етапі дослідження його рівень у плазмі крові хворих основної групи зростав до 37 ± 2 г/л (р < 0,05), у контрольній групі він все ще був нижчим за норму (27 ± 2 г/л, р < 0,05).
/48_2.jpg)
Як відомо, зростання рівня сечовини у критичних хворих вказує на підвищений катаболізм. Проаналізувавши показники сечовини (табл. 8), можна зробити висновок про те, що у хворих, яким проводили РЕХ, зниження її рівня було значно швидшим, ніж у хворих контрольної групи, що може вказувати на зменшення катаболічних процесів у організмі хворого.
Головним проблемами, що виникали при РЕХ, були великий залишковий об’єм шлунка (> 3 мл/кг маси тіла), що приводило до вимушеного припинення харчування, та гіперглікемія. Невдала спроба РЕХ була у 25 % хворих. У 3 % хворих виникала діарея, що була зумовлена застосуванням суміші занадто високої концентрації. При зменшенні концентрації суміші явища діареї припинялися, і через 2–3 доби вдавалося налагодити повноцінне ентеральне харчування. Незначна гіперглікемія (цукор крові 7–8 ммоль/л) спостерігалася у 2 % хворих і була скоригована дрібними дозами інсуліну.
Висновки
У контрольній групі хворих з компенсованим СГІД летальність становила 16,6 %. З 30 хворих померло 5 пацієнтів. В основній групі хворих з 32 пацієнтів померли 4 хворі, отже, летальність становила 12,5 %. Тобто раннє ентеральне харчування не тільки сприяє швидшому регресу ознак СГІД, але і зменшує летальність.
У хворих з компенсованим СГІД основним патогенетичним чинником розвитку цього патологічного процесу є недостатня нутритивна підтримка як ентероцитів, так і всього макроорганізму. Тому при компенсованій дисфункції ШКТ з метою забезпечення ентероцитів енергетичними і пластичним матеріалом основний акцент терапевтичних заходів повинен бути направлений на забезпечення нутритивної підтримки хворого у вигляді раннього ентерального харчування. Раннє ентеральне харчування приводить до більш швидкого регресу симптомів СГІД і СПОД, зменшення тяжкості стану хворих, тривалості їх перебування в критичному стані й летальності.
/48.jpg)

/45.jpg)
/46.jpg)
/47_2.jpg)
/47.jpg)
/48_2.jpg)