Журнал «Здоровье ребенка» 7 (67) 2015
Вернуться к номеру
Особенности гипервосприимчивости к гистамину дыхательных путей у больных бронхиальной астмой детей школьного возраста при разных воспалительных фенотипах заболевания
Авторы: Ортеменка Е.П. - Буковинский государственный медицинский университет, г. Черновцы,
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
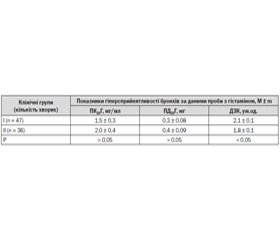
На базі Обласної дитячої клінічної лікарні м. Чернівці у 83 школярів, хворих на персистуючу бронхіальну астму, вивчалася діагностична цінність показників гіперсприйнятливості дихальних шляхів до гістаміну для верифікації запальних фенотипів захворювання. Першу (І) клінічну групу склали 47 дітей (56,6 %) з еозинофільним фенотипом бронхіальної астми, до другої (ІІ) групи ввійшли 36 пацієнтів (43,4 %), хворих на бронхіальну астму нееозинофільного/нейтрофільного фенотипу. У всіх хворим досліджували неспецифічну гіперсприйнятливість дихальних шляхів до прямих подразників за допомогою провокаційного спірометричного тесту з інгаляціями серійних розведень гістаміну (за методом E.F. Juniper, 1994). Обчислювали такі показники: провокаційну концентрацію гістаміну (ПК20Г), провокаційну дозу гістаміну та дозозалежну криву). Для оцінки діагностичної цінності тестів визначали їх чутливість, специфічність, передбачувану цінність позитивного та негативного результатів.
Бронхопровокаційну пробу з серійними розведеннями гістаміну доцільно використовувати для верифікації бронхіальної астми в дітей шкільного віку. А саме ПК20Г < 8,0 мг/мл виявляється високочутливим скринінговим тестом (чутливість 95 %) у встановленні діагнозу бронхіальной астми за різних запальних фенотипів. Жоден із показників неспецифічної гіперсприйнятливості дихальних шляхів до гістаміну недоцільно самостійно використовувати як скринуючий метод для верифікації еозинофільного фенотипу БА через високу частоту хибнонегативних результатів. Найбільш інформативним для підтвердження еозинофільного фенотипу захворювання виявляється показник гіперреактивності бронхів до гістаміну (дозозалежна крива ≥ 3,0 ум.од.) завдяки високій специфічності тесту (94 %) та незначній кількості (17 %) помилкового діагностування еозинофіласоційованого запалення дихальних шляхів за його відсутності.
На базе Областной детской клинической больницы г. Черновцы у 83 школьников, страдающих персистирующей бронхиальной астмой, изучали диагностическую ценность показателей гипервосприимчивости дыхательных путей к гистамину для верификации воспалительных фенотипов заболевания. Первую (І) клиническую группу составили 47 детей (56,6 %) с эозинофильным фенотипом бронхиальной астмы, во вторую (ІІ) группу вошли 36 пациентов (43,4 %), страдающих неэозинофильным/нейтрофильным фенотипом бронхиальной астмы. У всех больных исследовали неспецифическую гипервосприимчивость дыхательных путей к прямым раздражителям с помощью провокационного спирометрического теста с ингаляциями серийных разведений гистамина (по методу E.F. Juniper, 1994). Вычисляли следующие показатели: провокационную концентрацию гистамина (ПК20Г), провокационную дозу гистамина и дозозависимую кривую. Для оценки диагностической ценности тестов определяли их чувствительность, специфичность, прогнозируемую ценность положительного и отрицательного результатов.
Бронхопровокационную пробу с серийным разведением гистамина целесообразно использовать для верификации бронхиальной астмы у детей школьного возраста. А именно, ПК20Г < 8,0 мг/мл является высокочувствительным скрининговым тестом (95 %) для постановки диагноза БА при разных воспалительных фенотипах. Ни один из показателей неспецифической гипервосприимчивости дыхательных путей к гистамину нецелесообразно самостоятельно использовать как скрининговый метод выявления эозинофильного фенотипа бронхиальной астмы из-за высокой частоты ложноотрицательных результатов. Наиболее информативным для подтверждения эозинофильного фенотипа заболевания оказался показатель гиперреактивности бронхов к гистамину (дозозависимая кривая ≥ 3,0 усл.ед.) благодаря высокой специфичности теста (94 %) и незначительному количеству (17 %) ошибочной диагностики эозинофилассоциированного воспаления дыхательных путей при его отсутствии.
On the base of the Chernivtsy Regional Children Clinical Hospital the diagnostic value of the indices of airway hyperresponsiveness to histamine for a verification of asthma inflammatory phenotypes have been studied in 83 school age children with persistent bronchial asthma. The first (I) clinical group consisted of 47 (56,6 %) children with eosinophilic asthma phenotype. The second (II) clinical group included the remaining 36 (43,4 %) patients with non-eosinophilic/neutrophilic bronchial asthma. The non-specific bronchial hyperresposiveness to direct stimuli using spirometric provocative test with inhalation of the serial dilutions of histamine has been performed by the method of E.F. Juniper (1994). There have been calculated such indices: provocative concentration of histamine (PC20H), provocative dose of histamine (PD20H) and dose-response slope. To evaluate the diagnostic value of the tests their sensitivity, specificity, the positive and negative predictive values have been measured. Bronchial provocation test with inhalation of serial dilutions of histamine should be used for bronchial asthma verification in school-age children. Namely PC20H < 8.0 mg/ml appears highly sensitive screening test (95 %) in the diagnosis of different inflammatory asthma phenotypes. None of the indices of non-specific bronchial hyperresponsiveness to histamine can be used independently as a screening method for verification of eosinophilic asthma phenotype because of the high incidence of false negative results. The index of bronchial hyperresponsiveness to histamine (dose-relative slope ≥ 3.0 arbitrary units) is the most informative to confirm eosinophilic asthma phenotype due to the high specificity of the test (94 %) and a small number (17 %) of a false diagnosis of eosinophil-associated airway inflammation in its absence.
бронхіальна астма, діти, запальні фенотипи, гіперсприйнятливість дихальних шляхів.
бронхиальная астма, дети, воспалительные фенотипы, гипервосприимчивость дыхательных путей.
bronchial asthma, children, inflammatory phenotypes, airway hyperresponsiveness.
Статтю опубліковано на с. 24-28
Гіперсприйнятливість дихальних шляхів (ДШ) є кардинальною ознакою бронхіальної астми (БА) та визначається як їх надмірна спастична реакція у відповідь на вплив різних інгаляційних подразників [2]. Накопичені останніми десятиріччями дані дають підставу вважати, що при бронхіальній астмі основним чинником формування гіперсприйнятливості бронхів є запальний процес респіраторного тракту [1, 8], що й обґрунтувало загальноприйнятий менеджмент даної хронічної патології, а саме базисну протизапальну терапію, спрямовану на зменшення рецидивів захворювання та контроль над симптомами хвороби [5, 7]. Незважаючи на впровадження у практику чітких вітчизняних та міжнародних стандартів та протоколів лікування БА, у 10–30 % випадків спостерігається неефективність базисної протизапальної терапії, що супроводжується недостатнім рівнем контролю над симптомами захворювання [11, 12]. Резистентність до стандартної протизапальної терапії пов’язують наразі з фенотиповим поліморфізмом БА, а саме з існуванням альтернативних варіантів запалення дихальних шляхів [1, 5, 7], зокрема з нейтрофільною запальною відповіддю бронхів, що трапляється в 30–50 % пацієнтів [6, 7]. Водночас оприлюднені дані щодо особливостей гіперсприйнятливості дихальних шляхів за різних запальних фенотипів БА у дітей є обмеженими та досить суперечливими. А саме, у когорті дорослих, хворих на БА, зареєстрована певна ригідність бронхіального дерева при нееозинофільному фенотипі захворювання, що пояснювалося більш вираженими процесами ремоделювання ДШ у таких хворих унаслідок нейтрофілопосередкованого місцевого запалення [3, 11]. За даними F. Pederse (2014), значна персистуюча еозинофілія дихальних шляхів (за даними цитологічного дослідження індукованого мокротиння) асоціюється з вираженою гіперсприйнятливістю ДШ у дорослих пацієнтів, водночас серед дітей, хворих на БА, виражена бронхіальна гіперреактивність реєструвалася в пацієнтів із стабільно низьким рівнем еозинофілів у мокротинні [10]. Тому вивчення особливостей гіперсприйнятливості бронхів до прямих спазмогенних стимулів за окремих запальних фенотипів БА є актуальним і перспективним завданням.
Мета дослідження. Вивчити особливості гіперсприйнятливості дихальних шляхів до гістаміну у хворих на бронхіальну астму дітей шкільного віку за різних запальних фенотипів захворювання.
Матеріали і методи дослідження
/26.jpg)

/26_2.jpg)