Газета «Новости медицины и фармации» 15 (558) 2015
Вернуться к номеру
Легочная гипертензия у детей, больных на бронхолегочную дисплазию
Авторы: Сенаторова Г.С., Логвинова О.Л., Лапшин В.Ф., Муратов Г.Г., Башкирова Н.В. - Харьковский национальный медицинский университет
Разделы: Медицинское образование
Версия для печати
Статья опубликована на с. 28-32 (Укр.)
Упродовж століття проводяться дослідження та експерименти з виявлення причин і механізмів формування легеневої гіпертензії. Разом із тим досі залишаються відкритими деякі аспекти легеневої гемодинаміки в дітей, хворих на бронхолегеневу дисплазію. Не з’ясовані особливості легеневої циркуляції в дітей, народжених у сакулярну стадію, обговорюються можливість росту й відновлення легеневого русла в ранньому дитячому віці, предиктори формування хронічного легеневого серця.
1. Онтогенез легеневих судин людини
Пульмональна циркуляція формується паралельно альвеоляризації за рахунок інтеграції ендотелію, мезенхіми та епітелію, що оточують бронхіальні зачатки, в умовах низького рО2 (порівняно з постнатальним періодом) і залежить від протеїнів екстрацелюлярного матриксу, а також передавальних інтегринових рецепторів (Афанасьєва Ю.І. та співавт., 2006). Клітини вісцеральної мезодерми мають ангіобласти та розташовуються в екстрацелюлярному матриксі як координуючі клітини (cord-like-клітини). Ангіобласти продукують першу генерацію неспецифічних ендотеліальних клітин. Дочірні клітини ангіобластів мають особливості артеріального або венозного відрізка циркуляції. Сord-like-клітини формують великі судини за рахунок комплектування клітин м’язів і ендотелію артеріальної стінки, а також капілярну мережу й альвеоли.
Формування судин відбувається з початком експресії фетальної печінкової кінази-1 (FLK-1) ендотеліальними клітинами бронхіальних зачатків (Harkaitz B., 2008). Cord-like-ендотеліальні клітини створюють трубку та навколишні кров’яні острівки. У результаті формуються мікросудини. У людському ембріоні з 50-ї доби гестації починається каналізація та з’єднання венозного синуса з капілярами.
На 10-й тиждень уже існує примітивна капілярна мережа й виникає контакт між капілярами та венами біля дистальних відділів бронхіальних зачатків. Після цього розвивається судинна мережа, що акомпанує альвеолам. Так, судини ростуть у певному порядку: капіляри — пульмональні вени — просвіт вен — з’єднання вен із капілярами — каналізація бронхіальних і пульмональних артерій — їх з’єднання з капілярною мережею. У результаті на 19-му тижні капілярна мережа стає частиною альвеолярної стінки, формуючи альвеолокапілярну мембрану (Chen H., 2008; Morrisey E.E., 2009). Матриксні протеїни забезпечують зв’язок між мезенхімальними, епітеліальними й ендотеліальними клітинами. Цей зв’язок настільки сильний, що легенева мезенхіма без ендотеліальних клітин дегенерує.
До кінця першої половини вагітності примітивні бронхи із судинами та гілками дихальних шляхів уже сформовані. З 18-го до 26-го тижня гестації альвеолярний простір збільшується експотенційно: кількість генерацій артеріол збільшується від 5 до 40 розгалужень, а легеневий об’єм судин збільшується вдесятеро. З 20-го до 36-го тижня гестації діаметр правої камери серця збільшується на 60 %, а об’єм крові — на 8 %. Легеневий об’єм підвищувався швидше, ніж тиск у легеневих судинах.
Особливості репарації судинної стінки під час ангіогенезу
Судинна стінка швидко відновлюється після ураження. Під час відновлення клітини судинної стінки ростуть анатомічно правильно незалежно від характеру мітогену. Ремоделювання судин в ембріональному періоді відбувається за рахунок м’язових клітин судини, подібних до ембріональних (Рeacock J., Rubin L.J., 2004). Зростання за рахунок неоінтими та медії можливе тільки внутрішньоутробно. Після народження репарація судин здійснюється тільки за рахунок медії. Поповнення 80 % пулу клітин відбувається кожні 24 години. Після народження реплікація стає значно повільнішою. Внутрішньоутробна некоординованість сигналів може уповільнювати зростання альвеолярного простору, утримуючи порушення проникності альвеолокапілярної мембрани після народження. Малі дози нікотину під час вагітності індукують легеневу гіпоплазію з абнормальним розвитком циркуляції.
Роль оксигенації й ендогенних медіаторів в ангіогенезі
Зростання судин залежить від нормальної оксигенації. При низькій оксигенації виникає гальмування росту. Гіпоксичну пульмональну вазоконстрикцію описують у новонароджених 30–36 тижнів гестації. Найбільш очевидна субстанція, що контролює фетальну легеневу циркуляцію, — тиск у легеневій артерії. Низький тиск у легеневій артерії підтримується високим артеріальним тонусом легеневих артерій. Після народження високий артеріальний тиск знижується за рахунок зниження тонусу судин.
Фетальна киснезалежна регуляція легеневої циркуляції розвивається з 31-го тижня гестації, що доведено J. Rasanen, який вивчав легеневу циркуляцію плодів, при вдиханні матір’ю високооксигенерованої суміші. Високий тиск кисню у фетальних легенях активує кальційчутливі калієві канали (К+Са++) і дозволяє калієвим іонам витікати із клітин гладкої мускулатури, що сприяє вазодилатації. Хоча К+Са++-канали є медіаторами, вазодилатації сприяє NO, що синтезується медіаторами ендотелію. У більш пізні терміни гестації синтез NO забезпечується гладкою мускулатурою. NO — найпотужніший вазодилататор. В ендотеліальних клітинах — ензим нітритоксидсинтаза (eNOS), що каталізує продукцію ендотеліальними клітинами NO, конвертуючи L-аргінін (L-arg) у цитрулін. NO легко проходить у медіа, викликаючи релаксацію гладкої мускулатури судин; eNOS контролює нормальний васкулярний розвиток (Рeacock J., Rubin L.J., 2004).
Кисень активує NO в ендотелії, однак вазодилатація короткострокова — близько 2 годин. Транзиторна вазодилатація обумовлена також ацетилхоліном і посилюється цГМФ та іншими ендотелійзалежними вазодилататорами, такими як гістамін, брадикінін, толазолін. Вазодилататори сприяють закриттю артеріальної протоки через активацію ендотеліальних факторів. Ще один важливий вазодилататор — ендотелін-1, пептид, що регулюється через ендотелін-А-рецептори (ЕТА) (вазоконстриктори) або ендотелін-В-рецептори (ЕТВ) (вазодилататори) (Рeacock J., Rubin L.J., 2004).
Фетальна артеріальна стінка має здатність до репарації, що обумовлено наявністю специфічного ізоензиму протеїнкінази С, який з’являється у фетальному періоді та зникає або зменшується в дорослих. Фетальні м’язові клітини і фібробласти демонструють більш виражену реплікацію на гіпоксію, ніж клітини дорослих, а судинна стінка гірше реагує на екзогенні мітогени. У фетальній судинній стінці вище апоптоз і метаболізм матриксу, а гладком’язові клітини поліфункціональні. Особливістю матриксного внутрішньоутробного синтезу є більш виражена стимуляція фібронектину, еластину з продовженням абнормального стимулу в неонатальний період і підвищеною чутливістю до стимуляції в ранньому дитячому віці. Недоношені більше реагують вазоконстрикцією на гіпоксемію, а легенева гіпертензія зберігається ще протягом тривалого часу після низького рО2. Високий тиск в ЛА швидше, ніж у дорослих, викликає констрикцію судинної стінки, включаючи проліферацію фібробластів, синтез сполучної тканини, активацію цитокінів і мітогенів, матриксного протеїну фібробластів, що відкладаються в пульмональній артерії. Будь-яке ушкодження судинної стінки ще більше активує викид фібробластів, сприяє неоваскуляризації судин і збільшенню медії.
2. Етіологія легеневої гіпертензії в дітей, хворих на бронхолегеневу дисплазію
Причини легеневої гіпертензії в дітей із БЛД залежно від характеру судинних змін можуть бути розподілені на групи:
1. Порушення адаптації легеневих судин.
Дрібні м’язові легеневі артерії (< 250 мкм), маючи нормальний структурний розвиток й анатомію, після народження дитини не розправляються через перинатальний стрес: кровотеча, гіпоглікемія, гіпокальціємія, поліцитемія, аспірація меконію, гіпоксія, бактеріальна інфекція. Спочатку це обумовлює спазм артерій, пізніше тривала легенева гіпертензія викликає посилене утворення сполучної тканини навколо гладком’язових клітин, що зменшує їх здатність у вазодилатації.
2. Васкулярна гіпоплазія.
Затримка внутрішньоутробного дозрівання судин легенів проявляється в збереженні гіпертрофії середнього шару м’язових артерій і вен ацинуса й у поширенні гладком’язових клітин на артеріоли. Подібні характеристики типові для малого гестаційного віку. Вони обумовлюють збереження високого судинного опору. Затримка розвитку судин визначається в новонароджених, які піддавалися хронічному внутрішньоутробному стресу й гіпоксії. Особливість цього виду ЛГ у тому, що легеневі судини гальмованого онтогенезу надзвичайно схильні до спазму під впливом гіпоксії та ацидозу (Lecart C., Cayabyab, 2000).
3. Одночасне недорозвинення легенів і легеневих судин, підвищена мускулярнізація артеріол — типова морфологічна картина при вродженій діафрагмальній грижі. У новонароджених, які померли через цю ваду, виявлено нормальне співвідношення артерій та альвеол, але абсолютна їх кількість зменшена на 1/3 і більше. М’язовий шар артеріол у цих дітей такої ж товщини, як на тлі обструкції виходу з лівого шлуночка.
4. Стеноз легеневих вен.
5. Дисфункція лівого шлуночка.
6. Шунтування крові із системного кровообігу в пульмональний (аортопульмональні колатералі, атріо- та вентрикулосептальні дефекти, відкрита артеріальна протока).
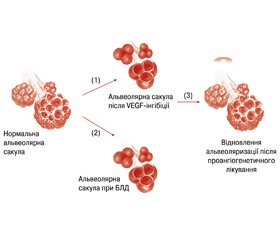
Необхідно пам’ятати, що артеріальна гіпоксемія та гіперкарбія також вважаються одним із факторів спазму легеневих артерій. Наявність легеневої артеріальної гіпертензії корелює з тяжкістю бронхолегеневої дисплазії. У моделях бронхолегеневої дисплазії з легеневою артеріальною гіпертензією в інтермедії судин виявляли фібробласти. Фібробласти чутливі до гіпоксії клітин, що продукують матриксну металопротеїназу-2 під впливом прозапальних цитокінів (Frid M., Aldashev A., 1999; Das M., Dempsey E.C., 2000; Ambalavanan N., 2004). Рецептори судинного ендотеліального і трансформуючого фактора росту виявляються в дистальній частині легень і зумовлюють зростання альвеол (Galambos C., Levy H., 2010; Minoo P., 2010). За умов інгібіції VEGF виникає гальмування росту альвеол (рис. 1).
Активує онтогенез легень збільшення VEGF, HIF-1 та NO в легеневих капілярах.
3. Патогенез легеневої гіпертензії
Зменшений сумарний просвіт судин, гіпоксія, гіперкапнія викликають підвищений опір легеневого кровообігу, легеневу гіпертензію. Подальший перебіг ЛГ активують два фактори: гіпоксія та гіперкапнія, що підсилюють гіпертензію. Процес переходить у другу стадію, до спастичної легеневої гіпертензії приєднується застійна. Виявлено, що при тривалій легеневій гіпертензії в частини пацієнтів наявні колатералі, пов’язані із системним кровообігом (аортою, підключичною артерією). Ріст колатералей можуть стимулювати гіпоксія та хронічне запалення. Третя стадія — фіброз легеневих судин — необоротна стадія. Звичайно, діти, хворі на бронхолегеневу дисплазію, мають повільний розвиток легеневої гіпертензії.
4. Клінічні критерії ЛГ у дітей, хворих на бронхолегеневу дисплазію
Головною скаргою в дітей, хворих на легеневу гіпертензію, є диспное. Диспное з’являється при фізичному навантаженні, потім при прогресуванні захворювання — у спокої, іноді супроводжується приступами задухи. Іншим проявом вважається пресинкопе/синкопе, частіше під час годування, неспокою. Синкопе виникають як наслідок зниження церебрального кровообігу, вазовагального рефлексу з легеневої артерії, зниження хвилинного об’єму кровообігу. Можливі швидка втомлюваність, запаморочення, приступи болю в ділянці серця через вплив гіпоксії на міокард, пов’язаної з відносною недостатністю коронарного кровообігу при гіпертрофії міокарда правого шлуночка та рефлекторним спазмом коронарних артерій. При огляді звертають на себе увагу тахікардія, посилена пульсація в ІІ міжребер’ї зліва та в епігастральній ділянці. При пальпації можна відмітити характерний симптом «двох молоточків»: І тон ляскаючий, ІІ тон різко акцентований. При аускультації визначається розщеплення І тону на верхівці (затримання закриття тристулкового клапана), ІІ тон над легеневою артерією різко посилений, акцентований. Характерна наявність ІІІ тону, що вислуховується справа від грудини та посилюється з появою правошлуночкової недостатності. Може вислуховуватися систолічний шум легеневого вигнання уздовж лівого краю грудини та діастолічний шум у ІІ міжребер’ї зліва через недостатність тристулкового клапана. Слід зазначити, що клінічні критерії мають низьку специфічність у дітей, хворих на бронхолегеневу дисплазію. Диспное неспецифічне за рахунок наявності дихальної недостатності. У дітей із БЛД часто має місце коморбідна патологія центральної нервової системи, що обмежує можливості визначення причин ціанозу та синкопе.
Алгоритм визначення ЛГ у дитини, хворої на БЛД, за клінічними критеріями
У пацієнта із БЛД під час чергового огляду клінічні дані оцінюються за 5 критеріями (табл. 1).
Кожний критерій має оціночну шкалу від 0 до 3 балів. Підраховується загальна сума балів. При набраній сумі балів ≥ 5 визначається ймовірність формування ЛГ у дитини, хворої на БЛД, і дитина направляється для додаткового обстеження. При загальній сумі балів < 5 дитина спостерігається залежно від ступеня тяжкості БЛД (ефективність — 90 % і чутливість — 88 %). Алгоритм критеріально відповідає рекомендаціям робочої групи Європейського товариства щодо діагностики та лікування ЛГ та розроблений за результатами дискримінаційного аналізу клінічних даних у 206 дітей із БЛД.
5. Аналіз рентгенографічних ознак ЛГ у дітей, хворих на бронхолегеневу дисплазію
Рентгенографія органів грудної клітки дозволяє виявити непрямі ознаки легеневої гіпертензії, якими є:
1. Розширення кореня легень.
Вимір кореня правої легені в його середній частині починається від зовнішньої межі правої легеневої артерії до зовнішньої межі правого головного бронха — показник Шведеля. При ЛГ показник Шведеля ≥ 0,8 см.
2. Серцева тінь характеризується вибуханням другої дуги (конуса легеневої артерії по лівому контуру).
3. Збільшення коефіцієнта Мура. Індекс Мура розраховується за формулою:
Індекс Мура = (РА • 100 %)/1/2 базального діаметра грудної клітки,де РА — перпендикуляр, що опущений на середню лінію (М) із найбільш віддаленої точки другої дуги зліва. Цей показник є відношенням поперечника дуги легеневої артерії до половини базального діаметра грудної клітки (лінія АС) у відсотках. Індекс Мура ≥ 30 % безпосередньо свідчить про легеневу гіпертензію.
4. Збільшення розмірів правого передсердя. Індекс Гудвіна розраховується за формулою:
індекс Гудвіна = (Mr • 100 %)/1/2 базального діаметра грудної клітки,
де Mr — перпендикуляр, опущений на середню лінію (М) із найбільш віддаленої точки правого контура серця. Індекс Гудвіна ≥ 30 % безпосередньо свідчить про дилатацію правого передсердя.
5. Посилення легеневого рисунка.
6. Загальне та нерівномірне підвищення прозорості легеневих полів.
Щодо рекомендацій робочої групи європейських товариств у пацієнтів із пульмональними захворюваннями та/або гіпоксією, до яких відноситься бронхолегенева дисплазія, рентгенографічні критерії слабко корелюють зі ступенем ЛГ.
6. Визначення електрокардіографічних критеріїв ЛГ у дітей, хворих на бронхолегеневу дисплазію
За допомогою електрокардіографії можна припустити формування легеневої гіпертензії при наявності гіпертрофії або напруження правого шлуночка (ПШ) і дилатації правого передсердя (ПП). За даними ECS, гіпертрофія ПШ наявна в 87 % хворих і дилатація ПП — у 79 % хворих із ЛГ. Аритмії зустрічаються дуже рідко, тільки при тяжкій ЛГ.
До електрокардіографічних (ЕКГ) опосередкованих ознак легеневої гіпертензії в дітей, хворих на БЛД, відносять (Bernard R., 2009):
1. Зубці Т у відведеннях V1, V2, V3 негативні.
2. Вісь комплексу QRS > 90°.
3. Відношення 100 R/(R + S) у V5 < 50 %.
4. Розміри P у ІІ відведенні > 2 мм.
5. Відношення 100 Р/(R + S) у ІІ відведенні > 26 %.
6. Відношення 100 R/(R + Q) у відведенні aVR > 50 %.
7. Відношення 100 R/(R + S) у V1 > 50 %.
1. Зубці Т у відведеннях V1, V2, V3 негативні.
2. Вісь комплексу QRS > 90°.
3. Відношення 100 R/(R + S) у V5 < 50 %.
4. Розміри P у ІІ відведенні > 2 мм.
5. Відношення 100 Р/(R + S) у ІІ відведенні > 26 %.
6. Відношення 100 R/(R + Q) у відведенні aVR > 50 %.
7. Відношення 100 R/(R + S) у V1 > 50 %.
7. Оцінка газів крові в дітей із ЛГ на тлі БЛД
Гази артеріальної крові можуть ідентифікувати внесок дихальних шляхів або паренхіми легень у формування ЛГ. Пацієнти із БЛД часто мають зменшену легеневу дифузійну поверхню та підвищений рівень CO2. При дослідженні нами виявлена вірогідна кореляція між рівнем SрO2 і рівнем легеневої гіпертензії (r = 0,896). Гостре зниження SрO2 < 92 % у дітей із БЛД може викликати спазм легеневих судин більше ніж на 2 години. Тривала низька сатурація (SрO2 < 92 %) викликає постійну вазоконстрикцію легеневих судин. Важливо оцінювати сатурацію кисню протягом доби: під час годування, неспокою та сну.
8. Визначення легеневої гіпертензії за допомогою допплер-ехокардіографії
На даний час методика катетеризації правих відділів серця є золотим стандартом при визначенні тиску в легеневій артерії. Поряд із цим дана методика інвазивна, має обмеження та не може бути використана для динамічного спостереження. Трансторакальна допплер-ехокардіографія (Д-ЕхоКГ) є обов’язковим методом діагностики легеневої гіпертензії за рахунок достатньої точності визначення систолічного, діастолічного та середнього тиску в легеневій артерії. Згідно з рекомендаціями ESC, основними параметрами визначення легеневої гіпертензії за Д-ЕхоКГ є швидкість трикуспідальної регургітації (velocity tricuspid regurgitation — Vtr) та систолічний тиск у легеневій артерії (pulmonary arterial systolic pressure — systolic-PAP). Визначити systolic-PAP можна декількома способами: визначивши пікову швидкість потоку трикуспідальної регургітації та за A. Kitabatake, емпірично через визначення діаметра нижньої порожнистої вени (НПВ).
Визначення ЛГ за допомогою пікової швидкості потоку трикуспідальної регургітації та оцінка систолічного тиску в легеневій артерії
Метод застосовується при відсутності обструкції вихідного відділу ПШ. В основі визначення systolic-PAP лежить модифіковане рівняння Бернуллі: ΔР = 4 • Vtr2, де ΔР — градієнт тиску через тристулковий клапан, Vtr — пікова швидкість трикуспідальної регургітації (м/с). Якщо ΔР < 50 мм рт.ст., то systolic-PAP = ΔР. Якщо ΔР = 85 мм рт.ст., то systolic-PAP = ΔР + 15 мм рт.ст.
Залежність systolic-PAP від mean-PAP виражається формулою:
systolic-PAP = mean-PAP – 2 мм рт.ст./0,61.
Визначення середнього тиску в легеневій артерії за A. Kitabatake
Даний метод відрізняється відносною простотою та високою точністю визначення mean-PAP. За A. Kitabatake розраховують середній тиск у легеневій артерії (mean-PAP), визначаючи часові параметри систолічного потоку в легеневій артерії (табл. 2).
Визначають відношення часу прискорення потоку (АТ) у вихідному відділі правого шлуночка до часу викиду (ЕТ). Було показано, що це відношення знаходиться в оберненій залежності від величини mean-PAP.
Визначення тиску в правому передсерді через діаметр нижньої порожнистої вени
Тиск у правому передсерді можна оцінити емпірично. Для цього визначають діаметр НПВ та оцінюють її реакцію на глибокий вдих. Якщо діаметр НПВ < 15 мм рт.ст. та вона колабує під час глибокого вдиху, то вважається, що тиск у ПП < 5 мм рт.ст. Якщо діаметр НПВ збільшується до 25 мм та зменшується під час вдиху > 50 %, то тиск у ПП 5–10 мм рт.ст. Зменшення реакції НПВ на глибокий вдих < 50 % при нормальному тиску свідчить про тиск у ПП 10–15 мм рт.ст., а при дилатації НПВ тиск досягає 15–20 мм рт.ст. Якщо виявлена дилатація не тільки НПВ, а й печінкових вен, то прийнято вважати, що тиск у ПП переважає 20 мм рт.ст.
Для визначення тиску в ПШ, а отже, і в легеневій артерії необхідно до градієнта тиску на трикуспідальному клапані (ΔР) додати тиск у ПП:
systolic-PAP = ΔР + тиск ПП.
Звичайно systolic-PAP визначається за допомогою пікової швидкості потоку трикуспідальної регургітації або за A. Kitabatake. При неможливості використовувати перераховані вище методи systolic-PAP приблизно підраховується за допомогою емпіричного аналізу нижньої порожнистої вени.
Ехокардіографічні критерії оцінки наявності ЛГ у дітей із БЛД
Робочою групою європейських товариств (2009, 2012) визначені Д-ЕхоКГ-критерії оцінки легеневої гіпертензії (рис. 2). За алгоритмом визначається ймовірність легеневої гіпертензії в дитини з бронхолегеневою дисплазією.
Додаткові критерії, за якими припускають ЛГ та визначають прогноз щодо виживаності дитини з БЛД:
1. Збільшення товщини стінки правого шлуночка. Стінка правого шлуночка вимірюється методом Д-ЕхоКГ та зіставляється з нормативними значеннями залежно від маси. Потовщення стінки визначається при товщині, більшій за 90-й перцентиль (табл. 3).
2. Збільшення кінцево-діастолічного діаметра правого шлуночка. Діаметр правого шлуночка вимірюється методом Д-ЕхоКГ і зіставляється з нормативними значеннями залежно від маси. Розширення порожнини ПШ визначається при товщині, більшій за 90-й процентиль (табл. 4).
9. Катетеризація правих відділів серця
Катетеризація правих відділів серця та легеневої артерії у хворих на легеневу гіпертензію проводиться у випадках необхідності виключення кардіальних чинників гіпертензії, визначення основних параметрів легеневої та центральної гемодинаміки, а також підбору ефективних вазодилататорів. При цьому оцінюють такі параметри: частоту серцевих скорочень, систолічний, діастолічний і середній тиск, тиск заклинювання в легеневих капілярах (ЛТЗ), серцевий викид (шляхом термодилюції або методом Фіка у випадках системно-легеневих шунтів), кров’яний тиск, легеневий і системний судинний опори, сатурацію кисню в артеріальній і змішаній венозній крові. Діагноз «легенева артеріальна гіпертензія» установлюють при середньому тиску в легеневій артерії > 25 мм рт.ст. у спокої або > 30 мм рт.ст. при фізичному навантаженні та ЛТЗ < 15 мм рт.ст. При катетеризації можливе виконання гострих вазодилатаційних тестів із простацикліном, аденозином, оксидом азоту. З 2009 року ECS рекомендоване використання перорального силденафілу та інгаляційного ілопросту для гострого вазодилатаційного тесту. Позитивною гострою відповіддю вважається певне зниження mean-PAP ≥ 10 мм рт.ст. до досягнення абсолютного значення mean-PAP ≤ 40 мм рт.ст. зі збільшенням парціального тиску вуглекислого газу (Guiddelines for the diagnosis and treatment of pulmonary hypertension, 2009; Barst R.J., 2010).
10. Оцінка виживаності в дітей із ЛГ на тлі БЛД
Модифікований тест на фізичну здатність дітей із ЛГ на тлі БЛД
Фізична здатність у дітей із ЛГ на тлі БЛД визначається за допомогою 6-хвилинного годування під спостереженням лікаря, постійним моніторуванням тривалості годування та наявності періодів десатурації (рис. 3).
При наявності однієї з вищеперерахованих ознак дитині визначається орієнтовно несприятливий прогноз щодо виживаності, та пацієнт направляється на проведення біохімічного і Д-ЕхоКГ-обстеження. Відмічено високу ефективність (90 %) та специфічність методу (97,1 %).
Шкала прогностичної оцінки виживаності в дітей із ЛГ на тлі БЛД
При огляді лікар визначає орієнтовно несприятливий прогноз щодо виживаності, і пацієнт направляється на проведення біохімічного та Д-ЕхоКГ-обстеження. Аналізується шкала прогностичної оцінки виживаності в дітей із ЛГ на тлі БЛД. При наявності ≥ 1 клінічного та ≥ 1 або 2 маркерів за Д-ЕхоКГ визначається несприятливий прогноз щодо виживаності дітей із легеневою гіпертензією на тлі бронхолегеневої дисплазії (табл. 5).
Ефективність методу — 94 %, чутливість — 92 %.
Для уточнення прогнозу та визначення тактики лікування рекомендований аналіз біохімічних маркерів — мозкового натрій–уретичного пептиду N-термінального фрагмента BNP (brain natriuretic peptide (BNP)) та (N-terminal segment proBNP (NT-proBNP)). При біохімічному аналізі крові рівень BNP > 180 пг/мл, NT-proBNP < 1400 пг/мл та судинного ендотеліального фактора росту < 85 пг/мл свідчить про несприятливий прогноз.
11. Лікування легеневої гіпертензії на тлі БЛД
Лікувальні заходи включають такі етапи:
1. Усунення гіпоксії.
2. Оптимізація параметрів респіраторної підтримки.
3. Визначення ВАП, її гемодинамічної значущості та лікування ВАП.
4. Підтримуюча медикаментозна терапія.
5. Специфічна медикаментозна терапія.
1. Усунення гіпоксії.
2. Оптимізація параметрів респіраторної підтримки.
3. Визначення ВАП, її гемодинамічної значущості та лікування ВАП.
4. Підтримуюча медикаментозна терапія.
5. Специфічна медикаментозна терапія.
Усунення гіпоксії
Гіпоксія є одним із факторів спазму легеневих артерій. Навіть короткочасна гіпоксія викликає спазм легеневих судин ≥ 2 годин. Тому при наявності легеневої гіпертензії для усунення подальшого спазму необхідно підтримувати SрO2 ≥ 94 %. При SрO2 < 94 % дотація О2 > 15 годин на день через маску або за допомогою NСРАР. Зазвичай у дітей із БЛД за допомогою киснетерапії вдається усунути легеневу гіпертензію. При незадовільному ефекті киснетерапії показана підтримуюча та специфічна медикаментозна терапія.
Оптимізація параметрів респіраторної підтримки
Часто ЛГ та перевантаження правих відділів серця виявляється в дітей, що знаходяться на ШВЛ, за рахунок постійного позитивного тиску при диханні. У недоношених дітей із початковою ригідністю легень високий PIP може підтримувати гіперінфляцію, зменшувати легеневу перфузію та серцевий викид, що призводить до зниження транспорту кисню PaO2. Затримка води в легенях значно виражена при збільшенні РаСО2. Анатомічні особливості недоношених, зокрема ригідні легені та недорозвинені артеріоли, ще більше сприяють набряку. Важливо підтримувати оптимальні параметри вентиляції. Схожі гемодинамічні зміни може викликати автопозитивний тиск наприкінці видиху на тлі бронхоспазму в дитини, яка не знаходиться на ШВЛ.
Специфічна медикаментозна терапія
Відповідно до резолюції педіатричної групи Світового симпозіуму з легеневої гіпертензії (2012), препаратами вибору щодо лікування ЛГ у дітей вважаються антагоністи ендотелінових рецепторів (endothelin receptor antagonists — ERA), простаноїди й інгібітори фосфодіестерази-5 (phosphodiesterase type-5 inhibitors — PDE-5). Вони мають клас А доказовості та клас І ефективності (Guiddelines for the diagnosis and treatment of pulmonary hypertension, 2013). Антагоністи ендотелінових рецепторів, простаноїди та інгібітори фосфодіестерази-5 сприяють онтогенезу легень за рахунок збільшення експресії VEGF, HIF-1 та NO в легеневих капілярах.
До призначення вазодилатаційної терапії проводять гострий вазодилатаційний тест. Зазвичай вазодилатаційні тести застосовують з метою визначення відповіді на гіпотензивну терапію при проведенні катетеризації правих відділів серця, що є інвазивною та небезпечною методикою. У дітей, хворих на бронхолегеневу дисплазію, запропоноване проведення вазодилатаційного тесту під час Д-ЕхоКГ. Як вазодилататор рекомендують використовувати інгібітор PDE-5, простаноїди, ERA. При проведенні Д-ЕхоКГ визначається systolic-PAP та mean-PAP за будь-якою зазначеною вище методикою. Після цього дитина отримує, наприклад, силденафіл перорально одноразово в дозі 1 мг/кг. Повторне вимірювання тиску в легеневій артерії проводиться через 60 хвилин. Позитивною реакцією вважається зниження mean-PAP ≥ 10 мм рт.ст. при проведенні вазодилатаційного тесту.
Антагоністи ендотелінових рецепторів мають вазодилатаційний та антимітогенний ефекти. Босентан — перший пероральний антагоніст ендетолін-А- та ендотелін-В-рецепторів. Призначається в дозі 2–3 мг/кг/добу перорально, розділеній на 2 прийоми. Можливе збільшення дози до 4 мг/кг/добу після 4 тижнів прийому при відсутності позитивного ефекту. Амбрисентан — останнє покоління ERA, селективний антагоніст ендетолін-А-рецепторів. Призначається в дозі 0,1 мг/кг/добу одноразово. Дозу можливо збільшити до 0,2 мг/кг/добу.
Інгібітори фосфодіестерази-5 (інгібітори PDE-5) — інгібітори циклічного гуанозин-3′-5′-монофосфату (цГМФ) фосфодіестерази 5-го типу, фармакологічний ефект яких пов’язаний із підвищенням внутрішньоклітинної концентрації цГМФ, релаксацією та зменшенням проліферації гладком’язових клітин судин. Силденафіл призначається в дозі 1–2 мг/кг/добу перорально, розділеній на 3 прийоми. За неефективності терапії можна підвищити дозу до 3–8 мг/кг/добу. Тадалафіл призначається в дозі 0,5–1 мг/кг/добу один раз на день. Більшість побічних ефектів інгібіторів PDE-5 пов’язана з вазодилатацією: головний біль, гіперемія, носова кровотеча. Останнім часом з’явились дослідження про підвищення ризику смертності у молодих тварин, в терапії легеневої гіпертензії яких використовувались високі дози інгібіторів ФДЕ-5. Педіатрична група Європейської асоціації кардіологів наполягає на перевазі простаноїдів у виборі препаратів для терапії легеневої гіпертензії у дітей. Простаноїди переважно продукуються ендотеліальними клітинами і сприяють вазодилатації та протекції всіх судин. Епопростенол — препарат для внутрішньовенної інфузії, нестабільний, має пері–од півжиття 3–5 хвилин, розпадається при кімнатній температурі ≥ 8 годин, тому його необхідно вводити постійною внутрішньовенною інфузією. Лікування епопростенолом ініціюють у дозі 2–4 нг/кг/хв з поступовим збільшенням дози до 20–40 нг/кг/хв, контролюючи побічні ефекти — головний біль, гіперемію, діарею. Ілопрост — синтетичний аналог простацикліну для внутрішньовенної інфузії, перорального прийому, інгаляцій. Перевагою інгаляційного призначення ілопросту вважається локальний вазодилатаційний ефект. Ранній вік дитини зменшує повноту таргетної доставки простаноїдів, тому їх ефективність може бути знижена. Інгаляційно ілопрост призначається в дозі 2,5–5 нг на 1 інгаляцію, 6–8 разів на день. Внутрішньовенно ілопрост призначається в дозі 0,5–2 нг/кг/хв. Ефект перорального ілопросту поки що вивчено при ЛГ. Трепростилін — трициклічний аналог епопростенолу, що має властивості стабільності розчину при кімнатній температурі. При прийомі трепростиліну спостерігаються найліпша керована ЛГ і виживаність. Призначається трепростилін у дозі 1–2 нг/кг/хв з поступовим збільшенням дози до 40–80 нг/кг/хв. За рекомендаціями педіатричної групи Світового симпозіуму з ЛГ (2012), при прийомі специфічної терапії дотримуються алгоритму, і при неефективності пероральної та інгаляційної монотерапії треба комбінувати вазодилататори та вводити їх внутрішньовенно (рис. 4).
Амінокислота аргінін (тівортін) резолюцією педіатричної групи Світового симпозіуму з легеневої гіпертензії (2012) не розглядається, водночас тривають дослідження щодо можливості її використання.

Пройти тестовое задание к симпозиуму

/29_u.jpg)
/29_u2.jpg)
/30_u.jpg)
/30_u2.jpg)
/30_u3.jpg)
/31_u.jpg)
/31_u2.jpg)
/31_u3.jpg)
/32_u.jpg)