Статья опубликована на с. 75-79
Введение
Монооксид азота (NO) в респираторном тракте продуцируется нитрооксидсинтазами (NOS) эпителиоцитов, эндотелиоцитов, провоспалительных клеток иммунной системы (макрофагов, нейтрофилов, тучных клеток, Т-лимфоцитов), нейронов [9, 17]. Из множества процессов в организме, которые регулируются NO, особое значение при патологии органов дыхания имеет его провоспалительное действие.
Краткая характеристика монооксида азота и активных радикалов азота
Различают три электронных состояния молекулы NO — нейтрально заряженный радикал; отрицательно заряженный радикал нитроксил (NO–), образующийся при присоединении одного электрона; положительно заряженный радикал нитрозоний (NO+), образующийся при потере одного электрона [3]. Период полураспада NO в живых организмах составляет от 1 до 5 секунд [4]. Активные радикалы азота участвуют в следующих процессах: 1) нитрования, образуя нитротирозин, нитрогуанозин; 2) нитрозилирования, образуя нитрозотиолы, нитроз–амины; 3) окисления [1].
К активированным азотсодержащим метаболитам относятся радикальные NO•, NO2• и NO3• и нерадикальные HNO2, NO+, NO–, N2O4, N2O3, NO2+, ROONO и RO2ONO соединения. NO быстро окисляется до двуокиси азота (NO2), которая в водных растворах превращается в нитрит-анион (NO2–) или нитрат-анион (NO3–) (рис. 1).
Взаимодействие NO и O2– приводит к образованию аниона пероксинитрата (OONOO–), сильнейшего нитрозилирующего агента динитрогентриоксида (азотистого ангидрида, N2O3) и мощного окислителя пероксинитрита (ONOO–). Пероксинитрит является основным промежуточным продуктом взаимодействия между молекулами NO и O2– [7, 16]. Анион пероксинитрата распадается с образованием нитрит-аниона (NO2–) и кислорода (O2), в то время как N2O3 может реагировать с тиоловыми группами, образуя нитрозотиолы, или с гидро–ксильным радикалом, образуя нитриты. Динитрогентриоксид также реагирует с пероксинитритом, образуя две молекулы диоксида азота и одну молекулу NO2–. Данная реакция происходит в естественных условиях, особенно тогда, когда NO образуется быстрее, чем супероксид анион-радикал. В связи с этим воспалительный процесс протекает с увеличением концентрации нитритов в организме. Пероксинитрит является сильным окислителем и может вступать в непосредственную реакцию с сульгидридными группами, цинк-тиоловыми кластерами. Он также взаимодействует с двуокисью углерода (CO2) и ионом водорода. Анион ONOO– реагирует с нуклеофилами, в частности с CO2, образуя переходный промежуточный нитрозопероксикарбонат, который быстро разлагается на диоксид азота (NO2) и сильный окислитель анион триоксида углерода (CO3−). Пероксинитрит взаимодействует и с ионами водорода. Это приводит к образованию пероксиазотистой кислоты (HOONO), которая быстро распадается на гидроксильный радикал и диоксид азота (рис. 2). Поскольку уровень концентрации CO2 почти в 10 000 раз выше, чем ионов водорода, в физиологических условиях преобладает формирование карбонатных радикалов перед образованием гидроксильных радикалов. Несмотря на то что действие карбонатного радикала, в отличие от гидроксильных радикалов, характеризуется выраженной селективностью, он является участником многих патофизиологических процессов [15].
/76.jpg)
Ни O2–, ни NO в физиологических условиях не проявляют особых цитотоксических свойств, так как они эффективно нейтрализуются антиоксидантной системой: O2– дисмутируется супероксиддисмутазами в перекись водорода, NO инактивируется оксигемоглобином, приводя к образованию метгемоглобина и NO3–. Однако если O2– и NO генерируются в непосредственной близости, то образуется пероксинитрит — каждое столкновение данных молекул без участия каких-либо катализаторов приводит к образованию пероксинитрита. Монооксид азота является единственной известной молекулой биологической системы, которая опережает супероксиддисмутазы в реакции O2–, поэтому образование пероксинитрита является неизбежным процессом. Скорость образования пероксинитрита в несколько раз превосходит скорость генерации супероксида анион-радикала и NO. Так, при воспалительном процессе количество O2– и NO увеличивается в 1000 раз, а пероксинитрита — в 1 000 000 раз [15]. Пероксинитрит может проникать внутрь клетки через анионные каналы клеточных мембран. Он является высокореактивным радикалом, который окисляет и нитрозилирует ароматические аминокислоты, липиды и ДНК. Пероксинитрит сравнительно медленно реагирует с биологическими молекулами [5]. Цитотоксические действия пероксинитрита многообразны. Он инициирует процессы перекисного окисления липидов, ингибирует активность митохондриальных ферментов дыхательной цепи, инактивирует глицеральдегид-3-фосфатдегидрогеназу, угнетает мембранные Na+/K+-АТФазы, подавляет мембранные натриевые каналы и др. Кроме того, пероксинитрит является мощным триггером процесса обрыва нити ДНК с последующей активацией ядерного фермента поли(АДФ-рибоза) полимеразы, гиперактивность которой может привести к некрозу клетки [19].
Активная генерация NO сопровождается S-нитрозилированием протеинов — ковалентной модификацией их цистеиновых остатков Точный механизм, с помощью которого происходит S-нитрозилирование в естественных условиях, до сих пор остается неизвестным. Основными нитрозилирующими агентами считают пероксиазотистую кислоту и N2O3. Результаты современных исследований представили доказательства, что процесс S-нитрозилирования, модифицирующий тиоловые группы цистеина, определяет большинство эффектов NO. В респираторном тракте человека в состоянии практического здоровья концентрация S-нитрозоглутатиона (GSNO) и S-нитрозотиольных белков колеблется в пределах 0,5–1,0 мкмоль. S-нитрозоглутатион является основным депо NO в организме человека и также выполняет другие физиологические функции. Так, GSNO усиливает биение ресничек реснитчатого эпителия и обладает бронходилатирующим цГМФ-независимым эффектом, который приблизительно вдвое превосходит действие теофиллина. В процессе восстановления GSNO принимает участие GSNO-редуктаза [8]. S-нитрозилирование оказывает влияние на экспрессию и активность большинства ионных хлоридных, в частности трансмембранного регуляторного белка муковисцидоза (cystic fibrosis transmembrane conductance regulator — CFTR), натриевых и кальциевых каналов клеток бронхолегочной системы. Показано, что NOS способны физически связываться с ионными каналами или со скаффолд-протеинами, которые способствуют локализации NOS в непосредственной близости каналов. Продукция NO вблизи ионных каналов обусловливает селективное S-нитрозилирование данных белковых структур. S-нитрозилирование модифицирует передачу сигналов с G-протеинсвязанных рецепторов (GPCR — G-protein-coupled receptor), рецептора тирозиновых киназ, а также процесс репарации ДНК [13, 18, 20].
Механизмы действия монооксида азота в респираторном тракте
Коэффициент диффузии азота в воде при 37 °C несколько больше, чем кислорода и углекислого газа, и идеально подходит для быстрой передачи информации на короткие расстояния. Молекула NO свободно проникает через клеточную мембрану и может многократно за считанные доли секунды диффундировать из клетки во внеклеточное пространство и обратно. Средняя скорость движения молекулы NO при комнатной температуре составляет примерно 400 метров в 1 секунду. Молекула NO в растворе производит около 10 000 000 000 столкновений в секунду. В связи с этим путь молекулы NO внутри клетки и в экстрацеллюлярном пространстве может быть очень сложным, а биологические эффекты — очень разнообразными [15]. В клетках организма NO может выполнять ряд функций: 1) активировать солютабную гуанилатциклазу (cГЦ); 2) инактивироваться, взаимодействуя с железом оксигемоглобина и с аминокислотным остатком Cys93 субъединицы B гемоглобина; 3) оказывать цитотоксическое действие.
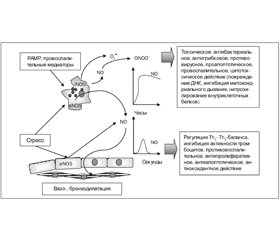
Спектр биологического действия NO зависит от уровня его концентрации. При низком уровне концентрации, которая сопровождает функционирование конститутивных эндотелиальных и нейронных изоформ NOS (еNOS и nNOS), NO оказывает цитопротекторное действие. В условиях высокой концентрации, возникающей при работе индуцибeльной изоформы нитрооксидсинтетазы (iNOS), NO оказывает цитотоксическое действие (рис. 3).
Высокая концентрация NO также оказывает антибактериальное, противовирусное, противогрибковое действие, способствует развитию воспалительного процесса, вызывает повреждение ДНК, ингибирует тканевое дыхание, способствует усилению апоптоза клеток, модулирует функциональную активность различных иммуноцитов [21, 22].
Низкая концентрация NO (5–10 нмоль) индуцирует активность циклической гуанилатциклазы (цГЦ), цитохрома Р450. Прямое взаимодействие NO• с ионом Fe цГЦ протекает быстрее, чем с любым другим известным гемопротеином. В результате активации цГЦ происходит увеличение внутриклеточной концентрации циклического 3’,5’-гуанилатмонофосфата (цГМФ), который индуцирует цГМФ-зависимую протеинкиназу (протеинкиназу G Iα — PKGIα), цГМФ-регулируемые фосфоди–эстеразы и активируемые циклическим нуклеотидом ионные каналы (CNG), действие которых обусловливает вазодилатационное, бронходилатационное, антипролиферативное, антиапоптотическое, иммунорегулирующее, антитромбоцитарное, антиоксидантное действие NO. Самая распространенная форма сГЦ (α1/β1), обеспечивающая бронходилатацию, высоко экспрессирована в гладкомышечных клетках респираторного тракта. Солютабная ГЦ и ГМФ-зависимая киназа I, экспрессированные в эпителиальных клетках респираторного тракта, участвуют в eNOS-ассоциированной регуляции функции ресничек [2, 6]. Участие в регуляции активности внутриклеточных сигнальных путей принимают N2O3 и пероксинитрит. Динитроген триоксид (N2O3) изменяет функциональность протеинов, вызывая S-нитрозилирование тиоловых групп их цистеиновых остатков, а пероксинитрит активирует MAPK (рис. 4) [12].
/78_2.jpg)
Протекторные эффекты NO представлены в табл. 1.
Список литературы
1. Бабак О.Я. Механизмы гепатопротекторного и токсического влияния азота оксида / О.Я. Бабак, Н.В. Ярмыш, Г.Ю. Панченко // Сучасна гастроентерологія. — 2006. — № 5 (31). — С. 76-84.
2. Козина О.В. Образование и биологическая роль NO при аллергическом воспалении / О.В. Козина, Л.М. Огородова // Бюллетень сибирской медицины. — 2009. — № 3. — C. 95-105.
3. Малышев И.Ю., Манухина Е.Б. Стресс, адаптация и оксид азота / И.Ю. Малышев, Е.Б. Манухина // Биохимия. — 1998. — № 7. — С. 992-1006.
4. Фрейдлин И.С. Регуляторные функции провоспалительных цитокинов и острофазных белков / И.С. Фрейдлин, П.Г. Назаров // Вест. РАМН. — 1999. — № 5. — C. 28-32.
5. Calcerrada P. Nitric oxide-derived oxidants with a focus on peroxynitrite: molecular targets, cellular responses and therapeutic implications / P. Calcerrada, G. Peluffo, R. Radi // Curr. Pharm. Des. — 2011. — Vol. 17, № 35. — P. 3905-3932. PMID: 21933142.
6. Coleman J.W. Nitric oxide in immunity and inflammation // Int. Immunopharmacol. — 2001. — Vol. 1. — P. 1397-1406. doi:10.1016/S1567-5769(01)00086-8.
7. Exner M. Kinetic and mechanistic studies of the peroxynitrite-mediated oxidation of oxymyoglobin and oxyhemoglobin / M. Exner, S. Herold // Chem. Res. Toxicol. — 2000. — Vol. 13, № 4. — P. 287-293. PMID: 10775329.
8. Foster M.W. Protein S-nitrosylation in health and disease: a current perspective / M.W. Foster, D.T. Hess, J.S. Stamler // Trends Mol. Med. — 2009. — Vol. 15, № 9. — P. 391-404. doi: 10.1016/j.molmed.2009.06.007.
9. Goodrum K.J. Cytokine Responses to Group B Streptococci Induce Nitric Oxide Production in Respiratory Epithelial Cells / K.J. Goodrum, J. Poulson-Dunlap // Infect Immun. — 2002. — 70 (1). — P. 49-54. doi: 10.1128/IAI.70.1.49-54.2002.
10. Guzik T.J. Nitric oxide and superoxide in inflammation and immune regulation / T.J. Guzik, R. Korbut, T. Adamek-Guzik // J. Physiol. Pharmacol. — 2003 — Vol. 54, № 4. — P. 469-487. PMID:14726604.
11. Hollenberg S.M. Bench-to-bedside review: nitric oxide in cri–tical illness-update 2008 / S.M. Hollenberg, I. Cinel // Crit. Care. — 2009. — Vol. 13, № 4. — P. 218. doi: 10.1186/cc7706.
12. S-nitrosylation in cardiovascular signaling / B. Lima, M.T. Forrester, D.T. Hess, J.S. Stamler // Circ. Res. — 2010. — Vol. 106, № 4. — P. 633-646. doi: 10.1161/CIRCRESAHA.109.207381.
13. S-Nitrosothiol Signaling in Respiratory / B.Gaston, D. Singel, A. Doctor, J.S. Stamler // Am. J. Respir. Crit. Care Med. — 2006. — Vol. 173, № 11. — P. 1186-1193. PMID: 16528016.
14. Oxidation of nitric oxide by oxomanganese-salen complexes: a new mechanism for cellular protection by superoxide dismutase/catalase mimetics / M.A. Sharpe, R. Ollosson, V.C. Stewart, J.B. Clark // Biochem. J. — 2002. — Vol. 366. — P. 97-107. PMID: 11994046.
15. Pacher P. Nitric oxide and peroxynitrite in health and di–sease / P. Pacher, J.S. Beckman, L. Liaudet // Physiol. Rev. — 2007. — Vol. 87, № 1. — P. 315-424. PMID: 17237348.
16. Peroxynitrite is the major species formed from different flux ratios of co-generated nitric oxide and superoxide: direct reaction with boronate-based fluorescent probe / J. Zielonka, A. Sikora, J. Joseph, B. Kalyanaraman // J. Biol. Chem. — 2010. — Vol. 285, № 19. — P. 14210-14216. doi: 10.1074/jbc.M110.110080.
17. Rao K.M.K. Molecular mechanisms regulating iNOS expression in various cell types // J. Toxicol. Environ. Health B Crit. Rev. — 2000. — 3 (1). — P. 27-58. doi: 10.1080/109374000281131.
18. Regulation of ion channel structure and function by reactive oxy–gen-nitrogen species / S. Matalon, K.M. Hardiman, L. Jain et al. // Am. J. Physiol. Lung. Cell Mol. Physiol. — 2003. — Vol. 285. — P. 1184-1189. PMID: 14604848.
19. Szabó C. Pathophysiological roles of peroxynitrite in circulatory shock / C. Szabó, K. Módis // Shock. — 2010. — Vol. 34, –Suppl. 1. — P. 4-14. doi: 10.1097/SHK.0b013e3181e7e9ba.
20. Tang C.H. Regulation of DNA repair by S-nitrosylation / C.H. Tang, W. Wei, L. Liu // Biochim. Biophys Acta. — 2012. — Vol. 1820, № 6. — P. 730-735. doi: 10.1016/j.bbagen.2011.04.014.
21. The role of nitric oxide in inflammatory reactions / P. Tripathi, P. Tripathi, L. Kashyap, V. Singh // FEMS Immunol. Med. Microbiol. — 2007. — Vol. 51, № 3. — P. 443-452. PMID: 17903207.
22. Tripathi P. Nitric oxide and immune response // Indian. J. Biochem. Biophys. — 2007. — Vol. 44, № 5. — P. 310-319. PMID: 18341206.
1. Babak O.YA. Mekhanizmy gepatoprotektornogo i toksicheskogo vliyaniya azota oksida / Babak O.YA., YArmysh N.V., Panchenko G.YU. // Suchasna gastroenterologіya. – 2006. - № 5 (31). – S. 76-84.
2. Kozina O.V. Obrazovanie i biologicheskaya rol' NO pri allergicheskom vospalenii / O.V. Kozina, L.M. Ogorodova // Byulleten' sibirskoj mediciny. – 2009. - № 3. – C. 95 – 105.
3. Malyshev I.YU., Manuhina E.B. Stress, adaptaciya i oksid azota / I.YU. Malyshev, E.B. Manuhina // Biohimiya. - 1998.- № 7.- S. 992-1006.
4. Frejdlin I.S. Regulyatornye funkcii provospalitel'nyh citokinov i ostrofaznyh belkov / I.S. Frejdlin, P.G. Nazarov // Vest. RAMN. - 1999. - N5. - C. 28-32.
5. Calcerrada P, Peluffo G, Radi R. Nitric oxide-derived oxidants with a focus on peroxynitrite: molecular targets, cellular responses and therapeutic implications. Curr Pharm Des. 2011 Dec;17(35):3905-32. PMID: 21933142.
6. Coleman JW. Nitric oxide in immunity and inflammation. Int Immunopharmacol. 2001 Aug;1(8):1397-406. PMID: 11515807.
7. Exner M, Herold S. Kinetic and mechanistic studies of the peroxynitrite-mediated oxidation of oxymyoglobin and oxyhemoglobin. Chem Res Toxicol. 2000 Apr;13(4):287-93. PMID: 10775329.
8. Foster MW, Hess DT, Stamler JS. Protein S-nitrosylation in health and disease: a current perspective. Trends Mol Med. 2009 Sep;15(9):391-404. doi: 10.1016/j.molmed.2009.06.007. Epub 2009 Aug 31.
9. Goodrum KJ, Poulson-Dunlap J. Cytokine responses to group B streptococci induce nitric oxide production in respiratory epithelial cells. Infect Immun. 2002 Jan;70(1):49-54.doi: 10.1128/IAI.70.1.49-54.2002.
10. Guzik TJ, Korbut R, Adamek-Guzik T. Nitric oxide and superoxide in inflammation and immune regulation. J Physiol Pharmacol. 2003 Dec;54(4):469-87. PMID:14726604.
11. Hollenberg SM, Cinel I. Bench-to-bedside review: nitric oxide in critical illness--update 2008.Crit Care. 2009;13(4):218. doi: 10.1186/cc7706. Epub 2009 Jul 16.
12. Lima B, Forrester MT, Hess DT, Stamler JS. S-nitrosylation in cardiovascular signaling. Circ Res. 2010 Mar 5;106(4):633-46. doi: 10.1161/CIRCRESAHA.109.207381.
13. Gaston B, Singel D, Doctor A, Stamler JS. S-nitrosothiol signaling in respiratory biology.Am J Respir Crit Care Med. 2006 Jun 1;173(11):1186-93. Epub 2006 Mar 9. PMID:16528016.
14. Sharpe MA, Ollosson R, Stewart VC, Clark JB. Oxidation of nitric oxide by oxomanganese-salen complexes: a new mechanism for cellular protection by superoxide dismutase/catalase mimetics. Biochem J. 2002 Aug 15;366(Pt 1):97-107. PMID:11994046.
15. Pacher P, Beckman JS, Liaudet L. Nitric oxide and peroxynitrite in health and disease. Physiol Rev. 2007 Jan;87(1):315-424. PMID: 17237348.
16. Zielonka J, Sikora A, Joseph J, Kalyanaraman B. Peroxynitrite is the major species formed from different flux ratios of co-generated nitric oxide and superoxide:direct reaction with boronate-based fluorescent probe. J Biol Chem. 2010 May 7;285(19):14210-6. doi: 10.1074/jbc.M110.110080. Epub 2010 Mar 1.
17. Rao KM. Molecular mechanisms regulating iNOS expression in various cell types. J Toxicol Environ Health B Crit Rev. 2000 Jan-Mar;3(1):27-58. doi: 10.1080/109374000281131.
18. Matalon S, Hardiman KM, Jain L, Eaton DC, Kotlikoff M, Eu JP, Sun J, Meissner G, Stamler JS. Regulation of ion channel structure and function by reactive oxygen-nitrogen species. Am J Physiol Lung Cell Mol Physiol. 2003 Dec;285(6):L1184-9. PMID:14604848.
19. Szabó C, Módis K. Pathophysiological roles of peroxynitrite in circulatory shock. Shock. 2010 Sep;34 Suppl 1:4-14. doi: 10.1097/SHK.0b013e3181e7e9ba.
20. Tang CH, Wei W, Liu L. Regulation of DNA repair by S-nitrosylation. Biochim Biophys Acta. 2012 Jun;1820(6):730-5. doi: 10.1016/j.bbagen.2011.04.014. Epub 2011 May 5.
21. Tripathi P1, Tripathi P, Kashyap L, Singh V. The role of nitric oxide in inflammatory reactions. FEMS Immunol Med Microbiol. 2007 Dec;51(3):443-52. Epub 2007 Sep 27. PMID:17903207.
22. Tripathi P. Nitric oxide and immune response. Indian J Biochem Biophys. 2007 Oct;44(5):310-9. PMID:18341206.
/78_2.jpg)

/76.jpg)
/77.jpg)
/78.jpg)