Статья опубликована на с. 112-120
Хроническая ишемия мозга (ХИМ) — одна из наиболее распространенных форм цереброваскулярной патологии [1]. Сосудистые заболевания головного мозга относятся к числу основных причин смертности и стойкой утраты трудоспособности. Это диктует необходимость разработки оптимальной фармакологической коррекции, направленной на профилактику инсультов и ограничение прогрессирования хронических сосудистых заболеваний мозга [2]. Патогенез хронической гипоперфузии мозга связывают с артериальной гипертензией, атеросклерозом экстра- и интрацеребральных сосудов, микроангиопатией мелких пенетрирующих мозговых артерий, заболеваниями сердца, сахарным диабетом, метаболическим синдромом и др. Считается, что лечение пациентов с ХИМ должно учитывать этиологию заболевания сосудов, основные патогенетические механизмы и клиническую симптоматику, которая приводит к ухудшению качества жизни пациентов и их ближайших родственников [3]. Традиционно основными направлениями лечения при ХИМ являются: а) гипотензивная, гиполипидемическая терапия; б) восстановление кровоснабжения мозга; в) поддержание метаболизма головного мозга; г) устранение неврологических симптомов и синдромов; д) коррекция когнитивных и эмоционально-аффективных нарушений; е) антиагрегантная терапия. Тем не менее до настоящего времени не унифицирован перечень лекарственных средств, рекомендуемых при ХИМ; остается необоснованным выбор препаратов, обладающих сходным фармакологическим эффектом, но отличающихся механизмом действия; не доказано оптимальное сочетание лекарственных препаратов, как воздействующих на разные клетки-мишени, так и обеспечивающих достижение одного эффекта, но посредством разных механизмов действия; не доказана эффективность применяемых комбинаций лекарственных средств; не установлено, изменяется ли спектр фармакологических препаратов при прогрессировании цереброваскулярной патологии. Сложившаяся ситуация порождает массу проблем, связанных с формированием стандарта лечения и рациональным лекарственным обеспечением больных с ХИМ.
Не менее актуальной представляется задача прогнозирования развития побочных эффектов рекомендуемой фармакотерапии. В этом отношении перспективным представляется исследование in vitro тромбоцитов и лейкоцитов, которые не только являются мишенями для лекарственных средств, поступающих в кровь, но и принимают участие в развитии тромбогенеза и аутоиммунного воспаления. Более того, взаимодействие эндотелия и тромбоцитов регулирует скорость микроциркуляции и проницаемость гематоэнцефалического барьера. Если в результате комплексного лечения пациентов с ХИМ будет достигнуто снижение функциональной активности тромбоцитов (состояние гипореактивности тромбоцитов), то: а) возможно поддержание оптимальной перфузии мозга и транспорта лекарственных средств в нервную ткань; б) уменьшается риск тромбогенеза, а значит и прогрессирования ХИМ.
Цель исследования: изучить влияние медикаментозного лечения на агрегацию тромбоцитов у пациентов с ХИМ (дисциркуляторной энцефалопатией 1-й степени атеросклеротического генеза).
Материал и методы
В исследование включены 17 пациентов с диагнозом «дисциркуляторная энцефалопатия 1-й степени» (ДЭП-1), из них 3 мужчин и 14 женщин в возрасте от 37 до 65 лет (средний возраст — 53,0 ± 1,6 года), которые находились на стационарном лечении в неврологическом отделении. Больным, кроме стандартного клинического обследования, проводилось исследование липидограммы, коагулограммы, электрокардиограммы, эхокардиограммы, электроэнцефалограммы, дуплексное сканирование магистральных сосудов головы, магнитно-резонансная томография головного мозга. Анализ когнитивных функций проводился по шкале MMSE (Mini-Mental State Examination). Ведущими жалобами у больных были головная боль, головокружение, снижение памяти, повышенная раздражительность, расстройство сна. В зависимости от выявленных расстройств и жалоб, а также данных клинико-лабораторных исследований назначалась медикаментозная терапия. Традиционно препараты нейропротекторного действия условно разделяют на четыре группы [9].
1. Психостимуляторы — средства, применяемые при синдроме нарушения внимания и гиперактивности (ADHD), и ноотропные средства. В исследовании данная группа была представлена холинергическими средствами, антагонистами NMDA-рецепторов и пирацетамом.
2. Препараты, оказывающие нейротрофическое действие. В схеме лечения пациентов использовались гидролизаты и дериваты тканей мозга; витамины группы В; субстанции, улучшающие энергетический и тканевой метаболизм, антиоксиданты.
3. Препараты для симптоматического лечения. Использовались допаминергические средства; блокаторы обратного захвата серотонина; мелатонинергический агонист MT1- и MT2-рецепторов и антагонист 5-HT2c-рецепторов.
4. Вазоактивные препараты. Данная группа представлена периферическими вазодилататорами, ангиопротекторами, антагонистами кальция, никотиновой кислотой и ее производными, производными пурина; прочими периферическими вазодилататорами.
Препараты, рекомендованные для лечения сердечно-сосудистых заболеваний, в том числе и у пациентов с ДЭП-1, можно разделить на пять групп.
1. Гипотензивные препараты. Для лечения назначались ингибиторы ангиотензинпревращающего фермента (АПФ), антагонисты к ангиотензину II, селективные блокаторы β-адренорецепторов.
2. Мочегонные препараты. Применялись высокоактивные диуретики (простые препараты сульфамидов) и калийсберегающие диуретики.
3. Кардиологические препараты — средства, действующие на коронарные сосуды, и антиаритмические препараты III класса — у данного контингента больных не использовались ввиду отсутствия показаний.
4. Антитромботические средства. Применялась ацетилсалициловая кислота.
5. Гиполипидемические средства. Назначались ингибиторы ГМГ-КоА-редуктаз.
Спектр использованных лекарственных средств анализировался посредством ретроспективного исследования.
Изучение функционального состояния тромбоцитов больных проводилось через 24 ч после начала медикаментозной терапии и повторно через 8–14 суток на момент завершения лечения и выписки из стационара. Тромбоциты выделяли из периферической крови путем центрифугирования. Для стимуляции тромбоцитов in vitro использовали аденозиндифосфат (АДФ, 5 мкМ), адреналин (5 мкМ), фактор активации тромбоцитов (ФАТ, 150 мкМ) в эффективной концентрации, вызывающей у здоровых лиц 50 ± 5% агрегацию тромбоцитов (ЕС50). Исследование агрегации тромбоцитов проводили на агрегометре фирмы Chrono-Log (США); содержание тромбоцитов в пробе составляло 200 000 ± 20 000/мкл. Наличие антиагрегантного эффекта констатировалось, если агрегация тромбоцитов (АТц) при воздействии ЕС50 основных агонистов была менее 45 %. Все клинические исследования выполнены по согласованию с комиссией по биоэтике Донецкого национального медицинского университета им. М. Горького. Статистическую обработку осуществляли с помощью пакета Medstat.
Результаты
Из 17 пациентов с ДЭП-1 препараты 1-й группы назначались 13 (76,5 %) больным; 2-й группы — всем пациентам (100 %), 3-й группы — 8 (47,1 %) и 4-й группы — 7 (41,2 %) больным. Представляет интерес частотная характеристика количества препаратов, назначаемых пациентам с ДЭП-1. Большинство пациентов (9 больных; 52,9 %) получали 3–4 препарата; 3 (17,6 %) пациента получали 5–6, а 1 (5,9 %) пациент — 7 лекарственных средств; и только 4 пациента получали 1–2 препарата. В случае назначения лекарственных средств 1-й группы из возможных пяти подгрупп использовались: пирацетам — у 9 (52,9 %) пациентов, холинергические средства — у 3 (17,6 %), антагонисты NMDA-рецепторов — у 1 (5,9 %) больного. Что касается 2-й группы лекарственных средств, то у 5 (29,4 %) пациентов использовались препараты из всех трех подгрупп, оказывающих нейротрофическое действие, то есть гидролизаты или дериваты тканей мозга, витамины группы В, субстанции, улучшающие энергетический и тканевой метаболизм. В 3 (17,6 %) случаях назначалась комбинация витаминов В и субстанций, улучшающих метаболизм, и у 9 пациентов (53 %) использовался только один препарат из этой группы. Наиболее востребованным препаратом оказались витамины группы В, которые назначались 11 (64,7 %) пациентам. Необходимо отметить, что 9 (52,9 %) пациентам назначались антиоксиданты. Распределение препаратов из 3-й группы было следующим: средства, применяемые при вестибулярных нарушениях, — 4 пациента (23,5 %), блокаторы обратного захвата серотонина — 3 (17,6 %) и агонисты допаминовых рецепторов — 1 (5,9 %) пациент. Назначение препаратов этой группы представляет интерес и в связи с возможным ингибирующим воздействием на функциональную активность тромбоцитов, поскольку блокаторы обратного захвата серотонина могут влиять на функциональную активность тромбоцитов. Из 4-й группы использовались два препарата, и оба могут модулировать функцию клеток крови. Это –α1-адреноблокатор (2 пациента), способный потенцировать эффект аспирина и антикоагулянтов, и эсцин (5 пациентов), вызывающий снижение активности лизосомальных гидролаз. Последний препарат, вероятно, может модулировать функцию лейкоцитов и формирование тромбоцитарно-лейкоцитарных агрегатов. Обращает на себя внимание, что препараты, обеспечивающие улучшение перфузии головного мозга (4-я группа), использовались значительно реже, чем лекарственные средства, оказывающие нейротрофическое действие (2-я группа), то есть имеет место некий диссонанс между стремлением восстановить регионарную гемодинамику и желанием поддержать метаболизм нервной ткани. Необходимо подчеркнуть, что у 12 (70,6 %) пациентов с симптоматикой шейного-грудного спондилоартроза использовались нестероидные противовоспалительные препараты, которые способны ингибировать циклооксигеназу не только лейкоцитов, но и тромбоцитов; тем самым блокируется синтез тромбоксана А2 и воспроизводится антиагрегантный эффект.
Таким образом, при назначении лекарственных средств, обладающих нейропротекторным действием, у больных с ДЭП-1 можно ожидать изолированный модулирующий эффект на тромбоциты у 5 (29,4 %) пациентов (эффекты блокаторов обратного захвата серотонина, α1-адреноблокатора) и на лейкоциты — у 5 (29,4 %) пациентов (эффект эсцина). Кроме этого, возможно одновременное ингибирующее воздействие на тромбоциты и лейкоциты антиоксидантов (9 больных) и нестероидных противовоспалительных препаратов (12 больных).
Только у 8 (47,1 %) пациентов с ДЭП-1 была диагностирована патология сердечно-сосудистой системы, которая требовала медикаментозной коррекции; у 9 (52,9 %) больных препараты 5–9-й групп не использовались. Из 8 пациентов препараты 5-й и 6-й групп назначались 5 больным (62,5 %), 7-й группы — не применялись, 8-й группы — 4 (50 %) и 9-й группы — 7 (87,5 %) больным. Представляет интерес частотная характеристика распределения количества препаратов, которые назначались пациентам с ДЭП-1. Большинство пациентов (4 больных; 50 %) получали 5–6 препаратов; 1 (12,5 %) пациент — 3 препарата, и 3 (37,5 %) пациента — 1–2 лекарственных средства. При назначении препаратов 5-й группы из возможных пяти подгрупп использовались: ингибиторы АПФ — у 4 (50 %) пациентов, антагонисты АТ1-рецептора к ангиотензину (Ан II) — у 1 (12,5 %) и блокаторы β-адренорецепторов — у 4 (50 %) больных. Поскольку ограничение синтеза ангиотензина II или блокада рецепторов к ангиотензину II могут проявляться воздействием не только на таргетные клетки (гладкомышечные клетки сосудов), но и на тромбоциты, имеющие соответствующие рецепторы, то у 5 пациентов возможна модуляция функциональной активности тромбоцитов. Из мочегонных препаратов (6-я группа) преимущественно назначались высокоактивные диуретики (4 пациента) и в 1 случае — антагонист альдостерона. Препараты 6-й группы использовались в комбинации с препаратами 5-й группы для достижения быстрого гипотензивного эффекта. Что касается 8-й группы лекарственных средств, то только у 4 (50 %) пациентов использовались антиагреганты (ацетилсалициловая кислота), то есть препараты, основной мишенью которых являются тромбоциты. Гиполипидемические средства (9-я группа, ингибиторы ГМГ-КоА-редуктаз) назначались 7 (87,5 %) пациентам с атеросклерозом, причем допускается возможность воспроизведения антиагрегантного эффекта. Таким образом, при назначении лекарственных средств, воздействующих на сердечно-сосудистую систему, возможно снижение функциональной активности тромбоцитов под влиянием ацетилсалициловой кислоты и нестероидных противовоспалительных препаратов, ингибиторов ангиотензинпревращающего фермента и антагонистов АТ1-рецептора к ангиотензину, а также статинов.
Приведенный анализ использования спектра лекарственных средств у пациентов с ДЭП-1 позволяет предположить достижение надежного антиагрегантного эффекта. С целью проверки данной гипотезы проведено исследование функциональной активности тромбоцитов.
Вначале следовало ответить на ключевой исследовательский вопрос: повлияла ли медикаментозная терапия на агрегационную активность тромбоцитов?
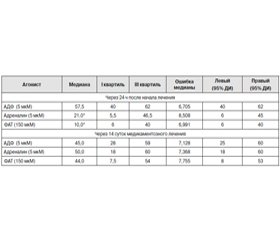
Установлено, что через 8–14 суток медикаментозного лечения наблюдалась нормальная реактивность тромбоцитов по отношению к трем основным агонистам — АДФ, адреналину и ФАТ (табл. 1).
/115.jpg)
Межгрупповая разница АТц статистически значимо не различалась (р > 0,05). Наличие статистически значимой корреляционной связи между АТц, стимулированной АДФ и адреналином (r = 0,433), АДФ и ФАТ (r = 0,636), а также адреналином и ФАТ (r = 0,552), свидетельствует, что причины данного феномена связаны с сопоставимой эффективностью функционирования соответствующих рецепторов тромбоцитов и ассоциированных внутриклеточных сигнальных систем. Если сравнить величины АТц в начале и конце лечения, то обнаруживается разнонаправленная динамика показателей. Так, АДФ-индуцированная АТц снижалась на 21,7 % (р = 0,339), тогда как реактивность тромбоцитов в отношении адреналина и ФАТ повышалась, разница также не являлась статистически значимой (р = 0,389 и р = 0,464 соответственно). Казалось бы, достигнутый результат — нормореактивность тромбоцитов — с точки зрения эффективности антиагрегантной терапии нельзя признать значимым, тем более что имеется тенденция к повышению реактивности тромбоцитов на адреналин и ФАТ, а у нескольких пациентов максимальные показатели агрегации тромбоцитов находились в диапазоне от 68 до 100 %.
Возникает вопрос: отличается ли функциональная активность тромбоцитов у пациентов, если в комплексной терапии отсутствуют ацетилсалициловая кислота или нестероидные противовоспалительные средства?
По данному критерию можно выделить две подгруппы: в подгруппе А у 5 пациентов в списке использованных лекарственных средств отсутствовала ацетилсалициловая кислота или нестероидный противовоспалительный препарат, в подгруппе Б у 12 пациентов эти лекарственные средства присутствовали в схеме лечения. При исследовании АДФ-индуцированной АТц в подгруппе А эта величина составила 60,0 ± 7,5 % (95% доверительный интервал (ДИ) 45–80 %), в подгруппе Б — 28,0 ± 8,0 % (95% ДИ 18–59 %). Отсутствие статистически значимой разницы показателей (р = 0,060) связано как с недостаточным количеством наблюдений, так и с множеством вмешивающихся факторов (различных комбинаций лекарственных средств, индивидуальной реактивности организма). Тем не менее тенденция очевидна — наличие в составе комплексной терапии ацетилсалициловой кислоты или нестероидного противовоспалительного средства обеспечивает более выраженный антиагрегантный эффект.
Для дальнейшего анализа функционального статуса тромбоцитов следовало ответить на вопросы: как изменяется индивидуальная реакция тромбоцитов на агонисты к моменту завершения лечения? Снижается ли реакция тромбоцитов на агонисты к моменту завершения лечения у всех обследованных пациентов?
При использовании АДФ у 11 (64,7 %) пациентов отмечено повышение АТц к концу лечения по сравнению со значениями начала лечения, и только у 6 (35,3 %) имело место снижение величины показателей. При изучении АТц, индуцированной адреналином, у 10 (58,8 %) больных выявлено повышение показателя к концу лечения, у 2 (11,8 %) реакция не изменилась, у 5 (29,4 %) больных отмечено снижение агрегации. В случае ФАТ-индуцированной агрегации у 8 (47,1 %) пациентов зарегистрировано повышение, у 2 (11,8 %) агрегация тромбоцитов не изменилась, в 7 (41,1 %) случаях выявлено снижение проагрегантной активности тромбоцитов. Таким образом, отсутствует закономерность в изменении реакции тромбоцитов на разные агонисты. С учетом полученных данных результаты оценки АТц в процессе лечения могут быть представлены под другим углом зрения. Так, анализ АДФ-индуцированной агрегации показал, что у большей части пациентов (11 человек) выявлено повышение АТц на 33,3 % (с 45,0 ± 7,1 % до 60,0 ± 3,5 %; р = 0,002). Причем если сопоставить данные АТц в I и III квартиле в начале лечения, соответственно 40 и 62 %, и в конце лечения — 59 и 65 %, то очевидно, что различия агрегации в большей степени проявляются у пациентов с исходной гипореактивностью тромбоцитов. Можно предположить, что у пациентов с гипореактивностью тромбоцитов, достигнутой достаточно быстро (в течение 24 ч лечения), в последующем возможно восстановление их реактивности. У 6 больных отмечено снижение АТц на 56,6 % к концу лечения (с 61,0 ± 10,1 % до 26,5 ± 4,2 %; р = 0,031; 95% ДИ 12–35 %). По сути, воспроизводится надежный антиагрегантный эффект. Интересными представляются результаты межквартильного анализа у этих пациентов: в начале лечения в I и III квартилях АТц 58 и 66 % соответственно, в конце лечения — 18 и 28 % соответственно. Складывается впечатление, что антиагрегантный эффект лечения воспроизводится у пациентов с исходной гиперреактивностью тромбоцитов, которая не подверглась коррекции в начале лечения.
При использовании адреналина в качестве агониста индукции агрегации тромбоцитов у большинства пациентов (10 человек) к концу лечения выявлено повышение АТц в 4,9 раза (с 12,0 ± 6,0 % до 59,0 ± 4,0 %; р = 0,002), что может рассматриваться как фактор риска нарушения микроциркуляции при активации симпатоадреналовой системы. Данные АТц в I и III квартиле, отмеченные в начале лечения — соответственно 5 и 22 % и при выписке из стационара — соответственно 54 и 68 %, свидетельствуют, что повышение функциональной активности тромбоцитов касалось пациентов с исходной гипоадренореактивностью. У 5 пациентов к концу лечения отмечен противоположный эффект — снижение в 2,9 раза (р = 0,063) АТц, индуцированной адреналином, с 53,0 ± 12,0 % до 18,0 ± 5,2 % (95% ДИ 10–32 %), то есть достигался защитный эффект относительно действия адреналина. Судя по данным АТц в I и III квартилях в начале (соответственно 48 и 65 %) и в конце лечения (соответственно 11 и 25 %), антиагрегантный эффект лечения воспроизводится у пациентов с исходной нормо- и гиперреактивностью тромбоцитов.
Представляют интерес и результаты исследования ФАТ-индуцированной АТц, поскольку ФАТ секретируется лейкоцитами и традиционно рассматривается как индуктор формирования тромбоцитарно-лейкоцитарных агрегатов при развитии воспаления. Установлено, что к концу лечения примерно одинаковое количество пациентов демонстрировали противоположные эффекты, то есть повышение или снижение АТц. Так, у 8 пациентов агрегация тромбоцитов, стимулированная ФАТ, повышалась в 6,6 раза (р = 0,004) — с 8,0 ± 1,0 % до 53,0 ± 3,6 % (95% ДИ 48–65 %); вполне вероятно, что у этих пациентов активированные лейкоциты при наличии воспаления любой этиологии могут являться патогенетическим фактором нарушения микроциркуляции мозга. Данные I и III квартилей в начале лечения (соответственно 6 и 10 %) и к концу лечения (соответственно 48 и 65 %) свидетельствуют, что эта группа пациентов характеризуется исходной гипореактивностью тромбоцитов. Является ли это следствием воздействия препаратов, и если да, то каких, или это проявление индивидуальной реактивности организма — еще предстоит уточнить. Можно предположить, что наличие воспаления у пациентов с ДЭП-1 будет ограничивать эффективность комплексного лечения. У 7 пациентов на момент выписки из стационара ФАТ-индуцированная АТц была в 8,3 раза (р = 0,016) меньше, чем в начале лечения, — соответственно 58,0 ± 9,0 % и 7,0 ± 2,8 %, тем самым стимуляция тромбоцитов лейкоцитами нивелировалась в процессе лечения. На момент начала лечения АТц в I и III квартилях достигала соответственно 22 и 60 %, а к моменту завершения лечения — соответственно 3 и 15 %. Достигнутая десенситизация ФАТ-рецепторов тромбоцитов у данной группы больных будет препятствовать взаимодействию тромбоцитов и лейкоцитов в случае развития или поддержания воспаления. Необходимо, однако, отметить, что сохранение критической сенситивности нескольких видов рецепторов к агонистам (например, АДФ, адреналину или ФАТ) может инициировать взаимодействие разных звеньев внутриклеточных сигнальных систем тромбоцитов и тем самым модулировать их функциональную активность. Данная гипотеза обосновывает необходимость использования нескольких агонистов, прежде всего АДФ, адреналина и ФАТ, для исследования реактивности тромбоцитов при хронической ишемии мозга.
Обсуждение
Полученные результаты высветили круг вопросов, которые требуют предметного обсуждения. Следует признать, что использование большого количества различных лекарственных средств, входящих в состав стандартной медикаментозной терапии, не гарантирует прекращения прогрессирования ХИМ, в противном случае у пациентов с ХИМ не продолжали бы развиваться когнитивные нарушения и различные неврологические синдромы, характерные для дисциркуляторной энцефалопатии 2–3-й степени тяжести (когда в головном мозге появляются множественные инфаркты мозга, включая прогрессирующий лейкоареоз). Более того, имеющая место полипрагмазия отражает отсутствие понимания конкретных таргетных механизмов, ответственных за развитие патологических процессов в мозге. Для большинства рекомендованных препаратов нет конкретной доказательной базы, подтверждающей механизм действия на нейроны и глию, а основным критерием эффективности лечения является оценка восстановления когнитивных функций с использованием различных шкал, что само по себе косвенно отражает пластичность нейронной сети головного мозга. Исключением в этом отношении является исследование [4], в котором предприняли попытку выяснить возможные механизмы действия церебролизина, анализируя его эффекты in vitro на культуре клеток, а также на экспериментальных моделях острых и хронических неврологических расстройств. Данный нейропептид продолжает оставаться в центре внимания неврологов, поскольку полагают, что церебролизин имитирует действие эндогенных нейротрофических факторов. Полученные результаты настолько интересны с точки зрения расширения знаний о возможностях данного препарата, что заслуживают более подробного обсуждения. Оказалось, что: а) при моделировании деменции церебролизин снижает отложение β-амилоида и фосфорилирование τ-белка микротрубочек путем регулирования активности гликогенсинтазы киназы-3β и циклинзависимой киназы-5, при этом увеличивается плотность межнейронных синапсов и восстанавливается цитоархитектоника нейронов. Авторы предполагают, что данные механизмы защищают целостность нейронных сетей и, следовательно, могут привести к улучшению когнитивных и поведенческих характеристик; б) церебролизин повышает нейрогенез в зубчатой извилине — зоне, являющейся источником для нейронзаместительной терапии при нейродегенеративных заболеваниях мозга; в) экспериментальные исследования на моделях инсульта показали, что церебролизин стабилизирует структурную целостность клеток мозга путем ингибирования кальпаина, тем самым уменьшается количество нейронов, находящихся в состоянии апоптоза после ишемического повреждения. При этом индуцировался нейрогенез в субвентрикулярной зоне и создавалась возможность самовосстановления мозга после инсульта.
Большинство же отечественных и зарубежных клинических исследований по оценке эффективности того или иного препарата выстраивается по единой схеме: в основной группе изучается действие препарата, который вводят на фоне базисной терапии, в контрольной группе лечение включает только базисную терапию. Учитывая индивидуальную реактивность организма, возможность взаимодействия лекарственных средств in vivo и рикошетный эффект на клетки крови, которые проиллюстрированы в данной работе, порой сложно отказаться от скептицизма в оценке полученных результатов. В последние годы отмечается стремление исправить данную ситуацию, для чего предлагается использовать показатели/индикаторы, объективно отражающие структуру — метаболизм — физиологию мозга. Так, [5] исследовали спонтанную агрегацию тромбоцитов и уровень экспрессии CD62P на поверхности тромбоцитов у пациентов с хронической ишемией мозга ишемического инсульта для оценки эффекта блокаторов рецепторов ангиотензина II. Вывод авторов, что стандартные дозы лозартана демонстрируют антитромботической эффект, может быть расширен до понимания того, что ангиотензин вовлечен в патогенез нарушения мозгового кровообращения. Подтверждение этой мысли можно найти в исследовании [6], в котором попытались ответить на вопрос, влияет ли ангиотензин II на состояние гематоэнцефалического барьера (ГЭБ). Введение данного олигопептидного гормона экспериментальным мышам в течение двух недель позволило выявить не только увеличение проницаемости ГЭБ, но и высокую плотность адгезии тромбоцитарно-лейкоцитарных агрегатов к стенке мозговых венул. Может возникнуть вопрос: а имеется ли связь между ангиотензином II — проницаемостью ГЭБ и когнитивными нарушениями? В литературе растет число доказательств, что ренин-ангиотензиновая система (РАС) участвует в патогенезе когнитивных нарушений. Последние исследования [7] обнаружили значительную утечку из микрососудов головного мозга и нарушение когнитивных функций у мышей при повышении уровня ангиотензина II в мозге. Указанные изменения отсутствовали у мышей с генетическим дефицитом рецептора AT-1a (–/–). Введение блокатора рецептора к ангиотензину II (олмесартана) не изменяло кровяное давление, но заметно ослабляло утечку веществ из сосудов микроциркуляторного русла мозга и способствовало восстановлению когнитивных функций у животных. Эти данные подтверждают гипотезу, что ингибирование РАC ослабляет когнитивные нарушения, уменьшая повреждение ГЭБ. Тем самым представляется оправданным включение ингибиторов АПФ или блокаторов рецепторов к ангиотензину II у пациентов с ХИМ.
А.В. Анисимова и соавт. [8] предприняли попытку обосновать терапевтическую эффективность назначения церебролизина у 300 пациентов с дисциркуляторной энцефалопатией I и II стадий на основании изучения динамики показателей агрегации тромбоцитов и эритроцитов, их деформируемости и компьютерно-морфоденситометрических свойств. Показано, что на фоне общего положительного влияния церебролизина на клиническую картину заболевания происходит улучшение гемореологических показателей. Это позволило предположить наличие дополнительных механизмов действия церебролизина — антиагрегантного, антигипоксического и мембранотропного. Вполне логичным представляется желание данных исследователей изучить состояние микроциркуляции на фоне лечения пациентов с острым ишемическим инсультом [9]. Использование лазерной допплеровской флоуметрии продемонстрировало, что после проведения тромболитической терапии отмечается активация притока крови в микроциркуляторное русло с усилением (?) миогенной активности артериол и преимущественно нутритивным режимом микрогемоциркуляции. Попытку доказательства влияния актовегина на миогенный тонус артериол предпринимали [10], что было продиктовано желанием оптимизировать консервативное лечение пациентов с хроническим облитерирующим заболеванием артерий нижних конечностей. Состояние микроциркуляции до и после курса инфузионной терапии оценивали с помощью лазерной допплеровской флоуметрии. Курс инфузионной терапии, включающий актовегин, сопровождался увеличением амплитуды миогенной флуктуации, тенденцией к снижению индекса шунтирующего кровотока, а также увеличением максимального уровня перфузии. Цитируемые исследования свидетельствуют об изменении микроциркуляции мозга при введении разных нейропротекторов. Дискуссионным представляется желание повысить микроциркуляцию путем повышения капиллярно-гидростатического давления, если имеет место увеличение проницаемости эндотелия. Может быть, более перспективно ориентироваться на необходимость восстановления функции ГЭБ? Реально ли достигнуть такой эффект при медикаментозном лечении ХИМ; как осуществляется регуляции ГЭБ при цереброваскулярных заболеваниях и какой показатель позволял бы мониторить состояние эндотелия стенки сосудов? Вполне вероятна возможность ограничения проницаемости ГЭБ при медикаментозном лечении, однако какие препараты или их комбинации оказываются действенными, как долго сохраняется эффект лечения — остается неизвестным. Что же касается механизмов, контролирующих ГЭБ, то таковые вполне могут воспроизводиться при взаимодействии эндотелия, тромбоцитов и лейкоцитов. В этом контексте тромбоциты являются многообещающим предметом изучения как патогенеза, так и эффективности лечения ХИМ. Аргументы в поддержку данной концепции таковы.
Во-первых, проведение исследования in vitro на тромбоцитах, выделенных из периферической крови больных, позволяет оценивать сенситивность рецепторов в динамике лечения, в частности, 5НТ2-серотониновых рецепторов, АТ1-рецепторов к ангиотензину II, пуриновых Р2Y12- и P2Y1-рецепторов, рецепторов к метаболитам арахидоновой кислоты, α2-адренорецепторов, которые представлены на разных клетках, в том числе и на эндотелии сосудов. В связи с этим открывается возможность анализа основных этиологических факторов ХИМ в прогрессировании заболевания.
Во-вторых, реактивность тромбоцитов является информативным индикатором, воспроизводящим механизм действия и выраженность эффекта препарата. Очевидно, что функциональная активность тромбоцитов будет зависеть от воздействия вводимых лекарственных средств на метаболизм и работу внутриклеточных сигнальных систем. В сущности, это может быть описано как рикошетный эффект, поскольку тромбоциты подвергаются одновременному воздействию разных лекарственных веществ стандартной терапии. Применительно к лечению пациентов с ДЭП-1 это блокаторы циклооксигеназы, ингибиторы активных форм кислорода, блокаторы Са2+-каналов, ингибиторы ГМГ-КоА-редуктазы, блокатор обратного захвата серотонина, α-адреноблокатор, ингибитор ангиотензинпревращающего фермента или блокатор АТ1-рецепторов. Даже этот краткий перечень возможных модуляторов функции тромбоцитов свидетельствует о сложности прогнозирования их функциональной активности, если таковая вообще возможна. Однако бесспорно и то, что прямая регистрация функционального состояния тромбоцитов отражает индивидуальную реактивность организма на лечение, что само по себе представляет интерес.
В-третьих, тромбоциты регулируют проницаемость эндотелия сосудов, и этому есть масса доказательств, квинтэссенция которых представлена в обзоре [11]. Известно, что барьерные свойства эндотелиальных клеток имеют решающее значение для поддержания водного и белкового баланса между внутрисосудистым и тканевым пространствами. Нарушение функции эндотелиального барьера вовлечено в развитие и прогрессирование различных патологических состояний, в том числе ишемического инсульта, нейродегенеративных расстройств. Изменение барьерной функции часто связано с выходом растворимых медиаторов из клеток-резидентов (например, макрофагов) и рекрутированных клеток крови. Взаимодействие секретированных биологически активных веществ с рецепторами, представленными на поверхности эндотелиальных клеток, вызывает снижение барьерной функции путем изменения экспрессии адгезивных белков в области межклеточных контактов или изменения реорганизации цитоскелета в самом эндотелии. Активные формы кислорода, протеолитические ферменты (например, матриксные металлопротеиназы, эластазы), онкостатин М и факторы роста (VEGF) являются частью длинного списка посредников, которые вовлечены в нарушение эндотелиального барьера. В этом контексте тромбоциты и лейкоциты представляют особый интерес, поскольку спектр секретируемых веществ участвует в регуляции барьерной функции эндотелия в норме и патологии. Доказательства того, что лейкоареоз является следствием повышения проницаемости ГЭБ, а тромбоциты играют в этом существенную роль, можно найти у [12]. В настоящее время тромбоциты и лейкоциты рассматриваются как мишени для терапевтического вмешательства при дисфункции эндотелиального барьера.
В-четвертых, тромбоциты принимают участие в восстановлении ишемизированного мозга, поскольку секретируют разнообразные биологически активные вещества. Так, [13] приводят данные, подтверждающие, что факторы роста и митогены, секретируемые тромбоцитами, могут способствовать нейрогенезу в коре мозга путем стимулирования процессов пролиферации, миграции и дифференциации эндогенных нервных стволовых клеток. Сочетание процессов стимуляции ангиогенеза, нейрогенеза и нейропротекции при участии тромбоцитов и их микрочастиц может приводить к улучшению функционального состояния центральной нервной системы после инсульта. Интересный механизм, проясняющий инициацию секреции тромбоцитов, приводят [14]. Известно, что сигнализация через тромбоксан-простаноидные (ТП) рецепторы обеспечивает участие тромбоцитов в воспалении и альтерации тканей, а также ангиогенезе. Оказалось, что эти рецепторы контролируют прикрепление тромбоцитов к эндотелию, тогда как у животных с отсутствием этого рецептора адгезия тромбоцитов к эндотелию снижалась. Эти результаты свидетельствуют, что триггером секреции веществ из тромбоцитов является их прикрепление к эндотелию. Если это так, то можно предположить сохранение секреторной активности у гипореактивных тромбоцитов, то есть тромбоцитов, функциональная активность которых была временно ингибирована в результате фармакологического воздействия. В подтверждение такой гипотезы можно привести исследование [15], в котором не обнаружили снижения секреции медиаторов из α-гранул тромбоцитов на фоне применения аспирина у пациентов с ишемическим инсультом, хотя у здоровых лиц аспирин вызывал ингибирование секреции веществ из тромбоцитов.
Выводы
1. Стандартная комплексная медикаментозная терапия у пациентов с дисциркуляторной энцефалопатией атеросклеротического генеза 1-й степени тяжести неоднозначно изменяет реактивность тромбоцитов в отношении агонистов — АДФ, адреналина и ФАТ, что отражает разное влияние использованных лекарственных средств на внутриклеточные сигнальные системы тромбоцитов, ассоциированные с пуриновыми (Р2Y12- и P2Y1) рецепторами, α2-адренорецепторами и ФАТ-рецепторами.
2. При наличии гиперреактивности тромбоцитов в отношении одного или нескольких агонистов на момент завершения стационарного лечения у пациентов сохраняется риск тромбогенеза, нарушений микроциркуляции мозга и развития воспаления, то есть тех патологических процессов, которые предопределяют прогрессирование хронической ишемии мозга. У данного контингента больных ситуационные повышения концентрации адреналина при стресс-реакции, секреции ФАТ нейтрофилами при воспалении и/или увеличение секреции АДФ тромбоцитами в процессе формирования адаптационной реакции клеток крови на гипоксию мозга могут рассматриваться как факторы риска тромбогенеза.
3. Гипореактивность тромбоцитов, выявленная в отношении одного из агонистов, не исключает возможности сохранения или восстановления их проагрегантной активности после завершения лечения, поскольку функциональный статус тромбоцитов определяется взаимодействием нескольких рецепторов, связывающих в том числе АДФ, адреналин и ФАТ.

/115.jpg)