Международный неврологический журнал 6 (76) 2015
Тразодон в лечении депрессии после инсульта
Авторы: Орос М.М., Луц В.В., Адамчо Н.Н. - Ужгородский национальный университет; Мукачевская центральная районная больница
Рубрики: Неврология
Разделы: Справочник специалиста
Резюме
Стаття присвячена проблемі депресії у пацієнтів, які перенесли інсульт. Доведена її актуальність, розглянуто поширеність у даної категорії хворих. Докладно висвітлено патогенез. Щодо лікування постінсультної депресії підкреслюється, що медикаментозна терапія повинна розглядатися як складова частина процесу реабілітації в усіх хворих, які перенесли інсульт. Відповідно до рекомендацій FDA, одним із найбільш оптимальних препаратів для лікування пацієнтів, які страждають від постінсультної депресії, є тразодон. Тразодон характеризується помірним інгібуванням зворотного захвату серотоніну і сильною блокадою серотонінових рецепторів. Крім антидепресивного впливу, він справляє дуже добрий анксіолітичний ефект, що можна порівняти з таким у хлордіазепоксиду та діазепаму. Беручи до уваги седативні властивості та сприятливий вплив на структуру сну, застосовується також як снодійне переважно тоді, коли прийом снодійних препаратів бензодіазепінового ряду пов’язаний з підвищеним ризиком. Клінічні дослідження попередніх років показують, що завдяки поєднаному впливу на різні групи рецепторів тразодон має значно менш виражені побічні ефекти та швидку терапевтичну відповідь.
Статья посвящена проблеме депрессии у пациентов, перенесших инсульт. Доказана ее актуальность, рассмотрена распространенность у данной категории больных. Детально освещен патогенез. Относительно лечения постинсультной депрессии подчеркивается, что медикаментозная терапия должна рассматриваться как составляющая часть процесса реабилитации у всех больных, перенесших инсульт. В соответствии с рекомендациями FDA, одним из наиболее оптимальных препаратов для лечения пациентов, страдающих постинсультной депрессией, является тразодон. Тразодон характеризуется умеренным ингибированием обратного захвата серотонина и сильной блокадой серотониновых рецепторов. Кроме антидепрессивного влияния, он оказывает очень хороший анксиолитический эффект, который можна сравнить с таковым у хлордиазепоксида и диазепама. Учитывая седативные свойства и благоприятное влияние на структуру сна, применяется также и как снотворное, преимущественно тогда, когда применение снотворных препаратов бензодиазепинового ряда связано с повышенным риском. Клинические исследования предыдущих лет показывают, что благодаря сочетанному влиянию на разные группы рецепторов тразодон имеет значительно менее выраженные побочные эффекты и быстрый терапевтический ответ.
The article deals with the problem of depression in patients who have had a stroke. Its relevance, prevalence in these patients is presented. The pathogenesis is described in detail. Regarding the treatment of post-stroke depression, it is emphasized that drug therapy should be considered as part of the rehabilitation process in all patients after stroke. According to FDA guidelines, one of the most appropriate drugs for the treatment of these patients suffering from post-stroke depression is trazodone. Trazodone is characterized by moderate inhibition of serotonin reuptake and strong blockade of serotonin receptors. In addition to antidepressive effect, it has a very good anxiolytic effect that is comparable with that of chlordiazepoxide and diazepam. Given the sedative properties and favourable effect on sleep structure, it is also used as a sedative, mainly when the use of benzodiazepine sleeping pills is associated with increased risk. Clinical studies from previous years show that due to combined effect on various groups of receptors, trazodone has much less severe side effects and rapid therapeutic response.
Ключевые слова
інсульт, депресія, лікування, тразодон.
инсульт, депрессия, лечение, тразодон.
stroke, depression, treatment, trazodone.
Статтю опубліковано на с. 123-129
Вступ
Внаслідок мозкового інсульту (МІ) в Україні щорічно помирає від 40 000 до 45 000 осіб. У 2010 р. зареєстровані 39 694 випадки смерті від МІ, що становить 86,7 випадку на 100 тис. населення (в Європі цей показник — 37–47 на 100 тис. населення). Інсульт залишається провідною причиною інвалідизації населення країни. Близько 20 000 хворих щорічно стають інвалідами внаслідок цереброваскулярних захворювань. Інсульт накладає особливі обов’язки на членів сім’ї хворого, значно знижуючи їх працездатний потенціал, і лягає важким соціально-економічним тягарем на суспільство. Тільки 10–20 % хворих після інсульту повертаються до праці. Тому реабілітація після інсульту є дуже важливою для цих пацієнтів. До числа факторів, що негативно впливають на ефективність реабілітаційних заходів для хворих на інсульт, а отже, погіршують функціональний результат захворювання, є зміни в психоемоційної сфері та сфері вищих психічних функцій, такі як депресія й деменція після інсульту [14, 19, 30, 33, 48].
Постінсультна депресія (ПІД) — найбільш важливий предиктор поганого відновлення повсякденної активності та зниження якості життя після інсульту. Одним з основних механізмів негативного впливу депресивних розладів на успішність відновного лікування є зниження мотивації пацієнта щодо участі в реабілітаційних заходах. Більше того, розвиток ПІД знижує виживання після інсульту. Так, смертність пацієнтів із ПІД протягом року після інсульту на 50 % вища, ніж хворих без депресії [11, 51, 52]. ПІД була описана в 1980 р. Labi et al. як одне з можливих ускладнень інсульту. Депресія ускладнює оцінку неврологічного статусу хворого в клініці, значно погіршує якість життя пацієнтів з інсультом і вірогідно знижує ефективність реабілітаційних заходів (Varga et al., 2002; Mayo et al., 2002.) Одним з основних механізмів негативного впливу депресивних розладів на успішність відновного лікування є зниження мотивації пацієнта щодо участі в реабілітаційних заходах. Розвиток депресії, за даними літератури, знижує відсоток виживання після інсульту (Whyte et al., 2002; Charles et al., 2004; Williams et al., 2004).
Діагностика та варіанти постінсультної депресії
У більшості робіт підкреслюються методологічні труднощі в застосуванні об’єктивних шкал, що використовуються в психіатрії, для оцінки депресії у хворих після інсульту. Діагностика депресії повинна проводитися на підставі клінічного спостереження, бесіди з хворим, з урахуванням анамнестичних даних та об’єктивної інформації, отриманої від знайомих і родичів хворого, і на підставі встановлених діагностичних критеріїв МКХ-10 (DSM-5). Неврологи і лікарі загальної практики частіше стикаються з малою депресією або легким депресивним епізодом. При цьому для встановлення діагнозу досить наявності у хворого пригніченого настрою або втрати можливості отримувати задоволення протягом не менше двох тижнів і всього двох із 9 критеріїв. Ускладнюють діагностику ПІД когнітивні розлади, що розвиваються після інсульту, через те, що хворі не можуть самостійно описати свої емоції, сформулювати скарги. Анозогнозія може бути причиною того, що пацієнти заперечують депресивні скарги, незважаючи на те, що багато проявів депресії помітні для оточуючих. Тому Black et al. (1995) вважають за доцільне розширити діагностичні критерії ПІД і стверджувати її наявність тільки після повної оцінки когнітивного та психічного статусу. Іноді депресія після інсульту перебігає в прихованій, атиповій формі, маскуючись різноманітними психовегетативними та соматичними проявами. Іншим варіантом ПІД може бути реактивний стан пацієнта у відповідь на хворобу. Практично будь-яке захворювання, від якого людина страждає, обмежує її можливості, змушує відмовлятися від звичного способу життя, може призвести до розвитку депресивного стану.
Депресія після інсульту може розвинутися й у відповідь на медикаментозну терапію (Мосолов С.Н., 1995; Смулевіч А.Б. та співавт., 1997; Adams R.D.M. et al., 1997). Існує досить велика кількість медикаментозних засобів, що, впливаючи на нейромедіаторні процеси в центральній нервовій системі (ЦНС), призводять до розвитку депресивних станів. Багато з них досить часто використовуються при лікуванні неврологічних хворих (ряд гіпотензивних засобів, кортикостероїди, барбітурати, транквілізатори, нестероїдні протизапальні засоби, серцеві глікозиди та ін.). Останнім часом важливу роль у розвитку саме соматизованого варіанта депресії після інсульту відводять алекситимії (Мосолов С.Н., 1995; Смулевіч А.Б. та співавт., 1997) — невмінню хворого ідентифікувати й описати свої відчуття, тобто вербалізувати свої душевні переживання та емоції. Наявність алекситимії ускладнює спілкування із хворим і навіть виявлення типової депресії. За даними деяких дослідників, алекситимія частіше розвивається у пацієнтів з ураженням недомінантної півкулі головного мозку.
Патогенез постінсультної депресії
Однозначної думки про причини розвитку депресії у хворих з ураженням головного мозку на сьогодні немає. Результати численних досліджень вказують на те, що в основі психічних розладів, очевидно, лежать порушення синаптичної передачі. Головними є катехоламінова (норадреналінова та дофамінова), фенілетиламінова та індоламінова гіпотези. Кожна з них підкреслює переважно функціональну недостатність при депресіях однієї з моноамінових систем, хоча вони зазвичай не виключають супутніх змін в інших моноамінових системах мозку. Норадреналін і серотонін не є ні гальмівними, ні збудливими нейротрансмітерами в класичному варіанті, скоріше, вони чинять нейромодулюючу дію на інтегративні функції нейронів. У вивченні механізмів ПІД є певні труднощі. Так, не існує моделей депресії на лабораторних тваринах з ураженням головного мозку. По-друге, порушення можуть стосуватися не всіх ланок конкретної нейрохімічної системи і, отже, відображати не всі доступні для дослідника параметри. Слід мати на увазі, що скупчення нейронів, що продукують ней-ротрансмітери, як правило, локалізовані. Так, нервові клітини, що синтезують серотонін, розташовані в ядрах шва довгастого мозку, норадренергічні нейрони — в ділянці блакитної плями, дофамін-продукуючі клітини — в чорній субстанції і мезолімбічній ділянці. Ці структури мозку людини малодоступні для дослідження: наприклад, внаслідок малих розмірів і глибинного розташування вони не справляють помітного впливу на електричну активність головного мозку (ЕЕГ), так що прямо виявити їх дисфункцію елекрофізіологічними методами не є можливим (єдиною перспективною альтернативою є позитронно-емісійна томографія, ПЕТ). Більше того, допускається, що ключові нейротрансмітери, що відіграють первинну роль у походженні депресивних розладів, ще не знайдені, а медикаментозні впливи на норадреналін- і серотонінергічні системи лише модулюють чутливість внутрішньоклітинних месенджерів (цикло-АМФ) до цих сполук, у складі яких можуть бути названі деякі амінокислоти (насамперед гліцин), пептиди (ендорфін, пептид дельта-сну), паратгормон, а також гормони (адренокортикотропний гормон, адреналін, мелатонін) та інші моноаміни.
У наш час з’явилися неінвазивні методики, що дозволяють оцінити нейрохімічний статус головного мозку in vivo (SPECT, ПЕТ). За допомогою SPECT у ряді досліджень (Staley et al.) виявлено зниження рівня серотоніну в середньому мозку у пацієнтів із тяжкою депресією після інсульту. При проведенні ПЕТ виявлено, що концентрація 5-НТ2-рецепторів не змінюється при депресії, але значно збільшується у відповідь на антидепресивну терапію. Виявлено вірогідний кореляційний зв’язок із підвищенням концентрації 5-НТ2-рецепторів і редукцією депресивних симптомів. Не вирішено завдання вивчення серотонінергічного синапсу (оцінка синаптичного рівня 5-НТ, пресинаптичного і постсинаптичного маркерів — 5-НТ1А- і 5-НТ2А-рецепторів) (рис. 1).
/125.jpg)
Нейротрофічний фактор мозку (BDNF) разом із фактором росту нервів (NGF) бере участь у регуляції пластичності допамінергічних, холінергічних та серотонінергічних нейронів; зниження вмісту даних факторів у певних відділах мозку після інсульту також може бути причиною розвитку депресії.
У генетичних дослідженнях останніх років виявлена значуща кореляція між наявністю промоутерної зони транспортера серотоніну (serotonin transporter-linked promoter region, 5-HTTLPR) — варіантом геному і розвитком депресії після інсульту у хворих (Ramasubbu et al., 2006).
У ряді нейрохімічних досліджень було доведено, що при розвитку депресії після інсульту має місце підвищення продукції прозапальних цитокінів, таких як IL-1-бета, TNF-альфа, IL-18, у лімбічної ділянці, активація індоламін-2,3-діоксигенази, що призводить до виснаження серототіну в паралімбічній ділянці, вентролатеральних відділах лобової частки, полюсі скроневої частки і базальних гангліях (Spalletta et al., 2006).
Термін (період) інсульту як фактор ризику ПІД обговорюється в роботах багатьох авторів. Проведені дослідження показали наявність депресії вже в гострому періоді інсульту: у 25,6 % хворих — через 7–10 днів від початку захворювання, за даними Ramasubbu et al. (1998), до 27 %, за даними Berg et al. (2001). У ранньому відновному періоді інсульту (через 3–4 місяці) частота депресії збільшується до 30–53 % і зберігається високою через рік захворювання — до 42 % (Pohjasvaara et al., 1998; Kauhanen et al., 1999; Huff et al., 2001).
Тенденцію до розвитку депресії після 6 місяців захворювання відзначають більшість дослідників. Багатьма авторами описана вірогідна кореляція появи депресивних розладів залежно від терміну інсульту (найбільший відсоток ПІД діагностований у пізньому відновному періоді — 6–12 місяців після інсульту). За даними І.Б. Сорокіної (2005), Є.І. Гусєва та співавт. (2001), найбільша частота депресії (до 72,2 %) виявлена у хворих у пізньому відновному періоді інсульту.
Лікування постінсультної депресії
ПІД є частим ускладненням інсульту, але рідко діагностується і ще рідше корегується медикаментозно. Медикаментозна терапія депресії повинна розглядатися як складова частина процесу реабілітації в усіх хворих, які перенесли інсульт. Основним методом сучасного лікування депресії є призначення антидепресантів або тімоаналептиків. До антидепресантів зараховують засоби, здатні ліквідувати болісно знижений настрій і загальмованість психічної діяльності. Основне завдання будь-якого антидепресанту з урахуванням сучасної концепції депресії полягає в усуненні дефіциту моноамінів, в основному серотоніну, в ЦНС.
Ефективне застосування антидепресантів, зокрема трициклічних антидепресантів (ТЦА), у хворих із ПІД описано в 1990 р. Robison et al., що було доведено і в подальших дослідженнях — Gonzalez-Torracillas et al. (1995), W. Huff et al. (2001). Удосконалення підходів до лікування ПІД відбувається відповідно до розвитку моноамінової гіпотези депресивних станів, пов’язаних із дефіцитом серотоніну і норадреналіну в синаптичній щілини. Основною проблемою застосування ТЦА є побічні ефекти, тому для неврологів важливим питанням є підбір адекватного та безпечного антидепресанту.
У наш час найчастіше використовуються селективні інгібітори зворотного захвату серотоніну (СІЗЗС) при лікуванні депресій у хворих з інсультом, оскільки даний клас антидепресантів викликає менше несприятливих, а іноді й небезпечних побічних ефектів, властивих ТЦА, що пов’язані з антихолінергічною дією (затримка сечовипускання, запори, сплутаність свідомості, а також кардіотоксичність, ортостатична гіпотензія, потенційна летальність при передозуванні).
У пацієнтів із ПІД, як і у пацієнтів із депресією загалом, однією із найбільш частих причин страждань є безсоння, або порушення сну, що включає в себе як порушення засинання, так і раннє пробудження. Тому при призначенні препарату лікар повинен враховувати цей розлад. Відповідно до рекомендацій FDA, одним із найбільш оптимальних препаратів для лікування цих пацієнтів є тразодон. Це специфічний серотонінергічний антидепресант, що характеризується помірним інгібуванням зворотного захвату серотоніну і сильною блокадою серотонінових рецепторів (рис. 1). Крім антидепресивного впливу, він справляє дуже добрий анксіолітичний ефект, що можна порівняти з таким у хлордіазепоксиду та діазепаму, та ефективний вже в дозі 50 мг/день.
З огляду на седативні властивості та сприятливий вплив на структуру сну застосовується також як снодійне переважно тоді, коли прийом снодійних препаратів бензодіазепінового ряду пов’язаний з підвищеним ризиком. Тразодон подовжує загальний час сну і час повільної фази сну, знижує кількість і тривалість нічних пробуджень і подовжує латентний період REM-фази сну (рис. 2).
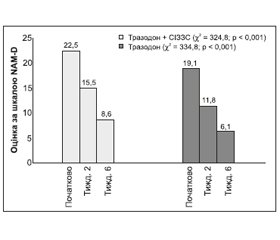
Тразодон позитивно впливає на параметри сну, що змінюються при депресії. Його антидепресивна ефективність при короткочасному і довготривалому лікуванні порівнянна із СІЗЗС і ТЦА. Препарат приймають одноразово в добовій дозі на ніч. Клінічні дослідження попередніх років показують, що завдяки поєднаному впливу на різні групи рецепторів тразодон має значно менш виражені побічні ефекти та швидку терапевтичну відповідь. Дія препарату у третини хворих розвивається протягом першого тижня прийому, у 75 % — протягом двох тижнів. Важливим фактором є можливість використовувати тразодон в осіб похилого віку. Серед осіб похилого віку з депресією проводився порівняльний аналіз ефективності тразодону і ТЦА (амітриптиліну) (Altamura et al., 1989). У двох подвійних сліпих рандомізованих дослідженнях, проведених з метою порівняльного аналізу тразодону і СІЗЗС (флуоксетину), у двох препаратів також відзначалася аналогічна антидепресивна ефективність (Beasley et al., 1991; Falk et al., 1984). Крім того, при застосуванні флуоксетину була більша частота виникнення побічних ефектів (збудження, тривоги, нервозність та безсоння) порівняно з тразодоном (Beasley et al., 1991). Однак седативну дію найчастіше відзначали у тразодону, ніж у флуоксетину (Beasley et al., 1991). За результатами ряду досліджень, зокрема Kaspera еt al., тразодон не поступається за ефективністю СІЗЗС, дані останнього огляду Saletu-Zyhlarz et al., проведеного на великій популяції хворих (n = 300–400), показали, що при помірній депресії монотерапія тразодоном характеризувалася такою ж ефективністю, що й комбінована терапія тразодоном із СІЗЗС. Ці режими приводили до однакового зниження бальності за шкалою HAM-D через 2 і 6 тижнів лікування (рис. 3).
/126.jpg)
Пацієнти з депресією можуть часто страждати від додаткових тривожних розладів, наприклад панічного і посттравматичного стресового розладу (ПТСР) (Wittchen et al., 1999). Фармакологічна терапія таких тривожних розладів включає два основні класи препаратів: бензодіазепіни й антидепресанти. Завдяки наявності снодійного/седативного ефекту тразодон протягом багатьох років став предметом досліджень у терапії тривожних розладів.
Відзначено, що тразодон ефективний у лікуванні пацієнтів із генералізованим тривожним розладом (Gale, 2002). У подвійному сліпому рандомізованому плацебо-контрольованому дослідженні спостерігалася аналогічна ефективність при прийомі тразодону, іміпраміну та діазепаму (Rickels et al., 1993) (рис. 4).
/127.jpg)
Хоча препаратами для терапії першої лінії при ПТСР є СІЗЗС, що не мають холіноблокуючої активності, і такий засіб, як тразодон, може використовуватися у разі неефективності або непереносимості СІЗЗС. У невеликому дослідженні, що включало 6 пацієнтів із ПТСР внаслідок бойових дій, тразодон у дозі 50–400 мг відзначено поліпшення за загальною клінічною шкалою оцінки посттравматичного стресового розладу і самооцінкою пацієнтів за шкалою Девідсона для оцінки травми порівняно з вихідними значеннями (Hertzberg et al., 1999). У дослідженні за участю 60 осіб із ПТСР терапія тразодоном у дозі 50–200 мг сприяла зменшенню частоти нічних кошмарів і поліпшенню процесу засинання та підтримання сну (Warner et al., 2001).
Крім того, оцінювали ефективність тразодону ТКВ у пацієнтів похилого віку з депресією (Bayer et al., 1989). Через чотири тижні від початку терапії тразодоном ТКВ і ТНВ (обидві форми призначалися в добовій дозі одноразово на ніч, починаючи зі 100 мг, зі збільшенням до 200 мг/добу залежно від переносимості) відзначався аналогічний ефект, який оцінювався за змінами показників за HDRS і загальної оцінки тяжкості депресії порівняно з вихідними значеннями [55]. Протягом першого тижня лікування у пацієнтів, які отримували тразодон ТКВ, було зареєстровано меншу кількість побічних ефектів.
Висновок
Високий рівень інтраверсії і нейротизму взаємопов’язані між собою і сприяють розвитку депресивних порушень у постінсультних пацієнтів. Преморбідні риси, що призводять до депресивних розладів, проявляються в меланхолійних, дистимічних та емоційно-лабільних акцентуаціях особистості.
Депресія обтяжує перебіг інсульту, уповільнює відновлення порушених функцій у хворих, погіршує соціальну адаптацію, знижує якість життя пацієнтів. У ранній період інсульту поряд зі стандартним неврологічним обстеженням потрібно психіатричне обстеження, орієнтоване насамперед на виявлення депресивних симптомів, розпізнавання депресії як клінічних розладів. Депресія при інсульті вимагає самостійної терапії антидепресантами, психотерапії або їх поєднання. Лікування ПІД на фоні базисної терапії інсульту дозволяє знизити ступінь вираженості, тяжкість симптомів і скоротити тривалість постінсульт-ного періоду. Три-чотирирічний катамнез пацієнтів із ПІД, які отримували антидепресанти, показав у цій групі осіб підвищення якості життя, полегшення тягаря хвороби і зниження показників смертності. Багатофункціональні властивості та механізми дії тразодону дають можливість застосовувати його для лікування ряду симптомів, пов’язаних із депресією, уникаючи при цьому таких побічних ефектів, як безсоння і тривога, що часто виникають або зберігаються при терапії СІЗЗС. Хоча тразодон часто призначається пацієнтам із депресією в малих дозах як седативний і снодійний засіб (у вигляді монотерапії або в комбінації з іншими антидепресантами), а також при станах, відмінних від депресії (наприклад, при первинному безсонні), клінічних доказів, що підтверджують його застосування в цих випадках, недостатньо, і ця можливість активно вивчається в даний час. Тразодон цінується в усьому світі завдяки не тільки своїй клінічній ефективності при широкому спектрі симптомів депресії, але також відсутності негативних впливів на сон як при монотерапії, так і в комбінації з іншими препаратами.
Список литературы
1. Александровский Ю., Барденштейн Л., Аведисова А. Психофармакотерапия пограничных психических расстройств. — М.: ГЭОТАР-МЕД, 2005. — 250 c.
2. Вейн А.М., Вознесенская Т.Г., Голубев В.Л., Дюкова Г.М. Депрессия в неврологической практике. — М., 1998.
3. Гусев Е.И., Скворцова В.И. Ишемия головного мозга. — М.: Медицина, 2001.
4. Гусев Е.И., Гехт А.Б., Боголепова А.Н., Сорокина И.Б. Особенности депрессивного синдрома у больных, перенесших ишемический инсульт // Журнал неврологии и психиатрии им. С.С. Корсакова, приложение «Инсульт». — 2001. — Вып. 3. — С. 28-31.
5. Гехт А.Б., Сорокина И.Б., Боголепова А.Н., Гудкова А.А. Опыт применения иксела (милнаципрана гидрохлорида) в лечении постинсультной депрессии // Терапевтический архив. — 2003. — № 75(10). — С. 34-8.
6. Гехт А.Б., Боголепова А.Н., Сорокина И.Б. Депрессия после инсульта: опыт применения ципрамила // Журнал неврологии и психиатрии им. С.С. Корсакова. — 2002. — Т. 102, № 5. — С. 36-40.
7. Мосолов С.Н. Клиническое применение современных антидепрессантов. — СПб., 1995. — 565 с.
8. Смулевич А.Б., Козырев В.Н., Сыркин А.Л. Депрессии у соматических больных. — М., 1997. — 108 с.
9. Сорокина И.Б. Депрессия у больных ишемическим інсультом: автореф. дис… канд. мед. наук. — М., 2005.
10. Adams R.D., Victor M., Ropper A.H. Principles of neuro-logy. — Sixth edition. — 1997. — Ch. 24-27, 57. — P. 495-573, 1520-1543.
11. Andersen G., Vestergaard K., Lauritzen L. Effective treatment of poststroke depression with the selective serotonin reuptake inhibitor citalopram // Stroke. — 1994. — Vol. 25, 6. — 1099-1104.
12. Berg A., Palomaki H., Lehtihalmes M., Lonnqvist J., Kaste M. Poststroke depression in acute phase after stroke // Cerebrovasc. Dis. — 2001. — Vol. 12(1). — P. 14-20.
13. Black K.G. Diagnosing depression after stroke // South. Med. J. — 1995 Jul. — Vol. 88(7). — P. 699-708.
14. Brola W., Szafraniec L. Depression as a complication of stroke // Przegl. Lek. — 1996. — Vol. 53(9). — P. 690-2.
15. Charles E. Mortality and Poststroke Depression // Am. J. Psychiatry. — August 2004. — Vol. 161. — P. 1506.
16. Choi-Kwon S., Han S.W., Kwon S.U., Kang D.W., Choi J.M., Kim J.S. Fluoxetine treatment in poststroke depression, emotional incontinence, and anger proneness: a doubleblind, placebo-controlled study // Stroke. — 2006 Jan. — Vol. 37(1). — P. 156-61.
17. Colonna L., Reines E.H., Andersen H.F. Escitalopram is well tolerated and more efficacious than citalopram in long-term treatment of moderately depressed patients. Poster presented at the 3rd International Forum on mood and anxiety disorders, Monte Carlo, Monaco, November 27–30, 2002.
18. Diequez S., Staub F., Bruggimann L., Bogousslavsky J. Is poststroke depression a vascular depression? // J. Neurol. Sci. — 2004 Nov 15. — Vol. 226(1–2). — P. 53-8.
19. Erfurth A., Loew M., Wendler G., Floreanu A. Depressive disorders in neurologic rehabilitation: therapy with paroxetine // Psychiatr. Prax. — 2001 Jan. — Vol. 28(1). — P. 43-4.
20. Huff W., Ruhrman S., Sitzer M. Post-stroke depression: diagnosis and therapy // Fortschr. Neurol. Psychiatr. — 2001 Dec. — Vol. 69(12). — P. 581-91.
21. Iacoboni M., Padovani A., Piero D., Lezi G.L. Poststroke depression: relationships with morphological damage and cognitive over time // Int. J. Neurol. Sci. — 1995. — Vol. 16. — P. 209-215.
22. Gonzalez-Torrecillas J.L., Mendlewicz J., Lobo A. Effects of early treatment of poststroke depression on neuropsychological rehabilitation // Int. Psychogeriatr. — 1995 Winter. — Vol. 7(4). — P. 547-60.
23. Kauhanen M., Korpelainen J.T., Hiltunen P., Brusin E., Mononen H., Maatta R., Nieminen P., Sotaniemi K.A., Myllyla V.V. Poststroke depression correlates with cognitive impairment and neurological deficits // Stroke. — 1999 Sep. — Vol. 30(9). — P. 1875-80.
24. Kim J.S., Choi-Kwon S. Poststroke depression and emotional incontinence: correlation with lesion location // Neurology. — 2000 May 9. — Vol. 54(9). — P. 1805-10.
25. Labi M.L.C., Phillips T.F., Gresham G.E. Psychosocial disability in physically restored long-term stroke survivors // Arch. Phys. Med Rehabil. — 1980. — Vol. 61. — P. 561-5.
26. Lepola U.M., Loft H., Reines E.H. Escitalopram (10–20 mg/day) is effective and well tolerated in a placebo-controlled study in depression in primary care // Int. Clin. Psychopharrnacol. — 2003. — Vol. 18. — P. 211-217.
27. Mayo N.E., WoodDauphinee S., Cote R., Durcan L., Carlton J. Activity, participation, and quality of life 6 months poststroke // Arch. Phys. Med. Rehabil. — 2002 Aug. — Vol. 83(8). — P. 1035-42.
28. Muller-Spahn F., Hock C. Clinical presentation of depression in elderly // Gerontology. — 1994. — Vol. 40 (Suppl. 1). — P. 10-14.
29. Narushima K., Kosier J.T., Robinson R.G. Preventing poststroke depression: a 12-week double-blind randomized treatment trial and 21-month follow-up // J. Nerv. Ment. Dis. — 2002 May. — Vol. 190(5). — P. 296-303.
30. Nys G.M., van Zandvoort M.J., van der Worp H.B., de Haan E.H., de Kort P.L., Jansen B.P., Kappelle L.J. Early cognitive impairment predicts long-term depressive symptoms and quality of life after stroke // J. Neurol. Sci. — 2006 Sep 25. — Vol. 247(2). — P. 149-56.
31. Ouimet M.A., Primeau F., Cole M.G. Psychosocial risk factors in poststroke depression: a systematic review // Can. J. Psychiatry. — 2001 Nov. — Vol. 46(9). — P. 819-28.
32. Paolucci S., Antonucci G., Grasso M.G., Morelli D., Troisi E., Coiro P., De Angelis D., Rizzi F., Bragoni M. Post-stroke depression, antidepressant treatment and rehabilitation results. A casecontrol study // Cerebrovasc. Dis. — 2001. — Vol. 12(3). — P. 264-271.
33. Paradiso S., Robinson R.G. Gender differences in poststroke depression // J. Neuropsychiatry Clin. Neurosci. — 1998 Winter. — Vol. 10(1). — P. 41-7.
34. Pohjasvaara T., Leppavuori A., Siira I., Vataja R., Kaste M., Erkinjuntti T. Frequency and clinical determinants of poststroke depression // Stroke. — 1998 Nov. — Vol. 29(11). — P. 2311-7.
35. Ramasubbu R., Robinson R.G., Flint A.J., Kosier T., Price T.R. Functional impairment associated with acute poststroke depression: the Stroke Data Bank Study // J. Neuropsychiatry Clin. Neurosci. — 1998 Winter. — Vol. 10(1). — P. 26-33.
36. Ramasubbu R., Tobias R., Buchan A.M., Bech-Hansen N.T. Serotonin transporter gene promoter region polymorphism associated with poststroke major depression // J. Neuropsychiatry Clin. Neurosci. — 2006 Winter. — Vol. 18(1). — P. 96-9.
37. Robinson R.G., Morris P.L., Fedoroff J.P. Depression and cerebrovascular disease // J. Clin. Psychiatry. — 1990 Jul. — Vol. 51(Suppl. 26–31). — Discussion 32-3.
38. Sanchez C., Kreilgaard M. R-citalopram ingibits functional and 5-HTP-evoked behavioural responses to the SSRI, escitalopram // Pharmacol. Biochem. Behav. — 2004. — Vol. 77. — P. 391-398.
39. Sato P., Bryan R.N., Fried L.P. Neuroanatomic and functional correlates of depressed mood: the Cardiovascular Health Study // Am. J. Epidemiol. — 1999. — Vol. 150. — P. 919-929.
40. Sandor H., Zsolt K., Harcos P., Nagy Z., Gyorgy N., Gyor-gy A. Clinical evaluation of the efficacy and safety of paroxetin in poststroke depression: results from a phase 4, open label, multicentre clinical trial with 26 weeks of follow-up // Orv. Hetil. — 2006 Dec 17. — Vol. 147(50). — P. 2397-404.
41. Schwartz J.A., Speed N.M., Brunberg J.A., Brewer T.L., Brown M., Greden J.F. Depression in stroke rehabilitation // Biol. Psychiatry. — 1993 May 15. — Vol. 33(10). — P. 694-9.
42. Shima S., Kitagawa Y., Kitamura T., Fujinawa A., Watanabe Y. Poststroke depression // Gen. Hosp. Psychiatry. — 1994 Jul. — Vol. 16(4). — P. 286-9.
43. Shimoda K., Robinson R.G. The relationship between poststroke depression and lesion location in long-term follow-up // Biol. Psychiatry. — 1999 Jan 15. — Vol. 45(2). — P. 187-92.
44. Spalletta G., Bossu P., Ciaramella A., Bria P., Caltagirone C., Robinson R.G. The etiology of poststroke depression: a review of the literature and a new hypothesis involving inflammatory cytokines // Mol. Psychiatry. — 2006 Nov. — Vol. 11(11). — P. 984-91. Epub 2006 Aug 8.
45. Staley J.K., Malison R.T., Innis R.B. Imaging of the serotonergic system: interactions of neuroanatomical and functional abnormalities of depression // Biol. Psychiatry. — 1998 Oct 1. — Vol. 44(7). — P. 534-49.
46. Varga D. Neuropsychiatric complications after stroke // Ideggyogy Sz. — 2002 Mar 20. — Vol. 55(3–4). — P. 128-36.
47. Verdelho A., Henon H. Depressive symptoms after stroke and relationship with dementia: a three-year follow-up study // Neuro-logy. — 2004 Mar 23. — Vol. 62(6). — P. 905-11.
48. Wiart L., Petit H., Joseph P.A., Mazaux J.M., Barat M. Fluoxetine in early poststroke depression: a double-blind placebo-controlled study // Stroke. — 2000 Aug. — Vol. 31(8). — P. 1829-32.
49. Williams L.S., Ghose S.S., Swinde R.W. Depression and other mental health diaognoses increase mortality risk after ische-mic stroke // Am. J. Psychiatry. — 2004 Jun. — Vol. 161(6). — P. 1090-5.
50. Whyte E., Mulsant B. Post stroke depression: epidemiology, pathophysiology, and biological treatment // Biol. Psychiatry. — 2002 Aug 1. — Vol. 52(3). — P. 253.
51. Yamakawa Y., Satoh S., Sawa S., Ohta H., Asada T. Efficacy of milnacipran on poststroke depression on inpatient rehabilitation // Psychiatry Clin. Neurosci. — 2005 Dec. — Vol. 59(6). — P. 705-10.
/125.jpg)
/127.jpg)

/126.jpg)