Статтю опубліковано на с. 19-25
Інсульт залишається другою причиною летальності й найчастіше спричиняє інвалідність у дорослому віці [1]. З позиції доказової медицини пріоритет у лікуванні ішемічного інсульту залишається за тромболітичною терапією, ефективність якої наразі оцінюється як помірна [2–4]. Позитивні результати випробувань ней-ропротекторних засобів у двогодинний період експериментально модельованої ішемії мозку спонукають до продовження їх клінічних випробувань у найгостріший період інсульту. Понад 70 препаратів із нейропротекторною дією апробовані в третій фазі рандомізованих контрольованих клінічних випробувань, однак досягнуті показники ефективності досі вважаються недостатньо переконливими [5].
У преклінічних випробуваннях показана пряма нейро- та гліопротекторна дія препаратів магнію [3, 6]. Це другий за значимістю після калію внутрішньоклітинний катіон, задіяний у понад 600 ензимних реакціях, включаючи енергетичний метаболізм і білковий синтез. Як фізіологічний антагоніст кальцію, магній потенційно здатний блокувати NMDA-опосередковану глутаматну ексайтотоксичність при різноманітних ураженнях головного мозку. Він зменшує виділення прозапальних цитокінів і вільних радикалів, чинить вазодилататорний та антиагрегантним ефекти, гіпотензивну й протинабрякову дію, седативний і протиепілептичний вплив [7–9]. Привабливими характеристиками магнієвмісних лікарських засобів є доступність і зручність введення, а також безпечність з огляду на досвід використання в акушерській практиці.
У рандомізованому контрольованому дослідженні інсульту IMAGES була випробувана одноразова 24-годинна інфузія сульфату магнію, розпочата протягом перших 12 годин після розвитку гострого порушення мозкового кровообігу. За даними цього випробування, сприятливий вплив препарату був вираженим лише у випадках некіркових і лакунарних інфарктів мозку [10, 11]. У дослідженні K.W. Muir та співавт. (2004) препарат уводили в середньому через 7,4 год від початку інсульту без вірогідного поліпшення результату, але відзначили потенціальну ефективність препарату за умови початку лікування протягом перших 3 годин [12]. Дизайн наступного випробування передбачав раннє призначення сульфату магнію на догоспітальному етапі протягом 2 годин від появи перших симптомів, однак включені були пацієнти як з ішемічним, так і з геморагічним інсультом, оскільки диференціальна діагностика на доклінічному етапі була неможливою [13].
У рандомізованому плацебо-контрольованому подвійному сліпому випробуванні S.A. Mousavi та співавт. (2004) вивчали вплив магнію сульфат на перебіг інсульту з формуванням кортикального інфаркту мозку у басейні середньої мозкової артерії за наявності помірного неврологічного дефіциту [14]. Протягом перших 24 годин інсульту вводили магнію сульфат (4 г початково, потім 1 г щогодини) або плацебо протягом 4 днів. У відносно невеликих групах виявлено статистично вірогідний позитивний вплив препарату на динаміку неврологічного дефіциту. Автори роблять висновок про вагомість нейропротективної дії досліджуваного засобу у гостру фазу інсульту і можливість скорочення терміну госпіталізації.
Щоденні ін’єкції сульфату магнію можуть запобігати розвитку вторинної ішемії на тлі інтракраніального крововиливу і вазоспазму. У деяких випробуваннях препарату у поєднанні з німодипіном виявлено зменшення частоти формування клінічно значимих церебральних інфарктів на тлі спонтанного субарахноїдального крововиливу [15, 16, 17].
У третій фазі випробування FAST-MAG введення магнезії передувало тромболізису або нейротромбектомії у хворих на ішемічний інсульт. Досить велика доза сульфату магнію — 16 г на 240 мл 0,9 % хлориду натрію по 10 мл щогодини протягом доби, вводилась за допомогою електронної інфузійної помпи. Поєднане випробування реперфузійної терапії і магнієвмісного препарату виявило позитивну тенденцію до поліпшення ефективності лікування ішемічного інсульту без досягнення статистично значимих результатів [18, 19].
Недостатньо вагомий нейропротекторний вплив сульфату магнію може бути пов’язаний з його відстроченим проходженням через гематоенцефалічний бар’єр, оскільки пікові концентрації досягаються у спинномозковій рідині через 4 год після введення. З іншого боку, біодоступність препарату в умовах ішемії може суттєво відрізнятись від фізіологічних умов. Відомо, що вже за кілька хвилин ішемії у паренхімі мозку порушується функція нейронів і пошкоджуються клітинні мембрани, що спричиняє внутрішньоклітинне накопичення води й розвиток цитотоксичного церебрального набряку. Ці зміни більш виражені у сірій речовині й візуалізуються у вигляді чітко відмежованої зони низької щільності. За даними КТ та ізотопних досліджень поєднання ендотеліальних клітин і гематоенцефалічний бар’єр у цілому залишаються інтактними протягом декількох днів. Але надалі підвищення проникності гематоенцефалічного бар’єра зумовлює проникнення компонентів плазми у позаклітинний простір і приєднання вазогенного набряку мозку. На цій стадії більше страждає біла речовина, у якій виявляються пальцеподібні ділянки низької щільності, типові також для пухлин головного мозку. Водночас слід зазначити, що прижиттєва КТ-візуалізація мас-ефекту внаслідок набряку виявляється у менше ніж 50 % випадків (включаючи летальні випадки інсульту).
J.A. McKee та співавт. (2005) визначали концентрацію загального й іонізованого магнію в лікворі шляхом дренування шлуночків у хворих з різною церебральною патологією в умовах 24-годинної гіпермагніємії, яка підтримувалась шляхом внутрішньовенного введення сульфату магнію. Викликана гіпермагніємія супроводжувалась зростанням вмісту магнію в спинномозковій рідині на 11–21 % без перевищення норми, що розширює можливості застосування великих доз магнієвмісних препаратів [20].
Препарат виробництва «Вьорваг Фарма», Німеччина, Кормагнезін® 200 і 400 в ампулах по 10 мл розчину для внутрішньовенних ін’єкцій містить відповідно 2 і 4 г активної речовини — магнію сульфату гептагідрат. Лікарський засіб зареєстрований в Австрії, Болгарії, Німеччині, Угорщині, Росії, Люксембурзі (Р.П. № UA/12290/01/01, UA/12290/01/02 від 08.06.2012 до 08.06.2017). Кормагнезін® 200 містить 8,3 ммоль магнію, Кормагнезін® 400 — 16,6 ммоль магнію.
Кормагнезін справляє заспокійливу, знеболювальну, протисудомну дію на ЦНС. Він впливає на регуляцію клітинної проникності й нервово-м’язової передачі, енергетичні процеси та обмін білків, жирів, вуглеводів, нуклеїнових кислот. Серцево-судинні впливи опосередковані ефектом стабілізації на клітини міокарда, поліпшення його скоротливої функції, спазмолітичною дією на гладенькі м’язи, зниженням загального периферичного судинного опору. Окрім зменшення проявів магнієвого дефіциту, препарат може позитивно впливати на агрегацію тромбоцитів, має курареподібний ефект, зменшуючи виділення ацетилхоліну нервовими закінченнями.
Фармакокінетика препарату ґрунтується на чіткій залежності виділення магнію з нирками від його наявної концентрації в крові. У середньому підтримується рівень макроелементу 0,84 ммоль/л, із яких 25–35 % зв’язується з білками, решта здатна до дифузії й фільтрується нирками, повторно всмоктується в проксимальних і дистальних канальцях 93–99 %. Абсолютна кількість магнію в організмі людини становить 25 мг, із яких кістки містять 60 %, такі органи, як печінка, м’язи, мозок тощо, — близько 39 %, екстрацелюлярний простір — 1 % і плазма крові — 0,5 %.
Показаннями до призначення препаратів магнію є стани, зумовлені магнієвим дефіцитом: порушення скоротливої активності м’язів, коронарні спазми, аритмії серця, зокрема пароксизмальна шлуночкова тахікардія, прееклампсія й еклампсія. Наразі відсутні доступні клініко-хімічні параметри дефіциту магнію, оскільки його концентрація в плазмі крові вірогідно не корелює з умістом електроліту в екстрацелюлярній речовині. Порушення метаболізму магнію може бути спричинене мальабсорбцією внаслідок патології шлунково-кишкового тракту, незбалансованим раціоном і/або низьким умістом магнію. Відомо, що алкоголь пригнічує резорбцію та збільшує діурез магнію. Стресові ситуації, а також застосування сечогінних, проносних засобів, кортикоїдів, інсуліну часто спричиняють абсолютне зниження рівня магнію в крові й підвищують потребу в ньому. Дефіцит магнію вважається фактором ризику серцево-судинних захворювань (аритмії, серцева недостатність, стенокардія), підвищеної збудливості нейронів, виникнення крампі, безсоння, запаморочення, мігрені. Непрямим свідченням недостатності магнію може бути наявність сечокам’яної хвороби з формуванням оксалатних каменів у нирках. Магній може запобігати побічним діям неселективних β-адреноміметиків, збуджуючий вплив яких на β1-адренорецептори призводить до серцевого стресу [21].
Уведення магнієвмісних препаратів протипоказане за наявності міастенії, вираженої брадикардії, передсердно-шлуночкової блокади й вираженого порушення функції нирок. Є дані про взаємодію аміноглікозидів із препаратами магнію, а також про зниження ефектів магнію в разі одночасного введення з солями кальцію. Міорелаксанти курареподібної дії підвищують периферичні впливи електроліту на кінцеву пластинку рухового нерва в нервово-м’язовому синапсі. Ризик дихальної недостатності зростає за умов поєднання Кормагнезіну з барбітуратами, наркотичними або гіпнотичними засобами.
Інтоксикація магнієм за умови нормальної функції нирок і застосування терапевтичних доз є малоймовірною. У високих дозах препарат може спричинити брадикардію, зниження артеріального тиску, порушення електричної провідності міокарда, розширення периферичних судин. Швидке введення Кормагнезіну може супроводжуватись появою нудоти, блювання, дихальної недостатності, запаморочення, неспокою, головного болю, жару, стану занепокоєння. Невідкладні заходи в такому разі передбачають внутрішньовенне введення 10% розчину хлориду кальцію протягом 5–10 хвилин.
У вітчизняній інсультології досвід застосування сульфату магнію в дозах, які б перевищували 2 г на добу, наразі обмежений.
Мета. Дослідити динаміку відновлення неврологічних функцій при застосуванні різних доз сульфату магнію в ранньому періоді ішемічного інсульту.
Матеріали і методи
У дослідженні були рандомізовані хворі в гострому періоді ішемічного інсульту (ІІ). Основну групу становили 30 пацієнтів, яким, окрім традиційного лікування ІІ, призначали по 10–20 мл (2–4 г) Кормагнезіну внутрішньовенно краплинно повільно (перші 2 мл протягом 3 хв) один раз на добу протягом 5 днів у положенні лежачи. Контрольну групу становили 20 хворих, у яких стандартна терапія ІІ включала введення 25% розчину магнезії по 5 мл внутрішньовенно.
Пацієнтам проводились клініко-неврологічне обстеження, огляд очного дна, комп’ютерна томографія головного мозку за допомогою томографа Aquilion, транскраніальна допплерографія (допплерограф Multigon 500M). Ступінь пригнічення свідомості визначався за шкалою коми Глазго: ясна свідомість — 15 балів, оглушення — 14–13, сопор — 12–9, кома — 8–4, позамежна кома — 3 бали. Вираженість неврологічних розладів оцінювали за шкалою Національного інституту здоров’я США (National Institute of Health Stroke Scale — NIHSS). За цією шкалою сумарний бал клінічних проявів від 3 до 8 свідчить про неврологічні порушення легкого ступеня тяжкості, від 9 до 12 — про порушення середнього ступеня тяжкості, від 13 до 15 — тяжкі порушення, понад 15 — про надто тяжкий ступінь неврологічних розладів.
Для визначення результативності проведеної терапії, характеристики досягнутого рівня повсякденної життєвої активності та функціонального результату у хворих застосовували індекс Бартел. Оцінку проводили в кінці спостереження, через 3 місяці від початку лікування. Значення індексу в межах від 0 до 50 балів відповідає тяжкій інвалідності хворого й залежності від сторонньої допомоги, 50–75 балів — помірній інвалідності, від 75 до 100 балів — мінімальному обмеженню або повному відновленню неврологічних функцій. Показники понад 60 балів відносили до сприятливих функціональних наслідків інсульту; менше ніж 60 балів — до несприятливих наслідків захворювання. Сумарна оцінка функціонального стану хворого: відмінно — індекс Бартел ≥ 95, NIHSS — 0–1 бал; добре — індекс Бартел 94–60 балів, NIHSS — 2–8 балів.
Результати
Середній вік хворих в основній і контрольній групі становив 75,2 ± 15,0 і 73,3 ± 13,0 року відповідно. У 13 хворих основної групи гостре порушення мозкового кровообігу виникло в лівому каротидному басейні, у 14 — у правому каротидному, у 3 — у вертебрально-базилярному. Частка хворих із порушенням свідомості на початку захворювання серед пацієнтів основної групи становила 70 %, при цьому середній бал за шкалою коми Глазго дорівнював 11,300 ± 0,649. Контрольна група пацієнтів була статистично порівнянною за відповідними показниками (65 %; 12,950 ± 0,554 бала; p > 0,05). Спектр розладів свідомості хворих на першу і п’яту добу інсульту відображено на рис. 1.
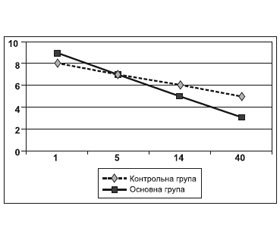
Протягом найгострішого періоду в більшості пацієнтів обох груп спостерігалося зменшення загальномозкової симптоматики, регресували менінгеальні ознаки й прояви набряку диска зорового нерва. Загальна оцінка рівня свідомості на п’яту добу інсульту виявила суттєву позитивну динаміку на фоні лікування Кормагнезіном, оскільки рівень свідомості в середньому зріс до 14,800 ± 0,113 бала (p < 0,05). Динаміку показника рівня свідомості за шкалою коми Глазго у хворих основної й контрольної груп показано на рис. 2.
/22.jpg)
Слід відзначити, що в 47,6 % пацієнтів основної групи, які перебували у стані оглушення, сопору або коми на початку розвитку інсульту, найвідчутніше зростання рівня свідомості (більше ніж на 1 бал) спостерігалось протягом 2–3-ї доби лікування. У групі контролю позитивні зміни не досягли статистичної значимості. Цей факт викликає зацікавлення, оскільки відомо, що саме в цей період розвиток набряку головного мозку є найзагрозливішим. Відома пряма кореляція набряку мозку з мас-ефектом, зміщенням серединної лінії, розміром інфаркту, вираженістю неврологічного дефіциту та наслідками інсульту. Перш за все це пояснюється збільшенням тиску в екстравазальному просторі, стисненням важливих судин і паренхіми мозку, посиленням дисциркуляторних розладів, поглибленням і поширенням ішемічних порушень у найбільш ураженій ділянці. Крім того, уклинення мозку спричиняє стиснення сільвієвого водопроводу й субарахноїдального простору, порушення циркуляції спинномозкової рідини, появу гідроцефалії та гіпертензії в супратенторіальному просторі. Іншим потенційним ускладненням набряку є виникнення ішемічного вогнища на відстані. Наприклад, зміщення набряклої півкулі поперек порожнини черепа загрожує вклиненням поясної звивини в серп великого мозку з подальшим стисненням передньої мозкової артерії і формуванням інфаркту в її басейні. Низхідне зміщення середнього мозку й мосту іноді асоціюється з появою парамедіанних ішемічних чи геморагічних вогнищ у стовбурі внаслідок натягання медіальних пенетрувальних гілок основної артерії, фіксованої в ділянці вілізієвого кола. Окрім стиснення артерій, мас-ефект з дислокацією може призводити до погіршення відтоку по церебральних венах. Так, центральне транстенторіальне вклинення проміжного й середнього мозку внаслідок рострокаудального зміщення через вирізку намету мозочка викликає стиснення великої вени мозку і суттєво збільшує гідростатичний тиск у її дренажній системі. Цим, зокрема, можна пояснити виникнення вторинної геморагії як у вогнищі інфаркту мозку, так і на відстані від нього. Вип’ячування під краєм вирізки намету мозочка гачка і гіпокампальної звивини відповідної скроневої частки супроводжується притисненням поруч розміщеного середнього мозку до протилежного краю вирізки намету. На транстенторіальне вклинення припадає 78 % летальних випадків ішемічного і 93 % геморагічного інсульту протягом першого тижня їх розвитку. Найчастіше набряк тканини мозку досягає своїх максимальних проявів на 2-гу — 4-ту добу від початку інсульту й поступово зменшується протягом одного-двох тижнів. Припускається, що більша частота дислокації мозку протягом першого тижня більшою мірою залежить від швидкості накопичення рідини, а не від абсолютного її об’єму [22].
В обох досліджуваних групах клінічні прояви значною мірою визначались початковим неврологічним дефіцитом, об’ємом і локалізацією вогнища інфаркту, соматичним станом хворих. Швидший регрес неврологічних порушень відзначався в разі початкових розладів легкого й середнього ступеня тяжкості. Динаміка неврологічного дефіциту в основній і контрольній групах наведена на рис. 3.
За даними транскраніальної допплерографії церебральні гемодинамічні розлади в перші години розвитку інфаркту мозку характеризувались суттєвим дефіцитом мозкової перфузії. Про це свідчить вірогідне зниження вихідних показників об’ємного мозкового кровотоку по внутрішніх сонних, хребетних артеріях на боці вогнища інфаркту й у протилежній півкулі мозку. Поширена гіпоперфузія могла бути спричинена такими патогенетичними механізмами інсульту, як тромбоз, кардіоемболія, гемодинамічно значимий стеноз магістральних артерій, порушення реологічних властивостей крові й мікроциркуляції. З іншого боку, вагомий внесок у перебіг дисциркуляторних порушень вносить виникнення цитотоксичного й вазогенного набряку головного мозку.
У поодиноких випадках (3 хворі основної й 4 пацієнти контрольної групи) з кардіоемболічним інфарктом мозку виявлялась рання (на 1-шу — 3-тю добу) гіперперфузія інфарктної тканини. Ще у 2 пацієнтів надлишкова перфузія визначалась на 4-ту — 7-му добу після розвитку інфаркту мозку. Причинами гіперперфузії мозкової тканини в інсультних хворих вважають накопичення у позаклітинному просторі кислих метаболітів, порушення реактивності судин, зрив реакції авторегуляції мозкового кровотоку, венозну гіперволемію.
У найгострішому періоді ішемічного інсульту також виявляли переважне зниження діастолічної й середньої швидкості мозкового кровотоку, загострення систоли, різке збільшення індексу пульсативності, що непрямо свідчило про збільшення внутрішньочерепного тиску. На тлі введення Кормагнезіну виявлено вірогідне поліпшення цих показників. На нашу думку, початкове дифузне зниження кровотоку не лише в ураженому басейні й позитивна динаміка показника середньої швидкості по магістральних артеріях мозку свідчать про більшу патогенетичну роль набряку мозку щодо цих показників, ніж хронічних морфологічних змін церебральних судин на початку інсульту. Основні зміни показників церебральної гемодинаміки у хворих на ішемічний інсульт при застосуванні Кормагнезіну відображені в табл. 1.
/23.jpg)
Проведена терапія сприяла досягненню вищого рівня повсякденної життєвої активності та функціонального результату у хворих. Значення індексу Бартел до 50 балів, що означало залежність від сторонньої допомоги, виявлено у 3 (10 %) хворих основної групи і 5 (25 %) пацієнтів контрольної. Помірна інвалідність (50–75 балів) — у 6 (20 %) і 8 (40 %) хворих відповідно. Повне відновлення неврологічних функцій або мінімальне обмеження (75–100 балів) відзначались у 21 (70 %) випадку застосування Кормагнезіну і в 7 (35 %) випадках використання низьких доз сульфату магнію. Отже, відсоток сприятливих функціональних наслідків інсульту в основній групі вдвічі перевищував відповідний показник контрольної групи (рис. 4).
/23_2.jpg)
Щодо переносимості препарату Кормагнезін, то побічних реакцій не було зафіксовано. Ураховуючи необхідність підтримання достатнього церебрального перфузійного тиску, який визначається різницею між артеріальним і внутрішньочерепним тиском, особлива увага приділялась впливу препарату на рівень артеріального тиску. На тлі застосування Кормагнезіну у хворих зниження показників систолічного, діастолічного й середнього артеріального тиску не перевищувало 15 % від початкового рівня, що було особливо важливо з огляду на поширеність ознак внутрішньочерепної гіпертензії в більшості пацієнтів. В одному випадку, незважаючи на введення магнезії, спостерігалося стійке підвищення артеріального тиску, що вимагало додаткової гіпотензивної терапії.
Висновки
Використання Кормагнезіну в найгострішому періоді ішемічного інсульту сприяє швидшому відновленню свідомості пацієнтів і зменшенню загальномозкової симптоматики порівняно з традиційною терапією, поліпшенню показників церебральної гемодинаміки за рахунок підвищення перфузії мозкової тканини й зменшення периферичного судинного опору, регресу неврологічного дефіциту й покращанню функціонального результату після інсульту. Введення Кормагнезіну в досліджуваній дозі характеризується задовільним профілем безпечності й переносимості і може бути рекомендованим для повсякденної неврологічної практики.
Список литературы
1. Saver J.L., Starkman S., Eckstein M., Stratton S.J., Pratt F.D., Hamilton S. et al. for the FAST-MAG Investigators and Coordinators // N. Engl. J. Med. — 2015. — Vol. 372. — P. 528-536. DOI: 10.1056/NEJMoa1408827.
2. Adeoye O., Hornung R., Khatri P., Kleindorfer D. Recombinant tissue-type plasminogen activator use for ischemic stroke in the United States: a doubling of treatment rates over the course of 5 years // Stroke. — 2011. — Vol. 42. — P. 1952-1955.
3. Saver J.L., Starkman S. Magnesium in clinical stroke // Magnesium in the Central Nervous System / Ed. by Vink R., Nechifor M. — The University of Adelaide: The University of Adelaide Press, 2011. — P. 205-216.
4. Saver J.L. Improving reperfusion therapy for acute ischaemic stroke // J. Thromb. Haemost. — 2011. — Vol. 9 (1). — P. 333-343.
5. Moretti A., Ferrari F., Villa R.F. Neuroprotection for ischaemic stroke: Current status and challenges // Pharmacology & Therapeutics 2015. — Vol. 146. — P. 23-34.
6. Muir K.W. Magnesium for neuroprotection in ischaemic stroke: rationale for use and evidence of effectiveness // CNS Drugs. — 2001. — Vol. 15. — P. 921-930.
7. Romani A.M. Cellular magnesium homeostasis // Arch. Biochem. Biophys. — 2011. — Vol. 512. — P. 1.-23. http://www.darujps.com/sfx_links?ui=2008-2231-20-74&bibl=B3
8. Hafez H., Abdelkader A., Elagaty A., Bakry M., Nawito A., Elwahab Y. Cerebral protective effect of magnesium during CABG assessed by cerebral oximetry and cognitive P300 visual evoked potentials // World Journal of Medical Sciences. — 2013. — Vol. 8. — P. 339-344.
9. De Baaij J.H.F., Hoenderop J.G.J., Bindels R.J.M. Magnesium in Man: Implications for Health and Disease // Physiological Reviews. — 2015. — Vol. 95, № 1. — P. 1-46. DOI: 10.1152/physrev.00012.2014.
10. Intravenous Magnesium Efficacy in Stroke (IMAGES) Study Investigators. Magnesium for acute stroke (Intravenous Magnesium Efficacy in Stroke trial): randomised controlled trial // Lancet. — 2004. — Vol. 363. — P. 439-445.
11. Aslanyan S., Weir C.J., Muir K.W., Lees K.R. and Investigators IS. Magnesium for treatment of acute lacunar stroke syndromes: further analysis of the IMAGES trial // Stroke. — 2007. — Vol. 38. — P. 1269-1273. http://dx.doi.org/10.1161/01.STR.0000259628.94421.09 PMid:17347471
12. Muir K.W., Lees K.R., Ford I., Davis S. Magnesium for acute stroke (Intravenous Magnesium Efficacy in Stroke trial): randomised controlled trial // Lancet. — 2004. — Vol. 363. — P. 439-445.
13. Saver J.L., Kidwell C., Eckstein M., Starkman S. and Investigators F-MPT. Prehospital neuroprotective therapy for acute stroke: results of the Field Administration of Stroke Therapy-Magnesium (FAST-MAG) pilot trial // Stroke. — 2004. — Vol. 35 (5). — Р. e106-е108.
14. Mousavi S.A., Ziaei J., Saadatnia M. Magnesium Sulfate in Acute Stroke: A Randomized Double-Blind Clinical Trial // Journal of Research in Medical Sciences. — 2004. — Vol. 9 (4). — P. 158-161. http://journals.mui.ac.ir/jrms/article/view/908
15. Wong G.K.C., Boet R., Poon W.S., Chan M.T.V., Gin T., Ng S.C.P., Zee B.C.Y. Intravenous magnesium sulphate for aneurysmal subarachnoid hemorrhage: an updated systemic review and meta-analysis // Critical Care Medicine. — 2011. — Vol. 15. — R52.
16. Vergouwen M.D.I. Magnesium sulfate for aneurysmal subarachnoid hemorrhage: the end of the road or more trials? // Critical Care. — 2011. — Vol. 15. — P. 140. doi:10.1186/cc10055
17. Van den Bergh W. Magnesium in subarachnoid hemorrhage // Magnesium in the Central Nervous System / Ed. by Vink R., Nechifor M. — The University of Adelaide The University of Adelaide Press, 2011. — P. 193-204.
18. Saver J.L., Starkman S., Eckstein M. et al. Methodology of the Field Administration of Stroke Therapy-Magnesium (FAST-MAG) phase 3 trial: part 1 — rationale and general methods // Int. J. Stroke. — 2014. — Vol. 9 (2). — P. 215-219.
19. Saver J.L., Starkman S., Eckstein M., et al. Methodology of the Field Administration of Stroke Therapy-Magnesium (FASTMAG) phase 3 trial: part 2 — prehospital study methods // Int. J. Stroke. — 2014. — Vol. 9 (2). — P. 220-225.
20. McKee J.A., Brewer R.P., Macy G.E., Phillips-Bute B., Campbell K.A., Borel C.O. et al. Analysis of the brain bioavailability of peripherally administered magnesium sulfate: A study in humans with acute brain injury undergoing prolonged induced hypermagnesemia // Critical Care Medicine. — 2005. — Vol. 33 (3). — Р. 661-666.
21. Кормагнезин. Компендиум. Лекарственные препараты online. http://pda.compendium.com.ua/info/200183/woerwag-pharma/kormagnezin-sup-sup-200.
22. Варлоу Ч.П., Деннис М.С., ван Гейн Ж. Инсульт. Практическое руководство для ведения больных: Пер. с англ. — СПб., 1998. — 629 с.
Уперше опубліковано в «Українському неврологічному журналі», 2015, № 4

/22.jpg)
/23.jpg)
/23_2.jpg)