Статья опубликована на с. 53-58
Широкое распространение вирусных гепатитов В и С, их склонность к хронизации с развитием инвалидизирующих и порой фатальных осложнений (цирроз, гепатокарцинома) составляют глобальную проблему человечества. Особую опасность эти инфекции представляют у иммуноскомпрометированных пациентов. В частности, на фоне онкогематологической патологии активная инфекция, вызванная вирусами гепатита В (ВГВ) или С (ВГС), может не только оказывать повреждающее действие на печень, но также быть причиной приостановки или даже отмены жизненно важной химиотерапии [16].
Опухолевый процесс и проведение лучевой и химиотерапии приводят к снижению иммунного контроля и активации латентной инфекции. Большинство наблюдений посвящено активации ВГВ-инфекции, однако на фоне широкого использования моноклональных антител в онкогематологической практике также появились сообщения о реактивации ВГС-инфекции [15, 32]. В исследованиях, включавших взрослых пациентов с онкогематологическими заболеваниями (ОГЗ), реактивация ВГВ-инфекции на фоне иммуносупрессивной терапии отмечена почти у 50 % больных [31]. Состояние этой проблемы в детском возрасте освещено лишь в единичных публикациях [17, 19].
Помимо реактивации, в периоде лечения онкогематологических пациентов может также происходить заражение с развитием острой ВГВ- или ВГС-инфекции. Среди факторов заражения значительную роль играют инвазивные манипуляции и переливания препаратов крови [19, 22]. Было показано, что риск инфицирования больных вирусами гепатитов при ОГЗ прямо пропорционален числу единиц получаемой крови и ее препаратов [17, 18].
Пациенты с ОГЗ вследствие повышенного риска инфицирования и реактивации подлежат обследованию на вирусные гепатиты В и С. Ведущие современные руководства рекомендуют проводить обследование на ВГВ до начала химиотерапии и в дальнейшем по показаниям проводить контрольные определения [15, 23]. Ведущая роль в диагностике вирусных гепатитов на сегодняшний день принадлежит молекулярным методам диагностики, в частности полимеразной цепной реакции (ПЦР). Показатели количественной ПЦР (вирусная нагрузка) используются не только для уточнения инфицированности, но и для определения показаний к назначению противовирусных средств и оценки эффективности проводимой терапии.
Большинство современных тестов для количественного определения ДНК HBV, основанного на ПЦР в реальном времени, имеют широкий линейный диапазон измерений — от 5 до 200 МЕ/мл. При использовании тест-систем с низкой чувствительностью отрицательный результат ошибочно свидетельствует об отсутствии инфекции.
Современные тесты ПЦР позволяют выявлять сверхмалые концентрации вируса (до 5–10 IU/ml), что дает возможность избежать многих диагностических ошибок, своевременно начать лечение, предупредить или отсрочить развитие инвалидизирующих или фатальных осложнений [12].
Всемирная организация здравоохранения (ВОЗ) определила международный стандарт для унификации описания концентраций ДНК HBV: данный показатель в сыворотке следует выражать в МЕ/мл, чтобы обеспечить возможность сравнения результатов. У одного пациента необходимо использовать один метод исследования для оценки эффективности ПВТ.
Лечебная тактика по отношению к детям с ОГЗ и ВГВ современными руководствами описывается достаточно однозначно. В период химиотерапии и не менее 12 месяцев после ее окончания рекомендуется использовать нуклеозидные/нуклеотидные аналоги [15, 23]. При коротких курсах возможно использование ламивудина, а при более длительной терапии — препараты с более высоким генетическим барьером резистентности (энтекавир, тенофовир). Относительно гепатита С у больных с ОГЗ на сегодняшний день нет специальных рекомендаций по ведению [20, 25]. Единственная схема лечения, рекомендуемая сейчас в педиатрической практике, базируется на комбинации интерферона-альфа с рибавирином.
Показатели эффективности терапии у пациентов с ОГЗ обычно ниже, чем в основной популяции [8]. При ВГВ у детей без ОГЗ устойчивый вирусологический ответ (УВО) получен у 40–80 % детей [1, 2, 21]. У детей с ВГВ на фоне ОГЗ УВО при моноинтерферонотерапии был получен у 17,1 %, при ВГС — ни у одного ребенка [9]. S. Ansari и соавт. (2006) при лечении ВГС препаратами интерферона у детей с ОГЗ получили УВО в 26 % случаев, А.Р. Рейзис (2002) — в 24,5 % случаев. При комбинированной терапии (интерферон + рибавирин) ВГС у детей без ОГЗ в стадии ремиссии УВО был получен в 38 % случаев при 1-м генотипе и в 82 % — при 2-м и 3-м генотипе [13], у детей с ОГЗ в стадии ремиссии УВО получен в 67 % случаев [8, 11, 13].
В клинике кафедры детских инфекционных болезней НМУ им. А.А. Богомольца под наблюдением находилось 108 детей с ВГ, страдающих различными онкологическими заболеваниями (ОЗ) и прошедших курс рентгенотерапии (РТ) и полихимиотерапии (ПХТ), а также 46 детей с ОЗ, получивших только оперативное лечение заболевания.
Терапия ВГ не назначалась в случаях наличия у пациентов лейкопении (< 2,0 • 109/л), анемии (гемоглобин < 100 г/л), тромбоцитопении (< 150 • 109/л) или декомпенсированного заболевания печени. Также исключались пациенты с умеренной или тяжелой депрессией, психическими заболеваниями, судорогами, почечной недостаточностью, аутоиммунным гепатитом.
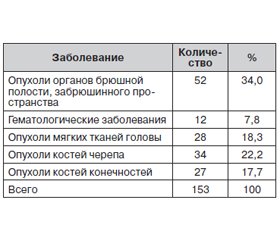
Перед началом терапии ВГ все дети находились в стадии комплексной ремиссии по онкологическому заболеванию. Длительность ремиссии была от 6 месяцев до 3 лет. Данные о нозологии онкологических заболеваний детей с ВГ представлены в табл. 1.
Дети находились в возрасте от 3 до 15 лет. Среди них была 71 девочка и 82 мальчика. У 109 пациентов (70,8 %) диагностирован ВГВ, у 44 — ВГС (29,2 %). Дети с ВГС имели следующие генотипы вируса: 1а — 11 детей (25 %), 1в — 13 детей (29,5 %), 3а — 20 (45,5 %) детей. Из этих детей 31 ребенок с ВГВ и 13 детей с ВГС прошли только оперативное лечение ОЗ без применения ПХТ и РТ.
При ВГВ 90 детей получали препараты рекомбинантного интерферона-альфа 2а и 2в в комбинации с ламивудином и 19 детей — монотерапию ламивудином. Доза альфа-интерферона при ВГВ составляла 5–6 млн МЕ/м2 3 раза в неделю, ламивудина — 3 мг/кг массы тела 1 раз в день, но не более 100 мг в сутки. Курс терапии длился 6–12 месяцев.
При ВГС 14 детей получали монотерапию препаратами рекомбинантного интерферона-альфа 2а и 2в в дозе 3 млн МЕ/м2 3 раза в неделю, 30 детей — комбинированную терапию альфа-интерфероном и препаратами рибавирина в дозе 15 мг/кг массы тела в день в 2 приема. Курс терапии составлял 6–12 месяцев.
Эффективность противовирусной терапии ВГ В и С у детей с ОЗ представлена в табл. 2–4.
Как видно из табл. 2, лечение ВГВ у детей с ОЗ только ламивудином было неэффективным. Ни в одном случае не удалось достичь УВО.
Монотерапия интерфероном ВГС у детей с ОЗ оказалась также неэффективной. Ни в одном случае при всех генотипах вируса не удалось получить УВО. По сравнению с 1-м более эффективной является терапия 3-го генотипа, что совпадает с данными, полученными при лечении ХГС у детей без ОЗ [8]. Однако полученные результаты требуют дальнейшего изучения в связи с недостаточным количеством больных, входящих в группы наблюдения.
Нами была проанализирована эффективность противовирусной терапии ВГ у детей с ОЗ в зависимости от сроков ее начала после окончания курса ПХТ и РТ. В литературе есть данные о том, что у детей с ВГС без ОЗ наибольший эффект противовирусной терапии имеет место при длительности заболевания не более 3 лет [7]. Данные собственных исследований представлены в табл. 5.
Из табл. 5 следует, что существует прямая корреляционная зависимость между эффективностью противовирусной терапии ВГС у детей с ОЗ и сроками окончания ПХТ и РТ, что, по-видимому, связано с восстановлением морфофункционального состояния печени и ликвидацией иммуносупрессии.
В работе была изучена сравнительная эффективность противовирусной терапии ВГ у детей с ОЗ, получивших только оперативное лечение заболевания, и детей, прошедших комбинированную терапию с применением ПХТ и РТ (табл. 6, 7).
Из табл. 6 и 7 видно, что применение ПХТ и РТ существенно влияет на эффективность лечения ВГ у детей с ОЗ. Частота УВО в группах сравнения достоверно была выше — в 4,3 раза при ВГВ и в 4,1 раза при ВГС у детей с ОЗ, не получавших иммуносупрессивную терапию.
Из литературы известно, что повышенный уровень АЛТ перед началом противовирусной терапии хронического вирусного гепатита (ХВГ) является предиктором эффективности терапии (10 AASLD Practice Guidline). Нами было изучено влияние этого показателя на эффективность терапии ХВГ у детей с ОЗ. Дети, получавшие монотерапию хронического гепатита В (ХГВ) ламивудином, не вошли в данное исследование. Данные представлены в табл. 8.
Из табл. 8 видно, что превышение уровня АЛТ в 1,5 раза и более — нормальный показатель перед началом противовирусной терапии ВГ — является предиктором ее эффективности. Так, если УВО у детей с исходным уровнем АЛТ меньше 1,5 нормы был достигнут у 8,3 % от получавших ПХТ и РТ, то у детей, получавших ПХТ и РТ, с уровнем АЛТ более 1,5 нормы он был достигнут в 28,6 % случаев, а у детей с ОЗ и повышенным уровнем АЛТ, не получавших ПХТ и РТ, — в 47,7 % случаев.
Кроме эффективности терапии ВГ у детей с ОЗ нами была изучена ее безопасность. В табл. 9 представлены побочные эффекты интерферонотерапии ВГ у детей с ОЗ.
На ламивудин у 5,3 % детей были зарегистрированы аллергические реакции в виде высыпаний на коже.
Частота побочных эффектов при проведении противовирусной терапии ВГ у детей с ОЗ не превышала таковую при лечении ВГ у детей без ОЗ, а их выраженность была легкой и средней степени тяжести и не требовала отмены лечения.
Выводы
1. Монотерапия ВГВ ламивудином и монотерапия ВГС простыми препаратами интерферона у детей с ОЗ неэффективна.
2. Эффективность комбинированной терапии ВГС у детей с ОЗ, вызванного 3-м генотипом вируса, превосходит терапию ВГС, вызванного 1-м генотипом вируса.
3. Оптимальное время начала противовирусной терапии ВГ у детей с ОЗ — не менее 36 месяцев после окончания ПХТ и РТ.
4. Повышение уровня АЛТ в 1,5 раза от нормы и более является предиктором эффективности терапии ВГ у детей с ОЗ.
5. В соответствии с последними рекомендациями современный подход к терапии больных ХГВ/С заключается в мониторировании вирусемии с максимально возможной на сегодня чувствительностью — 5 МЕ/мл на определенных этапах лечения, что позволяет прогнозировать эффективность терапии, риск развития резистентности в случае применения аналогов нуклеозидов/нуклеотидов и своевременно вносить изменения в схему ПВТ.
МЛ «ДИЛА» предлагает оптимальные комплексные решения
для диагностики и мониторинга эффективности противовирусной терапии
при вирусном гепатите В и С, регламентированные EASL,
Recommendations on Treatment of Hepatitis B, 2012;
EASL, Recommendations on Treatment of Hepatitis C, 2015
КДВ № 001
«Диагностика гепатита В перед интерферонотерапией»
HBsAg вируса гепатита В, антитела общие к HBsAg вируса гепатита В, НВеАg вируса гепатита В, антитела общие к НВеАg вируса гепатита В, обнаружение ДНК вируса гепатита В методом REAL TIME ПЦР — кровь (количественное определение), АЛТ, АСТ, мочевина, креатинин, билирубин общий, билирубин прямой, белковые фракции, глюкоза (венозная кровь), панкреатическая альфа-амилаза, холестерин, ГГТП, щелочная фосфатаза общая, Т3 своб., Т4 своб., АТТГ, АТПО, альфа-фетопротеин (АФП); скрининг заболеваний соединительной ткани (антинуклеарные антитела к антигенам (U1-RNP; SS-A/Ro; SS-B/La; centromere B; Scl-70; Jo-1; fibrillarin, RNA Pol III; Rib-P; PM-Scl; PCNA; Mi-2; Sm; Ds-DNA).
Срок исполнения — 5 (6,5) дней.
КДВ № 002
«Диагностика гепатита В перед терапией противовирусными препаратами прямого действия»
HBsAg вируса гепатита В, антитела общие к HBsAg вируса гепатита В, НВеАg вируса гепатита В, антитела общие к НВеАg вируса гепатита В, обнаружение ДНК вируса гепатита В методом REAL TIME ПЦР — кровь (количественное определение), АЛТ, АСТ, мочевина, креатинин, билирубин общий, билирубин прямой.
Срок исполнения — 5 (6,5) дней.
КДВ № 004
«Мониторинг эффективности лечения гепатита В — вирусологический ответ»
Антитела общие к HBsAg вируса гепатита В, антитела общие к НВеАg вируса гепатита В, обнаружение ДНК вируса гепатита В методом REAL TIME ПЦР — кровь (количественное определение), АЛТ, АСТ, общий анализ крови развернутый, мочевина, креатинин, билирубин общий, билирубин прямой, протромбиновый тест (протромбиновое время в секундах, процент протромбина по Квику, МНО).
Срок исполнения — 5 (6,5) дней.
КДВ № 23
«Диагностика гепатита С для выбора тактики лечения»
Обнаружение РНК вируса гепатита С методом REAL TIME ПЦР (количественное определение), генотипирование РНК вируса гепатита С (1, 2, 3) методом REAL TIME ПЦР — кровь, биоптат и др. (качественное определение). Иммуногенетика. Интерлейкин 28В (IL-28B).
Срок исполнения — 3 дня.
КДВ № 12
«Скрининг гепатита В и С»
Антитела к вирусу гепатита С — скрининг (Anti-HCV), антитела общие к HВcorAg гепатита В.
Срок исполнения — 1 (2) день.
КДВ № 93
«Диагностика гепатита В»
HBsAg вируса гепатита В, антитела общие к HBsAg вируса гепатита В, антитела общие к HBсorАg вируса гепатита В, антитела к HBсorАg вируса гепатита В IgM, НВеАg вируса гепатита В, антитела общие к НВеАg вируса гепатита В.
Срок исполнения — 1 (2) день.
Список литературы
1. Агаева С.Г. Влияние противовирусной терапии на течение хронического гепатита В у детей // Детские инфекции. — 2004. — № 1. — С. 33-35.
2. Березенко В.С. Клініко-патогенетичні особливості фіброгенезу печінки при хронічних гепатитах у дітей та шляхи його медикаментозної корекції: Автореф. дис… д-ра мед. наук. — К., 2007. — 37 с.
3. Желудкова О.Г., Бухны А.Ф., Финогенова Н.А. и соавт. Диагностика и лечение хронического гепатита у детей, больных злокачественными новообразованиями // Педиатрия. — 1996. — № 4. — С. 42-45.
4. Зайцев И.А., Заплотная А.А. Хронический гепатит В в вопросах и ответах. — К., 2006. — 112 с.
5. Маер К.П. Гепатит и последствия гепатита. — М.: ГЭОТАР, 1999. — 423 с.
6. Рейзис А.Р., Нурмухамедова Е.А. Клиническая онкогематология. — М.: ГЭОТАР, 2001. — С. 539-553.
7. Рейзис А.Р. Противовирусное лечение хронического гепатита С у детей и подростков // Медицинская кафедра. — 2002. — № 2. — С. 30-36.
8. Рейзис А.Р. Принципы интерферонотерапии вирусных гепатитов у детей с онкогематологическими заболеваниями // Вопросы гематологии/онкологии и иммунопатологии в педиатрии. — 2002. — № 1. — С. 48-50.
9. Россина А.Л., Смирнов А.В., Моисеенко Е.И. и соавт. Лечение хронических гепатитов В и С у детей с онкогематологическими заболеваниями рекомбинантным интерфероном α2в // Детские инфекции. — 2003. — № 1. — С. 27-28.
10. AASLD Practice Guidline. Diagnosis, Management, and Treatment Hepatitis C (B. Doris et al.) // J. Hepatol. — 2004. — V. 39. — P. 1147-1171.
11. Ansari S., Vossogh P., Bateni F., Tabarroki A. Treating children with chronic hepatitis C after malignancy // 24th European society for paediatric infectious diseases — ESPID. — Basel, 2006. — P. 247.
12. Caliendo A.M., Valsamakis A., Zhou Y. et al. Multilaboratory comparison of hepatitis C virus viral load assays // J. Clin. Microbiol. — 2006. — 44 (5). — 1726-32. doi: 10.1128/JCM.44.5.1726-1732.2006.
13. Christensson B., Wiebe T., Akeson A., Widell A. Interferon-alfa and ribavirin treatment of hepatitis C in children with malignancy in remission // Clin. Infect. Dis. — 2000. — V. 30. — P. 585-586.
14. Coppola N., Pisaturo M., Guastafierro S. et al. Increased hepatitis C viral load and reactivation of liver disease in HCV RNA-positive patients with onco-haematological disease undergoing chemotherapy // Dig. Liver Dis. — 2012. — 44 (1). — 49-54. doi: 10.1016/j.dld.2011.07.016.
15. European Association For The Study Of The Liver. EASL Clinical Practice Guidelines: Management of chronic hepatitis B virus infection // J. Hepatol. — 2012. — 30 (2). doi: 10.1016/j.jhep.2012.02.010.
16. Huang Y.-W., Chung R.T. Management of hepatitis B reactivation in patients receiving cancer chemotherapy // Therap. Adv. Gastroenterol. — 2012. — 5 (5). — 359-70. doi: 10.1177/1756283X12450245.
17. Jonas M.M., Zilleruelo G.E., LaRue S.I. et al. Hepatitis C in a pediatric dialysis population // Pediatrics. — 1992. — V. 89. — P. 707-709.
18. Kfalifa A.S., Mitchell G.M., Warts D.M. et al. Prevalence of hepatitis C viral antibody in transfused and non-transfused Egyptian children // Am. J. Trop. Med. Hyg. — 1993. — V. 49. — P. 316-321.
19. Kološová A., Gašparovič J. [Outbreak of viral hepatitis B and C in hospitalized cancer patients]. Epidemiol Mikrobiol Imunol Cas Spol pro Epidemiol a Mikrobiol Ces lékarské // Spol J.E. Purkyne. — 2014. — 63 (4). — 260-4. Available at. — http://www.ncbi.nlm.nih.gov/pubmed/25523217. Accessed March 3, 2016.
20. Mack C.L., Gonzalez-Peralta R.P., Gupta N. et al. NASPGHAN practice guidelines: Diagnosis and management of hepatitis C infection in infants, children, and adolescents // J. Pediatr Gastroenterol. Nutr. — 2012. — 54 (6). — 838-55. doi: 10.1097/MPG.0b013e318258328d.
21. Moraru E., Antonesei L., Sacaci P. et al. Chronic hepatitis B in children long-term surveillance and evolutive pathways // J. Hepatology. — 2007. — V. 46. — Suppl. 1. — P. 259.
22. Pozzetto B., Memmi M., Garraud O., Roblin X., Berthelot P. Health care-associated hepatitis C virus infection // World J. Gastroenterol. — 2014. — 20 (46). — 17265-78. doi: 10.3748/wjg.v20.i46.17265.
23. Sokal E.M., Paganelli M., Wirth S. et al. Management of chronic hepatitis B in childhood. — ESPGHAN clinical practice guidelines // J. Hepatol. — 2013. — 59 (4). — 814-829. doi: 10.1016/j.jhep.2013.05.016.
24. Wang Y., Luo X.-M., Yang D. et al. Testing for hepatitis B infection in prospective chemotherapy patients: a retrospective study // World J. Gastroenterol. — 2013. — 19 (6). — 923-30. doi: 10.3748/wjg.v19.i6.923.
25. Yazici O., Sendur M.A.N., Aksoy S. Hepatitis C virus reactivation in cancer patients in the era of targeted therapies // World J. Gastroenterol. — 2014. — 20 (22). — 6716-24. doi: 10.3748/wjg.v20.i22.6716.
26. Yeo W., Zee B., Zhong S. et al. Comprehensive analysis of risk factors associating with Hepatitis B virus (HBV) reactivation in cancer patients undergoing cytotoxic chemotherapy // Br. J. Cancer. — 2004. — 90 (7). — 1306-11. doi: 10.1038/sj.bjc.6601699.
27. Pozzetto B., Memmi M., Garraud O., Roblin X., Berthelot P. Health care-associated hepatitis C virus infection // World J. Gastroenterol. — 2014. — 20 (46). — С. 17265-78. doi: 10.3748/wjg.v20.i46.17265.
28. Sevinir B., Meral A., Günay U., Ozkan T., Ozuysal S., Sinirtas M. Increased risk of chronic hepatitis in children with cancer // Med. Pediatr. Oncol. — 2003. — 40 (2). — С. 104-10. doi: 10.1002/mpo.10090.
29. Sokal E.M., Paganelli M., Wirth S. et al. Management of chronic hepatitis B in childhood: ESPGHAN clinical practice guidelines // J. Hepatol. — 2013. — 59 (4). — 814-829. doi: 10.1016/j.jhep.2013.05.016.
30. Usta M., Urgancı N., Yıldırmak Z.Y., Dogan Vural S. Chronic hepatitis B in children with or without malignancies: a 13-year follow-up // World J. Gastroenterol. — 2015. — 21 (7). — С. 2073-9. doi:10.3748/wjg.v21.i7.2073.
31. Wang Y., Luo X.-M., Yang D. et al. Testing for hepatitis B infection in prospective chemotherapy patients: a retrospective study // World J. Gastroenterol. — 2013. — 19 (6). — 923-30. doi: 10.3748/wjg.v19.i6.923.
32. Yazici O., Sendur M.A.N., Aksoy S. Hepatitis C virus reactivation in cancer patients in the era of targeted therapies // World J. Gastroenterol. — 2014. — 20 (22). — 6716-24. doi: 10.3748/wjg.v20.i22.6716.
/54.jpg)

/55.jpg)
/56.jpg)