Журнал «Актуальная инфектология» 1 (10) 2016
Вернуться к номеру
Инновационный подход к индивидуализации лечения детей с острыми респираторными инфекциями
Авторы: Волянская Л.А., Бурбела Е.И., Мудрик У.М. - ГВУЗ «Тернопольский государственный медицинский университет имени И.Я. Горбачевского»; Евтушенко С.В. - КУТОС «Тернопольская областная детская клиническая больница»
Рубрики: Инфекционные заболевания
Разделы: Справочник специалиста
Версия для печати
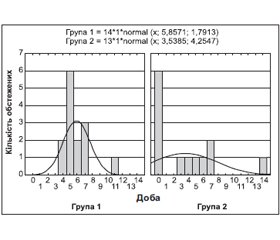
Під нашим спостереженням перебували 27 дітей віком від 10 міс. до 10 років, хворих на гострі респіраторні інфекції, з яких 14 пацієнтам введено до харчового раціону функціональний харчовий продукт із рослинної сировини «Пилок квітковий з розчинною клітковиною» та продукти для спеціального харчування «Олія вівса, ліпофільний комплекс», «Олія чорного кмину, ліпофільний комплекс». Проведений аналіз клінічної симптоматики показав відсутність відмінностей у перебігу захворювання, тривалості симптомів гострих респіраторних інфекцій та терапії при обох способах лікування за дуже подібної клінічної картини на старті хвороби. Обсяг лікувального комплексу в другій групі (13 хворих) був вірогідно більшим за кількістю застосованих препаратів, а вартість — суттєво вищою, ніж у групі порівняння. Тому запропонована схема лікування з корекцією харчування функціональними харчовими продуктами з рослинної сировини може бути рекомендована для практичного застосування.
Под нашим наблюдением находилось 27 детей в возрасте от 10 мес. до 10 лет, больных острыми респираторными инфекциями, из которых 14 пациентам введен в пищевой рацион функциональный питательный продукт растительного сырья «Пыльца цветочная, клетчатка растворимая» и продукты для специального питания «Масло семян овса, липофильный комплекс», «Масло черного тимьяна, липофильный комплекс». Проведенный анализ клинической симптоматики показал отсутствие различий в течении заболевания, длительности симптомов острых респираторных инфекций и периода терапии при обоих способах лечения при условии очень схожей клинической картины на старте болезни. Объем лечебного комплекса во второй группе (13 больных) был существенно большим по количеству применения препаратов, а стоимость — существенно выше, чем в группе сравнения. Поэтому предложенная схема лечения с коррекцией питания функциональными питательными продуктами из растительного сырья может быть рекомендована для практического использования.
Under our supervision, there were 27 children aged 10 months to 10 years suffering from acute respiratory infections, in 14 of them we have introduced to the diet the functional food from plant material «Pollen with soluble fiber» and food for special use «Oat oil, lipophilic complex», «Black cumin oil, lipophilic complex». The analysis of the clinical symptoms showed no difference in the disease course, duration of symptoms of acute respiratory infections and therapy in both methods of treatment, with very similar clinical picture at the onset of the disease. Medical complex in the second group (13 patients) was significantly larger by the number of applied drugs, and the cost — significantly higher than in the comparison group. Therefore, the proposed treatment regimen with diet modification using functional foods from plant material can be recommended for practical use.
гострі респіраторні інфекції, діти, лікування.
острые респираторные инфекции, дети, лечение.
acute respiratory infections, children, treatment.
Статтю опубліковано на с. 66-70
Вступ
Матеріали та методи дослідження
/68.jpg)
Обговорення результатів дослідження
Висновок
1. Печінка А.М. Гострі респіраторні захворювання: питання клінічної діагностики та лікування / А.М. Печінка, М.І. Дземан // Укр. мед. часопис. — 2010. — № 5 (79). — С. 94-103.
2. Шамшева О.В. Лечение и профилактика рецидивирующих респираторных инфекций у детей / О.В. Шамшева, В.Ф. Учайкин // Детские инфекции. — 2008. — № 3. — С. 50-52.
3. Ключников С.О. Острые респираторные заболевания у детей: Пособие для врачей / С.О. Ключников, О.В. Зайцева, И.М. Османов. — М., 2009. — 35 с.
4. Самсыгина Г.А. Инфекции респираторного тракта у детей раннего возраста / Под ред. Г.А. Самсыгиной. — М.: Миклош, 2006. — 279 с.
5. Dellepiane R.M. Atopyin preschool Italian children with recurrent respiratory infections / R.M. Dellepiane, P. Pavesi, M.F. Patria, E. Laicini, G. DiLandro, & M.C. Pietrogrande // La Pediatrica Medica e Chirurgica. — 2009. — № 4. — Р. 161-164.
6. Arden K.E. Frequent detection of human rhinoviruses, paramyxoviruses, coronaviruses and bocavirus during acute respiratory tract infections / K.E. Arden, P. McErlean, M.D. Nissen, T.P. Sloots, I. M. Mackay // Journal of Medical Virology. — September, 2006. — Vol. 78 (9). — P. 1232-1240.
7. Couriel J. Assessment of the child with recurrent chest infections / J. Couriel // British Medical Bulletin. — March, 2002. — Vol. 61 (1). — P. 115-132.
8. Юлиш Е.И. Подходы к терапии острых респираторных заболеваний у часто и длительно болеющих детей / Е.И. Юлиш, Б.И. Кривущев, С.Я. Ярошенко // Здоровье ребенка. — 2011. — № 2 (29). — С. 95-99.
9. Наказ МОЗ від 16.07.2014 № 499 «Про затвердження та впровадження медико-технологічних документів зі стандартизації медичної допомоги при грипі та гострих респіраторних інфекціях» // Актуальная инфектология. — 2014. — № 3 (4). — С. 111-191.
10. Возианова Ж.И. Инфекционные и паразитарные болезни / Ж.И. Возианова. — К.: Здоров’я, 2001–2002. — Т. 1–3. — 2504 c.
11. Парфенов Ф.И. Энтерология на рубеже 20 и 21 веков / Ф.И. Парфенов // Рос. ж. гастроэнтер., гепатол., колопроктол. — 2004. — № 3. — С. 41-44.
12. Янковский Д.С. Микробная экология человека: современные возможности ее поддержания и восстановления / Д.С. Янковский. — К.: Эксперт ЛТД, 2005. — 362 с.
13. Steven R. Gill et al. Metagenomic Analysis of the Human Distal Gut Microbiome / R. Steven // Science. — 2006. — Vol. 312. — P. 1355-1359.
14. Богадельников И.В. Этюды о человеке и микроорганизмах: Монография / И.В. Богадельников. — Симферополь: ИТ «АРИАЛ», 2014. — 160 с.
15. Осипов Г. Невидимый орган — микрофлора человека [Электронный ресурс]. — Режим доступа: http://www.rusmedserv.com/microbdiag/ invisibleorgan.htm#b6.
16. Asquith M. An innately dangerous balancing act: intestinal homeostasis, inflammation, and colitis-associated cancer / M. Asquith, F. Powrie // J. Exp. Med. — 2010. — 207 (8). — С. 1573-1577.
17. Шендеров Б.А. Медицинская микробная экология: некоторые итоги и перспективы исследований / Б.А. Шендеров // Вестн. Рос. АМН. — 2005. — № 12. — С. 13-17.
18. Гриневич В.Б. Принципы коррекции дисбиозов кишечника [Электронный ресурс] / В.Б. Гриневич // MEDI.RU. — Режим доступа к журналу: http://medi.ru/doc/1951118.htm
19. Осипов Г.А. Количественный in situ микробиологический анализ по липидным маркерам в биологических жидкостях с использованием метода газовой хроматографии — масс-спектрометрии / Г.А. Осипов, Н.Ф. Федосова, К.В. Лядов // Здраво–охранение и медицинские технологии. — 2007. — № 5. — С. 20-23.
20. Янковский Д.С. Микрофлора и здоровье человека / Д.С. Янковский. — К.: ТОВ «Червона Рута-Турс», 2008. — 552 с.
1. Pechinka AM, Dzeman MI. [Acute respiratory infections: problems of clinical diagnosis and treatment]. Ukr.med.chasopy`s. 2010; 5(79):94-103.Ukrainian.
2. Shamsheva OV, Uchaykin VF [Treatment and prevention of recurrent respiratory infections in children]. Detskie infektsii. 2008; 3:50–52. Russian.
3. Klyuchnikov SO, Zaytseva OV, Osmanov IM. Ostryie respiratornyie zabolevaniya u detey [Acute respiratory infections in children]. Posobie dlya vrachey. M; 2009. 35p. Russian.
4. Samsyigina GA, editor. Infektsii respiratornogo trakta u detey rannego vozrasta. [Respiratory tract infections in young children]. M.: Miklosh; 2006. 279 р. Russian.
5. Dellepiane, RM, Pavesi P, Patria MF. Atopyin preschool Italian children with recurrent respiratory infections. La Pediatrica Medica e Chirurgica. 2009; 4:161-164. Italian.
6. Arden KE, McErlean P, Nissen MD, Sloots TP, Mackay IM. [Frequent detection of human rhinoviruses, paramyxoviruses, coronaviruses and bocavirus during acute respiratory tract infections]. Journal of Medical Virology. 2006;78(9):1232-1240.
7. Couriel J. [Assessment of the child with recurrent chest infections]. British Medical Bulletin. 2002;61(1):115-132.
8. Yulish EI, Krivuschev BI, Yaroshenko SYa. [Approaches to therapy of acute respiratory diseases have often and long ill children]. Zdorove rebenka. 2011;2(29):95-99. Russian
9. Nakaz MOZ vid 16.07.2014 №499 [Pro zatverdžennja ta vprovadžennja medyko-texnolohičnyx dokumentiv zi standartyzaciji medyčnoji dopomohy pry hrypi ta hostryx respiratornyx infekcijax]. Aktualnaya infektologiya. 2014;3(4):111-191. Ukrainian.
10. Vozianova ZhI. Infektsionnyie i parazitarnyie bolezni [Infectious and parasitic diseases]. Kyjiv: Zdorovja; 2001-2002. (1,2,3) 2504p. Russian.
11. Parfenov FI. [Enterology at the turn of the 20th and 21st centuries]. Ross. Zh. gastroenter., gepatol., krorproktol. 2004;(3):41-44. Russian.
12. Yankovskiy DS. Mikrobnaya ekologiya cheloveka: sovremennye vozmozhnosti ee podderzhaniya i vosstanovleniya [Microbial ecology of human: contemporary possibilities of maintaining and restoring]. – K.: Ekspert LTD, 2005:362 p. Russian.
13. Steven R.; authors. Metagenomic Analysis of the Human Distal Gut Microbiome. Science. -2006;(312):1355-1359. Ukrainian.
14. Bogadel'nikov IV. Etyudy o cheloveke i mikroorganizmakh: [monografіya]. [Sketches of man and microorganisms: monograph] – Simferopol' : IT «ARIAL», 2014:160 p.
15. Osipov G. The invisible organ – a microflora of man [Internet]. Aesthetic medicine [updates 2016 Junuary 29]. Available from: http://www.rusmedserv. com/microbdiag/invisibleorgan.htm#b6. Russian.
16. Asquith M, Powrie F. An innately dangerous balancing act: intestinal homeostasis, inflammation, and colitis-associated cancer. J. Exp. Med. 2010; 207 (8): 1573-1577.
17. Shenderov BA. [Medical microbial ecology: some results and perspectives]. Vestn. Ros. AMN. 2005; 12:13-17. Russian.
18. Grinevich VB, Zaharchenko SM, Osipov GA. Principles of correction of intestinal dysbiosis [Internet]. MEDI.RU. Available from: http://medi.ru/doc/1951118.htm. Russian.
19. Osipov GA, Fedosova NF, Lyadov KV. [Quantitative in situ microbiological analysis lipid markers in biological fluids using gas chromatography - mass spectrometry]. Zdravoohranenie i medicinskie tekhnologi. 2007; 5:20-23. Russian.
20. Yankovskij DS, Dyment GS. Mikroflora i zdorov'e cheloveka [Microflora and human health]. K.: Chervona Ruta-Turs; 2008. 552 р. Russian.

/67.jpg)
/69.jpg)