Журнал «Медицина неотложных состояний» 6 (69) 2015
Вернуться к номеру
Монооксид углерода: физиологическое значение и токсикология
Авторы: Курсов С.В.
Харьковская медицинская академия последипломного образования, кафедра медицины неотложных состояний и медицины катастроф
Рубрики: Медицина неотложных состояний
Разделы: Справочник специалиста
Версия для печати
Статья опубликована на с. 9-16
Химические и физические свойства. Монооксид углерода (угарный газ — СО) при нормальных условиях представляет бесцветный газ, лишенный запаха, который несколько легче воздуха (молярная масса 28,01 г/моль < 28,98 г/моль). При комнатных температурах CO малоактивен, его химическая активность значительно повышается при нагревании и в растворах. СО горит пламенем синего цвета (температура начала реакции 700 °C) на воздухе:
2СО + О2 → 2СО2.
Температура горения CO может достигать 2100 °C. Реакция горения является цепной, причем инициаторами служат небольшие количества водородсодержащих соединений (вода, аммиак, сероводород и др.). Образуется при горении углерода или соединений на его основе в условиях недостатка кислорода:
2C + O2 → 2CO
или при восстановлении диоксида углерода раскаленным углем:
CO2 + C ↔ 2CO.
Эта реакция часто происходит при печной топке, когда слишком рано закрывают печную заслонку (пока окончательно не прогорели угли). Образующийся при этом монооксид углерода, вследствие своей ядовитости, вызывает физиологические расстройства (угар) и даже смерть, отсюда и одно из названий — «угарный газ».
Благодаря такой хорошей теплотворной способности CO является компонентом разных технических газовых смесей (например, генераторного газа), используемых в том числе для отопления. В смеси с воздухом взрывоопасен. СО реагирует с галогенами. Наибольшее практическое применение получила реакция с хлором:
СО + Cl2 → COCl2.
Реакция является экзотермической, и в присутствии катализатора (активированного угля) она идет уже при комнатной температуре. В результате реакции образуется фосген — высокотоксичное вещество [1, 2].
Источники СО в атмосфере. В атмосферу СО попадает в составе вулканических и болотных газов в результате вспышки лесных и степных пожаров, выделения микроорганизмами, растениями, животными и человеком. Из поверхностных слоев океанов в год выделяется 220 • 106 тонн СО в результате фоторазложения красных, сине-зеленых и др. водорослей, продуктов жизнедеятельности планктона. Естественный уровень содержания оксида углерода в атмосферном воздухе — 0,01–0,9 мг/м3.
Угарный газ попадает в атмосферу от промышленных предприятий, в первую очередь металлургии. В металлургических процессах при выплавке 1 млн тонн стали образуется 320–400 тонн СО. Большое количество СО образуется в нефтяной промышленности и на химических предприятиях (крекинг нефти, производство формалина, углеводородов, аммиака и др.). Высокая концентрация СО может иметь место в угольных шахтах и на углеподающих трассах, поскольку СО образуется при самоокислении угля. СО также образуется при неполном сгорании топлива в печах и двигателях внутреннего сгорания [1–3].
В результате деятельности человека в атмосферу ежегодно поступает 350–600 млн тонн угарного газа. В настоящее время около 56–62 % этого количества приходится на долю автотранспорта (содержание оксида углерода в выхлопных газах может достигать 12 %).
Основной путь превращения CO в атмосфере — окисление гидроксилом до диоксида углерода [1, 2]:
СО + Н2О → СО2 + Н2.
Немаловажным источником СО является табачный дым. В плохо вентилируемом прокуренном помещении насыщение крови СО у присутствующих может достигать 10 % и даже 14 %. Курение кальяна более опасно в плане возможности отравления СО, чем курение трубки или сигарет, поскольку он в этом случае поступает в организм в более высокой концентрации. В среднем при выкуривании одной сигареты концентрация карбоксигемоглобина в крови достигает 4–6,5 %. У курильщиков кальяна зарегистрирован уровень карбоксигемоглобина в крови в пределах 24,0–31,1 % [4].
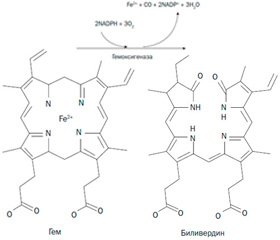
Физиологическое значение. СО является нормальным метаболитом организма человека. Эндогенный СО образуется в организме в процессе действия фермента гемоксигеназы на гем (гемзависимая продукция), является продуктом разрушения гемоглобина и миоглобина, а также других гемсодержащих белков (цитохромов, цитохромоксидазы, каталазы). Продукция СО в организме человека составляет в среднем 16,4 мкмоль/ч, достигая 500 мкмоль (12 мл) в сутки. Этот процесс вызывает образование в крови человека небольшого количества карбоксигемоглобина, даже если человек не курит и дышит не атмосферным воздухом, а чистым кислородом или смесью азота с кислородом. Содержание карбоксигемоглобина в крови в норме колеблется в пределах 1–2 % от всех видов гемоглобина и в среднем составляет 1,6 %. При патологических состояниях, сопровождающихся активацией гемолиза, продукция СО в организме значительно возрастает [5, 6].
Гемнезависимая продукция эндогенного СО происходит в результате ферментативного и аутоокисления фенолов, фотоокисления органических химических соединений, индуцируемого аскорбатом и ионами железа перекисного окисления липидов. Активаторы липидной пероксидации (фенобарбитал, дифенилгидантоин, прогестерон) способствуют увеличению продукции эндогенного СО. Напротив, применение антиоксидантов (альфа-токоферола, десферала) угнетает его гемнезависимое образование. Продукция СО происходит в нейронах головного мозга, клетках легких, печени, селезенки, почек и крови, однако количество образующегося эндогенного СО при гемнезависимом пути продукции несравнимо меньше, чем при работе гемоксигеназы. Высокая активность гемоксигеназы имеет место в селезенке, где и происходит наиболее активное образование эндогенного СО [5, 7].
До 80 % образующегося в организме СО связывается гемоглобином, образуя карбоксигемоглобин. Часть СО выводится из организма через легкие, а часть подвергается окислению до углекислого газа с участием цитохромоксидазы [5, 6].
Данные о влиянии СО на организм человека в настоящее время еще противоречивы. Например, установлено, что гипоксическая стимуляция активности гемоксигеназы в сердце с последующим увеличением продукции эндогенного СО приводит к снижению тонуса коронарных сосудов и увеличению кровоснабжения миокарда. Показано, что СО оказывал защитное действие на кардиомиоциты изолированных сердец животных в условиях моделирования ишемии-реперфузии. Экзогенный СО также уменьшал тяжесть реперфузионных повреждений в моделях острого инфаркта миокарда у мышей [8–10]. С другой стороны, в одном из последних продолжительных исследований (Framingham Offspring Study) обнаружено, что повышенный уровень эндогенного СО в организме ассоциирован со значительным увеличением риска развития сердечно-сосудистых заболеваний [11].
Феномен индуцируемой СО вазорелаксации был впервые описан в 1984 г. McGrath и Smith на коронарных артериях крыс. Очень скоро было установлено, что этот эффект не обусловлен активностью эндотелия [12]. Установлено, что СО способствует релаксации артерии хвоста, грудного отдела аорты кролика, сонных артерий собаки, коронарных мезентериальных и бедренных артерий свиней и морских свинок, печеночных вен крысы и многих других кровеносных сосудов [13]. Однако многие сосуды оказались не чувствительными к СО модуляции. Данные о влиянии СО на тонус легочных сосудов у разных авторов часто противоположны [5].
В ранних исследованиях, проводившихся на свиньях, было обнаружено, что создание концентрации СО в крови в пределах 160–185 ppm приводило к активации агрегации тромбоцитов. При повышении концентрации СО до 420 ppm с помощью электронной микроскопии была выявлена адгезия изменивших форму тромбоцитов на поверхности артериального эндотелия. Но в более поздних работах было показано значительное ингибирование тромбоцитарной агрегации под влиянием СО. Эффект реализовывался через увеличение продукции оксида азота (NO) и образования циклического гуанозинмонофосфата [14, 15].
Вдыхание СО ведет в первую очередь к гемической гипоксии через образование карбоксигемоглобина и снижение кислородной емкости крови, однако парадоксально, что ингаляция СО в концентрации 0,1% обусловливает уменьшение тяжести легочной ишемии, угнетает гипоксическую индукцию ингибитора активации плазминогена, благодаря чему снижает отложение фибрина и активность воспалительного процесса в легких [16]. Синтез сурфактанта пневмоцитами 2-го типа в организме человека угнетается под влиянием как экзогенного, так и эндогенного СО [17].
Вслед за появившимися в 1993 году первыми данными о том, что эндогенный CO является нормальным нейротрансмиттером в организме человека, а также одним из трех эндогенных газов, которые в норме модулируют течение воспалительных реакций в организме (два других — оксид азота и сероводород), CO привлек значительное внимание клиницистов и исследователей как важный биологический регулятор. Было показано, что во многих тканях все три вышеупомянутых газа являются противовоспалительными веществами, вазодилататорами, а также вызывают ангиогенез, СО — через активацию выработки сосудистого эндотелиального фактора роста. Основная его функция — создание новых кровеносных сосудов в эмбриональном развитии или после травмы, усиление роста мышц после физических упражнений, обеспечение коллатерального кровообращения (создание новых сосудов при блокировании уже имеющихся). Но повышенная активность сосудистого фактора роста может привести к возникновению и росту опухолей [5, 18].
Таким образом, в настоящее время СО рассматривают в качестве одной из сигнальных молекул, которая принимает участие в регуляции сосудистого тонуса, процессах гемореологии, нейротрансмиссии. Ведутся исследования, посвященные определению роли СО в процессах воспаления.
Статистика и источники отравления СО. Отравление СО составляет наиболее часто регистрируемую интоксикацию ядовитыми газами. В Великобритании ежегодно около 50 человек погибают в результате интоксикации СО при ежегодной констатации 1000–1100 отравлений СО. В США от отравления СО ежегодно погибает около 500 человек, а количество случаев интоксикации СО превышает 15 000 [19, 20].
Большинство случайных отравлений СО не имеют профессионального характера. Они обусловлены неполным сгоранием топлива в неисправных печах, отсутствием адекватной тяги и малыми размерами помещения. Профессиональные отравления встречаются намного реже и вызваны вдыханием выхлопных газов, нахождением в зоне пожаров и взрывов. При больших пожарах случаи массовых отравлений СО встречаются практически всегда [3].
Источниками интенсивного образования СО являются: газовые водонагреватели, керосиновые печи и обогреватели, древесноугольные грили, снабжаемые пропаном печи, бензиновые и дизельные электрогенераторы, заправляющиеся пропаном автопогрузчики, бензопилы, тягачи и буксировщики, лодочные моторы, устройства для распыления красок, лаков, растворителей и др.
Риску отравления СО подвержены: дети, едущие в крытых грузовиках в конце их кузова, рабочие целлюлозных мельниц, сталелитейных цехов, работающие у коксовых печей, рабочие, занятые на производстве формальдегида, работающие в зоне пожара, работающие в закрытых помещениях газо- и электросварщики, находящиеся вблизи работающих лодочных моторов. В мегаполисах до 80 % присутствующего в воздухе СО обусловлено работой автотранспорта. Его выделяется особенно много, когда в двигатель подают избыточное количество топлива, чтобы, например, завести его на холоде. Поэтому автомобили, работающие при низких температурах (а также при торможении в пробках и дальнейшем движении транспортного потока в зимнее время года), выделяют значительные количества СО [21]. Ниже приводится информация о содержании СО в воздухе или других газовых смесях, которые могут вдыхать современные жители.
— 0,1 ppm — естественный базовый уровень СО в атмосфере;
— 0,5–5 ppm — средний базовый уровень СО в жилых домах;
— 5–15 ppm — уровень СО в жилых домах вблизи от правильно отрегулированной газовой плиты;
— 100–200 ppm — выхлоп автомобилей в центре мегаполиса (Мехико, Мадрид, Милан и др.);
— 1000 ppm и выше — вблизи работающего лодочного мотора;
— 5000 ppm — камин дома, топящийся дровами;
— 7000 ppm — неразбавленный выхлопной газ машины;
— 30 000 ppm — неразбавленный дым сигареты [22].
— 0,5–5 ppm — средний базовый уровень СО в жилых домах;
— 5–15 ppm — уровень СО в жилых домах вблизи от правильно отрегулированной газовой плиты;
— 100–200 ppm — выхлоп автомобилей в центре мегаполиса (Мехико, Мадрид, Милан и др.);
— 1000 ppm и выше — вблизи работающего лодочного мотора;
— 5000 ppm — камин дома, топящийся дровами;
— 7000 ppm — неразбавленный выхлопной газ машины;
— 30 000 ppm — неразбавленный дым сигареты [22].
Содержание СО в газах, образующихся и выделяющихся в процессе промышленного производства, следующее:
— газы работающей вагранки содержат 13–15 % СО;
— газ, выделяемый опоками, содержит до 18 % СО;
— в доменном газе до 30 % СО;
— расплавленный и застывающий чугун выделяет газы, в состав которых входит до 3,4 % СО;
— в бессемеровском (конвертерном) газе содержится до 25 % СО;
— газ от печей для выплавки алюминия содержит 32,2 % СО;
— пороховые газы содержат до 50 % СО;
— выхлопные газы автомобилей в зависимости от системы двигателя, вида топлива и от условий работы мотора содержат от 1,0 до 13,7 % СО, в среднем 6,3 %;
— угольная пыль содержит от 0,1 до 3,9 % СО [22].
— газы работающей вагранки содержат 13–15 % СО;
— газ, выделяемый опоками, содержит до 18 % СО;
— в доменном газе до 30 % СО;
— расплавленный и застывающий чугун выделяет газы, в состав которых входит до 3,4 % СО;
— в бессемеровском (конвертерном) газе содержится до 25 % СО;
— газ от печей для выплавки алюминия содержит 32,2 % СО;
— пороховые газы содержат до 50 % СО;
— выхлопные газы автомобилей в зависимости от системы двигателя, вида топлива и от условий работы мотора содержат от 1,0 до 13,7 % СО, в среднем 6,3 %;
— угольная пыль содержит от 0,1 до 3,9 % СО [22].
Токсикология монооксида углерода. Механизм токсического действия СО на организм включает:
— образование карбоксигемоглобина;
— образование карбоксимиоглобина;
— связывание цитохромоксидазы;
— стимуляцию выработки NO и активацию липидной пероксидации в головном мозге [23–25].
— образование карбоксигемоглобина;
— образование карбоксимиоглобина;
— связывание цитохромоксидазы;
— стимуляцию выработки NO и активацию липидной пероксидации в головном мозге [23–25].
Наибольшее количество работ, затрагивающих аспекты токсикологии СО, посвящено повреждающему эффекту гемической гипоксии при образовании большого количества карбоксигемоглобина (HbCO):
HbO2 + CO → HbCO + O2.
Образование HbCO происходит очень быстро, поскольку сродство гемоглобина к СО в 250 раз больше, чем сродство к кислороду. Скорость образования HbCO зависит от его содержания во вдыхаемом воздухе. Например, наличие 1 объема СО в 1500 объемах вдыхаемого воздуха определяет образование 50% HbCO [3, 22, 23].
Растворы карбоксигемоглобина ярко-красного цвета, их спектр поглощения характеризуется максимумами при длине волны 570 и 539 нм. Вследствие этого при отравлении СО кожные покровы пострадавших могут приобретать розоватый оттенок. Врачи описывают наличие гиперемии или эритемы.
Если скорость образования HbCO возрастает в геометрической прогрессии, то обратная реакция (высвобождение гемоглобина, отделение его от СО) имеет линейную зависимость. Расщепление карбоксигемоглобина на Hb и CO происходит в 10 000 раз медленнее, чем расщепление оксигемоглобина на Hb и O2. Скорость замещения HbCO HbO2 зависит исключительно от количества кислорода, находящегося во вдыхаемой газовой смеси [22–24]. Период полураспада HbCO составляет:
— 320 минут, если пострадавший дышит воздухом;
— 80 минут при вдыхании 100% О2;
— 23 минуты при дыхании 100% О2 в барокамере при давлении 3 атм.
— 320 минут, если пострадавший дышит воздухом;
— 80 минут при вдыхании 100% О2;
— 23 минуты при дыхании 100% О2 в барокамере при давлении 3 атм.
В клинических условиях независимо от тяжести состояния пациента и количества вдыхаемого им кислорода через 12 часов после прекращения контакта с СО концентрация HbCO в крови не превышает нормальные показатели. Тяжесть состояния пациента будет определяться не только тяжестью гипоксических повреждений, полученных в период наличия гемической гипоксии, но также формированием гипоксии биоэнергетической, в основе которой находится митохондриальная дисфункция. Помимо гемоглобина и миоглобина, СО блокирует гем других белков, принимающих участие в тканевом дыхании, а именно цитохром-С-оксидазы, цитохрома С, цитохрома а3, цитохрома Р450, каталазы, пероксидазы. Сродство к СО у этих белков значительно меньше, чем у гемоглобина, однако и высвобождение их из связи с СО происходит значительно медленнее — в течение 48–72 часов. Соответственно, в этот период может быть серьезно снижена энергопродукция и имеется высокий риск развития или усугубления тяжести гипоксической энцефалопатии, а также расстройств сердечной деятельности [3, 25, 26].
Результаты пульсоксиметрического исследования и электрохимические исследования парциального давления газов крови в условиях острого отравления СО малоинформативны и не отражают тяжести гипоксемии и гипоксии. Гипоксия имеет смешанный характер, включая гемический и гистотоксический компоненты. Хотя подавляющее количество кислорода в гипо- и нормобарических условиях транспортируются в организме с помощью HbO2 и между показателями РО2 и SO2% имеется определенная нелинейная зависимость, в условиях отравления СО по причине того, что объемное содержание кислорода в плазме крови может оставаться вполне нормальным, у пациентов могут регистрироваться нормальные показатели РО2 и SO2% [27, 28]. Сумма показателей SpO2% и SpСO% нередко превышает 100 %. Так, при описании одного из клинических случаев отравления СО в Саудовской Аравии у пациентки при поступлении в клинику были зарегистрированы SaO2% = 99,8 % при SaСO% = 21,4 % [29].
Клиническая картина отравления СО. С учетом того, что к гипоксии наиболее чувствительны нейроны головного мозга, клиническая симптоматика при отравлении СО прежде всего проявляется нарушением функций ЦНС. Второе место занимают расстройства со стороны сердечно-сосудистой системы. Наиболее чувствительны к действию СО новорожденные, дети, беременные, лица пожилого и старческого возраста, особенно с сопутствующей патологией сердечно-сосудистой системы.
Для отравления легкой степени характерны: головная боль, ощущение пульсации в височной области, головокружение, ухудшение остроты зрения, умеренное оглушение, тошнота, слезотечение. Наблюдаются: покраснение кожных покровов (значительно чаще отмечают не распространенную гиперемию, а легкий румянец), тахикардия, артериальная гипертензия, боли в грудной клетке, сухой кашель.
Для отравления средней степени тяжести помимо указанных выше симптомов характерны усугуб–ление тяжести оглушения, состояние сомноленции, возможно появление парезов.
При тяжелом отравлении отмечаются: синкопе, развитие сопора и гипоксической комы, мышечная атония (чаще) или гипертония с гиперрефлексией (реже), судороги, ослабление пальпебральных, корнеальных рефлексов, фотореакций, появление миоза, сменяющегося двусторонним мидриазом или анизокорией, нарушается ритм дыхания, имеют место нарушения сердечного ритма, артериальная гипотензия, румянец сменяется цианозом.
Выделяют еще и молниеносную форму отравления СО. Она развивается, когда концентрация СО во вдыхаемом воздухе составляет 0,5–1,0 % или превышает это значение. При этом SaСO% быстро достигает 80 %. Пострадавший быстро впадает в кому с остановкой дыхания, сочетающуюся с декомпенсированным шоком [3, 22, 25].
Осложнениями являются гипоксический отек головного мозга и гипоксическая энцефалопатия с стойким неврологическим дефицитом, гипоксемический отек легких, инфаркт миокарда и острая недостаточность системного кровообращения, рабдомиолиз, миоглобинурия и острое повреждение почек [3, 30–32].
Зависимость развития клинической симптоматики от концентрации СО во вдыхаемом воздухе, а также от продолжительности контакта с токсическим веществом представлена в табл. 1 и 2.
Врачи давно знакомы с клиникой интоксикации СО. На протяжении многих лет были описаны многочисленные клинические формы, такие как цефалгическая, психозоподобная, судорожная, пьяная, висцеральная, легочная (протекающая с –отеком легких), желудочно-кишечная, рабдомиолизная и др. [3, 25, 34].
Неотложная помощь и интенсивная терапия. В соответствии с содержанием раздела приказа № 34 МЗ Украины (2014) «Острые отравления» после проведения оценки состояния пострадавшего согласно алгоритму ABCDE (A (airway) — проходимость дыхательных путей; B (breathing) — эффективность дыхания; C (circulation) — эффективность системного кровообращения; D (disability) — нарушение функции сознания; E (exposure) — дополнительная информация) пострадавший должен быть выведен или вынесен из зоны воздействия токсичного газа. При наличии симптоматики остановки эффективного кровообращения следует начать реанимационную акцию с последовательностью действий CAB.
При отсутствии признаков клинической смерти немедленно начать оксигенотерапию или ИВЛ с применением кислорода. Пациентам, находящимся в состоянии сопора и комы, необходимо инструментально обеспечить проходимость дыхательных путей.
Выполнить катетеризацию периферической вены и начать инфузию плазмозамещающих растворов (физиологический раствор, раствор Рингера, раствор Рингера лактат, раствор лактасол и др.) со скоростью 1,5–2,0 мл в минуту. При наличии глюкометра определить уровень гликемии. Не использовать растворы глюкозы при отсутствии гипогликемического состояния. Не использовать глюкокортикостероиды. При необходимости инотропной поддержки применить инфузии добутамина, допамина или адреналина.
При наличии специальных диагностических приборов немедленно определить содержание в крови карбоксигемоглобина. Если пострадавший эвакуирован из зоны действия токсических газов незамедлительно, то содержание карбоксигемоглобина в крови, не превышающее 8 %, укажет на то, что нарушение функции сознания, скорее всего, не связано с токсическим действием СО. Однако всегда следует учитывать возможность неточности функционирования прибора.
В качестве антидота, способствующего ускорению диссоциации карбоксигемоглобина и высвобождению гемоглобина, ввести пострадавшему внутривенно 60 мг ацизола.
При наличии судорог или психомоторного возбуждения после предварительного введения 0,3–0,5 мл атропина сульфата использовать внутривенно диазепам 10–20 мг или тиопентал натрия 1 мг/кг массы тела.
При наличии сукцинатсодержащих антигипо–ксантов (реамберина, мексидола, цитофлавина) использовать их как можно раньше.
Госпитализировать пациента в центр (отделение), имеющий возможности проведения интенсивной терапии с ИВЛ. Пациентов, находящихся в крайне тяжелом состоянии, с нестабильностью гемодинамики, проблемами обеспечения проходимости дыхательных путей не следует пытаться доставить в центр, имеющий возможность проведения гипербарической оксигенации, если возможна более быстрая доставка в отделение, где умеют проводить длительную ИВЛ. У пациентов, находящихся в состоянии глубокого оглушения, сопора, комы, нужно также учитывать необходимость обеспечения немедленной нейровизуализации.
В отделении интенсивной терапии пациентам, находящимся в состоянии сопора и комы, должна быть выполнена интубация трахеи. ИВЛ с применением 100% кислорода проводится в течение 6 часов.
Рекомендуется прогнозировать продолжительность необходимости применения 100% О2 из расчета, что в условиях оксигенотерапии с использованием 100% О2 период полураспада HbCO составляет в среднем 1 час. При неосложненных отравлениях СО продолжительность оксигенотерапии хорошо соответствует динамике снижения концентрации HbCO в крови.
Терапию 100% кислородом следует проводить до снижения концентрации HbCO до 10 %. У пациентов, имеющих патологию легких или сердечно-сосудистой системы, требуется продолжение оксигенотерапии с использованием 100% О2 до снижения концентрации HbCO в крови до 2 %.
Высокие показатели пульсоксиметрии не являются маркером снижения тяжести гипоксических повреждений и улучшения состояния пациента.
Пациентов с уровнем HbCO в крови 40 % и выше, а также пациентов с прогрессирующей недостаточностью функций ЦНС или сердечно-сосудистой системы, если это возможно, следует подвергнуть гипербарической оксигенотерапии.
Пациенты с отсутствием положительного эффекта от 4-часовой оксигенотерапии с применением 100% О2, также, если это возможно, должны быть направлены в отделение гипербарической оксигенации (ГБО).
Беременным необходимо проводить ГБО уже при концентрации HbCO в крови 15 % [25, 29, 37].
Гипербарическая оксигенация значительно и достоверно способствует ускорению разрушения СО и выведению его из организма. Период полураспада HbCO может быть сокращен до 15–23 минут. Наиболее распространенным режимом ГБО является использование 100% О2 под давлением 2,4–3 атм в течение 90–120 минут. При описании отдельных клинических случаев отмечают значительное и быстрое регрессирование неврологических расстройств, отека головного мозга и восстановление активности цитохромоксидазы. Однако в систематизированных обзорах четких преимуществ ГБО не показано, поэтому руководства для ее применения у пациентов с отравлением СО до сих пор не разработаны. Однако в странах Северной Америки до 85 % руководителей центрами ГБО при–шли к определенному консенсусу необходимости ее применения.
Наиболее часто показаниями к проведению ГБО называют наличие комы (98 %), синкопе (77 %), признаков ишемии миокарда по данным ЭКГ (91 %), очаговой неврологической симптоматики (94 %) и нарушений, выявленных при нейропсихиатрическом тестировании (91 %). 92 % специалистов по ГБО используют ее у пациентов с головной болью, тошнотой и при уровне HbCO в крови 40 % и выше [37–39].
Необходимо ЭКГ-мониторирование. У пациентов с атеросклеротическим поражением сердца имеется высокий риск внезапной остановки кровообращения уже при наличии в крови 20 % HbCO. У этих же больных уже при начальном уровне HbCO в крови 15 % и выше на ЭКГ часто обнаруживаются признаки ишемии миокарда и острого инфаркта миокарда [29, 34, 37].
Все пострадавшие нуждаются в исследовании состояния глазного дна и проведении ядерно-магнитно-резонансной компьютерной томографии головного мозга.
У пациентов с признаками отека головного мозга при проведении интенсивной терапии используются непрерывный мониторинг показателей АД, положение на койке с приподнятым головным концом, быстрая инфузия маннитола и ИВЛ в режиме гипервентиляции с целевым РаСО2 30 мм рт.ст. в течение 6–12 часов [32, 34, 37].
Необходимо обязательно провести исследование кислотно-основного статуса организма, если концентрация HbCO достигает 25 %.
Не следует применять ощелачивающую терапию, если рН плазмы крови превышает 7,15. Метаболический ацидоз имеет гипоксическое происхождение и регрессирует в процессе проведения оксигенотерапии [32, 34, 37].
Если во время пожара пациент помимо СО вдыхал другие токсические продукты горения и у него обнаружена метгемоглобинемия, необходимо использовать внутривенно тиосульфат натрия до 12 500 мг в сутки [37].
При наличии признаков рабдомиолиза с помощью инфузионной терапии и применения диуретиков следует обеспечить темп мочеотделения не менее чем 150 мл в час. При отсутствии эффекта от форсированного диуреза и развитии острой почечной недостаточности проводят заместительную почечную терапию [29, 31, 34].
Список литературы
1. Ахметов Н.С. Общая и неорганическая химия. — 5-е изд., испр. / Н.С. Ахметов — М.: Высшая школа, 2003. — 743 с.
2. Химия: справочное издание: Пер. с нем. — 2-е изд. / В. Шретер, К.-Х. Лаутеншлегер, Х. Бибрак [и др.]. — М.: Химия, 2000. — 648 с.
3. Могош Г. Острые отравления: Пер. с рум. М. Бурт, Л. Чернашов / Г. Могош. — Бухарест, 1984. — 580 с.
4. La Fauci G. Carbon monoxide poisoning in narghile (water pipe) tobacco smokers. Case Reports / G. La Fauci, G. Weiser, I.P. Steiner, I. Shavit // Canadian Journal of Emergency Medicine. — 2012. — Vol. 14, № 1. — Р. 57-59.
5. Wu L. Carbon Monoxide: Endogenous Production, Physio–logical Functions, and Pharmacological Applications / Lingyun Wu, Rui Wang // Pharmacological Reviews. — 2005. — Vol. 57, № 4. — Р. 585-630.
6. Piantadosi C.A. Biological chemistry of carbon monoxide / C.A. Piantadosi // Antioxidants & Redox Signaling. — 2002. — № 4. — Р. 259-270.
7. Rodgers P.A. Sources of carbon monoxide (CO) in biological systems and applications of CO detection technologies / P.A. Rodgers, H.J. Vreman, P.A. Dennery, D.K. Stevenson // Seminars in Perinatology. — 1994. — Vol. 18. — P. 2-10.
8. Inducible nitric oxide synthase and heme oxygenase-1 in rat heart: direct effect of chronic exposure to hypoxia / A. Grilli, M.A. De Lutiis, A. Patruno [et al.] // Annals of Clinical Laboratory Science. — 2003. — Vol. 33. — P. 208-215.
9. Administration of a CO-releasing molecule at the time of reperfusion reduces infarct size in vivo / Y. Guo, A.B. Stein, W.J. Wu [et al.] // American Journal of Physiology. Heart Circulation Physio-logy. — 2004. — Vol. 286. — Р. 1649-1653.
10. Cardiac-specific expression of heme oxygenase-1 protects against ischemia and reperfusion injury in transgenic mice / S.F. Yet, M.D. Layne, Z.Y. Wang [et al.] // Circulation Research. — 2001. — Vol. 89. — P. 168-173.
11. Association of exhaled carbon monoxide with subclinical cardiovascular disease and their conjoint impact on the incidence of cardiovascular outcomes / S. Cheng, D. Enserro, V. Xanthakis [et al.] // European Heart Journal. — 2014. — Vol. 35. — P. 2980-2987.
12. Vedernikov Y.P. Similar endothelium-independent arterial relaxation by carbon monoxide and nitric oxide / Y.P. Vedernikov, T. Graser, A.F. Vanin // Biomedica Biochimica Acta. — 1989. — Vol. 48. — P. 601-603.
13. Ndisang J.F. Induction of heme oxygenase-1 and stimulation of cGMP production by hemin in aortic tissues from hypertensive rats / J.F. Ndisang, L. Wu, W. Zhao, R. Wang // Blood. — 2003. — Vol. 101. — P. 3893-3900.
14. Mansouri A. Inhibition of platelet ADP and serotonin release by carbon monoxide and in cigarette smokers / A. Mansouri, C.A. Perry // Experientia. — 1984. — Vol. 40. — P. 515-517.
15. Du X. A new mechanism for nitric oxide- and cGMP-mediated platelet inhibition [Электронный ресурс] // Bloodjournal. — May 4 2015. — Hemostasis. — Режим доступа: http://www.bloodjournal.org/content/bloodjournal/109/2/392.full.pdf?sso-checked=true
16. Paradoxical rescue from ischemic lung injury by inhaled carbon monoxide driven by derepression of fibrinolysis / T. Fujita, K. Toda, A. Karimova [et al.] // Nature Medicine. — 2001. — Vol. 7. — P. 598-604.
17. Carbon monoxide contributes to the cytokine-induced inhibition of surfactant synthesis by human type II pneumocytes / J. Arias-Dias, N. Villa, J. Hernandez [et al.] // Archives of Surgery. — 1997. — Vol. 132. — Р. 1352-1360.
18. Кукоба Т.В. Гемоксигеназа та монооксид вуглецю: захист чи пошкодження клітин? / Т.В. Кукоба, О.О. Мойбенко // Фізіологічний журнал. — 2002. — Т. 48, № 5. — С. 79-92.
19. Carbon monoxide — the silent killer [Электронный ресурс] / The Royal Society for the Prevention of Accidents. — Режим доступа: http://www.rospa.com/home-safety/advice/carbon-monoxide-safety/
20. Carbon Monoxide Poisoning [Электронный ресурс] / American Red Cross. — Режим доступа: http://www.redcross.org/images/MEDIA_CustomProductCatalog/m4340092_FireCOFactSheet.pdf
21. Cunha J.P. Carbon Monoxide Poisoning [Электронный ресурс] / E-Medicine Health Experts for Everyday Emergencies / Режим доступа: http://www.emedicinehealth.com/carbon_mono–xide_poisoning/article_em.htm
22. Отравление монооксидом углерода (угарным газом) / Ю.В. Зобнин, Т.Н. Саватеева-Любимова, А.Л. Коваленко [и др.]. — Санкт-Петербург: Тактик-Студио, 2011. — 86 с.
23. Gorman D. The clinical toxicology of carbon monoxide / D. Gorman, A. Drewry, Y.L. Huang, C. Sames // Toxicology. — 2003. — Vol. 187. — P. 25-38.
24. Townsend C.L. Effects on health of prolonged exposure to low concentrations of carbon monoxide / C.L. Townsend, R.L. Maynard // Occupational and Environmental Medicine. — 2002. — Vol. 59, № 10. — Р. 708-711.
25. Dart. R.C. Medical toxicology / R.C. Dart. — Philadelphia: Williams & Wilkins, 2004. — Р. 1169.
26. Лукьянова Л.Д. Роль биоэнергетических нарушений в патогенезе гипоксии / Л.Д. Лукьянова // Патологическая физиология и экспериментальная терапия. — 2004. — № 2. — С. 2-11.
27. Godsell P.A. Co-oximetry: a historical review / P.A. Godsell / Clinical Biochemist Reviews. — 1995. — Vol. 16. — P. 104-109.
28. Mak T.W.L. Management of carbon monoxide poiso–ning –using oxygen therapy / T.W.L. Mak, C.W. Kam, J.P.S. Lai, C.M.C. Tang // HKMJ. — 2000. — Vol. 6. — P. 113-115.
29. Status epilepticus and cardiopulmonary arrest in a patient with carbon monoxide poisoning with full recovery after using a neuroprotective strategy: a case report / S. Abdulaziz, O. Dabbagh, Ya. Arabi [et al.] // Journal of Medical Case Reports. — 2012. — Vol. 6. — P. 421.
30. Заугольников В.С. Рабдомиолиз в клинической практике / В.С. Заугольников, Н.Н.Теплова // Вятский медицинский вестник. — 2002. — № 3. — С. 7-11.
31. Миронов Л.Л. Рабдомиолиз / Л.Л. Миронов // Медицина неотложных состояний. — 2006. — № 6(7). — С. 7-14.
32. Tucciarone M. Myocardial infarction secondary to carbon monoxide poisoning: an uncommon presentation of a common condition. Case report and review of the literature / M. Tucciarone, P.A. Dileo, E.R. Castro, M. Guerrero // American Journal of Therapeutics. — 2009. — Vol. 16, № 5. — Р. 462-465.
33. Окись углерода (угарный газ) / Вредные вещества в промышленности. Справочник для химиков, инженеров и врачей / Под ред. Н.В. Лазарева, И.Д. Гадаскиной. — 7-е изд. — Ленинград: Химия, 1977. — Т. 3. — С. 240-253. — 608 с.
34. Kao L.W Toxicity associated with carbon monoxide / L.W. Kao, K.A. Nañagas // Clinics in Laboratory Medicine. — 2006. — Vol. 26, № 1. — Р. 99-125
35. Goldstein M. Carbon monoxide poisoning / M. Goldstein // Journal of Emergency Nursing: JEN: Official Publication of the Emergency Department Nurses Association. — 2008. — Vol. 34, № 6. — P. 538-542.
36. Struttmann T. Unintentional carbon monoxide poisoning from an unlikely source / T. Struttmann, A. Scheerer, T.S. Prince, L.A. Goldstein // The Journal of the American Board of Family Practice. — 1998. — Vol. 11, № 6. — Р. 481-484.
37. Shochat G.N. Carbon Monoxide Toxicity Treatment & Ma–nagement / Medscape / Режим доступа: http://emedicine.medscape.com/article/819987-treatment#a1126
38. Hyperbaric Oxygen for Carbon Monoxide Poisoning / N.A. Buckley, D.N. Juurlink, G. Isbister [et al.] // Cochrane Database of Systematic Reviews. — 2011. — Vol. 13. — CD002041.
39. Olson K.R. Hyperbaric Oxygen for Carbon Monoxide Poiso-ning: Does it Really Work? / K.R. Olson, D. Seger // Annals of Emergency Medicine. — 1995. — Vol. 25. — P. 535-537.
40. Bennetto L. Accidental carbon monoxide poisoning presen-ting without a history of exposure: a case report / L. Bennetto, L. Powter, N.J. Scolding // Journal of Medical Case Reports. — 2008. — Vol. 22. — P. 112-118.

/10-1.jpg)
/13-1.jpg)
/14-1.jpg)