Статья опубликована на с. 69-77
Среди различных направлений современной нейрофармакологии и неврологии, наиболее интенсивно развивающихся в последние годы, на одно из первых мест следует поставить проблему адекватной и эффективной фармакотерапии деменций.
Деменции сегодня рассматриваются как важнейшая после сердечно-сосудистой и онкологической патологии медико-социальная проблема [25, 46]. Это во многом определяется тем обстоятельством, что существенные демографические сдвиги в промышленно развитых странах на протяжении ХХ века привели к двух-трехкратному увеличению доли пожилых и значительно большему возрастанию доли очень старых людей в популяции. В результате актуализировались вопросы своевременной диагностики, терапии и профилактики различных форм когнитивных нарушений, служащих фундаментом последующего развития деменций, и в первую очередь синдрома умеренных когнитивных нарушений. Однако на данном пути как фармаколога-экспериментатора, так и клинициста подстерегает ряд сложностей. Сложность патогенеза дементного процесса (независимо от клинической формы заболевания), поражение головного мозга на всех уровнях структурно-функциональной организации и, в результате, ранняя инвалидизация пациентов обусловливают трудности в выборе рациональной фармакотерапии, в подборе критериев эффективности проводимого лечения, в оценке долгосрочного действия того или иного препарата и т.д.
Во многом упомянутые сложности также связаны c клинической полиморфностью деменций и, соответственно, с проблемами адекватной диагностики. По современным представлениям, сенильные деменции подразделяются на нейродегенеративные (болезнь Альцгеймера (БА), деменция с тельцами Леви (ДТЛ), деменция при болезни Паркинсона), сосудистые и смешанные формы. Именно смешанным формам придается особое значение в последнее время, в частности роли сосудистых изменений при БА и первично-дегенеративных изменений при сосудистой деменции (СД). Сегодня считается, что на клиническую картину БА могут оказывать свое влияние целый ряд факторов, включая цереброваскулярные расстройства, что в комбинации с собственно «альцгеймеровскими» изменениями приводит к формированию клинической картины, весьма отличной от «классической» клиники БА. Также изменились представления о сосудистых когнитивных нарушениях, включая СД. Если раньше основное внимание уделялось инсульту как основной причине возникновения СД, то в настоящее время все большее значение придается ее безынсультным формам [8]. При этих вариантах СД нередко отмечается незаметное начало с прогредиентным прогрессированием, а выявляемые при нейровизуализации изменения (включая церебральную атрофию) сопоставимы с изменениями в мозге при БА.
Таким образом, в последнее время представления о соотношении БА и СД значительно изменились, и сходство между этими двумя состояниями представляется более значительным, чем считалось ранее.
Несмотря на ряд обнадеживающих результатов доклинических исследований и в некоторых случаях ограниченных клинических испытаний веществ, воздействующих на различные этапы биосинтеза белка-предшественника амилоида (АРР) и тау-белка [2, 54], на сегодняшний день препаратами выбора, включенными в мировые протоколы лечения БА и наиболее часто применяемыми в клинической практике, являются ингибиторы холинэстеразы (ИАХЭ) — донепезил, ривастигмин, галантамин и антагонист NMDA-рецепторов — мемантин.
Препараты холинергической терапии — ИАХЭ с различной степенью успешности применяются для лечения прежде всего БА, а также как инструмент фармакотерапии и других форм деменций. Кроме того, ИАХЭ (особенно донепезил и галантамин) являются прежде всего инструментами коррекции собственно когнитивного дефицита, т.е. в известной мере «чистыми» когнитивными активаторами [33]. При этом они весьма ограниченно влияют на поведенческие и психоэмоциональные расстройства у пациентов с деменциями, нередко играющие в клинической картине существенную роль. Более того, часто даже на ранних стадиях деменции именно психотические расстройства играют ведущую роль в десоциализации пациентов и формируют основное бремя нагрузки на родственников и обслуживающий персонал [11, 46]. Наконец, фармакотерапия препаратами ИАХЭ сопряжена с риском развития ряда клинически значимых побочных эффектов, связанных с проявлениями гиперактивации холинергических систем центральной нервной системы (ЦНС) и организма в целом. Их можно разделить на 2 основные группы:
1) возникающие на этапе титрования дозы (в основном нарушения со стороны желудочно-кишечного тракта — тошнота, рвота, диарея, диспепсия, а также анорексия, слабость, головокружение), которые нередко бывают причиной отказа от лечения;
2) возникающие на этапе поддерживающей терапии (в основном нарушения со стороны ЦНС — возбуждение, инсомния, тревожность; со стороны сердечно-сосудистой системы — брадикардия, гипотония, нарушения проводимости миокарда; мышечные спазмы) [5, 33].
Следует отметить, что более всего выражены упомянутые осложнения у наиболее эффективного представителя данной группы — ривастигмина [22], что существенно сужает возможности его широкого применения при всех формах деменций.
Таким образом, по мере дальнейшего накопления данных о нейромедиаторных механизмах развития деменций, с одной стороны, и из-за неудовлетворенности в ряде случаев результатами применения препаратов ИАХЭ — с другой, исследователи и клиницисты стали обращать все большее внимание на возможности фармакологического воздействия на еще одно ведущее звено патогенеза деменций — гиперактивацию глутаматергической нейромедиации и феномен эксайтотоксичности.
Понятие эксайтотоксичности в настоящее время широко распространено в клинической неврологии. В узком смысле слова оно подразумевает длительную постоянную активацию NMDA (N-метил-D-аспартат) ионотропных глутаматных рецепторов избыточными концентрациями основного возбуждающего нейромедиатора в ЦНС — глутамата, в результате чего развивается стойкая патологическая гиперполяризация постсинаптической нейрональной мембраны [19, 38]. В широком же смысле феномен эксайтотоксичности характеризуется комплексом патофизиологических реакций в ЦНС, запускаемых гиперактивацией NMDA-рецепторов на почве ишемии, нейродегенерации, травмы и других патологических факторов и приводящих в конечном итоге к формированию реакций апоптоза и гибели нейрона.
Гиперактивация NMDA-рецепторов, наряду с холинергической нейродегенерацией, является важнейшим нейрохимическим механизмом, лежащим в основе патогенеза деменций, «ишемического каскада» при инсульте и хронических нарушениях мозгового кровообращения и др. В частности, при деменциях именно глутаматергические процессы в ЦНС служат фундаментом развития поведенческих и психоэмоциональных расстройств, как уже упоминалось, мало подверженных монотерапии препаратами ИАХЭ [27]. Поэтому представляет интерес подробное рассмотрение роли феномена эксайтотоксичности в патогенезе деменций.
В норме глутамат является основным возбуждающим нейромедиатором в мозге, ответственным за реализацию ряда физиологических реакций, обеспечение различных видов памяти и процессов, связанных с обучением. NMDA-рецепторы представляют собой «медленный» подтип глутаматных рецепторов [42]. В физиологических условиях активация указанных рецепторов определяет развитие феномена долгосрочной потенциации, связанного с реализацией функции нейропластичности и формирования «следа» памяти. Нейрохимическим механизмом запуска данного процесса является активация поступления ионов Са2+ в клетку. При различных патологических условиях (ишемия, гипоксия, травма, стресс и т.д.) развивается повышенная активность NMDA-рецепторов, связанная со стабильным избыточным высвобождением глутамата, что приводит к подавлению активности мембранной Na+-К-АТФазы, массированному проникновению ионов Са2+ в клетку и, соответственно, значительному повышению его внутриклеточной концентрации. Описанный механизм запускает каскад дегенеративных реакций в нейроне — метаболическую дезинтеграцию, оксидативный стресс и апоптоз, приводящие в итоге к гибели клетки. Упомянутый комплекс патологических реакций и получил название «эксайтотоксичность» (excitоtoxicity — токсичность, развивающаяся при возбуждении) [24, 56]. Таким образом, глутамат в ЦНС может действовать не только как нейромедиатор, но и как нейротоксин.
Гиперактивация NMDA-рецепторов повышает интенсивность образования бета-амилоида и тау-протеина — основных нейрохимических маркеров БА [21]. Кроме того, сам бета-амилоид способен активировать NMDA-рецепторы, что может приводить к формированию порочного круга в системе «эксайтотоксичность — нейродегенерация» и дальнейшему прогрессированию патологического процесса. Наконец, гиперактивация глутаматергической системы способствует дальнейшему ослаблению холинергической нейротрансмиссии и усугублению когнитивного дефицита [42], поскольку глутамат и ацетилхолин находятся в ЦНС в реципрокных взаимоотношениях.
Здесь следует отметить, что сам по себе NMDA-рецептор представляет собой чрезвычайно перспективный фармакологический объект. Он является весьма сложной структурой, а именно поликомпонентным рецепторно-ионофорным комплексом, состоящим из четырех субъединиц (2 NR1 и 2 NR2), представляющих собой трансмембранные белки, формирующие специфический ионный канал (рецепторно-ионофорный комплекс). На данном комплексе находятся: а) сайт связывания глутамата (на NR2-субъединице); б) сайт связывания глицина (на NR1-субъединице); в) аллостерические модуляторные сайты, расположенные на мембране и непосредственно в ионном канале [19, 38, 42]. С точки зрения потенциального фармакологического воздействия ключевым компонентом рассмотренного NMDA-рецепторно-ионофорного комплекса является ионный канал. Именно активация либо блокада данного канала обеспечивают развитие либо торможение реакций эксайтотоксичности, и именно влияние на модуляторные сайты, локализующиеся в пределах упомянутого ионофора, может быть перспективным путем подавления реакций эксайтотоксичности, связанных с гиперактивацией сайтов связывания глутамата. Говоря проще, блокада ионного канала в пределах NMDA-рецептора может играть роль своеобразной «плотины», препятствующей избыточному потоку импульсов от участков связывания глутамата на NR2 и предотвращающей негативные последствия развернутого эксайтотоксического каскада (нарушение гомеостаза Сa2+, нейровоспаление, апоптоз и т.д.). Поэтому поиск препаратов с направленной антиглутаматергической активностью, и прежде всего антагонистов NMDA-рецепторов, стал одной из наиболее актуальных задач нейрофармакологии и клинической медицины.
Однако наибольшую сложность в разработке такого рода препаратов представляла необходимость сохранения нормального физиологического уровня глутаматергической нейротрансмиссии при одновременном подавлении патологической гиперактивности NMDA-рецепторов. Именно поэтому необратимые высокоаффинные блокаторы NMDA-рецепторов не дошли до стадии развернутых клинических испытаний вследствие выявившихся у них тяжелых побочных эффектов, связанных с тотальным подавлением глутаматергических процессов. Отмеченная проблема оставалась неразрешимой до введения в клиническую практику препарата мемантин.
Следует сразу же отметить, что мемантин занимает совершенно особое место не только в фармакотерапии деменций, но и в нейрофармакологии в целом, представляя собой не просто антагонист NMDA-рецепторов, а уникальный регулятор всей системы глутаматергической медиации, своего рода «адаптоген» в отношении глутаматзависимых процессов в ЦНС и «корректор» реакций эксайтотоксичности. Поэтому имеет смысл рассмотреть фармакологические особенности и клинические возможности данного препарата подробнее.
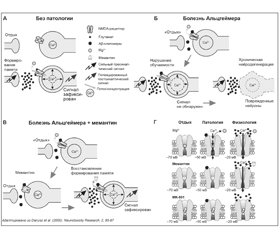
Мемантин — препарат из группы адамантанов (1-амино-3,5-диметиладамантан). Он является неконкурентным низкоаффинным антагонистом NMDA-рецепторов. Уникальным фармакологическим механизмом действия данного препарата следует считать наличие у него двойного потенциалзависимого эффекта. После блокады NMDA-рецепторов, реализуемой в состоянии покоя, и последующей их физиологической высокомощной активации природным медиатором — глутаматом мемантин освобождает ионный канал рецептора, делая возможным взаимодействие медиатора и рецептора. В условиях же хронической патологической активации NMDA-рецепторов импульсами малой мощности, ответственными за развитие эксайтотоксичности, но недостаточными для вытеснения мемантина из связи с рецептором, мемантин продолжает блокировать ионный канал, препятствуя возбуждению рецептора [28, 37, 39, 48]. В итоге мемантин действует как регулятор функции NMDA-рецепторов, обеспечивая сохранность их физиологической функции (в частности, как необходимого звена в функционировании когнитивной сферы), при этом «отсекая» патологическую импульсацию [49]. Можно сказать, что действие мемантина уподобляется своеобразному «фильтру», поддерживающему реализацию только жизненно важных глутаматопосредованных функций, но при этом блокирующему развитие реакций эксайтотоксичности на самых ранних стадиях (рис. 1).
/72.jpg)
Прямых аналогий такому эффекту мемантина нет не только среди других глутаматергических средств, но и в целом среди нейротропных препаратов, используемых в неврологической практике. Именно такой механизм действия мемантина определяет перспективы его применения при различных нейродегенеративных процессах, и в частности при деменциях (рис. 2).
Сопутствующие фармакологические эффекты мемантина, в частности блокада серотониновых 5-HT3-рецепторов, а также агонистическое действие в отношении дофаминовых D2-рецепторов могут играть определенную роль в его благоприятных когнитивных и психоэмоциональных эффектах [20, 51, 58]. Однако на сегодняшний день именно NMDA-рецепторзависимые эффекты мемантина рассматриваются как основа его клинического применения при деменциях [40].
/73.jpg)
Уже в эксперименте было выявлено нейропротекторное действие мемантина, обеспечивающее защиту холинергических нейронов в базальном ядре Мейнерта, сопровождающееся улучшением когнитивных функций и процесса обучения [59]. Кроме того, введение мемантина непосредственно устраняло патологические изменения в гиппокампе, вызываемые прямым введением бета-амилоида [47], что выражалось в уменьшении степени повреждения и общего числа пикнотических фрагментированных клеток. Отмеченная реакция прямо указывает на ослабление процессов апоптоза. Такие эффекты отмечались при введении низких, сопоставимых с терапевтическими, доз мемантина, при которых не проявлялись какие-либо побочные эффекты.
Таким образом, стало очевидным, что мемантин отвечает двум основным требованиям, предъявляемым к лекарственным средствам для лечения деменции: во-первых, он улучшает когнитивные функции и, во-вторых, может замедлять прогрессирование нейродегенеративного процесса за счет торможения формирования АРР и фосфорилирования тау-белка [28], что не свойственно ни препаратам ИАХЭ, ни другим инструментам фармакотерапии деменций (ноотропы, нейромидин).
Упомянутые экспериментальные данные способствовали интенсивной апробации мемантина в клинической практике при различных формах и стадиях дементного процесса.
При этом сразу же необходимо выделить три основных выявленных клинических преимущества мемантина:
1) эффективность при различных формах деменций (БА, СД, ДТЛ, деменция при болезни Паркинсона);
2) воздействие на широкий спектр клинической симптоматики (когнитивные и нейропсихиатрические симптомы + повседневная активность и качество жизни);
3) эффективность при клинических формах различной степени тяжести (от легкой до тяжелой степени).
На первом этапе клиническая эффективность мемантина изучалась у пациентов с деменциями различного генеза мягкой (начальной) и умеренной степени выраженности.
При лечении пациентов с БА и СД мемантином в течение 1,5–2 месяцев первые статистически значимые благоприятные эффекты препарата отмечались уже через 2 недели терапии, а к концу исследований упомянутые эффекты становились еще более выраженными [4, 30, 34]. Улучшение касалось всего спектра когнитивных функций (память, ориентация, скорость нейродинамических процессов), а также расстройств речи, психоэмоциональных функций, психопатологической симптоматики (спутанность, страх, тревожность), способности к самообслуживанию. В целом положительный терапевтический эффект разной степени выраженности достигался у 75–88 % пациентов, что следует признать весьма высоким показателем в фармакотерапии деменций.
Достаточно скоро стало ясно, что мемантин обладает наиболее комплексным клинико-фармакологическим действием из всех препаратов, применявшихся для лечения деменций.
Упомянутые данные были подтверждены более поздними многоцентровыми двойными слепыми плацебо-контролируемыми исследованиями у больных БА и СД [6, 31, 52]. Важнейшей особенностью этих исследований было включение в них пациентов с умеренными и тяжелыми клиническими формами, т.е. изначально весьма проблемных в терапевтическом плане. Полученные результаты 6-месячного курса лечения свидетельствуют о сохранении на протяжении данного периода когнитивного функционирования пациентов (в том числе с тяжелой деменцией) на уровне, предшествующем началу лечения, а также о поддержании возможностей физического самообслуживания и об уменьшении выраженности поведенческих и психотических симптомов.
В другом исследовании была подтверждена долгосрочная эффективность мемантина (стабилизация когнитивных функций) у пациентов с мягкой и умеренной деменцией (БА и СД) при лечении длительностью до 1 года [35], которая затем была верифицирована в рамках обширного метаанализа [55]. Особо следует подчеркнуть, что в отличие от ИАХЭ эффективность мемантина прямо коррелировала с тяжестью клинического состояния пациентов с БА, т.е. препарат демонстрировал большую эффективность на более тяжелых стадиях заболевания [29, 60].
При изучении клинического действия мемантина обращает на себя внимание выявленная целесообразность его применения при сосудистых когнитивных расстройствах, когда своевременная патогенетическая терапия может существенно затормозить прогрессирование когнитивного дефицита и формирование клинической картины деменции [7, 15, 50, 53], а также в случаях синдрома слабоумия неуточненной природы [50].
В настоящее время мемантин рассматривается как препарат патогенетического типа действия для лечения деменций с максимально широким спектром клинического применения [2, 10, 20, 50]. В связи с этим особо следует отметить активный интерес исследователей и клиницистов к обоснованию сочетанного применения мемантина и препаратов ИАХЭ, по которому уже имеется солидная доказательная база. Наиболее обосновано совместное назначение мемантина и донепезила [23, 43, 44, 54], хотя имеются и убедительные данные по комбинации с ривастигмином [26] и галантамином [44]. Включение мемантина в схемы лечения препаратами ИАХЭ способствует достоверному повышению эффективности терапии в плане улучшения параметров когнитивной сферы, функциональной активности и общего состояния при сроках наблюдения 6–12 месяцев. Отмеченные результаты с фармакологической точки зрения обоснованы различными взаимодополняющими механизмами действия данных препаратов на нейродегенеративные процессы в ЦНС, а именно на два важнейших компонента их патогенеза — глутаматергическую эксайтотоксичность и холинергический дефицит.
В последние годы мемантин прошел успешную апробацию и в отечественных клиниках. Была доказана высокая эффективность препарата у пациентов с сосудистыми когнитивными нарушениями [12, 17, 21], начальными стадиями БА и СД [1], а также с умеренными и тяжелыми формами БА [16] и СД [9].
Важно подчеркнуть, что сфера применения мемантина неуклонно расширяется. Следует выделить результаты его применения как эффективного нейропротектора и когнитивного активатора, препарата, улучшающего двигательную активность и психоэмоциональный статус при ишемическом инсульте с когнитивными нарушениями в раннем (1-я неделя — 3-й месяц) [18] и позднем восстановительном (3–12 мес.) [13] периодах, что может объясняться недавно выявленными способностями мемантина активировать процессы нейропластичности и увеличивать число синаптических контактов в очаге ишемии [41]. Эта способность принципиально выделяет мемантин среди всех прочих антидементных средств и в значительной степени может объясняться блокадой реакций эксайтотоксичности как ключевого механизма действия мемантина.
Кроме того, имеются убедительные данные об эффективности мемантина (улучшение общего клинического состояния, когнитивных и поведенческих симптомов) при такой сложной и малокурабельной патологической форме, как ДТЛ [14, 32].
Именно здесь следует особо подчеркнуть, что отмеченная широта клинического действия мемантина и его эффективность при различных формах патологии ЦНС определяются прежде всего влиянием на универсальный патофизиологический механизм развития нейродегенеративной и цереброваскулярной патологии — гиперактивность глутаматергической нейромедиации и феномен эксайтотоксичности, что принципиально выделяет мемантин из всего спектра как антидементных средств, так и препаратов нейропротекторного типа действия.
Важнейшей стороной клинического применения мемантина является его хорошая переносимость и безопасность. Побочные эффекты при его применении отмечались весьма редко и проявлялись, как правило, при ускоренном титровании дозы в виде психомоторного возбуждения, беспокойства, головокружения, головной боли, утомляемости, инсомнии, тошноты, которые чаще всего корригировались простым снижением дозовой нагрузки.
Мемантин, помимо ИАХЭ, хорошо сочетается также с другими лекарственными средствами, в частности, кардио- и вазотропного типа действия [18], широко применяемыми в комплексной терапии СД и как сопутствующая терапия при БА и других формах деменций у пациентов с патологией сердечно-сосудистой системы.
Противопоказанием к приему препарата является только повышенная чувствительность к нему.
Дозовый режим при лечении мемантином обеспечивается процедурой титрования и составляет:
— 1-я неделя — 5 мг (1/2 таблетки 1 раз в сутки);
— 2-я неделя — 10 мг (1/2 таблетки 2 раза в сутки или 1 таблетка 1 раз в сутки);
— 3-я неделя — 15 мг (1 таблетка 1 раз в сутки + 1/2 таблетки 1 раз в сутки);
— 4-я неделя — 20 мг (1 таблетка 2 раза в сутки), что является рекомендуемой поддерживающей дозой.
Важно подчеркнуть, что возраст не влияет на фармакокинетику мемантина и данный дозовый режим может быть применен у пациентов всех возрастных групп. Только у пациентов с выраженной почечной недостаточностью рекомендуется снижение суточной дозы до 10 мг.
В итоге мемантин характеризуется следующими клиническими преимуществами:
1) эффективность при различных формах деменции (БА, СД, смешанная, ДТЛ);
2) эффективность при всех стадиях развития патологического процесса (от легкой до тяжелой);
3) комплексность воздействия на все основные клинические синдромы (когнитивный, поведенческий, психоэмоциональный);
4) долгосрочность клинических эффектов;
5) медико-социальная эффективность (улучшение способности к самообслуживанию, уменьшение нагрузки на семью и медицинский персонал);
6) хорошая переносимость и безопасность;
7) сочетаемость с другими лекарственными средствами в рамках комбинированной терапии.
На фармацевтическом рынке Украины следует отметить появление нового препарата мемантина — Нейронтин в виде таблеток по 10 мг. Нейронтин оптимально сочетает европейские стандарты качества и максимальную экономическую доступность, что позволяет значительно расширить возможности применения мемантина в отечественной клинической практике.
В итоге необходимо подчеркнуть, что мемантин на сегодняшний день является не только одним из эффективных патогенетических инструментов лечения различных форм деменций, но, по сути, репрезентирует целый класс еще недостаточно разработанных, но весьма перспективных лекарственных средств — направленных регуляторов глутаматергической нейромедиации, потенциал клинического применения которых может включать самые разнообразные нозологические формы в неврологической практике как нейродегенеративной, так и сосудистой природы. Дальнейшее изучение механизмов действия (еще далеко не полностью известных) и клинических эффектов мемантина позволит сделать существенный шаг в усовершенствовании фармакотерапии одной из наиболее актуальных в медицинском и медико-социальном плане форм патологии — деменций, а также других заболеваний нервной системы.
Список литературы
1. Бачинська Н.Ю., Рожелюк І.Ф., Полєтаєва К.М. та ін. Застосування мемантину гідрохлориду у хворих похилого віку на початкових стадіях судинної деменції і хвороби Альцгеймера // Лік. справа. — 2013. — № 7. — С. 80-96.
2. Бачинская Н.Ю. Лечение болезни Альцгеймера: современные возможности и перспективы // НейроNews. — 2015. — № 2/1. — С. 10-17.
3. Бурчинский С.Г. Холинергическая фармакотерапия болезни Альцгеймера // НейроNews. — 2008. — № 3. — С. 20-23.
4. Гаврилова С.И., Калын Я.Б., Колыхалов И.В. и др. Акатинол мемантин — модулятор глутаматергической системы в лечении деменций альцгеймеровского типа // Соц. клин. психиат. — 1995. — № 2. — С. 78-89.
5. Гаврилова С.И. Фармакотерапия болезни Альцгеймера. — М.: Пульс, 2003. — 320 с.
6. Гаврилова С.И., Калын Я.Б., Селезнева Н.Д. и др. Глутаматергическая терапия болезни Альцгеймера на стадии умеренно-тяжелой и тяжелой деменции: результаты 26-недельного исследования эффективности и безопасности препарата акатинол мемантин // Журн. неврол. и психиат. — 2005. — Т. 105, № 2. — С. 72-76.
7. Гудкова А.А., Сорокина И.Б., Яковлев А.А. и др. Применение препарата акатинол мемантин у больных с сосудистыми когнитивными расстройствами // Журн. неврол. и психиат. — 2010. — Т. 110, № 12. — С. 37-40.
8. Дамулин И.В. Смешанная деменция // Когнітивні порушення при старінні: Мат. наук.-практ. конф., Київ (30–31 січня 2007 р.). — Київ, 2007. — С. 24.
9. Дзяк Л.А., Мизякина Е.В. Абикса — новая стратегия лечения больных с сосудистой деменцией // НейроNews. — 2008. — № 3. – С. 68-71.
10. Камчатнов П.Р. Когнитивный резерв, когнитивные нарушения и возможность их медикаментозной коррекции // Журн. неврол. и психиат. — 2014. — Т. 114, № 3. — С. 87-91.
11. Колыхалов И.В., Рассадина Г.А., Гаврилова С.И. и др. Холинергическая терапия болезни Альцгеймера и ее влияние на здоровье и качество жизни ухаживающих за больными лиц // Журн. неврол. и психиат. — 2010. — Т. 110, № 5. — С. 33-38.
12. Копчак О.О. Вивчення ефективності тривалого застосування мемантину в лікуванні когнітивних порушень у хворих з хронічною недостатністю мозкового кровообігу // Ліки України. — 2012. — № 1. — С.73-78.
13. Котов С.В., Исакова Е.В., Чатаева Г.С. и др. Акатинол мемантин в лечении больных ишемическим инсультом // Психиат. психофармакотер. — 2005. — Т. 7, № 6. — С. 1-7.
14. Левин О.С. Эффективность и безопасность мемантина при деменции с тельцами Леви // Журн. неврол. и психиат. — 2008. — Т. 108, № 5. — С. 39-46.
15. Литвиненко И.В., Воробьев С.В., Лобзин В.Ю. и др. Возможности фармакологической модуляции церебральной глутаматергической системы в терапии сосудистых когнитивных нарушений // Журн. неврол. и психиат. — 2013. — Т. 113, № 9. — С. 29-35.
16. Мельников В.А. Абикса: новая терапевтическая стратегия при болезни Альцгеймера // Таврич. журн. психиат. — 2007. — Т. 11, № 1. — С. 115-120.
17. Мищенко Т.С., Дмитриева Е.В., Балковая Н.Б. и др. Применение препарата мема в лечении сосудистых когнитивных расстройств // НейроNews. — 2010. — № 5. — С. 68-71.
18. Никитина Л.Ю., Парфенов В.А. Применение мемантина при ишемическом инсульте // Клин. геронтол. — 2006. — № 11. — С. 28-31.
19. Свістільнік Т.В. Феномен ексайтотоксичності: механізми виникнення, значення в розвитку нейронального пошкодження та можливості його корекції при патологіях ЦНС // Biomed. Biosoc. Anthropol. — 2013. — № 20. — Р. 207-215.
20. Хаустова Е.А., Безшейко В.Г. Рациональное использование мемантина: обзор доказательной базы // НейроNews. — 2015. — № 2. — С. 51-54.
21. Яворская В.А., Бондарь О.Б., Михаелян Т.Х. и др. Коррекция когнитивных нарушений у больных с сосудистыми церебральными расстройствами // Междунар. мед. журн. — 2012. — № 4. — С. 16-24.
22. Alvarez X.A., Figueroa J., Muresanu D. Peptidergic drugs for the treatment of traumatic brain injury // Future Neurol. — 2013. — V. 8. — P. 175-192.
23. Atri A. Memantine in patients with Alzheimer’s disease receiving donepezil: new analyses of efficacy and safety for combination therapy // Alzheimer’s Res. Ther. — 2013. — V. 5. — P. 1-11.
24. Chui D.W. Calcium: still center-stage in hypoxic-ischemic neuronal death // Trends Neurosci. — 1995. — V. 18. — P. 58-60.
25. Cummings J.L., Frank J.C., Cherry D. et al. Guidelines for managing Alzheimer’s disease // Amer. Fam. Physician. — 2002. — V. 65. — P. 2525-2534.
26. Dantoine T., Auricomde S., Sarazin M. et al. Rivastigmin monotherapy and combination therapy with memantine in patients with moderately severe Alzheimer’s disease who failed to benefit from previous cholinesterase inhibitor treatment // Int. J. Clin. Pract. — 2006. — V. 60. — P. 110-118.
27. Danysz W., Parsons C.G., Mobius H.-J. et al. Neuroprotective and symptomatological action of memantine relevant for Alzheimer’s disease — a unified glutamatergic hypothesis on the mechanism of action // Neurotox. Res. — 2000. — V. 2. — P. 85-97.
28. Danysz W., Parsons C.G. Alzheimer’s disease, beta-amyloid, glutamate, NMDA receptors and memantine — searching for the connections // Brit. J. Pharmacol. — 2012. — V. 167. — P. 324-352.
29. DiSanto S.G., Prinelli F., Adorni F. et al. A meta-analysis of the efficacy of donepezil, rivastigmine, galantamine, and memantine in relation to severity of Alzheimer’s disease // J. Alzheimer’s Dis. — 2013. — V. 35. — P. 349-361.
30. Ditzer K. Efficacy and tolerability of memantine in patients with patients with dementia syndrome // Drug. Res. — 1991. — V. 41. — P. 73-78.
31. Doody R., Wirth Y., Schmitt F. et al. Specific functional effects of memantine treatment in patients with moderate to severe Alzheimer’s disease // Dement. Geriatr. Cogn. Disord. — 2004. — V. 18. — P. 227-232.
32. Emre M., Tsolaki M., Bonaccelli U. et al. Memantine for patients with Parkinson’s disease dementia or dementia with Lewy bodies: a randomized, double-blind, placebo-controlled trial // Lancet Neurol. — 2010. — V. 9. — P. 969-977.
33. Farlow M.R., Cummings J.L. Effective pharmacological management of Alzheimer’s disease // Amer. J. Med. — 2007. — V. 120. — P. 388-397.
34. Gortelmeyer R., Erbler H. Memantine in treatment of mild to moderate dementia syndrome // Drug. Res. — 1992. — V. 42. — P. 904-913.
35. Gortelmeyer R., Pantev M., Parsons C.G. et al. The treatment of dementia syndrome with akatinol memantine, a modulator of the glutamatergic system // Spectrum der Neurorehabilitation. — Berlin, 1993. — P. 50-56.
36. Hock C. Biochemical aspects of dementia // Dial. Clin. Neurosci. — 2003. — V. 5. — P. 27-34.
37. Johnson J.W., Glasgow N.G., Povysheva N.V. Recent insights into the mode of action of memantine and ketamine // Cuee. Opin. Pharmacol. — 2015. — V. 20. — P. 54-63.
38. Kalia L.V., Kalia S.K., Salter M.W. MNDA-receptors in clinical neurology: excitatory times ahead // Lancet Neurol. — 2008. — V. 7. — P. 742-755.
39. Lipton S.A. Paradigm shift in NMDA receptor antagonist drug development: molecular mechanism of uncompetitive inhibition by memantine in the treatment of Alzheimer’s disease and other neurologic disorders // J. Alzheimer’s disease. — 2004. — V. 6. — P. 61-74.
40. Lipton S.A. Pathologically-activated therapeutics for neuroprotection: mechanism of NMDA-receptor block by memantine and S-nitrosylation // Curr. Drug Targets. — 2007. — V. 8. — P. 621-632.
41. Lopez-Valdes H.E., Clarkson A.N., Ao Y. et al. Memantine enhances recovery from stroke // Stroke. — 2014. — V. 45. — P. 2093-2100.
42. Mark L.P., Prost R.W., Ulmer J.L. et al. Pictorial review of glutamate excitotoxicity: fundamental concepts for neuroimaging // Amer. J. Neuroradiol. — 2001. — V. 22. — P. 1813-1824.
43. Matsunaga S., Kishi T., Iwata N. Combination therapy with cholinesterase inhibitors and memantine for Alzheimer’s disease: a systematic review and meta-analysis // Int. J. Neuropsychopharmacol. — 2014. — V. 18. — P. 864-880.
44. Matsuzono K., Hishikawa N., Ohta Y. et al. Combination therapy of cholinesterase inhibitor (donepezil or galantamine) plus memantine in the Okayama Memantine Study // J. Alzheimer’s Dis. — 2015. — V. 45. — P. 771-780.
45. McKnight C. Switching cholinesterase inhibitors // Geriatrics Aging. — 2007. — V. 10. — P. 158-161.
46. Mendez M.F., Cummings J.L. Dementia. — Philadelphia: Butterworth Heinemann, 2003. — 654 p.
47. Miquel Hidalgo J.J., Alvarez X.A., Quack G. et al. Protection by memantine against Ab (1-40)-induced neurodegeneration in CA1 subfield // Neurobiol. Aging. — 1998. — V. 19. — P. 542.
48. Parsons C.G., Danysz W., Quack G. Memantine is a clinically well tolerated N-methyl-D-aspartate (NMDA) — receptor antagonist — a review of preclinical data // Neuropharmacology. — 1999. —V. 38. — P. 735-767.
49. Parsons C.G., Stoffler A., Danysz W. Memantine: a NMDA receptor antagonist that improves memory by restoration of homeostasis in the glutamatergic system — too little activation is bad, too much is even worse // Neuropharmacology. — 2007. — V. 53. — P. 699-723.
50. Peng D., Yuan X., Zhu R. Memantine hydrochloride in the treatment of dementia subtypes // J. Clin. Neurosci. — 2013. — V. 20. — P. 1482-1485.
51. Rammes G., Rupprecht R., Ferrari U. et al. The N-methyl-d-aspartate receptor channel blockers memantine, MRZ 2/579 and other amino-alkyl-cyclohexanes antagonize 5-HT3 receptor currents in cultured HEK-293 and NIE-115 cell systems in a non-competitive manner // Neurosci. Lett. — 2001. — V. 306. — P. 81-84.
52. Reisberg B., Doody R., Stoffer A. et al. A 24-week open-label extension study of memantine in moderate to severe Alzheimer’s disease // Arch. Neurol. — 2006. — V. 63. — P. 49-54.
53. Ritter A., Pillai J.A. Treatment of vascular cognitive impairment // Curr. Treat. Options Neurol. — 2015. — V. 17. — P. 367.
54. Riordan K.C., Snyder C.R.H., Wellik K.E. et al. Effectiveness of adding memantine to an Alzheimer’s dementia treatment regimen with already includes stable donepezil therapy: a critical appraisal topic // Neurologist. — 2011. — V. 17. — P. 121-123.
55. Robinson D.W., Keating G.M. Memantine: a review of its use in Alzheimer’s disease // Drugs. — 2006. — V. 66. — P. 1515-1534.
56. Rothman S.M., Olney J.W. Excitotoxicity and the NMDA-receptors // Trends Neurosci. — 1987. — V. 10. — P. 299-302.
57. Schneider L.S. Фармакотерапия болезни Альцгеймера и исследования, касающиеся вопросов ее лечения // Міжнар. неврол. журн. — 2014. — № 4. — С. 114-131.
58. Seeman P., Caruso C., Lasaga M. Memantine agonist action at dopamine D2 high receptors // Synapse. — 2008. — V. 62. — P. 149-153.
59. Wenk G.L., Danysz W., Mobley S.L. MK-801, memantine and amantadine show neuroprotective activity in the nucleus basalis magnocellularis // Eur. J. Pharmacol. Env. Tox. Pharmacol. — 1995. — V. 293. — P. 267-270.
60. Winblad B., Jones R.W., Wirth Y. et al. Memantine in moderate to severe Alzheimer’s disease: a meta-analysis of randomized clinical trials // Dement. Geriatr. Cogn. Disord. — 2007. — V. 24. — P. 20-27.

/72.jpg)
/73.jpg)