Статья опубликована на с. 97-102
Введение
В современном обществе люди сталкиваются с множеством испытаний для психики: постоянные стрессы на работе и дома, спешка, ограниченное время для сна, эмоциональные переживания — все это создает перманентную нагрузку на нервную систему. Благодаря активизации адаптивных механизмов в головном мозге какое-то время удается справляться со всеми этими нагрузками. Однако нередко эти механизмы истощаются или не включаются вообще, что может приводить к появлению тревоги, изменению общего эмоционального фона и настроения и стать началом тревожно-депрессивных расстройств. Стресс и, как следствие, депрессия являются, в свою очередь, немаловажным этиологическим фактором в снижении иммунитета и развитии многих соматических заболеваний — инсульта и инфаркта, язвенной болезни желудка и двенадцатиперстной кишки, артериальной гипертензии, гипотонии, стенокардии, бронхиальной астмы и многих других. Такие пациенты обращаются за консультацией к врачам различных специальностей, которые часто наблюдают недостаточную эффективность, казалось бы, правильно подобранного лечения. Причиной снижения эффективности лечения соматической патологии зачастую может быть нескорректированный психологический статус больного. Пациенты с легким депрессивным синдромом в подавляющем большинстве случаев выпадают из поля зрения врача и не получают необходимой терапии. Еще одной причиной в дополнение к сложностям диагностики является отрицательное отношение пациентов к антидепрессантам и психотропным препаратам, а также нежелание врачей назначать синтетические антидепрессанты из-за их побочных эффектов.
Европейское региональное бюро ВОЗ опубликовало в Health Evidence Network данные самого крупного систематического обзора материалов исследований, наблюдений и метаанализов работ, в которых изучается влияние психосоциальных факторов на развитие не только сердечно-сосудистых, но и онкологических заболеваний. В частности, данная работа содержит доказательства ассоциации сердечно-сосудистых заболеваний (ССЗ) с депрессией [38]. Данные других исследований говорят о наличии взаимосвязи между бронхиальной астмой и депрессивными расстройствами. Специалисты отмечают более высокую заболеваемость бронхиальной астмой среди больных с тревожным синдромом. Например, Koltek и соавт. обнаружили большую частоту астмы среди подростков с посттравматическим стрессовым расстройством [36]. Ortega и соавт. в исследовании с участием 1285 молодых людей с бронхиальной астмой также зафиксировали более высокие показатели социально-психологических расстройств по сравнению с их сверстниками, не страдающими данной патологией [37].
С другой стороны, существует проблема соматизации тревожно-депрессивных расстройств, которая активно изучается во многих зарубежных исследованиях. Пациенты, имеющие такие расстройства, субъективно оценивают общее ухудшение состояния своего здоровья и тяжесть соматического заболевания неадекватно высоко по сравнению с данными объективных исследований. Они часто недовольны качеством медицинского обслуживания, обращаются к нескольким врачам по поводу одних и тех же жалоб. Получив подтверждение наличия у них соматического заболевания, такие пациенты отказываются признавать необходимость коррекции психологических расстройств, не соглашаются принимать синтетические антидепрессанты и часто остаются резистентны к терапии соматической патологии. По данным Arthur J. Barsky и соавт., соматизированные больные в два раза чаще обращаются за медицинской помощью и их лечение обходится в два раза дороже в сравнении с пациентами с аналогичными диагнозами без психологических проблем. Симптомы у этих пациентов незначительны, однако они приводят к выраженной дисфункции, длительным периодам нетрудоспособности и даже инвалидности, что вносит еще и экономическую составляющую в данную проблему [35].
Таким образом, взаимосвязь тревожно-депрессивного синдрома с соматической патологией, утяжеление состояния больного при наличии такого сочетания диктуют необходимость врачам различных профилей учитывать психическое здоровье пациентов при лечении их соматических заболеваний.
На сегодняшний день предпочитаемыми вариантами терапевтического воздействия при тревожных и депрессивных расстройствах являются когнитивно-поведенческая терапия и фармакологические агенты. Для лечения краткосрочных тревожных расстройств применяются бета-блокаторы и бензодиазепины, тогда как для терапии хронических состояний — селективные ингибиторы обратного захвата серотонина (СИОЗС), селективные ингибиторы обратного захвата серотонина и норадреналина (СИОЗСН) и ингибиторы моноамин-оксидазы (МАО). Однако эти препараты часто имеют выраженные побочные эффекты в виде изменений когнитивной сферы (в случае применения бензодиазепинов [1]) или проблем с сердечно-сосудистой системой (в случае применения ингибиторов обратного захвата серотонина [2]). Кроме того, нельзя не учитывать отношение пациентов к назначаемым препаратам, т.к. негативное отношение в сочетании с возможностью развития побочных эффектов становится препятствием в достижении желаемого результата.
Альтернативой этому могут быть препараты растительного происхождения, которые обладают сходными эффектами, но при этом практически не вызывают побочных явлений. Пациенты проявляют значительно более высокую готовность использовать растительные препараты, чем синтетические антидепрессанты. Так, по данным крупного популяционного исследования, проведенного в США, использование препаратов растительного происхождения выросло с 34 % в 1990 году до 42 % в 1997 году [3] и их применение продолжает расти. При этом их использование было почти вдвое больше у лиц с тревогой и депрессий, чем с какой-либо другой патологией. Врач, назначая такому больному средства растительного происхождения для коррекции психологического статуса, практически сводит к нулю возможное развитие побочных эффектов терапии при высокой эффективности таких препаратов в борьбе с легкими тревожно-депрессивными расстройствами.
Особую важность использование растительных препаратов приобретает в лечении соматоформных расстройств. Проблема лечения пациентов с расстройствами этой группы чрезвычайно актуальна и является предметом изучения во многих научных работах. Прежде всего это связано с их высокой распространенностью: 12-месячная распространенность в европейской популяции составляет в среднем 6,3 % с колебаниями в пределах 1,1–11 % в зависимости от страны, в которой проводили исследование [39]. По данным обзора 26 крупных рандомизированных исследований с общим участием 2159 пациентов, натуральные препараты в большей степени, чем плацебо, снижали соматические симптомы и тревогу у больных с соматоформными расстройствами. Тогда как курс лечения трициклическими антидепрессантами длительностью 6–12 недель уменьшал выраженность соматических симптомов не в большей степени, чем плацебо.
В последние годы появилось огромное количество исследований на тему применения препаратов растительного происхождения для лечения легкой и умеренной тревожности, тревожно-депрессивных расстройств, нарушений сна. В данном обзоре освещены некоторые имеющиеся данные о препаратах зверобоя и валерианы и результаты их применения в лечении тревожно-депрессивных расстройств.
Зверобой (Hypericum perforatum)
Экстракты зверобоя применяются в медицине многие века и уже давно доказали свою эффективность в многочисленных современных исследованиях. Экстракт зверобоя содержит минимум 10 биологически активных веществ. К ним относятся феноловые кислоты (хлорогеновая кислота), флавоноиды (кверцетин, кверцитрин, изокверцитрин, рутин, гиперозид, эпигенанин), производные флороглюцинола (гиперфорин, адгиперфорин) и нафтодиантроны (гиперицин, псевдогиперицин) (рис. 1).
/98.jpg)
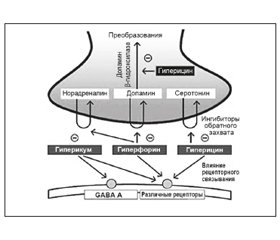
До недавнего времени считалось, что антидепрессивные и противовоспалительные свойства зверобоя связаны с нафтодиантронами [5], однако данные новых исследований показали, что в реализации этого механизма значительную роль играют также гиперфорин [6, 7] и производные флавоноидов [8]. Сейчас принято считать, что различные эффекты зверобоя реализуются через суммацию и синергетическое действие всех его компонентов [9, 10]. В исследовании антидепрессивных свойств экстракта зверобоя на молекулярном уровне было показано, что данная функция реализуется в ЦНС через ингибирование обратного захвата серотонина (эффект, подобный антидепрессантам из группы СИОЗС), дофамина, норадреналина, ГАМК и L-глутамата [11]. В экспериментальном исследовании был показан нейропротективный эффект экстракта зверобоя и его способность улучшать когнитивную функцию [12]. В другом лабораторном исследовании, проведенном Tian с коллегами и опубликованном в 2014 году [13], была установлена роль адгиперфорина, недавно обнаруженного нового активного компонента экстракта зверобоя, в реализации мощной антидепрессантоподобной активности. По данным авторов, этот механизм реализуется через ингибирование обратного захвата серотонина, дофамина и норадреналина, а также высокую аффинность связи с переносчиками серотонина и норадреналина (рис. 2).
/99.jpg)
Большинство клинических исследований у людей на сегодняшний день сфокусировано на антидепрессивных свойствах экстракта зверобоя. Так, в ряде систематических обзоров литературы и метаанализов была подтверждена эффективность экстракта зверобоя в лечении легкой и умеренной депрессии [14]. В рандомизированном клиническом исследовании экстракта зверобоя при соматоформных расстройствах, сопровождающихся высоким уровнем тревоги [15], был показан значительный положительный эффект экстракта зверобоя по сравнению с плацебо в уменьшении соматической и психической тревоги, общего балла тревожности и выраженности симптомов соматоформного расстройства. В последнем Кокрановском обзоре, проведенном Linde с соавторами в 2008 году, анализировались данные 29 методологически идентичных контролируемых клинических исследований [16], в 18 из которых эффективность и безопасность экстракта зверобоя сравнивалась с плацебо, в 17 — со стандартной терапией синтетическими антидепрессантами. Общее число пациентов, участвующих в исследованиях, составило 5489. За основной показатель эффективности принимался относительный коэффициент положительного эффекта от лечения, показывающий, во сколько раз чаще эффект от лечения был достигнут при использовании экстракта зверобоя по сравнению с использованием средств сравнения. Эффективной терапия считалась при достижении ремиссии. По данным 8 крупных исследований, этот коэффициент для экстракта зверобоя по сравнению с плацебо составил в среднем 1,28 (95% доверительный интервал 1,1–1,47), т.е. в среднем ремиссия достигалась в 1,28 раза (на 28 %) чаще при лечении экстрактом зверобоя, чем при применении плацебо. В 9 более мелких исследованиях коэффициент был 1,87 (95% ДИ 1,22–2,87), т.е. эффективность зверобоя в этих исследованиях превышала эффективность плацебо практически в 2 раза.
Исследования эффективности зверобоя и антидепрессантов показали, что достигнутые эффекты сходны в обеих группах. Так, по сравнению с три- или тетрациклическими антидепрессантами и селективными ингибиторами обратного захвата серотонина соответственно коэффициент эффективности был 1,02 (95% ДИ 0,90–1,15, по данным 5 исследований) и 1,00 (95% ДИ 0,90–1,11, по данным 12 исследований), т.е. количество пациентов, достигших ремиссии, было одинаковым в обеих группах.
Безопасность препарата оценивалась путем сравнения количества пациентов, прекративших лечение из-за развития нежелательных эффектов. В группе больных, принимавших зверобой, прекратили лечение достоверно меньше пациентов, чем в группе принимавших антидепрессанты. Коэффициент сравнения для трициклических антидепрессантов составил 0,24 (95% ДИ 0,13–0,46) и для СИОЗС — 0,53 (95% ДИ 0,34–0,83), т.е. пациенты, принимавшие экстракт зверобоя, прекращали лечение в связи с развитием нежелательных эффектов в 4 раза реже по сравнению с пациентами в группе трициклических антидепрессантов и в 2 раза реже по сравнению с принимавшими СИОЗС.
Таким образом, данные клинических исследований говорят о том, что экстракт зверобоя так же эффективен, как синтетические антидепрессанты, в лечении депрессивных расстройств легкой и средней степени тяжести при достоверно меньшем количестве побочных эффектов.
Валериана (Valeriana officinalis)
Первые упоминания о валериане относятся к далекому прошлому. Известно, что еще во II веке нашей эры Клавдий Гален применял валериану для лечения бессонницы. Однако применение препаратов валерианы сегодня основывается на данных современных исследований.
В состав валерианы входит более 150 биологически активных веществ [17–19], которые можно разделить на несколько групп: бициклические монотерпены (валепотриаты — вальтрат и дигидровальтрат), летучие масла (валеранон, валеренал, валереновая кислота), сесквитерпены, лигнаны, алкалоиды, аминокислоты (ГАМК, тирозин, аргинин, глутамин) (рис. 3). Ранее считалось, что валепотриаты, открытые еще в 1966 году, являются единственным биологически активным компонентом, оказывающим терапевтическое действие, однако позже, с выявлением новых молекул данная точка зрения изменилась [20]. Компоненты, входящие в состав валерианы, действуют синергично и дополняют друг друга [21, 22].
/100.jpg)
Известно, что компоненты валерианы связываются со множеством нейротрансмиттерных рецепторов [23], включая серотониновые 5-HT5A-рецепторы [24], что оказывает эффект на циркадные ритмы и уровень тревоги. Компоненты валерианы также являются аллостерическими модуляторами субъединице-специфических ГАМК-А-каналов [25] и аденозиновых А1-рецепторов [26]. В экспериментальных исследованиях был установлен выраженный анксиолитический эффект [27], обусловленный связыванием валереновой кислоты и ее производных со специфической бета-3-субъединицей ГАМК-А-рецептора [28]. Компоненты валерианы также подавляют фермент-индуцированный распад ГАМК, оказывая, таким образом, седативный эффект [29]. В исследовании Bodesheim с коллегами было показано, что компонент валерианы гидроксипинорезинол имеет свойство связываться с бензодиазепиновыми рецепторами [30].
В двойном слепом исследовании 48 взрослых испытуемых, помещенных в условия экспериментального социального стресса, применение экстракта валерианы уменьшало субъективное ощущение тревоги [31]. В другом рандомизированном плацебо-контролируемом исследовании было показано значительное снижение тревожности по шкале тревоги Гамильтона через 4 недели при применении препаратов валерианы (80 мг/сут), сопоставимое с применением диазепама (6,5 мг/сут) [32].
От монотерапии к эффективной комбинации
На сегодняшний день в общетерапевтической практике большинство пациентов с соматической патологией имеют ту или иную степень выраженности тревоги и депрессии, нарушений сна, сниженный фон настроения. Разнообразие психовегетативных нарушений обусловливает необходимость воздействия не на какое-то одно клиническое проявление, а на весь симптомокомплекс, имеющийся у пациента. Именно данный факт привел к тому, что в Германии, где культура использования растительных препаратов особенно высока, стали применять комбинацию экстракта зверобоя и экстракта валерианы. Процесс изготовления фитопрепаратов происходит в соответствии со строгими принципами стандартизации и с использованием методов, указанных в национальной фармакопее. Это означает, что препараты растительного происхождения соответствуют таким же строгим критериям качества, эффективности и безопасности, как и синтетические лекарственные средства.
В Германии с 1980 года было проведено более 350 клинических исследований с применением стандартизированных фитопрепаратов. В этих исследованиях изучалась эффективность препаратов растительного происхождения при лечении различных заболеваний легкой или средней степени тяжести или для профилактики последних. Некоторые сравнительные исследования показали, что препараты растительного происхождения имеют полную терапевтическую эквивалентность с химически синтезированными препаратами, не имея при этом побочных эффектов. Механизм действия таких фитопрепаратов, содержащих, в отличие от синтетических агентов, несколько активных компонентов, характеризуется как поливалентный, а в некоторых случаях — как потенцирующий.
Примером удачной комбинации экстрактов зверобоя и валерианы является препарат Седаристон, производимый в Германии. Он содержит 100 мг сухого экстракта травы зверобоя и 50 мг сухого экстракта корневищ и корней валерианы. В различных исследованиях было показано, что такая комбинация превосходит по эффективности монотерапию этими препаратами за счет комплексного и взаимопотенцирующего эффекта. Так, в открытом исследовании экстракта зверобоя в комбинации с экстрактом валерианы в лечении тревожно-депрессивных расстройств [33] было показано, что такая комбинация более эффективна, чем монотерапия экстрактом зверобоя; отмечалось значительное уменьшение тревожности при практически отсутствующих побочных эффектах.
В другом двойном слепом рандомизированном исследовании была показана более высокая эффективность стандартизированного экстракта зверобоя и валерианы в составе препарата Седаристон в лечении пациентов с тревожными состояниями средней степени тяжести по сравнению с диазепамом в дозе 4–6 мг в сутки [34].
Немецкие ученые K. Hiller, V. Rahlfs в двойном слепом рандомизированном контролируемом исследовании также оценили эффективность Седаристона в сравнении с амитриптилином при лечении больных с диагнозами: дистимия, короткие или более длительные депрессивные реакции, неврастения или невротическая депрессия (n = 153). Пациенты группы Седаристона получали по 1 или 2 капсулы 3 раза в сутки. Амитриптилин назначался в дозировке 25 или 50 мг 3 раза в сутки. Продолжительность лечения в обеих группах составила 6 недель. Оценка уровня депрессии производилась по шкале Гамильтона. Положительный эффект был достигнут у 82 % в группе Седаристона и у 77 % — в группе амитриптилина. Суммарная оценка по шкале Гамильтона сократилась с 24,2 до 8,4 балла после лечения Седаристоном и с 24,3 до 8,9 балла после лечения амитриптилином. Результаты этого исследования доказывают, что эффективность Седаристона при лечении тревожно-депрессивных расстройств не уступает эффективности амитриптилина. При этом Седаристон показал гораздо более высокий профиль безопасности. Его применение не сопровождалось развитием таких побочных явлений, как сонливость, перепады настроения и т.д.
Заключение
Единственным в Украине зарегистрированным препаратом, содержащим комбинацию экстрактов зверобоя и валерианы, является СЕДАРИСТОН. Эффект комбинированного препарата превышает простую сумму эффектов, оказываемых каждым экстрактом в отдельности. Такая превосходящая эффективность указанной фитокомбинации объясняется не только анксиолитической составляющей действия ее растительных компонентов, но и повышающим настроение эффектом зверобоя. Эффективность СЕДАРИСТОНа сопоставима с эффективностью таких синтетических препаратов, как амитриптилин и диазепам. Благодаря отсутствию сонливости при приеме СЕДАРИСТОНА круг пациентов для его назначения чрезвычайно широк.
Список литературы
1. Takahshi M., Iwamoto K., Kawamura Y., Nakamura Y., Ishihara R., Uchiyama Y., Ebe K., Noda A., Noda Y., Yoshida K., Iidaka T., Ozaki N. The effects of acute treatment with tandospirone, diazepam, and placebo on driving performance and cognitive function in healthy volunteers // Hum. Psychopharmacol. — 2010. — 25. — 260-7.
2. Smoller J.W., Allison M., Cochrane B.B., Curb J.D., Perlis R.H., Robinson J.G., Rosal M.C., Wenger N.K., Wassertheil-Smoller S. Antidepressant use and risk of incicent cardiovascular morbidity and mortality among postmenopausal women in the Women’s Health Initiative study // Arch. Int. Med. — 2009. — 1169. — 2118-39.
3. Eisenberg D.M., Davis R.B., Ettner S.L., Appel S., Wilkey S., Van Rompay M. et al. Trends in alternative medicine use in the United States, 1990-1997: results of a follow-up national survey // JAMA. — 1998. — 280. — 1569-75.
4. Di Carlo G., Borrelli F., Ernst E., Izzo A. St John’s wort. Prozac from the plant kingdom // Trends Pharmacol. Sci. — 2001. — 22. — 292-7.
5. Meruelo D., Lavie G., Lavie D. Therapeutic agents with dramatic antiretroviral activity and little toxicity at effective doses: aromatic polycyclic diones hypericin and pseudohypericin // Proc. Natl. Acad. Sci USA. — 1988. — 85. — 5230.
6. Zanoli P. Role of hyperforin in the pharmacological activities of St. John’s Wort // CNS Drug Rev. — 2004. — 10. — 203-18.
7. Medina M.A., Martínez-Poveda B., Amores-Sánchez M.I., Quesada A.R. Hyperforin: more than an antidepressant bioactive compound? // Life Sci. — 2006. — 79. — 105-11.
8. Butterweck V., Jurgenliemk G., Nahrstedt A., Winterhoff H. Flavonoids from Hypericum perforatum show antidepressant activity in the forced swimming test // Planta Med. — 2000. — 66. — 3-6.
9. Butterweck V., Schmidt M. St. John’s wort: role of active compounds for its mechanism of action and efficacy // Wien Med. Wochenschr. — 2007. — 157. — 356-61.
10. Filippini R., Piovan A., Borsarini A., Caniato R. Study of dynamic accumulation of secondary metabolites in three subspecies of Hypericum perforatum // Fitoterapia. — 2010. — 81. — 115-9.
11. Butterweck V. Mechanism of action of St John’s wort in depression: what is known? // CNS Drugs. — 2003. — 17. — 539-62.
12. Kumar V., Mdzinarishvili A., Kiewert C., Abbruscato T., Bickel U., Schyf C., Klein J. NMDA receptor-antagonistic properties of hyperforin, a constituent of St. John’s Wort // J. Pharmacol. Sci. — 2006. — 102. — 47-54.
13. Tian J., Zhang F., Cheng J., Guo S., Liu P., Wang H. Antidepressant-like activity of adhyperforin, a novel constituent of Hypericum perforatum L // Scientific Reports. — 2014. — 4. — 5632, 1-6.
14. Pilkington K., Rampes H., Richardson J. Complementary medicine for depression // Expert Rev. Neurother. — 2006. — 6. — 1741-51.
15. Volz H.P., Murck H., Kasper S., Moller H.J. St. John’s wort extract (LI 160) in somatoform disorders: results of a placebo-controlled trial // Psychopharmacology (Berl.). — 2002. — 164. — 294-300.
16. Linde K., Berner M.M., Kriston L. St John’s wort for major depression // Cochrane Database Syst. Rev. — 2008. — CD000448.
17. Gruenwald J. PDR for Herbal Medicines. — Montvale, NJ.: Thomson, 2000. — 1204.
18. Hadley S., Petry J.J. Valerian // Am. Fam. Physician. — 2003. — 67. — 1755-1758.
19. Houghton P.J. The scientific basis for the reputed activity of Valerian // J. Pharm. Pharmacol. May. — 1999. — 51 (5). — 505-512.
20. Weiss R.F., Fintelmann V. Herbal Medicine. — 2nd ed. — Stuttgart, Germany: Thieme, 2000. — 262-263.
21. Houghton P.J. The scientific basis for the reputed activity of valerian // J. Pharm. Pharmacol. — 1999. — 51. — 505-512.
22. Hendriks H., Bos R., Allersma D.P. et al. Pharmacological screening of valerenal and some other components of essential oil of Valeriana officinalis // Planta Med. — 1981. — 42. — 62-68.
23. Marder M., Viola H., Wasowski C., Fernández S., Medina J., Paladini A. 6-Methylapigenin and hesperidin: new valeriana flavonoids with activity on the CNS // Pharmacol. Biochem Behav. — 2003. — 75. — 537-45.
24. Dietz B.M., Mahady G.B., Pauli G.F., Farnsworth N.R. Valerian extract and valerenic acid are partial agonists of the 5-HT5a receptor in vitro // Brain Res. Mol. Brain Res. — 2005. — 138. — 191-7.
25. Khom S., Baburin I., Timin E., Hohaus A., Trauner G., Kopp B., Hering S. Valerenic acid potentiates and inhibits GABAA receptors: molecular mechanism and subunit specificity // Neuropharmacology. — 2007. — 53. — 178-87.
26. Lacher S.K., Mayer R., Sichardt K., Nieber K., Müller C.E. Interaction of valerian extracts of different polarity with adenosine receptors: identification of isovaltrate as an inverse agonist at A1 receptors // Biochem. Pharmacol. — 2007. — 73. — 248-58.
27. Murphy K., Kubin Z.J., Shepherd J.N., Ettinger R.H. Valeriana officinalis root extracts have potent anxiolytic effects in laboratory rats // Phytomedicine. — 2010. — 17. — 674-8.
28. Benke D., Barberis A., Kopp S., Altmann K.H., Schubiger M., Vogt K.E., Rudolph U., Mohler H. GABA(A) receptors as in vivo substrate for the anxiolytic action of valerenic acid, a major constituent of valerian root extracts // Neuropharmacology. — 2009. — 56. — 174-81.
29. Riedel E., Hansel R., Ehrke G. Inhibition of gamma-aminobutyric acid catabolism by valerenic acid derivatives // Planta Med. — 1982. — 46. — 219-220.
30. Bodesheim U., Holzl J. Isolation and receptor binding properties of alkaloids and lignans from Valeriana officialis L // Pharmazie. — 1997. — 52. — 386-391.
31. Kohnen R., Oswald W.D. The effects of valerian, propranolol, and their combination on activation, performance, and mood of healthy volunteers under social stress conditions // Pharmacopsychiatry. — 1988. — 21. — 447-448.
32. Andreatini R., Sartori V.A., Seabra M.L., Leite J.R. Effect of valepotriates (valerian extract) in generalized anxiety disorder: a randomized placebo-controlled pilot study // Phytother. Res. — 2002. — 16. — 650-654.
33. Muller D., Pfeil T., von den Driesch V. Treating depression comorbid with anxiety — results of an open, practice-oriented study with St. John’s wort WS 5572 and valerian extract in high doses // Phytomedicine. — 2003. — 10, suppl. 4. — 25-30.
34. Panijel M. Die Behandlung mittelschwerer Angstzustдnde. Randomisierte Doppelblindstudie zum klinischen Wirksamkeitsvergleich eines Phytotherapeutikums mit Diazepam // Therapiewoche. — 1985. — 41. — 4659-4668.
35. Arthur J. Barsky, E. John Orav, David W. Bates. Somatization Increases Medical Utilization and Costs Independent of Psychiatric and Medical Comorbidity // Arch. Gen. Psychiatry. — 2005. — 62 (8). — 903-910.
36. Goodwin R.D., Pine D.S. Respiratory disease and panic attacks among adults in the United States // Chest. — 2002. — 122645-650.
37. Ortega A.N., Huertas S.E., Canino G., Ramirez R., Rubio-Stipec M. Childhood asthma, chronic illness, and psychiatric disorders // J. Nerv. Ment. Dis. — 2002. — 190275-281.
38. Hynek Pikhart, Jitka Pikhartova. The relationship between psychosocial risk factors and health outcomes of chronic diseases: a review of the evidence for cancer and cardiovascular diseases // Health evidence network synthesis report. — 2015.
39. Wittchen H.U. et al. The size and burden of mental disorders and other disorders of the brain in Europe 2010 // European Neuropsychopharmacology. — 2011. — 21. — 655-679.
/98.jpg)
/99.jpg)
/100.jpg)