Международный неврологический журнал 1 (79) 2016
Вернуться к номеру
Сосудистые и другие клинические эффекты пентоксифиллина (научный обзор)
Авторы: Дубенко О.Е. - Харьковская медицинская академия последипломного образования
Рубрики: Неврология
Разделы: Справочник специалиста
Версия для печати
В статье приведен анализ современных исследований, посвященных фармакологическим и клиническим эффектам пентоксифиллина. Освещены исследования по применению пентоксифиллина при перемежающейся хромоте, ишемической болезни сердца, разных формах цереброваскулярной патологии, а также в онкологии. Показан потенциал пентоксифиллина как препарата, влияющего на мозговой кровоток, восстановление неврологических функций, а также обладающего противовоспалительными и иммуномодулирующими свойствами.
У статті наведений аналіз сучасних досліджень, присвячених фармакологічним і клінічним ефектам пентоксифіліну. Висвітлені дослідження по застосуванню пентоксифіліну при переміжній кульгавості, ішемічній хворобі серця, різних формах цереброваскулярної патології та в онкології. Показаний потенціал пентоксифіліну як засобу, що впливає на мозковий кровотік, відновлення неврологічних функцій, а також має протизапальну та імуномодулюючу дію.
The article provides an analysis of modern studies on the pharmacological and clinical effects of pentoxifylline. The researches on the use of pentoxifylline in intermittent claudication, ischemic heart disease, various forms of cerebrovascular pathology, as well as in oncology, are covered. It shows the potential of pentoxifylline as the drug influencing the brain blood flow, recovery of neurological functions, as well as having anti-inflammatory and immunomodulatory properties.
пентоксифиллин, Вазонит, атеросклероз, цереброваскулярная патология.
пентоксифілін, Вазоніт, атеросклероз, цереброваскулярна патологія.
pentoxifylline, Vasonit, atherosclerosis, cerebrovascular pathology.
Статья опубликована на с. 107-112
Пентоксифиллин (ПТФ) является одним из ведущих препаратов в терапии различных сосудистых расстройств, развивающихся при многих болезнях. Препарат был синтезирован в Германии и с 1970-х годов по настоящее время используется в клинической практике в разных отраслях медицины, спектр его применения постоянно расширяется. ПТФ — производное метилксантина, он улучшает реологические свойства крови за счет уменьшения агрегационной активности эритроцитов, улучшения их пластических свойств, повышения деформируемости, что способствует снижению вязкости крови, улучшению оксигенации тканей, также он снижает уровень фибриногена и стимулирует фибринолиз. ПТФ оказывает слабовыраженное миотропное сосудорасширяющее действие, незначительно снижает общее периферическое сопротивление и обладает положительным инотропным эффектом. Вследствие применения данного лекарственного средства улучшается микроциркуляция и снабжение тканей кислородом. ПТФ расслабляет гладкомышечные клетки, в том числе сосудистой стенки, за счет увеличения содержания внутриклеточного цАМФ. Благодаря этому свойству его и относят к группе вазодилататоров [1, 2]. В последние годы установлены также антиоксидантные, метаболические и эндотелийпротективные свойства ПТФ [3].
Клиническое применение
Пентоксифиллин при цереброваскулярной патологии
1. Ward A., Clissold S.P. Pentoxifylline. A review of its pharmacodynamics and pharmacokinetic properties, and its therapeutic efficacy // Drugs. — 1987. — Vol. 34. — P. 50-97.
2. Bacher A., Eggensperger E., Koppensteiner R. et al. Pentoxifylline attenuates the increase in whole blood viscosity after transfusion // Acta Anaestethiol. Scand. — 2006. — Vol. 49. — P. 41-46.
3. Кузнецова С.М. Клинические аспекты применения пентоксифиллина // Український неврологічний журнал. — 2007. — № 2. — С. 62-67.
4. Кошкин В.М., Богданец Л.И., Наставшева О.Д., Aлексеева Е.А. Место трентала (пентоксифиллина) в программе лечения хронических облитерирующих заболеваний артерий конечностей и различных сосудистых осложнений // Международный неврологический журнал. — 2011. — № 3 (41). — С. 101-104.
5. DeSanctis M.T. Treatment of long-distance intermittent claudication with pentoxifylline: a 12-monthrandomized trial // Angiology. — 2002. — № 53, Suppl. 15. — P. 13-17.
6. Cesarone M.R. et al. treatment of severe intermittent claudication with pentoxifylline: a 40-weeks, controlled, randomized trial // Angiology. — 2002. — № 53, Suppl. 1. — P. S7-12.
7. ACC/AHA 2005 Practice Guidelines for the Management of Patients With Peripheral Arterial Disease (Lower Extremity, Renal, Mesenteric, and Abdominal Aortic) // Circulation. — March 21, 2006. — P. 513.
8. Косарев В.В., Бабанов С.А. Современные подходы к диагностике и лечению облитерирующего атеросклероза нижних конечностей // РМЖ. — 2014. — № 30. — С. 2130-2135.
9. Schandene L., Vandenbussche P., Crusiaux et al. Differential effects of pentoxifylline on the production of tumor necrosis factor-alfa and interleukin-6 by monocytes and T-cells // Immunology. — 1992. — Vol. 76. — P. 30-34.
10. Marques L.J., Zheng L., Poulakis N., Guzman J., Costabel U. Pentoxifylline inhibits TNF-a production from human alveolar macrophages // American Journal of Respiratory and Critical Care Medicine. — 1999 February. — Vol. 159, № 2. — 508-511.
11. Hohenberger P., Latz E., Kettelhack C. et al. Pentoxifyllin attenuates the systemic inflammatory response induced during isolated limb perfusion with recombinant human tumor necrosis factor-a and melphalan // Annals of Surgical Oncology. — 2003. — 10. — 562-568.
12. Ross R. Atherosclerosis — aninflammatory disease // N. Engl. J. Med. — 1999. — Vol. 340. — P. 115-126.
13. Hansson G.K. Inflammation, atherosclerosis, and coronary artery disease // N. Engl. J. Med. — 2005. — Vol. 352 (16). — P. 1685-1695.
14. Okazaki S., Furukado S., Abe Y. et al. Association of inflammatory markers and carotid intima-media thickness with the risk of cardiovascular events in high-risk patients // Cerebrovasc. Dis. — 2010. — Vol. 30. — P. 180-187.
15. Okazaki S., Sakaguchi M., Miwa K. et al. Association of Interleukin-6 with the progression carotid atherosclerosis (a 9-year follow-up study // Stroke. — 2014. — Vol. 45 (10). — P. 2924-2929.
16. Fernandes J., de Oliveira R., Mamoni R. еt al. Pentoxifylline reduces pro-inflammatory and increases anti-inflammatory activity in patients with coronary artery disease — a randomized placebo-controlled study // Atherosclerosis. — 2008. — Vol. 196 (1). — Р. 434-442.
17. Шушляпин О.И., Тучинская М.А., Кононенко Л.Г., Сапричева Л.В. Ключевая роль пентоксифиллина и эналаприла в регуляции воспалительных цитокинов при сердечной недостаточности, обусловленной ишемической болезнью сердца, с метаболическим синдромом // Научные ведомости. Сер. Медицина. Фармация. — 2010. — № 22 (93), вып 12. — С. 117-121.
18. Batchelder K., Mayosi B.M. Pentoxifylline for heart failure: a systematic review // S. Afr. Med. J. — March 2005. — Vol. 95 (Suppl. 3). — P. 171-175.
19. Mohammadpour A.H., Falsoleiman H., Shamsara J., Allah-Abadi G., Rasooli R., Ramezani M. Pentoxifylline decrease serum level of adhesion molecules in atherosclerosis patients // Iran Biomed. J. — 2014. — Vol. 18 (1). — P. 23-27.
20. Широков Е.А. Второе пришествие пентоксифиллина в превентивную кардионеврологию // РМЖ. — 2013. — № 5. — С. 1-3.
21. Kavata A., Aykut K., Sisli E. et al. Pentoxifylline inhibit intimal hyperplasia and vascular smooth muscle cell proliferation in a rabbit carotid artery anastomosis model // Afr. J. Pharm. and Pharmocol. — 2013. — № 5. — P. 1-3.
22. Евтушенко С.К., Грищенко А.Б., Евтушенко И.С. Иммуномодулирующее и противовоспалительное действие трентала (научный обзор) // Международный неврологический журнал. — 2007. — № 6 (16). — С. 13-18.
23. D’haeseller M., Cambon M., Vanopdenbosch L., DeKeyse J. Vascular aspects of multiple sclerosis // Lancet Neurol. — 2011. — Vol. 10. — P. 657-666.
24. Aksungar F.B., Topkaya A.E., Yildiz Z., Sahin S., Turk U. Coagulation status and biochemical and inflammatory markers in multiple sclerosis // J. Clin. Neurosci. — 2008. — Vol. 15. — P. 393-397.
25. Sheremata W.A., Horstman L.L., Alexander J.S., Minagar A. Evidens of platelet activation in multiple sclerosis // J. Neuroinflamation. — 2008. — Vol. 5. — P. 27.
26. Wuerfel J., Paul F., Zipp F. Cerebral blood perfusion changes in multiple sclerosis // J. Neurol. Sci. — 2007. — Vol. 259. — P. 16-20.
27. DeKeyser J., Steen C., Mostert J.P., Koch M.W. Hypoperfusion of the cerebral white matter in multiple sclerosis: possible mechanisms and pathophysiological significance // J. Cereb. Blood Flow Metab. — 2008. — Vol. 28. — P. 1645-1651.
28. Грищенко А.Б., Евтушенко С.К. Трентал как ангиопротектор и иммуномодулятор в реабилитации больных рассеянным склерозом // Український вісник психоневрології. — 2007. — Т. 15, 1 (50). — С. 38-40.
29. Okunieff P., Augustine E., Hicks J.L. et al. Pentoxifylline in treatment of radiation-induced fibrosis // J. Clin. Oncol. — 2004. — Vol. 22 (11). — P. 2207-2213.
30. Magnusson M., Hцglund P., Johansson K. et al. Pentoxifylline and vitamin E treatment for prevention of radiation-induced side-effects in women with breast cancer: a phase two, double-blind, placebo-controlled randomized clinical trial (Ptx-5) // Eur. J. Cancer. — 2009. — Vol. 45 (14). — P. 2488-2495.
31. Barancik M., Bohacova V., Gibalova L. еt al. Potentiation of anticancer-drugs: effect pentoxifylline on neoplastic cell // Int. J. Mol. Sci. — 2012. — Vol. 13 (1). — P. 369-382.
32. Танашян М.М., Домашенко М.А. Трентал при ишемических цереброваскулярных заболеваниях (обзор литературы) // Международный неврологический журнал. — 2007. — № 2 (12). — С. 107-110.
33. Дроздов С.А. Пентоксифиллин в лечении нарушений мозгового кровообращения // Журн. невр. и психиатр. им. Корсакова. — 1997. — № 9. — С. 62-67.
34. Hartmann A., Alberti E., Lange D. Effect of pentoxifylline on regional CBF and CBV in dementia. // Acta Neurologica Scandinavica. — 1979. — Vol. 60 (Suppl. 72). — P. 624-625.
35. Ott E., Fazekas F., Valetitsch H. et al. The rationale of rheological pharmacological therapy // Clinical Hemorheology. — 1986. — Vol. 6. — P. 35-40.
36. Herskovits E., Famulari A., Tamaroff L. et al. Preventive treatment of cerebral transient ischemia: comparative randomized trial of pentoxifylline versus conventional antiaggregants // Eur. Neurol. — 1985. — № 24 (1). — P. 73-81.
37. Cunha G., Bezerra P., Saldanha M. et al. Pentoxifylline improves learning and memory in glutamate-lesioned rats // Pharmacol. Biochem. Behav. — 2000. — Vol. 66 (4). — P. 687-694.
38. Eun B., Liu X., Barks J. Pentoxifylline attenuates hypoxic-ischemic brain injury in immature rats // Pediatr. Res. — 2000. — Vol. 47 (1). — P. 73-78.
39. The European Pentoxifylline Multi-infarct Dementia (EPMID) Study Group: European Pentoxifylline Multi-infarct Dementia Study // Eur. Neuro. — 1996. — Vol. 36. — P. 315-321.
40. Sha M., Callahan C. The efficacy of pentoxifylline in the treatment of vascular dementia: a systematic review // Alzheimer Dis. Assoc. Disord. — 2003. — Vol. 17. — P. 46-54.
41. Bath P. M.W., Bath-Hextall F.J. The Cochrane Data base of systematic reviews. Pentoxifylline, propentofylline and penfillyne for acute ischaemic stroke // Review. — 2005. — Vol. 1. — S. 1-18.
42. Lauch E.S., Saver J.L., Adams H.P. et al. Guidelines for the Early Management of patients with acute ischemic stroke: a guideline for healthcare professionals from the AHA/ASA // Stroke. — 2013. — Vol. 44. — Р. 870-947.
43. Maas M.B., Lev M.H., Ay H. еt al. Collateral vessels on CT angiography predict outcome in acute ischemic stroke // Stroke. — 2009. — Vol. 40. — P. 3001-3005.
44. Lima F.O., Furie K.L., Silva G.S. et al. The pattern of leptomeningeal collaterals on CT angiography a strong predictor of long-term functional outcome in stroke patients with large vessel intracranial occlusion // Stroke. — 2010. — Vol. 41. — P. 2316-2322.
45. Liebeskind D.S., Costonis G.A., Saver J.L. et al. Collaterals dramatically alter stroke risk in intracranial atherosclerosis // Ann. Neurol. — 2011. — Vol. 69. — P. 963-974.
46. Lau A.Y., Wong E.H., Mok V.C., Leung T.W., Wong K.S. Significance of good collateral compensation in symptomatic intracranial atherosclerosis // Cerebrovasc. Dis. — 2012. — Vol. 33. — P. 517-524.
47. Shuaib A., Butcher K., Mohammad A.A. et al. Collateral blood vessels in acute ischemic stroke: a potential therapeutic target // Lancet Neurol. — 2011. — Vol. 10 (11). — P. 909-921.
48. Vermeer S.E., Longstreth W.T., Koudstaal P.J. Silent brain infarcts: a systematic rewiew // Lancet Neurol. — 2007. — Vol. 6. — P. 611-619.
49. Wardlaw J.M., Sandercock P.A., Dennis M.S. et al. Is breakdown of blood-brain barrier responsible for lacunar stroke, leukoaraiosis, and dementia? // Stroke. — 2003. — Vol. 34. — P. 806-812.
50. Hassan A., Hunt B.J., O’Sullivan M. et al. Markers of endothelial dysfunction in lacunar infarction and ischaemic leukoaraiosis // Brain. — 2003. — Vol. 126. — P. 424-432.
51. Yoshida M., Tomitory H., Machi Y. еt al. Acrolein, IL-6 and CRP as markers of silent brain infarction // Atherosclerosis. — 2009. — Vol. 203. — P. 557-562.
52. Дубенко О.Е., Кульгейко В.В., Сараева О.В. и др. Вазонит в терапии лакунарного инсульта // Український неврологічний журнал. — 2008. — № 3. — С. 75-80.

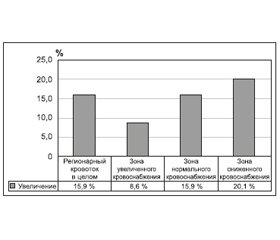
/109.jpg)