Журнал «Травма» Том 17, №1, 2016
Вернуться к номеру
Роль костного метаболизма в патогенезе гонартроза
Авторы: Синяченко О.В., Ермолаева М.В., Гейко И.А., Такташов Г.С., Ютовец Т.С. - Донецкий национальный медицинский университет имени М. Горького, г. Красный Лиман, Украина
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
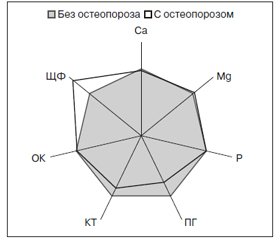
Актуальность проблем остеоартроза коленных сочленений (гонартроза) обусловлена широкой его распространенностью и высоким риском развития ограничений функции суставов с нарушением трудоспособности и снижением качества жизни пациентов. Целью и задачами данной работы стала оценка роли костного метаболизма при разных вариантах клинического течения гонартроза, связей с развитием остеопороза, с костно-деструктивными изменениями коленных суставов по данным рентгенографии, сонографии, магнитно-резонансной томографии, рентгеновской денситометрии. Материал и методы. Обследовано 104 больных остеоартрозом (47 % мужчин и 53 % женщин) в возрасте от 32 до 76 лет. Гонартроз установлен в 96 % наблюдений. Манифестный реактивный синовит по результатам клинико-сонографического исследования диагностирован в 62 % случаев, полиартроз — в 55 %, системный остеопороз — в 14 %, остеокистоз — в 91 %, а спондилопатия в виде остеохондроза и дугоотростчатого артроза — в 72 %. Результаты. У больных гонартрозом наблюдаются значительные изменения в крови маркеров костного метаболизма (МКМ), проявляющиеся дисбалансом остеоассоциированных макроэлементов (кальция, магния, фосфора) с развитием гипокальциемии, которая регистрируется соответственно в 98 %, высокой активностью щелочной фосфатазы (в 47 % случаев), признаками гиперпаратиреоидизма и гиперостеокальциемией. Нарушения костного метаболизма при остеоартрозе коленных сочленений связаны с темпами прогрессирования заболевания и распространенностью суставного синдрома, а показатели МКМ могут иметь прогностическое значение. МКМ (остеоассоциированные макроэлементы, гормоны — паратирин, кальцитонин, остеокальцин, а также фермент щелочная фосфатаза) участвуют в патогенетических построениях гонартроза, определяя развитие отдельных рентгенологических, сонографических и магнитно-резонансных артикулярных и периартикулярных признаков патологии коленных суставов (степень сужения суставных щелей, эпифизарный остеопороз, трабекулярный отек в мыщелках бедренной и большеберцовой костей, изменения рогов менисков, формирование кист Бейкера, интраартикулярных хондромных тел и тел Гоффа). Вывод. Нарушения костного метаболизма имеют клинико-патогенетическое значение при гонартрозе, что требует разработки специальной медицинской технологии проведения лечебно-реабилитационных мероприятий у таких больных.
Актуальність проблем остеоартрозу колінних зчленувань (гонартрозу) обумовлена значною його поширеністю і високим ризиком розвитку обмежень функції суглобів із порушенням працездатності та зниженням якості життя пацієнтів. Метою і задачами цієї роботи стала оцінка ролі кісткового метаболізму при різних варіантах клінічного перебігу гонартрозу, зв’язків із розвитком остеопорозу, з кістково-деструктивними змінами колінних суглобів за даними рентгенографії, сонографії, магнітно-резонансної томографії, рентгенівської денситометрії. Матеріал і методи. Обстежено 104 хворі на остеоартроз (47 % чоловіків і 53 % жінок) віком від 32 до 76 років. Гонартроз встановлено у 96 % спостережень. Маніфестний реактивний синовіт за результатами клініко-сонографічного дослідження діагностований у 62 % випадків, поліартроз — у 55 %, системний остеопороз — у 14 %, остеокістоз — у 91 %, а спондилопатія у вигляді остеохондрозу та дуговідростчастого артрозу — у 72 %. Результати. У хворих на гонартроз спостерігаються значні зміни в крові маркерів кісткового метаболізму (МКМ), що виявляються дисбалансом остеоасоційованих макроелементів (кальцію, магнію, фосфору) з розвитком гіпокальціємії, яка реєструється відповідно в 98 % випадків, високою активністю лужної фосфатази (у 47 %), ознаками гіперпаратиреоїдизму і гіперостеокальцинемією. Порушення кісткового метаболізму при остеоартрозі колінних зчленувань пов’язані з темпами прогресування захворювання та поширеністю суглобового синдрому, а показники МКМ можуть мати прогностичне значення. МКМ (остеоасоційовані макроелементи, гормони — паратирин, кальцитонін, остеокальцин, а також фермент лужна фосфатаза) беруть участь у патогенетичних побудовах гонартрозу, визначаючи розвиток окремих рентгенологічних, сонографічних і магнітно-резонансних артикулярних і периартикулярних ознак патології колінних суглобів (ступінь звуження суглобових щілин, епіфізарний остеопороз, трабекулярний набряк у виростках стегнової та великогомілкової кісток, зміни рогів менісків, формування кіст Бейкера, інтраартикулярних хондромних тіл і тіл Гоффа). Висновок. Порушення кісткового метаболізму мають клініко-патогенетичне значення при гонартрозі, що вимагає розробки спеціальної медичної технології проведення лікувально-реабілітаційних заходів у таких хворих.
The topicality of the problems of the knee joints osteoarthritis (gonarthrosis) is caused by its wide spreading and high risk of the restriction of joint function with the further disability and reduced quality of patients’ life. The goal and the objectives of this study were to evaluate the role of the bone metabolism with different variants of the clinical course of gonarthrosis, the links with the development of osteoporosis, bone destructive changes in the knee joints according to the findings of X-ray, sonography, magnetic imaging, X-ray densitometry. Material and methods. We observed 104 patients with osteoarthrosis (47 % men and 53 % women) aged from 32 to 76 years old. Gonarthrosis is revealed in 96 % of the cases. Overt reactive synovitis was diagnosed in 62 % of the cases by the results of the clinical and sonographic study, polyarthrosis in 55 %, systemic osteoporosis in 14 %, osteocystosis in 91 %, spondylopathy as osteochondrosis and athrosis of facet joints was detected in 72 %. Results. Significant changes in the blood markers of bone metabolism in the patients with gonarthrosis are observed, at the same time it reveals itself in the imbalance of osteoassociated macroelements (calcium, magnesium, phosphorus) with the development of hypocalcemia, which was detected in 98 %, high activity of alkaline phosphatase (47 % of the cases), signs of hyperparathyroidism and hyperosteocalcaemia. Bone metabolic disturbances in the knee joints osteoarthritis are associated with the rates of the progression of the disease and the spreading of the articular syndrome, and the indices of blood markers of bone metabolism can have a prognostic value. Markers of bone metabolism (osteoassociated macroelements, hormones parathyrin, calcitonin, osteocalcin, and alkaline phosphatase enzyme) are involved in the pathogenetic construction of gonarthrosis and they determine the development of individual radiographic, sonographic and magnetic imaging articular and periarticular signs of the pathology of the knee joints (the degree of narrowing of the articular slits, epiphyseal osteoporosis, trabecular oedema in the condyles of the femur (thigh-bone) and tibia (shinbone), the changes of the horns of meniscus, the formation of Baker cysts, intraarticular cartilage flaps and Hoffa bodies). Conclusion. The bone metabolic disturbances have clinical and pathogenetic significance in gonarthrosis that requires the development of specific medical technologies for treatment and rehabilitation of such patients.
гонартроз, кость, метаболизм, патогенез.
гонартроз, кістка, метаболізм, патогенез.
osteoarthritis, bone, metabolism, pathogenesis.
Статья опубликована на с. 67-70
Введение
Материал и методы
/68.jpg)
Результаты
/68_2.jpg)
/69.jpg)
/69_2.jpg)
Обсуждение
Выводы
1. Allen K.D. Patient and provider interventions for managing osteoarthritis in primary care: Protocols for two randomized controlled trials / K.D. Allen, H.B. Bosworth, D.S. Brock, J.G. Chapman // BMC Musculoskelet. Disord. — 2012. — Vol. 13, № 1. — P. 60-65.
2. Di Munno O. Effects of glucocorticoid treatment on focal and systemic bone loss in rheumatoid arthritis / O. Di Munno, A. Delle Sedie // J. Endocrinol. Invest. — 2015. — Vol. 31, № 7. — P. 43-47.
3. Felson D.T. Osteoarthritis: Virtual joint replacement as an outcome measure in OA / D.T. Felson // Nat. Rev. Rheumatol. — 2012. — Vol. 8, № 4. — P. 187-188.
4. Gelber A.C. Knee pain and osteoarthritis: lessons learned and lessons to be learned / A.C. Gelber // Ann. Intern. Med. — 2015. — Vol. 155, № 11. — P. 786-787.
5. Pereira D. The effect of osteoarthritis definition on prevalence and incidence estimates: a systematic review / D. Pereira, B. Peleteiro, J. Araújo, J. Branco // Osteoarthritis Cartilage. — 2011. — Vol. 19, № 11. — P. 1270-1285.
6. Phillips K. Strategies for the prevention and treatment of osteoporosis in patients with rheumatoid arthritis / K. Phillips, A. Aliprantis, J. Coblyn // Drugs. Aging. — 2014. — Vol. 23, № 10. — P. 773-779.
7. Wang M. Recent progress in understanding molecular mechanisms of cartilage degeneration during osteoarthritis / M. Wang, J. Shen, H. Jin, H.J. Im // Ann. NY Acad. Sci. — 2013. — Vol. 1240, № 12. — P. 61-69.
8. Zhai Y. Basic research progress of knee osteoarthritis / Y. Zhai, G.D. Gao, S.Y. Xu // Zhongguo Gu Shang. — 2012. — Vol. 25, № 1. — P. 83-87.