Статья опубликована на с. 116-120
Абсцесс печени — гнойное воспаление тканей печени с их расплавлением и образованием гнойной полости. Одной из возможных причин развития абсцесса печени является тупая травма живота: тупая с размозжением ткани печени, краевой разрыв печени, ушивание ее после значительных разрывов, а также нагноение посттравматической, послеоперационной гематом, колото-резаных или огнестрельных ран печени [6]. Эти состояния, характеризующиеся наличием гнойной полости в паренхиме печени вследствие травматического повреждения, по этиологическому фактору могут быть объединены в группу посттравматических абсцессов печени (ПАП). ПАП составляют 7,3–15 % от числа всех абсцессов печени [2, 7, 9].
Развитие ПАП обусловлено, как правило, повреждением при травме сосудистых и билиарных структур с септическим некрозом паренхимы печени [3]. Размозжение и некроз паренхимы печени, образование гематомы, скопление желчи, микроциркуляторные нарушения являются благоприятным условием для развития гнойно-воспалительного процесса, возбудители которого поступают через систему воротной вены, желчевыводящие пути, артериальное русло или занесены извне [1]. Формирование ПАП происходит в сроки от 14 дней до 2 месяцев после повреждения, течение их является длительным и тяжелым вследствие наличия нежизнеспособных тканей в полости очага [1, 6].
Диагностика ПАП может быть затруднена в связи с наличием иных повреждений с выраженной клинической симптоматикой. Внедрение в клиническую практику ультразвукового исследования, которое практически не имеет противопоказаний и является в настоящее время ведущим методом медицинской визуализации [4, 9], повысило эффективность диагностики ПАП: чувствительность метода составляет, по данным разных авторов, 81,9–100 %, специфичность — 84,4 %, точность — 85–90,5 % [5, 6].
Однако у больных с политравмой, особенно при наличии повреждений костей, по-прежнему ведущим методом лучевого исследования остается рентгенография, не позволяющая диагностировать ПАП и только в ряде случаев выявляющая косвенные признаки его наличия.
Наружное дренирование является методом выбора в лечении ПАП, поскольку позволяет избежать дальнейшего повреждения сосудов печени и желчных протоков, имеющих место при резекции печени [6]. Мини-инвазивные методы чрескожного дренирования под контролем УЗИ широко применяются в лечении абсцессов печени иной этиологии, однако, по мнению ряда авторов, не показаны при абсцессах посттравматического происхождения. В то же время малая травматичность, доступность, отсутствие потребности в общем наркозе в сочетании с высокой эффективностью и возможностью выполнения в любом соматическом состоянии обусловливают перспективность чрескожного эхоконтролируемого дренирования в лечении ПАП.
Цель работы — изучение возможностей ультразвуковой визуализации в диагностике и лечении ПАП.
Материал и методы
В исследование включены 36 пациентов с ПАП — 24 мужчины, 12 женщин в возрасте 21–56 лет.
Из исследования были исключены пациенты с абсцессами печени, развившимися после лечебных вмешательств без предшествующей травмы, которые расцениваются рядом авторов как посттравматические [3, 10]. В соответствии с используемой нами классификацией [1] такие абсцессы были классифицированы как ятрогенные и в настоящем исследовании не рассматривались.
Всем пациентам было выполнено УЗИ печени на УЗ-сканерах AI-5200, HDI 5000 и Logic 3, конвексный датчик 3,5 МГц, в соответствии со стандартизированным протоколом.
Больным проведено лечение ПАП путем чрескожного дренирования под контролем УЗИ. Режимы УЗИ соответствовали таковым при диагностическом обследовании. Для выбора безопасного акустического окна (БАО), контроля перемещения инструмента и оценки оттока содержимого полости ПАП использовали режим энергетического допплеровского картирования (ЭДК). Дренирование выполняли под местной анестезией в сочетании с атаралгезией с использованием бензодиазепинов и наркотических анальгетиков без выключения сознания.
Дренирование выполняли одномоментно троакарным способом самофиксирующимися дренажами либо по Сельдингеру.
Троакарное одномоментное дренирование самофиксирующимися дренажами BALTON, RUSCH 6-18 Fr проведено в 28 (77,8 %) случаях. При эхоконтролируемом одномоментном дренировании под непрерывным УЗ-контролем стилет (троакар) с надетым на него катетером вводили в полость ПАП, стилет удаляли. Дренаж фиксировали на коже.
В 8 (22,2 %) случаях при ПАП значительного объема (более 300 мл) проведено двухэтапное дренирование по Сельдингеру. При выполнении эхоконтролируемого двухэтапного дренирования по Сельдингеру производили пункцию ПАП тонкой иглой Chiba. Контролировали нахождение дистального конца иглы в полости ПАП эхографически. Через просвет иглы вводили металлический проводник до контакта с внутренней стенкой ПАП. По проводнику проводили один или несколько дилататоров возрастающего размера до формирования канала требуемого диаметра. После контроля расположения дистального конца в полости ПАП по проводнику заводили дренаж, проводник удаляли. Дренаж фиксировали на коже.
После установки дренажа пациент в течение 1 часа находился под наблюдением, после чего выполнялось контрольное УЗИ.
Пациентам проводили антибактериальную терапию по стандартным схемам. Полость ПАП регулярно промывали антисептиком. Оценивали динамику клинико-лабораторных показателей, количество отделяемого по дренажу; контрольные УЗИ проводили 1 раз в 3 дня.
Дренирование считали результативным при улучшении клинического состояния, снижении количества отделяемого по дренажу, уменьшении размеров полости ПАП по данным УЗИ. Извлечение дренажа производили под контролем УЗИ.
Результаты и обсуждение
Пациенты с ПАП составили 14,5 % от общего количества больных с абсцессами печени (248 пациентов), поступивших в отдел за изучаемый период, что согласуется с данными других исследователей [1, 2, 8, 10].
При клинико-анамнестическом анализе установлено, что для ПАП характерно наличие четкого анамнеза, они характеризуются длительным и тяжелым течением вследствие наличия нежизнеспособных тканей в полости очага и могут быть источниками поддиафрагмальных или подпеченочных абсцессов.
Причины развития ПАП были следующими. 12 (33,3 %) пациентов поступили с сочетанной травмой грудной клетки и брюшной полости с переломом ребер справа (8 случаев) и двусторонним (4 случая). В 8 (22,2 %) наблюдениях у больных в анамнезе выявлена тупая травма живота, в 7 (19,4 %) — контузия органов брюшной полости при падении с высоты либо горизонтальном ударе, в 5 (13,9 %) — огнестрельное ранение с нагноением зоны травматического повреждения, в 3 (8,3 %) — травматический разрыв гемангиомы правой доли печени, у одного больного развилось нагноение остаточной полости зоны ушивания паренхимы печени после огнестрельного ранения.
Больным был диагностирован ПАП в сроки 12–30 суток после травмы.
У всех больных отмечена смазанная клиническая картина с наложением симптомов, вызванных травмой других органов. Характерным было повышение температуры от субфебрильной до гектической с развитием лихорадки, слабость, отсутствие аппетита. Болевой синдром в правом подреберье отмечали 16 (44,4 %) больных. У всех пациентов наблюдали выраженный лейкоцитоз и анемию. В 12 (33,3 %) случаях пациентам при наличии реактивного выпота в плевральной полости в течение 10–14 дней проводилось лечение плеврита и нижнедолевой пневмонии без проведения УЗИ органов брюшной полости, в частности печени, что привело к пролонгации диагностического процесса.
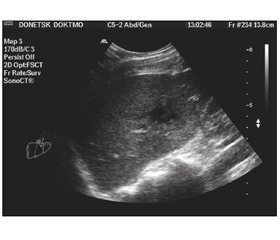
При УЗИ ПАП (рис. 1) определялись как структуры неправильной формы, с нечетким неровным контуром, ан- или гипоэхогенные, неоднородной эхоструктуры за счет наличия в просвете гиперизоэхогенных, изогиперэхогенных или гиперэхогенных полиморфных включений — тканевого детрита, секвестров печеночной ткани, сгустков фибрина. 24 (66,7 %) ПАП были локализованы в правой, 8 (22,2 %) — в левой доле печени, 4 (11,1 %) абсцесса затрагивали обе доли. Максимальный диаметр ПАП варьировал от 5 до 18 см. Характерной стала менее выраженная по сравнению с абсцессами печени иной этиологии зона демаркации. Не наблюдали признаков значимой компрессии желчных протоков и крупных кровеносных сосудов, характерных для холангиогенных и пилефлебитических абсцессов печени.
В 16 (44,4 %) случаях визуализация зоны ПАП была затруднена вследствие наличия посттравматических и послеоперационных изменений — отека, послеоперационного рубца; для получения достаточной диагностической информации применяли полипозиционное сканирование из абдоминального, бокового, межреберного доступов.
У 24 (66,7 %) пациентов с ПАП наблюдали реактивный плеврит. У 8 (22,2 %) больных ПАП сочетался с поддиафрагмальным абсцессом печени.
Установку дренажа выполняли под непрерывным ультразвуковым контролем. Выбор траектории пункционного канала осуществляли на основании результатов УЗИ с применением режима ЭДК. Избирали безопасное акустическое окно, не затрагивающее крупные кровеносные сосуды и желчные протоки, кратчайший доступ не считали обязательным условием. Стремились найти доступ, при котором дренаж до проведения в полость ПАП проходил не менее 2–3 см здоровой ткани печени для профилактики подтекания содержимого в свободную брюшную полость. В зависимости от локализации ПАП у 4 пациентов дренирование выполнено из трансабдоминального, у 2 — из бокового, у 3 — из межреберного доступа. При проведении через ткани дренаж эхографически определялся как гиперэхогенная структура в виде двух параллельных линий с эффектом дистального затухания различной выраженности (рис. 2).
/118.jpg)
Обязательным условием считали удержание дистального конца дренажа в плоскости сканирования. При затруднении визуализации использовали допплерографические приемы — выполняли низкоамплитудные возвратно-поступательные перемещения дренажа, а также движение жидкости в его просвете, визуализируемое в цвете в режиме ЭДК. Указанные меры во всех случаях позволили установить дренаж в полости ПАП без повреждения значимых кровеносных сосудов и желчных протоков.
Далее проводили аспирацию содержимого ПАП, в зависимости от размеров абсцесса было аспирировано от 150 до 480 мл гнойного содержимого с примесью крови и желчи. Адекватность дренирования оценивали допплерографически; в 8 (22,2 %) случаях для оптимизации оттока содержимого потребовалась коррекция положения дренажа.
В случаях сочетания ПАП с другими патологическими жидкостными коллекторами производили симультанные чрескожные эхоконтролируемые вмешательства. При наличии реактивного плеврита (24 (66,7 %) случая) под контролем УЗИ производили пункцию плевральной полости с аспирацией реактивного выпота, после чего выполняли дренирование ПАП. В случае наличия поддиафрагмального абсцесса (8 (22,2 %) пациентов) производили его чрескожное эхоконтролируемое дренирование после дренирования ПАП. Таким образом, симультанные вмешательства были выполнены у 24 (66,7 %) больных, в т.ч. у 16 (44,4 %) — двухэтапное (аспирация плевральной жидкости + дренирование ПАП), у 8 (22,2 %) — трехэтапное (аспирация плевральной жидкости + дренирование ПАП + дренирование поддиафрагмального абсцесса).
/119.jpg)
У 9 (25,0 %) нетранспортабельных пациентов, находящихся в тяжелом состоянии, диагностическое УЗИ и чрескожные лечебные вмешательства (в т.ч. в одном случае — трехэтапное) были выполнены в условиях реанимационного отделения с использованием портативного ультразвукового сканера.
Во всех случаях желаемый лечебный эффект был достигнут: клиническое состояние больного улучшилось, полость ПАП элиминирована. Дренаж был удален на 7–21-е сутки. Летальных исходов не было. Из осложнений отмечены: болевой синдром, требующий медикаментозного купирования, — 12 (33,3 %) случаев, смещение дренажа, вызвавшее нарушение оттока и требующее коррекции, — 1 случай.
Таким образом, при наличии травматических повреждений, особенно множественных, возможным осложнением является развитие посттравматического абсцесса печени. В связи со стертостью клинической картины, нередко тяжелым состоянием больного, преобладанием в ряде случаев симптомов повреждения других внутренних органов и костей ПАП могут быть своевременно не диагностированы. Это приводит к выбору ошибочной лечебной тактики, неэффективности терапии, усугублению состояния больного. Для избежания этого мы считаем обязательным проведение таким больным, особенно при наличии клинико-лабораторных признаков гнойно-воспалительного процесса (гипертермия, слабость, лейкоцитоз), динамического УЗИ органов брюшной полости, в частности печени, для выявления эхопризнаков ПАП. В случаях тяжелого состояния, нетранспортабельности пациента, нахождении его в профильном по основному заболеванию отделении (например, нейрохирургическом, политравмы и т.п.), отсутствия в отделении стационарного ультразвукового сканера УЗИ может быть проведено на портативном сканере, в т.ч. в условиях санавиации, выезда специалиста для консультации и проведения лечебных вмешательств.
Вопреки существующему в литературе мнению о нецелесообразности мини-инвазивного лечения ПАП полученные нами данные свидетельствуют о высокой эффективности чрескожного эхоконтролируемого дренирования. Достижению лечебного эффекта и избежанию значимых осложнений способствует непрерывный ультразвуковой контроль на всех этапах выполнения вмешательства: выбор безопасной траектории доступа, установка дренажа, контроль аспирации и адекватности дренирования, динамическое наблюдение в течение всего периода стояния дренажа и контроль его извлечения. Использование допплерографических режимов способствует оптимизации ультразвукового контроля: позволяет визуализировать значимые кровеносные сосуды, контролировать перемещение дренажа и отток содержимого. Использование портативного ультразвукового сканера предоставляет возможность проводить лечебные вмешательства и контроль после них в условиях профильного по основному заболеванию отделения, без транспортировки больного в отделения интервенционного ультразвука.
Хороший лечебный эффект и отсутствие значимых осложнений позволяют рекомендовать чрескожное эхоконтролируемое дренирование как метод выбора в лечении ПАП.
Выводы
1. ПАП составляют 14,5 ± 2,2 % от всех абсцессов печени и развиваются у пациентов с травмами, контузиями, ранениями печени, в т.ч. в сочетании с повреждениями органов брюшной полости, грудной клетки, скелета.
2. При подозрении на травму печени в анамнезе и наличии клинико-лабораторных признаков гнойно-воспалительного процесса пациенту показано УЗИ печени для выявления возможного ПАП.
3. Характерными эхопризнаками ПАП являются: неправильная форма, слабовыраженная демаркационная зона, наличие в просвете гиперполиморфных изоэхогенных, изогиперэхогенных или гиперэхогенных включений.
4. Методом выбора в лечении ПАП является чрескожное эхоконтролируемое дренирование, которое при необходимости может быть выполнено симультанно с аспирацией плеврального выпота и дренированием абсцессов другой локализации.
/119.jpg)

/118.jpg)