Журнал «Здоровье ребенка» 2 (70) 2016
Вернуться к номеру
Ультразвуковые и биохимические показатели дисфункции эндотелия при геморрагическом васкулите у детей
Авторы: Одинец Ю.В., Яворович М.В. - Харьковский национальный медицинский университет, г. Харьков, Украина
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
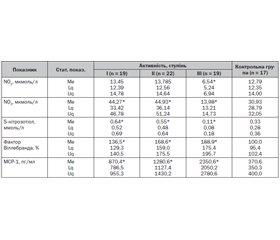
З метою виявлення ультразвукових і біохімічних маркерів дисфункції ендотелію залежно від ступеня активності та форми обстежено 60 дітей з геморагічним васкулітом. Проводили визначення в сироватці крові концентрації МСР-1 імуноферментним методом, вмісту оксиду азоту — за концентрацією його стабільних метаболітів — NO2, NO3 та S-нітрозотіолу, фактора Віллебранда — агрегометричним методом, оцінку товщини комплексу інтима-медіа загальної сонної артерії та визначення ендотелійзалежної дилатації плечової артерії. Рівні фактора Віллебранда та МСР-1 вірогідно підвищуються залежно від ступеня активності геморагічного васкуліту. Статистичні дані вказують на значне зниження концентрації метаболітів оксиду азоту в сироватці крові у дітей зі змішаною формою та нирковим синдромом. Товщина комплексу інтима-медіа загальної сонної артерії збільшувалась у дітей із тяжким перебігом геморагічного васкуліту та у дітей зі змішаною формою з нирковим синдромом. Зафіксована патологічна реакція ендотелійзалежної дилатації плечевої артерії незалежно від ступеня активності та форми геморагічного васкуліту свідчить про безпосереднє залучення в патологічний процес ендотелію.
С целью выявления ультразвуковых и биохимических маркеров дисфункции эндотелия в зависимости от степени активности и формы обследовано 60 детей с геморрагическим васкулитом. Проводили определение концентрации МСР-1 иммуноферментным методом, содержание оксида азота — по концентрации его стабильных метаболитов — NO2, NO3 и S-нитрозотиола, фактора Виллебранда — агрегометрическим методом, оценку толщины комплекса интима-медиа общей сонной артерии и эндотелийзависимой дилатации плечевой артерии. Уровни фактора Виллебранда и МСР-1 достоверно повышаются в зависимости от степени активности геморрагического васкулита. Статистические данные указывают на значительное снижение концентрации метаболитов оксида азота в сыворотке крови у детей со смешанной формой и почечным синдромом. Толщина комплекса интима-медиа общей сонной артерии увеличивалась у детей с тяжелым течением геморрагического васкулита и у детей со смешанной формой с почечным синдромом. Зафиксированная патологическая реакция эндотелийзависимой дилатации плечевой артерии независимо от степени активности и формы геморрагического васкулита свидетельствует о непосредственном вовлечении в патологический процесс эндотелия.
60 children with hemorrhagic vasculitis were examined in order to detect ultrasound and biochemical markers of endothelial dysfunction, depending on the degree of activity and the form. Serum monocyte chemoattractant protein 1 (MCP-1) concentration was determined using enzyme-linked immunoassay, the content of nitric oxide by its stable metabolites — NO2, NO3 and S-nitrosothiol, von Willebrand factor — using aggregometry, intima-media complex thickness of the common carotid artery and endothelium-dependent dilation of the brachial artery were evaluated. Levels of von Willebrand factor and MCP-1 significantly increased, depending on the degree of hemorrhagic vasculitis activity. Statistical data show a significant decrease in the concentration of nitric oxide metabolites in the blood serum of children with mixed form and nephritic syndrome. Intima-media complex thickness of the common carotid artery was increased in children with severe hemorrhagic vasculitis, and in children with a mixed form with renal syndrome. We have detected a pathological reaction of endothelium-dependent dilation of the brachial artery regardless of the degree of activity and the form of hemorrhagic vasculitis, this fact evidences direct involvement of the endothelium in the pathological process.
діти, геморагічний васкуліт, ендотеліальна дисфункція.
дети, геморрагический васкулит, эндотелиальная дисфункция.
children, hemorrhagic vasculitis, endothelial dysfunction.
Статтю опубліковано на с. 16-20
Зв’язок публікації з плановими науково-дослідними роботами: № 0114U003393 «Медико-біологічна адаптація дітей із соматичною патологією в сучасних умовах».
Вступ
Матеріали та методи
Результати та обговорення
Висновки
1. Рябоконь Ю.Ю. Стан ендотелійзалежної функції ендотелію у хворих на хронічну hcv-інфекцію з позапечінковими проявами // Інфекційні хвороби. — 2013. — № 4. — С. 26-33.
2. Коркушко О.В. Нарушения углеводного обмена и их роль в изменении гемоваскулярного гемостаза и функции эндотелия на уровне микроциркуляторного сосудистого русла у практически здоровых людей пожилого возраста / В.П. Чижова, В.Б. Шатило, Е.В. Бондаренко, И.А. Антонюк-Щеглова, С.С. Наскалова, Г.В. Дужак, И.А. Самоць, Н.С. Наумчук // Кровообіг та гемостаз. — 2014. — № 1–2. — С. 5-15.
3. Титов В.Н. Диагностическое значение эндотелийзависимой вазодилатации. Функциональное единение эндотелина, оксида азота и становление функции в филогенезе // Клиническая лабораторная диагностика. — 2009. — Т. 2. — С. 3-16.
4. Morita T. Effect of a polymorphism of endothelial nitric oxide synthase gene in Japanese patients with IgA nephropathy / Ito H., Suehiro T., Tahara K., Matsumori A., Chikazawa H., Nakauchi Y., Nishiya K., Hashimoto K. //Clinical Nephrology. — 1999. — Т. 52, № 4. — С. 203-209.
5. Андронов Е.В. Роль оксида азота в регуляции микроциркуляторного звена системы гемостаза обзор литературы) / Киричук В.Ф., Иванов А.Н., Мамонтова Н.В. // Саратовский научно-медицинский журнал. — 2007. — Т. 3, № . 3. — С. 39-44.
6. De Caterina R. et al. Nitric oxide decreases cytokine-induced endothelial activation. Nitric oxide selectively reduces endothelial expression of adhesion molecules and proinflammatory cytokines / Libby P., Peng H.B., Thannickal V.J., Rajavashisth T.B., Gimbrone M.A. Jr, Shin W.S., Liao J.K. // Journal of Clinical Investigation. — 1995. — Т. 96, № 1. — Р. 60.
7. Федин А.И., Старых Е.П., Путилина и др. Эндотелиальная дисфункция у больных с хронической ишемией мозга и возможности ее фармакологической коррекции //Лечащий врач. — 2015. — Т. 5. — С. 15-20.
8. Mudau M., Genis A., Lochner A., Strijdom H. Endothelial dysfunction: the early predictor of atherosclerosis // Cardiovascular journal of Africa. — 2012. — Т. 23, № . 4. — Р. 222-231.
9. Ding Y.Y., Ren Y., Feng X. et al. Correlation between brachial artery flow-mediated dilation and endothelial microparticle levels for identifying endothelial dysfunction in children with Kawasaki disease // Pediatric Research. — 2013. — Vol. 75, № 3. — Р. 453-458.
1. Ryabokon' Yu. Yu. Stan endoteliyzalezhnoyi funktsiyi endoteliyu u khvorykh na khronichnu hcv-infektsiyu z pozapechinkovymy proyavamy // Infektsiyni khvoroby. – 2013. – № 4. – S. 26-33.
2. Korkushko O. V. Narushenyya uhlevodnoho obmena y ykh rol' v yzmenenyy hemovaskulyarnoho hemostaza y funktsyy эndotelyya na urovne mykrotsyrkulyatornoho sosudystoho rusla u praktychesky zdorovыkh lyudey pozhyloho vozrasta / V.P. Chyzhova, V.B. Shatylo, E.V. Bondarenko, Y.A. Antonyuk-Shchehlova, S.S. Naskalova, H.V. Duzhak, Y.A. Samots', N.S. Naumchuk // Krovoobih ta hemostaz. – 2014. – № 1-2. – S. 5-15.
3. Tytov V. N. Dyahnostycheskoe znachenye эndotelyyzavysymoy vazodylatatsyy. Funktsyonal'noe edynenye эndotelyna, oksyda azota y stanovlenye funktsyy v fyloheneze // Klynycheskaya laboratornaya dyahnostyka. – 2009. – T. 2. – S. 3-16.
4. Morita T. Effect of a polymorphism of endothelial nitric oxide synthase gene in Japanese patients with IgA nephropathy / Ito H., Suehiro T., Tahara K., Matsumori A., Chikazawa H., Nakauchi Y., Nishiya K., Hashimoto K. //Clinical nephrology. – 1999. – Т. 52. – №. 4. – С. 203-209.
5. Andronov E. V. Rol' oksyda azota v rehulyatsyy mykrotsyrkulyatornoho zvena systemы hemostaza obzor lyteraturы) / Kyrychuk V.F., Yvanov A.N., Mamontova N. V. // Saratovskyy nauchno-medytsynskyy zhurnal. – 2007. – T. 3. – № 3. – S. 39-44
6. De Caterina R. et al. Nitric oxide decreases cytokine-induced endothelial activation. Nitric oxide selectively reduces endothelial expression of adhesion molecules and proinflammatory cytokines / Libby P, Peng H B, Thannickal V J, Rajavashisth T B, Gimbrone M A, Jr, Shin W S, Liao J K //Journal of Clinical Investigation. – 1995. – Т. 96. – №. 1. – Р. 60.
7. Fedyn A. Y., Starikh E. P., Putylyna y dr. Эndotelyal'naya dysfunktsyya u bol'nыkh s khronycheskoy yshemyey mozha y vozmozhnosty ee farmakolohycheskoy korrektsyy //Lechashchyy vrach. – 2015. – T. 5. – S. 15-20.
8. Mudau M., Genis A., Lochner A., Strijdom H. Endothelial dysfunction: the early predictor of atherosclerosis // Cardiovascular journal of Africa. – 2012. – Т. 23. – №. 4. – Р. 222-231.
9. Ding Y. Y., Ren Y., Feng X. et al. Correlation between brachial artery flow-mediated dilation and endothelial microparticle levels for identifying endothelial dysfunction in children with Kawasaki disease // Pediatric research. – 2013. – V. 75, №3. – Р. 453-458.

/18.jpg)
/19.jpg)