Статья опубликована на с. 72-78
Вступ
Авітаміноз вітаміну D (визначається як 25(ОН)D3 < 20 нг/мл (< 50 нмоль/л)) та гіповітаміноз вітаміну D (визначається як 25(ОН)D3 < 30 нг/мл (< 75 нмоль/л)) на сьогодні тісно пов’язані з бронхіальною астмою (БА) та атопічним дерматитом (АД) [10]. Літературні дані висвітлюють важливу роль порушення функції епідермального бар’єра в розвитку АД і, можливо, фенотипу АД плюс БА. Еволюційні зміни в структурі та функції шкіри, імовірніше, пояснюють підвищений рівень циркулюючого 25(ОН)D3 у крові жителів Північної Європи. Описано суттєвий зв’язок генетичних факторів структури епідермісу та вітамін-D-статусу, що корелює зі здатністю людини генерувати вітамін D під дією ультрафіолетового опромінення протягом літніх місяців [16].
Дефекти гена структурного білка шкіри філагрину (FLG) стали поширеними в північних європейців зі слабкою пігментацією шкіри. Вчені припускають, що це відбулося з метою подальшої оптимізації синтезу вітаміну D [14].
Філагрин містить велику кількість гістидину, що метаболізується в трансуроканову кислоту (UCA). Дефекти в гені філагрину призводять до порушень структури цього білка та зниження продукції UCA, що є основним ендогенним фільтром проти ультрафіолетового опромінення [14].
Було виявлено, що в осіб, які проживають у Європі, градієнт рівня 25(ОН)D3, найімовірніше, пояснюється FLG-мутаціями, ніж втратою пігментації. Гетерозиготні мутації в гені FLG зустрічаються в близько 10 % жителів Північної Європи і 5 % жителів Азії. Мутації R501X і 2282del4 становлять понад 80 % типових мутацій у північних європейців, тоді як вісім інших мутацій становлять ≈ 80 % серед жителів Азії [16]. Ці дані про поширеність мутацій є кореляційними.
Якщо розглянути поширеність даних мутацій залежно від географічної широти, то спостерігається виражений градієнт «північ — південь» у Європі та Африці з аналогічним, хоча і менш яскравим рисунком у популяціях Азії. Відносно низька поширеність мутацій серед жителів Австрії порівняно з іншими популяціями Центральної та Північної Європи, ймовірно, відображає багатовікову транснаціональну міграцію більш пігментних слов’ян із Північної Євразії. Так само дещо підвищена поширеність мутацій FLG на сьогодні в Південному Китаї, Сингапурі і Тайвані, імовірніше, відображає також порівняно недавні транснаціональні міграції з північних широт [14].
Отже, співвідношення між поширеністю FLG-мутацій, 25(ОН)D3 у сироватці крові та географічною широтою виявило високий ступінь статистичної кореляції [14]. Було виявлене позитивне значення коефіцієнта кореляції R Пірсона між широтою, 25(ОН)D3 у сироватці крові і FLG-мутаціями (R2 = 0,77 і R2 = 0,55). Слід зазначити, що співвідношення між 25(ОН)D3 і FLG-мутаціями також показали сильну кореляцію, R2 = 0,74. Таким чином, дана гіпотеза підтверджується такими спостереженнями: 1) сироватковий рівень 25(ОН)D3 незалежно від зовнішніх факторів та втручання був на 10 % вищим у приблизно 16 000 носіїв мутацій FLG у п’яти різних когорт населення в Німеччини та Данії; окрім того, було продемонстровано залежність рівня вітаміну 25(ОН)D3 у крові від алелі з найвищими рівнями в гомозиготних носіїв [15]; 2) мутації із втратою функції в гені FLG корелюють із відповідним зниженням рівня фоторецепторів та UCA [14]; 3) у цих популяціях було виявлено сезонний ефект із подальшим підвищенням рівня 25(ОН)D3 протягом літніх місяців [15].
У приблизно 10 000 дітей і підлітків з атопічним дерматитом у Німеччині були знайдені значно вищі рівні 25(ОН)D3 у сироватці в FLG-дефіцитних хворих порівняно з контролем. Середній рівень 25(ОН)D3 був значно вищий у пацієнтів з АД порівняно з контролем (р < 0,0001). Логістична регресія показала зворотний зв’язок між низьким рівнем 25(ОН)D3 та АД (багатовимірне відношення шансів для квартиля 1 порівняно з квартилем 2: 0,76 (95% довірчий інтервал 0,61–0,94)) [8].
У дослідженнях, проведених останнім часом, було показано, що вітамін D разом із класичними функціями бере участь у регуляції багатьох важливих фізіологічних процесів, включаючи запалення, імунну регуляцію і репарацію органів і тканин, і його дефіцит є важливим чинником ризику алергічних захворювань.
Дослідниками [5] була вивчена здатність сигнального шляху білка-мішені рапаміцину (MTOR) модулювати імунну відповідь та клітинну проліферацію. Відомо, що MTOR-сигналізація в умовах гіпоксії залучає гіпоксія-індукований фактор 1α — мішень DDIT4 [6]. Мішені MTOR можуть також відігравати ключову роль у забезпеченні некласичних дій вітаміну D. Було показано, що нокдаун міРНК DDIT4 повністю пригнічує антипроліферативну дію вітаміну D, передбачається, що це може бути ключовим механізмом для протиалергійного ефекту вітаміну D. У зв’язку з цим цікаво відзначити, що попередні дослідження показують, що інгібування за допомогою синтетичного аналога вітаміну D супроводжувалося зниженням MTOR-сигналізації [6]. Аналогічним чином інгібування MTOR-сигналізації з використанням інгібітору MTOR-сигналізації Everolimus (RAD-001) потенціює дію вітаміну D, що дозволяє припускати можливу стратегію для комбінованої терапії мішені MTOR у лікуванні алергічних захворювань [18].
Інгібування MTOR також відіграє ключову роль у механізмах вродженого й адаптивного імунітету, особливо шляхом сприяння формуванню автофагосом [12]. Ураховуючи, що кожен із цих аспектів імунітету, як відомо, активується вітаміном D [2], привабливим видається припущення, що MTOR є мішенню, головним регулятором для імуномодулюючих ефектів вітаміну D.
Ураховуючи дані щодо імуномодулюючої ролі вітаміну D шляхом регуляції генів MTOR та FLG, ми запропонували додавання холекальциферолу як препарату з імуномодулюючою та протизапальною дією до базисного лікування.
Матеріали та методи
До дослідження ввійшли діти віком від 5 до 18 років із БА та АД, які перебували на стаціонарному лікуванні в алергологічному відділенні Київської міської дитячої клінічної лікарні № 2, батьки (опікуни) яких підписали інформовану згоду щодо їх включення в дослідження.
Установлення діагнозу АД відбувалося на основі даних, внесених батьками в адаптовану затверджену анкету (ISAAC), і включало в себе скарги на висип, сухість шкіри, лущення, свербіж упродовж дитинства. У результаті клінічного обстеження відповідно до АД було виявлено висип, сухість шкіри, лущення, свербіж, ліхенізацію. Наявність БА встановлювалася на основі даних, зі слів батьків, щодо персистуючого, свистячого дихання (≥ 2 епізоди нападів, не пов’язаних з інфекцією верхніх дихальних шляхів), даних спірометрії (знижений обсяг форсованого видиху за 1-шу секунду (ОФВ1) і співвідношення ОФВ1/ФЖЄЛ, позитивний тест з β2-агоністом), підвищення рівня IgE, позитивних шкірних прік-тестів з аероалергенами.
У дослідження були включені такі хворі: 13 дітей із мінорним генотипом поліморфізму rs11204981 у гені FLG та 50 дітей із генотипом ризику поліморфізму rs11121704 у гені MTOR. З метою вивчення впливу холекальциферолу на клінічний перебіг БА та АД у дітей із генотипом ризику гену FLG та гена MTOR хворі були поділені на 2 групи.
До І групи увійшло 18 хлопчиків (58,00 %) та 13 дівчаток (42,00 %), до ІІ групи — 20 хлопчиків (62,5 %) та 32 дівчинки (37,5 %). Середній вік в І групі становив 9,0 ± 2,1 року, у ІІ групі — 8,0 ± 2,5 року.
Отримані дані демонструють, що віковий та статевий склад дітей І та ІІ груп статистично вірогідно не відрізнялися (p < 0,05).
Діти І групи отримували базисну терапію та холекальциферол по 1000 МО 1 раз на добу протягом 3 місяців. Вибір дози холекальциферолу був обумовлений результатами попередніх досліджень C.A. Camargo Jr, Amestejani [1, 4]. Діти ІІ групи отримували базисну терапію протягом 3 місяців.
Контрольне обстеження хворих І та ІІ груп виконувалося через 3 місяці від початку лікування. Оцінку ефективності лікування проводили за такими критеріями: частота загострень БА, ступінь тяжкості загострень, показники спірографії (ОФВ1), добові коливання пікової швидкості видиху (ПШВ), застосування сальбутамолу за потреби для зняття симптомів БА, ступінь тяжкості АД за шкалою SCORAD.
Відмінність в ефективності терапії між двома групами до і після лікування визначалася за допомогою χ2-тесту Пірсона та вважалася статистично значущою на рівні p < 0,05.
Результати
У І групі до лікування 12 пацієнтів (38,71 %) мали контрольовану, 14 (45,16 %) — частково контрольовану, 5 (16,13 %) — неконтрольовану БА. Після лікування 26 пацієнтів (83,87 %) мали контрольовану, 5 (16,13 %) — частково контрольовану БА. У ІІ групі динаміка перебігу БА була такою: до лікування 14 хворих (43,75 %) мали контрольовану, 12 (37,50 %) — частково контрольовану, 6 (18,75 %) — неконтрольовану БА. Після лікування 18 дітей (56,25 %) мали контрольовану, 10 (31,25 %) — частково контрольовану, 4 (12,50 %) — неконтрольовану БА (табл. 1).
Як видно з табл. 1, додавання до базисної терапії БА холекальциферолу приводить до покращення контрольованості (χ2 = 14,42; р < 0,05). При призначенні базисного лікування БА статистично вірогідного покращення контрольованості БА не відбулося (χ2 =1,08; р>0,05). Аналіз даних щодо порівняння ефективності лікування в І та ІІ групах виявив статистично вірогідну різницю результатів (χ2 = 5,34; р < 0,05).
У 26 хворих (83,87 %) І групи та у 18 осіб (56,25 %) ІІ групи було досягнуто контроль або частковий контроль БА, що дозволило через 3 місяці після початку лікування цим 44 хворим (69,84 %) призначити базисне лікування, що відповідало обсягу меншої сходинки. До лікування в І групі 3 дітей (9,68 %) отримували базисну терапію в обсязі кроку 1, 19 (61,29 %) — кроку 2, 6 (19,35 %) — кроку 3, 3 (9,68 %) — кроку 4. Після лікування 5 дітей (16,13 %) отримували базисну терапію в обсязі кроку 1, 21 (67,74 %) — кроку 2, 5 (16,13 %) — кроку 3. У ІІ групі до лікування 6 хворих (18,75 %) отримували базисну терапію в обсязі кроку 1, 16 (50,00 %) — кроку 2, 7 (21,86 %) — кроку 3, 3 (9,38 %) — кроку 4. Після лікування 8 осіб (25,00 %) отримували терапію в обсязі кроку 1, 14 (43,75 %) — кроку 2, 8 (25,00 %) — кроку 3, 2 (6,25 %) — кроку 4 (табл. 2).
/74.jpg)
Отримані дані демонструють, що в І групі 6 хворих (19,35 %) після лікування почали отримувати базисну терапію, що відповідає обсягу меншої сходинки. У ІІ групі таких дітей було 3 (9,38 %). Отже, додавання холекальциферолу до базисної терапії в дозі 1000 МО протягом 3 місяців приводить до застосування менших доз інгаляційних глюкокортикостероїдів (ІГКС) у хворих на БА (χ2 = 3,74; р > 0,05), що дозволяє зменшити ризик побічних ефектів ІГКС.
До лікування в І групі 11 хворих (35,58 %) мали загострення рідше 1 разу на місяць, 12 (38,71 %) — 2–3 рази на місяць, 6 (19,35 %) — більше 1 разу на тиждень, 2 (6,45 %) — щоденно. Після лікування 27 дітей (87,10 %) мали загострення рідше 1 разу на місяць, 4 (12,90 %) — 2–3 рази на місяць. У ІІ групі до лікування 6 хворих (18,75 %) мали загострення рідше 1 разу на місяць, 15 (46,89 %) — 2–3 рази на місяць, 8 (25,00 %) — більше 1 разу на тиждень, 3 (9,38 %) — щоденно. Після лікування 7 дітей (21,86 %) мали загострення рідше 1 разу на місяць, 14 (43,75 %) — 2–3 рази на місяць, 11 (34,38 %) — більше 1 разу на тиждень. До лікування в І групі тривалість загострень у 21 дитини (67,74 %) становила більше 10 днів, після лікування — у всіх пацієнтів не перевищувала 10 днів. У ІІ групі до лікування тривалі загострення мали 19 хворих (59,38 %), після — 21 (65,63 %) (табл. 3, 4).
/75_2.jpg)
Дані, наведені в табл. 3 та 4, демонструють, що динаміка клінічних проявів БА в І та ІІ групах була різною: у І групі хворих після лікування вірогідно зменшилася частота загострень (χ2 = 14,91; р < 0,05) та тривалість загострень (χ2 = 8,71; р < 0,05) на відміну від ІІ групи (р > 0,05). Ефективність лікування була вірогідно вищою в дітей І групи (χ2 = 12,91; р < 0,05).
Таким чином, додавання холекальциферолу до базисної терапії БА в дозі 1000 МО протягом 3 місяців покращує контроль симптомів БА, зменшуючи тривалість та частоту загострень захворювання, що призводить до поліпшення якості життя хворих на БА.
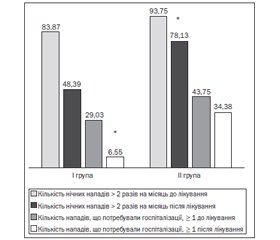
Кількість нападів, що потребували госпіталізації протягом 3 місяців, мала місце до лікування в 9 хворих (29,03 %) І групи, після лікування — у 2 (6,55 %), у ІІ групі — до лікування в 14 дітей (43,75 %), після лікування — в 11 (34,38 %). Кількість нічних нападів більше 2 разів на місяць спостерігалася у 26 осіб (83,87 %) І групи до лікування та в 15 (48,39 %) — після лікування, у ІІ групі — у 30 пацієнтів (93,75 %) до лікування та у 25 (78,13 %) — після лікування (рис. 1).
У І групі протягом 3 місяців після лікування вірогідно зменшилася кількість нападів, що потребували госпіталізації (χ2 = 5,42; р < 0,05), та нічних нападів (χ2 = 8,71; р < 0,05). У ІІ групі кількість нападів, що потребували госпіталізації (χ2 = 0,59; р > 0,05), та нічних нападів зменшилася невірогідно (χ2 = 3,23; р > 0,05). При аналізі результатів лікування хворих І та ІІ груп було виявлено вірогідну різницю за даними показниками (χ2 = 6,01; р < 0,05).
Отже, додавання холекальциферолу до базисної терапії БА в дозі 1000 МО протягом 3 місяців вірогідно зменшує кількість нападів, що потребують госпіталізації, та кількість нічних нападів за рахунок зменшення ступеня тяжкості нападів та покращення контрольованості БА.
У І групі до лікування 11 хворих (35,48 %) для зняття симптомів БА застосовували сальбутамол за потреби більше 2 разів на тиждень у дозі 100 мкг інгаляційно 3–4 рази на добу з інтервалом не менше 3 годин, після лікування — 3 (9,67 %), у ІІ групі — 10 (31,25 %) та 7 дітей (21,88 %) відповідно (табл. 5).
Дані табл. 5 демонструють, що в І групі хворих після лікування вірогідно зменшилося застосування сальбутамолу з метою зняття симптомів БА (χ2 = 7,38; р < 0,05). У ІІ групі хворих статистичної вірогідності не було досягнуто (χ2 = 1,70; р > 0,05).
Таким чином, додавання холекальциферолу до базисної терапії БА вірогідно зменшує застосування бронхолітика короткої дії для зняття симптомів БА. Це дозволяє зменшити потребу в невідкладному лікуванні, побічні ефекти ліків та медикаментозне навантаження за рахунок досягнення належного рівня контролю БА.
При вивченні динаміки показників функції зовнішнього дихання під впливом лікування були отримані такі результати. Зменшення показнику ОФВ1 < 80 % від належного виявлено в І групі у 18 хворих (64,29 %) до лікування та в 10 (35,71 %) — після нього, у ІІ групі в 19 дітей (70,37 %) — до лікування та в 16 (59,26 %) — після нього. Добові коливання ПШВ > 20 % в І групі спостерігалися в 16 дітей (51,61 %) до лікування та в 5 (16,13 %) — після, у ІІ групі — у 15 (46,88 %) та в 14 (43,75 %) відповідно (рис. 2).
У І групі досягнуто статистичну вірогідність підвищення ОФВ1 (χ2 = 4,57; р < 0,05) та зменшення добового коливання ПШВ після лікування (χ2 = 8,71; р < 0,05). У ІІ групі статистичної вірогідності за цими показниками не було досягнуто (χ2 = 0,73 та χ2 = 0,06 відповідно, р > 0,05). При порівнянні результатів після лікування двох груп було виявлено статистично вірогідну різницю (χ2 = 5,70; р < 0,05).
Нами було оцінено тяжкість АД хворих основної групи згідно з індексом SCORAD до та після лікування. У І групі до лікування 6 дітей (27,27 %) мали індекс SCORAD < 20 балів, у 9 хворих (40,91 %) індекс SCORAD знаходився в межах 20–40 балів, у 7 (31,82 %) — > 40 балів. Через 3 місяці після лікування 12 дітей (54,55 %) мали індекс SCORAD < 20 балів і в 10 хворих (45,55 %) він знаходився в межах 20–40 балів. У ІІ групі до лікування 13 дітей (61,90 %) мали індекс SCORAD < 20 балів, у 6 хворих (28,57 %) цей показник знаходився в межах 20–40 балів, у 2 (9,52 %) — > 40 балів. Після лікування в ІІ групі 14 хворих (66,67 %) мали індекс SCORAD < 20 балів, 6 (28,57 %) — у межах 20–40 балів, 1 (4,76 %) — > 40 балів (табл. 6).
Дані, що наведені в табл. 6, свідчать про те, що застосування холекальциферолу вірогідно зменшує індекс SCORAD. Після проведеної терапії індекс SCORAD покращився в 12 дітей (54,54 %) І групи (χ2 = 9,053; р < 0,05) проти 6 (28,57 %) ІІ групи (χ2 = 1,921; р > 0,05). Отже, додавання холекальциферолу зменшує прояви АД, покращуючи стан та функцію епідермального бар’єра.
Обговорення та висновки
Літературні дані свідчать, що ефект від FLG-мутацій збільшувався в зимовий період, що підтверджує гіпотезу про те, що різниця у вітамін-D-статусі була викликана ультрафіолетовим випромінюванням [4]. Гідроліз філагрину та подальший розпад амінокислот є чутливим до вологості процесом. Цей процес, як правило, прискорюється протягом зими в помірних кліматичних умовах через примусовий обігрів приміщень. Крім того, запалення шкіри, що спостерігається у хворих на АД, знижує рівень філагрину, особливо взимку [9]. Отже, зниження сонячного випромінювання взимку в поєднанні з вологістю і запаленням у шкірі, слугує приводом гідролізації філагрину і може пояснити зниження ефекту FLG-мутацій протягом зими [4, 16].
Порівняння хворих на AД та здорових дітей показало, що в дітей з AД був знижений прийом вітаміну D з їжею порівняно з контрольною групою [13]. Збільшення поширеності дефектів гена FLG відбувалося порівняно недавно з метою забезпечення адекватного вітамін-D-статусу в жителів північних широт та в культурах, де відсутнє широке споживання морепродуктів [14]. Зниження рівня філагрину приводить до відповідного зменшення рівнів транс-UCA, що є основним ендогенним фільтром проти ультрафіолетового опромінення в слабопігментованих осіб [14].
Дані численних досліджень вказують на асоціацію низького рівня 25(OH)D3 у крові, бронхообструкції та підвищеної потреби в ГКС. Дефіцит вітаміну D сприяє розвитку БА в дітей [7]. Зниження рівня 25(OH)D3 у крові пов’язане з більш високими шансами загострення БА [3]. Діти, які отримують інгаляційні та пероральні ГКС, мають статистично вірогідно нижчі рівні 25(OH)D3 у крові [17]; діти після отримання інгаляційного будесоніду та вітаміну D3 мають менше загострень БА [11].
Наше дослідження довело, що додавання холекальциферолу до базисної терапії БА в дозі 1000 МО протягом 3 місяців приводить до вірогідного зниження частоти та тривалості загострень захворювання, зменшення кількості нічних нападів та нападів, що потребують госпіталізації, покращує показники функції зовнішнього дихання, зменшує застосування сальбутамолу за потреби для зняття симптомів та зменшує індекс SCORAD. Це дозволяє рекомендувати запропоновану схему лікування при різних ступенях тяжкості БА в дітей з АД.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів.
Список литературы
1. Amestejani M. Vitamin D supplementation in the treatment of atopic dermatitis: a clinical trial study / Amestejani M., Salehi B.S., Vasigh M. // Journal of Drugs in Dermatology. — 2012. — 11(3). — 327-330. — PMID: 22395583.
2. Adams J.S. Unexpected actions of vitamin D: new perspectives on the regulation of innate and adaptive immunity / Adams J.S., Hewison M. // Nat. Clin. Pract. Endocrinol. Metab. — 2008. — 4. — 80-90. — doi: 10.1038/ncpendmet0716.
3. Brehm J.M., Schuemann B., Fuhlbrigge A.L., Hollis B.W., Strunk R.C., Zeiger R.S. et al. Serum vitamin D levels and severe asthma exacerbations in the Childhood Asthma Management Program study / Brehm J.M., Schuemann B., Fuhlbrigge A.L., Hollis B.W., Strunk R.C., Zeiger R.S. et al. // J. Allergy Clin. Immunol. — 2010. — 126(1). — 52-8.e5. — doi: 10.1016/j.jaci.2010.03.043.
4. Camargo C.A. Jr. Randomized trial of vitamin D supplementation for winter-related atopic dermatitis in children / Camargo C.A. Jr, Ganmaa D., Sidbury R., Erdenedelger Kh., Radnaakhand N., Khandsuren B. // J. Allergy Clin. Immunol. — 2014. — 134(4). — 831-835.e1. — doi: 10.1016/j.jaci.2014.08.002.
5. Delgoffe G.M. The mammalian target of rapamycin (MTOR) regulates T helper cell differentiation through the selective activation of MTORC1 and MTORC2 signaling / Delgoffe G.M., Pollizzi K.M., Waickman A.D., Heikamp E., Meyers D.J., Horton M.R., Bo Xiao, Worley P.F., Powell J.D. // Nature immunology. — 2011. — 12(4). — 295-303. — doi: 10.1038/ni.2005.
6. Ellisen L.W. Growth control under stress: mTOR regulation through the REDD1-TSC pathway / Ellisen L.W. // Cell. cycle. — 2005. — 4(11). — 1500-02. — doi: 10.4161/cc.4.11.2139.
7. Goleva E. Steroid requirements and immune associations with vitamin D are stronger in children than adults with asthma / Goleva E., Searing D.A., Jackson L.P., Richers B.N., Leung D.Y.M. // The Journal of Allergy and Clinical Immunology. — 2012. — 129(5). — 1243-1251. — doi:10.1016/j.jaci.2012.01.044.
8. Heimbeck I. Low vitamin D serum level is inversely associated with eczema in children and adolescents in Germany / Heimbeck I., Wjst M., Apfelbacher C.J. // Allergy. — 2013. — 68(7). — 906-910. — doi: 10.1111/all.12167.
9. Howell M.D. Cytokine modulation of atopic dermatitis filaggrin skin expression / Howell M.D., Kim B.E., Gao P., Grant A.V., Boguniewicz M., Debenedetto A. et al. // J. Allergy Clin. Immunol. — 2007. — 120. — 150-5. — doi: 10.1016/j.jaci.
10. Man L. Association between vitamin D deficiency and insufficiency and the risk of childhood asthma: evidence from a metaanalysis / Man L., Zhang Z., Zhang M. et al. // International Journal of Clinical and Experimental Medicine. — 2015. — 8(4). — 5699-5706. — PMID:26131154.
11. Majak P. Vitamin D supplementation in children may prevent asthma exacerbation triggered by acute respiratory infection / Majak P., Olszowiec-Chlebna M., Smejda K. et al. // J. Allergy Clin. Immunol. — 2011. — 127(5). — 1294-1296. — doi: 10.1016/j.jaci.2010.12.016.
12. Powell J.D. The mammalian target of rapamycin: linking T Cell differentiation, function, and metabolism / Powell J.D., Delgoffe G.M. // Immunity. — 2010. — 33(3). — 301-11. — doi:10.1016/j.immuni.2010.09.002
13. Solvoll K. Dietary habits among patient with atopic dermatitis / Solvoll K., Soyland E., Sandstad B., Drevon C.A. // European Journal of Clinical Nutrition. — 2000. — 54(2). — 93-97. — doi: 10.1038/sj.ejcn.1600901.
14. Thyssen J.P., Bikle D.D., Elias P.M. Evidence That Loss-of-Function Filaggrin Gene Mutations Evolved in Northern Europeans to Favor Intracutaneous Vitamin D3 Production / Thyssen J.P., Bikle D.D., Elias P.M. // Evolutionary biology. — 2014. — 41(3). — 388-396. — doi:10.1007/s11692-014-9282-7.
15. Thyssen J.P. Skin barrier abnormality caused by filaggrin (FLG) mutations is associated with increased serum 25-hydroxy vitamin D concentrations / Thyssen J.P., Thuesen B., Huth C., Standl M., Carson C.G. et al. // J. Allergy Clin. Immunol. — 2012. — 130(5). — 1204-1207. — doi: 10.1016/j.jaci.2012.06.046
16. Thyssen J.P., Zirwas M.J., Elias P.M. Potential role of reduced environmental UV exposure as a driver of the current epidemic of atopic dermatitis / Thyssen J.P., Zirwas M.J., Elias P.M. // J. Allergy Clin. Immunol. — 2015. — 136(5). — 1163-9. — doi: 10.1016/j.jaci.2015.06.042.
17. Searing D.A. Decreased serum vitamin D levels in children with asthma are associated with increased corticosteroid use / Searing D.A., Zhang Y., Murphy J.R., Hauk P.J., Goleva E., Leung D.Y. // J. Allergy Clin. Immunol. — 2010. — 125(5). — 995-1000. — doi: 10.1016/j.jaci.2010.03.008.
18. Yang J. Inhibition of mTORC1 by RAD001 (everolimus) potentiates the effects of 1,25-dihydroxyvitamin D(3) to induce growth arrest and differentiation of AML cells in vitro and in vivo / Yang J., Ikezoe T., Nishioka C., Ni L., Koeffler H.P., Yokoyama A. // Experimental hematology. — 2010. — 38(8). — 666-76. — doi: 10.1016/j.exphem.2010.03.020.
/75.jpg)
/76.jpg)

/74.jpg)
/75_2.jpg)
/76_2.jpg)