Державний експертний центр МОЗ
ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України
Національний інститут серцево-судинної хірургії імені М.М. Амосова НАМН України
Асоцiацiя кардiологiв України
Персональний склад мультидисциплінарної робочої групи з розробки медичних стандартів (уніфікованих клінічних протоколів) медичної допомоги на засадах доказової медицини у 2014 – 2015 роках за темою «Стабільна ішемічна хвороба серця»
Соколов Максим Юрійович провідний науковий співробітник відділу інтервенційної кардіології Державної установи «Національний науковий центр «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України», д.м.н., професор, головний позаштатний спеціаліст МОЗ України зі спеціальності «Кардіологія»;
Талаєва Тетяна Володимирівна в.о. Генерального директора Державного підприємства «Державний експертний центр Міністерства охорони здоров’я України», д.м.н., професор;
Ліщишина Олена Михайлівна директор Департаменту стандартизації медичних послуг Державного підприємства «Державний експертний центр Міністерства охорони здоров’я України», cт.н.с., к.м.н.;
Лутай Михайло Іларіонович заступник директора з наукової роботи Державної установи «Національний науковий центр «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України», д.м.н., професор;
Лисенко Ганна Федорівна старший науковий співробітник відділу атеросклерозу та хронічної ІХС Державної установи «Національний науковий центр «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України», к.м.н.;
Амосова Катерина Миколаївна ректор Національного медичного університету імені О.О. Богомольця, завідувач кафедри госпітальної терапії № 2, член-кор. НАМН України, д.м.н., професор;
Вакалюк Ігор Петрович проректор з наукової роботи Державного вищого навчального закладу «Івано-Франківський національний медичний університет», завідувач кафедри внутрішньої медицини № 4 та медсестринства, д.м.н., професор;
Гідзинська Ірина Миколаївна завідувач консультативно-діагностичного центру (КДЦ) терапевтичного відділення КДЦ Державної наукової установи «Науково-практичний центр профілактичної та клінічної медицини» Державного управління справами, к.м.н.;
Голікова Ілона Петрівна старший науковий співробітник відділу атеросклерозу та хронічної ІХС Державної установи «Національний науковий центр «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України», к.м.н.;
Жарінов Олег Йосипович професор кафедри кардіології та функціональної діагностики Національної медичної академії післядипломної освіти імені П.Л. Шупика, д.м.н., професор, головний позаштатний спеціаліст МОЗ України зі спеціальності «Функціональна діагностика»;
Клименко Ліліана Вікторівна асистент кафедри сімейної медицини та амбулаторно-поліклінічної допомоги Національної медичної академії післядипломної освіти імені П.Л. Шупика, к.м.н.;
Матюха Лариса Федорівна завідувач кафедри сімейної медицини і амбулаторно-поліклінічної допомоги Національної медичної академії післядипломної освіти імені П.Л. Шупика, д.м.н., професор, головний позаштатний спеціаліст МОЗ України зі спеціальності «Загальна практика – сімейна медицина»;
Мітченко Олена Іванівна завідувач відділу дисліпідемій Державної установи «Національний науковий центр «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України», д.м.н., професор;
Мороз Галина Зотівна професор кафедри військової загальної практики – сімейної медицини Української військово-медичної академії, д.м.н., професор;
Нетяженко Василь Захарович завідувач кафедри пропедевтики внутрішньої медицини № 1 Національного медичного університету імені О.О. Богомольця, член-кор. НАМН України, д.м.н., професор, головний позаштатний спеціаліст МОЗ України зі спеціальності «Терапія»;
Руденко Анатолій Вікторович завідувач відділенням хірургії ішемічної хвороби серця Державної установи «Національний інститут серцево-судинної хірургії імені М.М. Амосова НАМН України», д.м.н., професор;
Руденко Костянтин Володимирович заступник головного лікаря Державної установи «Національний інститут серцево-судинної хірургії імені М.М. Амосова НАМН України», д.м.н., головний позаштатний спеціаліст МОЗ України зі спеціальності «Хірургія серця і магістральних судин у дорослих»;
Скибчик Василь Антонович професор кафедри сімейної медицини та кафедри клінічної фармації Львівського національного медичного університету імені Данила Галицького, д.м.н., професор;
Соколов Юрій Миколайович завідувач відділу інтервенційної кардіології Державної установи «Національний науковий центр «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України», д.м.н., професор;
Тащук Віктор Корнійович завідувач кафедри внутрішньої медицини, фізичної реабілітації, спортивної медицини та фізичного виховання Вищого державного навчального закладу України «Буковинський державний медичний університет», д.мед.н., професор;
Титова Тетяна Анатоліївна доцент кафедри сімейної медицини та амбулаторно-поліклінічної допомоги Національної медичної академії післядипломної освіти імені П.Л. Шупика, к.м.н.;
Тихонова Сусанна Адольфівна професор кафедри внутрішньої медицини № 2 Одеського національного медичного університету, д.м.н., кардіолог вищої категорії;
Хіміон Людмила Вікторівна завідувач кафедри сімейної медицини Національної медичної академії післядипломної освіти ім. П.Л. Шупика;
Целуйко Віра Йосипівна завідувач кафедри кардіології та функціональної діагностики Харківської медичної академії післядипломної освіти, д.м.н., професор.
Методичний супровід та інформаційне забезпечення
Горох Євгеній Леонідович начальник відділу якості медичної допомоги та інформаційних технологій Державного підприємства «Державний експертний центр МОЗ України», к.техн.н.;
Мельник Євгенія Олександрівна начальник відділу доказової медицини Державного підприємства «Державний експертний центр МОЗ України»;
Нетяженко Нонна Василівна експерт відділу доказової медицини Державного підприємства «Державний експертний центр Міністерства охорони здоров’я України»;
Шилкіна Олена Олександрівна начальник відділу методичного забезпечення новітніх технологій у сфері охорони здоров’я Державного підприємства «Державний експертний центр МОЗ України».
Державний експертний центр МОЗ України є членом
Guidelines International Network (Міжнародна мережа настанов)
ADAPTE (Франція)(Міжнародний проект з адаптації клінічних настанов)
Рецензенти:
Коваль Олена Акіндінівна професор кафедри госпітальної терапії № 2 Державного закладу «Дніпропетровська медична академія Міністерства охорони здоров’я України», д.м.н., професор;
Долженко Марина Миколаївна завідуюча кафедрою кардіології Національної Академії післядипломної освіти ім. П.Л. Шупика, д.м.н. професор.
1.ПЕРЕЛІК СКОРОЧЕНЬ
АГ Артеріальна гіпертензія
АДФ Аденозину дифосфат
АКШ Аортокоронарне шунтування
АПФ Ангіотензинперетворюючий фермент
АТ Артеріальний тиск
АСК Ацетилсаліцилова кислота
АЧТЧ Активований частковий тромбопластиновий час
ББ β-адреноблокатори
БКК Блокатори каналів кальцію
БРА Блокатор рецепторів ангіотензину II
БЛНПГ Блокада лівої ніжки пучка Гіса
БПНПГ Блокада правої ніжки пучка Гіса
в/к Внутрішньокоронарний
в/в Внутрішньовенний
ВР Відносний ризик
ГІМ Гострий інфаркт міокарда
ГКС Гострий коронарний синдром
ДІ Довірчий інтервал
ДГП Дигідропіридинові
ДМЕКГ Добове моніторування ЕКГ
ЕД Еректильна дисфункція
ЗГТ Замісна гормональна терапія
ІМ Інфаркт міокарда
ІКГ Інвазивна коронарографія
ЗХС Загальний холестерин
ЕКГ Електрокардіограма
ЕхоКГ Ехокардіограма
ІМТ Індекс маси тіла
ІХС Ішемічна хвороба серця
КА Коронарні артерії
КВ Кардіо-васкулярний
КГ Коронарографія
КІН Контраст індукована нефропатія
КР Кардіореабілітація
КТ Комп’ютерна томографія
ЛШ Лівий шлуночок
ЛКА Ліва коронарна артерія
МРТ Магнітно-резонансна томографія
НМД Невідкладна медична допомога
НМГ Низькомолекулярні гепарини
НФГ Нефракціонований гепарин
ОМТ Оптимальна медикаментозна терапія
ПАТТ Подвійна антитромбоцитарна терапія
ПМК Перший медичний контакт
ПНГЛКА Передня низхідна гілка лівої коронарної артерії
ПЕТ Позитронна емісійна томографія
РКК Резерв коронарного кровотоку
САТ Систолічний артеріальний тиск
СРП С-реактивний протеїн
ССЗ Серцево-судинні захворювання
ТГ Тригліцериди
ТІА Транзиторна ішемічна атака
ТФН Толерантність до фізичного навантаження
УКПМД Уніфікований клінічний протокол надання медичної допомоги
ПКВ Перкутанне коронарне втручання
ФВ Фракція викиду
ФК Функціональний клас
ФР Фактори ризику
ФРК фракційний резерв кровотоку
ФШ Фібриляція шлуночків
ХС ЛПНЩ Холестерин ліпопротеїнів низької щільності
ХС ЛПВЩ Холестерин ліпопротеїнів високої щільності
ХСН Хронічна серцева недостатність
ХЗН Хронічне захворювання нирок
ХНН Хронічна ниркова недостатність
ЦД Цукровий діабет
ЧКВ Черезшкірне коронарне втручання
ЧСС Частота серцевих скорочень
ШКФ швидкість клубочкової фільтрації
ШТ Шлуночкова тахікардія
HbA1c Глікозильований гемоглобін
IVUS ІntraVascular Ultrasound Study (внутрішньосудинне ультразвукове дослідження)
2. ПЕРЕДМОВА
Клінічна настанова (КН) ставить за мету допомогти практикуючому лікарю обрати оптимальну стратегію щодо ведення хворого зі стабільною ішемічною хворобою серця (ІХС), враховуючи можливості, ризики і переваги сучасних діагностичних та терапевтичних заходів. Прототипами для розробки Клінічної настанови обрані:
1. 2013 ESC guidelines on the management of stable coronary artery disease //European Heart Journal (2013) 34, 2949–3003
2. 2012 ACCF/AHA/ACP/AATS/PCNA/SCAI/STS Guideline for the Diagnosis and Management of Patients with Stable Ischemic Heart Disease//Circulation, 2012, 126: e354-e471.
3. 2014 ESC/EACTS Guidelines on myocardial Revascularization. The Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS)// European Heart Journal (2014) 35, 2541–2619
Європейське кардіологічне товариство, як і Українська Асоціація кардіологів, регулярно публікують відповідні документи, які стосуються ведення хворих з кардіологічною патологією. Попередні Європейські рекомендації щодо лікування хронічної ІХС вийшли у 2006 році. Новий варіант рекомендацій включає результати останніх клінічних досліджень і реєстрів, дані практичної кардіології та передбачає використання якісних критеріїв допомоги кардіологічним пацієнтам. Рекомендації, які публікує Європейське кардіологічне товариство можна знайти на веб сайті: www.escardio.org/guidelines-surveys; Українська асоціація кардіологів. Зазначені рекомендації є офіційними документами вищеназваних організацій і представляють офіційну точку зору останніх щодо сучасного стану проблеми та належної курації хворих.
Коментар робочої групи: У порівнянні з Європейськими рекомендаціями 2006 року в новий документ було внесено цілий ряд суттєвих змін щодо визначення, діагностики і лікування захворювання. Так, для визначення нозології замість попереднього «стабільна стенокардія», використано термін «стабільна хвороба коронарних артерій», який, безперечно, є більш точним з точки зору патогенетичної сутності захворювання. Зазначимо, що за номенклатурою ВООЗ, цей термін вважається синонімом «ішемічної хвороби серця (ІХС)». В свою чергу, ІХС – загальновизнана назва патології в Україні, тому надалі у тексті використовується саме цей термін. Нові рекомендації включають наступні зміни:
• У діагностичному алгоритмі ІХС більше уваги приділяється визначенню претестової імовірності захворювання.
• Планується, що використання сучасної інформації щодо претестової імовірності, дозволить знизити частоту необгрунтованого діагностування ІХС, особливо у жінок.
• У діагностиці ІХС зростає роль візуалізаційних методів, таких, як магнітно-резонансна томографія (МРТ), комп’ютерна томографія (КТ), ангіографія.
• Більше уваги приділяється коронарному вазоспазму, мікроваскулярній дисфункції як достатньо розповсюдженим причинам стенокардії.
• Рекомендується чітке розмежування щодо діагностики і оцінки прогнозу як окремих етапів у веденні хворих з підозрою на стабільну ІХС
• Більше уваги приділяється боротьбі з факторами ризику (ФР) і, таким чином, попередженню серйозних коронарних ускладнень.
• Оновлені рекомендації щодо використання антиангінальних препаратів.
• Рекомендовані для впровадження нові методи оцінки ішемії і ураження коронарних артерій, а також – технічні пристрої для проведення реваскуляризації міокарда.
• Окремо обговорюється питання щодо стратегії лікування: реваскуляризація чи медикаментозне лікування, а також вибір методу реваскуляризації в залежності від потреб пацієнта.
У настанові застосована міжнародну класифікацію доказовості щодо методів діагностики та лікування (табл 1 і 2).
3. ВСТУП
Рекомендації призначені для надання медичної допомоги пацієнтам з підтвердженим діагнозом чи підозрою на стабільну ІХС, включаючи :
1) хворих зі стабільною стенокардією чи її еквівалентами (наприклад, задишкою)
2) хворих з підтвердженим діагнозом ІХС, у яких завдяки терапії симптоматика відсутня (ця група хворих потребує регулярного диспансерного нагляду)
3) хворих, які мають стабільну симптоматику протягом тривалого періоду (кілька місяців), проте звернулись за допомогою вперше.
Враховуючи, що перебіг ІХС включає різні фази, обстеження пацієнта має виключити наявність гострого коронарного синдрому (ГКС).
Алгоритми діагностики та лікування стабільної ІХС можуть також бути застосовані :
• У хворих, які мають стенокардію, що виникла вперше, та низький ризик ГКС (відсутні: рекурентний біль, симптоми серцевої недостатності, зміни на ЕКГ у стані спокою, біохімічні маркери міокардіального некрозу – підвищення рівнів тропоніну)
• У безсимптомних пацієнтів з аномальними результатами діагностичних тестів
• У хворих після стабілізації ГКС.
Традиційні уявлення про стабільну ІХС передбачають, що симптоматика захворювання провокується фізичними навантаженнями чи стресовими ситуаціями і обумовлена гемодинамічно значущими звуженнями (> 50% діаметру) > 1 з основних коронарних артерій. Порівняно з попередніми, рекомендації 2013 р. приділяють більше уваги діагностиці і прогностичному значенню інших патогенетичних механізмів захворювання, зокрема – вазоспазму коронарних судин та мікроваскулярній дисфункції. Ще одна відмінність нових рекомендацій – це визначення претестової імовірності ІХС як суттєвого чинника наступного діагностичного алгоритму.
4. ВИЗНАЧЕННЯ І ПАТОФІЗІОЛОГІЯ
Стабільна ІХС характеризується розвитком епізодів ішемії, які обумовлені дисбалансом між потребами та кровопостачанням міокарда. Як правило, такі епізоди провокуються фізичними або емоційними навантаженнями чи іншими стресовими ситуаціями, проте можуть з'являтись спонтанно. Класичним проявом ішемії міокарда є напади стенокардії. В деяких випадках захворювання певний час може мати безсимптомний перебіг і дебютувати гострим коронарним синдромом (ГКС). ІХС може мати довготривалий доклінічний період на фоні підтвердженого коронарного атеросклерозу. Стенокардія спокою, викликана спазмом коронарних судин, розглядається як одна із форм ІХС. Основні характеристики захворювання представлені у таблиці 1
5. ЕПІДЕМІОЛОГІЯ
Визначення реальної поширеності стабільної ІХС має певні труднощі через мультисимптомність захворювання. Як, правило, епідеміологічні дослідження ІХС базуються на виявленні стабільної стенокардії, як найбільш типової клінічної ознаки хвороби, з наступним клінічним підтвердженням діагнозу. Класичним скринінговим підходом до виявлення стенокардії є використання відповідних анкет, наприклад, опитувальника Rose. Слід зазначити, що при порівнянні отриманих результатів з даними коронарографії, анкета Rose має високу специфічність ~ 80-95% і дещо варіабельну чутливість – 20-80%. Поширеність стенокардії суттєво зростає з віком незалежно від статі. У жінок показник складає 5-7% у віці 45-64 роки і 10-12% у віці 65-84 роки. У чоловіків – 4-7% у віці 45-64 роки та 12-14% у 65-84 роки.
Коментар робочої групи: за офіційною статистикою 2013р поширеність усіх форм ІХС серед дорослого населення України становить ~ 2 4%, в тому числі серед осіб працездатного віку – близько 10%. Захворюваність ~ 2% на рік. Стенокардія зустрічається ~ у 35,5% хворих з ІХС, які звертаються за медичною допомогою. Проте, за результатами «Українського дослідження 20 факторів серцево-судинного ризику в міській популяції м. Дніпропетровськ (2009-2013 рр)», Мітченко О.І. та співавтори, розповсюдженість ІХС у віковій групі 30-69 років за клінічними даними і змінами на ЕКГ склала 13,2%, тобто, суттєво менше офіційних показників і практично відповідає європейським.
6. ПЕРЕБІГ ТА ПРОГНОЗ ЗАХВОРЮВАННЯ
У багатьох пацієнтів, ранніми проявами ІХС є дисфункція ендотелію і мікросудинна стенокардія. Їх наявність пов'язана з підвищеним ризиком ускладнень ІХС. Сучасні дані щодо загального прогнозу у хворих з ІХС можуть бути отримані з клінічних досліджень, присвячених визначенню ефективності лікування з використанням антиангінальних засобів та медикаментозних препаратів для покращення прогнозу та/або реваскуляризації, також ці дані можуть ґрунтуватись на результатах окремих підрозділів популяційних досліджень. За їх результатами розрахункові показники щорічної загальної смертності у зазначеної категорії хворих складають 1,2-2,4%, смертності від серцево-судинних причин – 0,6-1,4%.
Коментар робочої групи: в Україні у дорослих показник смертності від серцево-судинної патології серед усіх причин смерті складає 66,5%. Причому, у більшості померлих від кардіоваскулярних захворювань (68,1%) причиною смерті визнана ІХС, що становить 660,5 осіб на 100 тисяч населення.
Серед чинників, які погіршують прогноз хворих з ІХС – зниження фракції викиду лівого шлуночка (ФВ ЛШ) і серцева недостатність, більша кількість уражених судин, проксимальна локалізація і значна вираженість коронарного стенозу, більша площа ЛШ, на яку розповсюджується ішемія, старший вік, значна депресія сегменту ST на ЕКГ і більш тяжкий функціональний клас стенокардії.
Загальновизнані фактори ризику (ФР) що призводять розвитку ІХС – артеріальна гіпертензія (АГ), гіперхолестеринемія, цукровий діабет (ЦД), гіподинамія, ожиріння, тютюнопаління та обтяжений сімейний анамнез – також мають негативний вплив на прогноз пацієнтів з наявним захворюванням, переважно, за рахунок прогресування атеросклеротичного процесу. Дуже важливо, що відповідне лікування здатне зменшити зазначені ризики. Підвищену частоту серцевих скорочень (ЧСС) також відносять до показників несприятливого прогнозу у хворих з підозрою чи підтвердженим діагнозом ІХС. Тому корекція цього показника розглядається як обов’язкова складова оптимальної фармакотерапії.
7. ДІАГНОСТИКА СТАБІЛЬНОЇ ІХС
Діагностика та обстеження хворого зі стабільною ІХС включає клінічний огляд, лабораторне дослідження (визначення показників ліпідного обміну, глюкози крові, інших біохімічних даних), спеціальні кардіологічні дослідження (проби з дозованим фізичним навантаженням, проби з візуалізацією коронарних артерій, тощо). Такий комплекс досліджень при підозрі на ІХС необхідний для встановлення діагнозу, а також для визначення супутньої патології, факторів, які погіршують перебіг основного захворювання, стратифікації ризику та оцінки ефективності терапії. На практиці обстеження не тільки допомагає встановити діагноз, але і надає інформацію щодо прогнозу пацієнта. Проте для кращого сприйняття, у тексті рекомендацій данні щодо діагностики захворювання та оцінки прогнозу хворого представлені окремо.
7.1 Клінічні симптоми
Збір анамнезу залишається наріжним каменем у діагностиці стенокардії. У більшості випадків анамнез дозволяє встановити точний діагноз, а фізикальне обстеження та інструментальні методи дослідження необхідні тільки для його підтвердження чи виключення альтернативної патології.
Специфічні особливості больового синдрому (стенокардії), викликаного ішемією міокарда, включають наступні параметри: локалізацію, характер, тривалість болю, його зв’язок з фізичним чи психоемоційним навантаженням, а також фактори, які його усувають.
У типових випадках дискомфорт, обумовлений ішемією, локалізується у загрудинній області з можливою іррадіацією в нижню щелепу, ліве плече, епігастральну область, спину або верхні кінцівки. Дискомфорт характеризується як відчуття стискання, напруження, тяжкості, печії у зазначеній області. При зборі анамнезу необхідно запитувати пацієнтів про наявність такого «дискомфорту», оскільки багато хто з них не сприймають свої відчуття як «біль». Стенокардію може супроводжувати задишка, а також менш специфічні симптоми такі, як слабкість, нудота, відчуття тривоги, головокружіння. Задишка може бути єдиним симптомом стабільної ІХС, у таких випадках необхідна диференційна діагностика з патологією органів дихання. Симптоматика при стенокардії є короткотривалою і у більшості хворих продовжується кілька хвилин (не більше 10 хвилин в цілому). Проте, біль, який триває кілька секунд, не є стенокардією. Важливою характеристикою ангінозного больового синдрому є його зв’язок з фізичними навантаженнями, специфічною активністю чи емоційним стресом. У класичному варіанті симптоматика наростає при збільшенні навантаження, наприклад, при підйомі вгору, а також при ходьбі проти вітру чи в холодну погоду. Патологічні відчуття швидко – протягом кількох хвилин – зменшується після припинення дії провокуючих факторів. Посилення симптомів при фізичній активності після переїдання чи одразу після пробудження у ранкові години також є класичною ознакою стенокардії. Симптоматика може зменшуватись при повторних навантаженнях, у деяких хворих спостерігається «синдром розходжування». Буккальні та сублінгвальні форми нітратів здатні швидко усунути ангінозний біль і тому вважаються стандартними терапевтичними засобами для таких випадків. «Поріг» виникнення стенокардії, як і клінічна симптоматика, можуть відрізнятися у різні дні і навіть вподовж одного дня.
Визначення типової і атипової стенокардії представлені у таблиці 4. Атипова стенокардія нагадує типові напади, проте їй властиві не усі характерні особливості останніх. Поява стенокардії у стані спокою, з посиленням інтенсивності болю до максимуму протягом до 15 хвилин, повільне зменшення больових відчуттів можуть свідчити про те, що причиною захворювання є коронарний вазоспазм. Відповідна локалізація і характер болю, який може з’являтись не під час навантаження, а після його припинення, недостатня ефективність нітратів часто спостерігаються у пацієнтів з мікроваскулярною стенокардією.
/113/tab4.jpg)
Неангінальний біль не відповідає описаним типовим характеристикам, він може локалізуватись у невеликій ділянці правої або лівої половини грудної клітки і тривати від кількох годин до кількох днів. Як правило, така симптоматика не полегшується після застосування нітрогліцерину (за виключенням випадків езофагального спазму) і може провокуватись пальпацією відповідних ділянок грудної клітини. За наявності неангінального больового синдрому необхідно шукати некардіальні причини захворювання.
Класифікація Канадського кардіологічного товариства широко застосовується для визначення функціонального класу/тяжкості стабільної стенокардії з урахуванням порогового фізичного навантаження, під час якого з’являються симптоми захворювання (таблиця 5). Слід зазначити, що ангінозний біль у стані спокою, як вияв коронарного вазоспазму, може виникати за наявності стенокардії напруження будь-якого функціонального класу. Функціональний клас (ФК) стенокардії характеризує максимальне обмеження фізичних можливостей пацієнта, і в певні проміжки часу його самопочуття може бути кращим.
Пацієнти з болем у грудній клітці часто зустрічаються у клінічній практиці. У таких хворих для попереднього визначення імовірності ІХС рекомендований простий тест, який включає 5 показників:
- стать/вік (чоловіки >55 років, жінки >65);
- підтверджений діагноз судинної патології,
- підтверджений факт, що больовий синдром має кардіальне походження;
- біль посилюється при фізичному навантаженні
- біль не провокується пальпацією грудної клітки.
Наявність кожного показника дорівнює 1 балу. Специфічність тесту складає 81% (> 2 балів), чутливість – 87% (3-5 балів). Даний тест необхідно використовувати з урахуванням іншої клінічної інформації. Наприклад, наявність кашлю і колючий біль у грудях роблять діагноз ІХС малоймовірним. В той же час, іррадіація болю в ліву руку, відомий діагноз серцевої недостатності чи цукрового діабету (ЦД) підвищують вірогідність ІХС.
Важливими складовими клінічного дослідження хворого з підозрою на стенокардію є визначення наявності анемії, артеріальної гіпертензії (АГ), клапанних вад серця, гіпертрофічної обструктивної кардіоміопатії чи аритмій. Таким пацієнтам рекомендовано розрахувати індекс маси тіла (ІМТ) та проводити обстеження на предмет некоронарогенних захворювань. Зазначений огляд повинен включати оцінку пульсації на периферичних артеріях, аускультацію сонних та феморальних артерій, визначення гомілково-плечового індексу, а також – виявлення ознак коморбідних станів, при наявності захворювань щитоподібної залози, патології нирок чи ЦД. Хоча не існує специфічних особливостей щодо аускультації серця при стенокардії, під час чи одразу після епізоду ішемії міокарда можуть з’являтись ІІІ та IV серцеві тони, а також – ознаки мітральної недостатності, проте ці симптоми не є надійними і специфічними.
7.2 Неінвазивні кардіологічні дослідження
Хоча існує багато методів неінвазивних досліджень, які використовуються для підтвердження діагнозу стабільної ІХС, оптимальне застосування наявних ресурсів потребує попереднього визначення показника претестової імовірності захворювання, що базується на простих клінічних даних. Після встановлення діагнозу ІХС подальша курація хворого значною мірою залежить від тяжкості симптомів, ризику кардіоваскулярних ускладнень і побажань самого пацієнта. Йдеться про вибір між виключно медикаментозною терапією чи реваскуляризацією, з відповідним визначенням типу останньої. Існує усього кілька рандомізованих досліджень, які оцінювали результати діагностичних тестів, тому їх класифікація за рівнем доказовості базується на даних нерандомізованих досліджень і мета-аналізах цих же досліджень.
Базові дослідження
Перед проведенням будь-якого тестування необхідно оцінити загальний статус пацієнта, наявність супутніх захворювань і провести опитування щодо якості життя (наприклад, за анкетою «QoL»). Якщо попередня оцінка стану здоров’я пацієнта робить перспективу реваскуляризації малоімовірною, подальше обстеження хворого доцільно скоротити до клінічно необхідного мінімуму, при цьому потрібно призначити відповідну терапію, з можливим пробним призначенням антиангінальних препаратів, навіть якщо діагноз стабільної ІХС не повністю підтверджений.
Базове (першої лінії) дослідження пацієнтів з підозрою на стабільну ІХС включає загальний та біохімічний аналізи крові (таблиця 6), ЕКГ у стані спокою (таблиця 8), можливо – амбулаторне моніторування ЕКГ (якщо є вірогідність, що клінічна симптоматика обумовлена пароксизмальними порушеннями ритму) (таблиця 10), ЕхоКГ у стані спокою (таблиця 9), у вибраних хворих – рентгенографія грудної клітини (таблиця 11). Таке дослідження може проводитись амбулаторно.
Лабораторні дослідження крові
Лабораторні дослідження використовуються для визначення можливих причин ішемії, виявлення кардіоваскулярних ФР та пов’язаних з ними показників, а також для оцінки прогнозу.
Рівень гемоглобіну як частина загального аналізу крові, гормони щитоподібної залози (при підозрі на її захворювання) надають інформацію щодо можливих причин ішемії. Додаткову інформацію щодо прогнозу може надати загальний аналіз крові з визначенням кількості лейкоцитів та рівня гемоглобіну.
Кожен хворий з підозрою на ІХС потребує визначення рівня глюкози (натще) і глікозильованого гемоглобіну (HbA1c). Якщо обидва показники неінформативні, рекомендовано провести тест на толерантність до глюкози. Інформація щодо обміну глюкози є важливою, оскільки добре відомий зв’язок між кардіоваскулярними (КВ) ускладненнями та ЦД. Крім того, підвищення глюкози натще та постпрандіальна глікемія є предикторами несприятливого прогнозу при стабільній ІХС, незалежно від інших загальновизнаних ФР. Рівень HbA1c є предиктором прогнозу хворих, незалежно від наявності ЦД.
Коментар робочої групи: Обстеження та лікування пацієнтів з ЦД проводиться відповідно до положень Наказів МОЗ України № 1021від 29.12.2014 "Про затвердження та впровадження медико-технологічних документів зі стандартизації медичної допомоги при цукровому діабеті 1 типу у молодих людей та дорослих" та № 1118 від 21.12.2012 "Про затвердження та впровадження медико-технологічних документів зі стандартизації медичної допомоги при цукровому діабеті 2 типу».
Показники ліпідного обміну, включаючи загальний холестерин (ЗХС), холестерин ліпопротеїнів високої щільності (ХС ЛПВЩ), холестерин ліпопротеїнів низької щільності (ХС ЛПНЩ) і тригліцериди (ТГ), рекомендовано визначати у всіх хворих з підозрою чи встановленим діагнозом ІХС для оцінки ризику та контролю щодо потреб терапії.
Для оцінки ефективності лікування та виявлення нових випадків ЦД рекомендується проводити повторні аналізи параметрів ліпідного та вуглеводного обміну (таблиця 7). Оскільки на теперішній час немає доказів щодо оптимальних строків проведення таких обстежень, їх рекомендується проводити з частотою 1 раз на рік.
Ниркова дисфункція, асоційована з гіпертензією, ЦД чи реноваскулярним захворюванням, має негативний вплив на прогноз хворих зі стабільною ІХС. У зв’язку з цим, рекомендовано визначати базову функцію нирок за показником швидкості клубочкової фільтрації (ШКФ) з використанням формули Cockcroft-Gault
для жінок отриманий показник слід помножити на 0,85.
При підозрі на нестабільність перебігу ІХС необхідно визначати біохімічні маркери ушкодження міокарда (тропонін І або тропонін Т), використовуючи чутливий чи ультрачутливий кількісний аналіз. Якщо рівень тропоніну підвищений, наступна курація хворого повинна проводитись за відповідними рекомендаціями щодо лікування ГКС без елевації сегмента ST. Оскільки тропоніни відіграють основну роль у ідентифікації нестабільності, їх визначення показане усім пацієнтам, що госпіталізуються у зв’язку з симптомами ІХС. Разом з тим, у більшості хворих зі стабільним перебігом захворювання рівні тропонінів достатньо низькі, навіть при використанні високо чутливого кількісного аналізу. Тому при звичайному обстеженні амбулаторних пацієнтів зі стабільною ІХС їх визначення не рекомендоване.
Існують дані, що підвищений рівень С-реактивного протеїну (СРП, hs-CRP), виміряного високо чутливим методом, асоціюється зі зростанням ризику КВ ускладнень у хворих з ІХС. Проте останній аналіз 83 досліджень виявив відсутність чіткого взаємозв’язку між СРП і прогнозом пацієнтів зі стабільною ІХС, тому рутинне визначення цього параметру на теперішній час не рекомендоване.
Деякі інші біомаркери можуть мати додаткове прогностичне значення, але недостатність доказів не дозволяє рекомендувати визначення натрійуретичного пептиду, показників гемостазу, генетичне тестування у звичайній практиці ведення хворих зі стабільною ІХС.
Електрокардіограма у стані спокою (ЕКГ)
ЕКГ у стані спокою з використанням 12 стандартних відведень – обов’язкове дослідження для усіх пацієнтів з підозрою на ІХС. Нормальна ЕКГ у стані спокою – не рідкість навіть у хворих з тяжкою стенокардією, але вона не виключає діагнозу ішемії. Разом з тим, на ЕКГ можуть реєструватись ознаки ІХС – такі, як рубцеві зміни після інфаркту міокарда (ІМ) чи порушення реполяризації.
ЕКГ може допомогти в уточненні діагнозу. Наприклад, якщо під час болю, як прояв ішемії, реєструються динамічні зміни сегмента ST. ЕКГ під час або одразу після ангінозного нападу допомагає у діагностиці вазоспазму, оскільки повернення сегмента ST до ізолінії дещо запізнюється відносно зникнення болю. На ЕКГ можна виявити інші зміни, такі як гіпертрофія лівого шлуночка (ГЛШ), блокади лівої і правої ніжок пучка Гіса, синдром преекзитації, аритмії, порушення провідності. При виборі методів подальшого дослідження чи індивідуальному контролі терапії ця інформація може допомогти у визначенні механізмів, відповідальних за біль у грудях (наприклад, фібриляція передсердь може супроводжуватись дискомфортом у грудній клітці без ураження епікардіальних коронарних судин). ЕКГ спокою має значення для стратифікації ризику, як зазначено далі.
Ехокардіограма у стані спокою (ЕхоКГ) 2-вимірна, Doppler трансторакальна ЕхоКГ у стані спокою надає інформацію про структури і функцію серця. Хоча функція лівого шлуночка (ЛШ) у таких пацієнтів часто нормальна, можуть спостерігатись регіональні порушення скоротливості стінок, що підвищує вірогідність ІХС. За допомогою ЕхоКГ виявляється інша патологія така, як клапанні вади (аортальний стеноз) чи гіпертрофічна кардіоміопатія, що є альтернативною причиною клінічної симптоматики. Вимірюється глобальна функція ЛШ – важливий прогностичний чинник для пацієнтів зі стабільною ІХС. ЕхоКГ особливо корисна за наявності серцевих шумів, перенесеного ІМ та симптомів серцевої недостатності.
Після ЕхоКГ за відповідних технічних умов (датчик, кваліфікований спеціаліст) доцільно зробити ультразвукове дослідження сонних артерій. Виявлення потовщення комплексу інтима-медіа чи бляшок у відповідних судинах означає наявність системного атеросклерозу, що є показанням для подальшої превентивної терапії та підвищує імовірність ІХС.
Doppler ЕхоКГ та дослідження в режимі стрейн рейт (strain rate) допомагають виявити серцеву недостатність зі збереженою фракцією викиду, що пояснює симптоматику, викликану фізичною активністю. Порушення діастолічного наповнення є першою ознакою активної ішемії і може вказувати на мікроваскулярну дисфункцію у пацієнтів із скаргами на задишку, як можливий еквівалент стенокардії.
Хоча діагностична значимість ЕхоКГ у хворих зі стенокардією здебільшого стосується особливих підгруп, визначення функції ЛШ є важливим показником для стратифікації ризику у всіх пацієнтів. Тому ЕхоКГ (чи альтернативні методи оцінки функції ЛШ, якщо ЕхоКГ недостатньо якісна) рекомендовані для початкового обстеження усім хворим з симптомами стабільної ІХС.
Повторні/регулярні ЕхоКГ у таких хворих, за відсутності ускладнень ІХС чи зміни клінічного стану, не показані.
Метод магнітно-резонансної томографії у стані спокою (МРТ)
Метод використовується для виявлення структурних аномалій серця та оцінки функції ЛШ. Він рекомендований пацієнтам без протипоказань до МРТ, у яких, незважаючи на застосування контрасту, трансторакальна ЕхоКГ недостатньо інформативна (як правило, у зв’язку з параметрами акустичного «вікна»).
Амбулаторне (холтерівське) моніторування ЕКГ (АМЕКГ)
Амбулаторне моніторування ЕКГ може реєструвати епізоди ішемії міокарда під час звичайної денної активності хворих, проте метод значно поступається стрес-тестуванню щодо діагностичних можливостей. Також немає ніяких доказів щодо доцільності використання АМЕКГ з метою підвищення якості оцінки прогнозу у пацієнтів зі стабільною ІХС. Разом з тим, АМЕКГ є інформативним у хворих з аритміями та підозрою на вазоспастичну стенокардію.
Рентгенографія грудної клітини (РГК)
Метод часто застосовується у пацієнтів з болем у грудях, проте при стабільній ІХС він не дає специфічної інформації ні для діагностики, ні для стратифікації ризику. У деяких випадках РГК може бути корисною для оцінки стану хворих з підозрою на серцеву недостатність, а також при легеневій патології, яка часто супроводжує ІХС чи для виключення інших причин болю у грудній клітці атипового характеру.
7.3 Алгоритм ведення хворого з підозрою на ІХС (три «кроки»)
У настанові пропонується поетапний підхід щодо ведення хворого з підозрою на стабільну ІХС. Рекомендовано починати з визначення індивідуальної претестової імовірності захворювання (Крок 1) з наступним неінвазивним тестуванням для встановлення діагнозу ІХС чи атеросклерозу іншої локалізації (наприклад, за допомогою ультразвукового дослідження сонних артерій) у пацієнтів з середньою імовірністю захворювання (Крок 2). Одразу після підтвердження діагнозу стабільної ІХС необхідно призначати оптимальну медикаментозну терапію і проводити стратифікацію ризику можливих кардіоваскулярних подій (Крок 3). Оцінка КВ ризику, як правило, базується на результатах доступних неінвазивних тестів для того, щоб виявити хворих, які потребують інвазивних досліджень і реваскуляризації міокарда. За наявності тяжкої симптоматики проводиться інвазивна коронарографія (КГ) з відповідним підтвердженням гемодинамічної значущості стенозу (вимірювання фракційного резерву кровотоку – «fractional flow reserve» (ФРК) та подальшою реваскуляризацією без попереднього проведення неінвазивного тестування (Кроки 2 і 3).
Інтерпретація результатів неінвазивних кардіологічних досліджень щодо встановлення діагнозу потребує підходу за Bayes. Такий підхід включає поєднання даних щодо претестової імовірності захворювання з подальшим аналізом результатів діагностичних тестів (пост-тестову імовірність) для конкретного пацієнта. Претестова імовірність залежить від розповсюдженості захворювання у певній популяції, тоді як клінічні ознаки (включно з серцево-судинними ФР) носять індивідуальний характер. Визначальні фактори претестової імовірності – це вік, стать і характер клінічної симптоматики.
Чутливість і специфічність часто використовуються як характеристики точності діагностичного методу, проте вони не повністю узгоджуються з клінічним статусом пацієнтів. По-перше, деякі діагностичні методи можуть втрачати свою результативність в залежності від певних обставин, наприклад, якість зображень при КТ коронарографії залежить від ЧСС, маси тіла і наявної кальцифікації судин. По-друге, хоча чутливість та специфічність методу математично не залежать від показника претестової імовірності, у клінічній практиці багато тестів мають кращу якість при їх використанні у популяції низького ризику; наприклад, вже згадувана КТ коронарографія дає більш точні результати у пацієнтів з низькою вірогідністю захворювання – у більш молодих осіб з меншою кальцифікацією судин.
Оскільки існує взаємозалежність між претестовою імовірністю (клінічна вірогідність, що даний пацієнт має ІХС) і результатами доступних діагностичних методів (вірогідність, що пацієнт має захворювання, якщо тест позитивний, чи немає його, якщо тест негативний), при проведенні діагностичного тестування необхідно брати до уваги показник претестової імовірності. Тестування може зашкодити діагностиці, якщо кількість хибних результатів при його проведенні перевищує кількість правильних. Неінвазивні методи діагностики ІХС, що базуються на візуалізації міокарда, як правило, мають чутливість та специфічність близько 85% (таблиця 12). Отже, 15% результатів усіх діагностичних процедур можуть бути хибними, в той час, коли без усякого тестування, кількість неправильних діагнозів є мінімальною у пацієнтів з претестовою імовірністю < 15% (вірогідно здорові люди) чи >85% (передбачається, що цей показник стосується хворих з ІХС). У таких випадках додаткове тестування доцільно проводити тільки за наявності вагомих причин. Тобто автори Європейських рекомендацій вважають за доцільне не проводити додаткових досліджень у пацієнтів з низькою і високою претестовою імовірністю хвороби: < 15% і >85%, відповідно, оскільки у них з достатньою вірогідністю можна передбачити, що перші не мають, а другі мають ІХС.
/113/tab12.jpg)
ДФН – дозоване фізичне навантаження
ПЕТ-КТ – позитронно-емісійна комп’ютерна томографія
МРТ – магнітно-резонансна томографія
КТ – комп’ютерна томографія
Низька чутливість ЕКГ тестів з ДФН – тільки 50% (незважаючи на відмінну специфічність – до 90%, показники отримані за допомогою досліджень без достатньої верифікації) – є причиною переважання кількості хибних результатів над правильними у популяції з претестовою імовірністю захворювання > 65%. Відтак європейські експерти не рекомендують використовувати тести з навантаженням у зазначеній популяції з діагностичною метою. Проте, тести з ДФН у таких пацієнтів можуть бути корисними для об’єктивізації діагнозу, зважаючи на те, що показник претестової імовірності враховує тільки суб’єктивну симптоматику, а також для оцінки прогнозу.
За чинними міжнародними документами визначення показника претестової імовірності (таблиця 13) базується на останніх дослідженнях щодо поширеності ІХС. Цей же показник пропонується як стартовий «крок» у діагностичному алгоритмі захворювання.
Коментар робочої групи: в КН для визначення претестової імовірності захворювання використано данні європейських рекомендацій 2013 р.
• Білі клітинки у таблиці відповідають низькій претестовій імовірності ІХС < 15%, хворі з такими показниками не потребують подальшого тестування на ІХС
• Блакитні клітинки – відповідають середній низькій претестовій імовірності ІХС 15-65%, у таких випадках для первинної діагностики може бути використаний тест з ДФН. Проте більшу діагностичну інформативність для виявлення ішемії мають неінвазивні тести з візуалізацією міокарду. У молодих пацієнтів можуть розглядатись радіологічні методи діагностики.
• Рожеві клітинки – відповідають середній високій претестовій імовірності ІХС 66-85%, для підтвердження діагнозу ІХС рекомендовані неінвазивні функціональні тести з візуалізацією.
• Темно-червоні клітинки – висока претестова імовірність ІХС – > 85%, передбачається, що у таких пацієнтів наявна стабільна ІХС. Вони потребують виключно стратифікації ризику.
Якщо больовий синдром не носить характеру стенокардії, то рекомендовані відповідні дослідження для виявлення інших причин болю у грудях, наприклад, за рахунок патології шлунково-кишкового тракту, органів дихання чи кістково-м’язевої системи (рис. 1). Разом із тим, ці пацієнти повинні дотримуватись режиму щодо модифікації факторів КВ ризику, базуючись на результатах, визначених за шкалою SCORE. (додаток зі SCORE) Хворі з підозрою на стабільну ІХС, у яких супутня патологія перешкоджає проведенню реваскуляризації, повинні лікуватись медикаментозно, за необхідності для верифікації діагнозу їм показані фармакологічні тести з візуалізацією міокарда. Пацієнти зі зниженою ФВ ЛШ – < 45% – і типовими нападами стенокардії мають високий ризик КВ ускладнень, тому вони потребують проведення інвазивної КГ без попереднього тестування (рис. 1).
/113/r1.jpg)
У хворих з больовим синдромом, подібним до стенокардії, але низькою імовірністю ІХС – <15%, у першу чергу повинні бути виключені інші кардіологічні причини болю, при цьому пацієнти потребують обов’язкової модифікації факторів КВ ризику. Проте потреби у проведенні спеціальних неінвазивних тестів у таких випадках немає.
Пацієнти з повторними нападами болю у грудях, що виникають тільки у стані спокою, повинні бути обстежені щодо наявності вазоспастичної стенокардії з подальшим призначенням відповідного лікування. Хворі з середньою претестовою імовірністю захворювання – 15-85% – у подальшому потребують неінвазивного тестування. Якщо претестова імовірність >85%, діагноз ІХС ставиться на основі клінічних даних, і додаткове тестування не покращує точність діагностики. Проте, подальше обстеження може бути доцільним для стратифікації ризику, особливо, при недостатній ефективності медикаментозної терапії (рис. 1). Хворим з тяжкою стенокардією при низькій толерантності до фізичних навантажень та сукупністю клінічних ознак щодо високого ризику КВ ускладнень обстеження доцільно починати безпосередньо з інвазивної КГ. У таких випадках, показання до реваскуляризації можуть залежати від результату визначення фракційного резерву кровотоку – «fractional flow reserve» (ФРК).
Дуже висока негативна передбачувальна цінність КТ-ангіографії – якщо під час дослідження не виявляються стенози судин – дає підстави призначати таким пацієнтам медикаментозну терапію без подальшого додаткового обстеження. Це робить метод потенційно корисним, особливо за умови середньої низької претестової імовірності ІХС (15-65%) – рис. 2. Проте слід пам’ятати, що у випадках, коли індекс Agatston > 400, можлива гіпердіагностика стенотичних уражень судин. Крім того, доцільно вважати КТ-ангіографію неінформативною за наявності вираженої локальної чи дифузної кальцифікації, щоб уникнути помилкової оцінки просвіту артерії (рис. 2). Для досягнення оптимальних результатів необхідно ретельно дотримуватись існуючих професійних стандартів. З урахуванням вищесказаного, КТ-ангіографія може розглядатись, як альтернатива тестам щодо діагностики ішемії, особливо, у хворих з претестовою імовірністю ІХС < 50%.
7.4 Стрес-тести для діагностики ішемії міокарда
ЕКГ проби з дозованим фізичним навантаженням
Завдяки відносній простоті та широкій доступності, проби з ДФН на тредмілі чи велоергометрі з моніторуванням ЕКГ у 12 відведеннях залишаються в арсеналі діагностичних методів (таблиця 14) для пацієнтів з підозрою на ІХС та претестовою імовірністю 15-65%, за можливості їх адекватного проведення.
Мета проведення навантажувальних проб:
Навантажувальні проби – це добре регламентована методика, яка використовується для провокації та ідентифікації ішемії міокарда більше 60 років. За цей час сама методика тестування змінилась мало, але з'явилися нові технічні можливості (апаратура) та нові показання щодо її проведення.
Тести з ДФН зараз широко використовуються для наступних цілей: діагностика ішемічної хвороби серця (ІХС) у пацієнтів з підозрою на стенокардію, оцінка функціональної тяжкості ІХС; прогнозування серцево-судинних подій; оцінка фізичної працездатності і толерантності до фізичного навантаження; оцінка симптомів, пов'язаних з виконанням навантажень; оцінка хронотропної компетенції, аритмій і реакції на лікування імплантованими пристроями; оцінка ефективності медикаментозного лікування.
Розуміння мети індивідуального тестування з ДФН дозволяє лікарю вибрати відповідну методику, що відповідає максимальній безпечності тесту та дозволяє отримати оптимальну діагностичну і прогностичну інформацію.
Протягом останніх десятиліть навантажувальні проби застосовувались не тільки з діагностичною метою, але і для оцінки КВ ризику.
Абсолютні і відносні протипоказання щодо виконання проб з навантаженням необхідні для отримання балансу між ризиком і потенційною користю від проведення тесту.
Абсолютні протипоказання:
Гострий інфаркт міокарда (ІМ) протягом перших 2 днів
Нестабільна стенокардія
Гемодинамічно нестабільні аритмії
Гострий ендокардит
Симптоматичний тяжкий аортальний стеноз
Декомпенсована серцева недостатність
Гостра легенева емболія, інфаркт легені або тромбоз глибоких вен н/кінцівок
Гострий міокардит або перикардит
Гостра розшаровуюча аневризма аорти
Фізичні обмеження, при яких неможливе безпечне і адекватне тестування.
Відносні протипоказання:
Верифікована обструкція стовбура лівої коронарної артерії
Помірний та тяжкий аортальний стеноз з невизначеною симптоматикою
Тахіаритмії з неконтрольованою частотою серцевих скорочень
Атріовентрикулярна блокада високого ступеню
Обструктивна гіпертрофічна кардіоміопатія з вираженим градієнтом тиску у спокої
Нещодавно перенесений інсульт або транзиторна ішемічна атака (ТІА)
Психічний розлад з обмеженою здатністю до співпраці
Початковий систолічний/діастолічний артеріальний тиск > 200/110 мм рт.ст.
Клінічні стани, що порушують інтерпретацію проби, такі, як виражена анемія, електролітний дисбаланс, гіпертиреоз.
Прийом деяких медикаментів, які ускладнюють оцінку проби (препарати дигіталісу, тощо)
Підготовка до виконання тесту з навантаженням
Завчасне визначення мети дослідження забезпечує оптимальні діагностичні результати і безпечність тестування.
Протягом 3 годин перед проведенням навантаження пацієнт не повинен вживати їжу. Для створення комфортних умов щодо виконання тесту хворим доцільно одягати зручний одяг та взуття. Лікар повинен надати докладні відомості щодо процедури тестування, результатів, можливих симптомів та ускладнень.
Проведення рутинного діагностичного тесту з ДФН не потребує відміни медикаментозної терапії, але слід пам’ятати, що деякі препарати можуть впливати на результати дослідження. Наприклад, β-блокатори зменшують приріст ЧСС і артеріального тиску (АТ) у відповідь на навантаження. У таких випадках, відсутність ішемічних реакцій під час проби не виключає можливості хибнонегативного результату тестування. За рішенням лікаря цим хворим рекомендоване повторне дослідження після 24 годинної перерви у прийомі β–блокатора, проте необхідно враховувати можливий розвиток синдрому відміни для зазначеного класу препаратів.
Перед тестуванням необхідно записати стандартну ЕКГ у 12 відведеннях у горизонтальному і сидячому положеннях пацієнта для виявлення позиційних змін та порівняння з попередніми ЕКГ. Обов'язкове вимірювання АТ. Гіпервентиляція у стані спокою може призводити до неспецифічних змін сегмента ST у деяких хворих, ці зміни можуть з’являтися і під час фізичного навантаження, як хибнопозитивна відповідь щодо виявлення ішемії. Опис ЕКГ змін, які провокуються гіпервентиляцією, рекомендовано вносити в результати дослідження. Разом з тим, експерти зазначають, що використання проби з гіпервентиляцією знижує специфічність тестування з ДФН. Цей факт став передумовою для критичних зауважень щодо доцільності системного застосування проби з гіпервентиляцією у діагностичному алгоритмі ІХС.
Обладнання Бігова доріжка (тредміл) і велоергометр є динамічними пристроями, які зазвичай використовуються для проведення тестів з ДФН. Тредміл частіше застосовують у Сполучених Штатах Америки, де їзда на велосипеді менш поширена, ніж, наприклад, у Європі. Переваги велоергометру стосуються нижчої ціни апарату, його більшої компактності та нижчого рівня шуму під час роботи. Рухи верхньої половини тулуба при велоергометрії обмежені, що полегшує вимірювання АТ і запис ЕКГ.
Оскільки деякі люди відчувають певні труднощі на біговій доріжці, пов’язані з ортопедичними проблемами, в той час, як інші змушені припиняти пробу до досягнення діагностичних критеріїв через дискомфорт і втому сідничних м’язів та нижніх кінцівок при тестуванні на велоергометрі, вигідно мати обидва прилади.
Протоколи навантажувальних проб, як правило, включають 3 етапи: початковий період («розігріву») без навантаження, ступінчате збільшення навантаження і період відновлення (реституції). Протокол навантаження обирають в залежності від мети тестування. Одним з найбільш використовуваних для тредміл-тестування є стандартний протокол Bruce Цей протокол є добре вивченим, його застосовували при виконанні багатьох опублікованих клінічних досліджень. Проте деякі експерти вважають, що він передбачає задовгу тривалість кожної стадії навантаження – 3 хвилини. Тому певні категорії пацієнтів, особливо, літні люди, з патологією опорно-рухового апарату, з ожирінням, враховуючи часовий фактор, неспроможні виконати пробу до кінця, що ускладнює чи навіть робить неможливою її наступну оцінку. Використовують також і інші протоколи дослідження. У протоколі Cornell тривалість кожної стадії навантаження становить 2 хвилини. Протоколи Naughton і Balke забезпечують більш плавне зростання потужності навантаження, що має певні переваги для літніх і ослаблених хворих.
При проведенні велоергометрії, як правило, початкова потужність становить 25 Вт, з подальшим збільшенням на 25 Вт кожні 2 або 3 хвилин, поки не будуть досягнуті кінцеві точки. Двохвилинні стадії навантаження є найбільш популярними. Пацієнтам, які не можуть пройти стрес-тестування або фармакологічні тести з візуалізацією, рекомендовані тести з 6-ти хвилинною ходою. Ці тести часто застосовуються у пацієнтів з хронічною серцевою недостатністю, обструктивною хворобою легень, захворюванням периферичних артерій. Після 6-ти хвилинної ходи визначають загальну пройдену відстань, наявні симптоми, реєструють ЕКГ. Відсутність ЕКГ-моніторингу під час тесту з 6-ти хвилинною ходою дещо обмежує його діагностичні можливості для виявлення ішемії та порушень ритму.
Виконання проб з ДФН повинен контролювати кваліфікований лікар. Обов'язковим є розуміння пацієнтом суті дослідження. Хоча тести з ДФН вважаються достатньо безпечними, під час їх проведення можливий розвиток ускладнень, у тому числі, і серйозних, таких як ІМ та кардіальна смерть. Тому лікар і середній медичний персонал повинні мати відповідну підготовку для надання у таких випадках кваліфікованої невідкладної допомоги, включаючи проведення серцево-легеневої реанімації. Кабінети, відведені для проведення проб з ДФН, повинні бути оснащені дефібрилятором, медикаментами і приладдям, необхідним для надання невідкладної медичної допомоги. Статистичні дані свідчать, що під час проб з ДФН частота випадків смерті або зупинки серця становить від 0 до 6, а ІМ – від 2 до 10 на 10 000 досліджень, ці показники значною мірою залежать від основного захворювання серця. Під час тесту слід проводити ретельний моніторинг ЕКГ, ЧСС, АТ. Постійний контроль ЕКГ необхідний для своєчасного виявлення порушень ритму, відхилень сегмента ST та інших маркерів ішемії міокарда.
За відсутності показань до припинення тестування (див нижче), пробу, як правило, завершують після досягнення субмаксимальної ЧСС, яка становить ~ 85 % від максимальної, обумовленої віком. Враховуючи значні відмінності щодо індивідуальних можливостей виконання фізичного навантаження, слід ретельно оцінювати стан хворого для виявлення критеріїв припинення процедури.
Типова стенокардія, яка з’являється під час тесту з навантаженням, є прямим показанням для його припинення.
Абсолютні показання до припинення тесту з ДФН:
• елевація ST-сегмента ( > 1,0 мм) у відведеннях без зубця Q після попереднього ІМ (окрім AVR, AVL і V1 );
• падіння систолічного АТ > 10 мм рт.ст., незважаючи на збільшення навантаження, що супроводжуються будь-якими іншими ознаками ішемії;
• помірна або важка стенокардія;
• симптоми, пов’язані з ЦНС (наприклад, атаксія, запаморочення, пресинкопальний стан);
• ознаки недостатньої перфузії (ціаноз або блідість);
• стійка шлуночкова тахікардія (ШТ) або інші аритмії, включаючи атріо-вентрикулярну (АВ) блокаду другого або третього ступеня;
• технічні труднощі в моніторингу ЕКГ або систолічного АТ;
• бажання пацієнта зупинитися.
Відносні показання до припинення тесту з ДФН: депресія сегмента ST – горизонтальна або косонисхідна > 2 мм, протягом 60-80 мс після точки J (кінець комплексу QRS) – у пацієнтів з підозрою на ішемію; падіння систолічного АТ > 10 мм. рт. ст., незважаючи на збільшення навантаження, за відсутності інших доказів ішемії; збільшення болю в грудях; втома, задишка, свистяче дихання, судоми ніг або кульгавість; аритмії, крім ШТ, в тому числі мультифокальні ектопії, шлуночкові триплети, суправентрикулярні тахікардії, брадиаритмії, які потенційно можуть стати більш складним або заважають стабільності гемодинаміки; гіпертензивна відповідь (систолічний АТ > 250 мм. рт. ст. або діастолічний АТ > 115 мм. рт. ст.); розвиток блокад ніжок пучка Гіса, які складно диференціювати від ШТ.
Період відновлення (реституції). У деяких випадках аномальні реакції на ДФН розвиваються із запізненням, тобто, у період реституції, тому необхідно продовжувати моніторинг основних параметрів гемодинаміки та ЕКГ протягом не менше 6-8 хвилин після припинення навантаження, а також – до повного відновлення самопочуття, значень ЧСС і АТ, транзиторних змін на ЕКГ. Тобто тривалість періоду реституції визначається за повною нормалізацією показників ЧСС і АТ, і, відповідно, подовжується за умови збереження чи появи клінічної симптоматики та змін на ЕКГ. Слід наголосити, що патологічні/ішемічні зміни на ЕКГ, в тому числі і ті, які з’являються у період реституції, можуть бути безсимптомними. Це ж стосується порушень ритму. Механічна дисфункція і електрофізіологічні порушення в ішемізованому міокарді після навантаження можуть зберігатися від кількох хвилин до кількох годин.
Оцінка навантажувального тесту включає визначення клінічних симптомів, величину виконаного навантаження, гемодинамічних параметрів та змін на ЕКГ. Важливою ознакою ішемії міокарда є поява нападу стенокардії, особливо якщо його інтенсивність вимагає припинення тесту. До числа серйозних ознак відносяться порогова величина/потужність виконаної роботи та значення порогових ЧСС і систолічного АТ. Найбільш значущими ЕКГ симптомами ішемії є депресія та елевація сегмента ST. Відповідно до традиційного визначення, навантажувальний тест вважається позитивним при появі горизонтальної або косонисхідної депресії або елевації сегмента ST з амплітудою ≥ 1 мм, тривалістю ≥ 60-80 мсек від точки J (кінця комплексу QRS), під час проби або невдовзі після її припинення.
Патологічні зміни ЕКГ під час навантаження і в реституції, що свідчать про ішемію
Відхилення від ізолінії сегмента ST є загальновизнаним критерієм ішемії міокарда. Рівень ST вимірюють стосовно сегмента PR (PQ ), що пов’язане з високою ЧСС під час навантаження, яка обумовлює складності у визначенні ізолінії (положення сегменту Т-Р). Для оцінки тесту відхилення сегмента ST визначають у одному відведенні у 3 і більше послідовних комплексах QRS протягом 60-80 мс після точки J.
Депресія сегмента ST. Стандартним критерієм позитивного тесту є горизонтальна або косонисхідна депресія сегмента ST ≥ 1 мм ( 0,1 мВ) протягом 60-80 мс після точки J. За наявності незначної депресії сегмента ST у стані спокою оцінюють його додаткове відхилення під час навантаження. Виражена косовисхідна депресія сегмента ST (> 2 мм протягом 80 мс від точки J) вважається ознакою ішемії у хворих зі стенокардією.
Елевація сегмента ST у пацієнтів з перенесеним ІМ та зубцем Q. Виникнення елевації сегмента ST (>1 мм протягом 60 мс від точки J) у відведеннях із зубцем Q є патологічною реакцією, що може свідчити про розвиток ішемії в периінфарктних зонах. Ці зміни можуть також з'являтися як реципрокні при наявності ішемії у інших ділянках.
Елевація сегмента ST у пацієнтів без попереднього ІМ. У таких пацієнтів розвиток елевації сегмента ST свідчить про виражену транзиторну ендокардіальну/субепікардіальну ішемію, імовірно пов'язану з субтотальною оклюзією у проксимальному відділі відповідної коронарної артерії. Елевація ST-сегмента частіше асоційована з анатомічно вираженою проксимальною обструкцією, ніж з коронарним спазмом.
Аритмії та порушення провідності. Суправентрикулярні аритмії, індуковані фізичним навантаженням, як правило, не пов'язані з ІХС. Вони частіше з'являються у пацієнтів похилого віку, за наявності легеневої патології, після попереднього вживання алкоголю або кофеїну. Розвиток значних шлуночкових порушень ритму під час навантаження і, особливо, у період реституції має несприятливе прогностичне значення щодо смертності. Наявність блокади лівої ніжки пучка Гіса (ЛНПГ), як правило, унеможливлює визначення ішемії міокарда під час проб з ДФН. Поява блокади ЛНПГ під час навантаження може бути як пов’язаною, так і не пов’язаною з ІХС, проте є предиктором високого ризику смерті та серйозних КВ ускладнень.
Наявна блокада правої ніжки пучка Гіса (ПНПГ) не заважає інтерпретації результатів тесту з ДФН, за виключенням відведень V1,V2 і V3, у яких депресія сегмента ST часто реєструється у стані спокою і збільшується під час навантаження, навіть за відсутності коронарної обструкції. У популяції з високим ризиком кардіальної патології розвиток блокади ПНПГ під час фізичних навантажень спостерігається значно рідше, ніж ЛНПГ, але якщо блокада ЛНПГ часто з’являється у пацієнтів з неішемічними кардіопатіями, то поява блокади ПНПГ асоціюється з ІХС, зокрема, з ураженням передньої міжшлуночкової гілки лівої коронарної артерії (ПМШГ ЛКА). Виникнення АВ-блокади I ступеня може бути викликано прийомом препаратів, які уповільнюють АВ-провідність. Розвиток АВ- блокади II ступеня частіше обумовлений наявністю ІХС або стенозу аортального клапана. Ця блокада також може з'явитись внаслідок надмірно високої ЧСС. АВ-блокада III ступеня рідко з'являється під час навантаження, її виникнення також пов’язують з ішемією.
Коментар робочої групи: інформація щодо проведення діагностичних проб з ДФН наводиться за рекомендаціями «Exercise Standards for Testing and Training: A Scientific Statement From the American Heart Association» 2013 року (Circulation. 2013;128:873-934)
Отже, основним діагностичним ЕКГ-критерієм проби з ДФН вважають горизонтальну чи косо низхідну депресію сегмента ST >0,1 mV, тривалістю, як мінімум, 0,06-0,08 сек після точки J, в одному чи кількох ЕКГ-відведеннях. Слід зазначити, що приблизно у 15% хворих діагностичні зміни сегмента ST з’являються у період реституції. Проби з ДФН також надають додаткову інформацію щодо реакції ЧСС, АТ, появи інших клінічних симптомів та потужності виконаної роботи під час навантаження, що має як діагностичне, так і прогностичне значення.
Для одержання оптимальної діагностичної інформації, тести з ДФН доцільно проводити до появи клінічної симптоматики чи загальновизнаних критеріїв зупинки проби, а також – без попереднього прийому антиішемічних препаратів. Численні дослідження і їх мета-аналізи щодо використання проб з ДФН демонструють значну варіабельність їх діагностичної результативності при ІХС. Наприклад, депресія сегмента ST >0,1mV чи >1мм під час ДФН, визначена, як критерій позитивної проби, має чутливість і специфічність у межах 23-100% (в середньому, 68%) та 17-100% (в середньому, 77%), відповідно. Йдеться про діагностику ІХС з наявним стенозом хоча б однієї коронарної артерії >50%. Аналіз, обмежений названими дослідженнями, свідчить, що чутливість проб з ДФН складає 45-50%, а специфічність – 85-90% (таблиця 12). Важливо пам’ятати, що вказані показники дійсні для хворих з нормальною графікою ЕКГ у стані спокою. Проби з ДФН не мають діагностичної цінності за наявності блокади лівої ніжки пучка Гіса, штучного водія ритму, синдрому WPW. Хибно-позитивні результати частіше спостерігаються у хворих зі змінами на ЕКГ спокою за рахунок гіпертрофії ЛШ, електролітного дисбалансу, порушень інтравентрикулярної провідності, фібриляції передсердь і прийому препаратів дигіталісу.
Проби з ДФН мають нижчу чутливість і специфічність у жінок. Проте, одне з останніх, рандомізоване дослідження, в якому порівнювались діагностичні можливості МРТ з візуалізацією міокарда у поєднанні з навантажувальним тестом і стандартної проби з ДФН на тредмілі у жінок з підозрою на ІХС, не виявило суттєвих переваг більш дорогого і менш доступного методу МРТ щодо клінічних результатів.
У деяких пацієнтів проби з ДФН можуть бути неінформативними, наприклад, коли не вдається досягти 85% від максимальної ЧСС за відсутності симптомів і ознак ішемії, у випадках, коли можливість виконання навантаження лімітується ортопедичними чи іншими некардіальними проблемами, або коли зміни на ЕКГ носять сумнівний характер. Для таких хворих обирається альтернативний неінвазивний фармакологічний стрес-тест з візуалізацією міокарда (рис. 2). Для таких пацієнтів варіантом вибору може бути КТ-коронарографія. Крім того, «нормальна» проба з ДФН на фоні прийому антиішемічних препаратів не виключає ІХС.
Проби з ДФН можуть бути корисні для оцінки ефективності медикаментозної терапії чи реваскуляризації, а також для визначення режиму індивідуальної фізичної активності після усунення симптоматики. Для перерахованих показань проби з ДФН проводяться на фоні лікування, щоб оцінити контроль ішемії міокарда чи толерантність до фізичних навантажень. Вплив рутинних періодичних тестів з ДФН на клінічні параметри хворих офіційно не вивчався.
Стрес-тести з візуалізацією міокарда
Стрес-ехокардіографія проводиться у поєднанні з навантаженням на тредмілі або велоергометрі чи з фармакологічними агентами. Навантаження є більш фізіологічною процедурою, ніж фармакологічний тест, і забезпечує додаткову фізіологічну інформацію, таку, як тривалість і потужність навантаження, зміни ЧСС, АТ і ЕКГ. Отже, тест з навантаженням є методом вибору, якщо існує можливість його проведення (таблиця 15).
/113/tab15.jpg)
З іншого боку, фармакологічні тести мають переваги, коли є значні порушення скоротливості стінок ЛШ у стані спокою (добутамін – для визначення життєздатного міокарда), а також у пацієнтів, які не можуть адекватно виконувати фізичні навантаження. До недавнього часу індуковані аномалії скоротливості стінок ЛШ, виявлені під час стрес-ЕхоКГ, розцінювали як маркер ішемії (невідповідності між кровопостачанням і потребами міокарда). Основна інформація щодо результативності методу була отримана з використанням саме такого стандарту, проте відповідні показники чутливості і специфічності (таблиця 12) розраховувались на основі результатів старих досліджень, які проводились у той час, коли проби з контрастом не мали широкого застосування у клінічній практиці.
Засобом вибору для фармакологічних проб, які провокують дисбаланс між кровопостачанням і потребами міокарда, є добутамін. ЕхоКГ з контрастуванням міокарда (мікровезикули) дозволяє оцінити міокардіальну перфузію, поза визначенням скоротливості стінок ЛШ. Можливе використання обох варіантів фармакологічного впливу добутаміну як вазодилататора, так і інотропного агента. Зазначений метод не дуже широко застосовується в клініці.
Застосування контрасту можливе у всіх пацієнтів (без протипоказань) при усіх методиках стрес-ЕхоКГ у випадках, коли 2 або більше послідовних сегменти (17-сегментна модель ЛШ) погано візуалізуються у стані спокою. Використання контрасту покращує не тільки якість зображення, але і точність виявлення ІХС. Тканинний Doppler та дослідження в режимі стрейн рейт також підвищують діагностичну результативність стрес-ЕхоКГ за рахунок більших можливостей щодо виявлення ішемії.
Сцинтіграфія міокарда (однофотонна емісійна комп’ютерна томографія (ОФЕКТ) і позитрон-емісійна томографія (ПЕТ)). Для проведення ОФЕКТ у якості радіонуклідного маркеру найчастіше використовується технецій-99m. Дослідження може проводитись у поєднанні з навантажувальним тестом на велоергометрі чи тредмілі (таблиця 15). Талій-201 асоціюється з більш високою радіоактивністю і на теперішній час використовується рідше. Нові апарати для ОФЕКТ дають значно менше радіаційне навантаження.
Незалежно від використаних радіофармацевтичного засобу і типу апаратури, метод ОФЕКТ визначає перфузію міокарда – зображення отримують в результаті регіонального поглинання радіонуклідного маркера, інтенсивність якого відображає регіональну перфузію міокарда. При цьому, міокардіальна гіпоперфузія характеризується зменшенням поглинання маркера під час навантаження у порівнянням зі станом спокою. Підвищене поглинання радіонуклідного агента легеневою тканиною свідчить про стрес-індуковану дисфункцію ЛШ у пацієнтів з тяжкою ІХС. Як і всі стрес-тести з візуалізацією міокарда, ОФЕКТ має вищу чутливість щодо виявлення ІХС у порівнянні зі звичайними пробами з ДФН (таблиця 12). Транзиторна ішемічна дилатація і зниження після стрес-тесту ФВ ЛШ не стосуються параметрів міокардіальної перфузії, проте вони є важливими предикторами тяжкого ураження коронарних артерій. Проведення фармакологічних стрес-тестів із сцинтіграфією перфузії міокарда показано пацієнтам, які не спроможні адекватно виконати пробу з ДФН. Аденозин може викликати бронхоспазм у хворих з бронхіальною астмою за рахунок активації А1, А2В або А3 рецепторів, на додаток до А2А аденозинових рецепторів, які активуються гіперемією. Ці обмеження не залежать від методу візуалізації, для таких випадків у якості фармакологічних стресових агентів використовуються добутамін чи регаденосон (regadenoson), селективний агоніст А2А рецепторів.
Сцинтіграфія перфузії міокарда з використанням позитронно-емісійної томографії (ПЕТ) має переваги перед ОФЕКТ у виявленні стабільної ІХС за рахунок якості зображення, чітких критеріїв інтерпретації результатів, діагностичної цінності. Проте ОФЕКТ-сканери і відповідні радіоактивні маркери більш доступні та дешеві, ніж апаратура і радіомаркери (82Rb, 13N-аміак), які використовуються для ПЕТ. Тому метод рідше, ніж інші візуалізаційні стрес-тести використовується для діагностики стабільної ІХС. ПЕТ має унікальну можливість вимірювати регіональний міокардіальний кровотік у мл/хв/г, що дозволяє виявляти мікроваскулярну ІХС.
Магнітно-резонансна комп’ютерна томографія (МРТ). МРТ стрес-тести у поєднанні з добутаміном допомагають виявити реґіонарні порушення скоротливості стінок ЛШ, індуковані ішемією. За профілем безпеки методика аналогічна стрес-ЕхоКГ з добутаміном. Вона може бути корисною для хворих з субоптимальним акустичним «вікном», особливо, за наявності протипоказань щодо проведення фармакологічної проби з аденозином.
Визначення перфузії за допомогою МРТ використовується частіше, ніж стрес-МРТ з добутаміном. Дослідження останніх років підтвердили достатню діагностичну цінність методу МРТ (1,5 Tesla (T)), яка цілком відповідає результатам вищенаведених радіонуклідних методів.
Нещодавно були переглянуті протоколи стрес-тестів з візуалізацією. Аналізували можливості як візуальної ідентифікації низького сигналу на ділянках зі зниженою перфузією, так і комп’ютерного визначення відхилення міокардіального сигналу, який посилюється після першого пасажу відповідного фармакологічного агента. Кількісна оцінка перфузії міокарда за допомогою МРТ добре корелює з показниками фракційного резерву кровотоку (ФРК). Хоча використання апаратів МРТ високої потужності (3,0 Т) не дуже розповсюджене, вони мають кращі діагностичні характеристики, ніж прилади на 1,5 Т.
Гібридні методики дослідження з поєднанням візуалізаційних методів ОФЕКТ/КТ, ПЕТ/КТ, ПЕТ/МРТ на теперішній час виконуються тільки у кількох центрах. Гібридні методики візуалізації – це новаційні технології, які об’єднують функціональні і анатомічні показники, що виглядає дуже перспективним для майбутнього клінічного впровадження. Хоча досвід застосування гібридних методів сьогодні обмежений, вони демонструють більш високу діагностичну результативність. Існують окремі повідомлення, які вказують на можливості гібридних методик щодо визначення прогностичних показників.
7.5 Неінвазивні методи для оцінки коронарної анатомії
Комп’ютерна томографія (КТ). Технічні характеристики сучасних мультидетекторних КТ-систем цілком достатні для отримання якісних зображень КА у більшості пацієнтів. Метод дослідження пов’язаний з певним радіаційним навантаженням на організм хворого, тому рекомендовані спеціальні вимірювання, щоб виключити зайве/високе опромінення при його використанні для візуалізації КА. КТ-візуалізація КА може виконуватись без введення контрасту (визначення індексу кальцифікації) чи після внутрішньовенного введення йодоконтрастного препарату (КТ-коронарографія).
Індекс кальцифікації (Calcium scoring). Мультидетекторна КТ дозволяє виявити коронарну кальцифікацію у зонах підвищеного відкладення кальцію без введення контрасту, враховуючи коефіцієнт рентгенівського поглинання і площу кальцинатів. Узгоджена позиція експертів передбачає, що ділянка зі щільністю більше 130 одиниць Нounsfield (Нu) визначається як кальциноз КА. Зони кальцифікації, як правило, оцінюються за індексом Agatston (визначається як добуток площі кальцинованого ураження на фактор щільності).
За виключенням пацієнтів з нирковою недостатністю, у яких часто знаходять кальцифікацію серединного шару (медії) судин, коронарний кальцій співвідноситься виключно з коронарним атеросклерозом. Кількісні показники кальцинозу приблизно відповідають кількісним параметрам атеросклеротичного ураження КА, проте кореляція з величиною звуження просвіту судини (стенозом) недостатня. Навіть у випадку вираженої кальцифікації звуження просвіту артерії може не бути, а нульовий кальцієвий індекс не виключає наявності стенозу КА у пацієнтів з симптомами (таблиця 16), особливо, у осіб молодого віку і за наявності ГКС.
КТ-коронарографія. Після внутрішньовенного введення контрастного препарату, за допомогою КТ можливо візуалізувати просвіт КА. Для отримання коректних результатів необхідно використовувати адекватну технологію дослідження (як мінімум, КТ 64-зрізи) і ретельно добирати та готувати пацієнтів. Відповідно до експертного консенсусу, КТ-коронарографія може проводитись тільки у хворих зі збереженою дихальною функцією, без вираженого ожиріння, з відповідними показниками розподілу кальцифікації та індексом Agatston < 400, з синусовим ритмом і ЧСС – оптимально – 60 і менше ударів за хвилину. За необхідності для корекції ЧСС можливе застосування короткодіючих β-блокаторів чи інших препаратів, які зменшують ЧСС. Оскільки специфічність КТ-коронарографії зменшується при зростанні кальцифікації КА, видається доцільним не проводити дослідження, якщо індекс Agatston перевищує 400. На індивідуальному рівні визначення кальцифікації окремих сегментів КА має більше значення для діагностики, ніж звичайний підрахунок коронарного кальцію (Calcium scoring). Результативність КТ-коронарографії дещо покращується при виконанні дослідження на низькій ЧСС і при використанні сучасних КТ-систем. У випадках, коли кальцієвий індекс не підлягає підрахунку, а кальцифікація тільки ускладнює КТ-сканування, доцільно утриматись від кількісної оцінки стенозів на ділянках значної кальцифікації. Результати таких тестів вважають недіагностичними (рис. 2).
/113/tab16.jpg)
У пацієнтів з підозрою на ІХС мультицентрові дослідження з використанням КТ – 64-зрізи демонстрували високу чутливість – до 95-99% – і специфічність – 64-83% (таблиця 12), а також негативну передбачувальну цінність – 97-99% – щодо ідентифікації хворих з наявністю хоча б однієї стенозованої артерії за даними інвазивної КГ. Мета-аналізи менших досліджень підтверджують високу чутливість (98-99%) і негативну передбачувальну цінність (99-100%) КТ у поєднанні з дещо нижчою специфічністю (82-89%) і позитивною передбачувальною цінністю (91-93%). Результати мультицентрового дослідження, в якому брали участь пацієнти з підтвердженим діагнозом ІХС після перенесеного ІМ та черезшкірного коронарного втручання (ЧКВ), засвідчили дещо нижчі показники чутливості (85%) і специфічності (90%). Виражена кальцифікація КА має суттєвий негативний вплив на точність методу обстеження. КТ-коронарографія має обмеження у хворих зі стентами, оскільки їх металева основа провокує появу артефактів, які погіршують візуалізацію. Оцінка результатів КТ після аорто-коронарного шунтування (АКШ) також вимагає певної обережності, бо після шунтування значно ускладнюється візуалізація нативних артерій, що часто призводить до хибно-позитивних результатів.
Хоча на теперішній час проспективні рандомізовані дослідження щодо КТ- коронарографії у стабільних пацієнтів з болями у грудях не проводились, дані відповідних реєстрів підтверджують сприятливий прогноз у випадках, коли дослідження демонстрували відсутність обструктивних уражень КА. Показання для КТ- коронарографії представлені на рис. 2.
Діагностична цінність КТ-коронарографії вища у осіб з середнім-низьким рівнем претестової імовірності захворювання. Метод може бути корисним для виключення стенозів КА у таких хворих за умови якісної візуалізації і можливості забезпечення низької дози радіаційного опромінення (відповідні технічні характеристики апаратури і професійні навички персоналу). За таких передумов, КТ-коронарографія доцільна у пацієнтів, у яких результати стрес-тестів не відповідають клінічним проявам захворювання (особливо, коли позитивний стрес-тест спостерігається при відсутності клініки обструктивного ураження КА) – таблиця 16.
Враховуючи частоту хибно-позитивних стрес-тестів у деяких популяціях хворих, наприклад, з гіпертрофією ЛШ, КТ-коронарографія у них може розглядатись у якості методу діагностики першої лінії. Проте метод не виключає можливості функціональних причин ІХС (вазоспазм) у таких пацієнтів. КТ-коронарографія не вивчалась як скринінговий метод і тому не рекомендується її застосування з цією метою у асимптомних хворих. Удосконалення методу КТ-коронарогорафії за допомогою КТ-ФРК потребує подальшого вивчення.
Магнітно-резонансна коронарна ангіографія. Метод дозволяє неінвазивним шляхом візуалізувати КА без радіаційного опромінення хворих. Результати невеликого багатоцентрового дослідження показали, що чутливість, специфічність, позитивна та негативна передбачувальна цінність МРТ-коронарографії складають 88, 72, 71, 88% відповідно. Тривалий час, необхідний для отримання зображення, невисока просторова резолюція та залежність від професіоналізму дослідника залишаються серед основних обмежень щодо використання методу. До його переваг відносять можливості оцінки як анатомії, так і функції серця. Проте, на теперішній час МРТ-коронарографію здебільшого, розцінюють як метод для наукових досліджень і не рекомендують для використання у рутинній діагностичній практиці.
Коментар робочої групи: використання сучасних неінвазивних методик з візуалізацією міокарда в Україні доступне на етапі високоспеціалізованої допомоги, що обмежує їх широке застосування для діагностики ІХС і оцінки прогнозу.
7.6 Інвазивна коронарографія (ІКГ)
Неінвазивні методи на прийнятному рівні визначають вірогідність обструктивної коронарної хвороби. Тому потреба у проведенні ІКГ виключно з діагностичною метою у пацієнтів з підозрою на ІХС виникає рідко. Подібна ситуація стосується хворих, які не можуть пройти стрес-тестування з використанням візуалізаційних методів або за наявності типової стенокардії і зниженої ФВ ЛШ < 45% (рис. 1), а також – у осіб особливих професій, наприклад, авіаційних пілотів, що регулюється відповідним законодавством. ІКГ показана після проведення неінвазивної стратифікації ризику для вибору методу реваскуляризації. У пацієнтів з високою претестовою імовірністю і тяжкими симптомами захворювання чи у разі сукупності клінічних показників, які свідчать про високий ризик ускладнень, раннє проведення ІКГ без попередніх неінвазивних тестів є хорошою стратегією для визначення уражень КА, що потребують реваскуляризації (рис. 1). По можливості, рекомендується визначення ФРК. Методики виконання ІКГ постійно удосконалюються заради зменшення ускладнень і швидкого відновлення фізичної активності хворих. Це стосується ІКГ з доступом через а.radialis. Сумарна частота основних ускладнень при феморальному доступі (найчастіше – кровотечі, що вимагають гемотрансфузій) складає 0,5-2%. Сумарний показник КВ ускладнень (смертність, ІМ чи інсульт) – 0,1-0,2%.
ІКГ не показана пацієнтам зі стенокардією, які не потребують або відмовляються від інвазивних процедур і реваскуляризації, а також у випадках, коли не очікується, що реваскуляризація покращить функціональний статус чи якість життя.
8. СТРАТИФІКАЦІЯ РИЗИКУ КАРДІОВАСКУЛЯРНИХ ПОДІЙ
Довготривалий прогноз стабільної ІХС залежить від цілого ряду факторів, таких, як клінічні і демографічні параметри, функція ЛШ, результати стрес-тестування і коронарної ангіографії. Ризик КВ подій у пацієнтів зі стабільною ІХС визначається, як ризик кардіоваскулярної смерті та інфаркту міокарда, хоча в деяких дослідженнях у визначенні кінцевих точок враховували інші, додаткові показники. Найбільш точним прогностичним показником вважається показник загальної смертності (від усіх причин), і дані рекомендації визначають ризик у відповідності до цієї твердої кінцевої точки. Процес стратифікації дозволяє ідентифікувати пацієнтів високого ризику, які матимуть користь від реваскуляризації, незалежно від зменшення симптоматики.
Визначення групи пацієнтів високого ризику, які матимуть користь від реваскуляризації, має відмінності від попередніх рекомендацій. Останні ідентифікували ризик, як високий, за єдиним показником – тредміл-індексом Duke, якщо він відповідав щорічному показнику кардіальної смертності >2%. Незалежно від результатів коронарної ангіографії таким пацієнтам рекомендували розглянути питання щодо проведення реваскуляризації. Ці данні базувались на показниках КВ смертності у пацієнтів з плацебо-груп у дослідженнях з популяціями високого ризику, такими, як діабетична мікроальбумінурія, у КВ і «нирковому» суб-дослідженнях у Heart Outcomes Prevention Evaluation study (MICRO-HOPE) та Impact Of Nicorandil in Angina (IONA).
Європейські рекомендації 2013 р визначають пацієнтів високого ризику, якщо показник щорічної смертності >3%. Інформація, отримана за результатами досліджень, які виявляють ішемію чи анатомічні зміни, дають аналогічні результати щодо визначення пацієнтів високого ризику. Низьким вважається ризик, якщо показник щорічної смертності < 1%. Середнім – від 1 до 3% (таблиця 17).
Рекомендована наступна послідовність визначення ризику :
1) Стратифікація ризику за результатами клінічного обстеження
2) Стратифікація ризику на основі визначення функції ЛШ
3) Стратифікація ризику за результатами стрес-тестів
4) Стратифікація ризику на основі інформації щодо коронарної анатомії.
Стратифікація ризику за результатами клінічного обстеження
Анамнез, клінічне обстеження, результати ЕКГ та лабораторних аналізів мають важливе значення для визначення прогнозу. ЦД, АГ, тютюнопаління і підвищений рівень ЗХС (без терапії чи незважаючи на неї) передбачають несприятливі події у пацієнтів зі стабільною стенокардією чи іншими формами ІХС. Важливим прогностичним фактором, який необхідно брати до уваги, є вік пацієнта, а також наявність хронічних захворювань нирок або периферичних артерій, перенесеного ІМ, ознак серцевої недостатності. Мають значення характерні особливості стенокардії, наприклад, напади з’явились нещодавно чи носять прогресуючий характер, тяжкість больового синдрому, особливо при неефективності лікування. Проте ця інформація є занадто складною, щоб на її основі можна було створити шкалу для обчислення ризику ускладнень у пацієнтів зі стабільною ІХС, тому клінічні симптоми, особливо, за наявності тяжкої стенокардії, рекомендовано використовувати для оцінки прогнозу на додаток до показника претестової імовірності захворювання і результатів неінвазивних діагностичних тестів (рис. 3).
Стратифікація ризику на основі визначення функції ЛШ
Найважливішим предиктором довготривалого прогнозу є функція ЛШ. У пацієнтів зі стабільною ІХС зниження ФВ ЛШ супроводжується зростанням показника смертності. Наприклад, за даними реєстру Coronary Artery Surgery Study (CASS) 12-річна виживаємість хворих з ФВ >50%, 35-49% та < 35% була відповідно 73, 54 та 21% (р<0,0001). Високий ризик кардіальної смерті (щорічний показник >3%) спостерігається уже у пацієнтів з ФВ ЛШ <50%, незалежно від інших факторів ризику, включаючи значну вираженість ішемії міокарда.
Знижена ФВ <50% визначає зростання ризику КВ ускладнень, проте у таких хворих важливо врахувати характер обструктивного ураження коронарних судин, яке призводить до розвитку ішемії, тому з діагностичною метою доцільно використовувати стес-тести з візуалазіцією міокарда замість проб з ДФН (рис. 2).
Хоча у пацієнтів без перенесеного ІМ, з нормальними показниками ЕКГ та рентгенографії грудної клітини вірогідність збереженої систолічної функції ЛШ висока, безсимптомна вентрикулярна дисфункція також не рідкість. Тому усім хворим з підозрою на ІХС рекомендована ЕхоКГ у стані спокою (таблиця 18).
Стратифікація ризику за результатами стрес- тестів
Пацієнтам з клінічними симптомами, з підозрою на ІХС чи підтвердженим діагнозом захворювання рекомендовано проведення стрес-тестів для стратифікації КВ ризику з метою вибору терапевтичної тактики, якщо вони є кандидатами для проведення коронарної реваскуляризації (таблиця 19). Слід зазначити, що відповідна доказова база, стосовно покращення результатів лікування при використанні оцінки ризиків на основі стрес-тестів, включає тільки обсерваційні, а не рандомізовані дослідження. Проте, більшість хворих повинні пройти певне діагностичне обстеження у будь-якому разі, і ці результати можуть бути використані для стратифікації ризику КВ ускладнень. Пацієнтам з високою претестовою імовірністю захворювання (>85%), які не потребують діагностичних досліджень, показані стрес-тести з візуалізацією міокарда для оцінки ризику з метою подальшого визначення потреби у реваскуляризації (рис. 3). Якщо з огляду на клінічну симптоматику хворим з претестовою імовірністю >85% проведена ІКГ, можлива потреба у додатковому визначенні ФРК для належної стратифікації ризику КВ подій (рис. 3). Показання щодо використання стрес-тестів з візуалізацією для ідентифікації життєздатного міокарда включені до Европейських рекомендацій по серцевій недостатності.
/113/tab19.jpg)
ЕКГ-проби з дозованим фізичним навантаженням Пацієнти з нормальними ЕКГ показниками проб з ДФН і низьким, за клінічними параметрами, ризиком ускладнень ІХС мають в цілому сприятливий прогноз. Проте у дослідженні Pryor D і співавторів (1993 р), 37% амбулаторних пацієнтів, які були віднесені до категорії низького ризику зі щорічною частотою ускладнень < 1%, мали ураження стовбуру лівої КА чи померли протягом 3-х наступних років. Враховуючи фізіологічність, доступність та низьку вартість проб з ДФН (тредміл-тест), їх використання можливе для стартової оцінки КВ ризику, якщо йдеться про високий ризик ускладнень показана коронарна ангіографія.
До прогностичних маркерів проб з ДФН відносять толерантність до фізичного навантаження (ТФН), реакцію АТ, появу тест-індукованої ішемії (клініка, ЕКГ). Максимальна ТФН – один з основних прогностичних маркерів. На цей показник частково впливає вираженість вентрикулярної дисфункції як у стані спокою, так індукованої фізичним навантаженням. ТФН також залежить від віку, загального фізичного і психологічного стану пацієнта, супутньої патології. Показник оцінюється за максимальною тривалістю навантаження, максимальним досягнутим рівнем МЕТ (метаболічний еквівалент) чи максимальною досягнутою потужністю у ватах, максимальною ЧСС та значенням подвійного добутку (ЧСС Х систолічний АТ).
Загальновизнаний індекс Duke дозволяє визначити прогностичні показники (щорічної смертності, 5- річної виживаємості та ризику щодо обструктивного ураження КА) за результатами проби з ДФН на тредмілі. Для його розрахунку необхідні наступні параметри тредміл-тесту: амплітуда максимальної депресії сегмента ST під час навантаження, значення порогового показника МЕТ та інформація про наявність чи відсутність стрес-індукованої стенокардії.
Коментар робочої групи: Обчислити індекс Duke можна, скориставшись відповідним калькулятором за електронною адресою: http://www.cardiology.org/tools/medcalc/duke/.
Коментар робочої групи: в американських рекомендаціях з діагностики та лікування пацієнтів зі стабільною ІХС 2012 р (2012 CCF/AHA/ACP/AATS/PCNA/SCAI/STS Guideline for the Diagnosis and Management of Patients With Stable Ischemic Heart Disease) одним з варіантів розрахунку КВ ризику є номограма, представлена на рисунку 4. Ця номограма, на відміну від індексу Duke, включає не тільки результати тредміл-тесту, але і деякі інші клінічні та демографічні показники. На думку розробників, Lauer M і співавторів, запропонована ними номограма дозволяє більш точно оцінити ризик смерті у певної частини хворих, дещо нижчий, ніж при використанні індексу Duke. Зокрема, відмінності стосувались 21% з 33 268 пацієнтів-учасників проспективного когортного дослідження з середнім та високим КВ ризиком, які знаходились під медичним наглядом протягом ~ 14 років, з 1990 по 2004 рр. Слід зазначити, що в дослідження були включені хворі з підозрою на ІХС, а не підтвердженим діагнозом захворювання. Разом з тим, робоча група вважає за доцільне включити зазначену номограму у вітчизняну настанову у зв’язку з відсутністю загальновизнаної методики розрахунку КВ ризику для пацієнтів зі стабільною ІХС з урахуванням клінічних та демографічних даних, а також зважаючи на простоту розрахунку КВ прогнозу з її використанням, зокрема, у тих випадках, коли відсутній вільний доступ до Інтернету, необхідний для визначення індексу Duke за допомогою електронного калькулятора.
Номограма мультиваріабельної моделі пропорційних ризиків для прогнозування смертності від усіх причин
Рисунок 4. Щоб визначити ризик, проведіть вертикальну лінію від кожного маркера ризику у верхньому рядку з міткою "БАЛИ", для розрахунку балів для кожного маркера ризику. Сумма всіх цих точок позначаються на лінії з написом «ВСЬОГО БАЛІВ». Опустіть вертикальну лінію звідти для отримання ймовірності 3- і 5-річного виживання. Для бінарних змінних, 1 – означає «так», 0 – означає «немає». MET = Метаболічний еквівалент
Стрес-ехокардіографія Стрес-ЕхоКГ є ефективним методом стратифікації ризику КВ ускладнень, а також має високу негативну передбачувальну цінність у пацієнтів з негативними результатами тесту, а саме, з відсутністю індукованих порушень скоротливості стінок ЛШ. За таких умов щорічний ризик КВ ускладнень (смерть та ІМ) не перевищує 0,5%. У пацієнтів з нормальною функцією ЛШ у стані спокою ризик подальших КВ подій зростає в залежності від площі та тяжкості індукованих аномалій скоротливості стінок ЛШ. Якщо порушення скоротливості стінок ЛШ займають площу > 3 з 17 сегментів стандартної моделі ЛШ, це розглядається як показник високого ризику, що відповідає щорічній смертності > 3%.
Стрес-сцинтіграфія міокарда (однофотонна емісійна комп’ютерна томографія (ОФЕКТ) і позитрон емісійна томографія (ПЕТ)). Візуалізація міокарда за допомогою ОФЕКТ – корисний неінвазивний метод для визначення КВ ризику, що дозволяє ідентифікувати пацієнтів з найвищим ризиком наступної смерті та ІМ. Великі дослідження продемонстрували, що нормальні показники перфузії міокарда під час стрес-тестів відповідають низькому ризику КВ ускладнень (кардіальна смерть і ІМ) < 1% за рік, що приблизно дорівнює загальнопопуляційним показникам. На противагу, великі стрес-індуковані дефекти перфузії міокарда, порушення перфузії, що відповідають басейнам різних КА, транзиторна ішемічна дилатація ЛШ та підвищене поглинання 201Tl легеневою тканиною на післястресових знімках є індикаторами несприятливого прогнозу. Пацієнти з транзиторними дефектами перфузії, які займають >10% площі ЛШ (> 2 з 17 сегментів) відносяться до категорії високого ризику. Їм показана рання ІКГ.
Визначення поширеності/тяжкості ішемії міокарда чи наявності рубців за допомогою ПЕТ у пацієнтів з підозрою на ІХС чи підтвердженим діагнозом захворювання надає додаткову інформацію для стратифікації ризику КВ ускладнень. Крім того, ПЕТ дозволяє провести кількісну оцінку вазодилататорної дисфункції КА, яка незалежно корелює з кардіальною смертністю, включаючи пацієнтів з ЦД.
Стрес-тести з магнітно-резонансною томографією (МРТ). Існує незалежний зв’язок між несприятливим прогнозом та аномальними результатами стрес-тесту з добутаміном у поєднанні з МРТ і, навпаки, показник виживаємості становить >99% у пацієнтів без ішемії під час зазначеного тесту протягом 36 місяців спостереження. Аналогічні результати були отримані при проведенні стрес-тесту з аденозином у поєднанні з МРТ. Враховуючи спільні біологічні принципи, на яких базуються стрес-тести з ЕхоКГ, ОФЕКТ і МРТ, поява стрес-індукованих порушень скоротливості стінок (> 3 сегментів 17-сегментної моделі ЛШ) чи транзиторних дефектів перфузії, що займають > 10% площі міокарда ЛШ вказує на високий ризик КВ ускладнень. Проте обчислення КВ ризику з урахуванням результатів МРТ має певні обмеження, оскільки в сучасних стандартних методиках доступні тільки три зрізи ЛШ.
Стратифікація ризику на основі даних коронарної анатомії
КТ-коронарографія. Існує дослідження, в якому за допомогою КТ-коронарографії було показано, що пацієнти з суттєво ремодельованими сегментами КА мають вищий ризик розвитку гострих коронарних подій, ніж за умови наявності звичайних бляшок. Кількість уражених КА також має прогностичне значення, і наявність бляшок у трьох основних судинах при візуалізації за допомогою КТ-коронарографії, асоціюється зі зростанням показника смертності (відносний ризик 1,77 у порівнянні з особами, у яких бляшки не були виявлені). Проте фактична клінічна користь методу КТ-коронарографії щодо візуалізації стінки для стратифікації ризику, за виключенням виявлення значних стенозів КА, залишається невизначеною.
Великі проспективні дослідження продемонстрували прогностичну цінність КТ-коронарографії як у випадках значного звуження просвіту судин, так і за наявності не-обструктивного атеросклеротичного ураження КА. Метод характеризується високою передбачувальною цінністю стосовно показників смертності і серйозних ускладнень, незалежно від інших традиційних ФР. Так, частота КВ подій за відсутності бляшок у КА є дуже низькою (показник щорічної смертності – 0,22-0,28%). У пацієнтів з нестенозуючими бляшками смертність дещо більша, проте не перевищує 0,5%. Разом з тим, хворі із стенозом стовбуру лівої КА чи проксимальними 3-х судинними ураженнями КА мають у ~ у 10 разів вищий ризик смерті від усіх причин, при цьому прогностичні показники, отримані у клінічних дослідженнях за допомогою КТ-коронарографії, не відрізнялись від результатів ІКГ. Результати КТ у пацієнтів з одно і 2-судинними ураженнями також відповідають результатам клінічних досліджень з ІКГ.
При використанні КТ-коронарографії існує можливість завищеної оцінки коронарної обструкції, тому малосимптомним пацієнтам високого ризику доцільно проводити ІКГ після додаткових тестів щодо виявлення ішемії міокарда (таблиця 20).
Інвазивна коронарна ангіографія вважається стандартним методом визначення і оцінки ступеня тяжкості ІХС, але, це інвазивний метод, її проведення пов’язане з можливими небажаними явищами. Навіть досвідчений інтервенційний кардіолог не може без наявності функціональної інформації точно спрогнозувати значимість множинних проміжних стенозів, спираючись на візуальне оцінювання або кількісну візуальну ангіографію. Коли візуалізація при навантаженні протипоказана, є неінформативною або недоступна під час діагностичної коронарної ангіографії допомагають вимір фракційного резерву кровотоку (ФРК) або резервного коронарного кровообігу. Так, пацієнти з ФРК > 0,80 мають достатньо сприятливий прогноз.
Визначення показника ФРК показане для оцінки функціонального значення помірних коронарних стенозыв.
a Сканування у випадку безсимптомної ішемії міокарда можна розглядати в вибіркових групах пацієнтів з високим ризиком, таких як пацієнти з цукровим діабетом.
b Ймовірність ІХС перед дослідженням. Низька – 0–15%, середня – 15–85%, висока > 85%, по критерію з Рекомендацій ESC по стабільній ішемічні хворобі серця.
c Клас рекомендацій
d Рівень доказовості
e Посилання
f Відноситься до КТ ангіографії, не у випадку з радіоізотопами кальцію.
g Вважається, що КТ краще проводити при більш низькому рівні ризику розвитку ІХС перед дослідженням (15–50%)
9. ДІАГНОСТИЧНІ ЗАХОДИ У БЕЗСИМПТОМНИХ ОСІБ З ПІДОЗРОЮ НА ІХС
Серед скринінгових заходів, які можуть бути використані для потенційного зменшення ризику коронарної смертності серед дорослих безсимптомних осіб, рекомендовано визначення факторів і маркерів ризику та проведення стрес-тестування. Перелік відповідних досліджень у хворих без клінічної симптоматики наведений у таблиці 21.
Коментар робочої групи: рекомендації Європейського кардіологічного товариства щодо профілактики серцево-судинних захворювань та Американського кардіологічного коледжу і кардіологічної асоціації стосовно визначення КВ ризику і заходів для його зниження у безсимптомних дорослих осіб співпадають з наведеними нижче.
Не існує інформації щодо ведення асимптомних пацієнтів з патологічними результатами стрес-тестів, окрім зазначеної у чинних рекомендаціях. У них застосовуються ті самі принципи стратифікації ризику, що і у пацієнтів з симптомами ІХС. Такі хворі з низьким та середнім ризиком повинні отримувати профілактичне лікування, яке окреслене Европейськими рекомендаціями з профілактики серцево-судинних захворювань. Проведення ІКГ показане хворим високого ризику, визначеного за результатами стрес-тестування (таблиця 22). Важливо пам’ятати, що інформації щодо покращення прогнозу за умови сучасного лікування таких пацієнтів, недостатньо.
Особи, професії яких пов’язані із соціальної безпекою (авіаційні пілоти, водії вантажних авто і громадського транспорту) чи професійні спортсмени періодично проходять відповідне обстеження, включаючи проби з ДФН, для визначення толерантності до навантаження і оцінки можливих захворювань серцево-судинної системи, включаючи ІХС. Хоча інформації, яка б підтвердила доцільність зазначеного підходу, недостатньо, такі дослідження у ряді випадків мають медико-юридичне обґрунтування. Проведення додаткових тестів з візуалізацією міокарда у зазначеної категорії осіб не має достатньої доказової бази. За певних обставин заходи, рекомендовані для обстеження і лікування асимптомних пацієнтів, можуть бути використані і для цих індивідуумів.
КВ ризик – кардіо-васкулярний ризик
КТ – комп»ютерна томографія
ДФН – дозоване фізичне навантаження
МРТ – магнітно-резонансна томографія
10. ВЕДЕННЯ ХВОРИХ З ПІДТВЕРДЖЕНОЮ ІХС
Перебіг захворювання у пацієнтів з підтвердженим діагнозом ІХС може бути стабільним чи ускладнюватись періодами нестабільності, розвитком ІМ чи серцевої недостатності. У певних випадках може з’явитись потреба у реваскуляризації міокарда. Рекомендації щодо ведення хворих у таких клінічних ситуаціях представлені у відповідних європейських документах.
Немає рандомізованих досліджень щодо оцінки впливу різних стратегій ведення хворих з ІХС на їх прогностичні показники. Зокрема, немає інформації, що використання будь-яких стрес-тестів допомагає покращити прогноз асимптомних пацієнтів. Повторна оцінка прогнозу у хворих низького ризику (рис. 3) може розглядатись після закінчення терміну валідності попередньої, оскільки подальший прогноз у таких випадках втрачає визначеність і стає потенційно гіршим (таблиця 23). Період у 3 роки у попередніх рекомендаціях визначався як середній період валідності для нормальних показників щодо перфузії міокарда за даними ОФЕКТ, у хворих без підтвердженого діагнозу ІХС цей період був дещо довшим, у середньому, 5,5 років. Для пацієнтів з ІХС валідний період був значно коротшим, і погіршувався у зв’язку з віком, у осіб жіночої статі та за наявності ЦД. У таких випадках вважається доцільним проведення повторного стрес-тестування за такою самою методикою як і попередній тест. Протокол ведення хворих зі стабільною ІХС представлений у таблиці 23.
Коментар робочої групи: контроль стану пацієнтів з встановленим діагнозом ІХС відбувається в рамках диспансерного нагляду, тому у подальшому використовується цей термін.
11. ОСОБЛИВІ ДІАГНОСТИЧНІ ВИПАДКИ: СТЕНОКАРДІЯ З «НОРМАЛЬНИМИ» КОРОНАРНИМИ АРТЕРІЯМИ
З початку використання ІКГ відомо, що у певної частини пацієнтів, особливо жінок, які пройшли дослідження у зв’язку з симптомами болю у грудях чи задишкою під час навантажень, відсутні значні обструктивні ураження КА. Больовий синдром у таких пацієнтів вірогідно обумовлений різними патофізіологічними механізмами, з яких найбільш актуальними є наступні:
(1) Стенокардія, в основі якої лежить мікроваскулярна хвороба (мікроваскулярна стенокардія), здебільшого має типові ознаки захворювання (хоча можлива дещо більша тривалість ангінозних нападів і нечіткий зв’язок з навантаженнями), часто асоційована з аномальними результатами стрес-тестів.
(2) Біль, викликаний коронарним вазоспазмом (вазоспастична стенокардія), має типові ознаки стенокардії за локалізацією та тривалістю, але з’являється, переважно, у стані спокою.
Пацієнти з мікроваскулярною стенокардією часто мають типову сукупність класичних атеросклеротичних ФР і представляють особливу групу осіб, яким, в деяких випадках, регулярно проводять численні неінвазивні стрес-тести і навіть повторні ІКГ з намірами щодо подальшої реваскуляризації. Мікроваскулярна хвороба зустрічається і у хворих з ангіографічно наявними гемодинамічно значущими (>70%) стенозами КА. До таких пацієнтів (близько 20%) імовірно належать особи, у яких клінічні симптоми залишаються без змін після проведення успішної реваскуляризації міокарда.
У хворих з вазоспастичною стенокардією симптоматика спостерігається переважно у стані спокою і може супроводжуватись появою ангіографічних ознак «гострої» оклюзії КА. У цих випадках важливо не пропустити розвиток справжнього тромбозу КА з появою оклюзії чи субоклюзії артерії, тобто, ГКС/нестабільної стенокардії чи ІМ з елевацією чи без елевації сегмента ST.
Слід пам’ятати, що біль у грудях може бути пов’язаний з шлунково-кишковою чи кістково-м’язовою патологією, захворюваннями аорти чи перикарду. Детальне обговорення зазначених захворювань виходить за рамки чинної КН.
11.1 Мікроваскулярна стенокардія
Клінічна картина. Первинна коронарна мікроваскулярна хвороба імовірна у пацієнтів з типовим болем у грудях, у яких, незважаючи на аномальну ЕКГ і результати стрес-тестів, що вказують на наявність ішемії міокарда, на ангіограмах відсутні динамічні чи фіксовані стенози епікардіальних КА. Порушення мікроваскулярного кровотоку можуть виникати і при деяких інших кардіологічних захворюваннях, таких, як гіпертрофічна кардіоміопатія чи аортальний стеноз, у цих випадках можна говорити про «вторинну мікроваскулярну хворобу» (зазначена патологія не обговорюється у КН).
АГ, незалежно від наявності гіпертрофії міокарда, часто супроводжується болем у грудях за наявності «нормальних» КА. Основою такої клінічної симптоматики також можуть бути порушення мікроваскулярного кровотоку, які часто називають «гіпертензивною хворобою серця». Подібні зміни зустрічаються у хворих з ЦД та обтяженим сімейним анамнезом щодо серцево-судинних захворювань. Вважають, що у цих випадках основою патогенезу є зниження резерву коронарного кровотоку (РКК) з подальшим розвитком інтерстиціального чи периваскулярного фіброзу, що призводить до порушення діастолічної функції. Надалі у процесі захворювання можливий розвиток епікардіальних атеросклеротичних бляшок і відповідних артеріальних стенозів, які набувають домінуючого значення у клінічній картині.
Патогенез і прогноз. Механізм болю у пацієнтів з коронарною мікроваскулярною хворобою залишається предметом дискусій. Функціональні аномалії коронарної мікроциркуляції під час стресу, включаючи аномальні вазодилататорні реакції і гіперчутливість до вазоконстрикторних стимулів, можуть розглядатись як потенційні механізми больового синдрому та ішемічної депресії сегмента ST під час навантаження. Ендотеліальна дисфункція, скоріше за все, є тільки однією із складових патогенезу захворювання. Підвищена больова чутливість у поєднанні з мінімальними порушеннями резерву коронарного кровотоку пропонується для пояснення появи стенокардії (іноді тяжкої), незалежно від помірних ознак чи навіть за відсутності ознак ішемії міокарда.
У попередніх дослідженнях в невеликих групах добре обстежених пацієнтів з мікроваскулярною стенокардією прогноз був сприятливим за виключенням повторних нападів стенокардії. Проте в останньому великому дослідженні комбінований показник КВ ускладнень (КВ смерть, ІМ, інсульт, серцева недостатність і смерть від усіх причин) виявився вищим у пацієнтів з ІХС і нормальними КА (відносний ризик – 1,52) чи не-обструктивним ураженням КА (відносний ризик 1,85) у порівнянні з референтною популяцією без ІХС. 5-річний показник КВ ускладнень становив – 2% для жінок (0,4% на рік) та 6% для чоловіків (1,2% на рік).
Діагностика коронарної мікроваскулярної хвороби. Питання щодо діагностики мікроваскулярної стенокардії на теперішній час є складним і недостатньо вивченим, що знайшло своє відображення у класі рекомендацій («ІІа-b») та рівнях доказовості («С») відповідних діагностичних методик, зазначених у КН (таблиця 24). Попередній діагноз коронарної мікроваскулярної хвороби може бути поставлений у випадках, коли спостерігаються стенокардія навантаження та об’єктивні ознаки стрес-індукованої ішемії міокарда (ST-депресія під час проб з ДФН, ішемічні зміни при виконанні стрес-тестів з візуалізацією міокарда) за наявності «нормальних» чи мало змінених КА на ангіограмах (КТ-коронарографія, ІКГ).
Больовий синдром при «чистих» КА важливо диференціювати з некардіальним болем. Дифузний коронароспазм, що виникає у дистальному сегменті епікардіальної КА та імовірно поширюється на мікроваскулярне русло, може бути спровокований інтракоронарною ін’єкцією ацетилхоліну у значної частини пацієнтів з типовою коронарною мікроваскулярною хворобою. Клінічні прояви мікроваскулярної хвороби відрізняються від чистої вазоспастичної стенокардії, оскільки у першому випадку звичайно превалюють симптоми, індуковані навантаженнями, на додаток до симптоматики у стані спокою.
11.2 Вазоспастична стенокардія
Клінічна картина. У пацієнтів з вазоспастичною стенокардією спостерігається ангінальний біль типової локалізації, який з’являється у стані спокою, і надзвичайно рідко спостерігається під час фізичних навантажень. Типові напади вазоспастичної стенокардії часто виникають уночі і рано вранці. У разі сильного болю може виникнути потреба у госпіталізації. Нітрати, як правило, зменшують інтенсивність нападу протягом кількох хвилин. Стенокардія спокою, викликана возоспазмом, досить часто спостерігається у пацієнтів зі стабільним обструктивним атеросклерозом, тоді як індукована спазмом стенокардія напруження є рідкісним симптомом у хворих з необструктивним атеросклерозом.
Діагноз вазоспастичної стенокардії
Електрокардіографія. Типова графіка ЕКГ під час вазоспазму – це елевація сегмента ST. На ангіограмах у таких хворих реєструється локальний обструктивний спазм КА (стенокардія Принцметала чи варіантна стенокардія). Проте більшість пацієнтів з коронарним вазоспазмом на ангіограмах демонструють виражений дифузний субтотальний вазоспазм, який на ЕКГ звичайно асоціюється з депресією сегмента ST. Така форма вазоспазму, як правило, поєднується з мікроваскулярним спазмом і виявляється у хворих з мікроваскулярною стенокардією і стенокардією спокою. У частини пацієнтів, незважаючи на клінічну картину, викликати зміни на ЕКГ (відхилення від ізолінії сегмента ST) за допомогою проб, провокуючих вазоспазм, не вдається. Напади вазоспазму характеризуються відносно короткою тривалістю, що ускладнює можливість задокументувати їх на ЕКГ. Тому для реєстрації електрокардіографічних змін, поєднаних з ангінальним синдромом, доцільно використовувати повторне добове моніторування за Холтером.
Коронарна артеріографія. Хоча елевація сегмента ST під час нападу стенокардії за умови нормальних коронарних ангіограм робить діагноз варіантної стенокардії достатньо вірогідним, певні розбіжності щодо даних клінічного обстеження та результатів інструментальних досліджень можуть ускладнювати встановлення діагнозу у менш очевидних випадках.
Спонтанний спазм під час проведення коронарної ангіографії у пацієнтів з підозрою на вазоспастичну стенокардію спостерігається рідко. Тому є виправданим застосування спеціальних тестів для провокації вазоспазму, з визначенням його типу, локалізації тощо. Гіпервентиляція і холодова проба мають обмежену чутливість для виявлення коронароспазму. На сьогоднішній день у більшості центрів для провокації спазму КА застосовується проба з інтракоронарним введенням ацетилхоліну (таблиця 25). Ацетилхолін вводиться з інтервалами у наростаючих дозах до 200 μg. Аналогічні результати для провокації вазоспазму дає внутрішньокоронарне введення ергоновину (ергометрину) у наростаючих дозах до 60 μg.
Коронарний спазм може бути локальним і дифузним. За даними літератури, спазмом визнають зменшення просвіту судини на 75-99% у порівнянні з діаметром після ін’єкції нітрогліцерину, але сильний біль у грудях з депресією сегменту ST може з’явитись і без епікардіального спазму. В останньому випадку можливий розвиток мікроваскулярного спазму, що спостерігається у пацієнтів з мікроваскулярною стенокардією. Зменшення просвіту судини <30% нерідко спостерігається у неспазмованих коронарних сегментах і вважається «фізіологічною» констрикторною реакцією на високі дози ацетилхоліну чи ергоновину (ергометрину) при проведенні відповідних тестів.
Ацетилхоліновий і ергоновиновий тести на вазоспазм вважаються безпечними процедурами. Вибраний фармакологічний агент селективно вводиться у ліву чи праву КА. Описані неінвазивні дослідження з ергоновином (ергометрином), коли препарат вводиться внутрішньовенно з наступною реєстрацією ЕКГ та/чи візуалізацією міокарда (ЕхоКГ чи сцинтіграфія з визначенням перфузії міокарда). Проте необхідна обережність при виконанні тесту з внутрішньовенним введенням ергоновину (ергометрину), оскільки можливий розвиток фатальних ускладнень за рахунок тривалого спазму із залученням багатьох КА, тому бажаним є внутрішньокоронарний шлях введення препарату. Провокативні внутрішньовенні тести з ергоновином (ергометрином), не рекомендовані пацієнтам з невідомою коронарною анатомією, а також – з підозрою чи наявними значними обструктивними ураженнями КА на КГ.
12. МОДИФІКАЦІЯ СПОСОБУ ЖИТТЯ ТА ФАРМАКОТЕРАПІЯ ІХС
Загальні підходи до лікування стабільної ІХС. Метою лікування стабільної ІХС є зменшення симптомів захворювання і покращення прогнозу. Лікування хворих на ІХС включає модифікацію способу життя, контроль факторів ризику ІХС, призначення фармакологічних препаратів з доведеною ефективністю та навчання пацієнтів.
Коментар робочої групи: рекомендації щодо модифікації способу життя в КН відповідають описаним у рекомендаціях Європейського товариства кардіологів щодо профілактики ССЗ (2012 р) та настановах щодо корекції дисліпідемії (2011).
12.1 Модифікація способу життя і контроль факторів ризику
Куріння є потужним незалежним фактором ризику розвитку серцево-судинних захворювань (ССЗ), тому всім пацієнтам з ССЗ слід уникати будь-яких варіантів куріння, в тому числі, пасивного куріння. Позитивний ефект відмови від куріння описаний у численних наукових публікаціях, відмова від куріння є потенційно найбільш перспективним заходом профілактики, який призводить до зниження смертності пацієнтів після перенесеного гострого інфаркта міокарда, на 36 %. Клініцистам потрібно звертати увагу пацієнтів з ІХС на те, що відмова від куріння може суттєво зменшити ризик розвитку ішемії міокарда. Потрібно регулярно проводити оцінку статусу куріння, у тому числі, пасивного, всім курцям слід рекомендувати кинути курити, а також – запропонувати допомогу по відмові від тютюнопаління. Слід враховувати, що відмова від куріння є складним процесом, оскільки воно пов’язане як з фізіологічною, так і з психологічною залежністю. Надання рекомендацій, підтримка лікаря та призначення фармакологічних препаратів можуть позитивно вплинути на результат. Безпечність нікотин-замісної терапії дозволяє призначати її пацієнтам з ІХС. Результати окремих досліджень свідчать про безпечність застосування у пацієнтів зі стабільною ІХС препаратів бупропіон та вареніклін. Проте мета-аналіз існуючих досліджень показав незначне, але статистично вірогідне, збільшення випадків ССЗ при застосуванні варенікліну, що поставило під сумнів безпечність застосування цього препарату у даної категорії хворих.
Дієта. Здорове харчування знижує ризик розвитку ССЗ. Основні засади здорового харчування наведені у таблиці 26. Енергетична цінність раціону повинна бути обмежена і достатня для підтримки (або досягнення) нормальної маси тіла – тобто, ІМТ <25 кг/м2. У випадку дотримання рекомендацій щодо здорового харчування додаткове вживання харчових добавок недоцільне. Споживання омега-3 поліненасичених жирних кислот (ПНЖК), в основному, з жирної риби, має потенційний позитивний вплив на ризик ССЗ, зокрема, за рахунок зниження рівня тригліцеридів. Проте позитивний вплив на частоту виникнення серцево-судинних подій спостерігався далеко не у всіх рандомізованих контрольованих дослідженнях. Тому на теперішній час забезпечувати вміст ПНЖК у раціоні рекомендовано за рахунок збільшення вживання морської риби, а не додавання харчових добавок. Результати проведених останнім часом досліджень щодо так званої «Середземноморської дієти» з додаванням оливкової олії або горіхів, свідчать про суттєве зниження частоти виникнення «великих» серцево-судинних подій у пацієнтів без наявних ССЗ, але з високим КВ ризиком.
/113/tab26.jpg)
Фізична активність. Показано, що рівень захворюваності та смертності від ССЗ нижчий у пацієнтів з ІХС з достатнім рівнем фізичної активності, тому фізична активність має стати складовою життя таких пацієнтів. Пацієнтам з ІХС потрібно рекомендувати регулярно займатись аеробними фізичними вправами, які можуть бути частиною програми реабілітації для пацієнтів з ССЗ, за умови попередньої оцінки здатності адекватно виконувати відповідне навантаження без розвитку ішемічних реакцій. Пацієнтам з ГІМ, АКШ або стентуванням в анамнезі, хворим на стабільну стенокардію або зі стабільною хронічною серцевою недостатністю слід поступово переходити від помірних до інтенсивних аеробних вправ тривалістю 30 хвилин ≥ 3 разів на тиждень. Малоактивних пацієнтів слід заохочувати до виконання фізичних вправ легкої інтенсивності після адекватної оцінки ризику, пов’язаного з фізичним навантаженням. Для пацієнтів з ІХС, яким не буде проводитись реваскуляризація, фізичні тренування можуть стати альтернативою для зменшення симптомів і покращення прогнозу.
Сексуальна активність. Сексуальна активність пов'язана з фізичним навантаженням, інтенсивність якого може досягати 6 МЕТ (МЕТ – метаболічний еквівалент, 1 MEТ = споживання близько 3,5 мл кисню/кг/хв). Активація симпатичної нервової системи є невід'ємною складовою реакції сексуального збудження, при цьому ЧСС і рівень АТ можуть бути вищими, ніж очікувані при аналогічному рівні фізичного навантаження, що може призвести до ішемії міокарда. Тому, як і перед будь-яким іншим видом фізичної активності, перед статевим актом може мати позитивний ефект прийом нітрогліцерину. Хворі, які не мають виражених симптомів стенокардії, особи, яким було проведено успішну реваскуляризацію міокарда, та пацієнти з хронічною серцевою недостатністю (ХСН) І ФК за Нью-Йоркською класифікацією (NYHA) не потребують додаткових призначень для відновлення сексуальної активності. Хворим з більш вираженими клінічними симптомами, в тому числі, нападами стенокардії, рекомендується попередньо провести тест з ДФН – для оцінки ризику і для того, щоб пацієнт почував себе більш впевнено. Хворих потрібно заохочувати до регулярних фізичних тренувань – для збільшення толерантності до фізичного навантаження та зниження потреби міокарда у кисні під час сексуальної активності.
Еректильна дисфункція (ЕД) часто зустрічається за наявності факторів ризику ССЗ та у хворих з ІХС. В основі її лежить ендотеліальна дисфункція, при цьому прийом деяких антигіпертензивних препаратів, зокрема, b-блокаторів та тіазидних діуретиків, підвищує ризик розвитку ЕД. Позитивний ефект при ЕД мають заходи по модифікації способу життя, в т.ч., нормалізація маси тіла, відмова від куріння, підтримка оптимального рівня фізичної активності та прийом статинів. Лікування інгібіторами фосфодіестерази типу 5 (ФДЕ-5), такими, як силденафіл, тадалафіл і варденафіл, є ефективним, безпечним і добре переноситься пацієнтами чоловічої статі зі стабільною ІХС. Пацієнтам низького ризику можна призначати інгібітори ФДЕ-5 без проведення додаткових обстежень. Проте, прийом органічних нітратів, тобто, будь-яких фармакологічних форм нітрогліцерину, ізосорбіду мононітрату або ізосорбіду дінітрату, є абсолютним протипоказанням для одночасного призначення інгібіторів ФДЕ-5 через ризик синергічної дії препаратів, яка може призвести до надмірної вазодилятації з розвитком неконтрольованої гіпотензії та порушенням перфузії життєво важливих органів. Не рекомендується призначати інгібітори ФДЕ-5 пацієнтам з низьким АТ, з вираженою ХСН (NYHA III –IV), рефрактерною стенокардією або нещодавніми серцево-судинними подіями. Пацієнтам потрібно надати інформацію про потенційно шкідливу взаємодію між інгібіторами ФДЕ-5 та нітратами. Якщо у хворого, який приймає інгібітори ФДЕ-5, виникає біль у грудях, йому не можна призначати нітрати, як мінімум, протягом 24 годин після прийому силденафілу та варденафілу та 48 годин після прийому тадалафілу.
Корекція маси тіла. Надмірна маса тіла та ожиріння призводять до підвищення ризику смерті у пацієнтів з ІХС. Пацієнтам з надмірною масою тіла та ожирінням рекомендується зниження маси тіла, що призводить до позитивного впливу на рівень АТ, дисліпідемію та метаболізм глюкози. Рекомендується обстежувати таких пацієнтів, особливо – з ожирінням – щодо наявності симптомів апное уві сні. Наявність апное уві сні тісно пов'язане з підвищенням захворюваності та смертності від ССЗ.
Лікування дисліпідемій проводиться за допомогою фармакологічних препаратів та модифікації способу життя. Пацієнти з ІХС мають дуже високий ризик розвитку серцево-судинних ускладнень, тому терапія статинами у таких хворих проводиться незалежно від початкового рівня холестерину ліпопротеїнів низької щільності (ХС ЛПНЩ). Метою лікування є досягнення цільового рівня ХС ЛПНЩ нижче 1,8 ммоль/л (70 мг/дл) або його зниження принаймні на 50% у випадку неможливості досягнення цільового рівня. У більшості пацієнтів проводиться монотерапія статинами. Призначення інших препаратів – фібратів, секвестрантів жовчних кислот, препаратів нікотинової кислоти, езетимібу – може призвести до додаткового зниження ХС ЛПНЩ, але це не впливає на кінцевий клінічний результат. Хоча підвищені рівні тригліцеридів і низький рівень ХС ліпопротеїнів високої щільності (ХС ЛПВЩ) пов'язані з підвищеним ризику ССЗ, на даний час не існує доказової бази щодо доцільності досягнення цільового рівня даних показників за допомогою медикаментозної терапії. Рекомендується розглянути можливість призначення високих доз статинів пацієнтам зі стабільною ІХС перед проведенням ЧКВ – незалежно їх від попереднього прийому. За результатами проведених досліджень з метою профілактики розвитку ГІМ під час реваскуляризації доведено ефективність використання високих доз аторвастатину цими пацієнтами.
Артеріальна гіпертензія. Підвищення рівня АТ є основним фактором ризику розвитку ІХС, серцевої недостатності, цереброваскулярної хвороби та ниркової недостатності, тому всім пацієнтам рекомендується контролювати рівень АТ. Існуюча доказова база обґрунтовує зниження систолічного АТ (САТ) до <140 мм рт.ст. та діастолічного АТ (ДАТ) до <90 мм рт.ст. у хворих зі стабільною ІХС та АГ. Результати проведених в останні роки досліджень дозволяють рекомендувати підтримувати рівень САТ/ДАТ в діапазоні 130-139/80-85 мм рт. У пацієнтів з ЦД цільовий рівень АТ становить < 140/85 мм рт.ст.
/113/tab27.jpg)
Цукровий діабет та інші супутні захворювання. ЦД є доведеним фактором ризику серцево-судинних ускладнень, який прискорює розвиток ІХС і потребує відповідного лікування. Показником контролю глікемії є рівень глікозильованого гемоглобіну (HbA1c) не вище 7,0% (53 ммоль/моль), при можливості – у окремих пацієнтів – рекомендується підтримувати рівень HbA1c 6,5%-6,9% (48-52 ммоль/моль). Питання щодо можливості досягнення цільових показників рівня глікемії вирішується індивідуально, з урахуванням віку хворого, наявності ускладнень і тривалості захворювання. Пацієнтам з ЦД рекомендується проводити корекцію всіх ФР, зокрема, корекцію маси тіла та дотримання рекомендованого рівня фізичної активності. Пацієнтам з ЦД та ІХС, верифікованою за допомогою ангіографії, рекомендується призначення статинів з досягненням цільового рівня ХС ЛПНЩ < 1,8 ммоль/л (70 мг/дл). Рекомендація щодо досягнення цільового рівня АТ у пацієнтів з ЦД нижче 130 мм рт.ст. не підтримується результатами проведених в останні роки досліджень, крім того, у клінічній практиці у більшості пацієнтів не вдається досягти такого рівня АТ. Цільовий рівень АТ у пацієнтів з ЦД та ІХС становить <140/85 мм рт.ст. Для лікування АГ у пацієнтів з ЦД рекомендується призначати інгібітори ангіотензин перетворюючого ферменту (АПФ) або блокатори рецепторів ангіотензину та реніну, які мають ренопротекторну дію. Пацієнти з хронічним захворюванням нирок (ХЗН) мають високий ризик розвитку ССЗ, тому для них принципово важливими є корекція ФР та досягнення цільових рівнів АТ і ліпідів. Як правило, лікування статинами добре переноситься хворими з хронічною нирковою недостатністю (ХНН) 1-2 стадії (ШКФ > 60-89 мл/хвил/1.73 м2), а пацієнтам з ХНН 3-5 стадії слід призначати статини, які мають низький рівень екскреції нирками (аторвастатин, пітавастатін, розувастатін).
Психосоціальні фактори. Депресія, тривога і пригнічений настрій часто зустрічаються у пацієнтів з ІХС, тому у них доцільно проводити оцінку психосоціального статусу та, за необхідності, рекомендувати заходи корекції. За наявності клінічних ознак тривоги, депресії та агресії хворому показане надання відповідної психотерапевтичної допомоги, медикаментозного лікування або комбінації цих заходів. Використання зазначених методів терапії призводить до зменшення симптомів та покращення якості життя, хоча докази впливу на кінцеві прогностичні точки не є переконливими.
Реабілітація. Пацієнтам з ІХС рекомендується проведення заходів корекції ризику в рамках програми комплексної реабілітації. Програма реабілітації, як правило, призначається пацієнтам після перенесеного ІМ або проведеного коронарного втручання, але рекомендується розглянути доцільність призначення такої програми усім пацієнтам з ІХС, в т.ч., пацієнтам зі стабільною стенокардією. Дозована фізична активність у рамках програми реабілітації є ефективним заходом зниження загальної і серцево-судинної смертності, а також частоти госпіталізацій, тоді як її вплив на частоту розвитку ІМ або потребу у реваскуляризації (АКШ або ПКВ) не такий однозначний, особливо, при довгостроковому спостереженні. Існує доказова база щодо позитивного впливу фізичної активності на якість життя пацієнтів. В окремих групах хворих програма реабілітації може проводитись не лише у спеціалізованих медичних центрах, але в домашніх умовах, при цьому її ефективність зберігається. Слід зазначити, що участь пацієнтів у програмах реабілітації залишається низькою, особливо це стосується жінок, людей похилого віку і осіб з низьким соціально-економічним статусом. Разом з тим, саме у цих групах хворих можна очікувати реального покращення стану при їх активному залученні до участі у таких програмах.
Вакцинація проти грипу. Рекомендується проводити щорічну вакцинацію проти грипу всім пацієнтам зі стабільною ІХС, особливо, особам старших вікових груп.
Замісна гормональна терапія. Дані епідеміологічних та експериментальних досліджень свідчать про позитивний вплив естрогенів на ризик ССЗ, що, у свій час, стало підставою для рекомендацій про застосування замісної гормональної терапії (ЗГТ) з профілактичною метою. Однак результати великих рандомізованих клінічних досліджень не підтвердили цю гіпотезу. Навпаки, було продемонстровано, що ЗГТ підвищує ризик ССЗ у жінок віком > 60 років. Механізм цього явища невідомий. Обговорюється можливість призначення ЗГТ жінкам з інтактним судинним ендотелієм і незначною кількістю факторів КВ ризику у більш ранньому віці (у період настання менопаузи). Однак, за відсутності достатніх доказів, на теперішній час не рекомендується призначати ЗГТ з метою первинної або вторинної профілактики ССЗ.
12.2 Навчання пацієнта зі стабільною ІХС
Коментар робочої групи: рекомендації щодо навчання пацієнта детально розглядаються в Клінічних настановах Американської асоціації кардіологів (2012 ACCF/AHA/ACP/AATS/PCNA/SCAI/STS Guideline for the Diagnosis and Management of Patients With Stable Ischemic Heart Disease)
Навчання пацієнтів декларується як основа політики в галузі зміцнення здоров'я населення. Ефективне навчання і консультування пацієнта ґрунтується на комплексному підході, який визнає потреби конкретного пацієнта з урахуванням когнітивних, поведінкових і соціально-демографічних чинників. Пацієнти, які активно беруть участь у прийнятті рішень щодо лікування, більш схильні виконувати рекомендації лікаря щодо медикаментозного лікування та зміни поведінки, спрямовані на поліпшення здоров'я. Американська академія сімейних лікарів визначає освіту пацієнта як "процес впливу на поведінку пацієнта шляхом надання інформації та консультування, який спрямований на отримання змін у рівні знань, відношення і навичок, необхідних для підтримки або поліпшення здоров'я".
Для підвищення поінформованості пацієнтів використовують різні підходи:
1. Індивідуальне консультування. Цей навчальний формат використовується в контексті звичайного візиту до лікаря. Зазвичай, це відносно коротке інформування пацієнта щодо модифікації способу життя та медикаментозного лікування. Практикується надання друкованих матеріалів, інформаційних листів тощо
2. Групове навчання. Передбачається участь пацієнтів з однотипними діагнозами в групових заняттях за спеціальною програмою в поєднанні з індивідуальним відвідуванням лікаря.
3. Самоконтроль. Самоконтроль сприяє підвищенню ефективності навчання пацієнтів і зміні поведінки. Такі приклади, як контроль пацієнтом вдома рівня АТ, фізичної активності можуть підтримувати важливі зміни способу життя, особливо, якщо ці питання розглядаються при подальших візитах до лікаря, що підтримує мотивацію зміни поведінки.
4. Сучасні інформаційні технології. Зростає значення поширення медичної інформації через мережу Інтернет (веб-сайти та спеціальні програми). Проте цей підхід вимагає адекватного доступу до комп'ютера та певних навичок.
5. Перспективним є використання смартфонів, мобільних телефонів для забезпечення мотиваційного нагадування і надання порад щодо зміни способу життя і самоконтролю ФР, але клінічна ефективність використання цього підходу ще потребує дослідження.
У цілому, в сучасній охороні здоров'я все ще залишається проблемою, як найкращим чином забезпечити економічно ефективні освітні стратегії для пацієнтів. Визначені фактори, які ускладнюють ефективне навчання пацієнтів: низький рівень грамотності, несприятливі соціально-демографічні фактори (наприклад, бідність, соціальна ізоляція, і емоційні розлади, такі, як депресія), культурні і мовні бар'єри, фактори навколишнього середовища, похилий вік, наявність тяжких супутніх захворювань. Ці та інші фактори відіграють важливу роль у впровадженні здорового способу життя та дотриманні рекомендацій щодо лікування.
Необхідність навчання хворих на ІХС обґрунтована з позиції доказової медицини:
Клас I
1. Пацієнти з ІХС повинні мати індивідуальний план навчання для оптимізації лікування та сприяння оздоровленню, зокрема:
а) підвищити поінформованість щодо важливості прихильності до лікування для управління симптомами і уповільнення прогресування захворювання (рівень доказовості С);
в) надавати рекомендації щодо прийому медикаментів і стратегій щодо зменшення серцево-судинних ризиків в доступній формі, з урахуванням індивідуальних особливостей пацієнта (рівень доказовості B);
с) надати всебічну інформацію щодо всіх терапевтичних можливостей (рівень доказовості B);
d) надати рекомендації щодо відповідних рівнів фізичних навантажень, заохочувати підтримувати рекомендовані рівні щоденної фізичної активності (рівень доказовості С);
е) заохочувати до самоконтролю навичок (Рівень доказовості: C);
f) надати інформацію про те, як розпізнати погіршення серцево-судинних симптомів і вжити відповідних заходів. (Рівень доказовості: C)
2. Пацієнти з ІХС повинні бути поінформовані про елементи способу життя, які могли б вплинути на прогноз: контроль ваги, підтримка ІМТ від 18,5 до 24,9 кг/м2, а обхват талії менше 102 см у чоловіків і менше 88 см у жінок (менше для деяких расових груп); контроль показників ліпідного обміну; контроль АТ; відмова від куріння і уникнення впливу пасивного куріння; та індивідуальні рекомендації щодо лікування, харчування і зміни способу життя для пацієнтів з ЦД, які доповнюють ціль лікування діабету та освіти. (Рівень доведеності: C)
Клас IIa
1. Доцільно надити інформацію пацієнту з ІХС про:
а) дотримання дієти з низьким вмістом насичених жирів, холестерину і транс-жирів; високим вмістом свіжих фруктів, овочів, цільнозернових продуктів; обмеження споживання кухонної солі, з урахуванням культурних та етнічних уподобань (рівень доказовості: B);
в) поширені симптоми стресу і депресії, щоб звести до мінімуму симптоми стенокардії, пов'язані зі стресом (рівень доказовості С);
с) комплексні поведінкові підходи до управління стресом і депресією (рівень доказовості: C); і
d) оцінку і лікування депресивного розладу при наявності показань (Рівень доказовості: B)
12.3 Фармакотерапія пацієнтів з стабільною ІХС
Цілі терапії. Фармакотерапія пацієнтів зі стабільною ІХС має 2 мети: зменшення клінічної симптоматики та попередження розвитку серцево-судинних ускладнень.
Зменшення симптомів стенокардії. Показано, що препарати нітрогліцерину швидкої дії здатні полегшити симптоми при нападі стенокардії та дозволяють уникнути розвитку нападу (лікування або профілактика нападу стенокардії). Показано, що такі заходи, як призначення антиішемічних препаратів, модифікація способу життя, регулярні фізичні вправи, інформування пацієнтів та проведення реваскуляризації міокарда сприяють зменшенню або усуненню симптомів захворювання упродовж тривалого часу (довгострокова профілактика).
Профілактика серцево-судинних подій: заходи, спрямовані на попередження ІМ та зменшення смертності від ІХС, у першу чергу, мають на меті зменшенні ризику тромботичних ускладнень та розвитку дисфункції ЛШ. Цього можна досягти за допомогою фармакологічних препаратів і модифікації способу життя, які:
1. перешкоджають прогресуванню атеросклеротичного процесу;
2. забезпечують стабілізацію атеросклеротичної бляшки за рахунок зменшення запалення;
3. запобігають тромбоутворенню внаслідок розриву або ерозії бляшки.
У пацієнтів зі значним ураженням коронарних артерій і порушенням кровопостачання значної площі міокарда, застосування комбінованої стратегії – призначення фармакологічних препаратів та реваскуляризації – надає додаткові можливості для покращення прогнозу за рахунок оптимізації або забезпечення альтернативних шляхів коронарної перфузії.
Медикаментозна терапія. Оптимальною медикаментозною терапією (OMT) стабільної ІХС вважають призначення як мінімум одного антиангінального/антиішемічного засобу для зменшення клінічних проявів захворювання (стенокардії) у поєднанні з препаратами, які покращують прогноз пацієнта – препарати ацетилсаліцилової кислоти (АСК) і статини, а також інгібітори АПФ за показаннями. У таблиці 28 представлені основні побічні ефекти, протипоказання до призначення і особливості взаємодії препаратів різних фармакологічних груп. У таблиці 29 вказані загальні принципи щодо призначення медикаментозної терапії.
Антиішемічні препарати
Нітрати. Основним гемодинамічним ефектом нітратів, який забезпечує анти ішемічну дію, є вазодилятація венозного (переднавантаження) і артеріального (післянавантаження) русла, включаючи коронарні судини. Препарати діють як ендотелій-незалежні донатори оксиду азоту (NO), що вивільняється у процесі їх метаболізму.
Нітрати короткої дії при нападі стенокардії напруження Сублінгвальна форма нітрогліцерину є стандартною стартовою терапією при виникненні нападу стенокардії напруження. Під час нападу пацієнту необхідно сісти (в положенні стоячи є ризик синкопальних станів, у положенні лежачи збільшується приток венозної крові та робота серця) та приймати нітрогліцерин сублінгвально (у дозі 0,3-0,6 мг) кожні 5 хвилин до припинення нападу або досягнення максимальної дози у 1,2 мг нітрогліцерину протягом 15 хв. Нітрогліцерин у формі спрею діє швидше. Нітрогліцерин можна використовувати з метою профілактики розвитку нападів стенокардії – при запланованій фізичній активності, після прийому їжі, при емоційному стресі, перед заняттям сексом, у холодну погоду тощо.
Ізосорбіду динітрат (5 мг сублінгвально) дозволяє усунути напад стенокардії приблизно упродовж 1 години. Для реалізації фармакологічної дії препарат потребує печінкового метаболізму з утворенням активних метаболітів (мононітратів), тому його антиангінальний ефект розвивається повільніше (в межах 3-4 хв.), ніж після прийому нітрогліцерину. Після перорального використання гемодинамічний та антиангінальний ефекти зберігаються протягом кількох годин, що забезпечує більш тривалий антиішемічний ефект, ніж у сублінгвальної форми нітрогліцерину.
Нітрати тривалої дії для профілактики нападів стенокардії. Нітрати пролонгованої дії можуть втрачати антиангінальну ефективність (феномен толерантності) при регулярному призначенні протягом тривалого часу.У зв»язку з чим, рекомендовані обов»язкові перерви на 8-10 годин у їх прийомі уподовж доби. Обмеженням щодо використання нітратів тривалої дії вважають потенційну можливість погіршення ендотеліальної функції під впливом цих препаратів, тому їх рутинне використання пацієнтами зі стенокардією напруження, у якості засобів першої лінії, на теперішній час потребує переоцінки.
Ізосорбіду динітрат (пероральний препарат) часто призначається з метою профілактики ангінозних нападів. У плацебо-контрольованому дослідженні було показано, що одноразовий прийом ізосорбіду динітрату у дозі 15-120 мг мав позитивний вплив на тривалість фізичного навантаження протягом 6-8 годин, однак при регулярному використанні тих самих доз препарату 4 рази на день тривалість дії зменшувалась і становила лише 2 години, незважаючи на значно вищу концентрацію препарату в плазмі. У великому багатоцентровому дослідженні було показано, що ефективність ізосорбіду динітрату пролонгованої дії при призначенні у дозі 40 мг двічі на день – вранці та через 7 годин – була такою ж, як і при прийомі плацебо. Таким чином, доказова база щодо призначення тривалої терапії препаратом ізосорбід динітрат недостатня.
Мононітрати за дозуванням та механізмом дії подібні до ізосорбіду динітрату. Толерантність до них, включаючи лікарські форми пролонгованої дії, можна попередити змінюючи дози та час призначення препаратів. Є свідчення, що тільки 2-разовий добовий прийом засобів швидкого вивільнення чи дуже високі дози пролонгованих мононітратів двічі на день можуть забезпечити стійкий антиангінальний ефект.
Трансдермальна форма нітрогліцерину не забезпечує 24-годинного ефекту при тривалому призначенні. Дотримання перерви у 12 годин при застосуванні трансдермальних форм дозволяє отримати швидкий ефект, який розвивається через кілька хвилин після аплікації препарату і утримується до 3-5 годин. Даних щодо збільшення ефективності при застосуванні другої або третьої дози при тривалому використанні зазначеної лікарської форми немає.
Побічні реакції нітратів. Гіпотензія є найбільш серйозною побічною реакцією на призначення нітратів, головний біль – найчастішою. Поява головного болю (може зменшуватись після прийому препаратів АСК) призводить до втрати комплайєнсу/прихильності до лікування. Проте, часто головний біль носить тимчасовий характер і проходить, незважаючи на продовження терапії з використанням нітропрепаратів.
Взаємодія нітратів з іншими препаратами. Існує досить багато препаратів, які здатні взаємодіяти з нітратами посилюючи їх гемодинамічні ефекти (вазодилятацію), наприклад, блокатори кальцієвих каналів (БКК). Дуже важливо, що виражене/критичне зниження АТ може виникнути при одночасному застосуванні нітратів та селективних інгібіторів ФДЕ-5 (силденафіл та ін.), які показані для лікування ЕД або легеневої гіпертензії. Силденафіл знижує АТ приблизно на 8,4/5,5 мм рт.ст., його гіпотензивна дія значно зростає при одночасному застосуванні з нітратами. При випадковому прийомі комбінації нітратів з селективними інгібіторами ФДЕ-5 для надання медичної допомоги можуть знадобитись α-адреноміметики або навіть норадреналін. Не рекомендується призначати нітрати з α-адреноблокаторами. Проте нітрати можуть бути призначені чоловікам з патологією передміхурової залози, які приймають тамсулозин (блокатор α1А і α1D рецепторів).
β-адреноблокатори. β-адреноблокатори (ББ) діють безпосередньо на серце, зменшуючи ЧСС, скоротливість міокарда, ектопічну активність та уповільнюючи атріо-вентрикулярну (AВ) провідність. Крім того, вони позитивно впливають на перфузію ішемізованих ділянок серцевого м’яза за рахунок подовження діастоли та підвищення судинного опору в неішемізованих ділянках. У пацієнтів, які перенесли ІМ, прийом ББ призводить до зниження ризику серцево-судинної смерті та частоти повторного інфаркту на 30%. Вважається, що у пацієнтів зі стабільною ІХС, ББ також реалізують протекторні властивості, хоча цей факт і не підтверджений результатами плацебо-контрольованих клінічних досліджень. Нещодавно проведений ретроспективний аналіз реєстру REACH показав, що у хворих, які мають ФР ІХС, ІМ в анамнезі та діагностовану ІХС без ІМ, використання ББ не призводило до зниження ризику серцево-судинних подій. Серед недоліків цього аналізу слід вказати, що більшість досліджень щодо використання ББ у пацієнтів з ІМ в анамнезі було проведено до впровадження сучасних засобів вторинної профілактики з доведеною ефективністю, зокрема, статинів та інгібіторів АПФ. Тобто, на теперішній час неможливо зробити остаточні висновки відносно ефективності використання ББ на додаток до загальновизнаних препаратів, які покращують прогноз пацієнтів з ІХС.
ББ мають доведену антиангінальну ефективність, вони підвищують толерантність до фізичного навантаження та зменшують кількість епізодів ішемії – як симптоматичних, так і безсимптомних. Щодо контролю симптомів стенокардії, ББ аналогічні БКК. Для лікування стенокардії ББ можна комбінувати з дигідропіридиновими (ДГП) БКК. Проте, через ризик виникнення брадикардії або АВ-блокади, не рекомендується застосовувати ББ з верапамілом або дилтіаземом (таблиця 28).
У країнах Європи найчастіше використовують селективні ББ, які переважно впливають на β1-адренорецептори – такі, як метопролол, бісопролол, атенолол або небіволол. Часто призначають карведілол, який є неселективним блокатором β- та α1-адренорецепторів. Усі вони, за виключенням атенололу, зменшують ризик серцевих подій та покращують перебіг захворювання у пацієнтів з хронічною серцевою недостатністю. Тобто, існує доказова база щодо позитивного впливу ББ на прогноз хворих, які перенесли ІМ, або мають серцеву недостатність. Екстраполяція наведених даних у загальній популяції хворих зі стабільною ІХС дозволяє визнати ББ препаратами першої лінії для проведення антиангінальної терапії, за відсутності протипоказань. Небіволол і бісопролол частково виводяться нирками, карведілол і метопролол метаболізуються у печінці, тому вони більш безпечні у пацієнтів з патологією нирок.
Блокатори кальцієвих каналів. Основним механізмом дії антагоністів кальцію або БКК є вазодилятація та зниження периферичного судинного опору. БКК є гетерогенною групою препаратів, які за своєю хімічною структурою можуть бути класифіковані, як дигідропіридіни (ДГП) і не-дигідропіридіни (не-ДГП), усі вони є селективними блокаторами L кальцієвих каналів у гладеньких м'язах судин та міокарда.
Різниця між ДГП і не-ДГП БКК полягає в різних рівнях зв'язування діючої речовини у кальцієвих каналах і більшій судинній селективності БКК групи ДГП (амлодипін, ніфедипін, фелодипін). БКК не-ДГП групи (верапаміл і дилтіазем) блокують СА- і АВ- провідність, що призводить до зменшення частоти серцевих скорочень і, в результаті, до антиангінального ефекту.
Недигідропіридинові БКК (блокатори кальцієвих каналів, які зменшують частоту серцевих скорочень)
Верапаміл – серед БКК, має широкий спектр показань до застосування, в тому числі, всі форми стенокардії (напруження, вазоспастична, нестабільна), надшлуночкові тахікардії, АГ. Опосередковані дані підтверджують достатню безпечність препарату, але його прийом може призвести до розвитку блокади серця, брадикардії і серцевої недостатності. Антиангінальна активність верапамілу аналогічна активності метопрололу. У пацієнтів з АГ та ІХС при лікуванні верапамілом зареєстровано меншу частоту нових випадків ЦД, нападів стенокардії та депресії, порівняно з атенололом. Не рекомендується призначати комбінацію верапамілу з ББ (у зв'язку з ризиком розвитку блокад серця); у таких випадках рекомендовані дигідропіридинові БКК.
Дилтіазем – завдяки меншому ризику побічних реакцій, має переваги при лікуванні стенокардії напруження у порівнянні з верапамілом. Як і верапаміл, він викликає периферичну вазодилятацію, зменшує індуковану навантаженням коронарну вазоконстрикцію, має помірний негативний інотропний ефект та пригнічує функцію синусового вузла. Порівняльні дослідження щодо прогностичної ефективності дилтіазему і верапамілу не проводились. Не рекомендується застосовувати комбінацію дилтіазему з ББ та призначати препарат пацієнтам з порушенням функції лівого шлуночка.
Дигідропіридинові БКК
Ніфедипін тривалої дії є потужним артеріальним вазодилататором з незначною кількістю серйозних побічних ефектів. Більшість досліджень щодо ніфедипіна тривалої дії проведено при застосуванні препарату у комбінації з ББ у пацієнтів зі стенокардією та супутньою АГ. У великому плацебо-контрольованому дослідженні ACTION доведено безпечність ніфедипіну тривалої дії у пацієнтів зі стабільною стенокардією та показано зниження у них потреби в серцево-судинних втручаннях. Протипоказань до призначення ніфедипіну небагато (важкий аортальний стеноз, обструктивна кардіоміопатія або серцева недостатність), рекомендується призначати препарат у комбінації з ББ. До побічних ефектів, пов’язаних з вазодилятацією, відносять головний біль та набряки нижніх кінцівок.
Амлодипін завдяки тривалому періоду напіввиведення та хорошій переносимості є ефективним антиангінальним і антигіпертензивним засобом, який, на противагу багатьом іншим, потребує лише одноразового прийому на день. Амлодипін має незначну кількість побічних ефектів, в основному, це набряки нижніх кінцівок. У 24-місячному дослідженні за участі хворих з ІХС та нормальним АТ прийом препарату супроводжувався зниженням КВ ускладнень. 305 Порівняно з ББ, атенололом, амлодипін більш ефективно впливав на ішемію, індуковану фізичним навантаженням, а комбінація цих препаратів була ще більш ефективною. Проте, навіть у дослідженнях, в яких декларується «оптимальне лікування» стабільної стенокардії напруження, комбінація ББ і дигідропіридинових БКК часто не призначається.
Інші. Фелодипін, лацидипін та лерканідипін мають стандартні властивості дигідропіридинів тривалої дії.
Івабрадин знижує ЧСС за рахунок селективного інгібування I(f) – каналів у синусовому вузлі, що призводить до зменшення потреби міокарда в кисні без впливу на скоротливість та рівень АТ. Івабрадин був схвалений Європейським агентством з лікарських засобів (EMA) для терапії стабільної стенокардії у пацієнтів з синусовим ритмом у разі непереносимості чи недостатньої ефективності ББ щодо контролю ЧСС (>70 уд./хв.). У хворих зі стабільною ІХС, івабрадин мав таку ж ефективність як атенолол та амлодипін. У дозі 7,5 мг двічі на день, на додаток до атенололу, препарат забезпечував кращий контроль ЧСС і симптомів стенокардії. У 1507 пацієнтів зі стенокардією, які увійшли в дослідження BEAUTIFUL, івабрадин зменшував частоту комбінованої первинної кінцевої точки (серцево-судинна смерть, госпіталізація з приводу ІМ та серцевої недостатності). Більш виражений ефект спостерігався у пацієнтів з ЧСС≥70 уд/хв. Таким чином, івабрадин є ефективним антиангінальним препаратом, як при монотерапії, так і у комбінації з ББ.
Нікорандил є нітратним похідним нікотинаміду і може бути використаний для тривалого лікування з метою попередження нападів стенокардії, в т.ч., у комбінації з ББ та БКК. Препарат схвалено EMA, проте не схвалено FDA. Нікорандил розширює епікардіальні коронарні артерії і стимулює АТФ-чутливі калієві канали в гладеньких м'язах судин. В дослідженні IONA (Impact Of Nicorandil in Angina) прийом нікорандилу, в середньому, протягом 1,6 років 5126 пацієнтами з хронічною ІХС, призвів до зниження ризику серцево-судинних подій на 14 % (відносний ризик 0,86; P = 0,027). Проте не повідомлялося про зменшення клінічної симптоматики. Тривале пероральне застосування нікорандилу може стабілізувати коронарні бляшки у пацієнтів зі стабільною стенокардією. Побічні реакції виникають рідко, можлива поява виразок у ротовій порожнині, кишківнику та перианальній ділянці.
Коментар робочої групи: станом на 28.12.2015 Нікорандил в Україні не зареєстрований.
Триметазидин – антиішемічний метаболічний засіб з антиангінальною ефективністю, аналогічною пропранололу, при використанні дози 20 мг тричі на день. В дослідженнях з триметазидином значення ЧСС і подвійного добутку (ЧСС×систолічний АТ) у стані спокою та на висоті фізичного навантаження залишались незмінними, що вказує на негемодинамічну природу його антиішемічної дії. Прийом пролонгованого триметазидину (в дозі 35 мг двічі на день) у поєднанні з ББ (атенололом) зменшував стрес-індуковану ішемію міокарда. Дані про зазначену фармакотерапевтичну дію внесені до відповідних документів Європейської агенції з лікарських засобів (ЕМА), яка перереєструвала препарат у червні 2012 року. Триметазидин протипоказаний при хворобі Паркінсона та екстрапірамідних рухових розладах (тремор, м'язова ригідність, розлади ходи та синдром неспокійних ніг). У пацієнтів з ЦД препарат знижував рівень HbA1c та глікемії. Великі, сучасні дослідження щодо ефективності триметазидину у хворих зі стабільною ІХС не проводились.
Ранолазин є селективним інгібітором пізнього натрієвого току, має антиішемічні та метаболічні властивості. В добовій дозі 500-2000 мг ранолазин зменшує симптоми стенокардії та підвищує толерантність до фізичних навантажень без впливу на ЧСС та рівень АТ. У 2009 році EMA схвалила використання ранолазину для додаткового лікування стабільної ІХС у пацієнтів з недостатнім контролем симптомів або при непереносимості препаратів першої лінії (ББ та/або БКК). У дослідженні MERLIN-TIMI 36 (Metabolic Efficiency with Ranolazine for Less Ischemia in Non-ST-Elevation Acute Coronary Syndromes: Thrombolysis In Myocardial Infarction) препарат приймали 6560 хворих з нещодавнім ГКС без елевації сегмента ST без суттєвого ефекту. Проте, в підгрупі пацієнтів з хронічною стенокардією, яка передувала ГКС, ранолазин зменшував частоту рецидивів ішемії [відносний ризик (ВР) 0,78; P=0,002 ]. У хворих, які перенесли коронарні події, призначення препарату асоціювалось з меншою кількістю випадків вперше зареєстрованого підвищення HbA1c на 32%. У нещодавньому дослідженні TERISA (Type 2 Diabetes Evaluationof Ranolazine in Subjects With Chronic Stable Angina), ранолазин зменшував кількість нападів стенокардії і потребу в сублінгвальному нітрогліцерині у 949 хворих на ЦД, що вже приймали один або два антиангінальних препарати. Позитивний ефект ранолазину був більш вираженим у пацієнтів з високим рівнем HbA1c. Згідно з цими даними, ранолазин може призначатись, як антиангінальний препарат, на додаток до інших загальновизнаних засобів, зокрема, пацієнтам з високим рівнем HbA1c.
Рівень ранолазину в плазмі крові збільшується при його застосуванні у комбінації з інгібіторами цитохрому CYP3A4 (дилтіазем, верапаміл, макроліди, грейпфрутовий сік). Кліренс препарату знижується при нирковій та печінковій недостатності. Ранолазин подовжує інтервал QT, тому його слід використовувати з обережністю у хворих з подовженим QT та у комбінації з іншими засобами, які можуть збільшувати тривалість інтервала QT.
Алопуринол – інгібітор ксантиноксидази, який знижує рівень сечової кислоти у хворих з подагрою, має також антиангінальну дію. Ці дані були отримані в єдиному рандомізованому перехресному дослідженні за участі 65 пацієнтів зі стабільною ІХС. Алопуринол у дозі 600 мг/добу збільшував час до виникнення депресії сегмента ST та появи болю у грудях. При нирковій недостатності такі високі дози можуть мати токсичну дію. У пацієнтів зі стабільною ІХС, які отримували оптимальну медикаментозну терапію, алопуринол зменшував васкулярний оксидативний стрес, у хворих з серцевою недостатністю він підтримував рівень АТФ.
Молсидомін – прямий донатор NO, його антиішемічна дія подібна до ізосорбіду динітрату. Одноразовий прийом молсидоміну тривалої дії у дозі 16 мг/добу має таку саму ефективність, як і прийом препарату у дозі 8 мг двічі на день.
Пацієнти з низьким артеріальним тиском Застосування антиангінальних препаратів необхідно починати з дуже низьких доз, перевагу надавати лікам з мінімальним впливом на АТ, таким, як івабрадин (у хворих із синусовим ритмом), ранолазин або триметазидин.
Пацієнти з низькою ЧСС У ряді досліджень було показано, що збільшення ЧСС у стані спокою є потужним незалежним фактором ризику щодо несприятливого прогнозу у хворих зі стабільною ІХС. Існує лінійна залежність між ЧСС у спокої і розвитком серйозних КВ ускладнень, з чітким зниженням серцево-судинного ризику при нижчих значення ЧСС. Сприятливий ефект зниження ЧСС продемонстровано при використанні різних препаратів. Хоча зниження ЧСС до рівня <60 уд/хв. є цільовим показником для терапії стабільної ІХС, лікування хворих з низькою ЧСС має деякі особливості. Таким пацієнтам рекомендується уникати препаратів, які додатково знижують ЧСС (ББ, івабрадин, не-ДГП БКК) або використовувати їх з обережністю, за необхідності, починаючи з дуже низьких доз. Перевага надається антиангінальним засобам, які не знижують ЧСС.
Попередження кардіоваскулярних ускладнень
Антитромбоцитарні препарати знижують агрегацію тромбоцитів і можуть запобігати утворенню коронарних тромбів. Препаратом вибору у більшості пацієнтів зі стабільною ІХС є АСК у низьких дозах – через сприятливе співвідношення між користю і ризиком та низьку вартість. У деяких випадках можна розглянути доцільність призначення клопідогрелю. Використання антитромбоцитарних препаратів пов'язано із підвищенням ризику кровотечі.
Низькі дози ацетилсаліцилової кислоти (АСК). АСК залишається наріжним каменем фармакологічної профілактики артеріальних тромбозів. При регулярному прийомі у дозі ≥75 мг/день препарат призводить до незворотної блокади циклооксигенази-1 (ЦОГ-1) тромбоцитів, що супроводжується пригніченням синтезу тромбоксану. Вищі дози АСК збільшують ризик побічних реакцій з боку шлунково-кишкового тракту, при цьому антитромбоцитарний ефект не збільшується. Оптимальне співвідношення ризику і користі спостерігається при дозуванні препарату 75-150 мг/день.
Інгібітори P2Y12, включаючи тієнопіридини, є антагоністами P2Y12 рецепторів тромбоцитів до аденозиндифосфату (АДФ), що мають антиагрегантний ефект. Провідним дослідженням, у якому було показано доцільність використання тієнопіридинів у хворих на стабільну ІХС, є CAPRIE (Clopidogrel vs. Aspirin in Patients at Risk of Ischaemic Events), у ньому було продемонстровано певну перевагу клопідогрелю над препаратами АСК (зі сприятливим профілем безпеки) щодо попередження серцево-судинних ускладнень. Зазначені результати були отримані переважно за рахунок підгрупи пацієнтів із захворюванням периферичних артерій (ЗПА). Недоліком зазначеного дослідження була неоптимальна, за сучасними даними, доза АСК (325 мг/добу), з якою порівнювали клопідогрель. Таким чином, у хворих зі стабільною ІХС препарат можна використовувати як другу лінію терапії, особливо, при непереносимості АСК. Прасугрел і тікагрелор є новими P2Y12 антагоністами, їх застосування призводило до більш вираженого пригнічення агрегації тромбоцитів порівняно з клопідогрелем. Прийом прасугрелю і тікагрелору супроводжувався більш значним зниженням ризику серцево-судинних ускладнень у пацієнтів з ГКС, але немає клінічних досліджень щодо їх використання у пацієнтів зі стабільною ІХС. Немає досліджень, які б підтверджували позитивний вплив більш інтенсивного пригнічення агрегації тромбоцитів у пацієнтів з нестабільною стенокардією або ІМ без підйому ST-сегмента після стабілізації клінічного стану та призначення оптимальної медикаментозної терапії.
Комбінована антитромбоцитарна терапія. Подвійна антитромбоцитарна терапія (ПАТТ), яка включає препарати АСК та інгібітори P2Y12, є стандартом лікування пацієнтів з ГКС після стабілізації клінічного стану, та хворих зі стабільною ІХС, яким проведено ЧКВ. Хоча у дослідженні CHARISMA (Clopidogrel for High Atherothrombotic Risk and Ischemic Stabilization, Management, and Avoidance) не були виявлені переваги ПАТТ у пацієнтів зі стабільним перебігом КВ захворювань чи ризиком атеротромбозу, подальший аналіз засвідчив значний позитивний вплив такої терапії у хворих з підтвердженим атеротромбозом, зокрема, з ІМ в анамнезі. Нещодавно закінчилось дослідження щодо ефективності комбінованої антитромбоцитарної терапії з використанням нового класу препаратів, антагоністів тромбінових рецепторів 1 типу, що активуються протеазою (PAR-1). Така терапія (інгібітор PAR-1 – ворапаксар (vorapaxar), на додаток до стандартних антитромбоцитарних засобів) мала вірогідний позитивний вплив на комбіновану первинну кінцеву точку – смерть від ССЗ, розвиток ІМ або інсульту, найбільш демонстративні результати спостерігались у групі пацієнтів з ІМ в анамнезі. Проте, застосування такої комбінації призводить до підвищення ризику серйозних кровотеч, включаючи внутрішньочерепні. Загалом, на основі результатів проведеного дослідження, можна зробити висновок, що комбінована антиагрегантна терапія може мати позитивний ефект у окремих пацієнтів, які мають високий ризик розвитку ішемічних подій, але не може бути рекомендована для рутинного застосування у всіх пацієнтів зі стабільною ІХС.
Недостатня ефективність антитромбоцитарних засобів. Останнім часом обговорюється можливість використання функціональних та/або генетичних тестів щодо вибору оптимальної терапії, враховуючи значну варіабельність індивідуальних реакцій у відповідь на застосування антитромбоцитарних засобів. Вплив АСК та/або клопідогрелю на реактивність тромбоцитів залежить від численних факторів, в тому числі, від прихильності до лікування, швидкості оновлення тромбоцитів, взаємодії з іншими препаратами, індивідуальних характеристик пацієнтів (вік, стать, наявність ЦД) та їх генетичних особливостей (однонуклеотидний поліморфізм [цитохром P450 2C19 (CYPC19*2), ATP-binding cassette sub-family B member (ABCB1) для клопідогрелю]. Вплив генотипу на ефективність антиагрегантної терапії, особливо з використанням клопідогрелю, був продемонстрований у пацієнтів з ГКС, яким планувались ЧКВ. У хворих зі стабільною ІХС такого зв’язку встановлено не було. Таким чином, на теперішній час рекомендацій щодо необхідності виконання генетичного тестування або визначення функції тромбоцитів у пацієнтів із стабільною ІХС, яким планується проведення ЧКВ, немає.
Гіполіпідемічні препарати. Пацієнти з встановленим діагнозом ІХС мають дуже високий ризик КВ ускладнень, і потребують призначення статинів у відповідності до Рекомендацій Європейського товариства з атеросклерозу. Цільовий рівень ХС ЛПНЩ у таких хворих становить <1,8 ммоль/л, при неможливості досягнення таких показників, рекомендується його зниження > на 50 %.
Блокатори ренін-ангіотензин-альдостеронової системи. Інгібітори АПФ знижують рівень загальної смертності, частоту ІМ, інсультів та серцевої недостатності у певних підгрупах, включаючи хворих з серцевою недостатністю, встановленим діагнозом судинного захворювання та ЦД у поєднанні з високим КВ ризиком. Отже, призначення інгібіторів АПФ пацієнтам зі стабільною ІХС вважається доцільним, особливо, за наявності АГ, дисфункції ЛШ з ФВ ≤40 %, ЦД або ХЗН при відсутності протипоказань.
Не усі клінічні дослідження демонстрували ефективність інгібіторів АПФ у зниженні загальної і серцево-судинної смертності, частоти розвитку ІМ, інсультів та серцевої недостатності у пацієнтів з атеросклерозом і збереженою функцією ЛШ. У хворих з поєднанням стабільної ІХС та АГ, за результатами ASCOT (Anglo-Scandinavian Cardiac Outcomes Trial) і ACCOMPLISH (Avoiding Cardiovascular Events Through Combination Therapy in Patients Living With Systolic Hypertension), позитивний вплив на прогноз мали комбінації ліків: інгібітор АПФ + ДГП БКК (периндоприл з амлодипіном та беназеприл з амлодипіном, відповідно). На противагу, застосування комбінації блокатора рецепторів ангіотензину II (БРА) та інгібітору АПФ не призводило до підвищення ефективності лікування, але збільшувало частоту виникнення побічних реакцій. Тому, призначення БРА може бути альтернативою для пацієнтів зі стабільною ІХС у випадку непереносимості інгібіторів АПФ. Клінічні дослідження щодо прогностичного впливу БРА у хворих зі стабільною ІХС не проводились.
Блокатори альдостерону, спіронолактон або еплеренон, показані пацієнтам з перенесеним ІМ, ЦД або серцевою недостатністю (ФВ ЛШ ≤40 %), які отримують терапевтичні дози інгібітору АПФ та ББ, за відсутності вираженого порушення функції нирок чи гіперкаліємії.
Інші препарати
Анальгетики. Результати клінічних досліджень по лікуванню артропатій та профілактики онкологічних захворювань свідчать, що використання селективних інгібіторів циклооксигенази-2 (ЦОГ-2) та неселективних нестероїдних протизапальних препаратів (НПЗП) призводить до підвищення ризику серцево-судинних подій, тому пацієнтам з ІХС не рекомендується призначати ці препарати. У пацієнтів з високим кардіоваскулярним ризиком при необхідності знеболення, рекомендується починати з використання ацетамінофену або АСК у найнижчих ефективних дозах, по можливості, короткими курсами. За необхідності призначення НПЗП рекомендовані мінімальні ефективні дози на короткий термін. У пацієнтів з атеросклеротичним ураженням судин, зокрема, зі стабільною ІХС, при необхідності НПЗП призначаються у комбінації з низькими дозами АСК – для забезпечення ефективної антиагрегантної дії.
На рис. 5 наведені загальні принципи вибору медикаментозних засобів для лікування пацієнтів зі стабільною ІХС. Вибір препаратів залежить від наявності супутніх захворювань, протипоказань, особистих уподобань хворого та вартості ліків. Медикаментозне лікування, як правило, включає препарат, що впливає на симптоми стенокардії/ішемії, засоби, які мають позитивний вплив на прогноз захворювання, та швидкодіючі форми нітрогліцерину для лікування нападів стенокардії. Препаратами вибору для використання разом з нітратами короткої дії є ББ або недигідропіридинові БКК, що дозволяє контролювати ЧСС і допомагає зменшити симптоми захворювання. При недостатній ефективності терапії рекомендується замінити ББ на БКК, або навпаки, чи призначити комбінацію ББ та ДГП БКК. Не рекомендується застосовувати ББ разом з БКК, які мають негативний хронотропний ефект. Інші антиангінальні препарати можуть бути використані як препарати другої лінії за відсутності адекватного контролю симптомів. За умови непереносимості чи протипоказань до призначення ББ або БКК у якості терапії першої лінії можуть бути використані препарати другої лінії. З метою попередження серцево-судинних ускладнень показані антитромбоцитарні засоби і статини. За наявності додаткових показань призначають інгібітори АПФ або БРА.
12.4 Лікування окремих форм стабільної ІХС
Мікроваскулярна стенокардія. У всіх пацієнтів з мікроваскулярною стенокардією необхідно забезпечити оптимальний контроль ФР. Симптоматичне лікування захворювання є емпіричним, оскільки причини його розвитку до кінця не відомі. Результати проведених клінічних досліджень не можуть бути використані як доказова база через неоднорідний склад пацієнтів, малу кількість учасників, неадекватний дизайн та відсутність клінічної ефективності призначеного лікування щодо перебігу захворювання.
Рекомендується розпочинати лікування з призначення традиційних антиішемічних засобів. Для лікування нападів стенокардії можна використовувати нітрати короткої дії, але часто вони бувають недостатньо ефективними. Враховуючи, що основним симптомом захворювання є стенокардія напруження, видається доцільним призначення ББ. У ряді досліджень ББ мали позитивний вплив на симптоми захворювання, тому їх можна розглядати, як препарати першого ряду, особливо у пацієнтів з ознаками підвищеної активності симпатичної нервової системи (висока ЧСС у спокої або під час низьких фізичних навантажень).
/113/tab30.jpg)
БКК і нітрати тривалої дії, за даним клінічних досліджень, не завжди давали позитивний клінічний ефект, проте ці групи препаратів рекомендовані у комбінації з ББ при недостатньому контролі симптомів. У деяких випадках, зокрема, у пацієнтів з високою варіабельністю порогового навантаження при стенокардії напруження, БКК можуть призначатись, як засоби першої лінії. Якщо симптоми захворювання зберігаються, незважаючи на оптимальну медикаментозну терапію, доцільне призначення препаратів інших фармакологічних груп. Інгібітори АПФ (можливо також – БРА) позитивно впливають на мікросудинне русло за рахунок нейтралізації вазоконстрикторної дії ангіотензину II. За результатами проведених клінічних досліджень з незначною кількістю учасників вони позитивно впливають на симптоми захворювання та толерантність до фізичного навантаження, їх рекомендується використовувати у пацієнтів з АГ та ЦД. α-адреноблокатори можуть зменшувати вазоконстрикцію, обумовлену активацією симпатоадреналової системи, їх можна призначати окремим хворим, хоча результати клінічних досліджень, як правило, непереконливі. Є невелике дослідження, в якому спостерігали збільшення толерантності до фізичного навантаження при лікуванні нікорандилом. Описане зменшення симптомів стенокардії, можливо, пов’язане з покращенням функції ендотелію при застосуванні статинів та замісної терапії естрогенами. У пацієнтів зі стенокардією, рефрактерною до стандартної терапії, можна призначати інші препарати/схеми лікування. Наприклад, похідні ксантину (амінофіллін, баміфіллін), які є блокаторами рецепторів аденозину (аденозин – провідний медіатор серцевого болю). У окремих пацієнтів з мікросудинною стенокардією позитивні результати мало призначення ранолазину та івабрадину. При рефрактерній стенокардії можна розглянути додаткові схеми лікування (див. розділ 9 щодо рефрактерної стенокардії).
У пацієнтів з мікросудинною стенокардією чутливість до різних груп препаратів є надзвичайно варіабельною, тому задовільного контролю симптомів можна досягти лише шляхом оцінки ефективності різних комбінацій препаратів
Лікування вазоспастичної стенокардії
У всіх пацієнтів з вазоспастичною стенокардією слід забезпечити оптимальний контроль ФР, особливо – відмову від куріння – та обов’язково призначити АСК. Потрібно оцінити можливість зв’язку симптомів захворювання з прийомом наркотичних засобів (наприклад, кокаїн або амфетаміни), за наявності такого зв’язку необхідно надати відповідну медичну допомогу. Профілактика нападів вазоспастичної стенокардії, в основному, базується на застосуванні БКК. Призначення БКК у середніх терапевтичних дозах (верапаміл або дилтіазем – 240-360 мг/добу або ніфедипін – 40-60 мг/добу) запобігає виникненню спазму судин приблизно у 90% пацієнтів. Деяким хворим для підвищення ефективності лікування можна рекомендувати нітрати тривалої дії. Запобігти розвитку толерантності до нітратів у таких хворих можна, якщо призначати препарати у той час доби, коли напади стенокардії виникають найчастіше. Потрібно уникати прийому ББ, вони можуть провокувати вазоспазм за рахунок стимуляції α-адренорецепторів при відсутності протидії – вазодилятації, опосередкованої β-рецепторами.
Приблизно в 10 % випадків спазм коронарних артерій резистентний до стандартної терапії, проте, у більшості пацієнтів така резистентність є тимчасовою і короткостроковою. Подолати її, як правило, допомагає призначення БКК і нітратів у дуже високих дозах. В деяких випадках для контролю симптомів, до лікування рекомендується додавати антиадренергічні препарати – гуанетидин або клофелін. Описаний позитивний ефект від проведення ЧКВ з імплантацією стенту в місце спазму (навіть за відсутності гемодинамічно значущого стенозу), та хімічної або хірургічної симпатикотомії, але таке лікування не рекомендується до впровадження у загальну клінічну практику. Через високу частоту безсимптомних епізодів ішемії та можливу наявність аритмії контроль ефективності лікування рекомендується проводити за допомогою 24-годинного амбулаторного моніторингу ЕКГ.
Пацієнтам з ішемією, яка призводить до виникнення небезпечних для життя аритмій, показана імплантація автоматичного кардіовертера-дефібрилятора або кардіостимулятора, особливо у випадках, коли вазоспазм не піддається або недостатньо піддається корекції за допомогою медикаментозної терапії.
13. РЕВАСКУЛЯРИЗАЦІЯ МІОКАРДА
В 2014 році виповнюється 50 років з моменту першого застосування аортокоронарного шунтування (АКШ), яке було проведене в 1964 році. 1 Через тринадцять років було проведене перкутанне коронарне втручання (ПКВ). З тих пір обидва методи реваскуляризації постійно вдосконалювалися, наприклад, при АКШ систематично використовуються артеріальні кондуїти, з’явилися стенти. За цей час ПКВ стало одним з найбільш частих терапевтичних втручань у медицині, помітний прогрес в постійному зменшенні кількості перипроцедурних небажаних явищ і відмінні результати при використанні обох методів. Тим не менш, потрібно розуміти різницю між двома методами реваскуляризації. При АКШ судинний шунт накладають на середні сегменти коронарних судин нижче ураженої ділянки, що надає додаткові джерела для кровообігу до міокарда, а також захищає його від наслідків обструктивної хвороби. Метою встановлення коронарних стентів, навпаки, є відновлення нормального кровообігу нативної судини шляхом місцевого лікування обструктивних уражень без профілактики нового захворювання проксимальніше від стента.
Шкали та стратифікація ризику
Реваскуляризація міокарда доречна, коли очікувана користь у відношенні виживання або клінічних результатів (симптоми, функціональний стан і/або якість життя) перевищує очікувані негативні наслідки даної процедури. Вибір методу втручання (ПКВ або АКШ) має залежати від оцінки відношення ризик-користь цих видів лікування. Потрібно оцінити ризики з позитивними ефектами: ризик перипроцедурної смерті, інфаркту міокарда та інсульту проти позитивного впливу на якість життя, пов’язану з покращенням стану здоров’я, довготривалим звільненням від інфаркту міокарда, повторної реваскуляризації та подовження тривалості життя. Кардіологічна команда (Heart Team, в яку входять кардіологи, інтервенційні кардіологи і кардіохірурги), має враховувати анатомію коронарних артерій, захворювання, вік та супутні захворювання, показання пацієнта та досвід лікарні.
Для виділення груп ризику були розроблені різні моделі, зосереджені на анатомічній комплексності або клінічному ризику, які продемонстрували своє значення під час прийняття клінічних рішень.6 Ці моделі, які найчастіше використовують в клінічних умовах, представлені в Таблиці 31,32 рекомендацій (моделі ризику для оцінки короткотривалих (у стаціонарі – протягом 30 днів) і довготривалих (≥ 1 рік) результатів). Найбільш популярною і розвивається шкалою анатомічної складності коронарної анатомії (а в подальшому і клінічних особливостей) стала шкала SYNTAX.
Шкала SYNTAX (Таблиця 33) була розроблена для оцінки анатомічної складності коронарних уражень у пацієнтів з ураженням стовбура лівої коронарної артерії або трьохсудинного ураження. Шкала була визнана незалежним прогностичним фактором довготривалих тяжких серцево-судинних і цереброваскулярних небажаних явищ у пацієнтів, що проходять ПКВ (але не АКШ).17,18 Вона полегшує вибір оптимального лікування, дозволяючи виявляти пацієнтів з найбільшим ризиком розвитку небажаних явищ, що супроводжують ПКВ. Варіабельність результатів у різних дослідників дослідження SYNTAX (Synergy between Percutaneous Coronary Intervention with TAXUS and Cardiac Surgery) є значною, 19 хоча розробка неінвазивних оцінок може полегшити обчислення оцінки по шкалі SYNTAX.
Клінічна шкала SYNTAX є поєднанням шкал ACEF та SYNTAX. Спочатку вона була розроблена як додаткова модель, в результаті подальшого розвитку логістичної моделі з’явилася більш налагоджена система оцінювання ризику.24
Шкала SYNTAX II є комбінацією анатомічних і клінічних факторів (вік, кліренс креатиніну, функція лівого шлуночка, стать, хронічне обструктивне захворювання легенів, захворювання периферичних судин) і прогнозує смертність у віддаленому періоді у пацієнтів зі складним трьохсудинним ураженням або ураженням головного стовбура лівої коронарної артерії. 25 Вона продемонструвала свою перевагу над звичайною шкалою SYNTAX у питанні вибору між АКШ і ПКВ у дослідженні SYNTAX і надалі була утверджена в реєстрі DELTA стента з медикаментозним покриттям при ураженні стовбура лівої коронарної артерії.9 Для дослідження ASCERT (American College of Cardiology Foundation – Society of Thoracic Surgeons Database Collaboration)26 використовувалися два великих набори даних Національного реєстру серцево-судинних захворювань (NCDR) та STS для розробки декількох моделей для передбачення смертності в різні моменти часу після АКШ і ПКВ. 27, 28
Кількість порівнювальних аналізів цих моделей обмежена, тому що в наявних дослідженнях частіше всього використовуються моделі з оцінкою індивідуального ризику в різних групах популяцій, з різними критеріями ефективності в різний час, і більшість моделей обмежуються одним видом реваскуляризації. Крім того, в дані шкали ризику не включені деякі важливі змінні, такі як уразливість, фізична незалежність і наявність кальцинозу аорти. Ідеальна модель ризик-користь дозволяє порівняти короткотривалий позитивний ефект ПКВ з довготривалим ефектом АКШ. Однак, не дивлячись на те, що моделі оцінки ризику можуть надати важливу інформацію для прогнозування смертності і серйозних небажаних явищ, передбачити, у кого з пацієнтів в результаті покращиться якість життя, таким чином, є неможливим.
Це обмежує можливість рекомендувати одну модель оцінки ризику. Також важливо розуміти, що жодна шкала оцінки не дозволяє точно передбачити явища в окремого пацієнта. Крім того, обмеження існують в усіх базах даних, що використовуються для створення моделі оцінки ризику, різниця у визначеннях і різний зміст можуть впливати на показники шкал при застосуванні в різних популяціях. Нарешті, стратифікація ризику має бути використана як орієнтир, тоді як клінічна оцінка та багатопрофільний діалог (Кардіологічна команда, Heart Team) залишаються необхідною умовою. 25
Таблиця 33. Спосіб розрахунку оцінки за шкалою SYNTAX
13.1 Реваскуляризація при стабільній ішемічній хворобі серця
Обґрунтування доцільності реваскуляризації. Пацієнти зі стабільною ІХС до реваскуляризації повинні отримати оптимальну медикаментозну терапію згідно з рекомендаціями відповідного клінічного протоколу, оскільки доведено, що це позитивно впливає на прогноз захворювання і полегшення симптомів. 47 Стеноз коронарних артерій з порушенням кровотоку може бути показанням до реваскуляризації шляхом ПКВ або АКШ з ціллю зменшення ішемії міокарда та її несприятливих клінічних проявів. 85‒87 Показаннями до реваскуляризації у пацієнтів з ІХС є збереження симптомів незважаючи на медикаментозну терапію та/чи поліпшення прогнозу. 47 Відтак, слід розглядати реваскуляризацію і медикаментозну терапію як стратегії лікування, що доповнюють одне одну, а не конкурують між собою.
Стенокардія супроводжується погіршенням якості життя, зменшенням фізичної витривалості, депресією, а також повторними госпіталізаціями й візитами до поліклініки. 88 Реваскуляризація шляхом ПКВ або АКШ усуває стенокардію, зменшує потребу в застосуванні антиангінальних лікарських засобів, а також підвищує толерантність до фізичних навантажень і якість життя ефективніше за оптимальну медикаментозну терапію (Таблиця 2 веб-додатка). 54, 89‒96
Наявність ішемії впливає на прогноз пацієнтів зі стабільною ІХС, особливо в тих випадках, коли вона виникає при невеликому фізичному навантаженні. 97, 98 Реваскуляризація усуває ішемію міокарда ефективніше за оптимальну медикаментозну терапію. 92,97,99,100 Поширеність, локалізація і тяжкість ураження коронарної артерії, які оцінюють за допомогою коронарографії або КТ-коронарографії, разом з ішемією і функцією лівого шлуночка є важливими факторами, що впливають на прогноз. 101‒103
Доказова база для реваскуляризації. Доказова база для реваскуляризації шляхом ПКВ або АКШ у порівнянні з медикаментозною терапією була зібрана на основі декількох рандомізованих клінічних досліджень (РКД), які підсумовано в Таблиці 5. Важливо зазначити, що найкращі поточні результати ПКВ було отримано при використанні стентів з медикаментозним покриттям (Drug Eluting Stent, DES) та АКШ з максимальним використанням шунтів. Хоча реваскуляризація пов’язана з ризиком розвитку під час операції спонтанного інфаркту міокарда з підвищенням рівня біомаркерів, декілька досліджень вказують на те, що саме підвищення біомаркерів перед операцією ПКВ, а не після неї, є тим фактором, який несприятливо впливає на прогноз. 104 Хоча добре відомо, що спонтанний інфаркт міокарда несприятливим чином впливає на прогноз і пов’язаний зі значною смертністю, останні дослідження говорять про те, що ПКВ пов’язане з меншим ризиком розвитку інфаркту міокарда, ніж медикаментозна терапія. 105
Хоча окремі РКД з подальшим мета-аналізом є найвищою формою доказової медицини, 106‒108 можливості екстраполяції їхніх результатів на клінічну практику дещо обмежені. В більшість РКД включали в основному чоловіків, відносно молодих (за винятком дослідження TIME [Trial of Invasive Medical therapy in the Elderly]), зі збереженою функцією лівого шлуночка і таких, що не проходили реваскуляризацію. Пацієнтів відбирали ретельно, оскільки рандомізацію, як правило, проводили після ангіографічного визначення анатомічного ходу коронарних артерій, не проводячи рутинну оцінку ішемії. В усіх РКД свідомо порівнювались стратегії лікування, які допускають проведення реваскуляризації у випадку погіршення стану пацієнта, який отримує медикаментозну терапію. У результаті доля пацієнтів, яким не проводили реваскуляризацію, протягом періоду спостереження поступово зменшувалась, приховуючи різницю між двома стратегіями і ускладнюючи проведення аналізу залежно від призначеного лікування. Врешті, обмежена тривалість періоду спостереження (як правило, 5 років) не в повній мірі відбиває переваги АКШ, пов’язані з шунтами. Ці переваги з часом зростають, але можуть врешті зійти нанівець через прогресуюче руйнування венозного трансплантата.
Реваскуляризація шляхом перкутанного коронарного втручання. Ефективність поєднання ПКВ з медикаментозною терапією у пацієнтів зі стабільною ІХС розглядалася в декількох РКД, 54, 91, 94 мета-аналізах, 106, 107, 117‒120 і великомасштабних реєстрах. 121 Найважливіші сучасні дослідження та їхні дані наведено в Таблиці 5.
У дослідженні COURAGE (Clinical Outcomes Utilizing Revascularization and Aggressive Drug Evaluation) 91 було рандомізовано 2287 пацієнтів зі стабільною ІХС, із об’єктивними ознаками ішемії міокарда і значним атеросклерозом коронарних артерій, яким проводили тільки медикаментозну терапію, або ПКВ на тлі медикаментозної терапії (з використанням металевого стента без покриття (BMS). Середня тривалість періоду спостереження склала 4,6 років. Протягом цього періоду не було виявлено значної різниці в сумарній частоті виникнення смертей, ІМ та інсульту. Стенокардія значно рідше виникала у пацієнтів з групи ПКВ при спостереженні через 1 рік та через 3 роки, але ця перевага зійшла нанівець через 5 років, коли 21% пацієнтів з групи ПКВ і 33% пацієнтів з групи медикаментозного лікування було проведено додаткову реваскуляризацію (P<0,001). В дослідженні COURAGE тяжкість ІХС була середньою, більшість пацієнтів (70%) початково страждали на легку ішемію, або не мали її зовсім, без порушення функції лівого шлуночка (ЛШ) у більшості з них. 122 Пацієнтів з ураженням стовбура лівої коронарної артерії з дослідження виключили.
Дослідження MASS II (Medical, Angioplasty or Surgery Study II), в якому взяли участь 611 пацієнтів з багатосудинним ураженням, усі з одного і того ж закладу, ‒ це єдине РКД, в якому медикаментозна терапія порівнюється з ПКВ (72% з BMS; 28% тільки з балонною ангіопластикою) і з АКШ.
Через 10 років, при порівнянні медикаментозного лікування з ПКВ, відповідні показники смертності від будь-яких причин дорівнювали 31% і 24,1% (P=0,09), інфаркту міокарда 20,7% і 13,3% (P=0,01) і позбавлення від стенокардії 43% і 59% (P<0,001). 94
У дослідженні FAME-2 (Fractional Flow Reserve versus Angiography for Multivessel Evaluation 2) 54 взяли участь пацієнти з ІХС і щонайменш одним функціонально значним стенозом (фракційний резерв кровотоку ≤0,80), яким випадковим чином призначили оптимальну медикаментозну терапію (МТ) або МТ в комбінації з ПКВ під контролем ФРК. В дослідження планували включити 1632 пацієнти, але комітет з оцінки результатів і безпеки дослідження припинив його достроково, після включення 888 пацієнтів, через те, що первинна кінцева точка (сукупний рівень смертності, інфаркту міокарда й ургентних реваскуляризацій) значно частіше наступала при ПКВ під контролем ФРК; було малоймовірно, що ця різниця нівелюється після включення в дослідження більшого числа пацієнтів. Остаточний аналіз показав, що первинна кінцева точка наступила в 4,3% в групі ПКВ і в 12,7% у групі медикаментозної терапії (P<0,001), але сумарна частота виникнення смертей та ІМ в цих групах не відрізнялись. Інтерпретація результатів дослідження FAME-2 є досить складною, в тому сенсі, що на рішення про ургентну реваскуляризацію може впливати відкритий характер дослідження. Визначення «ургентна реваскуляризація» відповідає критеріям клінічних проявів гострого коронарного синдрому (ГКС) і у 50% пацієнтів, яким було проведено ургентну реваскуляризацію, були наявні симптоми триваючої ішемії.
У більшості мета-аналізів, у яких порівнювались ПКВ і первинна медикаментозна терапія, не було виявлено доказової бази на користь інвазивної стратегії лікування в контексті виживаності чи розвитку інфаркту міокарда. 117, 118, 123, 125 В двох із них повідомлялося про невелику перевагу ПКВ над медикаментозною терапією у відношенні виживаності, але на це могло вплинути включення в дослідження підгрупи пацієнтів, які напередодні (за 4 тижні) пережили інфаркт міокарда. 107, 119 В одному мета-аналізі, обновленому для пізніших РКД, було показано, що у порівнянні з первинною медикаментозною терапією ПКВ не супроводжувалося значним поліпшенням рівня загальної смертності [співвідношення ризику (СР) 0,85; 95% довірчий інтервал (ДІ) 0,71–1,01], смертності від серцево-судинних захворювань (СР 0,71; 95% ДІ 0,47–1,06), інфаркту міокарда (СР 0,93; 95% ДІ 0,70–1,24) або повторної реваскуляризації (СР 0,93; 95% ДІ – 0,76–1,14) протягом коротко- та довгострокового спостереження. 96 В мета-аналізі п’яти РКД, в яких взяли участь 5286 пацієнтів з ішемією, не було виявлено різниці між ПКВ і медикаментозною терапією в контексті смертності, розвитку інфаркту міокарда, незапланованої реваскуляризації або стенокардії протягом середнього періоду спостереження в 5 років. 100
У базі даних «New York State’s Cardiac Diagnostic Catheterization Database», у період між 2003 і 2008 роками було виявлено 9586 пацієнтів, які перенесли ПКВ (n=8486; 89%) або медикаментозну терапію (n=1100; 11%). Порівняння 933 пацієнтів з однаковим коефіцієнтом схильності в кожній групі показало, що через 4 роки в групі ПКВ сумарна частота смертей та ІМ була нижче (16,5% проти 21,2% відповідно; P=0,003), так само як і кожний з цих показників окремо: смертність (10,2% проти 14,5%, відповідно; P=0,02), інфаркт міокарда (8,0% проти 11,3% відповідно; P=0,007).121 Автори застерігають, що ця різниця може частково бути зумовлена відмінностями між тим, як в різних групах використовували оптимальну медикаментозну терапію.
Перкутанне коронарне втручання: стенти з медикаментозним покриттям проти металевих стентів без покриття. Основне обмеження, з яким зіткнулася більшість попередніх порівнянь ‒ це недостатнє використання стентів з медикаментозним покриттям (DES). В декількох мета-аналізах РКД, в яких порівнювались перші покоління DES з металевими стентами без покриття (BMS) повідомляється, що рівні загальної смертності, серцевої смертності й нефатальних інфарктів міокарда не відрізнялись, але при використанні DES спостерігалося 50–70% відносне зменшення ризику (ВЗР) потреби подальшої або повторної реваскуляризації цільової судини (РЦС). 124, 125
DES нового покоління, з тонким каркасом і використанням біосумісних стійких полімерів або полімерів, що біорозсмоктуються і антипроліферативних агентів на основі лімусу, значно ефективніші й безпечніші за BMS і DES попереднього покоління (див. розділ 17). Частота повторної реваскуляризації в порівнянні зі стентами попереднього покоління зменшилась на 10–20%. 126–129 DES нового покоління в порівнянні з металевими стентами без покриття і DES попереднього покоління також мають вищий рівень безпеки, в тому числі стосовно сумарної частоти смертей, ІМ і тромбозів стента. Ряд досліджень свідчить про те, що ризик визначеного або ймовірного тромбозу знижується приблизно на 50% у порівнянні з DES попереднього покоління, особливо протягом пізньої фази. 128–131 Деякі дослідження свідчать про менший ризик тромбозу стента у порівнянні з BMS. 125, 131 Порівняння різнорідних досліджень DES і BMS, яке охоплювало 76 РКД і 117 762 пацієнто-років спостереження, не виявило зниження риску смерті, але виявило 20–25% зниження ризику розвитку ІМ при використанні DES (за винятком стентів з паклітакселем), ніж при використанні стентів без покриття. 132 Рандомізоване дослідження BASKET–PROVE (Basel Stent Kosten Effektivitäts TrialProspective Validation Examination), в якому порівнювали DES з BMS, імплантовані пацієнтам з судинами великого діаметру (>3мм), не виявило суттєвих відмінностей у частоті смертей чи розвитку ІМ між стентами з сіролімусом і еверолімусом та металевими стентами без покриття. Однак ризик серцевої смерті та ІМ при використанні DES був меншим (об’єднані дані DES проти BMS: СР 0,60; 95% ДІ 0,39–0,93; P=0,02) через 2 роки спостереження. 133 Індивідуальний мета-аналіз даних пацієнтів з трьох РКД (всього 1989 пацієнтів), в якому порівнювалось нове покоління стентів з еверолімусом і попереднє покоління стентів з паклітакселем, показав через 3 роки спостереження зниження ризику смерті (3,2% проти 5,1%; відносний ризик (ВР) 0,65; 95% ДІ 0,49–0,86; P=0,003), серцевої смерті або ІМ (4,4% проти 6,3%; ВР 0,70; 95% ДІ 0,54–0,90; P=0,005 і тромбозу стента (0,7% проти 1,7%; ВР 0,45; 95% ДІ 0,26–0,78; P=0,003) при використанні стентів нового покоління. 126 В об’єднаному аналізі даних окремих пацієнтів із 26 РКД, який охоплював 11 557 жінок, через 3 роки було виявлено зниження рівня смертності та частоти ІМ у жінок, яких лікували за допомогою DES нового покоління (9,2%) у порівнянні з DES попереднього покоління (10,9%) і BMS (12,8%; P=0,001). 129 Так само, найнижчий ризик визначеного або ймовірного тромбозу стента був у групі DES нового покоління (1,1%), далі йшли BMS (1,3%) і DES попереднього покоління (2,1%; P=0,01).
Реваскуляризація шляхом аорто-коронарного шунтування. У мета-аналізі семи РКД було встановлено перевагу АКШ над первинною медикаментозною терапією в окремих підгрупах хворих зі стабільною ІХС. 108 Було виявлено, що АКШ підвищує виживаність у пацієнтів зі стенозом стовбура лівої коронарної артерії (ЛКА) або з трьохсудинним ураженням, особливо при залученні проксимального відділу низхідної гілки ЛКА. Цей ефект був сильніше виражений у пацієнтів з тяжкими симптомами, ранніми позитивними результатами тестів навантаження і зниженою функцією лівого шлуночка. Важливо відмітити, що в цих ранніх дослідженнях лише 10% пацієнтів було зроблено маммаро-коронарне шунтування (МКШ), що є важливим прогностичним фактором. Більш того, 40% пацієнтів, які отримували медикаментозну терапію, протягом періоду спостереження перейшли в групу АКШ. В пізнішому мета-аналізі говориться про зниження ризику смерті в групі АКШ у порівнянні з групою медикаментозної терапії (ВР 0,62; 95% ДІ 0,50–0,77). 107
У дослідженні MASS II медикаментозну терапію в довільному порядку порівнювали з ПКВ і АКШ. Через 10 років АКШ у порівнянні з медикаментозною терапією супроводжувалося меншими показниками серцевої смертності, розвитку ІМ та стенокардії. 94 В дослідженні STICH (Surgical Treatment Is Chemic Heart failure) взяли участь 1212 пацієнтів з ІХС та фракцією викиду лівого шлуночка (ФВЛШ) ≤ 35%, яких рандомізували по групах медикаментозної терапії та АКШ. Пацієнтів з ураженням стовбура ЛКА було виключено із дослідження. Наприкінці періоду спостереження 17% пацієнтів, які отримували медикаментозну терапію, було проведено АКШ і 6% пацієнтів ‒ ПКВ. В аналізі залежно від призначеного лікування загальна смертність в групі АКШ не була значно нижчою, ніж в групі МТ (36% проти 41%; ВР 0,86; 95% ДІ 0,71–1,04; P=0,12). Однак серед пацієнтів з АКШ рівень загальної смертності чи госпіталізації за серцево-судинними причинами був нижчий, ніж в групі МТ (58% проти 68%; ВР 0,74; 95% ДІ 0,64–0,85; P<0,001). Вторинні клінічні наслідки також свідчили на користь АКШ. Крім того, при АКШ знижувався ризик первинного результату, смерті, в аналізі «по факту лікування» (ВР 0,70; 95% ДІ 0,58–0,84; Р<0,001). 112
/113/tab33_2.jpg)
Перкутанне коронарне втручання проти аорто-коронарного шунтування. Велика кількість досліджень, в яких порівнюються ці два методи реваскуляризації, свідчить, що ані ПКВ, ані АКШ не може стати методом вибору для всіх пацієнтів з ІХС, які потребують реваскуляризації. Однак АКШ забезпечує повнішу реваскуляризацію, ніж ПКВ, а встановлення обхідних шунтів на середні гілки коронарних артерій знижує вплив ураження проксимальних гілок, особливо у випадках хронічних проксимальних оклюзій. Дані РКД, в яких порівнювались АКШ і ПКВ, підсумовано в Таблиці 6.
/113/tab34.jpg)
/113/tab35.jpg)
Ураження проксимального відділу низхідної гілки ЛКА. У двох мета-аналізах (один з яких включав 9 РКД із залученням 1210 пацієнтів з ізольованим ураженням проксимального відділу низхідної гілки ЛКА, період спостереження складав до 5 років, 160 а інший включав 6 РКД і два нерандомізованих дослідження, всього 1952 пацієнти з ізольованим ураженням проксимального відділу низхідної гілки ЛКА, період спостереження складав до 4 років) 161 не було виявлено статистично значущих відмінностей в рівні смертності, частоті розвитку ІМ чи інсульту, але було відмічено трьохкратне підвищення частоти рецидивуючої стенокардії і п’ятикратне зростання частоти повторної реваскуляризації при ПКВ у порівнянні з АКШ. В більшості досліджень, про які говориться вище, використовували BMS, в той час як впровадження DES значно знизило риск повторної реваскуляризації. Так само, тільки в невеликій кількості досліджень пацієнтів з ізольованим ураженням проксимального відділу низхідної гілки ЛКА говориться про довгострокові результати, хоча проходимість внутрішньої грудної артерії на ангіографії через 20 років періоду спостереження складала >90%. Більш того, підвищення рівня виживаності при односторонньому маммаро-коронарному шунтуванні у пацієнтів, що страждають ІХС з багатосудинним ураженням, про яке повідомили через 10 років періоду спостереження, тепер продовжено до 20 і 30 років, особливо при двохсторонньому МКШ. 162–165
Ураження стовбура лівої коронарної артерії. Протягом декількох десятків років АКШ розглядалося як стандарт лікування значної оклюзії стовбура ЛКА у пацієнтів, в яких можна виконувати оперативне втручання. Це положення в основному ґрунтувалось на реєстрі CASS (Coronary Artery Surgery Study). 108 Вважалося, що ймовірність успіху ПКВ при ураженні стовбура ЛКА знижують дві важливі патофізіологічні риси цієї патології: (і) у 80% пацієнтів стеноз стовбура ЛКА розповсюджуються на біфуркацію, що, як відомо, підвищує ризик повторного стенозу; (іі) у 80% пацієнтів стеноз стовбура ЛКА також страждають на багатосудинне ураження, при якому АКШ підвищує виживаність незалежно від наявності ураження стовбура ЛКА. 159, 166, 167
Однак, пізніше отримані дані свідчать про те, що при нетяжкій оклюзії стовбура ЛКА результати ПКВ принаймні аналогічні результатам АКШ (щонайменш протягом п’ятирічного періоду спостереження). Дослідження SYNTAX включало аналіз обмеженої потужності у заздалегідь визначених підгрупах. В дослідженні взяли участь 705 пацієнтів, переважно з дистальною оклюзією стовбура ЛКА, яких було рандомізовано в групи АКШ і ПКВ. Частота розвитку первинної кінцевої точки ‒ основних небажаних серцевих і цереброваскулярних явищ (сукупність смертей, ІМ, ГПМК і повторних реваскуляризацій) ‒ при обох цих методах протягом одного року суттєво не відрізнялась (АКШ 13,7% проти ПКВ 15,8%; P=0,44). 168
Через п’ять років спостереження не було виявлено статистично значної різниці в частоті випадків смерті (АКШ=14,6% проти ПКВ=12,8%; P=0,53) та ІМ (АКШ=4,8% проти ПКВ=8,2%; P=0,10), однак при АКШ зростав ризик ГПМК (4,3% проти 1,5%; P=0,03), але знижувався ризик повторної реваскуляризації (15,5% проти 26,7%; P<0,001) при відсутності значних відмінностей в показниках основних небажаних серцевих і цереброваскулярних явищ в цілому (31,0% проти 36,9%; P=0,12).17, 169 В двох нижніх терцилях частоту розвитку основних небажаних серцевих і цереброваскулярних явищ в групах ПКВ і АКШ можна було порівняти (0–22: 30,4% проти 31,5%; P=0,74) і (23–32; 32,7% проти 32,3%; P=0,88) відповідно. У пацієнтів зі значенням індексу SYNTAX >32 АКШ знижувало смертність (14,1% проти 20,9%; P=0,11) і значно знижувало потребу в реваскуляризації (11,6% проти 34,1%; P<0,001), хоча і підвищувало ризик порушення мозкового кровообігу (4,9% проти 1,6%; P=0,13).
У дослідженні PRECOMBAT (Premier of Randomized Comparison of Bypass Surgery vs. Angioplasty Using Sirolimus-Eluting Stent in Patients with Left Main Coronary Artery Disease) 600 пацієнтів з ураженням стовбура ЛКА було рандомізовано в групи ПКВ і АКШ. 159 Первинна кінцева точка (смерть, ІМ, ГПМК та реваскуляризація внаслідок ішемії впродовж 12 місяців) виникла у 6,7 % осіб з групи АКШ і 8,7% ‒ з групи ПКВ (P=0,37). Сумарний показник смертей, ІМ та ГПМК протягом одного року склав 4,0% для АКШ і 3,3% для ПКВ (P=0,66). Відсутність значних відмінностей між двома групами зберігалася більше 2 років з моменту рандомізації і також розповсюджувалась на смертність (3,4% в групі АКШ і 2,4% в групі ПКВ; P=0,45), а також для сумарного показника смертей, ІМ та ГПМК (4,4% в групі АКШ і 4,7% в групі ПКВ; P=0,83). На відміну від дослідження SYNTAX, частота розвитку ГПМК в групах ПКВ (0,4%) і АКШ (0,7%) суттєво не відрізнялась.
/113/tab36.jpg)
BMS=металевий стент без покриття, АКШ – аорто-коронарне шунтування, БСУ – багатосудинне ураження, ІМ – інфаркт міокарда, р. – роки, Рев. – реваскуляризація, PES – стент, покритий паклітакселем, SES – стент, покритий сіролімусом
а P<0,05
b Не менша ефективність досліджуваного методу
c Не менша ефективність досліджуваного методу відсутня.
Включено лише дослідження зі щонайменш 100 пацієнтами в групі лікування. Надаються середні значення віку і фракції викиду.
У мета-аналізі 170 було об’єднано результати трьох РКД, присвячених порівнянню ПКВ і АКШ при ураженні стовбура ЛКА 158, 159, 171 і одної підгрупи з ураженням стовбура ЛКА, попередньо відібраної з найбільшого РКД. 168 Всього в цьому мета-аналізі було оцінено результати лікування 1611 пацієнтів через 12 місяців від початку. Сумарний показник смертей, ІМ, ГПМК чи повторної реваскуляризації в цільовій судині склав 11,8% в групі АКШ і 14,5% в групі ПКВ (P=0,11). Сумарний показник смертей, ІМ та ГПМК склав 6,8% в групі АКШ і 5,3% в групі ПКВ (P=0,26). У той час як не спостерігалося значних відмінностей в показниках смертності (4,1% в групі АКШ і 3,0% в групі ПКВ (P=0,29) чи ІМ (2,8% в групі АКШ і 2,9% в групі ПКВ (P=0,95), частота ГПМК в групі АКШ була вище (1,7% проти 0,1%; P=0,01), а повторних реваскуляризацій ‒ нижче (5,4% проти 11,4%; P<0,001).
У реєстрі ASAN-MAIN зіставлялись результати лікування пацієнтів з ураженням стовбура ЛКА, яким проводили ПКВ або АКШ протягом одного й того ж періоду. Результати двох аналізів, ‒ в одному оцінювались результати ПКВ з BMS у 100 пацієнтів і АКШ у 250 пацієнтів через 10 років, а в другому ‒ результати ПКВ з DES у 176 пацієнтів і АКШ у 219 пацієнтів через 5 років, ‒ показали відсутність значних відмінностей між двома методами в показниках смертності та сукупності смертей, ІМ і ГПМК. В обох порівняннях ризик повторної реваскуляризації при АКШ був менший. 172 В реєстрі з 810 пацієнтів із ураженням стовбура ЛКА, яким проводили АКШ (335 пацієнтів) або ПКВ (475 пацієнтів), який вели паралельно з РКД, не було виявлено значних відмінностей між двома підходами до лікування в показнику сукупних смертей, ІМ так ГПМК через 2 роки, в той час як при АКШ ризик повторного втручання був значно нижчим. 159
Трьохсудинне ураження вінцевих артерій. У мета-аналізі, заснованому на індивідуальних даних пацієнтів з РКД, які проводились до впровадження DES, повідомляється про відсутність відмінностей в показниках смертності між групами ПКВ і АКШ, хоча у пацієнтів з цукровим діабетом і хворих віком ≥65 років рівень смертності після АКШ був нижчим. 106 У мета-аналізі шести рандомізованих досліджень, в яких взяли участь 6055 пацієнтів, АКШ порівнювалося з ПКВ (балонна ангіопластика, BMS і DES), при цьому було виявлене значне зниження рівня смертності (ВР 0,73; 95% ДІ 0,62–0,86), частоти ІМ (ВР 0,58; 95% ДІ 0,48–0,72) і повторної реваскуляризації (ВР 0,29; 95% ДІ 0,21–0,41) при АКШ. 173 При АКШ була виявлена тенденція до поширених ГПМК (ВР 1,36; 95% ДІ 0,99–1,86; P=0,06). Дані декількох РКД і мета-аналізів вказують на те, що АКШ пов’язане з більшим ризиком ГПМК, ніж ПКВ, при довготривалому спостереженні ця різниця зменшується. 174, 175
У дослідженні SYNTAX 1800 пацієнтів з ураженням стовбура ЛКА та/чи трьохсудинним ураженням було рандомізовано по групах АКШ та ПКВ зі стентом, покритим паклітакселем. 157 Первинна кінцева точка (основні небажані серцеві та цереброваскулярні явища [MACCE]) на першому році виникла у 12,4% пацієнтів з групи АКШ та 17,8% пацієнтів з групи ПКВ (P=0,002). Через 5 років в групі АКШ у порівнянні з ПКВ первинна кінцева точка спостерігалася значно рідше, сумарно 26,9% проти 37,3% (P<0,001), загинуло 11,4% проти 13,9% (P=0,10) пацієнтів, ІМ розвинувся у 3,8% проти 9,7% (P<0,0001, ГПМК у 3,7% проти 2,4% (P=0,09) і 13,7% проти 25,9% (P<0,0001) потребували повторної реваскуляризації. 17 У 1095 пацієнтів з трьохсудинним ураженням, АКШ у порівнянні з ПКВ призвело до меншого проценту смертей (9,2% проти 14,6%; P=0,006), кардіальних смертей (5,3% проти 9,0%; P=0,003), інфарктів міокарда (3,3% проти 10,6%; P<0,001) і повторних реваскуляризацій (12,6% проти 25,4%; P<0,001). 176 У пацієнтів з низьким індексом SYNTAX (0‒22), показники для АКШ і ПКВ не відрізнялись (26,8% проти 33,3%; P=0,21). Навпаки, в порівнянні з ПКВ в групі пацієнтів з середніми і високими індексами SYNTAX, при АКШ частота MACCE була нижчою (22,6% проти 37,9%; P=0,0008 і 24,1% проти 41,9%; P=0,0005, відповідно), в тому числі окремо смертність, ІМ і повторна реваскуляризація. 176 Слід відмітити, що пацієнти, яких внесли в реєстр АКШ дослідження SYNTAX через неможливість провести їм ПКВ, мали нижчі показники MACCE, ніж рандомізована когорта АКШ (23,3% проти 26,9% відповідно), що потенційно може бути пов’язано з повнішим об’ємом реваскуляризації (76% проти 63% відповідно). 17
В обсерваційному дослідженні, заснованому на реєстрі штату Нью-Йорк (New York State registry), оцінювались пацієнти з ІХС, яким провели або тільки шунтування (13 212 пацієнтів) або ПКВ з DES (20 161 пацієнт) між 2003 і 2005 роками, приділяючи особливу увагу 5-річній виживаності. 177 Різниця в абсолютній виживаності серед всіх пацієнтів була невеликою (78,5% при АКШ проти 76% при ПКВ). Основний аналіз було проведено після зіставлення коефіцієнтів схильності у 8121 парах пацієнтів з 5-річною виживаністю в 80,4% при АКШ і 73,6% при ПКВ з DES (ВР 0,71; 95% ДІ 0,67–0,77; P<0,001). В усіх підгрупах, крім пацієнтів з двохсудинним ураженням проксимального відділу низхідної гілки ЛКА, було відмічено нижчий ризик смерті. Треба підкреслити два основних висновки цього дослідження: (і) наявність ураження низхідної гілки ЛКА підвищувала виживаність в групі АКШ, (іі) підвищення виживаності в групі АКШ ставало очевидним тільки в другій половині 5-річного періоду спостереження. В реєстрі елективних пацієнтів ASCERT, в який входять пацієнти старше 65 років з двох- та трьохсудинним ураженням, 86 244 пацієнтам було проведено АКШ і 103 549 пацієнтам ‒ ПКВ (78% ‒ з DES попереднього покоління).
/113/tab37.jpg)
При використанні коефіцієнтів схильності і поправки зворотньої ймовірності, рівень смертності через 4 роки (але не через 1 рік) в групі АКШ виявився нижчим, ніж в групі ПКВ (16,4% проти 20,8%; СР 0,79; 95% ДІ 0,76‒0,82). 26 Обсерваційний характер досліджень не дозволяє оцінити спосіб, яким було відібрано пацієнтів для того чи іншого методу лікування, і, окрім статистичних поправок, також не можна виключити вплив залишкових факторів. Використовувались DES попереднього покоління, які не мають переваг стентів нового покоління. 125‒131, 133 Висновки щодо переваг у виживаності, які дає АКШ у порівнянні з ПКВ, виділяються помітною послідовністю.
Реконструкція шлуночка Мета хірургічної реконструкції шлуночка (ХРШ) полягає у видаленні рубцевої тканини зі стінки ЛШ за допомогою ендовентрикулопластики з використанням внтурішньошлуночкової латки, що тим самим дозволяє відновити фізіологічний об’єм ЛШ, і у відновленні еліптичної, а не сферичної форми. Рішення про додаткове проведення ХРШ разом з АКШ має ґрунтуватися на ретельній оцінці симптомів (симптоми серцевої недостатності повинні мати пріоритет над проявами стенокардії), вимірюванні об’єму ЛШ і оцінці ступеня трансмурального рубцювання тканини міокарда, і повинна проводитися тільки в центрах з високим рівнем хірургічного досвіду. У дослідженні STICH не вдалося показати різницю у первинній кінцевій точці (смерть з будь-яких причин або госпіталізація з приводу серцевої причини) між АКШ та комбінованою процедурою (АКШ і ХРШ). Зниження індексу кінцево-систолічного об’єму у дослідженні STICH – менше, ніж у більш ранніх експериментальних дослідженнях лікування великих аневризм – може пояснити суперечливі дані і, таким чином, значення обґрунтованої ХРШ може бути недооцінене. 291, 292 Аналіз підгруп дослідження STICH показує, що пацієнти з менш дилатованим ЛШ і більшою ФВЛШ можуть отримати хороший клінічний ефект від ХРШ, в той час як пацієнтам з розширеним ЛШ і меншою ФВЛШ ця процедура може гірше навіть зашкодити. 293 У дослідженні STICH післяопераційний індекс кінцевого систолічного об’єму лівого шлуночка (LVESVI) 70 мл/м2 або нижче, після АКШ в поєднанні з ХРШ, асоціювався з підвищенням виживаності в порівнянні з самим АКШ. В іншому дослідженні, у пацієнтів, які перенесли АКШ і ХРШ, післяопераційний LVESVI менше 60 мл/м2 був пов’язаний з поліпшенням виживаності в порівнянні з післяопераційним LVESVI ≥ 60 мл/м2. 294 У деяких пацієнтів з великими аневризмами, які були б виключені з дослідження STICH (через гостру серцеву недостатність, інотропну підтримку або порушення інших критеріїв включення), хірургічна реконструкція шлуночка продемонструвала сприятливі результати, хоча і за відсутності компаратора методу лікування для порівняння. 295
13.2 Реваскулярізація у пацієнтів з цукровим діабетом
Дані рандомізованих досліджень реваскуляризації у пацієнтів з цукровим діабетом підсумовані у Таблиці 38. За додатковою інформацією щодо цукрового діабету ми звертались до рекомендацій ESC з діагностики та лікування цукрового діабету. 84 Пацієнти з цукровим діабетом, яким проводиться реваскуляризація шляхом АКШ чи ПКВ, мають вищий ризик пошкодження нирок в порівнянні з пацієнтами без цукрового діабету.
Дослідження реваскуляризації за допомогою шунтування у пацієнтів з цукровим діабетом 2 типу (Bypass Angioplasty Revascularization Investigation 2 Diabetes, BARI-2D) прицільно вивчало питання реваскуляризації міокарда у пацієнтів з цукровим діабетом та стабільною ІХС. 334 Загалом 2368 пацієнтів з цукровим діабетом та ознаками ішемії, або з симптомами стенокардії за наявності ангіографічно визначеної стабільної ІХС, були рандомізовані на медикаментозну терапію чи проведення реваскуляризації міокарда у доповнення до медикаментозної терапії. До проведення рандомізації відповідальні лікарі розподілили пацієнтів по групах реваскуляризації за допомогою ПКВ або АКШ згідно з показаннями. Цільова чисельність пацієнтів у дослідженні в 2800 осіб не була досягнута, тому період подальшого спостереження довелося збільшити з 1,5 до 5,3 року. З дослідження виключались пацієнти з ураженням стовбура ЛКА, нестабільні пацієнти з потребою у невідкладній реваскуляризації, пацієнти з рівнем креатиніну >2,0 мг/дл чи помірною та тяжкою серцевою недостатністю. Первинною кінцевою точкою була смертність з будь-якої причини, головна вторинна комбінована кінцева точка включала смерть, інфаркт міокарда чи інсульт (MACCE). Використання DES (35%) було низьким та обмежувалось пристроями ранніх поколінь. Загалом 42% пацієнтів в групі медикаментозної терапії протягом періоду подальшого спостереження перенесли клінічно показану реваскуляризацію.
Виживаність через 5 років не відрізнялась у групах медикаментозної терапії та реваскуляризації, також не було відмінностей у MACCE (Таблиця 38). В групі ПКВ не було відмінностей у наслідках при проведенні ПКВ чи медикаментозної терапії. У групі АКШ, що включала пацієнтів з більш важкою ІХС, відсутність MACCE була достовірно вищою при проведенні реваскуляризації порівняно із медикаментозною терапією. 334 Незважаючи на це, виживаність достовірно не відрізнялась, що може відображати значимість факту вірогідного подальшого проведення реваскуляризації пацієнтам в групі медикаментозної терапії при наявності більш виражених порушень перфузії міокарда чи зниженні функції ЛШ. 335 У порівнянні з медикаментозною терапією, проведення реваскуляризації при 3-річному періоді подальшого спостереження характеризувалось нижчою частотою прогресування стенокардії (8% проти 13% відповідно; P<0,001), розвитку стенокардії, що виникла вперше (37% проти 57% відповідно; P<0,001) та випадків повторної коронарної реваскуляризації (18% проти 33% відповідно; P<0,001), а також вищою частотою відсутності приступів стенокардії (66% проти 58% відповідно; P<0,003).
Дослідники припускають, що перевага АКШ над медикаментозною терапією виникла внаслідок надання пріоритету АКШ перед ПКВ у пацієнтів з більш важкою ІХС. В подальшому це було обґрунтовано в дослідженні впливу ангіографічної (бал за шкалою BARI-2D) оцінки ризику на наслідки. 5-річний ризик смерті, інфаркту міокарда чи інсульту був достовірно нижчим серед пацієнтів з групи АКШ з високим ангіографічним ризиком та підсилювався у пацієнтів, направлених на реваскуляризацію, порівняно із медикаментозною терапією (24,8% проти 36,8% відповідно; P=0,005). 336
Види реваскуляризації міокарда. Наявність цукрового діабету визначає стратегію лікування для важливої підгрупи пацієнтів з множинним ураженням судин при ІХС.
Рандомізовані клінічні дослідження. Дослідження майбутньої оцінки реваскуляризації у пацієнтів з цукровим діабетом (Future Revascularization Evaluation in Patients with Diabetes Mellitus, FREEDOM) є єдиним рандомізованим дослідженням достатньої потужності, у котрому порівнюється АКШ та ПКВ з використанням DES ранніх поколінь (94%) у пацієнтів з цукровим діабетом при селективній реваскуляризації з приводу множинного ураження судин за відсутності стенозу стовбура ЛКА. 175 За період з 2005 по 2010 рік були оглянуті 33 966 пацієнтів, 3309 з котрих відповідали критеріям включення та 1900 (6%) з котрих прийняли участь у дослідженні. Середній бал за шкалою SYNTAX складав 26±9.
Частота таких первинних наслідків, як смерть з будь-якої причини, нефатальний інфаркт міокарда чи інсульт, була нижчою у групі АКШ порівняно із групою ПКВ, розходження кривих починалось через 2 роки. Різниця обумовлювалась сумнівним зниженням рівня смертності з усіх причин (P=0,049) та значно нижчою частотою інфаркту міокарда в групі АКШ (P=0,001). Навпаки, в групі АКШ подвоювалась частота інсульту (P=0,03). Перевага АКШ над ПКВ була постійною в усіх заздалегідь визначених підгрупах, включаючи бал SYNTAX, єдиним виключенням було те, що пацієнти за межами США (n=1130) мали менш виражену відносну користь порівняно із пацієнтами у США (n=770) (P=0,05 для кореляції). 175 При деталізованій оцінці якості життя було виявлено значне та тривале покращення в стані серцево-судинного здоров’я як в групі ПКВ, так і в групі АКШ. Протягом першого місяця після лікування ПКВ приводило до більш швидкого покращення стану здоров’я та якості життя; в період від 6 місяців до 2 років ситуація змінювалась на користь АКШ, через 2 роки відмінності зникали. 344
/113/tab38.jpg)
BMS=металевий стент без покриття; АКШ=аортокоронарне шунтування; СС=серцево-судинний; DES=стент з медикаментозним покриттям; ФВ=фракція викиду; ІМ=інфаркт міокарда; МТ=медикаментозна терапія; БСУ=багатосудинне ураження; ПКВ=перкутанне коронарне втручання; PES=стент, що виділяє паклітаксел; Реваск.=реваскуляризація; SES=стент, що виділяє сиролімус; Sx-бал=оцінка по шкалі SYNTAX; р.=роки.
a P<0,05.
b Рандомізація згідно виду реваскуляризації.
c Захворювання трьох судин.
d Аналіз підгруп.
Вік та фракція викиду подані як середні величини.
Тим не менше, незрозуміло, чи проводився аналіз оцінки по шкалі SYNTAX осліпленою центральною лабораторією, що є важливим для відтворюваності результатів. Слід зазначити, що оцінка по шкалі SYNTAX почала використовуватись у ході дослідження FREEDOM і не зазначена в протоколі цього дослідження. 345 Таким чином достовірність спостереження про більш сприятливі наслідки після проведення АКШ порівняно із ПКВ, не беручи до уваги оцінку по шкалі SYNTAX, є суперечливою і не відповідає даним відносно підгрупи пацієнтів з цукровим діабетом у дослідженні SYNTAX. Підвищений ризик інсульту підіймає питання щодо вибору стратегії лікування, особливо у пацієнтів похилого віку. Також слід зазначити, що середня тривалість періоду подальшого спостереження складала 3,8 року, але тільки 23% пацієнтів входили в групу ризику через 5 років.
У підгрупі пацієнтів з цукровим діабетом та множинним ураженням судин при ІХС у дослідженні SYNTAX, що складалась з 452 осіб, через 5 років не було значущих відмінностей у комбінованій кінцевій точці, що включала смерть з будь-якої причини, інфаркт міокарду чи інсульт (АКШ 19,1% проти ПКВ 23,9%; P=0,26), чи в окремих складових, таких як смерть з будь-якої причини (P=0,07), інсульт (P=0,34), чи інфаркт міокарда (P=0,20). 346 Тим не менш, потреба в проведенні повторної реваскуляризації рідше виникала в групі АКШ (P<0,001). Серед пацієнтів з низькою оцінкою по шкалі SYNTAX (≤ 22 балів) частота виникнення MACCE була однаковою для АКШ та ПКВ (33,7% проти 42,5% відповідно; P=0,38), однак потреба в проведенні повторної реваскуляризації частіше виникала в групі ПКВ (18,5% проти 38,5% відповідно; P=0,01). Цікаво, що в дослідженні SYNTAX цукровий діабет не виступав в ролі незалежного предиктора несприятливих наслідків, оскільки оцінку по шкалі SYNTAX було включено до мультиваріабельної моделі. 25
У дослідженні реваскуляризації коронарних артерії при цукровому діабеті (Coronary Artery Revascularization in Diabetes, CARDia) 510 пацієнтів з цукровим діабетом та множинним чи складним ізольованим ураженням судин при ІХС з 24 різних локалізацій були рандомізовані на проведення АКШ чи ПКВ з використанням BMS або DES та рутинним призначенням абциксімабу. Відмінностей між АКШ та ПКВ щодо первинної кінцевої точки, яка включала смерть, інфаркт міокарда чи інсульт протягом 1 року, не було. 347 При порівнянні підгрупи пацієнтів, яким було встановлено DES, рівні первинних наслідків складали 12,4% в групі АКШ та 11,6% в групі ПКВ (ВР 0,93; 95% ДІ 0,51–1,71; P=0,82). Повторна реваскуляризація частіше проводилась у пацієнтів після ПКВ (P<0,001), тоді як інсульти у цій групі пацієнтів виникали рідше (P=0,07).
Таким чином, беручи до уваги нещодавно отримані дані, АКШ є втручанням вибору для реваскуляризації пацієнтів з цукровим діабетом та множинним ураженням судин при ІХС; тим не менш, можна розглядати ПКВ як альтернативний спосіб лікування для пацієнтів з цукровим діабетом, множинним ураженням судин та низькою оцінкою по шкалі SYNTAX (≤ 22 балів).
Мета-аналіз даних 10 РКД селективної реваскуляризації міокарда 106 підтверджує перевагу АКШ над ПКВ щодо виживання у пацієнтів з цукровим діабетом, тоді як для пацієнтів без діабету відмінностей не було; важливою була взаємодія між наявністю цукрового діабету та видом реваскуляризації. У цьому сукупному аналізі ПКВ проводилось шляхом балонної ангіопластики чи постановки BMS. Більш новий мета-аналіз, що стосувався пацієнтів з цукровим діабетом після АКШ чи ПКВ з 80% і більше артеріальних анастомозів або стентів (BMS та DES ранніх поколінь), продемонстрував достовірно нижчий рівень смертності через 5 років чи при довшому періоді подальшого спостереження при проведенні АКШ (ВР 0,67; 95% ДІ 0,52–0,86; P=0,002). 349 З іншого боку, цей сукупний аналіз продемонстрував підвищений рівень інсульту при проведенні АКШ в порівнянні з ПКВ при 5-річному періоді подальшого спостереження (ВР 1,72; 95% ДІ 1,18–2,53; P=0,005). Аналогічним чином, мета-аналіз, що був обмежений чотирма РКД за участі 3052 пацієнтів, у котрих порівнювали ПКВ з використанням DES ранніх поколінь та АКШ у пацієнтів з цукровим діабетом та множинним ураженням судин при ІХС, продемонстрував вищий ризик смерті та інфаркту міокарда при реваскуляризації за допомогою DES ранніх поколінь (ВР 1,51; 95% ДІ 1,09–2,10; P=0,01), але нижчий ризик інсульту (2,3% проти 3,8%; ВР 0,59; 95% ДІ 0,39–0,90; P=0,01). 350 Аналіз чутливості виявив, що перевага АКШ над DES ранніх поколінь щодо кінцевої точки (MACCE) була більш вираженою у пацієнтів з високою оцінкою по шкалі SYNTAX, але не була значущою у пацієнтів з низьким балом по шкалі SYNTAX. Всі РКД продемонстрували більш високу частоту втручань для повторної реваскуляризації у пацієнтів з цукровим діабетом при проведенні ПКВ порівняно з АКШ. 106,346
Реваскуляризація за допомогою перкутанного коронарного втручання. В ході об’єднаного мережевого мета-аналізу було проведено порівняння DES з BMS у 3852 пацієнтів з цукровим діабетом. 351 Потреба в повторній реваскуляризації після виникнення стенозу була значно нижчою при використанні DES порівняно з BMS (ВР 0,29 для стента, що виділяє сиролімус; 0,38 для стента, що виділяє паклітаксел). У більш новому порівнянні 42 досліджень з комбінованим лікуванням, що включало 22 844 пацієнто-роки подальшого спостереження, оцінювалась ефективність та безпечність кількох DES ранніх і нових поколінь та BMS у пацієнтів з цукровим діабетом. У порівнянні з BMS, усі DES продемонстрували на 37–69% нижчий рівень РЦС. При використанні будь-якого DES у пацієнтів з цукровим діабетом не було відмінностей у частоті смерті, інфаркту міокарда чи тромбозу стента порівняно із BMS.352 Немає переконливих даних про перевагу використання у пацієнтів з діабетом будь-якого DES перед іншим.
Реваскуляризація за допомогою аорто-коронарного шунтування. Не існує чітких рандомізованих даних на користь або проти створення у пацієнтів з цукровим діабетом анастомозу з однією внутрішньою грудною артерією (ВГА) порівняно із двома. Вірогідне підвищення ризику розвитку глибоких грудинних раневих ускладнень при використанні обох ВГА все ще є предметом обговорення, хоча пацієнти з цукровим діабетом мають особливу схильність до розвитку грудинних інфекційних ускладнень при двосторонніх втручаннях на ВГА. Тим не менш, дані обсерваційних досліджень з періодами подальшого спостереження до 30 років вказують на покращення довгострокових наслідків при двосторонніх втручаннях на ВГА. 23, 24 До отримання довгострокових результатів рандомізованого дослідження артеріальної реваскуляризації (Arterial Revascularisation Trial, ART) 353 залишається неясним питання про отримання кращих наслідків при створенні двосторонніх анастомозів з ВГА, проте загальна виживаність при створенні двосторонніх анастомозів з ВГА не залежала від наявності цукрового діабету. 354 В недавно проведеному аналізі не зафіксовано значущого зв’язку з цукровим діабетом при більш ніж 15-річному періоді подальшого спостереження після створення декількох артеріальних шунтів. 355 Дійсно, альтернативні методики, включаючи використання променевої артерії у пацієнтів з надзвичайно високим ризиком стернальних ускладнень (наприклад, у пацієнтів з ожирінням), протягом періоду подальшого спостереження довели свою безпечність та спроможність подовжити строки життя порівняно з використанням венозних шунтів.356
Антитромбоцитарна фармакотерапія. Немає необхідності в зміні антитромбоцитарної фармакотерапії у пацієнтів з цукровим діабетом та без цього захворювання при проведенні реваскуляризації. Хоча в більш ранніх дослідженнях без супутнього використання тієнопіридинів був помічений зв’язок між цукровим діабетом та ефективністю інгібіторів ГП IIb/IIIa, більш нове дослідження раннього пригнічення ГП IIb/IIIa при гострому коронарному синдромі без елевації сегмента ST (Early glycoprotein IIb/IIIa inhibition in non-ST-segment elevation acute coronary syndrome, EARLY-ACS) не підтвердило цих даних. 357 Беручи до уваги поточне використання пероральних інгібіторів P2Y12, додавання інгібіторів ГП IIb/IIIa у пацієнтів з цукровим діабетом не приносить особливої користі.
Протидіабетичні препарати. Було проведено лише декілька спеціальних досліджень протидіабетичних препаратів у пацієнтів, направлених на реваскуляризацію міокарда.
Метформін. Беручи до уваги ризик розвитку лактоацидозу у пацієнтів при отриманні йодованих контрастних речовин, загальною рекомендацією є припинення прийому метформіну до проведення ангіографії або ПКВ та його повторне призначення через 48 годин потому за умови нормальної роботи нирок. Період напіввиведення метформіну складає 6,2 години; тим не менш, немає переконливих даних для подібної рекомендації. Перевірка функції нирок після ангіографії у пацієнтів, що приймають метформін, та відмова від препарату при порушенні ниркової функції може бути прийнятною альтернативою автоматичній відміні метформіну. У пацієнтів з нирковою недостатністю слід відмінити метформін до проведення втручання. Загальноприйняті показники метформін-індукованого лактоацидозу включають pH артеріальної крові <7,35, рівень лактату крові >5 ммоль/л (>45 мг/дл) та таку концентрацію метформіну, що може бути визначена у плазмі крові. Важливими заходами для швидкого одужання є ретельне розпізнавання метформін-індукованого лактоацидозу та відповідний початок гемодіалізу.
Інші препарати. Дані обсерваційних досліджень викликали занепокоєння щодо використання препаратів сульфонілсечовини у пацієнтів, яким провели первинне ПКВ при гострому інфаркті міокарда. Подібна думка не отримала підтвердження в ході ретроспективного аналізу дослідження інфузій інсуліну та глюкози при гострому інфаркті міокарда (Diabetes, Insulin Glucose Infusion in Acute Myocardial Infarction, DIGAMI-2), хоча в даному дослідженні число пацієнтів, яким провели ПКВ, було малим. 358 Аритмії та ішемічні ускладнення також зустрічались рідше у пацієнтів, які приймають гліклазид чи глімепірид. 359 Тіазолідиндіони можуть асоціюватись з нижчою частотою розвитку рестенозу після проведення ПКВ з BMS, 360 але підвищувати ризик розвитку серцевої недостатності за рахунок затримки нирками води.
Жодне з досліджень не продемонструвало покращення наслідків проведення ПКВ після STEMI при призначенні інсуліну чи суміші глюкоза-інсулін-калій. Обсерваційні дані пацієнтів, яким проводили АКШ, свідчать на користь того, що постійна внутрішньовенна (в/в) інфузія інсуліну з метою досягнення помірно жорсткого глікемічного контролю (6,6–9,9 ммоль/л або 120–180 мг/дл) незалежно асоціюється з нижчим рівнем смертності та серйозних ускладнень порівняно з жорстким (6,6 ммоль/л або 120 мг/дл) чи більш м’яким (9,9 ммоль/л або 180 мг/дл) глікемічним контролем. 361 В дослідженні BARI-2D наслідки у пацієнтів, які з метою глікемічного контролю отримують препарати, що підвищують чутливість до інсуліну, були аналогічними таким у пацієнтів, які отримують інсулінові секретагоги чи ін’єкції інсуліну. В групі АКШ призначення інсуліну асоціювалось з більшим числом серцево-судинних подій порівняно із препаратами інсулінових сенситайзерів. 139
В дослідженні впливу саксагліптину на серцево-судинні наслідки у пацієнтів з цукровим діабетом 2 типу (Saxagliptin and Cardiovascular Outcomes in Patients with Type 2 Diabetes Mellitus, SAVOR-TIMI 53) пригнічення дипептидил пептидази-4 (ДПП-4) за допомогою саксагліптину не впливало на виникнення ішемічних подій, незважаючи на підвищення частоти госпіталізації з приводу серцевої недостатності. 362
13.3 Реваскуляризація у хворих з хронічним захворюванням нирок
Доказова база для реваскуляризації. Реваскуляризація міокарда дуже рідко використовується у хворих з хронічним захворюванням нирок (ХЗН). 369–371 У всіх категоріях функції нирок (визначених в веб-додотках), експериментальні дослідження свідчать, що пацієнти з ХЗН та багатосудинним ураженням, які проходять реваскуляризацію, мають кращі показники виживаності, аніж ті, що отримують медикаментозне лікування. 372, 373 Зокрема, серед пацієнтів з ГКС, великі реєстри показують краще коротко- і довгострокове виживання після ранньої реваскуляризації, ніж після медикаментозної терапії на всіх етапах ХЗН. 371, 374 Коли є показання для ПКВ, перевагу слід надавати DES над BMS, через низький ризик реваскуляризації і відсутність проблем безпеки. 375, 376 Тим не менше, використання контрастних речовин при діагностичних та інтервенційних судинних процедурах є найбільш частою причиною гострого ураження нирок у госпіталізованих пацієнтів. Крім того, пацієнти з ХЗН часто мають супутні захворювання, які підвищують ризик перипроцедурних ішемічних патологій і кровотеч. Примітно, що існує мало доказів з РКД, оскільки більшість терапевтичних РКД по реваскуляризації виключають хворих з ХЗН. Сучасні стратегії лікування розраховуються на основі ретроспективних аналізів РКД і даних з великих реєстрів.
Пацієнти з помірною хронічною нирковою недостатністю Експериментальні дослідження вказують на підвищений ризик подій зі смертельними наслідками в периопераційний період і короткостроковій перспективі (~12 місяців), але після АКШ спостерігається нижчий рівень смертності в середньостроковій або довгостроковій перспективі порівняно з ПКВ. 377, 378 Абсолютний ризик при нирковій недостатності в термінальній стадії нижче, ніж ризик подій зі смертельними наслідками у цій популяції пацієнтів, і комбінований рівень смертності або ризик ниркової недостатності в термінальній стадії може залишатися нижчим після проведення АКШ при довгостроковому спостереженні. Ретроспективний аналіз пацієнтів із ХЗН (25% серед 1205 пацієнтів) в рандомізованому дослідженні ARTS (Arterial Revascularization Therapies Study), в якому порівнювалися АКШ з багатосудинним ПКВ з використанням непокритого стента, не виявив ніякої різниці в головному кінцевому показнику смертності, інфаркту міокарда чи інсульту (19% проти 17%; ВР 0,93; 95% ДІ 0,54–1,61; P=0,80), а також смертності після 3 років спостереження; Однак, після АКШ ризик повторної реваскуляризації був нижчим (25% проти 8%; ВР 0,28; 95% ДІ 0,14–0,54; P=0,01). 379 Існує ряд доказів, які вказують на те, що підхід без використання апарату штучного кровообігу у цих хворих може зменшити ризик периопераційної гострої ниркової недостатності та/або прогресування ниркової хвороби в термінальну стадію. 380 Були запропоновані засоби прогнозування, перспективні в якості засобу ідентифікації пацієнтів з ХЗН, які могли б отримати максимальну вигоду від конкретної стратегії реваскуляризації, проте такі засоби не були систематично контролированы. 381
Хворі з тяжким хронічним захворюванням нирок і нирковою недостатністю в термінальній стадії та пацієнти на гемодіалізі. У той час як не має даних РКД, результати великої групи з 21 981 хворих з нирковою недостатністю в термінальній стадії (дані з системи US Renal Data System) з поганою 5-річною виживаністю (22–25%) показують, що варто надавати перевагу АКШ на противагу ПКВ при багатосудинній коронарній реваскуляризації у підібраних хворих на гемодіалізі. 382 У порівнянні з ПКВ, АКШ було пов’язано зі значно меншим ризиком смерті і нижчим сумарним коефіцієнтом смертності або інфаркту міокарда. 382 При виборі найбільш відповідної стратегії реваскуляризації необхідно враховувати загальний стан і очікувану тривалість життя пацієнта; найменш інвазивний підхід є більш доцільним при лікуванні слабких хворих з ускладненнями.
Кандидати на пересадку нирок повинні бути обстежені на наявність ішемії міокарда, а в випадку з хворими зі значною ІХС не слід відхиляти можливість проведення реваскуляризації міокарда, яка може мати потенційну користь. Повідомлялося, що реципієнти ниркового трансплантата мають аналогічну довгострокову виживаність після АКШ і ПКВ. 383
13.4 Профілактика контраст-індукованої нефропатії
Особливо, якщо швидкість клубочкової фільтрації (ШКФ) становить <40 мл/хв./1,73 м2, всі пацієнти з ХЗН, які проходять діагностичну катетеризацію, повинні проходити профілактичну гідратацію фізіологічним сольовим розчином приблизно за 12 годин до ангіографії протягом принаймні 24 годин для зниження ризику контраст-індукованої нефропатії (КІН). 384, 385 Виявлено, що введення високих доз статину перед діагностичною катетеризацією зменшує частоту КІН, і повинно розглядатися в якості додаткового запобіжного заходу у хворих без протипоказань. 386Антиоксидант аскорбінова кислота досліджувався в якості препарату для перорального і внутрішньовенного застосування з метою запобігання розвитку КІН. Недавній мета-аналіз дев’яти РКД, що включали 1536 пацієнтів, виявив нижчий ризик розвитку КІН серед пацієнтів з ХЗН, які отримували аскорбінову кислоту, ніж у пацієнтів, які отримували плацебо або альтернативне лікування (9,6% проти 16.8%, відповідно; ВР=0,67 ; 95% ДІ 0,47 до 0,97; Р=0,034) 387, проте необхідно отримати більше доказів для надання певних рекомендацій щодо застосування цього препарату з вказаною метою. Хоча виконання діагностичних та інтервенційних процедур окремо зменшує використання контрастних речовин, ризик атероемболічного захворювання нирок збільшується пропорційно кількості катетеризацій. Таким чином, у пацієнтів із ХЗН з дифузним атеросклерозом можна розглядати один інвазивний підхід (діагностична ангіографія з подальшим ПКВ), але тільки якщо об’єм контрастної речовини можна буде підтримувати на рівні 4 мл/кг. Ризик КІН значно зростає, коли відношення загального обсягу контрастної речовини до ШКФ перевищує 3,7:1. 388, 389 Для пацієнтів, які перенесли АКШ, ефективність фармакологічних профілактичних заходів, таких як застосування клонідину, фенолдопаму, натрійуретичних пептидів, N-ацетилцистеїну або елективного передопераційного гемодіалізу, залишається недоведеною.
/113/tab40.jpg)
Таблиця 41. Рекомендації щодо профілактики контраст-індукованої нефропатії
a Клас рекомендацій.
b Рівень доказовості.
c Посилання.
d Особливо у пацієнтів з ШКФ 40 мл/хв./1,73 м2
ГНН=гостра ниркова недостатність; КІН=контраст-індукована нефропатія; ХЗН=хронічне захворювання нирок; ШКФ=швидкість клубочкової фільтрації; ЛШ=лівий шлуночок; МДКТ=мультидетекторна комп’ютерна томографія; ПКВ=перкутанне коронарне втручання.
13.5 Реваскуляризація у пацієнтів, яким необхідне втручання на клапанному апараті серця
Первинні показання до втручання на клапанному апараті серця. Загалом у 40% пацієнтів з вадами клапанів серця спостерігається супутня ІХС. Рекомендується проводити коронарну ангіографію всім пацієнтам з вадами клапанів серця при необхідності хірургічного втручання на клапані, за винятком пацієнтів молодого віку (чоловіки віком <40 років та жінки в передменопаузальний період) без факторів ризику ІХС або якщо ризики при ангіографії переважають користь (наприклад, у випадках розшаровуючої аневризми аорти, значних вегетацій аорти попереду гирла коронарної артерії або оклюзійного тромбозу протезу, що призводить до нестабільного гемодинамічного стану). 411 У пацієнтів, що проходять протезування аортального клапана (ПАК), які також страждають на виражену ІХС, комбінація АКШ з хірургічним втручанням на аортальному клапані зменшує частоту периопераційного ІМ, рівень периопераційної смертності, пізньої летальності та частоту ускладнень, в порівнянні з пацієнтами, які не проходили одночасного АКШ. 412–415 Тим не менш, ця комбінована операція несе підвищений ризик летальності в порівнянні з проведенням лише протезування аортального клапана. В сучасному аналізі масштабної вибірки більший ризик комбінованої операції, ніж при протезуванні аортального клапана, був пов’язаний з попередньою наявністю ішемічного ураження міокарда та супутніми захворюваннями. 419У пацієнтів з тяжкими супутніми захворюваннями кардіологи можуть зробити вибір на користь транскатетерного втручання на клапані.
Коментар робочої групи: транкатетерная імплантація в Україні проводяться (на період 2014-15 рр) в одиничних випадках. Тому на сьогоднішній день рекомендація по системний транскатетерна імплантації аортального клапана неможлива. Однак, кардіолог і кардіохірург повинен розуміти, що існує альтрнатівний спосіб заміни клапана, інформувати про це пацієнта та його родичів.
Однак, систематичний огляд обсерваційних досліджень показав відсутність значного впливу ІХС на пацієнтів, що проходять транскатетерну імплантацію аортального клапану (ТІАК), 420 в останньому одноцентровому дослідженні було продемонстровано підвищений ризик розвитку небажаних серцево-судинних явищ у пацієнтів з прогресуючою ІХС (оцінка за шкалою SYNTAX >22 балів). 421 ПКВ у пацієнтів з ІХС, що проходять ТІАК, не виявило в короткотривалому проміжку підвищення ризику смертності, інфаркту міокарда або інсульту в порівнянні з пацієнтами, які проходили тільки ТІАК; тим не менш, цей вплив в довгостроковій перспективі добре не вивчений. 422–425 Вибір уражень для лікування за допомогою ПКВ зазвичай ґрунтується на клінічній картині та результатах ангіографії, оскільки функціональні методи визначення ішемії не достовірні для пацієнтів зі стенозом аортального клапана в тяжкій формі. 422, 423, 426–428 Наразі немає остаточних висновків щодо того, чи варто проводити ПКВ як стадію втручання, чи здійснювати цю процедуру одноетапно, а приймати рішення слід на індивідуальній основі відповідно до основних клінічних проблем, ниркової недостатності та загального фону ІХС. Опубліковані відомості щодо ПКВ та перкутанної реконструкції мітрального клапана наразі обмежуються звітами про окремі випадки. 422, 424, 425, 428, 429 Опублікований досвід ПКВ та перкутанної реконструкції мітрального клапана наразі обмежений окремими звітами.
До альтернативних методів лікування пацієнтів з високим ризиком також відносяться «гібридні» процедури, до складу яких входить комбінація планового хірургічного втручання з приводу заміни клапана з плановим ПКВ з приводу реваскуляризації міокарда. Однак, наразі відомості щодо «гібридних» процедур втручання на клапані/ПКВ дуже обмежені, зводяться до описів окремих клінічних випадків та невеликих серій випадків. Індивідуальний план лікування у випадках таких складних пацієнтів має бути сформульованим Командою кардіохірургів.
Первинні показання до коронарної реваскуляризації. Багато пацієнтів з ІХС та погіршенням функції ЛШ страждають на вторинну недостатність мітрального клапана. Дані обсерваційного дослідження STICH свідчать про те, що у пацієнтів з дисфункцією ЛШ (ФВЛШ ≤35%) та мітральною недостатністю від помірного до тяжкого ступеня реконструкція мітрального клапана в комбінації з АКШ веде до кращої виживаності, ніж проведення тільки АКШ. 431 Аналогічним чином у пацієнтів, що проходять АКШ з основною клінічною проблемою ІХС, слід замінити аортальні клапани з помірним стенозом. 411 Прийняття рішення Командою кардіохірургів необхідне в кожному окремому випадку у пацієнтів з показаннями до ПКВ та аномалією клапана від помірного до тяжкого ступеня.
/113/tab42.jpg)
a Клас рекомендацій
b Рівень доказовості
c Посилання.
АКШ=аортокоронарне шунтування; ІХС=ішемічна хвороба серця; КТ=комп’ютерна томографія; ЛШ=лівий шлуночок; ФВЛШ=фракція викиду лівого шлуночка; ПКВ=перкутанне коронарне втручання;
13.6 Супутнє ураження сонної та периферичних артерій
Превалювання стенозу сонної артерії збільшується з тяжкістю ІХС, а також є індикатором погіршення прогнозу. 433 Хоча зв’язок між стенозом сонної артерії та ІХС очевидний, превалювання вираженого стенозу сонної артерії у всій вибірці залишається відносно низьким. І навпаки, до 40% пацієнтів, які проходять каротидну ендартеректомію, мають значну ІХС і для них може бути ефективною передопераційна оцінка ризику ускладнень з боку серця.
Фактори ризику виникнення інсульту, пов’язані з реваскуляризацією міокарда. Частота виникнення інсульту після АКШ відрізняється в залежності від віку, супутніх захворювань та техніки хірургічного втручання. У дослідженні FREEDOM, в якому порівнювалось ПКВ з АКШ у пацієнтів з багатосудинною ІХС, хворих на цукровий діабет, було зареєстровано 1,8% інсультів впродовж 30 днів після АКШ та 0,3% після ПКВ (Р=0,002). 175 Аналогічно, у дослідженні SYNTAX повідомлялося про вищий ризик інсультів, який зменшувався впродовж довгострокового спостереження після закінчення дослідження, і більше не був значущим через 5 років (АКШ 3,7% проти ПКВ 2,4%; Р=0,09). 17 В мета-аналізі 19 рандомізованих досліджень з участю 10 994 пацієнтів ризик інсульту був нижчим серед пацієнтів, яким було призначене ПКВ, ніж серед тих, кому було призначене АКШ впродовж 30 днів та впродовж одного року. 131 Ці результати вказують на те, що АКШ пов’язане з більшим перипроцедурним ризиком інсульту, а також що ризик цереброваскулярних ускладнень в довготривалій перспективі залишається незмінним при застосуванні обох методів лікування. 17 Найчастішою причиною виникнення інсульту внаслідок АКШ є емболізація атеротромботичного дебрису від висхідної аорти, зокрема під час катетеризації аорти. Ризик розвитку перипроцедурного інсульту після АКШ у пацієнтів зі стенозом сонної артерії пов’язаний з тяжкістю стенозу і, навіть в більшій мірі, з наявністю в анамнезі інсульту або транзиторної ішемічної атаки (ТІА) (впродовж 6 місяців). 434 Достовірних свідчень того, що ІХС є значущою причиною периоперативного інсульту, недостатньо. 435 Розповсюдження атеросклеротичного ураження на інтра- та екстрацеребральні ділянки, рентгенографічне відображення попереднього інсульту та аортального атероматозного ураження є найбільш важливими факторами передбачення підвищення ризику розвитку периоперативного інсульту. 435
Оскільки симптоматичний стеноз сонної артерії пов’язаний з більшим ризиком виникнення інсульту, у 50% пацієнтів, які страждають на інсульт після АКШ, не спостерігається ураження сонної артерії, а 60% локалізованих інфарктів, виявлених за допомогою КТ-сканування/автопсії, не можуть бути спричинені лише ураженням сонної артерії. Більше того, лише близько 40% інсультів після АКШ виявляють в перший день після хірургічного втручання, в той час як 60% інсультів виникають після безпроблемного відновлення після анестезії. В останньому дослідженні, яке включало 45 432 пацієнти, які пройшли АКШ, 1,6% перенесли інсульт, а факторами ризику для всіх інсультів були вік, менша площа поверхні тіла, невідкладне хірургічне втручання, наявність інсульту в анамнезі, передопераційна фібриляція передсердь (ФП) та АКШ із застосуванням апарата штучного кровообігу з гіпотермічною зупинкою кровообігу. Щодо інсультів під час операції, додатковими факторами ризику були ураження сонної та периферичних артерій, попереднє кардіологічне хірургічне втручання, погіршення клінічної картини, дисфункція ЛШ, стеноз огинаючої гілки лівої коронарної артерії >70%, а також АКШ із застосуванням апарата штучного кровообігу з гіпотермічною зупинкою кровообігу. 436
Оскільки ризик інсульту в пацієнтів, що проходять ПКВ, низький, ураження сонної артерії, гострий коронарний синдром, серцева недостатність та поширений атеросклероз є незалежними факторами ризику цього небажаного явища. У великому реєстрі, що нараховує 348 092 пацієнти, що пройшли ПКВ, поширеність інсульту та ТІА досягала лише 0,1% та не відрізнялася у випадках трансфеморального та радіального доступу. 437
Превентивні заходи зниження ризику інсульту після аортокоронарного шунтування. Визначення тяжкого ураження біфуркації сонної артерії може в окремих випадках призводити до супутньої каротидної реваскуляризації. Визначення атеросклерозу аорти вважається важливим кроком до зменшення ризику інсульту після АКШ. Передопераційна КТ або інтраопераційне епіаортальне УЗД – краще, ніж пальпація аорти – може призводити до змін в операційному втручанні, що може знижувати ризик інсульту, пов’язаного з АКШ. 438, 439 Відомості щодо впливу АКШ без застосування штучного кровообігу на частоту інсультів суперечливі. 440 Останнє рандомізоване дослідження показало відсутність відмінностей у частоті інсультів після АКШ із застосуванням апарата штучного кровообігу або на працюючому серці впродовж 30 днів. Однак, дослідження «мінімального втручання» на аорті свідчать про нижчий ризик інсульту та основних небажаних серцевих та цереброваскулярних явищ (MACCE) при АКШ без застосування апарата штучного кровообігу. 442, 443
Периоперативна медикаментозна терапія відіграє фундаментальну роль у попередженні неврологічних ускладнень внаслідок АКШ. Статини в комбінації з бета-блокаторами продемонстрували захисну дію щодо ризику інсульту після АКШ. 444
Реваскуляризація сонної артерії у пацієнтів із запланованою реваскуляризацією міокарда.
У пацієнтів з перенесеними раніше ТІА або інсультом і при наявності стенозу сонної артерії (50–99% просвіту судини у чоловіків; 70–99% просвіту судини у жінок) каротидна ендартеректомія, проведена досвідченими фахівцями, може знизити ризик периопераційного інсульту або смерті. 434 І навпаки, ізольовану реваскуляризацію міокарда слід проводити пацієнтам з безсимптомним одностороннім стенозом сонної артерії через невелике зменшення ризику інсульту та смерті, який досягається супутньою реваскуляризацією сонної артерії (1% на рік). 434 Можливість проведення каротидної реваскуляризації може розглядатися у чоловіків з симптомами тяжкого білатерального стенозу сонної артерії або контрлатеральної оклюзії, яка передбачає, що ризик інсульту або смерті впродовж 30 днів може становити <3% при наявності прогнозованої тривалості життя >5 років.
У жінок з безсимптомним захворюванням сонної артерії або пацієнтів з прогнозованою тривалістю життя <5 років, переваги каротидної реваскуляризації залишаються нез’ясованими. 434 За відсутності явних підтверджень того, що етапна або синхронна каротидна ендартеректомія чи стентування сонної артерії (ССА) можуть бути корисними для пацієнтів, які проходять АКШ, оцінювати пацієнтів слід індивідуально за участі різнопрофільних фахівців, включаючи невролога. Така ж стратегія прийнятна для пацієнтів із запланованим ПКВ. Стратегія комбінування ПКВ із ССА у окремих пацієнтів не рекомендована в якості рутинної, за винятком нечастих випадків ускладнень супутнім тяжким гострим коронарним синдромом або синдромом сонної артерії.
Тип реваскуляризації у пацієнтів з пов’язаним захворювання сонної та коронарної артерії.
Деякі пацієнти із запланованим АКШ потребують синхронної або односторонньої каротидної реваскуляризації. Через відсутність рандомізованих досліджень, в яких здійснювалось порівняння стратегій лікування пацієнтів із супутньою ІХС та захворюванням сонної артерії, вибір методу каротидної реваскуляризації (каротидна ендартеректомія або ССА) має ґрунтуватися на супутніх захворюваннях пацієнта, анатомії супра-аортальних судин, ступеневі терміновості АШК та огляду на місці. 449 Кваліфікація хірурга впливає на результати обох методів каротидної реваскуляризації, і в більшій мірі на результати ССА; при цьому вищий рівень смертності спостерігається серед пацієнтів, яких оперували недосвідчені хірурги або хірурги з малим досвідом. Якщо ССА проводиться перед елективним АКШ, необхідність подвійної антитромбоцитарной терапії (ПАТТ) зазвичай призводить до відтермінування кардіологічного хірургічного втручання на 4–5 тижнів. 451, 452
/113/tab45.jpg)
Супутні захворювання коронарних та периферичних артерій. Захворювання периферичних артерій (ЗПА) є важливим передвісником небажаного результату після реваскуляризації міокарда та вказує на можливість поганих результатів у довготривалій перспективі. 457, 458 Пацієнти з клінічними проявами ЗПА знаходяться в групі підвищеного ризику процедурних ускладнень після ПКВ або АКШ. При порівнянні результатів АКШ та ПКВ у пацієнтів із ЗПА та багатосудинним ураженням, АКШ пов’язують з тенденцією до кращої виживаності. Реєстраційні дані, скориговані щодо ризику, показали, що пацієнти з багатосудинним ураженням та ЗПА, які проходять АКШ, мають кращу 3-річну виживаність, ніж подібні пацієнти, які проходять ПКВ, незважаючи на вищий рівень внутрішньолікарняної смертності. Під час АКШ хірургам слід уникати забору вени з ніг, значно уражених ЗПА; тим не менш, за відсутності достовірних відомостей про таку популяцію обидва підходи до реваскуляризації міокарда, ймовірно, так само підходять пацієнтам із ЗПА, як і іншим хворим на ІХС.
13.7 Некардіологічне хірургічне втручання на судинах у пацієнтів з супутнім захворюванням коронарної артерії
Пацієнти із запланованим некардіологічним хірургічним втручання знаходяться в групі підвищеного ризику кардіоваскулярних ускладнень та смертності через високу поширеність першопричинної сиптоматичної або безсимптомної ІХС. 451, 459 Результати найбільшого РКД продемонстрували, що серед 510 пацієнтів, рандомізованих в групу профілактичної реваскуляризації міокарда (як за допомогою ПКВ, так і АКШ) та групу лише медикаментозної терапії, не було виявлено переваги стосовно частоти виникнення периопераційного інфаркту міокарда, рівнем ранньої чи пізньої смертності перед хірургічним втручанням на магістральних судинах. 460 У пацієнтів, включених до дослідження, була збережена функція ЛШ та спостерігалась стабільна ІХС. В РКД з участю 208 пацієнтів з помірним або високим серцевим ризиком, у яких було заплановане хірургічне втручання на магістральних судинах, повідомлялось про подібні результати: пацієнти, які проходили систематичну передопераційну коронарну ангіографію та реваскуляризацію, мали подібний результат у лікувальному закладі, але меншу ймовірність серцево-судинних ускладнень впродовж 4 років, ніж при селективній стратегії. 461 Загалом, окремі пацієнти групи високого ризику можуть мати переваги при етапній або супутній реваскуляризації міокарда з варіантами від одно-етапного хірургічного підходу до комбінованого ПКВ та периферичного ендоваскулярного відновлення або «гібридних» процедур.
РКД з участю пацієнтів групи високого ризику, когортні дослідження та мета-аналізи надають докази того, що у пацієнтів, які проходять некардіологічне хірургічне втручання на судинах з високим ризиком або ендоваскулярні процедури, рівень смертності внаслідок кардіологічних причин та частота інфаркту міокарда нижчі в порівнянні з пацієнтами, що проходять медикаментозну терапію, в тому числі статинами. 458 Загалом, периопераційні кардіоваскулярні ускладнення часто зустрічаються у пацієнтів із ЗПА, пов’язаним з ІХС, і призводять до значної летальності після некардіологічного хірургічного втручання на судинах. Всім пацієнтам необхідний передопераційний скринінг для визначення наявних та майбутніх ризиків з особливою увагою до відомої ІХС, факторів ризику ІХС та функціональної здатності. 451, 462
13.8 Повторна реваскуляризація та «гібридні» процедури
Раннє відторгнення трансплантата. За результатами ангіографічного дослідження, що здійснювалось під час операції, раннє відторгнення трансплантата після АКШ зареєстроване майже у 12% випадків (при пересадці лівої внутрішньої грудної артерії – 7%; трансплантату з підшкірної вени – 8%), 463 але клінічно проявлялись лише меншість з цих випадків, близько 3%. 464 Відторгнення трансплантата, ймовірно, виникало внаслідок наявності дефектів судинного протезу, технічних помилок при утворенні анастомозу, слабкого кровотоку власної судини або конкурентного потоку з власною судиною. Відносно клініки, гостре відторгнення трансплантата може призводити до інфаркту міокарда з послідовним підвищенням рівня смертності та частоти виникнення серйозних серцевих ускладнень. Підозра щодо відторгнення трансплантата має з’являтися за наявності ЕКГ-ознак ішемії, шлуночкової аритмії, важливих змін біомаркерів, нових порушень руху стінок або гемодинамічної нестабільності. Через низьку специфічність ЕКГ-змін та ехокардіографічних ознак порушень руху стінок впродовж післяопераційного періоду та затримку проявів змін біомаркерів, ретельна оцінка всіх відхилень матиме вплив на прийняття рішення щодо ангіографічного дослідження.
Периопераційна ангіографія рекомендована у випадках підозри на міокардіальну ішемію для визначення її причин та допомоги у прийнятті рішення щодо вибору відповідного лікування. 463, 465, 466 У пацієнтів з проявами симптомів раннє відторгнення трансплантата може бути визначено як причина ішемії у майже 82% випадків. 467 При ранньому післяопераційному відторгненні трансплантата невідкладне ПКВ може обмежити поширення інфаркту міокарда у порівнянні з повторним хірургічним втручанням. 467 Метою ПКВ є відновлення просвіту власної судини або трансплантата з внутрішньої грудної артерії, і в той же час слід уникати втручань на трансплантаті із підшкірної вени з гострою оклюзією та анастомозі з міркувань можливої емболізації або перфорації. Повторному хірургічному втручанню слід надавати перевагу, якщо анатомічні особливості не підходять для виконання ПКВ або при оклюзії кількох важливих трансплантатів. В цій групі пацієнтів зареєстрований рівень ранньої смертності становив 9–15%, без відмінностей між двома стратегіями реваскуляризації. 467 У пацієнтів без симптомів необхідність повторної реваскуляризації слід розглядати при відповідному розмірі артерії та достатньо великій ділянці міокарда, що кровопостачаються нею. Обирати оптимальну стратегію у пацієнтів з гострим відторгненням імплантата слід за результатами ситуативної (ad hoc) консультації з серцево-судинним хірургом та інтервенційним кардіологом, ґрунтуючись на клінічному стані хворого та ступеневі ризику для міокарда.
Прогресування хвороби та пізнє відторгнення трансплантата. Ішемія після АКШ може виникнути внаслідок прогресування захворювання власних судин або захворювання обхідних судинних шунтів (Таблиця 47). У таких пацієнтів повторна реваскуляризація показана при наявності виражених симптомів, що зберігаються незважаючи на лікування препаратами, а також у пацієнтів без симптомів з об’єктивними ознаками ішемії міокарда ( > 10% ЛШ). 54, 143 Передбачається, що механічна реваскуляризація, в порівнянні із застосуванням лише медикаментозної терапії, не впливає на виживаність пацієнтів зі збереженою прохідністю лівою внутрішньої грудної артерії до ділянки відходження передньої низхідної гілки ЛКА та ішемією в ділянці правої та огинаючої коронарних артерій. 468
/113/tab47.jpg)
Повторне аортокоронарне шунтування або перкутанне коронарне втручання. Перкутанне коронарне втручання у пацієнтів з попереднім АКШ характеризується гіршими близькими та віддаленими результатами, ніж у пацієнтів без попереднього АКШ. Повторне АКШ підвищує летальність у 2-4 рази у порівнянні з першим АКШ. 477, 478 Відомості щодо порівняння ефективності ПКВ з повторним АКШ у пацієнтів з попереднім АКШ обмежені. У РКД під назвою AWESOME (In the Angina With Extremely Serious Operative Mortality Evaluation) та реєстрі загальний рівень внутрішньолікарняної смертності був вищим при повторному АКШ, ніж при ПКВ. 151, 479 Дані більш сучасних обсерваційних досліджень показують подібні віддалені результати у пацієнтів, яких лікували за допомогою повторного АКШ та ПКВ, з більшою частотою реваскуляризації в групі ПКВ. 479, 480 З огляду на вищий ризик процедурної смертності при АКШ та подібний віддалений результат, ПКВ є більш привабливою стратегією реваскуляризації для пацієнтів з незакритою лівою внутрішньою грудною артерією (ЛВГА) та підходящою анатомією судин. АКШ потрібно надавати перевагу в пацієнтів із значно ураженими або закритими обхідними судинними шунтами, зниженою систолічною функцією ЛШ, кількома тотальними оклюзіями власних артерій та відсутністю артеріальних шунтів. ВГА є кращим судинним протезом для реваскуляризації під час повторного АКШ. 481
Перкутанне коронарне втручання за допомогою шунтування власною артерією пацієнта має бути переважним підходом, який забезпечує відсутність хронічної оклюзії власних судин. Перкутанне коронарне втручання при хронічній тотальній оклюзії (ХПО) може бути показане при наявності ішемічних симптомів з ознаками значної ішемії та при наявності життєздатного міокарда в ділянці втручання. При невдалому ПКВ на власних судинах залишається можливість здійснення ПКВ на ураженому трансплантаті з підшкірної вени.
Перкутанне коронарне втручання на ураженнях трансплантатів з підшкірної вени пов’язане з підвищеним ризиком дистальної коронарної емболізації, яка призводить до розвитку перипроцедурного інфаркту міокарда. Перкутанне коронарне втручання вперше виявленого стенозу трансплантатів з підшкірної вени розглядається як втручання з високим ризиком, оскільки атеросклеротична бляшка трансплантата з підшкірної вени дуже крихка та більш схильна до дистальної емболізації. Зведений аналіз п’яти РКД вказує на те, що інгібітори глікопротеїнів IIb/IIIa менш ефективні при втручаннях на трансплантатах з підшкірної вени, ніж на власних судинах. Кілька різних підходів вивчались щодо попередження дистальної емболізації частками розпаду, включаючи дистальну оклюзію / аспірацію, проксимальну оклюзію, відсмоктування, фільтрувальні засоби або стенти, вкриті сіткою. 484 На відміну від оклюдуючих засобів, дистальний захист із застосуванням фільтрів, пропонує невід’ємну перевагу, а саме – збереження антеградної перфузії та можливість здійснення ін’єкцій контрастних речовин. Зведені відомості, головним чином порівняльних досліджень різних фільтруючих засобів, виступають в підтримку застосування дистального емболічного захисту під час ПКВ на шунті з підшкірної вени. 485, 486 У РКД, в якому порівнювали різні засоби дистального захисту при ПКВ на шунті з підшкірної вени, єдиним незалежним предиктором розвитку МАСЕ впродовж 30 днів був об’єм бляшки, а не тип застосовуваного захисного засобу. 487 Досвід застосування інших засобів під час ПКВ на шунті з підшкірної вени, таких як стенти з сітки, обмежений.
Імплантація стентів з медикаментозним покриттям при ураженнях трансплантата з підшкірної вени пов’язане з меншим ризиком повторної реваскуляризації, ніж у випадку встановлення стентів без покриття. 489–497 У реєстрі Swedish Coronary Angiography and Angioplasty Registry (SCAAR) 3063 процедур із застосуванням 4576 стентів (включаючи DES та BMS) при ураженнях трансплантата з підшкірної вени, частота летальних випадків у пацієнтів зі стентами з медикаментозним покриттям була меншою. 489 Тим не менш, у рандомізованому дослідженні ISAR-CABG (Is Drug-Eluting-Stenting Associated with Improved Results in Coronary Artery Bypass Grafts) не спостерігалося різниці стосовно рівня смертності, частоти інфаркту міокарда або тромбозу стента. 495
Довготривалі результати (до 7 років після проведення процедури) встановлення DES першого покоління, в порівнянні з BMS, при ураженнях трансплантата з підшкірної вени є задовільними, без наявності підвищеного ризику тромбозу стента та зі збереженням низької частоти рестенозу. 494, 496 В порівнянні з пацієнтами, що перенесли ПКВ з протезуванням власними коронарними судинами, хворі, що пройшли ПКВ з використанням трансплантату з підшкірної вени мають гірші довгострокові результати. 498
13.9 Гострі ускладнення перкутанного коронарного втручання
Більшість ускладнень, пов’язаних з ПКВ (включаючи розшарування, оклюзію судин, інтракоронарний тромбоз та перфорацію коронарних артерій), успішно лікуються в катетеризаційній лабораторії; 499, 500 тому під час проведення цих процедур не потрібне хірургічне втручання на місці попереднього втручання або поруч. Необхідність невідкладного хірургічного втручання для усунення ускладнень, пов’язаних з ПКВ, виникає нечасто; воно потрібне пацієнтам зі значними ускладненнями, які не можуть бути усунені відповідним чином за допомогою перкутанної технології. Переважно це стосується пацієнтів з обширним прогресуючим інфарктом міокарда, що виник внаслідок ятрогенної оклюзії судини, кровопостачання через яку не можна відновити перкутанним шляхом, та пацієнтів з ятрогенною тампонадою серця внаслідок пункції перикарду або з рецидивуючою тампонадою. При наявності тяжкої гемодинамічної нестабільності, перед невідкладним хірургічним втручанням може бути бажаним здійснення внутрішньоаортальної балонної контрпульсації або механічної підтримки кровообігу.
Повторне перкутанне коронарне втручання. Рецидив симптомів або ішемії після ПКВ є результатом повторного стенозу, неповної початкової реваскуляризації або прогресування захворювання. Зрідка пацієнтам може знадобитися повторне виконання ПКВ внаслідок пізнього та дуже пізнього тромбозу стента.
Повторний стеноз. Повторний стеноз, пов’язаний зі стенокардією або ішемією, слід лікувати за допомогою повторної реваскуляризації та повторного ПКВ, дотримуючись стратегії вибору для таких пацієнтів при наявності технічної можливості. Спочатку при таких обставинах часто застосовувалася балонна ангіопластика з хорошими початковими результатами, але високим ризиком рецидиву. 501, 502 Металеві стенти без медикаментозного покриття забезпечували чудовий первинний результат у пацієнтів з внутрішньостентовим рестенозом, але призводили до небажаних результатів в довгостроковій перспективі і тому їх застосування залишено для пацієнтів з субоптимальними первинними результатами після балонної агніопластики або для пацієнтів з крупними судинами. 501, 502
Аблативні технології (включаючи ротаційну атеректомію та застосування лазера) не змогли покращити результати лікування в таких пацієнтів. Хоча контактна променева терапія була ефективною в лікуванні внутрішньостентового рестенозу, вона не набула широкого розповсюдження, головним чином через логістичні проблеми. Наразі імплантація DES рекомендована пацієнтам з повторним стенозом BMS або DES. За таких обставин, результати лікування з використанням DES кращі в порівнянні з балонною ангіопластикою, імплантацією BMS та контактною променевою терапією. 501–505 Балони з медикаментозним покриттям також ефективні у таких пацієнтів, і в окремих випадках мають більшу перевагу, якщо у судині вже є більше одного шару стента. Балони з медикаментозним покриттям чудово підходять для балонної ангіопластики і дають результати, подібні до застосування DES першого покоління у пацієнтів з внутрішньостентовим рестенозом BMS або DES. 506–512
Застосування внутрішньокоронарної візуалізації може надати корисну інформацію щодо основного механізму розвитку внутрішньостентового рестенозу. Наявність недорозширеного стента слід по можливості відкоригувати під час виконання повторної процедури. У пацієнтів з повторюваними епізодами дифузного внутрішньостентового рестенозу та пацієнтів з пов’язаним багатосудинним ураженням, особливо при наявності інших складних уражень, таких як хронічна повна оклюзія, перед новою спробою ПКВ слід розглядати можливість виконання АКШ.
Прогресування захворювання. Пацієнти з симптоматичним прогресуванням захворювання після ПКВ налічують до 50% випадків повторних втручань. 513, 514 Їх слід лікувати, використовуючи критерії, подібні до пацієнтів без попередньої реваскуляризації, якщо ангіографічні та функціональні результати попередніх втручань залишаються задовільними. ПКВ є прекрасним методом лікування для таких пацієнтів, але слід уважно визначати місце попереднього введення стента, оскільки, як виявилося, це може ускладнювати повторне втручання на тій же судині. В цій популяції слід максимально використовувати фармакологічні стратегії.
Тромбоз стента. Оскільки тромбоз стента трапляється дуже рідко, це ускладнення може мати руйнівні клінічні наслідки. Тромбоз стента зазвичай проявляється обширним інфарктом міокарда і в такому випадку пацієнту слід проходити негайне первинне ПКВ. 515 Внаслідок рідкості цього ускладнення, стратегія вибору втручання залишається сумнівною, але застосування тромбоаспірації та внутрішньокоронарного введення інгібіторів рецепторів ГП IIb/IIIa часто є виправданим. Агресивна балонна дилатація під високим тиском має застосовуватись для корекції основних, пов’язаних зі стентуванням, провокуючих механічних проблем. 516 В таких складних умовах передбачається, що технології внутрішньокоронарної діагностики мають застосовуватися для коригування механічних проблем та оптимізації результатів лікування. 516
Хоча оптична когерентна томографія (ОКТ) забезпечує кращу в порівнянні з внутрішньосудинним ультразвуковим дослідженням (ВСУЗД) роздільну здатність ближнього поля та здатна візуалізувати червоні тромби, тіні тромбів при цьому дослідженні можуть заважати виявленню основних структур. 516 В деяких пацієнтів з дуже пізнім тромбозом стента основним патофізіологічним механізмом його розвитку насправді є неоатеросклероз, а розпізнати його можливо за допомогою внутрішньокоронарної візуалізації. 516 Хоча сенс повторного стентування у пацієнтів з тромбозом стента викликає суперечки та потребує уникання, якщо задовільні результати отримано завдяки використанню балонної дилатації, новий стент може знадобитися для подолання крайових розшаровувань та безпосередньо прилягаючих уражень або оптимізації кінцевих результатів лікування. 517 Визначення та корекція будь-якого тромбоутворюючого середовища залишається важливим під час цих втручань. 516
Відповідне пригнічення агресії тромбоцитів має надзвичайно велике значення у мінімізації ризику тромбозу стента, а також попередженні його рецидиву. У пацієнтів з тромбозом стента окрему увагу слід приділити вибору найбільш відповідного інгібітора P2Y12 та переконатися у важливості дотримання схеми лікування завдяки наданню пацієнтові відповідної інформації. Немає причин стверджувати, що дослідження тромбоцитарної функції ефективне у спрямовуванні процесу прийняття рішень щодо виду інгібітора P2Y12 в таких особливих умовах. Оскільки прасугрель та тікагрелор знижують ризик первинного ГКС з підйомом сегмента ST, 341, 518 цим препаратам слід надавати перевагу над клопідогрелем, якщо це показано клінічно. Лікування має тривати щонайменше 12 місяців після загострення та можливо довше при хорошій переносимості. У випадках недоступності цих нових препаратів або протипоказань до їх застосування може бути виправданим подвоєння дози клопідогрелю. 519
Гібридні процедури. Гібридна реваскуляризація міокарда є запланованим втручанням, яке кардіохірург комбінує з катетерним втручанням, що проводиться у попередньо визначений час. 520–523 Процедури можуть проводитися одночасно у «гібридній» операційній, або послідовно в окремих приміщеннях з відповідною підготовкою кардіохірургів щодо хірургічного втручання та ПКВ. Рішення команди кардіологів та розробка спільної стратегії мають критичне значення для пацієнтів. Гібридні процедури, які складаються з шунтування від ВГА до передньої низхідної гілки ЛКА та ПКВ на інших ділянках, виявляються виправданими, якщо ПКВ на передній низхідній гілці ЛКА не є варіантом або навпаки передбачає хороший результат у довгостроковій перспективі, або якщо досягнення повної реваскуляризації під час АКШ може бути пов’язаним з підвищенням ризику хірургічного втручання. Хоча в більшості лікувальних центрів кількість гібридних процедур порівняно мала, залишається важливим розглядати, коли вони є клінічно показаними. 520, 521
Можливі варіанти:
(1) Окремі пацієнти з ураженням лише передньої низхідної гілки ЛКА, або з багатосудинним ураженням, але недостатніми показаннями для хірургічного втручання, крім ураження території, що кровопостачається передньою низхідною гілкою ЛКА, у яких можливо проведення малоінвазивного прямого аортокоронарного шунтування (МІПАКШ) для шунтування передньої низхідної гілки ЛКА з використанням ЛВГА. Решта уражень на інших судинах після цього лікується шляхом ПКВ.
(2) Пацієнти, які попередньо проходили АКШ а тепер потребують хірургічного втручання на клапані, та які вже мають хоч один важливий стент (наприклад, в ділянці від ВГА до передньої низхідної гілки ЛКА) та один або два оклюдованих стенти з власної судини, прийнятних для ПКВ.
(3) Комбінація реваскуляризації з хірургічним втручанням на клапані без стернотомії (наприклад, ПКВ та малоінвазивне відновлення мітрального клапана, або ПКВ та трансапікальна імплантація аортального клапана).
Крім того, деякі пацієнти зі складним багатосудинним ураженням та інфарктом міокарда з елевацією сегмента ST (STEMI) в першу чергу потребують первинного ПКВ на причинній артерії, але потім їм може знадобитися повна хірургічна реваскуляризація. Подібна ситуація виникає, коли пацієнтам із поєднаним захворюванням клапана та ІХС потрібна невідкладна реваскуляризація та ПКВ. Нарешті, коли в операційній залі хірург визначає сильно кальциновану аорту, він може обрати припинення спроб повної реваскуляризації та запропонувати відкласти ПКВ.
/113/tab48.jpg)
/113/tab48_2.jpg)
Шлуночкові аритмії/ Реваскуляризація для запобігання раптовій серцевій смерті у пацієнтів зі стабільною ішемічною хворобою серця та зниженою функцією лівого шлуночка. Реваскуляризація відіграє важливу роль у зменшенні частоти шлуночкових аритмій у пацієнтів із нормальною та дещо зниженою функцією ЛШ (дослідження CASS. 525, Європейське дослідження коронарної хірургії (European Coronary Surgery Study)). 109 Таким чином, реваскуляризація значно зменшувала ризик раптової серцевої смерті у пацієнтів з ІХС та ФВЛШ <35% [Дослідження дисфункції лівого шлуночка (SOLVD)]. 526 Аналогічним чином, одночасна імплантація кардіовертер-дефібрилятора під час АКШ не підвищувала рівень виживаності у пацієнтів зі зниженою функцією ЛШ (імплантат АКШ). 527 І навпаки, підвищення скоригованого ризику шлуночкової тахікардії (ШТ) або фібриляції шлуночків (ФШ) на 5% або 8%, відповідно, спостерігалося із кожним роком з моменту реваскуляризації незалежно від способу реваскуляризації, що, ймовірно, пов’язано із поступовим прогресуванням ІХС (дослідження MADIT-CRT [Multicenter Automatic Defibrillator Implantation Trial – Cardiac Resynchronization Therapy]). 528 Непрямі свідчення на користь захисного ефекту коронарної реваскуляризації від раптової серцевої смерті були одержані під час ретроспективного аналізу даних дослідження MADIT II та SCD-HEFT (Sudden Cardiac Death in Heart Failure Trial) під час яких імплантація ICD здійснювалася з метою первинної профілактики раптової серцевої смерті у пацієнтів з ІХС та ФВЛШ <30–35%, відповідно. У цих дослідженнях імплантація ICD не зменшувала частоти раптової серцевої смерті, якщо реваскуляризація була виконана впродовж 6-ти місяців (MADIT II) 608 або 2-х років (SCD-HEFT) 529 до імплантації ICD. І нарешті, у дослідженні STICH, у якому вивчали вплив реваскуляризації (АКШ) у пацієнтів зі зниженою функцією ЛШ (ФВЛШ <35%), було виявлено статистично незначну тенденцію до зменшення загального рівня смертності у групі АКШ, але статистично вагомі переваги у цій групі за кінцевими точками серцево-судинних наслідків (наприклад, смерть внаслідок серцевих причин, у тому числі раптова смерть). 112 Враховуючи захисний ефект реваскуляризації на шлуночкові аритмії, пацієнти з ішемічною дисфункцією лівого шлуночка (ФВЛШ <35%), доцільність проведення яким первинної превентивної імплантації ICD розглядається, мають пройти дослідження на наявність залишкових ознак ішемії та розглядатися як потенційні кандидати для проведення реваскуляризації.Оскільки реваскуляризація методом АКШ призводила до зменшення на 46% ризику раптової серцевої смерті у дослідженні SOLVD, а також враховуючи низький ризик раптової серцевої смерті впродовж 2-х років після реваскуляризації у дослідженні MADIT-II, слід зважувати доцільність переоцінки функції ЛШ протягом періоду до 6-ти місяців після реваскуляризації до проведення первинної превентивної імплантації ICD пацієнтам з ІХС та ФВЛШ <35%. Ця пропозиція ґрунтується на спостереженні про те, що протягом періоду до 6-ти місяців після процедур реваскуляризації можуть мати місце зворотне ремоделювання ЛШ та покращення його функції. 530, 531
Реваскуляризація для лікування «електричного шторму». «Електричний шторм» – це загрозливий для життя синдром, пов’язаний із безперервними шлуночковими аритміями, який найчастіше спостерігається у пацієнтів з ІХС, пізніми стадіями систолічної серцевої недостатності, аномалією клапанів серця, коригованими вродженими вадами серця та генетичними порушеннями, такими як синдром Бругада, синдром ранньої реполяризації та синдром подовженого інтервалу QT. У дослідженні MADIT-II виникнення тимчасових ішемічних явищ (стенокардії або інфаркту міокарда) після включення до складу учасників дослідження було незалежним прогностичним фактором «електричного шторму», хоча значна кореляція між часом настання цих двох подій була відсутня. 532 Термінова коронарна ангіографія та реваскуляризація мають стати елементами лікування пацієнтів із «електричним штормом», так само як і лікування антиаритмічними препаратами та/або абляція шлуночкової тахікардії.
Реваскуляризація після зупинки серця поза межами лікарні. Приблизно 70% пацієнтів, які пережили зупинку серця поза межами лікарні, страждають на ІХС, причому гостра оклюзія судин спостерігається у 50%. 533 Дані численних нерандомізованих досліджень свідчать, що термінова коронарна ангіографія та ПКВ після зупинки серця поза межами лікарні дозволяють забезпечити сприятливий рівень виживаності – до 60% через 1 рік, що значно вище, ніж загальний рівень виживаності (25%) серед пацієнтів із відновленням серцебиття після його зупинки. 534, 535 Згідно з нещодавно одержаними даними, майже одна чверть пацієнтів, які пройшли реанімаційні заходи у зв’язку із зупинкою серця, проте без підйому сегмента ST, мають ураження відповідної судини (оклюзію або порушення форми судини). 536, 537 Варто відзначити, що, за даними Проспективного реєстру випадків зупинки серця поза межами лікарні Паризького регіону (PROCAT), у 96% пацієнтів із STEMI та у 58% пацієнтів без STEMI після зупинки серця поза межами лікарні було виявлене принаймні одне значне пошкодження коронарної артерії, і рівень виживаності пацієнтів у лікарнях був значно вищим у разі негайного успішного проведення ПКВ. 538, 539 Таким чином, пацієнтам, які пережили зупинку серця поза межами лікарні, слід проводити коронарну ангіографію на ранніх етапах та ПКВ (якщо це є доцільним) незалежно від характеру ЕКГ-змін, якщо відсутня однозначна не пов’язана з серцем причина аритмії. 540
Фібриляція передсердь, яка ускладнює перкутанне коронарне втручання. Вперше виявлена фібриляція передсердь (ФП) у пацієнтів, які проходять ПКВ, має місце після 2–6% процедур, причому її частота зростає з віком, у разі наявності серцевої недостатності, гострого інфаркту міокарда та артеріальної гіпертонії. 541–544 Слід відзначити, що перша поява ФП (що визначається як відхилення від синусового ритму у період з моменту надходження в лікарню до моменту виконання ПКВ або після цієї процедури), як правило, трапляється протягом перших 4-х днів після гострого інфаркту міокарда та пов’язана із погіршенням прогнозу, більш ніж подвоюючи ризик летального наслідку, застійної серцевої недостатності та інсульту.
Застосування пероральних антикоагулянтів додатково до антитромбоцитарних засобів, як виявляється, зменшує ризик інсульту після ПКВ, про що свідчать дані обсерваційних досліджень. 543, 545, 546 Інформація щодо тривалості вперше виниклої ФП після ПКВ є досить обмеженою, проте більшість таких випадків, ймовірно, мають пароксизмальну природу або припиняються шляхом електроімпульсної терапії під час перебування у лікарні. Поки не зрозуміло, чи виступає ФП незалежним фактором ризику розвитку серцево-судинних ускладнень після ПКВ або просто є відображенням тяжкості основної хвороби серця. Лікування антитромбоцитарними засобами з метою профілактики інсульту в пацієнтів з ФП, що виникла під час або після ПКВ, має відбуватися згідно з Рекомендаціями щодо лікування антитромбоцитарними засобами ФП, не пов’язаної із ПКВ, хоча дані проспективних досліджень з цього питання є досить обмеженими (див. розділ 18). Слід оцінювати потенційну можливість підвищення ризику кровотеч у цієї популяції пацієнтів, як описано у Рекомендаціях ESC стосовно ФП. 547
Фібриляція передсердь, яка ускладнює аортокоронарне шунтування. Безперервна телеметрія протягом усього терміну перебування у лікарні виявила, що післяопераційна ФП, що вперше виникла, може спостерігатися у однієї третини пацієнтів, які проходять ізольоване АКШ. 548 Наявність ФП після АКШ сама по собі пов’язана із підвищенням рівня захворюваності та смертності через серцеві хвороби, подовженням терміну госпіталізації, зростанням витрат на медичну допомогу та незадовільним довгостроковим прогнозом. 549, 550 Було проаналізовано ряд спроб запобігти післяопераційній ФП та контролювати її, що включали, зокрема, застосування магнію, статинів, стероїдів та препаратів-антиоксидантів. 547
Можна розпочинати застосування антиаритмічних препаратів до проведення операції, проте слід зважити доцільність такого підходу з урахуванням побічних ефектів. Бета-блокатори значно зменшують ризик виникнення ФП після АКШ. 551–557 Оскільки бета-блокатори є ефективними у профілактиці післяопераційної ФП та можуть застосовуватися із низьким ризиком, їх використання рекомендується для зменшення частоти ФП після АКШ; проте, застосування бета-блокаторів після АКШ можна припиняти у разі відсутності ФП та інших підстав для їхнього застосування (наприклад, зниження систолічної функції ЛШ). Оптимальний період до припинення бета-блокади невідомий, проте 3-місячний період здається достатнім, враховуючи той факт, що ймовірність виникнення післяопераційної ФП швидко зменшується після АКШ. 631
Аміодарон є ефективним у профілактиці розвитку післяопераційної ФП, 552, 558, 559 проте може спричинити брадикардію.
Післяопераційна фібриляція передсердь та ризик інсульту. Післяопераційна ФП пов’язана з підвищенням ризику емболічних явищ у 2–4 рази. Нещодавно проведений аналіз >16 000 пацієнтів, які проходили АКШ, виявив, що застосування пероральних антикоагулянтів, розпочате з моменту виписки у 20% пацієнтів з післяопераційною ФП, призводило до зменшення відносного ризику летальних наслідків на 22%. 560 У пацієнтів з післяопераційною ФП сукупний ризик смерті у зв’язку з емболією зростає протягом першого року після АКШ і продовжує зростати, поки не сплине 2 роки з моменту операції, після чого досягає області «плато», що свідчить про те, що ризик інсульту у пацієнтів з АКШ, що мають післяопераційну ФП, пов’язаний не лише у успішністю операції. Лікування антитромбоцитарними засобами з метою профілактики інсульту у пацієнтів з післяопераційною ФП має відбуватися згідно з Рекомендаціями щодо лікування антитромбоцитарними засобами ФП, не пов’язаної із АКШ. 547 У разі збереження післяопераційної ФП протягом більш ніж 48 годин, необхідно розпочата антикоагуляційну терапію гепарином або НПАК; її слід продовжувати протягом принаймні 4-х тижнів після відновлення синусового ритму або довше у разі наявності факторів ризику інсульту. 547 Відсутність документально підтвердженої ФП протягом періоду спостереження – навіть у разі наступного посиленого контролю наявності ФП та ризику інсульту – необов’язково має призводити до відмови від лікування антикоагулянтами, враховуючи високу частоту безсимптомних «прихованих» випадків ФП. 561 Відсутні дані щодо того, чи впливає профілактична абляція ФП під час операції на виникнення післяопераційної ФП.
Одночасні хірургічні процедури для лікування фібриляції передсердь або інсульту. Оригінальна процедура розрізання та зшивання «лабіринт» для лікування ФП, описана Коксом (Cox) та співавт., 562 передбачає видалення або перев’язку вушка лівого передсердя (LAA). Окрім того, ретроспективний аналіз продемонстрував, що хірургічна оклюзія LAA незалежно від хірургічного лікування ФП під час основної операції зменшує ризик інсульту. 563 Аналогічним чином, транскатетерна оклюзія LAA у дослідженні під назвою PROTECT AF (Watchman Left Atrial Appendage System for Embolic Protection in Patients with Atrial Fibrillation) виявилася не менш ефективною, ніж застосування пероральних антикоагулянтів – антагоністів вітаміну К у пацієнтів з ФП. 564 Здатність хірургічної облітерації LAA (для якої не використовуються протези, що знаходяться у безпосередньому контакті з кров’ю, що потенційно виключає потребу у застосуванні тривалої антитромбоцитарної / антикоагуляційної терапії) зменшувати ризик інсульту поки не була вивчена у рандомізованих проспективних дослідженнях. На сьогодні можливо розглядати доцільність одночасної хірургічної облітерації LAA для зменшення ризику інсульту у пацієнтів після АКШ з наявністю ФП у анамнезі, проте для остаточного вирішення цього питання необхідні рандомізовані дослідження. Видалення або перекриття LAA слід розглядати як додаток, а не альтернативу лікуванню антикоагулянтами аж до появи більшої кількості даних, зібраних протягом більш тривалих періодів.
/113/tab49.jpg)
/113/tab50.jpg)
14. АСПЕКТИ ПРОЦЕДУРИ АОРТОКОРОНАРНОГО ШУНТУВАННЯ
Передопераційні заходи. Більшість пацієнтів, зарахованих до лікарень з метою проведення хірургічної реваскуляризації, вже використовували медикаментозне лікування інгібіторами ангіотензин-перетворюючого ферменту (АПФ), статинами, антиагрегантними засобами, бета-блокаторами та/або іншими засобами проти стенокардії. Прийом бета-блокаторів не слід припиняти, щоб уникнути гострої ішемії, а прийом статинів слід продовжувати до операції – або розпочати їх застосування, якщо це не було зроблене раніше. Застосування інгібіторів АПФ можна припинити за 1–2 дні до АКШ, щоб уникнути потенційних несприятливих наслідків гіпотензії під час операції.
У розділі, присвяченому антитромботичним та антиагрегантним засобам лікування, будуть розглянуті особливості підготовки та проведення процедури АКШ, які стосуються цього конкретного аспекту.
Хірургічні процедури/ Повнота реваскуляризації. У ідеалі, загальноприйняте визначення повноти міокардіальної реваскуляризації включає: (i) розмір судини, (ii) тяжкість ураження, (iii) ішемічне навантаження, спричинене ураженням і (iv) життєздатність відповідної зони міокарда. 591–593 Поточна хірургічна практика ґрунтується на анатомічному визначенні повної реваскуляризації, що визначається як обхідне шунтування усіх епікардіальних судин діаметром ≥ 1,5 мм зі зменшенням діаметру на ≥ 50%, принаймні на одній проекції ангіограми. 594 Тим не менш, у інших клінічних випробуваннях використовувалися різні визначення повноти реваскуляризації. Наслідки неповної реваскуляризації для пацієнтів, які проходили АКШ, були такими самими 595–599 або гіршими 594, 598, 600, 601 за наслідки для пацієнтів з повною реваскуляризацією. Базове дослідження втручання виявило кращі результати ФРК-керованої функціонально повної реваскуляризації, аніж результати, одержані для анатомічно повної реваскуляризації методом ПКВ. 50 На сьогодні, тим не менш, ці результати не можна екстраполювати на усю зазначену групу пацієнтів, які пройшли АКШ. 53
15. ПРОЦЕДУРНІ АСПЕКТИ ПЕРКУТАННОГО КОРОНАРНОГО ВТРУЧАННЯ
Пристрої для перкутанного коронарного втручання/ Балонна ангіопластика. Звичайна балонна ангіопластика була заміщена в лікуванні нових коронарних уражень після демонстрації переваги BMS і, зовсім недавно, DES з точки зору повторних реваскулярізацій. 645 Свій внесок у лікуванні внутрішньо-стентового рестенозу мало також покращення після недавніх досліджень, що продемонстрували переваги DES та балонів з лікарським покриттям, показаних для цього. 505, 511 Однак, балонна ангіопластика може бути цінним варіантом ПКВ у всіх пацієнтів, у яких імплантація стентів є технічно недосяжною, або в судині, яка є занадто малою для стентування ( < 2,0 мм), а також у пацієнтів з критичними стенозами, які вимагають термінового хірургічного втручання.
Коронарні стенти /Непокриті металеві стенти. Коронарні стенти є дуже ефективними при відновлювальних диссекціях, тому відпала необхідність термінової операції АКШ у зв’язку з різким закриттям судини. Повністю покриті стенти можуть врятувати життя в рідкісних випадках ішемічної перфорації. Внесок BMS – це приблизно на 30% нижчий рівень рестенозу, ніж при звичайній балонній ангіопластиці. 645 Хоча було докладено багато зусиль для подальшого зниження частоти виникнення рестенозу шляхом модифікації конструкції і матеріалів стента, витончення стента було єдиним доведеним способом, здатним знижувати рестеноз BMS. Непокриті металеві стенти асоціювались зі сприятливими результатами відносно летальності, інфаркту міокарда та тромбозу стента. 124 Однак, через те що ангіографічний стеноз повторюється в 20–30% випадків протягом 6–9 місяців після імплантації, рестеноз BMS часто згадується як «ахіллесова п’ята» ПКВ. 645 Немає ніяких показань для надання переваги BMS перед DES нового покоління, незалежно від пацієнта і різновиду ураження. Крім того, немає чітких доказів різниці в ризику розвитку тромбозу стента між DES і BMS після незапланованого припинення курсу ПАТТ. 648
Стенти з лікарським покриттям раннього покоління. Ризик рестенозу BMS призвів до розробки DES, які складаються з платформи металевого стента з регульованим вивільненням антипроліферативних лікарських засобів, в основному контрольованих поверхневими полімерами. DES раннього покоління виділяють сиролімус (наприклад, Сайфер®), або паклітаксел (наприклад, Таксус®). 650 Як і у власних судинах, так і в обхідних венозних шунтах, DES сильно скорочують ангіографічну та показану ішемією РЦС. 124, 495 Таким чином, ризик клінічного рестенозу при використанні DES раннього покоління був на 50–70% нижчим, ніж при застосуванні BMS, необхідна кількість яких для лікування складає приблизно 7–8. 124 У РКД, після використання DES або BMS не спостерігалося жодних істотних відмінностей в довгострокових оцінках смертності або інфаркту міокарда. 124, 199 Незважаючи на переважаючу анти-рестенозну ефективність DES раннього покоління над BMS, завдяки дослідженням, проблеми, що виникають, показали підвищену схильність до дуже пізнього тромбозу стента. 244, 651, 652 Хоча DES раннього покоління представляли собою важливий крок вперед в області ПКВ, 653 сьогодні вони відіграють непотрібну роль в лікуванні ІХС, і в значній мірі витіснені завдяки DES нового покоління. 3
Стенти з лікарським покриттям нового покоління. DES нового покоління характеризуються тонко-каркасними, металевими платформами, які виділяють лімус-основані антипроліферативні лікарські засоби зі стійких полімерів з поліпшеною біосумісністю та низькомолекулярною полімерною масою, 654, 655 біорозкладаючих полімерів, 654, 656–658 або вільних від полімерів поверхонь. 659, 660 Нещодавні дослідження показали перевагу DES нового покоління над DES раннього покоління не тільки по відношенню до ефективності, але також і по відношенню до безпеки. 128, 129, 661, 662 Відносно попередніх проблем дуже пізнього тромбозу стента, DES нового покоління принаймні так само безпечні, як і непокриті металеві стенти впродовж тривалого періоду спостереження. У Таблиці 10 зазначено затверджений список Європейської Відповідності (ЄВ) DES нового покоління, щодо даних РКД з клінічними кінцевими точками. У Таблиці 11 представлений затверджений список ЄВ DES нового покоління, доведена ефективність яких була заснована на ангіографічних результатах досліджень з контрольною групою або без неї. Ці таблиці надають тільки тимчасовий «знімок» наявних продуктів, а нові пристрої або оновлені дані про встановлені пристрої будуть внесені по мірі їх надходження.
Коментар робочої групи: В доданих таблицях, в яких перераховуються моделі стентів, які рекомендовані Європейським товариством кардіологів, представлено багато стентів (та інших пристроїв), які не мають реєстрації в Україні. Однак, члени робочої групи вважають, що перерахування цих продуктів в Настанові необхідно зберегти, так як протягом часу реєстрація перерахованих і рекомендованих устройст цілком можлива.
/113/tab51.jpg)
/113/tab52.jpg)
/113/tab52_2.jpg)
Показання для використання DES нового покоління. Збільшення ефективності та безпеки DES нового покоління дозволило їх необмежене використання у пацієнтів з ІХС та показаннями до ПКВ, включаючи пацієнтів з цукровим діабетом, різними судинними захворюваннями та ураженнями стовбура ЛКА, гострим інфарктом міокарда, трансплантатом з підшкірної вени і рестенотичними ураженнями і хронічними тотальними оклюзіями. 3 Тому DES нового покоління слід розглядати як основу у всіх клінічних умовах і при різних видах уражень. Що стосується хворих, які вимагають антикоагуляції із застосування новітніх пероральних антикоагулянтів (НПАК), перенесли некардіологічну операцію або ускладнення, пов’язані з кровотечею, або не дотримуються режиму лікування, попередні побоювання, пов’язані з відмінностями в тривалості ПАТТ і ризиком її припиненням, виходячи з останніх даних, не мають передумов. 648, 663
Біорозсмоктуючі стенти. Повністю біорозсмоктуючі стенти, які розчиняються після виконання своєї функції підтримки в місці пошкодження коронарної судини, були багаторічною метою з моменту введення металевих стентів. Поєднання платформ стентів, що розсмоктуються, з властивостями лікарських покриттів розширило ефективність цих пристроїв. Поточні платформи стента базуються на основі двох технологій: виготовлення стентів що біорозсмоктуються з лікарським покриттям, на основі полімерів та металевих (магнієвих) стентів з лікарським покриттям, що розсмоктуються. 684 Процес розсмоктування платформи стента займає від кількох місяців до 2 років, залежно від полімерного складу. На сьогоднішній день, стенти що біорозсмоктуються, були показані до повного розчинення протягом певного періоду часу, для відновлення судинно-рухової функції відновлюваних сегментів коронарних судин, і, в результаті, позитивного ремоделювання кінцевого розширення просвіту судин. У невеликій групі пацієнтів з відносно простими ураженнями, ранні результати є багатообіцяючими і, здається, схожими на результати DES нового покоління. 685–687 Однак підтвердження у великомасштабних РКД вимагає встановлення показань для застосування цих пристроїв. В Таблиці 12 міститься список пристроїв, дозволених для використання в Європі.
/113/tab53.jpg)
Балони з лікарським покриттям. Обгрунтування використання балонів з лікарським покриттям засноване на принципі того, що достатньо навіть короткого контакту між поверхнею балона з високоліпофільними лікарськими засобами та стінкою судини для ефективної доставки лікарського засобу. Використання балона покритого паклітакселем, в трьох РКД (Paclitaxel-Coated Balloon Catheter I [PACCOCATH-I] і PACCOCATH-ІІ, 507, 508 і Paclitaxel-Eluting PTCA–Catheter In Coronary Disease II [PEPCAD-II]), 689 орієнтоване на рестеноз стента після імплантації BMS, а три інші орієнтовані на рестеноз стента у хворих, які переважно отримували DES покриті лімус-аналогами. 509–511 В силу досягнутих позитивних результатів без додаткової імплантації стента, балони з лікарським покриттям можуть являти собою привабливий варіант для пацієнтів з рестенозом після імплантації DES, хоча не відомо, чи є вони безпечними і ефективними при цих показаннях для DES нового покоління, покритих лімус-аналогами.
У рандомізованому дослідженні PEPCAD III, поєднання балона з лікарським покриттям з хром-кобальт імплантованим стентом поступалося сиролімус-покритому стентові в нових показаннях. 690 Крім того, у дослідженні DEB-AMI (Drug Eluting Balloon in Acute Myocardial Infarction) було продемонстровано, що у пацієнтів зі STEMI балон з лікарським покриттям з подальшою імплантацією BMS поступався паклітаксел-покритим стентам. 691 Недавнє ангіографічне дослідження показало, що балони з лікарським покриттям можуть слугувати в якості альтернативи паклітаксел-покритим стентам для лікування уражень в малих коронарних судинах; 692 однак, роль балонів з лікарським покриттям в цій обстановці оцінювалась в порівнянні з більш ефективним DES нового покоління з лімус-аналогами. Існують різні типи балонів з лікарським покриттям, схвалені для використання в Європі, їх основні характеристики наведені в Таблиці 13. Більшість відмінностей пов’язані з носієм лікарського засобу, в той час як паклітаксел в даний час є єдиним використовуваним активним лікарським засобом. Оскільки недостатньо спеціально розроблених порівняльних досліджень, ніхто не може передбачити класовий ефект усіх балонів з лікарським покриттям. 693
/113/tab54.jpg)
Інші пристрої. Хоча регулярне використання ротаційної атеректомії не знижує наслідків після встановлення DES, 698 такий пристрій технічно може знадобитися у разі щільних кальцифікованих уражень, для можливого подальшого проходження балонів та стентів. Можна повернутися до використання ротаційної атеректомії з метою оптимального наближення до ураження у пацієнтів, які перенесли імплантацію біорозсмоктуючих стентів.
16. ДОДАТКОВІ ІНВАЗИВНІ ДІАГНОСТИЧНІ ДОСЛІДЖЕННЯ
Внутрішньосудинне ультразвукове дослідження. Коронарна ангіографія не в змозі візуалізувати атеросклеротичне ураження артеріальної стінки. Внутрішньосудинне ультразвукове дослідження (ВСУЗД) дозволяє в режимі реального часу, томографічно встановити площу просвіту і склад бляшки, її розмір і розподіл. В результаті дифузного ураження і ремоделювання судин, коронарна ангіографія недооцінює масштаби і тяжкість захворювання в порівнянні із ВСУЗД. 699 Хоча ВСУЗД за своєю природою є інвазивним дослідженням, воно є встановленим стандартом для точного вимірювання розміру бляшок і виступає методикою, яка систематично використовується для визначення впливу різних препаратів на коронарні прогресуючі або регресуючі бляшки. 700, 701
Кілька РКД, що стосувались визначення потенціалу ВСУЗД в зниженні рестенозу і несприятливих наслідків після імплантації BMS, мають суперечливі результати. Більшість з цих РКД зосереджені на оптимізації розширення просвіту стента за допомогою ВСУЗД. Виходячи з висновків мета-аналізів згодом припустили, що кращі клінічні та ангіографічні результати можуть бути отримані під супроводом ВСУЗД. 702–704 В епоху DES, межу збільшення просвіту стента (5,0–5,5 мм2) було запропоновано розглядати в якості предиктора появи пізніх небажаних явищ. У підгрупі пацієнтів з ураженням стовбура ЛКА, обсерваційні дослідження свідчать про те, що у супроводі ВСУЗД імплантований стент пов’язаний з поліпшенням виживаності при тривалому клінічному спостереженні. Використання інтракоронарного зображення також рекомендується пацієнтам з невдачами після встановлення стента, у тому числі рестенозом і тромбозом стента, з метою експлікації та коригування основних механічних факторів. У багатоцентровому дослідженні без критеріїв виключення, проведеному з метою встановлення частоти, предикторів і термінів виникнення тромбозу стента, було виконане заздалегідь заплановане субдослідження, в якому порівнювались результати ВСУЗД та ангіографічного супроводу імплантації DES. 706
ВСУЗД-супровідну DES імплантацію (до і після ПКВ у 63% врахованих випадків) проводили у 3349 із 8583 пацієнтів (39%). У багатофакторному аналізі з поправкою на схильність, ВСУЗД-супровід був пов’язаний зі зниженням частоти ідентифікованого або передбачуваного тромбозу стента (скоригований ВР 0,40; 95% ДІ 0,21–0,73; P=0,003), інфаркту міокарда (скоригований ВР 0,66; 95% ДІ 0,49–0,88; P=0,004) і основних небажаних серцево-судинних явищ (скоригований ВР 0,70; 95% ДІ 0,55–0,88; P=0,003) через 1 рік після встановлення стента. Відчутними обмеженнями цього дослідження були відсутність рандомізації та заздалегідь встановлених рекомендацій щодо виконання ВСУЗД.
Для забезпечення додаткових діагностичних результатів, крім звичайної сірої шкали ВСУЗД, використовувались й інші пристрої, що базуються на ультразвуку. Оцінка складу бляшки може бути додатково покращена шляхом аналізу повного радіочастотного сигналу з використанням різних діагностичних алгоритмів, в тому числі тих, які використовуються у «віртуальній гістології».
Оптична когерентна томографія. (ОКТ) заснована на світловий модальності внутрішньосудинного зображення з більш високою просторовою роздільною здатністю, ніж ВСУЗД (15 проти 150 мкм) і ідеально підходить для точного виявлення внутрішньо-просвітних структур. Також може бути визначений склад бляшки, у тому числі в присутності ліпідного скупчення і внутрішньо-просвітного тромбу. 707 Слід зазначити, що це єдиний метод, здатний забезпечити точні вимірювання товщини фіброзного потовщення і виявити навіть незначні порушення в потовщенні. 707, 708 Ранні стадії серцевої алотрансплантатної васкулопатії, що пов’язані з серйозними прогностичними наслідками, часто не помітні при ангіографії, але можуть бути візуалізовані завдяки ОКТ або ВСУЗД. Для отримання зображень при ОКТ потрібне повне видалення крові з просвіту судини, також це дослідження характеризується обмеженим проникненням до стінок судин і, отже, не в змозі цілком оцінити обсяги ураження бляшкою. Після імплантації стента, ОКТ є більш точною, ніж ВСУЗД, у виявленні малопомітних морфологічних деталей, включаючи неправильне встановлення стента, наявність залишкових пошкоджень і тромбів, пролапсу бляшки, хоча клінічну значимість цих наслідків ще належить визначити. 709, 710 Під час тривалих проведеннях подальших досліджень, ОКТ є більш точним, ніж ВСУЗД для оцінки навіть товщини неоінтими, приєднання та охоплення каркасу стента. Ці дані є важливими сурогатними маркерами ефективності та безпеки DES і часто використовуються для оцінювання нових DES. На основі недавнього ретроспективного обсерваційного дослідження було зроблено припущення, що ОКТ-супровідне стентування може поліпшити клінічні наслідки. 711 Завдяки дуже високій роздільній здатності, ОКТ використовують для виявлення основних механізмів виникнення невдач після встановлення стента, в тому числі рестенозу і тромбозу стента. 516 Крім того, завдяки цьому дослідженню можна охарактеризувати неоінтімальну тканину всередині стента, включаючи виявлення неоатеросклерозу, який може бути пов’язаний між рестенозом всередині стента і тромбозом стента. 516, 712 Для визначення клінічного значення ОКТ необхідні подальші дослідження.
Тиск, що вимірюється при визначенні фракційного резерву кровоточу. Фракційний резерв кровотоку (ФРК) є діючим стандартом клінічної практики функціональної оцінки тяжкості ураження. 713 Методи візуалізації відкривають цінну інформацію (тобто, дозволяють встановити мінімальну площу просвіту судини), але ФРК здатний забезпечити фізіологічну оцінку. Початкові дослідження показали, що порогове значення 0,75 було надійним для виявлення ішемічного пошкодження, але згодом критерій 0,80 отримав широке визнання і його клінічна роль була підтверджена за результатами досліджень. Оцінка ФРК є цінною для пацієнтів, які перенесли діагностичну коронарну ангіографію без попереднього неінвазивного функціонального тестування за наявності суттєвих пошкоджень і у пацієнтів з багатосудинним ураженням. Підхід до уникнення непотрібного лікування уражень, які є гемодинамічно незначними, був продемонстрований в випробуваннях DEFER і FAME (Fractional Flow Reserve Vs. Angiography for Multivessel Evaluation). 50, 51 Нещодавно, результати дослідження FAME II показали, що у пацієнтів зі стабільною ІХС, ПКВ з використанням DES, кероване ФРК, призвело до зменшення потреби в терміновій реваскуляризації, в порівнянні з медикаментозною терапією. 54 Тоді як ФРК потребує максимальної і стабільної гіперемії (зазвичай її отримують шляхом внутрішньовенного введення аденозину), з метою спрощення досліджень та досягнення більш широкого застосування фізіологічного оцінювання були запропоновані нові методи і показники (в тому числі миттєвий показник iFR [instantaneous wave-free ratio]), які не ґрунтуються на запропонованій концепції максимальної гіперемії. Подальші дослідження повинні підтвердити значення цих нових показників в прийнятті клінічних рішень. 714 Фракційний резерв кровотоку також можна встановити на усьому коронарному судинному дереві з використанням анатомічної інформації, отриманої завдяки багатозрізовій КТ. 715, 716 Хоча визначення ФРК у супроводі із КТ завдяки своїй неінвазивній природі є привабливою методикою, вона вимагає подальшої клінічної перевірки, перш ніж її клінічне застосування може бути виправдане.
/113/tab55.jpg)
17. ЧЕРЕЗШКІРНЕ КОРОНАРНЕ ВТРУЧАННЯ ПРИ СТАБІЛЬНІЙ ІШЕМІЧНІЙ ХВОРОБІ СЕРЦЯ
17.1 Антитромбоцитарна терапія при ЧКВ у хворих зі стабільною ІХС
Подвійна антитромбоцитарна терапія включає в себе прийом ацетилсаліцилової кислоти (АСК) з пероральною навантажувальною дозою 150-300 мг (або 80-150 мг в/в) з подальшим прийомом 75-100 мг перорально щодня плюс клопідогрель з навантажувальною дозою 300-600 мг, з подальшим прийомом в дозі 75 мг щодня. 773-775 Ацетилсаліцилова кислота діє шляхом незворотного інгібування циклооксигенази-1 тромбоцитів (ЦОГ-1), яка зазвичай комплексно призначається з постійним режимом дозуванням ≥ 75 мг/добу. На відміну від антитромбоцитарних ефектів, побічні ефекти АСК з боку шлунково-кишкового тракту збільшуються при більш високих дозах. Оптимальне співвідношення ризик-користь досягається за допомогою прийому АСК у дозі 75-150 мг/добу. 774, 776
Доказів користі систематичного попереднього навантаження клопідогрелем до проведення діагностичної коронарної ангіографії при стабільній ІХС немає. 777 Навантажувальна доза в ≥ 600 мг рекомендована пацієнтам із запланованим елективним ПКВ, якщо відома анатомія коронарних артерій. Застосування більш високої підтримуючої дози (150 мг) було запропоновано пацієнтам з високим тромботичним ризиком (наприклад, при цукровому діабеті, після повторного інфаркту міокарда, після раннього та пізнього тромбозу стента, при складних ураженнях, в загрозливих для життя ситуаціях при виникненні оклюзії); однак, дослідження не встановили короткострокової або довгострокової користі від добової підтримуючої дози в 150 мг. Зокрема, дослідження GRAVITAS (Gauging Responsiveness with A Verify Now assay: Impact on Thrombosis And Safety) не змогло показати користі подвоєння підтримуючої дози клопідогрелю у пацієнтів, які вважалися такими, що не відреагували на лікування. 778
Рекомендується довічне проведення антитромбоцитарної монотерапії. Пацієнти повинні бути проінструктовані про те, що їм не слід передчасно припиняти антитромбоцитарну терапію пероральними препаратами після стентування через можливі ризики тромбозу стента та інфаркту міокарда. 774, 779 Дані реєстру PARIS (Patterns of Non-Adherence to Anti-Platelet Regimens In Stented Patients) показують, що небажані серцеві явища після припинення ПАТТ залежать від клінічної ситуації і причини припинення терапії, і, що вони зменшуються з плином часу. 648 Половина випадків, при яких лікування було припинено протягом 2 років після імплантації стента, відбувались під керівництвом лікаря і не призводили до розвитку жодних побічних ефектів. Порушення, пов’язані з кровотечею або недотриманням режиму лікування, склали 14% всіх випадків припинення і були пов’язані зі значним підвищенням ризику тяжких побічних реакцій з боку серця, хоча цей зв’язок в значній мірі послаблюється через 30 днів. Хоча загальний внесок припинення ПАТТ до ризику серцево-судинних ускладнень був невеликим, при цьому, ускладнюючи існуючі парадигми для розширення антитромбоцитарної терапії у стабільних пацієнтів після ПКВ, ці результати свідчать про необхідність навчання пацієнтів.
Внутрішньовенна антитромбоцитарна терапія. Останні дослідження не продемонстрували додаткової користі від застосування інгібіторів ГП IIb/IIIa після прийому навантажувальної дози клопідогрелю в 600 мг. 780-782 Проте життєвий досвід свідчить про те, що інгібітори ГП IIb/IIIa можуть бути корисними при надзвичайних ситуаціях (формування тромбу при проведенні процедури, повільний кровотік, загроза закриття просвіту судини). 86 Застосування кангрелору розглядається в розділі 18.4.2.
17.2 Антикоагулянтна терапія
Дослідження REPLACE-2 (Randomized Evaluation in PCI Linking Angiomax to Reduced Clinical Events 2) показало схожий результат застосування бівалірудину та попередньої блокади ГП IIb/IIIa з результатом застосування нефракціонованого гепарину (НФГ) у поєднанні з запланованим інгібуванням ГП IIb/IIIa під час ПКВ при стабільній ІХС. 783 Згодом, дослідження ISAR-REACT 3 (Intracoronary Stenting and Antithrombotic Regimen-Rapid Early Action for Coronary Treatment 3), яке проводилось серед пацієнтів, що проходили попереднє лікування клопідогрелем, показало аналогічні чисті клінічні результати застосування бівалірудину та НФГ, 784 але доза НФГ була вищою (140 МО/кг) за рекомендовану, що призвело до надлишку кровотеч у пацієнтів, які переважно проходили процедури через стегновий доступ. Зважаючи на результати первинних кінцевих точок і тенденцію до зниження ризику інфаркту міокарда, антикоагуляція із застосуванням НФГ та в/в болюсної терапії 70-100 МО/кг залишається стандартною антикоагуляційною терапією при елективному ПКВ. Серед пацієнтів, які перенесли ПКВ, з негативними біомаркерами, бівалірудин зменшив ризик кровотечі, не впливаючи на смертність і, отже, може розглядатися для використання у пацієнтів з високим ризиком розвитку кровотеч. 785
/113/tab56.jpg)
/113/tab56_2.jpg)
Дослідження STEEPLE (The Safety and Efficacy of Intravenous Enoxaparin in Elective Percutaneous Coronary Intervention Randomized Evaluation) продемонструвало низьку ймовірність розвитку кровотечі при внутрішньовенному введенні еноксапарину (0,5 мг/кг; P=0,01; 0,75 мг/кг; P=0,05) і на 57% меншу ймовірність виникнення масивної кровотечі при застосуванні обох доз (P<0,01 для обох доз) у порівнянні з НФГ з аналогічною ефективністю. 786 Проте, значна користь по відношенню до первинної кінцевої точки була виявлена тільки в групі лікування низькими дозами, яке було припинено достроково через незначну тенденцію до надмірної смертності, не пов’язаною з ішемічними подіями і, яка не була підтверджена протягом річного подальшого спостереження. 787 Недавній мета-аналіз підтвердив сприятливий профіль безпеки. 788
Це дослідження передбачає, що ймовірно слід брати до уваги низьку дозу ривароксабану (2,5 мг двічі на добу) для пацієнтів, які отримують АСК та клопідогрель після розвитку ГКС, зокрема після STEMI. 857
Однак, фаза ІІІ дослідження апіксабану, ще одного антагоніста фактора Ха, (Apixaban for Prevention of Acute Ischemic and Safety Events 2 [APPRAISE-2]), 858 в якій порівнювалась комбінація повної дози апіксабану (5 мг двічі на добу) та ПАТТ із власне ПАТТ, була припинена на початку з міркувань безпеки, пов’язаних з підвищенням ризику кровотечі за відсутності ефективності лікування ІХС у пацієнтів з високим ризиком розвитку ГКС. Зокрема, популяція дослідження мала вищий показник супутніх захворювань, і апіксабан застосовувався в повній дозі для попередження кардіо-емболічного інсульту при неклапанній фібриляції передсердь.
Нарешті, дарексабан та дабігатран досліджувались у фазі ІІ досліджень з визначення оптимальної дози у пацієнтів після ГКС. 859, 860 В обох випадках спостерігалося дозо-залежне зростання частоти значних кровотеч, але за цих умов не було ознак додаткової ефективності при додатковому застосуванні антикоагулянтів при антитромбоцитарній терапії.І навпаки, у фазі ІІ досліджень з визначення оптимальної дози ривароксабану та апіксабану було продемонстровано вищу дозо-залежну частоту проявів значних кровотеч при значно нижчих показниках смертності, інфаркту міокарда або інсульту, ніж при використанні плацебо замість ривароксабану і подібною тенденцією для апіксабану. 861,862 Фармакологічні характеристики пероральних антикоагулянтів прямої дії узагальнено в Таблиці 14.
/113/tab57.jpg)
Підбиваючи підсумки, слід зазначити перспективність ролі пероральних антикоагулянтів прямої дії в комбінації з ПАТТ у вторинній профілактиці ГКС. Проте незавершеність тлумачення сукупності проявів цього класу препаратів вимагає подальшого проведення їх дослідження.
Антикоагуляція під час перкутанного коронарного втручання у пацієнтів, які приймають пероральні антикоагулянти. Вагома частка пацієнтів (6–8%), які проходять ПКВ, мають показання до довготривалого застосування пероральних антагоністів вітаміну К (АВК) або новітніх пероральних антикоагулянтів (НПАК) через різні компрометуючі стани, такі як фібриляція передсердь з помірним чи високим ризиком емболії, наявність штучних клапанів серця або венозного тромбоемболізму. Переривання терапії АВК може призвести до підвищення ризику виникнення тромбоемболії. 863 Перкутанне коронарне втручання може бути непростим процесом з повною антикоагуляцією за допомогою АВК або НПАК.
При елективному ПКВ додаткова антикоагуляція може не знадобитися, якщо міжнародне нормалізаційне співвідношення (МНС) складає >2,5. Найкращим вибором має бути радіальний доступ задля зменшення ризику виникнення перипроцедурної кровотечі.
Пріоритетною стратегією має бути ПКВ без переривання терапії АВК, аби уникнути перехідної терапії, яка може призвести до більшої кровотечі або ішемічних ускладнень. Крім того, слід уникати застосування інгібіторів ГП IIb/IIIa, крім невідкладних випадків.
В першу чергу, ПКВ у пацієнтів, які приймають пероральні антикоагулянти, має проводитися через радіальний доступ із застосуванням додаткових парентаральних антикоагулянтів, незалежно від часу прийому останньої дози перорального антикоагулянта. За умови короткотривалої дії в 25 хвилин та меншого ризику кровотечі, бівалірудин – застосовують під час процедури та негайно припиняють прийом після первинного ПКВ – може мати переваги над НФГ або еноксапарином, особливо якщо пацієнти знаходяться під дією дабігатрану. Еноксапарин має бути парентеральним антикоагулянтом вибору у випадках попереднього застосування анти-Ха інгібітора прямої дії (ривароксабан або апіксабан), щоб уникнути перехресної реактивності. Крім невідкладних ситуацій, слід загалом уникати застосування інгібіторів ГП IIb/IIIa.
Антитромботична терапія після перкутанного коронарного втручання у пацієнтів, яким необхідні пероральні антикоагулянти. Довготривалий вплив на пацієнтів потрійної терапії пов’язаний з високим ризиком кровотечі. 864 Смертельні кровотечі виникають в 1 з 10 випадків кровотеч, половина з яких має внутрішньочерепне походження, а половина – кишково-шлункове. 865 Докази надто непевні для надання чітких рекомендацій. 866, 867 Потрійна терапія, що складається з АСК, клопідогрелю та НПАК, після ПКВ має проводитися тільки при наявності особливих показань (тобто пароксизмальна, стійка або перманентна фібриляція передсердь з оцінкою за шкалою CHA2DS2-VASc (до її складу входять наступні показники: серцева недостатність, гіпертензія, вік ≥ 75 [подвоєний], цукровий діабет, інсульт [подвоєний] – захворювання судин, вік 65–74 роки та статева приналежність [жінки]) ≥ 2; штучний клапан; тромбоз глибоких вен або наявність легеневої емболії в минулому чи зараз).
Потрійна терапія повинна мати обмежену тривалість в залежності від клінічної картини, ризику тромбоемболії (оцінка за шкалою CHA2DS2-VASc) та кровотечі за шкалою HAS-BLED (до її складу входять наступні показники: гіпертензія, порушення функції нирок та печінки, наявність інсульту, схильність або наявність в анамнезі кровотеч, нестабільне МНС, похилий вік, наркотична / алкогольна залежність). Слід уникати застосування прасугрелю або тікагрелору як частини потрійної терапії, через недостатньо встановлену ефективність та більший ризик виникнення значних кровотеч у порівнянні з клопідогрелем (ВР 4,6; 95% ДІ 1,9–11,4; P<0,001) у неекспериментальному дослідженні. 868 Слід застосовувати засоби захисту кишково-шлункового тракту з блокатором протонного насосу. Інтенсивність дозування пероральних антикоагулянтів слід ретельно відстежувати з метою досягнення МНС 2,0–2,5 у випадку застосування АВК та застосування меншої перевіреної дози, аби запобігти розвитку інсульту у випадках застосування НПАК (дабігатран в дозі 100 мг двічі на добу; ривароксабан в дозі 15 мг один раз на добу тощо).
Складно давати рекомендації щодо типу стента (DES або BMS) за відсутності інформативних відомостей. Хоча ПАТТ зазвичай рекомендується впродовж щонайменше 1 місяця після встановлення BMS та впродовж 6 місяців після встановлення DES, ризик тромбозу стента (та інших очікуваних ішемічних проявів) від 1 до 12 місяців після стентування подібний для обох видів стента. 124, 352, 869 Крім того, останні відомості щодо ризиків побічної дії у пацієнтів, які припинили застосування ПАТТ 648 та пацієнтів, що пройшли некардіологічне хірургічне втручання, передбачають відсутність різниці між DES або BMS. 663 До появи відомостей рандомізованих досліджень ця спеціальна група рекомендує надавати перевагу DES нового покоління над BMS у пацієнтів, що потребують застосування пероральних антикоагулянтів та знаходяться в групі низького ризику кровотечі (оцінка за шкалою HAS-BLED ≤ 2). Серед пацієнтів, що пройшли ПКВ та потребують застосування пероральних антикоагулянтів, і знаходяться в групі високого ризику (оцінка за шкалою HAS-BLED ≥ 3) кровотечі, вибір між BMS та DES нового покоління слід робити індивідуально.
Відмова від застосування АСК під час продовження прийому клопідогрелю вивчалась у дослідженні WOEST (What is the Optimal antiplatElet and anticoagulant therapy in patients with oral anticoagulation and coronary StenTing), яке рандомізувало 573 пацієнтів, які застосовують подвійну терапію пероральним антикоагулянтом та клопідогрелем (75 мг на день) або потрійну терапію пероральним антикоагулянтом, клопідогрелем та АСК в дозі 80 мг на добу. Лікування продовжувалося протягом 1 місяця після встановлення BMS у 35% пацієнтів та протягом 1 року після встановлення DES у решти 65%; спостереження продовжувалося протягом 1 року. 870 Перкутанне коронарне втручання було проведено з використанням АВК у половини пацієнтів, а третина пацієнтів страждала на ГКС без елевації сегмента ST. Основний показник будь-якої кровотечі за шкалою TIMI був значно нижчим при застосуванні подвійної терапії (19,5% у порівнянні 44,9%; ВР 0,36; 95% ДІ 0,26–0,50; P<0,001). Показники інфаркту міокарда, інсульту, РЦС або тромбозу стента значно не відрізнялися, але рівень загальної смертності був нижчим в групі подвійної терапії (подвійна терапія: 2,5% в порівнянні з потрійною: 6,4%; P=0,027) впродовж одного року. Однак, відмінності були викликані незначними кровотечами, оскільки частота виникнення значних кровотеч не була значно нижчою, у більшості пацієнтів (74%) застосовувався доступ через стегнову вену, а потрійна терапія застосовувалася впродовж одного року. Хоча дослідження було занадто малим аби оцінити наслідки ішемії, подвійна терапія клопідогрелем та пероральним антикоагулянтом може розглядатися в якості альтернативи потрійній терапії у пацієнтів з групи високого ризику розвитку кровотечі.
/113/tab58.jpg)
/113/tab58_2.jpg)
ГКС=гострий коронарний синдром; АСК=ацетилсаліцилова кислота; BMS=непокритий металевий стент; CHA2DS2-VASc=зупинка серця, гіпертензія, вік ≥75 [подвоєний], діабет, інсульт [подвоєний] – захворювання судин, вік 65–74 та статева приналежність [жінки]; DAPT= подвійна антитромбоцитарна терапія; DES=стент, що виділяє лікарський засіб; НПАК=новітні пероральні антикоагулянти; HAS-BLED=гіпертензія, порушення функції нирок та печінки, інсульт, наявність кровотеч в історії хвороби або схильність до них, нестабільний міжнародний індекс нормалізації, похилий вік, наркотики/алкоголь; МНС= міжнародне нормалізаційне співвідношення; ЛШ=лівий шлуночок; ПКВ=перкутанне коронарне втручання; Стабільна ІХС=стабільна ішемічна хвороба серця; НФГ=нефракціонований гепарин.
17.3 Тривалість подвійної антитромбоцитарної терапії після ЧКВ
В базових дослідженнях, які оцінювали DES раннього покоління, тривалість ПАТТ становила 2–3 місяці для стента, вкритого сиролімусом, та 6 місяців – для стента, вкритого паклітакселем. Внаслідок міркувань щодо більшого ризику тромбозу стента та побічних ішемічних ускладнень 651 деякі протоколи рекомендують проводити ПАТТ впродовж 1 року або довше після встановлення DES. 779 Докладний аналіз порівняння DES раннього покоління з BMS підтвердив відсутність нових відомостей щодо безпеки з подібними показниками смертності та інфаркту міокарда під час довготривалого подальшого спостереження пацієнтів після закінчення дослідження впродовж наступних 5 років з нерівномірною тривалістю ПАТТ з коливаннями від 2 місяців до 1 року. 124, 649, 650 Оскільки частіше спостерігався дуже пізній тромбоз стента, це нечасте ускладнення було нівельоване дещо нижчою частотою виникнення раннього тромбозу стента та низьким ризиком інфаркту міокарда, пов’язаного з повторною реваскуляризацією. Останнім часом DES нового покоління продемонстрував характеристики безпеки, подібні чи навіть ліпші за BMS, включаючи ризик дуже пізнього тромбозу стента. 125, 129–132
Наразі доступні відомості, які не підтримують продовження ПАТТ понад 1 рік після встановлення DES. В рандомізованому дослідженні під назвою ZEST-LATE/REAL-LATE (Zotarolimus-Eluting Stent, Sirolimus-Eluting Stent, or PacliTaxel-Eluting Stent Implantation for Coronary Lesions – Late Coronary Arterial Thrombotic Events/REAL-world Patients Treated with Drug-Eluting Stent Implantation and Late Coronary Arterial Thrombotic Events) стабільним пацієнтам через 1 рік після встановлення DES призначали продовжувати прийом клопідогрелю з АСК або тільки АСК. 871 Після завершення періоду спостереження (що становив в середньому 19 місяців) було виявлено незначне підвищення частоти інфаркту міокарда, інсульту та рівня смертності серед пацієнтів, які продовжували лікування клопідогрелем на відміну від тих, хто припинив приймати клопідогрель через 1 рік після встановлення стента.
Кілька рандомізованих досліджень, включаючи EXCELLENT (Efficacy of Xience/Promus Vs. Cypher in rEducing Late Loss After stenting), 803 RESET (Real Safety and Efficacy of a 3-month Dual Antiplatelet Therapy Following Zotarolimus-eluting Stents Implantation), 805 OPTIMIZE (Optimized Duration of Clopidogrel Therapy Following Treatment With the Zotarolimus-Eluting Stent in Real-WorldClinicalPractice) 804 та PRODIGY (PROlonging Dual Antiplatelet Treatment In Patients With Coronary Artery Disease After Graded Stent-induced Intimal Hyperplasia studY), 799 порівняли короткотривалу (3–6 місяців) ПАТТ з подовженою (12–24 місяці), та відповідно продемонстрували недостатню ефективність відносно впливу на ішемію при вищому ризику кровотечі.
Останні відомості мета-аналізу порівняння ПАТТ короткої та пролонгованої (понад 12 місяців) тривалості привели до висновку, що продовження ПАТТ понад 6 місяців збільшує ризик кровотечі без зменшення показника ішемічних ускладнень. 802 Слід зазначити, що жодне з цих досліджень не проводилося з урахуванням очікуваних результатів щодо ішемії; всі вони були відкритими та відрізнялися за часом між стентуванням та рандомізацією. Тому оцінити якість отриманих доказів важко, і ці висновки потребують підтвердження подальшими широкомасштабними дослідженнями, в тому числі дослідження інтракоронарного стентування та антитромбоцитарної терапії: безпека та ефективність 6-місячної ПАТТ після встановлення стента, що виділяє лікарський засіб (ISAR-SAFE; NCT00661206) та DAPT (NCT00977938).
З огляду на добре вивчені ризики кровотечі, пов’язані з ПАТТ тривалістю більше 12 місяців, та недостатністю доказів щодо ефективності попередження ішемічних ускладнень, звичайна ПАТТ понад 6 місяців після встановлення DES нового покоління при стабільній ІХС не може бути рекомендована через доступні наразі відомості.
Відомості спостереження стентів нового покоління, вкритих зотаролімусом та еверолімусом передбачають, що навіть менш тривала ПАТТ може бути достатньою. 872, 873 У дослідженні OPTIMIZE було визначено не меншу клінічну ефективність ПАТТ впродовж 3 місяців в порівнянні з такою ж терапією впродовж 12 місяців у пацієнтів, що пройшли ПКВ із встановленням стента, вкритого зотаролімусом. 804
Загальний показник небажаних явищ не відрізнявся при короткостроковій та тривалій ПАТТ (6,0% в порівнянні з 5,8%, відповідно; різниця ризиків, 0,17; 95% ДІ 21,52–1,86). Показники кровотеч, значних чи будь-яких інших, значно не відрізнялися. Через невелику кількість достовірних відомостей про 3-місячну (або менш тривалу) ПАТТ після встановлення DES нового покоління, ця схема має залишатися першочерговою для пацієнтів групи високого ризику кровотечі або тих, кому потрібні пероральні антикоагулянти.
Для пацієнтів з високим ризиком ГСК, у яких відбувається реваскуляризація міокарда, ПАТТ рекомендується застосовувати впродовж 1 року незалежно від типу стента. Ця рекомендація ґрунтується на ранньому дослідженні CURE, – яке продемонструвало послідовне підвищення ефективності ПАТТ у порівнянні з АСК впродовж всього періоду спостереження після завершення дослідження, – а також результатах більш сучасних досліджень TRITON-TIMI 38 та PLATO, котрі показали послідовне збільшення ефективності ПАТТ з використанням нових більш потужних блокаторів рецептора P2Y12.
Після стентування при ГКС, зокрема STEMI, продовжена ПАТТ знижує ризик тромбозу стента, повторного інфаркту та смертності внаслідок серцево-судинних захворювань, 825 а більш потужні схеми ПАТТ пов’язані з найбільшим клінічним ефектом після ГКС будь-якого типу. 830 Важливо поінформувати пацієнтів та їх лікарів про необхідність уникати передчасного припинення ПАТТ.
Підсумовуючи викладене можна зробити висновок, що ПАТТ рекомендується застосовувати щонайменше впродовж 1 місяця після встановлення BMS на фоні стабільної ІХС, 86 впродовж 6 місяців після встановлення DES нового покоління на фоні стабільної ІХС, 86 та до 1 року у пацієнтів після ГКС, незалежно від стратегії реваскуляризації.180
17.4 Порушення функції нирок
Порушення функції нирок присутнє у 30–40% пацієнтів з ІХС, а ступінь тяжкості ХЗН сильно пов’язаний з ризиком несприятливих внутрішньолікарняних наслідків. Знижені клінічні результати пацієнтів з ХЗН імовірно пояснюються більшою частотою серцево-судинних захворювань в них в анамнезі, більш поширеним тромбозом артерій, більш тяжким проявом ГКС, більш низьким показником реваскуляризації та невикористанням в повній мірі обґрунтованої терапії з можливим передозуванням медикаментами у пацієнтів, чий метаболізм та виведення препаратів залежать від функції нирок.
Кліренс креатиніну слід розрахувати за формулою Кокрофта-Гольта, щоб дотриматися інструкції із застосування лікарського засобу та уникнути передозування антитромболітиками – часта ситуація у пацієнтів з хронічною нирковою недостатністю – що призводить до підвищення ризику кровотечі. 875, 876 У пацієнтів, що звернулися з приводу невідкладної ПКВ, зазвичай перша доза антитромболітичних препаратів не збільшує ризику кровотечі у випадку ХЗН.
Повторні інфузії або введення антикоагулянтів можуть призвести до накопичення препарату та збільшення ризику кровотечі. Відповідно, при відсутності протипоказань, пацієнти з ХЗН мають отримувати таку саму першочергову терапію, як і інші пацієнти. Відповідно, підбір дозування з урахуванням функції нирок має велике значення і можливо знадобиться надати перевагу особливим антитромболітичним засобам (Таблиця 59).
Це важливо задля мінімізації ризику розвитку контраст-індукованої нефропатії (КІН), щоб забезпечити відповідну гідратацію під час та після первинного ПКВ, та задля обмеження дози контрастної речовини (дивіться розділ 11.4).
Порушення функції нирок було одним з кількох критеріїв ризику, який слід було прийняти до уваги в дослідженні PLATO і виключати тільки пацієнтів з нирковою недостатністю термінальної стадії, яка потребує гемодіалізу. Пацієнти з ХЗН (21%) отримали надзвичайний ефект від тікагрелору з 23% відносним зниженням ризику (ВЗР) для основного ішемічного показника (у порівнянні з незначно нижчим на 10% показником у пацієнтів без ХЗН), і навіть більш вираженим 4% абсолютним та 28% відносним зниженням ризику загальної смертності. 877
17.5 Хірургічне втручання у пацієнтів, які проходять антитромбоцитарну терапію
Лікування пацієнтів, що приймають ПАТТ, які звернулися з приводу хірургічного втручання, залежить від терміновості, ризику утворення тромбів та кровотечі у кожного окремого пацієнта в кожному окремому випадку. 878 Більшість хірургічних процедур можна проводити при ПАТТ або при застосуванні тільки АСК з прийнятним рівнем ризику розвитку кровотечі. Для визначення групи ризику (кровотечі та тромбозу) пацієнта та обрання найкращої стратегії необхідна взаємодія фахівців різних галузей (кардіологів, анестезіологів, гематологів та хірургів). Дійсно, кровотечі, пов’язані з хірургічним втручанням, збільшують рівень смертності впродовж 30 днів та у віддаленому періоді. 573
Обсерваційні дані масштабного когортного дослідження (встановлення 124 844 BMS або DES) показують, що найсильнішими факторами ризику виникнення MACE після некардіологічного хірургічного втручання є неелективне хірургічне втручання, інфаркт міокарда в анамнезі впродовж найближчих 6 місяців після хірургічного втручання та тяжке серцеве захворювання.
Тоді як час проведення хірургічного втручання асоціювався з наявністю MACE впродовж перших 6 місяців після ПКВ, цей факт більше не мав значення через 6 місяців. 663 Слід зазначити, що тип стента (BMS або DES) не був пов’язаний з MACE після хірургічного втручання. Задля зниження ризику кровотечі та тромбозів слід відкладати рекомендовані, але необов’язкові некардіологічні хірургічні втручання до завершення повного курсу призначеної ПАТТ (найкраще через 6 місяців на фоні стабільної ІХС та через 1 рік на фоні ГКС), і це хірургічне втручання слід проводити без припинення застосування аспірину, якщо це можливо. Коротший термін ПАТТ може бути виправданий неможливістю відкласти хірургічне втручання.
При підготовці до хірургічних процедур в групі від високого до дуже високого ризику кровотечі рекомендується припинити застосування клопідогрелю за 5 днів до хірургічного втручання задля зниження ризику виникнення кровотечі та необхідності переливання крові, та одночасно продовжувати прийом АСК впродовж передопераційного періоду. 879 Прийом прасугрелю слід припинити за 7 днів до хірургічного втручання через його більш тривале та ефективне пригнічення утворення тромбів, в порівнянні з клопідогрелем.
Цікаво, що незважаючи на вищу частоту масивної кровотечі за шкалою TIMI (ВШ 4,73; 95% ДІ 1,9–11,8), переливання тромбоцитарної маси та повторні хірургічні обстеження з приводу кровотечі, прасугрель був пов’язаний з нижчим рівнем смертності після АКШ, ніж клопідогрель в невеликій підгрупі пацієнтів в дослідженні TRITON-TIMI 38 (2,3% в порівнянні з 8,7%, відповідно; середнє ВШ 0,26; P=0,025). 880 Більшість випадків АКШ були запланованими та проводилися після завершення підготовчих процедур, і зазвичай прийом досліджуваного препарату після АКШ відновлювався. В дослідженні PLATO у підгрупі пацієнтів, що проходили АКШ через 7 днів після останнього прийому досліджуваного препарату (3–5 днів), тікагрелор у порівнянні з клопідогрелем був також пов’язаний з нижчим рівнем загальної смертності (4,6% в порівнянні з 9,2%, відповідно; P=0,002) без підвищеного ризику кровотечі, пов’язаної з АКШ. 881 Більш ніж в половині випадків АКШ проводили під час підготовчих процедур. Це пояснювало меншу кількість смертей, пов’язаних з кровотечею та інфекцією, так само як і меншою кількістю ішемічних ускладнень. Всього 37% пацієнтів не відновили прийом досліджуваного препарату впродовж 7 днів після припинення.
Таким чином, припинення прийому інгібіторів P2Y12 не рекомендується в групах високого ризику, в яких продовжується ішемія, та високим анатомічним ризиком (наприклад, ураженням стовбура ЛКА або тяжким багатосудинним ураженням). Таким пацієнтам слід проходити АКШ, продовжуючи прийом інгібіторів P2Y12, і в той же час приділяючи особливу увагу зменшенню ризику виникнення кровотечі. Може бути виправданим – хоча б у пацієнтів дуже високої групи ризику – утримання від застосування інгібіторів P2Y12 перед хірургічним втручанням, навіть серед тих, у кого є активна ішемія, та приділити увагу перехідній стратегії (дивіться нижче). Слід повернутися до ПАТТ якомога швидше, включаючи навантажувальну дозу клопідогрелю, тікагрелору або прасугрелю (якщо можливо впродовж 24 годин після хірургічного втручання), тим не менш оптимальний час відновлення застосування лікарського засобу після хірургічного втручання з приводу АКШ залишається невизначеним.
Моніторинг лікування з аналізом безпосередньо біля ліжка хворого передбачали скоріше як опцію до протоколу переривання лікування, ніж застосування випадкового, специфічного періоду. Пригнічення тромбоцитів у відповідь на застосування клопідогрелю визначає кровотечу, пов’язану з АКШ, 882 а стратегія, заснована на передопераційному дослідженні тромбоцитарної функції, для визначення часу проведення АКШ у пацієнтів, що приймали клопідогрель, призводить до скорочення часу очікування на ~ 50% у порівнянні з рекомендованим у поточних Рекомендаціях. 883 З цих причин оновлення рекомендацій Асоціації торакальних хірургів 2012 року передбачає, що відкладання антитромбоцитарної терапії на день чи два обґрунтоване для зниження ризику кровотечі та утворення тромбів у пацієнтів з ГКС. 879
У ситуаціях дуже високого ризику, таких як перший тиждень після встановлення стента, передбачається, що пацієнта протягом 5 днів перед хірургічним втручанням можливо слід переключити з клопідогрелю на антитромбоцитарний засіб з коротким періодом напіввиведення (наприклад, внутрішньовенні інгібітори ГП IIb/IIIa, тірофібан або ептифібатид) з припиненням вливання за 4 години до хірургічного втручання, 884 ґрунтуючись виключно на фармакодинамічних та фармакокінетичних дослідженнях на підтримку цього підходу.
У дослідженні «Перехідна антикоагуляція у пацієнтів, які потребують тимчасового переривання терапії варфарином при рекомендованих інвазивних процедурах або хірургічному втручанні» (BRIDGE) було досліджено застосування кангрелору (внутрішньовенного зворотно-діючого інгібітора P2Y12 рецепторів тромбоцитів) порівнювалось з плацебо для переходу пацієнтів, які приймали тієнопіридин, до проведення АКШ. 854
Прийом пероральних інгібіторів P2Y12 було припинено за 48 годин до АКШ. Кангрелор призвів до вищого рівня підтримки пригнічення тромбоцитів (основний очікуваний результат, P2Y12 реагуючих одиниць <240; 98,8% (83/84) в порівнянні з 19,0% (16/84), відповідно; ВР 5,2; 95% ДІ 3,3–8,1; P<0,001). Перехід за допомогою продовження інфузій кангрелору не збільшив частоти масивних кровотеч перед хірургічним втручанням.
Заміна ПАТТ НМГ чи НФГ. 885 При хірургічних процедурах в групах від низького до помірного ризику кровотечі хірургам слід відмовитися від операції при продовженні ПАТТ.
Можна зробити висновок, що клопідогрель після АКШ виявляється безпечним та ефективним відповідно до найновішого мета-аналізу п’яти рандомізованих досліджень та шести неекспериментальних досліджень, які включали 25 728 пацієнтів, що приймали клопідогрель додатково до АСК замість прийому тільки АСК, який показав краще раннє розкриття венозного трансплантату (ВР 0,59; 95% ДІ 0,43–0,82; P=0,02) та нижчий рівень внутрішньолікарняної смертності впродовж 30 днів (0,8% в порівнянні з 1,9%; P<0,0001). 886 Покращення рівня смертності після АКШ у дослідженнях PLATO та TRITON-TIMI 38 передбачає, що тікагрелор та прасугрель можна знову починати приймати після АКШ; однак свідчення обмежені лише однією третиною пацієнтів, які відновили прийом тікагрелору у PLATO і відсутністю рандомізованого оцінювання. 881
Пацієнти з гіперчутливістю до ацетилсаліцилової кислоти. Можна провести процедуру швидкої десенсибілізації пацієнтам з гіперчутливістю до АСК, яким необхідна терапія цим препаратом. 898 Клопідогрель в дозі 75 мг на добу є відповідною альтернативою для пацієнтів з непереносимістю або алергією на АСК при довготривалому лікуванні. 899 Альтернативно у випадку непереносимості аспірину можна віддати перевагу новітньому інгібітору P2Y12 (прасугрелю або тікогрелору) над клопідогрелем, як єдиній антитромбоцитарній терапії обмеженого терміну застосування (від 1 до 6 місяців) після ПКВ.
Тромбоцитопенія, спричинена гепарином. У пацієнтів з тромбоцитопенією, спричиненою гепарином, не слід застосовувати ані НФГ, ані НМГ внаслідок міркувань щодо перехресної реактивності. В такому випадку бівалірудин буде найкращим варіантом антикоагулянта; іншими альтернативами є аргатробан, хірудин, лепірудин та данапароїд.
18. РЕФРАКТЕРНА СТЕНОКАРДІЯ
Термін «рефрактерна стенокардія» визначається як «хронічний стан, викликаний клінічно підтвердженою рекурентною ішемією міокарда за наявності ураження коронарних судин, яка не може бути адекватно контрольована комбінацією медикаментозної терапії, ангіопластики або аортокоронарного шунтування». Для цієї групи пацієнтів рекомендовані ряд нових фармакологічних засобів і немедикаментозних методів лікування (див. Таблицю 61).
До нефармакологічних відносяться методи зовнішньої контрпульсації і нейростимуляції. Їх застосування показало, що вони можуть полегшити симптоми і покращити якість життя пацієнтів, хоча переконливі докази щодо зменшення ішемії і смертності як і раніше відсутні.
19. ПЕРВИННА МЕДИЧНА ДОПОМОГА
Лікарі первинної ланки повинні відігравати важливу роль у ідентифікації та веденні пацієнтів зі стабільною ІХС. Зокрема:
1. Виявляти пацієнтів з симптоматикою, яка передбачає можливий діагноз стабільної ІХС, для подальшого обстеження і лікування.
2. Виявляти хворих з підвищеним ризиком розвитку ІХС та проводити роботу щодо модифікації факторів ризику, включаючи зміни способу життя і терапевтичні заходи, з метою зменшення їх ризику у майбутньому.
3. Забезпечити, щоб пацієнти зі стабільною ІХС розуміли значення прийому, як симптоматичних, так прогноз-модифікуючих препаратів, тобто обох складових оптимальної медикаментозної терапії, а у відповідних випадках – переваги ПКВ або АКШ.
4. Забезпечити, з відповідними інтервалами, систематичний медичний нагляд/диспансеризацію пацієнтів зі стабільною ІХС для повторної оцінки клінічних симптомів, прийому медикаментів і факторів ризику.
Список литературы
1. Head SJ, Kieser TM, Falk V, Huysmans HA, Kappetein AP. Coronary artery bypassgrafting: Part 1:the evolution over the first 50 years. Eur Heart J 2013;34(37):2862–2872
2. Grutzig A. Transluminal dilatation of coronary-artery stenosis. Lancet 1978;1(8058):263
3. Stefanini GG, Holmes DR Jr. Drug-eluting coronary-artery stents. N Engl J Med2013;368(3):254–265
4. Windecker S, Stortecky S, Stefanini GG, da Costa B, Rutjes AW, di Nisio M,Siletta MG, Maione A, Alfonso F, Clemmensen P, Collet JP, Cremer J, Falk F, Filippatos G, Hamm C, Head SJ, Kappetein AP, Kastrati A, Knuuti J,-Landmesser U, Laufer G, Neumann FJ, Richter D, Schauerte P, Sousa-Uva M, Taggart D, Torracca L, Valgimigli M, WijnsW, Witkowski A, Kolh P, Juni P. Revascularisation vs. Medical Treatment in Patients With Stable Coronary Artery Disease: A Network Meta-Analysis. BMJ. 2014 Jun 23;348:g3859
5. Head SJ, Kaul S, MackMJ, SerruysPW, TaggartDP, HolmesDRJr., Leon MB, Marco J,Bogers AJ, Kappetein AP. The rationale for Heart Team decision-making forpatients with stable, complex coronary artery disease. Eur Heart J 2013;34(32):2510–2518
5a. Campeau L. The Canadian Cardiovascular Society grading of angina pectoris revisited 30 years later. Can J Cardiol 2002;18:371–379.
6. Head SJ, Holmes DR Jr., Mack MJ, SerruysPW, MohrFW, Morice MC, Colombo A, Kappetein AP, Investigators S. Risk profile and 3-year outcomes from the SYNTAX percutaneous coronary intervention and coronary artery bypass grafting nested registries. JACC Cardiovasc Interv 2012;5(6):618–625
7. Nashef SA, Roques F, Michel P, Gauducheau E, Lemeshow S, Salamon R. European system for cardiac operative risk evaluation (EuroSCORE). Eur J Cardiothorac Surg 1999;16(1):9–13
8. Roques F, Michel P, Goldstone AR, Nashef SA. The logistic EuroSCORE. Eur Heart J 2003;24(9):881–882
9. Siregar S, Groenwold RH, de Heer F, Bots ML, van der Graaf Y, van Herwerden LA. Performance of the original EuroSCORE. Eur J Cardiothorac Surg 2012;41(4): 746–754.
10. Hickey GL, Grant SW, Murphy GJ, Bhabra M, Pagano D, McAllister K, Buchan I, Bridgewater B. Dynamic trends in cardiac surgery: why the logistic EuroSCORE is no longer suitable for contemporary cardiac surgery and implications for-future risk models. Eur J Cardiothorac Surg 2013;43(6):1146–1152
11. Nashef SA, Roques F, Sharples LD, Nilsson J, Smith C, Goldstone AR, Lockowandt U. EuroSCORE II. Eur J Cardiothorac Surg 2012;41(4):734–744; discussion 744–745
12. Biancari F, Vasques F, Mikkola R, Martin M, Lahtinen J, Heikkinen J. Validation of EuroSCORE II in patients undergoing coronary artery bypass surgery. Ann Thorac Surg 2012;93(6):1930–1935
13. Chalmers J, Pullan M, Fabri B, McShane J, Shaw M, Mediratta N, Poullis M. Validation of EuroSCORE II in a modern cohort of patients undergoing cardiac surgery. Eur J Cardiothorac Surg 2013;43(4):688–694
14. Grant SW, Hickey GL, Dimarakis I, Trivedi U, Bryan A, Treasure T, Cooper G, Pagano D, Buchan I, Bridgewater B. How does EuroSCORE II perform in UK cardiac surgery; an analysis of 23 740 patients from the Society for Cardiothoracic Surgery in Great Britain and Ireland National Database. Heart 2012;98(21): 1568–1572
15. Shahian DM, O’Brien SM, Filardo G, Ferraris VA, Haan CK, Rich JB, Normand SL, DeLong ER, Shewan CM, Dokholyan RS, Peterson ED, Edwards FH, Anderson RP, Society of Thoracic Surgeons Quality Measurement Task F. The-Society of Thoracic Surgeons 2008 cardiac surgery risk models: part 3: valve plus coronary artery bypass grafting surgery. Ann Thorac Surg 2009;88(1 Suppl):S43–62
16. Shahian DM, O’Brien SM, Filardo G, Ferraris VA, Haan CK, Rich JB, Normand SL, DeLong ER, Shewan CM, Dokholyan RS, Peterson ED, Edwards FH, Anderson RP, Society of Thoracic Surgeons Quality Measurement Task F. The-Society of Thoracic Surgeons 2008 cardiac surgery risk models: part 1: coronary artery bypass grafting surgery. Ann Thorac Surg 2009;88(1 Suppl):S2–22
17. Mohr FW, Morice MC, Kappetein AP, Feldman TE, Stahle E, Colombo A, Mack MJ, HolmesDRJr., Morel MA, Van Dyck N, Houle VM, Dawkins KD, SerruysPW. Coronary artery bypass graft surgery vs. percutaneous coronary intervention in patients with three-vessel disease and left main coronary disease: 5-year follow-up of the randomised, clinical SYNTAX trial. Lancet 2013;381(9867):629–638.
18. MohrFW, Rastan AJ, SerruysPW, Kappetein AP, Holmes DR, Pomar JL,Westaby S, Leadley K, Dawkins KD, Mack MJ. Complex coronary anatomy in coronary artery bypass graft surgery: impact of complex coronary anatomy in modern bypass surgery? Lessons learned from theSYNTAXtrial aftertwo years. J Thorac Cardiovasc Surg 2011;141(1):130–140
19. Genereux P, Palmerini T, Caixeta A, Cristea E, Mehran R, Sanchez R, Lazar D, Jankovic I, Corral MD, Dressler O, Fahy MP, Parise H, Lansky AJ, Stone GW SYNTAX score reproducibility and variability between interventional cardiologists, core laboratory technicians, and quantitative coronary measurements. Circ Cardiovasc Interv 2011;4(6):553–561
20. Papadopoulou SL, Girasis C, Dharampal A, FarooqV,Onuma Y, Rossi A, MorelMA, Krestin GP, Serruys PW, de Feyter PJ, Garcia Garcia HM. CT-SYNTAX score: a feasibility and reproducibility Study. JACC Cardiovasc Imaging 2013;6(3):413–415
20a. KittaY, Obata JE, NakamuraT, Hirano M, KodamaY, Fujioka D, Saito Y, Kawabata K, Sano K, Kobayashi T, Yano T, Nakamura K, Kugiyama K. Persistent impairment of endothelial vasomotor function has a negative impact on outcome in patients with coronary artery disease. J Am Coll Cardiol 2009;53:323–330.
21. Peterson ED, Dai D, DeLong ER, Brennan JM, Singh M, Rao SV, Shaw RE, Roe MT, Ho KK, Klein LW, Krone RJ,Weintraub WS, Brindis RG, Rumsfeld JS, Spertus JA, Participants NR. Contemporary mortality risk prediction for percutaneous coronary intervention: results from 588,398 procedures in the National Cardiovascular Data Registry. J Am Coll Cardiol 2010;55(18):1923–1932
21a. Gulati M, Cooper-DeHoff RM, McClure C, Johnson BD, Shaw LJ, Handberg EM, Zineh I, Kelsey SF, Arnsdorf MF, Black HR, Pepine CJ, Merz CN. Adverse cardiovascular outcomes in women with nonobstructive coronary artery disease: a report from the Women’s Ischemia Syndrome Evaluation Study and the St James Women Take Heart Project. Arch Intern Med 2009;169843–850.
22. Ranucci M, Castelvecchio S, Menicanti L, Frigiola A, Pelissero G. Risk of assessing mortality risk in elective cardiac operations: age, creatinine, ejection fraction, and the law of parsimony. Circulation 2009;119(24):3053–3061
22a. Jespersen L, Hvelplund A, Abildstrom SZ, Pedersen F, Galatius S, Madsen JK, Jorgensen E, Kelbaek H, Prescott E. Stable angina pectoris with no obstructive coronary artery disease is associated with increased risks of major adverse cardiovascular events. Eur Heart J 2012;33:734–744.
23. Wykrzykowska JJ, Garg S, Onuma Y, de Vries T, Goedhart D, Morel MA, van Es GA, Buszman P, Linke A, Ischinger T, Klauss V, Corti R, Eberli F, WijnsW, Morice MC, di Mario C, van Geuns RJ, Juni P, Windecker S, Serruys PW. Value of age, creatinine, and ejection fraction (ACEF score) in assessing risk in patients undergoing percutaneous coronary interventions in the ’All-Comers’ LEADERS trial. Circ Cardiovasc Interv 2011;4(1):47–56
23a. Boden WE, O’Rourke RA, Teo KK, Hartigan PM, Maron DJ, Kostuk WJ, Knudtson M, Dada M, Casperson P, Harris CL, Chaitman BR, Shaw L, Gosselin G, Nawaz S, Title LM, Gau G, Blaustein AS, Booth DC, Bates ER, Spertus JA, Berman DS, Mancini GB, Weintraub WS. Optimal medical therapy with or without PCI for stable coronary disease.NEng JMed 2007;356:1503–1516.
24. Farooq V, Vergouwe Y, Raber L, Vranckx P, Garcia-Garcia H, Diletti R, Kappetein AP, Morel MA, de Vries T, Swart M, Valgimigli M, Dawkins KD, Windecker S, Steyerberg EW, Serruys PW. Combined anatomical and clinical factors for the long-term risk stratification of patients undergoing percutaneous coronary intervention: the Logistic Clinical SYNTAX score. Eur Heart J 2012; 33(24):3098–3104
24a. Chung SC, Hlatky MA, Faxon D, Ramanathan K, Adler D, Mooradian A, Rihal C, Stone RA, Bromberger JT, Kelsey SF, Brooks MM. The effect of age on clinical outcomes and health status BARI 2D (Bypass Angioplasty Revascularization Investigation in Type 2 Diabetes). J Am Coll Cardiol 2011;58:810–819.
25. Farooq V, van Klaveren D, Steyerberg EW, Meliga E, Vergouwe Y, Chieffo A, Kappetein AP, Colombo A, Holmes DR Jr., Mack M, Feldman T, Morice MC, Stahle E, Onuma Y, Morel MA, Garcia-Garcia HM, van Es GA, Dawkins KD,-Mohr FW, Serruys PW. Anatomical and clinical characteristics to guide decision making between coronary artery bypass surgery and percutaneous coronary intervention for individual patients: development and validation of SYNTAX score II Lancet 2013;381(9867):639–650
25a. Frye RL, August P, BrooksMM,Hardison RM, Kelsey SF, MacGregor JM, Orchard TJ, Chaitman BR, Genuth SM, Goldberg SH, Hlatky MA, Jones TL, Molitch ME, NestoRW, Sako EY, Sobel BE. A randomized trial of therapies for type 2 diabetes and coronary artery disease. N Eng J Med 2009;360:2503–2515.
26. Weintraub WS, Grau-SepulvedaMV,Weiss JM, O’Brien SM, Peterson ED, Kolm P, Zhang Z, Klein LW, Shaw RE, McKay C, Ritzenthaler LL, Popma JJ, Messenger JC, Shahian DM, Grover FL, Mayer JE, Shewan CM, Garratt KN, Moussa ID, Dangas GD, Edwards FH. Comparative effectiveness of revascularization strategies N Engl J Med 2012;366(16):1467–1476
26a. Henderson RA, Pocock SJ, Clayton TC, Knight R, Fox KA, Julian DG, Chamberlain DA. Seven-year outcome in the RITA-2 trial: coronary angioplasty versus medical therapy. J Am Coll Cardiol 2003;42:1161–1170.
27. Shahian DM, O’Brien SM, Sheng S, Grover FL, Mayer JE, Jacobs JP, Weiss JM, Delong ER, Peterson ED, Weintraub WS, Grau-Sepulveda MV, Klein LW, ShawRE, Garratt KN, Moussa ID,Shewan CM,DangasGD, Edwards FH. Predictors of long-term survival after coronary artery bypass grafting surgery: results from the Society of Thoracic Surgeons Adult Cardiac Surgery Database (the ASCERT study). Circulation 2012;125(12):1491–1500
27a. Poole-Wilson PA, Lubsen J, Kirwan BA, van Dalen FJ, Wagener G, Danchin N, Just H, Fox KA, Pocock SJ, Clayton TC, Motro M, Parker JD, Bourassa MG, Dart AM, Hildebrandt P, Hjalmarson A, Kragten JA, Molhoek GP, Otterstad JE, Seabra-Gomes R, Soler-Soler J,Weber S. Effect of long-acting nifedipine on mortality and cardiovascular morbidity in patients with stable angina requiring treatment (ACTION trial): randomised controlled trial. Lancet 2004;364:849–857.
28. Weintraub WS, Grau-Sepulveda MV, Weiss JM, Delong ER, Peterson ED, O’Brien SM, Kolm P, Klein LW, Shaw RE, McKay C, Ritzenthaler LL, Popma JJ, Messenger JC, Shahian DM, Grover FL, Mayer JE, Garratt KN, Moussa ID, Edwards FH, Dangas GD. Prediction of long-term mortality after percutaneous coronary intervention in older adults: results from the National Cardiovascular Data Registry. Circulation 2012;125(12):1501–1510
28a. Steg PG, Greenlaw N, Tardif JC, Tendera M, Ford I, Kaab S, Abergel H, Fox KM, Ferrari R.Women and men with stable coronary artery disease have similar clinical outcomes: insights from the international prospectiveCLARIFY registry. Eur Heart J 2012;33:2831–2840.
29. Medina A, Suarez de Lezo J, Pan M. [A new classification of coronary bifurcation lesions]. Rev Esp Cardiol 2006;59(2):183
30. Sianos G, Morel MA, Kappetein AP, Morice MC, Colombo A, Dawkins K, van den Brand M, Van Dyck N, Russell ME, Mohr FW, SerruysPW. The SYNTAX Score: an angiographic tool grading the complexity of coronary artery disease. EuroIntervention 2005;1(2):219–227
31. Beauchamp T, Childress J. Principles of Biomedical Ethics. 4th ed. New York: Oxford University Press; 1994
32. Tong BC, Huber JC, Ascheim DD, Puskas JD, Ferguson TB Jr., Blackstone EH, Smith PK. Weighting composite endpoints in clinical trials: essential evidence for the Heart Team. Ann Thorac Surg 2012;94(6):1908–1913
33. Chandrasekharan DP, Taggart DP. Informed consent for interventions in stable coronary artery disease: problems, etiologies, and solutions. Eur J Cardiothorac Surg 2011;39(6):912–917
34. Filardo G, Maggioni AP, Mura G, Valagussa F, Valagussa L, Schweiger C, Ballard DJ, Liberati A. The consequences of under-use of coronary revascularization; results of a cohort study in Northern Italy. Eur Heart J 2001;22(8):654–662
35. YatesMT, Soppa GK, Valencia O, Jones S, Firoozi S, Jahangiri M. Impact of European Society of Cardiology and European Association for Cardiothoracic Surgery Guidelines on Myocardial Revascularization on the activity of percutaneous coronary intervention and coronary artery bypass graft surgery for stable coronary artery disease. J Thorac Cardiovasc Surg 2014;147(2):606–610
36. OECD. Health at a glance. In: OECD Publishing; 2009
37. Hannan EL, Cozzens K, Samadashvili Z, Walford G, Jacobs AK, Holmes DR Jr., Stamato NJ, Sharma S, Venditti FJ, Fergus I, King SB 3rd. Appropriateness of coronary revascularization for patients without acute coronary syndromes. J Am Coll Cardiol 2012;59(21):1870–1876
38. Frutkin AD, Lindsey JB, Mehta SK, House JA, Spertus JA, Cohen DJ, Rumsfeld JS, Marso SP, Ncdr. Drug-eluting stents and the use of percutaneous coronary intervention among patients with class I indications for coronary artery bypass surgery undergoing index revascularization: analysis from the NCDR(National Cardiovascular Data Registry). JACC Cardiovasc Interv 2009;2(7):614–621
39. Epstein AJ, Polsky D, Yang F, Yang L, Groeneveld PW. Coronary revascularization trends in the United States, 2001–2008. JAMA 2011;305(17):1769–1776
40. Hannan EL, Racz MJ, Gold J, Cozzens K, Stamato NJ, Powell T, Hibberd M, Walford G, American College of C, American Heart A. Adherence of catheterization laboratory cardiologists to American College of Cardiology/American Heart Association guidelines for percutaneous coronary interventions and coronary artery bypass graft surgery: what happens in actual practice? Circulation 2010; 121(2):267–275
41. Denvir MA, Pell JP, Lee AJ, Rysdale J, Prescott RJ, Eteiba H, Walker A, Mankad P, Starkey IR. Variations in clinical decision-making between cardiologists and cardiac surgeons; a case for management by multidisciplinary teams? J Cardiothorac Surg 2006;1:2
42. Long J, Luckraz H, Thekkudan J, Maher A, Norell M. Heart Team discussion in managing patients with coronary artery disease: outcome and reproducibility. Interact Cardiovasc Thorac Surg 2012;14(5):594–598
43. Sobolev BG, Fradet G, Kuramoto L, Rogula B. The occurrence of adverse events in relation to time after registration for coronary artery bypass surgery: a populationbased observational study. J Cardiothorac Surg 2013;8:74
44. Graham MM, Knudtson ML, O’Neill BJ, Ross DB. Treating the right patient at the right time: Access to cardiac catheterization, percutaneous coronary intervention and cardiac surgery. Can J Cardiol 2006;22(8):679–683
45. Hannan EL, Samadashvili Z, Walford G, Holmes DR, Jacobs A, Sharma S, Katz S, King SB 3rd. Predictors and outcomes of ad hoc vs. non-ad hoc percutaneous coronary interventions. JACC Cardiovasc Interv 2009;2(4):350–356
46. Nallamothu BK, Krumholz HM. Putting ad hoc PCI on pause. JAMA 2010;304(18): 2059–2060
47. Montalescot G, Sechtem U, Achenbach S, Andreotti F, Arden C, Budaj A, Bugiardini R, Crea F, Cuisset T, Di Mario C, Ferreira JR, Gersh BJ, Gitt AK, Hulot JS, Marx N, Opie LH, Pfisterer M, Prescott E, Ruschitzka F, Sabate M, Senior R,-Taggart DP, van der Wall EE, Vrints CJ, Zamorano JL, Baumgartner H, Bax JJ, Bueno H, Dean V, Deaton C, Erol C, Fagard R, Ferrari R, Hasdai D, Hoes AW, Kirchhof P, Knuuti J, Kolh P, Lancellotti P, Linhart A, Nihoyannopoulos P, Piepoli MF, Ponikowski P, Sirnes PA, Tamargo JL, Tendera M, Torbicki A, Wijns W, Windecker S, Valgimigli M, Claeys MJ, Donner-Banzhoff N, Frank H, Funck-Brentano C, Gaemperli O, Gonzalez-Juanatey JR, Hamilos M, Husted S, James SK, Kervinen K, Kristensen SD, Maggioni AP, Pries AR, Romeo F, Ryden L, Simoons ML, Steg PG, Timmis A, Yildirir A. 2013 ESC guidelines on the management of stable coronary artery disease: The Task Force on the management of stable coronary artery disease of the European Society of Cardiology. Eur Heart J 2013;34(38):2949–3003
48. Knuuti J, Bengel F, Bax JJ, Kaufmann PA, Le Guludec D, Perrone Filardi P, Marcassa C, Ajmone Marsan N, Achenbach S, Kitsiou A, Flotats A, Eeckhout E, Minn H, Hesse BRisks and benefits of cardiac imaging: an analysis of risks related to imaging for coronary artery disease. Eur Heart J 2014;35(10):633–638
48a. Amsterdam EA, Kirk JD, Bluemke DA, Diercks D, Farkouh ME, Garvey JL, Kontos MC, McCord J, Miller TD, Morise A, Newby LK, Ruberg FL, Scordo KA, Thompson PD. Testing of low-risk patients presenting to the emergency department with chest pain: a scientific statement from the American Heart Association. Circulation 2010;122:1756–1776.
49. Hulten E, Villines TC, Cheezum MK, Berman DS, Dunning A, Achenbach S, Al-Mallah M, Budoff MJ, Cademartiri F, Callister TQ, Chang HJ, Cheng VY, Chinnaiyan K, Chow BJ, Cury RC, Delago A, Feuchtner G, Hadamitzky M,-Hausleiter J, Kaufmann PA, Karlsberg RP, Kim YJ, Leipsic J, Lin FY, Maffei E, Plank F, Raff GL, Labounty TM, Shaw LJ, Min JK, Investigators C. Usefulness of coronary computed tomography angiography to predict mortality and myocardial infarction among Caucasian, African and East Asian ethnicities (from the CONFIRM [Coronary CT Angiography Evaluation for Clinical Outcomes: An International Multicenter] Registry). Am J Cardiol 2013;111(4):479–485
50. Tonino PA, De Bruyne B, Pijls NH, Siebert U, Ikeno F, van’t Veer M, Klauss V, Manoharan G, Engstrom T, Oldroyd KG, Ver Lee PN, MacCarthy PA, Fearon WF, Investigators FS. Fractional flow reserve vs. angiography for guiding-percutaneous coronary intervention. N Engl J Med 2009;360(3):213–224
50a. Diamond GA.Aclinically relevant classification of chest discomfort. JAmColl Cardiol 1983;1:574–575.
51. Pijls NH, van Schaardenburgh P, Manoharan G, Boersma E, Bech JW, van’t Veer M, Bar F, Hoorntje J, Koolen J, WijnsW, de Bruyne B. Percutaneous coronary intervention of functionally nonsignificant stenosis: 5-year follow-up of the DEFER StudyJ Am Coll Cardiol 2007;49(21):2105–2111
51a. Lanza GA, Sestito A, Sgueglia GA, Infusino F, Manolfi M, Crea F, Maseri A. Current clinical features, diagnostic assessment and prognostic determinants of patients with variant angina. Int J Cardiol 2007;118:41–47.
52. Botman KJ, Pijls NH, Bech JW, Aarnoudse W, Peels K, van Straten B, Penn O, Michels HR, Bonnier H, Koolen JJ. Percutaneous coronary intervention or bypass surgery in multivessel disease? A tailored approach based on coronary pressure measurement. Catheter Cardiovasc Interv 2004;63(2):184–191
53. Toth G,DeBruyne B, Casselman F,DeVroey F, Pyxaras S, Di Serafino L, Van Praet F, Van Mieghem C, Stockman B, Wijns W, Degrieck I, Barbato E. Fractional flow reserve-guided vs. angiography-guided coronary artery bypass graft surgery. Circulation 2013;128(13):1405–1411
54. De Bruyne B, Pijls NH, Kalesan B, Barbato E, Tonino PA, Piroth Z, Jagic N, Mobius-Winkler S, Rioufol G, Witt N, Kala P, MacCarthy P, Engstrom T, Oldroyd KG, Mavromatis K, Manoharan G, Verlee P, Frobert O, Curzen N, Johnson JB, Juni P, Fearon WF, Investigators FT. Fractional flow reserve-guided PCI vs. medical therapy in stable coronary disease. N Engl J Med 2012;367(11): 991–1001
55. Allman KC, Shaw LJ, Hachamovitch R, Udelson JE. Myocardial viability testing and impact of revascularization on prognosis in patients with coronary artery disease and left ventricular dysfunction: a meta-analysis. J Am Coll Cardiol 2002;39(7): 1151–1158
56. Beanlands RS, Nichol G, Huszti E, Humen D, Racine N, Freeman M, Gulenchyn KY, Garrard L, deKemp R, Guo A, Ruddy TD, Benard F, Lamy A, Iwanochko RM, Investigators P-. F-18-fluorodeoxyglucose positron emission tomography-imaging-assisted management of patients with severe left ventricular dysfunction and suspected coronary disease: a randomized, controlled trial (PARR-2). J Am Coll Cardiol 2007;50(20):2002–2012
56a. Madjid M, Fatemi O. Components of the complete blood count as risk predictors for coronary heart disease: in-depth review and update. Tex Heart Inst J 2013;40: 17–29.57. Meijboom WB, Meijs MF, Schuijf JD, Cramer MJ, Mollet NR, van Mieghem CA, Nieman K, van Werkhoven JM, Pundziute G, Weustink AC, de Vos AM, Pugliese F, Rensing B, Jukema JW, Bax JJ, Prokop M, Doevendans PA, Hunink MG, Krestin GP, de Feyter PJ. Diagnostic accuracy of 64-slice computed tomography coronary angiography: a prospective, multicenter, multivendor study. J Am Coll Cardiol 2008;52(25):2135–2144
57a. Ryden L. ESC Guideline diabetes 2013. Eur Heart J 2013
58. Miller JM, Rochitte CE, Dewey M, Arbab-Zadeh A, Niinuma H, Gottlieb I, Paul N, Clouse ME, Shapiro EP, Hoe J, Lardo AC, Bush DE, de Roos A, Cox C, Brinker J, Lima JA. Diagnostic performance of coronary angiography by 64-row CT. N Engl J Med 2008;359(22):2324–2336
59. Sarno G, Decraemer I, Vanhoenacker PK, De Bruyne B, Hamilos M, Cuisset T, Wyffels E, Bartunek J, Heyndrickx GR, WijnsW. On the inappropriateness of noninvasive multidetector computed tomography coronary angiography to trigger coronary revascularization: a comparison with invasive angiography. JACC Cardiovasc Interv 2009;2(6):550–557
60. Schuijf JD, WijnsW, Jukema JW, Decramer I, Atsma DE, de Roos A, Stokkel MP, Dibbets-Schneider P, van der Wall EE, Bax JJ. A comparative regional analysis of coronary atherosclerosis and calcium score on multislice CT vs. myocardial perfusion on SPECT. J Nucl Med 2006;47(11):1749–55
61. Budoff MJ, Dowe D, Jollis JG, Gitter M, Sutherland J, Halamert E, Scherer M, Bellinger R, Martin A, Benton R, Delago A, Min JK. Diagnostic performance of 64-multidetector row coronary computed tomographic angiography for evaluation of coronary artery stenosis in individuals without known coronary artery disease: results from the prospective multicenter ACCURACY (Assessment by Coronary Computed Tomographic Angiography of Individuals Undergoing Invasive Coronary Angiography) trial. J Am Coll Cardiol 2008;52(21):1724–1732
62. Neglia D, Rovai D, Caselli C, Kaufmann P, Lombardi M, Lorenzoni V, Marinelli M, Nekolla D, Pietila M, Scholte A, Sicari R, Teresinska A, Zamorano J, Underwood R, Knuuti J, For the EVINCI Investigators. Detection of obstructive-coronary artery disease by non invasive anatomical and functional imaging Results of the multicenter European EVINCI study. Circulation 2013
62a. Reiner Z, Catapano AL, De Backer G, Graham I, Taskinen MR, Wiklund O, Agewall S, Alegria E, Chapman MJ, Durrington P, Erdine S, Halcox J, Hobbs R, Kjekshus J, Filardi PP, Riccardi G, Storey RF, Wood D, Bax J, Vahanian A, Auricchio A, Baumgartner H, Ceconi C, Dean V, Deaton C, Fagard R, Filippatos G, Funck-Brentano C, Hasdai D, Hoes A, Kearney P, Knuuti J, Kolh P, McDonagh T, Moulin C, Poldermans D, Popescu BA, Sechtem U, Sirnes PA, Tendera M, Torbicki A, Vardas P, Widimsky P, Windecker S, Berkenboom G, De Graaf J, Descamps O, Gotcheva N, Griffith K, Guida GF, Gulec S, Henkin Y, Huber K, Kesaniemi YA, Lekakis J, Manolis AJ, Marques-Vidal P, Masana L, McMurray J, Mendes M, Pagava Z, Pedersen T, Prescott E, Rato Q, Rosano G, Sans S, Stalenhoef A, Tokgozoglu L, Viigimaa M, Wittekoek ME, Zamorano JL. ESC/EAS Guidelines for the management of dyslipidaemias: the Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS). Eur Heart J 2011;32:1769–1818.
63. Elhendy A, Shub C, McCully RB, Mahoney DW, Burger KN, Pellikka PA. Exercise echocardiography for the prognostic stratification of patients with low pretest probability of coronary artery disease. Am J Med 2001;111(1):18–23
63a. Sedlis SP, Jurkovitz CT, Hartigan PM, Goldfarb DS, Lorin JD, Dada M, Maron DJ, Spertus JA, Mancini GB, Teo KK, O’Rourke RA, Boden WE, Weintraub WS. Optimal medical therapy with or without percutaneous coronary intervention for patients with stable coronary artery disease and chronic kidney disease. Am J Cardiol 2009;104:1647–1653.
64. Elhendy A, MahoneyDW, Burger KN, McCully RB, Pellikka PA. Prognostic value of exercise echocardiography in patients with classic angina pectoris. Am J Cardiol 2004;94(5):559–563
64a. Reddan DN, Szczech LA, Tuttle RH, Shaw LK, Jones RH, Schwab SJ, Smith MS, Califf RM, Mark DB, OwenWFJr. Chronic kidney disease, mortality, and treatment strategies among patients with clinically significant coronary artery disease. JAmSoc Nephrol 2003;14:2373–2380.
65. Sicari R, Pasanisi E, Venneri L, Landi P, Cortigiani L, Picano E, Echo Persantine International Cooperative Study G, Echo Dobutamine International Cooperative Study G. Stress echo results predict mortality: a large-scale multicenter prospective international study. J Am Coll Cardiol 2003;41(4):589–595
65a. Di Angelantonio E, Chowdhury R, Sarwar N, Aspelund T, Danesh J, Gudnason V. Chronic kidney disease and risk of major cardiovascular disease and non-vascular mortality: prospective population based cohort study. BMJ 2010;341:c4986
66. Giri S, Shaw LJ, Murthy DR, Travin MI, Miller DD, Hachamovitch R, Borges-Neto S, Berman DS, Waters DD, Heller GV. Impact of diabetes on the risk stratification using stress single-photon emission computed tomography myocardial perfusion imaging in patients with symptoms suggestive of coronary artery disease. Circulation 2002;105(1):32–40
66a. CockcroftDW, Gault MH. Prediction of creatinine clearance from serum creatinine. Nephron 1976;16:31–41.
67. Mc Ardle BA, Dowsley TF, deKemp RA, Wells GA, Beanlands RS. Does rubidium-82 PET have superior accuracy to SPECT perfusion imaging for the diagnosis of obstructive coronary disease?: A systematic reviewand meta-analysis. J Am-Coll Cardiol 2012;60(18):1828–1837
68. ShawLJ,Hendel R, Borges-Neto S, Lauer MS, Alazraki N, Burnette J, Krawczynska E, Cerqueira M, Maddahi J, Myoview Multicenter R. Prognostic value of normal exercise and adenosine (99m)Tc-tetrofosmin SPECT imaging: results from the multicenter registry of 4,728 patients. J Nucl Med 2003;44(2):134–139
69. Bateman TM, Heller GV, McGhie AI, Friedman JD, Case JA, Bryngelson JR, Hertenstein GK, Moutray KL, Reid K, Cullom SJ. Diagnostic accuracy of rest/ stress ECG-gated Rb-82 myocardial perfusion PET: comparison with ECG-gated-Tc-99m sestamibi SPECT. J Nucl Cardiol 2006;13(1):24–33
70. Parker MW, Iskandar A, Limone B, Perugini A, Kim H, Jones C, Calamari B, Coleman CI, Heller GV. Diagnostic accuracy of cardiac positron emission tomography vs. single photon emission computed tomography for coronary artery-disease: a bivariate meta-analysis. Circ Cardiovasc Imaging 2012;5(6):700–707
71. Nandalur KR, Dwamena BA, Choudhri AF, Nandalur MR, Carlos RC. Diagnostic performance of stress cardiac magnetic resonance imaging in the detection of coronary artery disease: a meta-analysis. J Am Coll Cardiol 2007;50(14):1343–1353
72. Schwitter J, Wacker CM, van Rossum AC, Lombardi M, Al-Saadi N, Ahlstrom H, Dill T, Larsson HB, Flamm SD, Marquardt M, Johansson L. MR-IMPACT: comparison of perfusion-cardiac magnetic resonance with single-photon emission computed tomography for the detection of coronary artery disease in a multicentre, multivendor, randomized trial. Eur Heart J 2008;29(4):480–489
73. Schwitter J,Wacker CM, Wilke N, Al-Saadi N, Sauer E, Huettle K, Schonberg SO, Luchner A, Strohm O, Ahlstrom H, Dill T, Hoebel N, Simor T, Investigators M-IMR-IMPACT II: Magnetic Resonance Imaging for Myocardial Perfusion Assessment in Coronary artery disease Trial: perfusion-cardiac magnetic resonance vs. singlephoton emission computed tomography for the detection of coronary artery disease: a comparative multicentre, multivendor trial. Eur Heart J 2013;34(10): 775–781
74. Jahnke C, Nagel E, Gebker R, KokocinskiT, Kelle S, Manka R, Fleck E, Paetsch I. Prognostic value of cardiac magnetic resonance stress tests: adenosine stress perfusion and dobutamine stress wall motion imaging. Circulation 2007;115(13):1769–1776
75. Korosoglou G, Elhmidi Y, Steen H, Schellberg D, Riedle N, Ahrens J, Lehrke S, Merten C, Lossnitzer D, Radeleff J, Zugck C, Giannitsis E, Katus HA. Prognostic value of high-dose dobutamine stress magnetic resonance imaging in 1,493 consecutive patients: assessment of myocardial wall motion and perfusion. J Am Coll Cardiol 2010;56(15):1225–1234
76. Dorbala S, Di Carli MF, Beanlands RS, Merhige ME, Williams BA, Veledar E, Chow BJ, Min JK, Pencina MJ, Berman DS, Shaw LJ. Prognostic value of stress myocardial perfusion positron emission tomography: results from a multicenter observational registry. J Am Coll Cardiol 2013;61(2):176–184
77. Murthy VL, Naya M, Foster CR, Gaber M, Hainer J, Klein J, Dorbala S, Blankstein R, Di Carli MF. Association between coronary vascular dysfunction and cardiac mortality in patients with and without diabetes mellitus. Circulation 2012;126(15): 1858–1868
78. Kajander S, Joutsiniemi E, Saraste M, Pietila M, Ukkonen H, Saraste A, Sipila HT, Teras M, Maki M, Airaksinen J, Hartiala J, Knuuti J. Cardiac positron emission tomography/ computed tomography imaging accurately detects anatomically and functionally significant coronary artery disease. Circulation 2010;122(6):603–613
78a. Androulakis A, Aznaouridis KA, Aggeli CJ, Roussakis GN, Michaelides AP, Kartalis AN, Stougiannos PN, Dilaveris PE, Misovoulos PI, Stefanadis CI, Kallikazaros IE. Transient ST-segment depression during paroxysms of atrial fibrillation in otherwise normal individuals: relation with underlying coronary artery disease. J Am Coll Cardiol 2007;50:1909–1911.
79. Pazhenkottil AP, Nkoulou RN, Ghadri JR, Herzog BA, Kuest SM, Husmann L, Wolfrum M, Goetti R, Buechel RR, Gaemperli O, Luscher TF, Kaufmann PAImpact of cardiac hybrid single-photon emission computed tomography/computed tomography imaging on choice of treatment strategy in coronary artery disease. Eur Heart J 2011;32(22):2824–2829
80. Danad I, Raijmakers PG, Appelman YE, Harms HJ, de Haan S, van den Oever ML, Heymans MW, Tulevski II, van Kuijk C, Hoekstra OS, Lammertsma AA, Lubberink M, van Rossum AC, Knaapen P. Hybrid imaging using quantitative H215O PET and CT-based coronary angiography for the detection of coronary artery disease. J Nucl Med 2013;54(1):55–63
80a. Douglas PS, Garcia MJ, Haines DE, Lai WW, Manning WJ, Patel AR, Picard MH, Polk DM, Ragosta M,Ward RP,Weiner RB. ACCF/ASE/AHA/ASNC/HFSA/HRS/ SCAI/SCCM/SCCT/SCMR 2011 Appropriate Use Criteria for Echocardiography. AReport of the American College of Cardiology Foundation Appropriate Use Criteria Task Force, American Society of Echocardiography, American Heart Association, American Society of Nuclear Cardiology, Heart Failure Society of America, Heart Rhythm Society, Society for Cardiovascular Angiography and Interventions, Society of Critical Care Medicine, Society of Cardiovascular Computed Tomography, and Society forCardiovascular Magnetic Resonance Endorsed by the American College of Chest Physicians. J Am Coll Cardiol 2011;57:1126–1166.
81. Schaap J, de Groot JA, Nieman K, Meijboom WB, Boekholdt SM, Post MC, Van der Heyden JA, de Kroon TL, Rensing BJ, Moons KG, Verzijlbergen JF. Hybrid myocardial perfusion SPECT/CT coronary angiography and invasive coronary angiography in patients with stable angina pectoris lead to similar treatment decisions. Heart 2013;99(3):188–194
82. Fiechter M, Ghadri JR, Wolfrum M, Kuest SM, Pazhenkottil AP, Nkoulou RN, Herzog BA, Gebhard C, Fuchs TA, Gaemperli O, Kaufmann PA. Downstream resource utilization following hybrid cardiac imaging with an integrated-cadmium-zinc-telluride/64-slice CT device. Eur J Nucl Med Mol Imaging 2012; 39(3):430–436
83. van Werkhoven JM, Heijenbrok MW, Schuijf JD, Jukema JW, van der Wall EE, Schreur JH, Bax JJ. Combined non-invasive anatomical and functional assessment with MSCT and MRI for the detection of significant coronary artery disease in patients with an intermediate pre-test likelihood. Heart 2010;96(6):425–431
84. Ryden L, Grant PJ, Anker SD, Berne C, Cosentino F, Danchin N, Deaton C, Escaned J, Hammes HP, Huikuri H, Marre M, Marx N, Mellbin L, Ostergren J, Patrono C, Seferovic P, Uva MS, Taskinen MR, Tendera M, Tuomilehto J, Valensi P, Zamorano JL, Achenbach S, Baumgartner H, Bax JJ, Bueno H, Dean V, Erol C, Fagard R, Ferrari R, Hasdai D, Hoes AW, Kirchhof P, Knuuti J, Kolh P, Lancellotti P, Linhart A, Nihoyannopoulos P, Piepoli MF, Ponikowski P, Sirnes PA, Tamargo JL, Torbicki A, Wijns W, Windecker S, De Backer G, Ezquerra EA, Avogaro A, Badimon L, Baranova E, Betteridge J, Ceriello A, Funck-Brentano C, Gulba DC, Kjekshus JK, Lev E, Mueller C, Neyses L, Nilsson PM, Perk J, Reiner Z, Sattar N, Schachinger V, Scheen A, Schirmer H, Stromberg A, Sudzhaeva S, Viigimaa M, Vlachopoulos C, Xuereb RG. ESC Guidelines on diabetes, prediabetes, and cardiovascular diseases developed in collaboration with the EASD: the Task Force on diabetes, pre-diabetes, and cardiovascular diseases of the European Society of Cardiology (ESC) and developed in collaboration with the European Association for the Study of Diabetes (EASD). Eur Heart J 2013;34(39): 3035–3087
85. Kolh P, Wijns W, Danchin N, Di Mario C, Falk V, Folliguet T, Garg S, Huber K, James S, Knuuti J, Lopez-Sendon J, Marco J, Menicanti L, Ostojic M, Piepoli MF, Pirlet C, Pomar JL, Reifart N, Ribichini FL, Schalij MJ, Sergeant P, Serruys PW, Silber S, Sousa Uva M, Taggart D. Guidelines on myocardial revascularizationEur J Cardiothorac Surg 2010;38 Suppl:S1–S52
86. Wijns W, Kolh P, Danchin N, Di Mario C, Falk V, Folliguet T, Garg S, Huber K, James S, Knuuti J, Lopez-Sendon J, Marco J, Menicanti L, Ostojic M, Piepoli MF, Pirlet C, Pomar JL, Reifart N, Ribichini FL, Schalij MJ, Sergeant P, Serruys PW, Silber S, Sousa Uva M, Taggart D, Vahanian A, Auricchio A, Bax J, Ceconi C, Dean V, Filippatos G, Funck-Brentano C, Hobbs R, Kearney P, McDonagh T, Popescu BA, Reiner Z, Sechtem U, Sirnes PA, Tendera M, Vardas PE, Widimsky P, Alfieri O, Dunning J, Elia S, Kappetein P, Lockowandt U, Sarris G, Vouhe P, von Segesser L, Agewall S, Aladashvili A, Alexopoulos D, Antunes MJ, Atalar E, Brutel de la Riviere A, Doganov A, Eha J, Fajadet J, Ferreira R, Garot J, Halcox J, Hasin Y, Janssens S, Kervinen K, Laufer G, Legrand V, Nashef SA, Neumann FJ, Niemela K, Nihoyannopoulos P, Noc M, Piek JJ, Pirk J, Rozenman Y, SabateM, Starc R, Thielmann M, Wheatley DJ,Windecker S, Zembala M. Guidelines on myocardial revascularization: The Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2010;31(20):2501–2555
87. Deb S, Wijeysundera HC, Ko DT, Tsubota H, Hill S, Fremes SE. Coronary artery bypass graft surgery vs.percutaneous interventions in coronary revascularization: a systematic review. JAMA 2013;310(19):2086–2095
88. Spertus JA, Salisbury AC, Jones PG, Conaway DG, Thompson RC. Predictors of quality-of-life benefit after percutaneous coronary intervention. Circulation 2004; 110(25):3789–3794
88a. Cohn PF, Fox KM, Daly C. Silent myocardial ischemia. Circulation 2003;108: 263–1277.
89. Coronary angioplasty vs. medical therapy for angina: the second Randomised Intervention Treatment of Angina (RITA-2) trial. RITA-2 trial participants. Lancet 1997; 350(9076):461–468
90. Trial of invasive vs. medical therapy in elderly patients with chronic symptomatic coronary-artery disease (TIME): a randomised trial. Lancet 2001;358(9286): 951–957
90a. Diamond GA,Forrester JS. Analysis of probability as an aid in the clinical diagnosis of coronary-artery disease. N Eng J Med 1979;300:1350–1358.
91. Boden WE, O’Rourke RA, Teo KK, Hartigan PM, Maron DJ, Kostuk WJ, Knudtson M, Dada M, Casperson P, Harris CL, Chaitman BR, Shaw L, Gosselin G, Nawaz S, Title LM, Gau G, Blaustein AS, Booth DC, Bates ER, Spertus JA, Berman DS, Mancini GB, Weintraub WS, Group CTR. Optimal medical therapy with or without PCI for stable coronary disease. N Engl J Med 2007;356(15):1503–1516
92. Erne P, Schoenenberger AW, Burckhardt D, Zuber M, Kiowski W, Buser PT, Dubach P, Resink TJ, Pfisterer M. Effects of percutaneous coronary interventions in silent ischemia after myocardial infarction: the SWISSI II randomized controlled trial. JAMA 2007;297(18):1985–1991
93. Frye RL, August P, BrooksMM,Hardison RM, Kelsey SF, MacGregor JM, Orchard TJ, Chaitman BR, Genuth SM, Goldberg SH, Hlatky MA, Jones TL, Molitch ME, NestoRW, Sako EY, Sobel BE. A randomized trial of therapies for type 2 diabetes and coronary artery disease. N Engl J Med 2009;360(24):2503–2515
94. Hueb W, Lopes N, Gersh BJ, Soares PR, Ribeiro EE, Pereira AC, Favarato D, Rocha AS, Hueb AC, Ramires JA. Ten-year follow-up survival of the Medicine, Angioplasty, or Surgery Study (MASS II): a randomized controlled clinical trial of-3 therapeutic strategies for multivessel coronary artery disease. Circulation 2010; 122(10):949–957
95. Wijeysundera HC, Nallamothu BK, Krumholz HM, Tu JV, Ko DT. Meta-analysis: effects of percutaneous coronary intervention vs. medical therapy on angina relief. Ann Intern Med 2010;152(6):370–379
96. Pursnani S, Korley F, Gopaul R, Kanade P, Chandra N, Shaw RE, Bangalore S. Percutaneous coronary intervention vs. optimal medical therapy in stable coronary artery disease: a systematic review and meta-analysis of randomized clinical trials Circ Cardiovasc Interv 2012;5(4):476–490
97. Hachamovitch R, Rozanski A, Shaw LJ, Stone GW, Thomson LE, Friedman JD, Hayes SW, Cohen I, Germano G, Berman DS. Impact of ischaemia and scar on the therapeutic benefit derived from myocardial revascularization vs. medical therapy among patients undergoing stress-rest myocardial perfusion scintigraphy Eur Heart J 2011;32(8):1012–1024
98. Sajadieh A, NielsenOW, Rasmussen V, Hein HO, Hansen JF. Prevalence and prognostic significance of daily-life silent myocardial ischaemia in middle-aged and elderly subjects with no apparent heart disease. Eur Heart J 2005;26(14):-1402–1409
99. Shaw LJ, Berman DS, Maron DJ, Mancini GB, Hayes SW, Hartigan PM, Weintraub WS, O’Rourke RA, Dada M, Spertus JA, Chaitman BR, Friedman J, Slomka P, Heller GV, Germano G, Gosselin G, Berger P, Kostuk WJ, Schwartz RG, Knudtson M, Veledar E, Bates ER, McCallister B, Teo KK, Boden WE, Investigators C. Optimal medical therapy with or without percutaneous coronary intervention to reduce ischemic burden: results from the Clinical Outcomes Utilizing Revascularization and Aggressive Drug Evaluation (COURAGE) trial nuclear substudy. Circulation 2008;117(10):1283–1291
100. Stergiopoulos K, Boden WE, Hartigan P, Mobius-Winkler S, Hambrecht R, HuebW, Hardison RM, Abbott JD, Brown DL. Percutaneous Coronary Intervention Outcomes in Patients With Stable Obstructive Coronary Artery Disease and Myocardial Ischemia:ACollaborative Meta-analysis of Contemporary Randomized Clinical Trials. JAMA Intern Med 2014;174(2):232–240
101. Min JK, Dunning A, Lin FY, Achenbach S, Al-Mallah M, Budoff MJ, Cademartiri F, Callister TQ, Chang HJ, Cheng V, Chinnaiyan K, Chow BJ, Delago A, Hadamitzky M, Hausleiter J, Kaufmann P, Maffei E, Raff G, Shaw LJ, Villines T,-Berman DS. Age- and sex-related differences in all-cause mortality risk based on coronary computed tomography angiography findings results from the International MulticenterCONFIRM(CoronaryCTAngiography Evaluation for Clinical Outcomes: An International Multicenter Registry) of 23,854 patients without known coronary artery disease. J Am Coll Cardiol 2011;58(8):849–860
102. Min JK, Shaw LJ, Devereux RB, Okin PM, Weinsaft JW, Russo DJ, Lippolis NJ, Berman DS, Callister TQ. Prognostic value of multidetector coronary computed tomographic angiography for prediction of all-cause mortality. J Am Coll Cardiol 2007;50(12):1161–1170
103. Califf RM, Armstrong PW, Carver JR, D’Agostino RB, Strauss WE. 27th Bethesda Conference: matching the intensity of risk factor management with the hazard for coronary disease events. Task Force 5. Stratification of patients into high, medium and low risk subgroups for purposes of risk factor management. J Am Coll Cardiol 1996;27(5):1007–1019
103a. Budoff MJ, Dowe D, Jollis JG, Gitter M, Sutherland J, Halamert E, Scherer M, Bellinger R, Martin A, Benton R, Delago A, Min JK. Diagnostic performance of 64-multidetector row coronary computed tomographic angiography for evaluation of coronary artery stenosis in individuals without known coronary artery disease: results from the prospective multicenter ACCURACY (Assessment by Coronary Computed Tomographic Angiography of Individuals Undergoing Invasive Coronary Angiography) trial. J Am Coll Cardiol 2008;52:1724–1732.
104. Prasad A, Rihal CS, Lennon RJ, Singh M, Jaffe AS, Holmes DR Jr. Significance of periprocedural myonecrosis on outcomes after percutaneous coronary intervention: an analysis of preintervention and postintervention troponin T levels in 5487 patients. Circ Cardiovasc Interv 2008;1(1):10–19
105. Bangalore S, Pursnani S, Kumar S, Bagos PG. Percutaneous coronary intervention vs. optimal medical therapy for prevention of spontaneous myocardial infarction in subjects with stable ischemic heart disease. Circulation 2013;127(7):769–781
106. Hlatky MA, Boothroyd DB, Bravata DM, Boersma E, Booth J, BrooksMM, Carrie D, Clayton TC, Danchin N, Flather M, Hamm CW, Hueb WA, Kahler J, Kelsey SF, King SB, Kosinski AS, Lopes N, McDonald KM, Rodriguez A, Serruys P, Sigwart U, Stables RH,OwensDK, Pocock SJ.Coronary artery bypass surgery compared with percutaneous coronary interventions for multivessel disease: a collaborative analysis of individual patient data from ten randomised trials. Lancet 2009; 373(9670):1190–1197
107. Jeremias A, Kaul S, Rosengart TK, Gruberg L, Brown DL. The impact of revascularization on mortality in patients with nonacute coronary artery disease. Am J Med 2009;122(2):152–161
108. Yusuf S, Zucker D, Peduzzi P, Fisher LD, Takaro T, Kennedy JW, Davis K, Killip T, Passamani E, Norris R et al. Effect of coronary artery bypass graft surgery on survival: overview of 10-year results from randomised trials by the Coronary Artery Bypass Graft Surgery Trialists Collaboration. Lancet 1994;344(8922):563–570
109. Long-term results of prospective randomised study of coronary artery bypass surgery in stable angina pectoris. European Coronary Surgery Study Group Lancet 1982;2(8309):1173–1180
110. Eleven-year survival in the Veterans Administration randomized trial of coronary bypass surgery for stable angina. The Veterans Administration Coronary Artery Bypass Surgery Cooperative Study Group.NEngl J Med 1984;311(21):1333–1339
110a. Tonino PA, De Bruyne B, Pijls NH, Siebert U, Ikeno F, van’ t Veer M, Klauss V, Manoharan G, Engstrom T, Oldroyd KG, Ver Lee PN, MacCarthy PA, Fearon WF. Fractional flow reserve versus angiography for guiding percutaneous coronary intervention. N Eng J Med 2009;360:213–224.
111. Myocardial infarction and mortality in the coronary artery surgery study (CASS) randomized trial. N Engl J Med 1984;310(12):750–758
112. Velazquez EJ, Lee KL, Deja MA, Jain A, Sopko G, Marchenko A, Ali IS, Pohost G, Gradinac S, Abraham WT, Yii M, Prabhakaran D, Szwed H, Ferrazzi P, Petrie MC, O’Connor CM, Panchavinnin P, She L, Bonow RO, Rankin GR, Jones RH, Rouleau JL. Coronary-artery bypass surgery in patients with left ventricular dysfunction N Engl J Med 2011;364(17):1607–1616
113. Pitt B, Waters D, Brown WV, van Boven AJ, Schwartz L, Title LM, Eisenberg D, Shurzinske L, McCormick LS. Aggressive lipid-lowering therapy compared with angioplasty in stable coronary artery disease. Atorvastatin vs. Revascularization Treatment Investigators. N Engl J Med 1999;341(2):70–76
114. Zeymer U, Uebis R, Vogt A, Glunz HG, Vohringer HF, Harmjanz D, Neuhaus KL Randomized comparison of percutaneous transluminal coronary angioplasty and medical therapy in stable survivors of acute myocardial infarction with single vessel disease: a study of the Arbeitsgemeinschaft Leitende Kardiologische Krankenhausarzte Circulation 2003;108(11):1324–1328
115. Hochman JS, Lamas GA, Buller CE, Dzavik V, Reynolds HR, Abramsky SJ, Forman S, RuzylloW, Maggioni AP, White H, Sadowski Z, Carvalho AC, Rankin JM, Renkin JP, Steg PG, Mascette AM, Sopko G, Pfisterer ME, Leor J, Fridrich V, Mark DB, Knatterud GL. Coronary intervention for persistent occlusion after myocardial infarction N Engl J Med 2006;355(23):2395–2407
116. Nishigaki K, Yamazaki T, Kitabatake A, Yamaguchi T, Kanmatsuse K, Kodama I, Takekoshi N, Tomoike H, Hori M, Matsuzaki M, Takeshita A, Shimbo T, Fujiwara H. Percutaneous coronary intervention plus medical therapy reduces-the incidence of acute coronary syndrome more effectively than initial medical therapy only among patients with low-risk coronary artery disease a randomized, comparative, multicenter study. JACC Cardiovasc Interv 2008;1(5):469–479
117. Bucher HC, Hengstler P, Schindler C, Guyatt GH. Percutaneous transluminal coronary angioplasty vs. medical treatment for non-acute coronary heart disease: meta-analysis of randomised controlled trials. BMJ 2000;321(7253):73–77
118. Katritsis DG, Ioannidis JP. Percutaneous coronary intervention vs. conservative therapy in nonacute coronary artery disease: a meta-analysis. Circulation 2005; 111(22):2906–2912
119. Schomig A, Mehilli J, deWaha A, Seyfarth M, Pache J, Kastrati A. A meta-analysis of 17 randomized trials of a percutaneous coronary intervention-based strategy in patients with stable coronary artery disease. J Am Coll Cardiol 2008;52(11): 894–904
120. Trikalinos TA, Alsheikh-Ali AA, Tatsioni A, Nallamothu BK, Kent DM. Percutaneous coronary interventions for non-acute coronary artery disease: a quantitative 20-year synopsis and a network meta-analysis. Lancet 2009;373(9667):911–918
121. Hannan EL, Samadashvili Z, Cozzens K, Walford G, Jacobs AK, Holmes DR Jr., Stamato NJ, Gold JP, Sharma S, Venditti FJ, Powell T, King SB 3rd. Comparative outcomes for patients who do and do not undergo percutaneous coronary intervention for stable coronary artery disease in New York. Circulation 2012;125(15): 1870–1879
121a. Sicari R, Nihoyannopoulos P, Evangelista A, Kasprzak J, Lancellotti P, Poldermans D, Voigt JU, Zamorano JL. Stress echocardiography expert consensus statement: European Association of Echocardiography (EAE) (a registered branch of the ESC). Eur J Echocardiogr 2008;9(415–437.
122. Shaw LJ,Weintraub WS, Maron DJ, Hartigan PM, Hachamovitch R, Min JK, Dada M, Mancini GB, Hayes SW, O’Rourke RA, Spertus JA, Kostuk W, Gosselin G, Chaitman BR, Knudtson M, Friedman J, Slomka P, Germano G, Bates ER, Teo KK, Boden WE, Berman DS. Baseline stress myocardial perfusion imaging results and outcomes in patients with stable ischemic heart disease randomized to optimal medical therapy with or without percutaneous coronary intervention. Am Heart J 2012;164(2):243–250
123. Stergiopoulos K, Brown DL. Initial coronary stent implantation with medical therapy vs.medical therapy alone for stable coronary artery disease: meta-analysis of randomized controlled trials. Arch Intern Med 2012;172(4):312–319
124. Stettler C,Wandel S, Allemann S, Kastrati A, Morice MC, Schomig A, Pfisterer ME, StoneGW, Leon MB, de Lezo JS, Goy JJ, Park SJ, Sabate M, Suttorp MJ, Kelbaek H, Spaulding C, Menichelli M, Vermeersch P, Dirksen MT, Cervinka P, Petronio AS, Nordmann AJ, Diem P, Meier B, Zwahlen M, Reichenbach S, Trelle S, Windecker S, Juni P. Outcomes associated with drug-eluting and bare-metal stents: a collaborative network meta-analysis. Lancet 2007;370(9591):937–948
125. Bangalore S, Kumar S, Fusaro M, Amoroso N, Attubato MJ, Feit F, Bhatt DL, Slater J Short- and long-term outcomes with drug-eluting and bare-metal coronary stents: a mixed-treatment comparison analysis of 117 762 patient-years of follow-up from randomized trials. Circulation 2012;125(23):2873–2891
126. Dangas GD, SerruysPW, Kereiakes DJ, Hermiller J, Rizvi A, NewmanW, Sudhir K, Smith RS Jr., Cao S, Theodoropoulos K, Cutlip DE, Lansky AJ, Stone GW Meta-analysis of everolimus-eluting vs. paclitaxel-eluting stents in coronary artery disease: final 3-year results of the SPIRIT clinical trials program (Clinical Evaluation of the Xience V Everolimus Eluting Coronary Stent System in the Treatment of Patients With De Novo Native Coronary Artery Lesions). JACC Cardiovasc Interv 2013;6(9):914–922
126a. Imbert L, Poussier S, Franken PR, Songy B, Verger A, Morel O, Wolf D, Noel A, Karcher G, Marie PY. Compared performance of high-sensitivity cameras dedicated to myocardial perfusion SPECT: a comprehensive analysis of phantom and human images. J Nucl Med 2012;53:1897–1903.
127. Baber U, Mehran R, Sharma SK, Brar S, Yu J, Suh JW, Kim HS, Park SJ, Kastrati A, de Waha A, Krishnan P, Moreno P, Sweeny J, Kim MC, Suleman J, Pyo R, Wiley J, Kovacic J, Kini AS, Dangas GD. Impact of the everolimus-eluting stent on stent thrombosis: a meta-analysis of 13 randomized trials. J Am Coll Cardiol 2011; 58(15):1569–1577
128. Stefanini GG, Byrne RA, Serruys PW, de Waha A, Meier B, Massberg S, Juni P, Schomig A, Windecker S, Kastrati A. Biodegradable polymer drug-eluting stents reduce the risk of stent thrombosis at 4 years in patients undergoing percutaneous coronary intervention: a pooled analysis of individual patient data from the ISAR-TEST 3, ISAR-TEST 4, and LEADERS randomized trials. Eur Heart J 2012; 33(10):1214–1222
129. Stefanini GG, Baber U, Windecker S, Morice MC, Sartori S, Leon MB, Stone GW, SerruysPW, WijnsW,Weisz G, Camenzind E, Steg PG, Smits PC, Kandzari D, Von Birgelen C, Galatius S, Jeger RV, Kimura T, Mikhail G, Itchhaporia D, Mehta L, Ortega R, Kim HS, Valgimigli M, Kastrati A, Chieffo A, Mehran R. Safety and efficacy of drug-eluting stents in women: a patient-level pooled analysis of randomised trials. Lancet 2013;382(9908):1879–1888
130. Stefanini GG, Kalesan B, Serruys PW, Heg D, Buszman P, Linke A, Ischinger T, Klauss V, Eberli F, Wijns W, Morice MC, Di Mario C, Corti R, Antoni D, Sohn HY, Eerdmans P, van Es GA, Meier B, Windecker S, Juni P. Long-term clinical outcomes of biodegradable polymer biolimus-eluting stents vs. durable polymer sirolimus-eluting stents in patients with coronary artery disease (LEADERS): 4 year follow-up of a randomised non-inferiority trial. Lancet 2011;378(9807):-1940–1948
131. Palmerini T, Biondi-Zoccai G, Della Riva D, Stettler C, Sangiorgi D, D’Ascenzo F, Kimura T, Briguori C, Sabate M, Kim HS, De Waha A, Kedhi E, Smits PC, Kaiser C, Sardella G, Marullo A, Kirtane AJ, Leon MB, StoneGW. Stent thrombosis with drug-eluting and bare-metal stents: evidence from a comprehensive network meta-analysis. Lancet 2012;379(9824):1393–1402
132. Bangalore S, Toklu B, Amoroso N, Fusaro M, Kumar S, Hannan EL, FaxonDP, Feit F Bare metal stents, durable polymer drug eluting stents, and biodegradable polymer drug eluting stents for coronary artery disease: mixed treatment comparison meta-analysis. BMJ 2013;347:f6625
133. Kaiser C, Galatius S, Erne P, Eberli F, Alber H, Rickli H, Pedrazzini G, Hornig B, Bertel O, Bonetti P, De Servi S, Brunner-La Rocca HP, Ricard I, Pfisterer M Drug-eluting vs. bare-metal stents in large coronary arteries. N Engl J Med 2010; 363(24):2310–2319
134. Bittl JA, He Y, Jacobs AK, YancyCW, Normand SL. Bayesian methods affirm the use of percutaneous coronary intervention to improve survival in patients with unprotected left main coronary artery disease. Circulation 2013;127(22):2177–2185
135. Dzavik V, GhaliWA, Norris C, Mitchell LB, Koshal A, Saunders LD, Galbraith PD, HuiW, Faris P, Knudtson ML. Long-term survival in 11,661 patients withmultivessel coronary artery disease in the era of stenting: a report from the Alberta Provincial Project forOutcome Assessment in CoronaryHeart Disease(APPROACH)Investigators Am Heart J 2001;142(1):119–126
136. Smith PK, Califf RM, Tuttle RH, Shaw LK, Lee KL, Delong ER, Lilly RE, SketchMHJr., Peterson ED, Jones RH. Selection of surgical or percutaneous coronary intervention provides differential longevity benefit. Ann Thorac Surg 2006;82(4):1420–1428; discussion 1428–1429
137. Hannan EL, Wu C, Walford G, Culliford AT, Gold JP, Smith CR, Higgins RS, Carlson RE, Jones RH. Drug-eluting stents vs. coronary-artery bypass grafting in multivessel coronary disease. N Engl J Med 2008;358(4):331–341
138. Caracciolo EA, Davis KB, Sopko G, Kaiser GC, Corley SD, Schaff H, Taylor HA, Chaitman BR. Comparison of surgical and medical group survival in patients with left main equivalent coronary artery disease. Long-term CASS experience. Circulation 1995;91(9):2335–2344
139. Chaitman BR, Hardison RM, Adler D, Gebhart S, Grogan M, Ocampo S, Sopko G, Ramires JA, Schneider D, Frye RL, Bypass Angioplasty Revascularization Investigation 2 Diabetes Study G. The Bypass Angioplasty Revascularization Investigation 2 Diabetes randomized trial of different treatment strategies in type 2 diabetes mellitus with stable ischemic heart disease: impact of treatment strategy on cardiac mortality and myocardial infarction. Circulation 2009;120(25):2529–2540
140. Passamani E, Davis KB, Gillespie MJ, Killip T. A randomized trial of coronary artery bypass surgery. Survival of patients with a low ejection fraction. N Engl J Med 1985; 312(26):1665–1671
141. Jones RH, Kesler K, Phillips HR 3rd, Mark DB, Smith PK, Nelson CL, Newman MF, Reves JG, AndersonRW, Califf RM. Long-term survival benefits of coronary artery bypass grafting and percutaneous transluminal angioplasty in patients with coronary artery disease. J Thorac Cardiovasc Surg 1996;111(5):1013–1025
142. BakerDW, Jones R, Hodges J, Massie BM, Konstam MA, Rose EA. Management of heart failure. III. The role of revascularization in the treatment of patients with moderate or severe left ventricular systolic dysfunction. JAMA 1994;272(19): 1528–1534
143. Hachamovitch R, HayesSW, Friedman JD, Cohen I, Berman DS. Comparison of the short-term survival benefit associated with revascularization compared with medical therapy in patients with no prior coronary artery disease undergoing stress myocardial perfusion single photon emission computed tomography. Circulation 2003;107(23):2900–2907
144. Davies RF, Goldberg AD, Forman S, Pepine CJ, Knatterud GL, Geller N, Sopko G, Pratt C, Deanfield J, Conti CR. Asymptomatic Cardiac Ischemia Pilot (ACIP) study two-year follow-up: outcomes of patients randomized to initial strategies of medical therapy vs. revascularization. Circulation 1997;95(8):2037–2043
145. Thomas S, Gokhale R, Boden WE, Devereaux PJ. A meta-analysis of randomized controlled trials comparing percutaneous coronary intervention with medical therapy in stable angina pectoris. Can J Cardiol 2013;29(4):472–482
146. Coronary angioplasty vs. coronary artery bypass surgery: the Randomized Intervention Treatment of Angina (RITA) trial. Lancet 1993;341(8845):573–580
147. Hamm CW, Reimers J, Ischinger T, Rupprecht HJ, Berger J, Bleifeld W. A randomized study of coronary angioplasty compared with bypass surgery in patients with symptomatic multivessel coronary disease. German Angioplasty Bypass Surgery Investigation (GABI). N Engl J Med 1994;331(16):1037–1043
148. King SB 3rd, Lembo NJ, Weintraub WS, Kosinski AS, Barnhart HX, Kutner MH, AlazrakiNP, Guyton RA, ZhaoXQ.A randomized trial comparing coronary angioplasty with coronary bypass surgery. Emory Angioplasty vs. Surgery Trial (EAST).N Engl J Med 1994;331(16):1044–1050
149. First-year results of CABRI (Coronary Angioplasty vs. Bypass Revascularisation Investigation) CABRI Trial Participants. Lancet 1995;346(8984):1179–1184
150. Comparison of coronary bypass surgery with angioplasty in patients with multivessel disease. The Bypass Angioplasty Revascularization Investigation (BARI) Investigators N Engl J Med 1996;335(4):217–225
150a. Halliburton S, Arbab-Zadeh A, Dey D, Einstein AJ, Gentry R, George RT, Gerber T, Mahesh M,Weigold WG. State-of-the-art in CT hardware and scan modes for cardiovascular CT. J Cardiovasc Comput Tomogr 2012;6:154–163.
151. Morrison DA, Sethi G, Sacks J, Henderson W, Grover F, Sedlis S, Esposito R, Ramanathan K, Weiman D, Saucedo J, Antakli T, Paramesh V, Pett S, Vernon S, Birjiniuk V, Welt F, Krucoff M, Wolfe W, Lucke JC, Mediratta S, Booth D,-Barbiere C, Lewis D, Angina With Extremely Serious Operative Mortality E. Percutaneous coronary intervention vs. coronary artery bypass graft surgery for patients with medically refractory myocardial ischemia and risk factors for adverse outcomes with bypass: a multicenter, randomized trial. Investigators of the Department of Veterans Affairs Cooperative Study #385, the Angina With Extremely Serious Operative Mortality Evaluation (AWESOME). J Am Coll Cardiol 2001; 38(1):143–149
151a. Hausleiter J, Martinoff S, Hadamitzky M, Martuscelli E, Pschierer I, Feuchtner GM, Catalan-Sanz P, Czermak B, Meyer TS, Hein F, Bischoff B, Kuse M, Schomig A, Achenbach S. Image quality and radiation exposure with a low tube voltage protocol for coronary CT angiography results of the PROTECTION II Trial. JACC Cardiovasc Imaging 2010;3:1113–1123.
152. Rodriguez A, Bernardi V, Navia J, Baldi J, Grinfeld L, Martinez J, Vogel D, Grinfeld R, Delacasa A, Garrido M, Oliveri R, Mele E, Palacios I, O’NeillW. Argentine Randomized Study: Coronary Angioplasty with Stenting vs. Coronary Bypass Surgery in patients with Multiple-Vessel Disease (ERACI II): 30-day and one-year follow-up results. ERACI II Investigators. J Am Coll Cardiol 2001;37(1):51–58
153. Serruys PW, Unger F, Sousa JE, Jatene A, Bonnier HJ, Schonberger JP, Buller N, Bonser R, van den Brand MJ, van Herwerden LA, MorelMA, van Hout BA. Comparison of coronary-artery bypass surgery and stenting for the treatment of multivessel disease. N Engl J Med 2001;344(15):1117–1124
154. Coronary artery bypass surgery vs. percutaneous coronary intervention with stent implantation in patients with multivessel coronary artery disease (the Stent or Surgery trial): a randomised controlled trial. Lancet 2002;360(9338):965–970
155. Eefting F, Nathoe H, van Dijk D, Jansen E, Lahpor J, Stella P, SuykerW, Diephuis J, Suryapranata H, Ernst S, Borst C, Buskens E, Grobbee D, de Jaegere P. Randomized comparison between stenting and off-pump bypass surgery in patients referred for angioplasty. Circulation 2003;108(23):2870–2876
155a. Brodoefel H, Burgstahler C, Tsiflikas I, Reimann A, Schroeder S, Claussen CD, Heuschmid M, Kopp AF. Dual-source CT: effect of heart rate, heart rate variability, and calcification on image quality and diagnostic accuracy. Radiology 2008;247: 346–355.
156. Thiele H, Oettel S, Jacobs S, Hambrecht R, Sick P, Gummert JF, Mohr FW, Schuler G, Falk V. Comparison of bare-metal stenting with minimally invasive bypass surgery for stenosis of the left anterior descending coronary artery: a 5-year follow-up. Circulation 2005;112(22):3445–3450
156a. Chen CC, Chen CC, Hsieh IC, Liu YC, LiuCY, ChanT,Wen MS,Wan YL. The effect of calcium score on the diagnostic accuracy of coronary computed tomography angiography. Int J Cardiovasc Imaging 2011;27 Suppl 1:37–42.
157. Serruys PW, Morice MC, Kappetein AP, Colombo A, Holmes DR, Mack MJ, Stahle E, Feldman TE, van den Brand M, Bass EJ, Van Dyck N, Leadley K, Dawkins KD, Mohr FW. Percutaneous coronary intervention vs. coronary-artery-bypass grafting for severe coronary artery disease. N Engl J Med 2009;360(10): 961–972
158. Boudriot E, Thiele H,Walther T, Liebetrau C, Boeckstegers P, Pohl T, Reichart B, Mudra H, Beier F, Gansera B, Neumann FJ, Gick M, Zietak T, Desch S, Schuler G, Mohr FW. Randomized comparison of percutaneous coronary intervention with sirolimus-eluting stents vs. coronary artery bypass grafting in unprotected left main stem stenosis. J Am Coll Cardiol 2011;57(5):538–545
159. Park SJ, Kim YH, Park DW, Yun SC, Ahn JM, Song HG, Lee JY, Kim WJ, Kang SJ, Lee SW, Lee CW, Park SW, Chung CH, Lee JW, Lim DS, Rha SW, Lee SG, Gwon HC, Kim HS, Chae IH, Jang Y, Jeong MH, Tahk SJ, Seung KB. Randomized trial of stents vs. bypass surgery for left main coronary artery disease. N Engl J Med 2011;364(18):1718–1727
160. Kapoor JR, Gienger AL, Ardehali R, Varghese R, Perez MV, Sundaram V, McDonald KM, Owens DK, Hlatky MA, Bravata DM. Isolated disease of the proximal left anterior descending artery comparing the effectiveness of percutaneous-coronary interventions and coronary artery bypass surgery. JACC Cardiovasc Interv 2008;1(5):483–491
161. Aziz O, Rao C, Panesar SS, Jones C, Morris S, Darzi A, Athanasiou T. Meta-analysis of minimally invasive internal thoracic artery bypass vs. percutaneous revascularisation for isolated lesions of the left anterior descending artery. BMJ 2007;334(7594): 617
162. Loop FD, Lytle BW, Cosgrove DM, Stewart RW, Goormastic M, Williams GW, Golding LA, Gill CC, Taylor PC, Sheldon WC et al. Influence of the internal-mammary-artery graft on 10-year survival and other cardiac events. N Engl J Med 1986;314(1):1–6
163. Cameron A, Davis KB, Green GE, Myers WO, Pettinger M. Clinical implications of internal mammary artery bypass grafts: the Coronary Artery Surgery Study experience Circulation 1988;77(4):815–819
164. Lytle BW, Blackstone EH, Sabik JF, Houghtaling P, Loop FD, Cosgrove DM. The effect of bilateral internal thoracic artery grafting on survival during 20 postoperative years. Ann Thorac Surg 2004;78(6):2005–2012; discussion 2012–2014
165. Kurlansky PA, Traad EA, Dorman MJ, Galbut DL, Zucker M, Ebra G. Thirty-year follow-up defines survival benefit for second internal mammary artery in propensity-matched groups. Ann Thorac Surg 2010;90(1):101–108
166. Taggart DP, Kaul S, Boden WE, Ferguson TB Jr., Guyton RA, Mack MJ, Sergeant PT, Shemin RJ, Smith PK, Yusuf S. Revascularization for unprotected left main stem coronary artery stenosis stenting or surgery. J Am Coll Cardiol 2008;51(9):885–892
167. Mehilli J, Kastrati A, Byrne RA, Bruskina O, Iijima R, Schulz S, Pache J, Seyfarth M, Massberg S, Laugwitz KL, Dirschinger J, Schomig A. Paclitaxel- vs. sirolimus-eluting stents for unprotected left main coronary artery disease. J Am Coll Cardiol 2009; 53(19):1760–1768
168. Morice MC, Serruys PW, Kappetein AP, Feldman TE, Stahle E, Colombo A, Mack MJ, Holmes DR, Torracca L, van Es GA, Leadley K, Dawkins KD, Mohr F. Outcomes in patients with de novo left main disease treated with either percutaneous coronary intervention using paclitaxel-eluting stents or coronary artery bypass graft treatment in the Synergy Between Percutaneous Coronary Intervention with TAXUS and Cardiac Surgery (SYNTAX) trial. Circulation 2010;121(24): 2645–2653
169. Morice MC, Serruys PW, Kappetein AP, Feldman TE, Stahle E, Colombo A, Mack MJ, Holmes DR, Choi JW, Ruzyllo W, Religa G, Huang J, Roy K, Dawkins KD, Mohr F. Five-Year Outcomes in Patients with Left Main Disease-Treated with Either Percutaneous Coronary Intervention or Coronary Artery Bypass Grafting in the SYNTAX Trial. Circulation 2014;129:2388–2394
170. Capodanno D, StoneGW, Morice MC, Bass TA, Tamburino C. Percutaneous coronary intervention vs. coronary artery bypass graft surgery in left main coronary artery disease: a meta-analysis of randomized clinical data. J Am Coll Cardiol 2011; 58(14):1426–1432
170a. Kato S, Kitagawa K, Ishida N, Ishida M, Nagata M, Ichikawa Y, Katahira K, Matsumoto Y, Seo K, Ochiai R, Kobayashi Y, Sakuma H. Assessment of coronary artery disease using magnetic resonance coronary angiography: a national multicenter trial. J Am Coll Cardiol 2010;56:983–991.
171. Buszman PE, Buszman PP, Kiesz RS, Bochenek A, Trela B, Konkolewska M, Wallace-Bradley D, Wilczynski M, Banasiewicz-Szkrobka I, Peszek-Przybyla E, Krol M, Kondys M, Milewski K, Wiernek S, Debinski M, Zurakowski A, Martin JL, Tendera M. Early and long-term results of unprotected left main coronary artery stenting: the LE MANS (Left Main Coronary Artery Stenting) registry. J Am Coll Cardiol 2009;54(16):1500–1511
172. Park DW, Kim YH, Yun SC, Lee JY, Kim WJ, Kang SJ, Lee SW, Lee CW, Kim JJ, Choo SJ, Chung CH, Lee JW, ParkSW, Park SJ. Long-term outcomes after stenting vs. coronary artery bypass grafting for unprotected left main coronary artery disease: 10-year results of bare-metal stents and 5-year results of drug-eluting stents from the ASAN-MAIN (ASAN Medical Center-Left MAIN Revascularization) Registry. J Am Coll Cardiol 2010;56(17):1366–1375
172a. Wijns W, Kolh P, Danchin N, Di Mario C, Falk V, Folliguet T, Garg S, Huber K, James S, Knuuti J, Lopez-Sendon J, Marco J, Menicanti L, Ostojic M, Piepoli MF, Pirlet C, Pomar JL, Reifart N, Ribichini FL, Schalij MJ, Sergeant P, Serruys PW, Silber S, Sousa Uva M, Taggart D. Guidelines on myocardial revascularization. Eur Heart J 2010;31:2501–2555.
173. Sipahi I, Akay MH, Dagdelen S, Blitz A, Alhan C. Coronary Artery Bypass Grafting vs.Percutaneous Coronary Intervention and Long-term Mortality and Morbidity in Multivessel Disease: Meta-analysis of Randomized Clinical Trials of the Arterial Grafting and Stenting Era. JAMA Intern Med 2014;174(2):223–230
174. Bravata DM, Gienger AL, McDonald KM, Sundaram V, Perez MV, Varghese R, Kapoor JR, Ardehali R, OwensDK, Hlatky MA. Systematic review: the comparative effectiveness of percutaneous coronary interventions and coronary artery bypass graft surgery. Ann Intern Med 2007;147(10):703–716
175. Farkouh ME, Domanski M, Sleeper LA, Siami FS, Dangas G, Mack M, Yang M, Cohen DJ, Rosenberg Y, Solomon SD, Desai AS, Gersh BJ, Magnuson EA, Lansky A, Boineau R, Weinberger J, Ramanathan K, Sousa JE, Rankin J, Bhargava B, Buse J, Hueb W, Smith CR, Muratov V, Bansilal S, King S 3rd, Bertrand M, Fuster V, Investigators FT. Strategies for multivessel revascularization in patients with diabetes. N Engl J Med 2012;367(25):2375–2384
176. Head SJ, Davierwala PM, Serruys PW, Redwood SR, Colombo A, Mack MJ, Morice MC, Holmes DR, Feldman TE, Staehle E, Underwood P, Dawkins KD, Kappetein AP, Mohr FW. Coronary artery bypass grafting vs. percutaneous-coronary intervention for patients with three-vessel disease: final five-year followup of the SYNTAX trial. Eur Heart J. Published online 21 May 2014; doi: 10.1093/ eurheartj/ehu213
177. Wu C, Camacho FT, Zhao S, Wechsler AS, Culliford AT, Lahey SJ, King SB 3rd, Walford G, Gold JP, Smith CR, Jordan D, Higgins RS, Hannan EL. Long-term mortality of coronary artery bypass graft surgery and stenting with drug-eluting stents Ann Thorac Surg 2013;95(4):1297–1305
178. Blazek S, Holzhey D, Jungert C, Borger MA, Fuernau G, Desch S, Eitel I, deWaha S, Lurz P, Schuler G, Mohr FW, Thiele H. Comparison of bare-metal stenting with minimally invasive bypass surgery for stenosis of the left anterior descending coronary artery: 10-year follow-up of a randomized trial. JACC Cardiovasc Interv 2013; 6(1):20–26
179. Thiele H, Neumann-Schniedewind P, Jacobs S, Boudriot E,Walther T, Mohr FW, Schuler G, Falk V. Randomized comparison of minimally invasive direct coronary artery bypass surgery vs. sirolimus-eluting stenting in isolated proximal left anterior descending coronary artery stenosis. J Am Coll Cardiol 2009;53(25):2324–2331
180. Hamm CW, Bassand JP, Agewall S, Bax J, Boersma E, Bueno H, Caso P, Dudek D, Gielen S, Huber K, Ohman M, Petrie MC, Sonntag F, Uva MS, Storey RF, WijnsW, Zahger D, Guidelines ESCCfP. ESC Guidelines for the management of-acute coronary syndromes in patients presenting without persistent ST-segment elevation: The Task Force for the management of acute coronary syndromes (ACS) in patients presenting without persistent ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J 2011;32(23):2999–3054
181. Mehta SR, Cannon CP, Fox KA, Wallentin L, Boden WE, Spacek R, Widimsky P, McCullough PA, Hunt D, Braunwald E, Yusuf S. Routine vs. selective invasive strategies in patients with acute coronary syndromes: a collaborative meta-analysis of randomized trials. JAMA 2005;293(23):2908–2917
182. Bavry AA, Kumbhani DJ, Rassi AN, Bhatt DL, Askari AT. Benefit of early invasive therapy in acute coronary syndromes: a meta-analysis of contemporary randomized clinical trials. J Am Coll Cardiol 2006;48(7):1319–1325
183. O’Donoghue M, Boden WE, Braunwald E, Cannon CP, Clayton TC, de Winter RJ, Fox KA, Lagerqvist B, McCullough PA, Murphy SA, Spacek R, Swahn E,Wallentin L, Windhausen F, Sabatine MS. Early invasive vs.conservative treatment strategies in women and men with unstable angina and non-ST-segment elevation myocardial infarction: a meta-analysis. JAMA 2008;300(1):71–80
184. Fox KA, Clayton TC, Damman P, Pocock SJ, de Winter RJ, Tijssen JG, Lagerqvist B, Wallentin L. Long-term outcome of a routine vs. selective invasive strategy in patients with non-ST-segment elevation acute coronary syndrome a meta-analysis of individual patient data. J Am Coll Cardiol 2010;55(22):2435–2445
185. Katritsis DG, Siontis GC, Kastrati A, van’t Hof AW, Neumann FJ, Siontis KC, Ioannidis JP. Optimal timing of coronary angiography and potential intervention in non-ST-elevation acute coronary syndromes. Eur Heart J 2011;32(1):32–40
186. Navarese EP, Gurbel PA, Andreotti F, Tantry U, Jeong YH, Kozinski M, Engstrom T, Di Pasquale G, Kochman W, Ardissino D, Kedhi E, Stone GW, Kubica J. Optimal timing of coronary invasive strategy in non-ST-segment elevation acute coronary syndromes: a systematic review and meta-analysis. Ann Intern Med 2013;158(4): 261–270
187. Mehta SR, Granger CB, Boden WE, Steg PG, Bassand JP, Faxon DP, Afzal R, Chrolavicius S, Jolly SS, Widimsky P, Avezum A, Rupprecht HJ, Zhu J, Col J, Natarajan MK, Horsman C, Fox KA, Yusuf S, Investigators T. Early vs. delayed invasive intervention in acute coronary syndromes. N Engl J Med 2009;360(21): 2165–2175
188. Sorajja P, Gersh BJ, Cox DA, McLaughlin MG, Zimetbaum P, Costantini C, Stuckey T, Tcheng JE, Mehran R, Lansky AJ, Grines CL, StoneGW. Impact of multivessel disease on reperfusion success and clinical outcomes in patients undergoing primary percutaneous coronary intervention for acute myocardial infarction. Eur Heart J 2007;28(14):1709–1716
189. Ben-Gal Y, Moses JW, Mehran R, Lansky AJ, Weisz G, Nikolsky E, Argenziano M, Williams MR, Colombo A, Aylward PE, StoneGW. Surgical vs. percutaneous revascularization for multivessel disease in patients with acute coronary syndromes: analysis from the ACUITY (Acute Catheterization and Urgent Intervention Triage Strategy) trial. JACC Cardiovasc Interv 2010;3(10):1059–1067
190. Palmerini T, Genereux P, Caixeta A, Cristea E, Lansky A, Mehran R, Dangas G, Lazar D, Sanchez R, Fahy M, Xu K, Stone GW. Prognostic value of the SYNTAX score in patients with acute coronary syndromes undergoing percutaneous coronary intervention: analysis from the ACUITY (Acute Catheterization and Urgent Intervention Triage StrategY) trial. J Am Coll Cardiol 2011;57(24):2389–2397
191. Brener SJ, Milford-Beland S, Roe MT, Bhatt DL, Weintraub WS, Brindis RG Culprit-only or multivessel revascularization in patients with acute coronary syndromes: an American College of Cardiology National Cardiovascular Database Registry report. Am Heart J 2008;155(1):140–146
192. Hannan EL, Samadashvili Z, Walford G, Jacobs AK, Stamato NJ, Venditti FJ, Holmes DR Jr., Sharma S, King SB 3rd. Staged vs. one-time complete revascularization with percutaneous coronary intervention for multivessel coronary artery disease patients without ST-elevation myocardial infarction. Circ Cardiovasc Interv 2013;6(1):12–20
193. Rosner GF, Kirtane AJ, Genereux P, Lansky AJ, Cristea E, Gersh BJ, Weisz G, Parise H, Fahy M, Mehran R, Stone GW. Impact of the presence and extent of incomplete angiographic revascularization after percutaneous coronary intervention in acute coronary syndromes: the Acute Catheterization and Urgent Intervention Triage Strategy (ACUITY) trial. Circulation 2012;125(21):2613–2620
194. Monteiro P. Impact of early coronary artery bypass graft in an unselected acute coronary syndrome patient population. Circulation 2006;114(1 Suppl):I467–I472
195. Parikh SV, de Lemos JA, Jessen ME, Brilakis ES, Ohman EM, Chen AY, Wang TY, Peterson ED, Roe MT, Holper EM. Timing of in-hospital coronary artery bypass graft surgery for non-ST-segment elevation myocardial infarction patients results from the National Cardiovascular Data Registry ACTION Registry-GWTG (Acute Coronary Treatment and Intervention Outcomes Network Registry-Get With The Guidelines). JACC Cardiovasc Interv 2010;3(4):419–427
196. Greenhalgh J, Hockenhull J, Rao N, Dundar Y, Dickson RC, Bagust A. Drug-eluting stents vs. bare metal stents for angina or acute coronary syndromes. Cochrane Database Syst Rev 2010(5):CD004587
197. Amsterdam EA, Kirk JD, Diercks DB, Lewis WR, Turnipseed SD. Immediate exercise testing to evaluate low-risk patients presenting to the emergency department with chest pain. J Am Coll Cardiol 2002;40(2):251–256
198. Nyman I,Wallentin L, Areskog M, Areskog NH, Swahn E. Risk stratification by early exercise testing after an episode of unstable coronary artery disease. The RISC Study Group. Int J Cardiol 1993;39(2):131–142
199. Kirtane AJ, Gupta A, Iyengar S, Moses JW, Leon MB, Applegate R, Brodie B, Hannan E, Harjai K, Jensen LO, Park SJ, Perry R, Racz M, Saia F, Tu JV, Waksman R, Lansky AJ, Mehran R, Stone GW. Safety and efficacy of drug-eluting and bare metal stents: comprehensive meta-analysis of randomized trials and observational studies. Circulation 2009;119(25):3198–3206
200. Moses JW, Mehran R, Nikolsky E, Lasala JM, CoreyW, Albin G, Hirsch C, Leon MB, Russell ME, Ellis SG, Stone GW. Outcomes with the paclitaxel-eluting stent in patients with acute coronary syndromes: analysis from the TAXUS-IV trial. J Am Coll Cardiol 2005;45(8):1165–1171
201. Steg PG, James SK, Atar D, Badano LP, Blomstrom-Lundqvist C, Borger MA, Di Mario C, Dickstein K, Ducrocq G, Fernandez-Aviles F, Gershlick AH, Giannuzzi P, Halvorsen S, Huber K, Juni P, Kastrati A, Knuuti J, Lenzen MJ, Mahaffey KW, Valgimigli M, van ’t Hof A, Widimsky P, Zahger D. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J 2012;33(20):2569–2619
202. Gershlick AH, Banning AP, Myat A, Verheugt FW, Gersh BJ. Reperfusion therapy for STEMI: is there still a role for thrombolysis in the era of primary percutaneous coronary intervention? Lancet 2013;382(9892):624–632
203. Miedema MD, Newell MC, Duval S, Garberich RF, Handran CB, Larson DM, Mulder S,Wang YL, Lips DL, Henry TD. Causes of delay and associated mortality in patients transferred with ST-segment-elevation myocardial infarction. Circulation 2011;124(15):1636–1644
204. Herrin J, Miller LE, Turkmani DF, NsaW, Drye EE, BernheimSM, Ling SM, RappMT, HanLF, BratzlerDW, Bradley EH, Nallamothu BK, TingHH,KrumholzHM.National performance on door-in to door-out time among patients transferred for primary percutaneous coronary intervention. Arch Intern Med 2011;171(21): 1879–1886
205. Wang TY, Nallamothu BK, Krumholz HM, Li S, Roe MT, Jollis JG, Jacobs AK, Holmes DR, Peterson ED, Ting HH. Association of door-in to door-out time with reperfusion delays and outcomes among patients transferred for primary percutaneous coronary intervention. JAMA 2011;305(24):2540–2547
206. O’Gara PT, Kushner FG, Ascheim DD, Casey DE Jr., Chung MK, de Lemos JA, Ettinger SM, Fang JC, Fesmire FM, Franklin BA, Granger CB, Krumholz HM, Linderbaum JA, Morrow DA, Newby LK, Ornato JP, Ou N, Radford MJ, Tamis-Holland JE, Tommaso CL, Tracy CM, Woo YJ, Zhao DX, Anderson JL, Jacobs AK, Halperin JL, Albert NM, Brindis RG, Creager MA, DeMets D, Guyton RA, Hochman JS, Kovacs RJ, Ohman EM, Stevenson WG, Yancy CW 2013ACCF/AHA guideline for the management of ST-elevation myocardial infarction: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation 2013;127(4):e362– e425
207. Boersma E, Maas AC, Deckers JW, Simoons ML. Early thrombolytic treatment in acute myocardial infarction: reappraisal of the golden hour. Lancet 1996; 348(9030):771–775
208. Boersma E. Does time matter? A pooled analysis of randomized clinical trials comparing primary percutaneous coronary intervention and in-hospital fibrinolysis in acute myocardial infarction patients. Eur Heart J 2006;27(7):779–788
209. Keeley EC, Boura JA, Grines CL. Comparison of primary and facilitated percutaneous coronary interventions for ST-elevation myocardial infarction: quantitative review of randomised trials. Lancet 2006;367(9510):579–588
210. Bonnefoy E, Lapostolle F, Leizorovicz A, Steg G, McFadden EP, Dubien PY, Cattan S, Boullenger E, Machecourt J, Lacroute JM, Cassagnes J, Dissait F, Touboul P. Primary angioplasty vs. prehospital fibrinolysis in acute myocardial infarction: a randomised study. Lancet 2002;360(9336):825–829
211. Bonnefoy E, Steg PG, Boutitie F, Dubien PY, Lapostolle F, Roncalli J, Dissait F, Vanzetto G, Leizorowicz A, Kirkorian G, Mercier C, McFadden EP, Touboul P Comparison of primary angioplasty and pre-hospital fibrinolysis in acute myocardial infarction (CAPTIM) trial: a 5-year follow-up. Eur Heart J 2009;30(13): 1598–1606
212. Morrison LJ, Verbeek PR, McDonaldAC, Sawadsky BV, CookDJ. Mortality and prehospital thrombolysis for acute myocardial infarction: A meta-analysis. JAMA 2000; 283(20):2686–2692
213. Steg PG, Bonnefoy E, Chabaud S, Lapostolle F, Dubien PY, Cristofini P, Leizorovicz A, Touboul P. Impact of time to treatment on mortality after prehospital fibrinolysis or primary angioplasty: data from the CAPTIM randomized clinical trial. Circulation 2003;108(23):2851–2856
214. Pinto DS, Frederick PD, Chakrabarti AK, Kirtane AJ, Ullman E, Dejam A, Miller DP, Henry TD, Gibson CM. Benefit of transferring ST-segment-elevation myocardial infarction patients for percutaneous coronary intervention compared with administration of onsite fibrinolytic declines as delays increase. Circulation 2011;124(23): 2512–2521
215. Armstrong PW, Gershlick AH, Goldstein P, Wilcox R, Danays T, Lambert Y, Sulimov V, Rosell Ortiz F, Ostojic M, Welsh RC, Carvalho AC, Nanas J, Arntz HR, Halvorsen S, Huber K, Grajek S, Fresco C, Bluhmki E, Regelin A,-Vandenberghe K, Bogaerts K, Van de Werf F. Fibrinolysis or primary PCI in ST-segment elevation myocardial infarction. N Engl J Med 2013;368(15): 1379–1387
216. Bates ER, Jacobs AK. Time to treatment in patients with STEMI. N Engl J Med 2013; 369(10):889–892
217. Luepker RV, Raczynski JM, Osganian S, Goldberg RJ, Finnegan JR Jr., Hedges JR, Goff DC Jr., Eisenberg MS, Zapka JG, Feldman HA, Labarthe DR, McGovern PG, Cornell CE, Proschan MA, Simons-Morton DG. Effect of a community intervention on patient delay and emergency medical service use in acute coronary heart disease: The Rapid Early Action for Coronary Treatment (REACT) Trial. JAMA 2000;284(1):60–67
218. Kristensen SD, Laut KG, Fajadet J, Kaifoszova Z, Kala P, Di Mario C, Wijns W, Clemmensen P, Agladze V, Antoniades L, Alhabib KF, De Boer MJ, Claeys MJ, Deleanu D, Dudek D, Erglis A, Gilard M, Goktekin O, Guagliumi G, Gudnason T, Hansen KW, Huber K, James S, Janota T, Jennings S, Kajander O, Kanakakis J, Karamfiloff KK, Kedev S, Kornowski R, Ludman PF, Merkely B, Milicic D, Najafov R, Nicolini FA, Noc M, Ostojic M, Pereira H, Radovanovic D, Sabate M, Sobhy M, Sokolov M, Studencan M, Terzic I, Wahler S, Widimsky P. Reperfusion therapy for ST elevation acute myocardial infarction 2010/2011: current status in 37 ESC countries. Eur Heart J 2014;35:1957–1970
219. Andersen HR, Nielsen TT, Rasmussen K, Thuesen L, Kelbaek H, Thayssen P, Abildgaard U, Pedersen F, Madsen JK, Grande P, Villadsen AB, Krusell LR, Haghfelt T, Lomholt P, Husted SE, Vigholt E, Kjaergard HK, Mortensen LS. A comparison of coronary angioplasty with fibrinolytic therapy in acute myocardial infarction N Engl J Med 2003;349(8):733–742
220. Dalby M, Bouzamondo A, Lechat P, Montalescot G. Transfer for primary angioplasty vs. immediate thrombolysis in acute myocardial infarction: a meta-analysis Circulation 2003;108(15):1809–1814
221. Hochman JS, Sleeper LA,Webb JG, Sanborn TA, White HD, Talley JD, Buller CE, Jacobs AK, Slater JN, Col J, McKinlay SM, LeJemtel TH. Early revascularization in acute myocardial infarction complicated by cardiogenic shock. SHOCK Investigators ShouldWe Emergently Revascularize Occluded Coronaries for Cardiogenic Shock. N Engl J Med 1999;341(9):625–634
222. Mehilli J, Kastrati A, Schulz S, Frungel S, Nekolla SG, MoshageW, Dotzer F, Huber K, Pache J, Dirschinger J, Seyfarth M, Martinoff S, Schwaiger M, Schomig A. Abciximab in patients with acute ST-segment-elevation myocardial infarction undergoing primary percutaneous coronary intervention after clopidogrel loading: a randomized double-blind trial. Circulation 2009;119(14):1933–1940
223. Busk M, Kaltoft A, Nielsen SS, Bottcher M, Rehling M, Thuesen L, Botker HE, Lassen JF, Christiansen EH, Krusell LR, Andersen HR, Nielsen TT, Kristensen SD Infarct size and myocardial salvage after primary angioplasty in patients presenting with symptoms for,12 h vs. 12–72 h. Eur Heart J 2009;30(11):1322–1330
224. Schomig A, Mehilli J, Antoniucci D, Ndrepepa G, Markwardt C, Di Pede F, Nekolla SG, Schlotterbeck K, Schuhlen H, Pache J, Seyfarth M, Martinoff S, BenzerW, Schmitt C, Dirschinger J, Schwaiger M, Kastrati A. Mechanical reperfusion-in patients with acute myocardial infarction presenting more than 12 hours from symptom onset: a randomized controlled trial. JAMA 2005;293(23): 2865–2872
225. Kalla K, Christ G, Karnik R, Malzer R, Norman G, Prachar H, SchreiberW, Unger G, Glogar HD, Kaff A, Laggner AN, Maurer G, Mlczoch J, Slany J,Weber HS, Huber K Implementation of guidelines improves the standard of care: the Viennese registry on reperfusion strategies in ST-elevation myocardial infarction (Vienna STEMI registry). Circulation 2006;113(20):2398–2405
226. Henry TD, Sharkey SW, Burke MN, Chavez IJ, Graham KJ, Henry CR, Lips DL, Madison JD, Menssen KM, Mooney MR, Newell MC, Pedersen WR, Poulose AK, Traverse JH, Unger BT, Wang YL, Larson DM. A regional system to provide timely access to percutaneous coronary intervention for ST-elevation myocardial infarction. Circulation 2007;116(7):721–728
227. Nallamothu BK, Krumholz HM, Ko DT, LaBresh KA, Rathore S, Roe MT, Schwamm L. Development of systems of care for ST-elevation myocardial infarction patients: gaps, barriers, and implications. Circulation 2007;116(2):e68–e72
228. Widimsky P, WijnsW, Fajadet J, de Belder M, Knot J, Aaberge L, Andrikopoulos G, Baz JA, Betriu A, Claeys M, Danchin N, Djambazov S, Erne P, Hartikainen J, Huber K, Kala P, Klinceva M, Kristensen SD,Ludman P, Ferre JM, Merkely B, Milicic D, Morais J, Noc M, Opolski G, Ostojic M, Radovanovic D, De Servi S, Stenestrand U, Studencan M, Tubaro M, Vasiljevic Z,Weidinger F, Witkowski A, Zeymer U. Reperfusion therapy for ST elevation acute myocardial infarction in Europe: description of the current situation in 30 countries. Eur Heart J 2010;31(8):943–957
229. Knot J, Widimsky P, Wijns W, Stenestrand U, Kristensen SD, Van THA, Weidinger F, Janzon M, Norgaard BL, Soerensen JT, van de Wetering H, Thygesen K, Bergsten PA, Digerfeldt C, Potgieter A, Tomer N, Fajadet J. How to set up an effective national primary angioplasty network: lessons learned from five European countries. EuroIntervention 2009;5(3):299, 301–309
230. Bradley EH, Herrin J,Wang Y, Barton BA,Webster TR, Mattera JA, Roumanis SA, Curtis JP, Nallamothu BK, Magid DJ, McNamara RL, Parkosewich J, Loeb JM, Krumholz HM. Strategies for reducing the door-to-balloon time in acute myocardial infarction. N Engl J Med 2006;355(22):2308–2320
231. Pinto DS, Kirtane AJ, Nallamothu BK, Murphy SA, Cohen DJ, Laham RJ, Cutlip DE, Bates ER, Frederick PD, Miller DP, Carrozza JP Jr., Antman EM, Cannon CP, Gibson CM. Hospital delays in reperfusion for ST-elevation myocardial infarction: implications when selecting a reperfusion strategy. Circulation 2006;114(19): 2019–2025
232. Steg PG, Cambou JP, Goldstein P, Durand E, Sauval P, Kadri Z, Blanchard D, Lablanche JM, Gueret P, Cottin Y, Juliard JM, Hanania G, Vaur L, Danchin N. Bypassing the emergency room reduces delays and mortality in ST elevation myocardial infarction: the USIC 2000 registry. Heart 2006;92(10):1378–1383
233. Cavender MA, Milford-Beland S, Roe MT, Peterson ED, Weintraub WS, Rao SV Prevalence, predictors, and in-hospital outcomes of non-infarct artery intervention during primary percutaneous coronary intervention for ST-segment elevation myocardial infarction (from the National Cardiovascular Data Registry). Am J Cardiol 2009;104(4):507–513
234. Kornowski R, Mehran R, Dangas G, Nikolsky E, Assali A, Claessen BE, Gersh BJ, Wong SC, Witzenbichler B, Guagliumi G, Dudek D, Fahy M, Lansky AJ, Stone GW. Prognostic impact of staged vs. "one-time" multivessel percutaneous intervention in acute myocardial infarction: analysis from the HORIZONS-AMI (harmonizing outcomes with revascularization and stents in acute myocardial infarction) trial. J Am Coll Cardiol 2011;58(7):704–711
235. Politi L, Sgura F, Rossi R, Monopoli D, Guerri E, Leuzzi C, Bursi F, Sangiorgi GM, Modena MG. A randomised trial of target-vessel vs. multi-vessel revascularisation in ST-elevation myocardial infarction: major adverse cardiac events during longterm follow-up. Heart 2010;96(9):662–667
236. Di Mario C, Mara S, Flavio A, Imad S, Antonio M, Anna P, Emanuela P, Stefano DS, Angelo R, Stefania C, Anna F, Carmelo C, Antonio C,Monzini N, Bonardi MA. Single vs.multivessel treatment during primary angioplasty: results of the multicentre randomised HEpacoat for cuLPrit or multivessel stenting for Acute Myocardial Infarction (HELP AMI) Study. Int J Cardiovasc Intervent 2004;6(3–4):128–133
237. Jolly SS, Yusuf S, Cairns J, Niemela K, Xavier D, Widimsky P, Budaj A, Niemela M, Valentin V, Lewis BS, Avezum A, Steg PG, Rao SV, Gao P, Afzal R, Joyner CD, Chrolavicius S, Mehta SR. Radial vs. femoral access for coronary angiography and intervention in patients with acute coronary syndromes (RIVAL): a randomised, parallel group, multicentre trial. Lancet 2011;377(9775):1409–1420
238. Romagnoli E, Biondi-Zoccai G, Sciahbasi A, Politi L, Rigattieri S, Pendenza G, Summaria F, Patrizi R, Borghi A, Di Russo C, Moretti C, Agostoni P, Loschiavo P, Lioy E, Sheiban I, Sangiorgi G. Radial vs. femoral randomized investigation in ST-segment elevation acute coronary syndrome: the RIFLE-STEACS (Radial Vs Femoral Randomized Investigation in ST-Elevation Acute Coronary Syndrome) study. J Am Coll Cardiol 2012;60(24):2481–2489
239. Baklanov DV, Kaltenbach LA, Marso SP, Subherwal SS, Feldman DN, Garratt KN, Curtis JP, Messenger JC, Rao SV. The prevalence and outcomes of transradial percutaneous coronary intervention for ST-segment elevation myocardial infarction: analysis from the National Cardiovascular Data Registry (2007 to 2011). J Am Coll Cardiol 2013;61(4):420–426
240. Hamon M, Pristipino C, Di Mario C, Nolan J, Ludwig J, Tubaro M, Sabate M, Mauri-Ferre J, Huber K, Niemela K, Haude M, Wijns W, Dudek D, Fajadet J, Kiemeneij F. Consensus document on the radial approach in percutaneous cardiovascular interventions: position paper by the European Association of Percutaneous Cardiovascular Interventions and Working Groups on Acute Cardiac Care** and Thrombosis of the European Society of Cardiology. EuroIntervention-2013;8(11):1242–1251
241. Nordmann AJ, Hengstler P, Harr T, Young J, Bucher HC. Clinical outcomes of primary stenting vs. balloon angioplasty in patients with myocardial infarction: a meta-analysis of randomized controlled trials. Am J Med 2004;116(4):253–262
242. Stone GW, Grines CL, Cox DA, Garcia E, Tcheng JE, Griffin JJ, Guagliumi G, Stuckey T, Turco M, Carroll JD, Rutherford BD, Lansky AJ. Comparison of angioplasty with stenting, with or without abciximab, in acute myocardial infarction. N Engl J Med 2002;346(13):957–966
243. Stone GW, Witzenbichler B, Guagliumi G, Peruga JZ, Brodie BR, Dudek D, Kornowski R, Hartmann F, Gersh BJ, Pocock SJ, Dangas G, Wong SC, Fahy M, Parise H, Mehran R. Heparin plus a glycoprotein IIb/IIIa inhibitor vs. bivalirudin-monotherapyand paclitaxel-eluting stents vs. bare-metal stents in acute myocardial infarction (HORIZONS-AMI): final 3-year results from a multicentre, randomised controlled trial. Lancet 2011;377(9784):2193–2204
244. Kalesan B, Pilgrim T, Heinimann K, Raber L, Stefanini GG, Valgimigli M, da Costa BR, Mach F, Luscher TF, Meier B, Windecker S, Juni P. Comparison of drug-eluting stents with bare metal stents in patients with ST-segment elevation myocardial infarctionEur Heart J 2012;33(8):977–987
245. Nakazawa G, Finn AV, Vorpahl M, Ladich ER, Kolodgie FD, Virmani R. Coronary responses and differential mechanisms of late stent thrombosis attributed to firstgeneration sirolimus- and paclitaxel-eluting stents. J Am Coll Cardiol 2011;57(4): 390–398
246. Hofma SH, Brouwer J, Velders MA, van’t Hof AW, Smits PC, Quere M, de Vries CJ, van Boven AJ. Second-generation everolimus-eluting stents vs. first-generation sirolimus-eluting stents in acute myocardial infarction. 1-year results of the randomized XAMI (XienceV Stent vs. Cypher Stent in Primary PCI for Acute Myocardial Infarction) trial. J Am Coll Cardiol 2012;60(5):381–387
247. Sabate M, Cequier A, Iniguez A, Serra A, Hernandez-Antolin R, Mainar V, Valgimigli M, Tespili M, den Heijer P, Bethencourt A, Vazquez N, Gomez-Hospital JA, Baz JA, Martin-Yuste V, van Geuns RJ, Alfonso F, Bordes P, Tebaldi M, Masotti M, Silvestro A, Backx B, Brugaletta S, van Es GA, Serruys PW Everolimus-eluting stent vs. bare-metal stent in ST-segment elevation myocardial infarction (EXAMINATION): 1 year results of a randomised controlled trial Lancet 2012;380(9852):1482–1490
248. Raber L, Kelbaek H, Ostojic M, Baumbach A, Heg D, Tuller D, von Birgelen C, Roffi M, Moschovitis A, Khattab AA, Wenaweser P, Bonvini R, Pedrazzini G, Kornowski R, Weber K, Trelle S, Luscher TF, Taniwaki M, Matter CM, Meier B, Juni P, Windecker S. Effect of biolimus-eluting stents with biodegradable polymer vs.bare-metal stents on cardiovascular events among patients with acute myocardial infarction: the COMFORTABLE AMI randomized trial. JAMA 2012;308(8): 777–787
249. Sabate M, Raber L, Heg D, Brugaletta S, Kelbaek H, Cequier A, Ostojic M, Iniguez A, Tuller D, Serra A, Baumbach A, von Birgelen C, Hernandez-Antolin R, Roffi M, Mainar V, Valgimigli M, Serruys PW, Juni P, Windecker S. Comparison of Newer- Generation Drug-Eluting With Bare-Metal Stents in Patients With Acute ST-Segment Elevation Myocardial Infarction: A Pooled Analysis of the EXAMINATION (clinical Evaluation of the Xience-V stent in Acute Myocardial INfArc- TION) and COMFORTABLE-AMI (Comparison of Biolimus Eluted From an Erodible Stent Coating With Bare Metal Stents in Acute ST-Elevation Myocardial Infarction) Trials. JACC Cardiovasc Interv 2014;7(1):55–63
250. Vlaar PJ, Svilaas T, van der Horst IC, Diercks GF, Fokkema ML, de Smet BJ, van den Heuvel AF, Anthonio RL, Jessurun GA, Tan ES, Suurmeijer AJ, Zijlstra F. Cardiac death and reinfarction after1 year in the Thrombus Aspiration during Percutaneous coronary intervention in Acute myocardial infarction Study (TAPAS): a 1-year follow-up study. Lancet 2008;371(9628):1915–1920
251. Sardella G, Mancone M, Bucciarelli-Ducci C, Agati L, Scardala R, Carbone I, Francone M, Di Roma A, Benedetti G, Conti G, Fedele F. Thrombus aspiration during primary percutaneous coronary intervention improves myocardial reperfusion and reduces infarct size: the EXPIRA (thrombectomy with export catheter in infarct-related artery during primary percutaneous coronary intervention) prospective, randomized trial. J Am Coll Cardiol 2009;53(4):309–315
252. De Luca G, Dudek D, Sardella G, Marino P, Chevalier B, Zijlstra F. Adjunctive manual thrombectomy improves myocardial perfusion and mortality in patients undergoing primary percutaneous coronary intervention for ST-elevation-myocardial infarction: a meta-analysis of randomized trials. Eur Heart J 2008; 29(24):3002–3010
253. Costopoulos C, Gorog DA, Di Mario C, Kukreja N. Use of thrombectomy devices in primary percutaneous coronary intervention: a systematic review and meta-analysis. Int J Cardiol 2013;163(3):229–241
254. De Luca G, Navarese EP, Suryapranata H. A meta-analytic overview of thrombectomy during primary angioplasty. Int J Cardiol 2013;166(3):606–612
255. Bavry AA, Kumbhani DJ, Bhatt DL. Role of adjunctive thrombectomy and embolic protection devices in acute myocardial infarction: a comprehensive meta-analysis of randomized trials. Eur Heart J 2008;29(24):2989–3001
256. Frobert O, Lagerqvist B, Olivecrona GK, Omerovic E, Gudnason T, Maeng M, Aasa M, Angeras O, Calais F, Danielewicz M, Erlinge D, Hellsten L, Jensen U, Johansson AC, Karegren A, Nilsson J, Robertson L, Sandhall L, Sjogren I,-Ostlund O, Harnek J, James SK. Thrombus aspiration during ST-segment elevation myocardial infarction. N Engl J Med 2013;369(17):1587–1597
257. Ali A, Cox D, Dib N, Brodie B, Berman D, Gupta N, Browne K, Iwaoka R, Azrin M, Stapleton D, Setum C, Popma J. Rheolytic thrombectomy with percutaneous coronary intervention for infarct size reduction in acute myocardial infarction: 30-day results from a multicenter randomized study. JAmColl Cardiol 2006;48(2):244–252
258. Migliorini A, Stabile A, Rodriguez AE, Gandolfo C, Rodriguez Granillo AM, Valenti R, Parodi G, Neumann FJ, Colombo A, Antoniucci D. Comparison of Angio- Jet rheolytic thrombectomy before direct infarct artery stenting with direct stenting alone in patients with acute myocardial infarction. The JETSTENT trial. J Am Coll Cardiol 2010;56(16):1298–1306
259. Stone GW, Webb J, Cox DA, Brodie BR, Qureshi M, Kalynych A, Turco M, Schultheiss HP, Dulas D, Rutherford BD, Antoniucci D, Krucoff MW, Gibbons RJ, Jones D, Lansky AJ, Mehran R. Distal microcirculatory protection during percutaneous coronary intervention in acute ST-segment elevation myocardial infarction: a randomized controlled trial. JAMA 2005;293(9):1063–1072
260. Botker HE, Kharbanda R, Schmidt MR, Bottcher M, Kaltoft AK, Terkelsen CJ, Munk K, Andersen NH, Hansen TM, Trautner S, Lassen JF, Christiansen EH, Krusell LR, Kristensen SD, Thuesen L, Nielsen SS, Rehling M, Sorensen HT,-Redington AN, Nielsen TT. Remote ischaemic conditioning before hospital admission, as a complement to angioplasty, and effect on myocardial salvage in patients with acute myocardial infarction: a randomised trial. Lancet 2010;375(9716): 727–734
261. Ibanez B, Macaya C, Sanchez-Brunete V, Pizarro G, Fernandez-Friera L, Mateos A, Fernandez-Ortiz A, Garcia-Ruiz JM, Garcia-Alvarez A, Iniguez A, Jimenez-Borreguero J, Lopez-Romero P, Fernandez-Jimenez R, Goicolea J, Ruiz-Mateos B, Bastante T, Arias M, Iglesias-Vazquez JA, Rodriguez MD, Escalera N, Acebal C, Cabrera JA, Valenciano J, Perez de Prado A, Fernandez-Campos MJ, Casado I, Garcia-Rubira JC, Garcia-Prieto J, Sanz-Rosa D, Cuellas C, Hernandez-Antolin R, Albarran A, Fernandez-Vazquez F, de la Torre-Hernandez JM, Pocock S, Sanz G, Fuster V. Effect of Early Metoprolol on Infarct Size in ST-Segment-Elevation Myocardial Infarction Patients Undergoing Primary Percutaneous Coronary Intervention: The Effect of Metoprolol in Cardioprotection During an Acute Myocardial Infarction (METOCARD-CNIC) Trial Circulation 2013;128(14):1495–1503
262. vanWerkum JW, Heestermans AA, Zomer AC, Kelder JC, Suttorp MJ, Rensing BJ, Koolen JJ, Brueren BR, Dambrink JH, HautvastRW, VerheugtFW, ten Berg JM. Predictors of coronary stent thrombosis: the Dutch Stent Thrombosis Registry. J Am Coll Cardiol 2009;53(16):1399–1409
263. Stone GW, Abizaid A, Silber S, Dizon JM, Merkely B, Costa RA, Kornowski R, Wojdyla R, Maehara A, Dressler O, Brener SJ, Bar E, Dudek D. Prospective, Randomized, Multicenter Evaluation of a Polyethylene Terephthalate Micronet Mesh- Covered Stent (MGuard) in ST-Segment Elevation Myocardial Infarction: The MASTER Trial. J Am Coll Cardiol 2012;60:1975–1984
264. Hannan EL, Samadashvili Z, Walford G, Holmes DR Jr., Jacobs AK, Stamato NJ, Venditti FJ, Sharma S, King SB 3rd. Culprit vessel percutaneous coronary intervention vs. multivessel and staged percutaneous coronary intervention for ST-segment elevation myocardial infarction patients with multivessel disease. JACC Cardiovasc Interv 2010;3(1):22–31
265. Toma M, Buller CE, Westerhout CM, Fu Y, O’Neill WW, Holmes DR Jr., Hamm CW, Granger CB, Armstrong PW. Non-culprit coronary artery percutaneous coronary intervention during acute ST-segment elevation myocardial infarction:-insights from the APEX-AMI trial. Eur Heart J 2010;31(14):1701–1707
266. Vlaar PJ, Mahmoud KD, Holmes DR Jr., van Valkenhoef G, Hillege HL, van der Horst IC, Zijlstra F, de Smet BJ. Culprit vessel only vs. multivessel and staged percutaneous coronary intervention for multivessel disease in patients presenting with ST-segment elevation myocardial infarction: a pairwise and network meta-analysis. J Am Coll Cardiol 2011;58(7):692–703
267. Wald DS, Morris JK, Wald NJ, Chase AJ, Edwards RJ, Hughes LO, Berry C, Oldroyd KG. Randomized trial of preventive angioplasty in myocardial infarction N Engl J Med 2013;369(12):1115–1123
268. Palmerini T, Biondi-Zoccai G, Della Riva D, Mariani A, Sabate M, Valgimigli M, Frati G, Kedhi E, Smits PC, Kaiser C, Genereux P, Galatius S, Kirtane AJ, Stone GW. Clinical outcomes with drug-eluting and bare-metal stents in patients with ST-segme nt elevation myocardial infarction: evidence from a comprehensive network meta-analysis. J Am Coll Cardiol 2013;62(6):496–504
269. Kastrati A, Dibra A, Spaulding C, Laarman GJ, Menichelli M, Valgimigli M, Di Lorenzo E, Kaiser C, Tierala I, Mehilli J, Seyfarth M, Varenne O, Dirksen MT, Percoco G, Varricchio A, Pittl U, Syvanne M, Suttorp MJ, Violini R, Schomig A Meta-analysis of randomized trials on drug-eluting stents vs. bare-metal stents in patients with acute myocardial infarction. Eur Heart J 2007;28(22):2706–2713
270. KarrowniW, Vyas A, Giacomino B, Schweizer M, Blevins A, Girotra S, Horwitz PA Radial vs. femoral access for primary percutaneous interventions in ST-segment elevation myocardial infarction patients: a meta-analysis of randomized controlled trials. JACC Cardiovasc Interv 2013;6(8):814–823
271. Ellis SG, Tendera M, de Belder MA, van Boven AJ, Widimsky P, Janssens L, Andersen HR, Betriu A, Savonitto S, Adamus J, Peruga JZ, Kosmider M, Katz O, Neunteufl T, Jorgova J, Dorobantu M, Grinfeld L, Armstrong P, Brodie BR,-Herrmann HC, Montalescot G, Neumann FJ, Effron MB, Barnathan ES, Topol EJ Facilitated PCI in patients with ST-elevation myocardial infarction. N Engl J Med 2008;358(21):2205–2217
272. Cantor WJ, Fitchett D, Borgundvaag B, Ducas J, Heffernan M, Cohen EA, Morrison LJ, Langer A, Dzavik V, Mehta SR, Lazzam C, Schwartz B, Casanova A, Goodman SG. Routine early angioplasty after fibrinolysis for acute myocardial infarction N Engl J Med 2009;360(26):2705–2718
273. Di Mario C,Dudek D, Piscione F, MieleckiW, Savonitto S, Murena E, Dimopoulos K, Manari A, Gaspardone A, Ochala A, Zmudka K, Bolognese L, Steg PG, Flather M Immediate angioplasty vs. standard therapy with rescue angioplasty after thrombolysis in the Combined Abciximab REteplase Stent Study in Acute Myocardial Infarction-(CARESS-in-AMI): an open, prospective, randomised, multicentre trial Lancet 2008;371(9612):559–568
274. Bohmer E, Hoffmann P, Abdelnoor M, Arnesen H, Halvorsen S. Efficacy and safety of immediate angioplasty vs. ischemia-guided management after thrombolysis in acute myocardial infarction in areas with very long transfer distances results of theNORDISTEMI (NORwegian study on DIstrict treatment of ST-elevation myocardial infarction). J Am Coll Cardiol 2010;55(2):102–110
275. Fernandez-Aviles F, Alonso JJ, Castro-Beiras A, Vazquez N, Blanco J, Alonso-Briales J, Lopez-Mesa J, Fernandez-Vazquez F, Calvo I, Martinez-Elbal L, San Roman JA, Ramos B. Routine invasive strategy within 24 hours of thrombolysis vs. ischaemia-guided conservative approach for acute myocardial infarction with ST-segment elevation (GRACIA-1): a randomised controlled trial. Lancet 2004; 364(9439):1045–1053
276. Le May MR, Wells GA, Labinaz M, Davies RF, Turek M, Leddy D, Maloney J, McKibbin T, Quinn B, Beanlands RS, Glover C, Marquis JF, O’Brien ER, Williams WL, Higginson LA. Combined angioplasty and pharmacological intervention vs. thrombolysis alone in acute myocardial infarction (CAPITAL AMI study) J Am Coll Cardiol 2005;46(3):417–424
277. Scheller B, Hennen B, Hammer B, Walle J, Hofer C, Hilpert V, Winter H, Nickenig G, Bohm M. Beneficial effects of immediate stenting after thrombolysis in acute myocardial infarction. J Am Coll Cardiol 2003;42(4):634–641
278. Borgia F, Goodman SG, Halvorsen S, Cantor WJ, Piscione F, Le May MR, Fernandez-Aviles F, Sanchez PL, Dimopoulos K, Scheller B, Armstrong PW, Di Mario C. Early routine percutaneous coronary intervention after fibrinolysis vs standard therapy in ST-segment elevation myocardial infarction: a meta-analysis Eur Heart J 2010;31(17):2156–2169
279. Collet JP, Montalescot G, Le May M, Borentain M, Gershlick A. Percutaneous coronary intervention after fibrinolysis: a multiple meta-analyses approach according to the type of strategy. J Am Coll Cardiol 2006;48(7):1326–1335
280. D’Souza SP, Mamas MA, Fraser DG, Fath-Ordoubadi F. Routine early coronary angioplasty vs. ischaemia-guided angioplasty after thrombolysis in acute ST-elevation myocardial infarction: a meta-analysis. Eur Heart J 2011;32(8): 972–982
281. Desch S, Eitel I, Rahimi K, deWaha S, Schuler G, Thiele H. Timing of invasive treatment after fibrinolysis in ST elevation myocardial infarction:a meta-analysis of immediate or early routine vs. deferred or ischemia-guided randomised controlled trials. Heart 2010;96(21):1695–1702
282. Gershlick AH, Stephens-Lloyd A, Hughes S, Abrams KR, Stevens SE, Uren NG, de Belder A, Davis J, Pitt M, Banning A, Baumbach A, ShiuMF, Schofield P, DawkinsKD, Henderson RA, Oldroyd KG, Wilcox R. Rescue angioplasty after failed thrombolytic therapy for acute myocardial infarction. N Engl J Med 2005;353(26): 2758–2768
283. Hochman JS, Sleeper LA, White HD, Dzavik V, Wong SC, Menon V, Webb JG, Steingart R, Picard MH, Menegus MA, Boland J, Sanborn T, Buller CE, Modur S, Forman R, Desvigne-Nickens P, Jacobs AK, Slater JN, LeJemtel TH. One-year survival following early revascularization for cardiogenic shock. JAMA 2001;285(2): 190–192
284. Ellis SG, da Silva ER, Heyndrickx G, Talley JD, Cernigliaro C, Steg G, Spaulding C, Nobuyoshi M, Erbel R, Vassanelli Cet al. Randomized comparison of rescue angioplasty with conservative management of patients with early failure of thrombolysis for acute anterior myocardial infarction. Circulation 1994;90(5):2280–2284
285. Hillis LD, Smith PK, Anderson JL, Bittl JA, Bridges CR, Byrne JG, Cigarroa JE, Disesa VJ, Hiratzka LF, Hutter AM Jr., Jessen ME, Keeley EC, Lahey SJ, Lange RA, London MJ, Mack MJ, Patel MR, Puskas JD, Sabik JF, Selnes O, Shahian DM, Trost JC, Winniford MD. 2011 ACCF/AHA Guideline for Coronary Artery Bypass Graft Surgery: a report of the American College of Cardiology Foundation/ American Heart Association Task Force on Practice Guidelines. Circulation-2011;124(23):e652–e735
286. Weiss ES, Chang DD, Joyce DL, Nwakanma LU, Yuh DD. Optimal timing of coronary artery bypass after acute myocardial infarction: a review of California discharge data. J Thorac Cardiovasc Surg 2008;135(3):503–11, 511 e1–e3
287. McMurray JJ, Adamopoulos S, Anker SD, Auricchio A, Bohm M, Dickstein K, Falk V, Filippatos G, Fonseca C, Gomez-Sanchez MA, Jaarsma T, Kober L, Lip GY, Maggioni AP, Parkhomenko A, Pieske BM, Popescu BA, Ronnevik PK, Rutten FH, Schwitter J, Seferovic P, Stepinska J, Trindade PT, Voors AA, Zannad F, Zeiher A
ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC. Eur Heart J 2012;33(14):1787–1847
288. Velazquez EJ, Williams JB, Yow E, Shaw LK, Lee KL, Phillips HR, O’Connor CM, Smith PK, Jones RH. Long-term survival of patients with ischemic cardiomyopathy treated by coronary artery bypass grafting vs. medical therapy. Ann Thorac Surg 2012;93(2):523–530
289. Bonow RO, Maurer G, Lee KL, Holly TA, Binkley PF, Desvigne-Nickens P, Drozdz J, Farsky PS, Feldman AM, Doenst T, Michler RE, Berman DS, Nicolau JC, Pellikka PA, Wrobel K, Alotti N, Asch FM, Favaloro LE, She L, Velazquez EJ, Jones RH, Panza JA, Investigators ST. Myocardial viability and survival in ischemic left ventricular dysfunction N Engl J Med 2011;364(17):1617–1625
290. Ling LF, Marwick TH, Flores DR, Jaber WA, Brunken RC, Cerqueira MD, Hachamovitch R. Identification of therapeutic benefit from revascularization in patients with left ventricular systolic dysfunction: inducible ischemia vs. hibernating myocardium. Circ Cardiovasc Imaging 2013;6(3):363–372
291. Di Donato M, Castelvecchio S, Menicanti L. End-systolic volume following surgical ventricular reconstruction impacts survival in patients with ischaemic dilated cardiomyopathy Eur J Heart Fail 2010;12(4):375–381
292. Jones RH, Velazquez EJ, Michler RE, Sopko G, Oh JK, O’Connor CM, Hill JA, Menicanti L, Sadowski Z, Desvigne-Nickens P, Rouleau JL, Lee KL. Coronary bypass surgery with or without surgical ventricular reconstruction. N Engl J Med-2009;360(17):1705–1717
293. Oh JK, Velazquez EJ, Menicanti L, Pohost GM, Bonow RO, Lin G, Hellkamp AS, Ferrazzi P, Wos S, Rao V, Berman D, Bochenek A, Cherniavsky A, Rogowski J, Rouleau JL, Lee KL, Investigators S. Influence of baseline left ventricular function on the clinical outcome of surgical ventricular reconstruction in patients with ischaemic-cardiomyopathy. Eur Heart J 2013;34(1):39–47
294. Michler RE, Rouleau JL, Al-Khalidi HR, Bonow RO, Pellikka PA, Pohost GM, Holly TA, Oh JK, Dagenais F, Milano C, Wrobel K, Pirk J, Ali IS, Jones RH, Velazquez EJ, Lee KL, DiDonato M. Insights from the STICH trial: change in left ventricular size after coronary artery bypass grafting with and without surgical ventricular reconstruction. J Thorac Cardiovasc Surg 2013;146(5):1139–1145 e6
295. Dor V, Civaia F, Alexandrescu C, Sabatier M, Montiglio F. Favorable effects of left ventricular reconstruction in patients excluded from the Surgical Treatments for Ischemic Heart Failure (STICH) trial. J Thorac Cardiovasc Surg 2011;141(4):905– 916, 916 e1–e4
296. Lindholm MG, Kober L, Boesgaard S, Torp-Pedersen C, Aldershvile J, Trandolapril Cardiac Evaluation study g. Cardiogenic shock complicating acute myocardial infarction; prognostic impact of early and late shock development. Eur Heart J 2003;24(3):258–265
297. Katz JN, Stebbins AL, Alexander JH, Reynolds HR, Pieper KS, RuzylloW,Werdan K, Geppert A, Dzavik V, Van de Werf F, Hochman JS, Investigators T. Predictors of 30-day mortality in patients with refractory cardiogenic shock following acutemyocardial infarction despite a patent infarct artery. Am Heart J 2009;158(4):680–687
298. Zeymer U, Vogt A, Zahn R,Weber MA, Tebbe U, Gottwik M, Bonzel T, Senges J, Neuhaus KL, Arbeitsgemeinschaft Leitende Kardiologische K. Predictors of in-hospital mortality in 1333 patients with acute myocardial infarction complicated by cardiogenic shock treated with primary percutaneous coronary intervention (PCI); Results of the primary PCI registry of the Arbeitsgemeinschaft Leitende Kardiologische Krankenhausarzte (ALKK). Eur Heart J 2004;25(4):322–328
299. Dzavik V, Sleeper LA, Cocke TP, Moscucci M, Saucedo J, Hosat S, Jiang X, Slater J, LeJemtel T, Hochman JS, Investigators S. Early revascularization is associated with improved survival in elderly patients with acute myocardial infarction complicated by cardiogenic shock: a report from the SHOCK Trial Registry. Eur Heart J 2003; 24(9):828–837
300. Kantrowitz A, Tjonneland S, Freed PS, Phillips SJ, Butner AN, Sherman JL Jr. Initial clinical experience with intraaortic balloon pumping in cardiogenic shock. JAMA 1968;203(2):113–118
301. Thiele H, Zeymer U, Neumann FJ, Ferenc M, Olbrich HG, Hausleiter J, Richardt G, Hennersdorf M, Empen K, Fuernau G, Desch S, Eitel I, Hambrecht R, Fuhrmann J, Bohm M, Ebelt H, Schneider S, Schuler G,Werdan K, Investigators I-SIT. Intraaortic balloon support for myocardial infarction with cardiogenic shock. N Engl J Med 2012;367(14):1287–1296
302. Thiele H, Zeymer U, Neumann FJ, Ferenc M, Olbrich HG, Hausleiter J, deWaha A, Richardt G, Hennersdorf M, Empen K, Fuernau G, Desch S, Eitel I, Hambrecht R, Lauer B, Bohm M, Ebelt H, Schneider S, Werdan K, Schuler G. Intra-aortic balloon counterpulsation in acute myocardial infarction complicated by cardiogenic shock (IABP-SHOCK II): final 12 month results of a randomised, open-label trial. Lancet 2013;382(9905):1638–1645
303. Burkhoff D, Cohen H, Brunckhorst C, O’NeillWW, TandemHeart Investigators G A randomized multicenter clinical study to evaluate the safety and efficacy of the TandemHeart percutaneous ventricular assist device vs. conventional therapy with intraaortic balloon pumping for treatment of cardiogenic shock. Am Heart J 2006;152(3):469 e1–e8
304. Kar B, Basra SS, Shah NR, Loyalka P. Percutaneous circulatory support in cardiogenic shock: interventional bridge to recovery. Circulation 2012;125(14): 1809–1817
305. Thiele H, Sick P, Boudriot E, Diederich KW, Hambrecht R, Niebauer J, Schuler G Randomized comparison of intra-aortic balloon support with a percutaneous left ventricular assist device in patients with revascularized acute myocardial infarction complicated by cardiogenic shock. Eur Heart J 2005;26(13):1276–1283
306. Seyfarth M, Sibbing D, Bauer I, Frohlich G, Bott-Flugel L, Byrne R, Dirschinger J, Kastrati A, Schomig A. A randomized clinical trial to evaluate the safety and efficacy of a percutaneous left ventricular assist device vs. intra-aortic balloon pumping for treatment of cardiogenic shock caused by myocardial infarction. J Am Coll Cardiol-2008;52(19):1584–1588
307. Cheng JM, den Uil CA, Hoeks SE, van der Ent M, Jewbali LS, van Domburg RT, Serruys PW. Percutaneous left ventricular assist devices vs. intra-aortic balloon pump counterpulsation for treatment of cardiogenic shock: a meta-analysis of controlled trials. Eur Heart J 2009;30(17):2102–2108
308. Kirklin JK, Naftel DC, Kormos RL, Stevenson LW, Pagani FD, Miller MA, Baldwin JT, Young JB. The Fourth INTERMACS Annual Report: 4,000 implants and counting J Heart Lung Transplant 2012;31(2):117–126
309. Kirklin JK, Naftel DC, Kormos RL, Stevenson LW, Pagani FD, Miller MA, Timothy Baldwin J, Young JB. Fifth INTERMACS annual report: risk factor analysis from more than 6,000 mechanical circulatory support patients. J Heart Lung Transplant 2013;32(2):141–156
310. Kirklin JK, Naftel DC, Pagani FD, Kormos RL, Stevenson L, Miller M, Young JB. Longterm mechanical circulatory support (destination therapy): on track to compete with heart transplantation? J Thorac Cardiovasc Surg 2012;144(3):584–603; discussion 597–598
311. Cohn JN, Guiha NH, Broder MI, Limas CJ. Right ventricular infarction. Clinical and hemodynamic features. Am J Cardiol 1974;33(2):209–214
312. Dell’Italia LJ, Starling MR, Crawford MH, Boros BL, Chaudhuri TK, O’Rourke RA Right ventricular infarction: identification by hemodynamic measurements before after volume loading correlation with noninvasive techniques. J Am Coll Cardiol 1984;4(5):931–939
313. Goldstein JA. Pathophysiology and management of right heart ischemia. J Am Coll Cardiol 2002;40(5):841–853
314. Goldstein JA, Barzilai B, Rosamond TL, Eisenberg PR, Jaffe AS. Determinants of hemodynamic compromise with severe right ventricular infarction. Circulation 1990;82(2):359–368
315. Lorell B, Leinbach RC, Pohost GM, Gold HK, Dinsmore RE, Hutter AM Jr., Pastore JO, DesanctisRW. Right ventricular infarction. Clinical diagnosis and differentiation from cardiac tamponade and pericardial constriction. Am J Cardiol 1979; 43(3):465–471
316. Jacobs AK, Leopold JA, Bates E, Mendes LA, Sleeper LA, White H, Davidoff R, Boland J, Modur S, Forman R, Hochman JS. Cardiogenic shock caused by right ventricular infarction: a report from the SHOCK registry. J Am Coll Cardiol 2003;41(8): 1273–1279
317. Hochman JS, Buller CE, Sleeper LA, Boland J, Dzavik V, Sanborn TA, Godfrey E, White HD, Lim J, LeJemtel T. Cardiogenic shock complicating acute myocardial infarction:etiologies, management and outcome: a report from the SHOCK Trial Registry. SHould we emergently revascularize Occluded Coronaries for cardiogenic shocK? J Am Coll Cardiol 2000;36(3 Suppl A):1063–1070
318. Brodie BR, Stuckey TD, Hansen C, Bradshaw BH, Downey WE, Pulsipher MW Comparison of late survival in patients with cardiogenic shock due to right ventricular infarction vs. left ventricular pump failure following primary percutaneous coronary intervention for ST-elevation acute myocardial infarction. Am J Cardiol 2007;99(4):431–435
319. Zeymer U, Neuhaus KL,Wegscheider K, Tebbe U, Molhoek P, Schroder R. Effects of thrombolytic therapy in acute inferior myocardial infarction with or without right ventricular involvement. HIT-4 Trial Group. Hirudin for Improvement of Thrombolysis. J Am Coll Cardiol 1998;32(4):876–881
320. The effects of tissue plasminogen activator, streptokinase, or both on coronary-artery patency, ventricular function, and survival after acute myocardial infarction. The GUSTO Angiographic Investigators. N Engl J Med 1993;329(22): 1615–1622
321. Kinn JW, O’Neill WW, Benzuly KH, Jones DE, Grines CL. Primary angioplasty reduces risk of myocardial rupture compared to thrombolysis for acute myocardial infarction. Cathet Cardiovasc Diagn 1997;42(2):151–157
322. Moreno R, Lopez-Sendon J, Garcia E, Perez de Isla L, Lopez de Sa E, Ortega A, Moreno M, Rubio R, Soriano J, Abeytua M, Garcia-Fernandez MA. Primary angioplasty reduces the risk of left ventricular free wall rupture compared with thrombolysis in patients with acute myocardial infarction. J Am Coll Cardiol 2002;39(4): 598–603
323. Menon V,Webb JG, Hillis LD, Sleeper LA, Abboud R, DzavikV, Slater JN, Forman R, Monrad ES, Talley JD, Hochman JS. Outcome and profile of ventricular septal rupture with cardiogenic shock after myocardial infarction: a report from the SHOCKTrial Registry. SHould we emergently revascularize Occluded Coronaries in cardiogenic shocK? J Am Coll Cardiol 2000;36(3 Suppl A):1110–1116
324. Thiele H, Kaulfersch C, Daehnert I, Schoenauer M, Eitel I, Borger M, Schuler G. Immediate primary transcatheter closure of postinfarction ventricular septal defects Eur Heart J 2009;30(1):81–88
325. Zhu XY, Qin YW, Han YL, Zhang DZ, Wang P, Liu YF, Xu YW, Jing QM, Xu K, Gersh BJ, Wang XZ. Long-term efficacy of transcatheter closure of ventricular septal defect in combination with percutaneous coronary intervention in patients with ventricular septal defect complicating acute myocardial infarction: a multicentre study. EuroIntervention 2013;8(11):1270–1276
326. Assenza GE, McElhinney DB, Valente AM, Pearson DD, Volpe M, Martucci G, Landzberg MJ, Lock JE. Transcatheter closure of post-myocardial infarction ventricular septal rupture. Circ Cardiovasc Interv 2013;6(1):59–67
327. Slater J, Brown RJ, Antonelli TA, Menon V, Boland J, Col J, Dzavik V, Greenberg M, Menegus M, Connery C, Hochman JS. Cardiogenic shock due to cardiac free-wall rupture or tamponade after acute myocardial infarction: a report from theSHOCK Trial Registry. Should weemergently revascularize occluded coronaries for cardiogenic shock? J Am Coll Cardiol 2000;36(3 Suppl A):1117–1122
328. Lopez-Sendon J, Gonzalez A, Lopez de Sa E, Coma-Canella I, Roldan I, Dominguez F, Maqueda I, Martin Jadraque L. Diagnosis of subacute ventricular wall rupture after acute myocardial infarction: sensitivity and specificity of clinical, hemodynamic and echocardiographic criteria. J Am Coll Cardiol 1992;19(6): 1145–1153
329. Menon V, Hochman JS, Stebbins A, Pfisterer M, Col J, Anderson RD, Hasdai D, Holmes DR, Bates ER, Topol EJ, Califf RM, Ohman EM. Lack of progress in cardiogenic shock: lessons from the GUSTO trials. Eur Heart J 2000;21(23):1928–1936
330. Chevalier P, Burri H, Fahrat F, Cucherat M, Jegaden O, Obadia JF, Kirkorian G, Touboul P. Perioperativeoutcome and long-term survival of surgery for acute postinfarction mitral regurgitation. Eur J Cardiothorac Surg 2004;26(2):330–335
331. Hochman JS, Sleeper LA, Webb JG, Dzavik V, Buller CE, Aylward P, Col J, White HD, Investigators S. Early revascularization and long-termsurvival in cardiogenic shock complicating acute myocardial infarction. JAMA 2006;295(21): 2511–2515
332. Sjauw KD, Engstrom AE, VisMM,van der Schaaf RJ, Baan J Jr., KochKT, de Winter RJ, Piek JJ, Tijssen JG, Henriques JP. A systematic review and meta-analysis of intra-aortic balloon pump therapy in ST-elevation myocardial infarction: should we change the guidelines? Eur Heart J 2009;30(4):459–468
333. Buerke M, Prondzinsky R, Lemm H, Dietz S, Buerke U, Ebelt H, Bushnaq H, Silber RE, Werdan K. Intra-aortic balloon counterpulsation in the treatment of infarction-related cardiogenic shock:review of the current evidence. Artif Organs 2012;36(6):505–511
334. Frye RL, August P, BrooksMM,Hardison RM, Kelsey SF, MacGregor JM, Orchard TJ, Chaitman BR, Genuth SM, Goldberg SH, Hlatky MA, Jones TL, Molitch ME, NestoRW, Sako EY, Sobel BE. A randomized trial of therapies for type 2 diabetes and coronary artery disease. N Engl J Med 2009;360(24):2503–2515
335. Shaw LJ, Cerqueira MD, Brooks MM, Althouse AD, Sansing VV, Beller GA, Pop-Busui R, Taillefer R, Chaitman BR, Gibbons RJ, Heo J, Iskandrian AE. Impact of left ventricular function and the extent of ischemia and scar by stress myocardial perfusion imaging on prognosis and therapeutic risk reduction in diabetic patients with coronary artery disease: results from the Bypass Angioplasty Revascularization Investigation 2 Diabetes (BARI 2D) trial. Journal of Nuclear Cardiology 2012; 19(4):658–669
336. Brooks MM, Chaitman BR, Nesto RW, Hardison RM, Feit F, Gersh BJ, Krone RJ, Sako EY, Rogers WJ, Garber AJ, King SB 3rd, Davidson CJ, Ikeno F, Frye RL. Clinical, angiographic risk stratification differential impact on treatment outcomes in the Bypass Angioplasty Revascularization Investigation 2 Diabetes (BARI 2D) trial. Circulation-2012;126(17):2115–2124
337. Wiviott SD, Braunwald E, Angiolillo DJ, Meisel S, Dalby AJ, Verheugt FW, Goodman SG, Corbalan R, Purdy DA, Murphy SA, McCabe CH, Antman EM, Investigators T-T. Greater clinical benefit of more intensive oral antiplatelet-therapy with prasugrel in patients with diabetes mellitus in the trial to assess improvement in therapeutic outcomes by optimizing platelet inhibition with prasugrel-Thrombolysis in Myocardial Infarction 38. Circulation 2008;118(16): 1626–1636
338. O’Donoghue ML, Vaidya A, Afsal R, Alfredsson J, Boden WE, Braunwald E, Cannon CP, Clayton TC, de Winter RJ, Fox KA, Lagerqvist B, McCullough PA, Murphy SA, Spacek R, Swahn E, Windhausen F, Sabatine MS. An invasive or conservative strategy in patients with diabetes mellitus and non-ST-segment elevation acute coronary syndromes: a collaborative meta-analysis of randomized trials J Am Coll Cardiol 2012;60(2):106–111
339. Malmberg K, Yusuf S, Gerstein HC, Brown J, Zhao F, Hunt D, Piegas L, Calvin J, Keltai M, Budaj A. Impact of diabetes on long-term prognosis in patients with unstable angina and non-Q-wave myocardial infarction: results of the OASIS (Organization to Assess Strategies for Ischemic Syndromes) Registry. Circulation 2000; 102(9):1014–1019
340. Mehta SR, Granger CB, EikelboomJW, Bassand JP,Wallentin L, FaxonDP, Peters RJ, Budaj A, Afzal R, Chrolavicius S, Fox KA, Yusuf S. Efficacy and safety of fondaparinux vs. enoxaparin in patients with acute coronary syndromes undergoing percutaneous coronary intervention: results from the OASIS-5 trial. J Am Coll Cardiol-2007;50(18):1742–1751
341. Wallentin L, Becker RC, Budaj A, Cannon CP, Emanuelsson H, Held C, Horrow J, Husted S, James S, Katus H, MahaffeyKW, Scirica BM, Skene A, Steg PG, Storey RF, Harrington RA, Freij A, Thorsen M. Ticagrelor vs. clopidogrel in patients with acute coronary syndromes. N Engl J Med 2009;361(11):1045–1057
342. Lagerqvist B, Husted S, Kontny F, Stahle E, Swahn E,Wallentin L, Fast Revascularisation during InStability in Coronary artery disease I. 5-year outcomes in the FRISC-II randomised trial of an invasive vs. a non-invasive strategy in non-ST-elevation acute coronary syndrome: a follow-up study. Lancet 2006;368(9540):998–1004
343. Damman P, Hirsch A, Windhausen F, Tijssen JG, de Winter RJ. 5-year clinical outcomes in the ICTUS (Invasive vs. Conservative Treatment in Unstable coronary Syndromes) trial a randomized comparison of an early invasive vs. selective invasive management in patients with non-ST-segment elevation acute coronary syndrome J Am Coll Cardiol 2010;55(9):858–864
344. Abdallah MS,Wang K, Magnuson EA, Spertus JA, Farkouh ME, Fuster V, Cohen DJ, Investigators FT. Quality of life after PCI vs.CABG among patients with diabetes and multivessel coronary artery disease: a randomized clinical trial. JAMA 2013;310(15): 1581–1590
345. SerruysPW, Farooq V. Revascularization strategies in patients with diabetes.NEngl J Med 2013;368(15):1454–1455
346. Kappetein AP, Head SJ, Morice MC, Banning AP, Serruys PW, Mohr FW, Dawkins KD, Mack MJ, Investigators S. Treatment of complex coronary artery disease in patients with diabetes: 5-year results comparing outcomes of bypass-surgery and percutaneous coronary intervention in the SYNTAX trial. Eur J Cardiothorac Surg 2013;43(5):1006–1013
347. Kapur A, Hall RJ, Malik IS, QureshiAC, Butts J, de Belder M, Baumbach A, Angelini G, de Belder A, Oldroyd KG, Flather M, Roughton M, Nihoyannopoulos P, Bagger JP, Morgan K, Beatt KJ. Randomized comparison of percutaneous coronary intervention with coronary artery bypass grafting in diabetic patients. 1-year results of the CARDia (Coronary Artery Revascularization in Diabetes) trial. J Am Coll Cardiol 2010;55(5):432–440
348. Kamalesh M, Sharp TG, Tang XC, Shunk K,Ward HB,Walsh J, King S 3rd, Colling C, Moritz T, Stroupe K, Reda D. Percutaneous coronary intervention vs. coronary bypass surgery in United States veterans with diabetes. J Am Coll Cardiol 2013; 61(8):808–816
349. Verma S, Farkouh ME, Yanagawa B, Fitchett DH, AhsanMR, Ruel M, Sud S, Gupta M, Singh S, Gupta N, Cheema AN, Leiter LA, FedakPW, Teoh H, Latter DA, Fuster V, Friedrich JO. Comparison of coronary artery bypass surgery and percutaneous coronary interventions in patients with diabetes: a meta-analysis of randomised controlled trials. Lancet Diabetes & Endocrinology 2013;1(4):317–328
350. Hakeem A, Garg N, Bhatti S, Rajpurohit N, Ahmed Z, Uretsky BF. Effectiveness of percutaneous coronary intervention with drug-eluting stents compared with bypass surgery in diabetics with multivessel coronary disease: comprehensive systematic reviewand meta-analysis of randomized clinical data. JAmHeart Assoc 2013; 2(4):e000354
351. Stettler C, Allemann S,Wandel S, Kastrati A, Morice MC, Schomig A, Pfisterer ME, StoneGW, Leon MB, de Lezo JS, Goy JJ, Park SJ, Sabate M, Suttorp MJ, Kelbaek H, Spaulding C, Menichelli M, Vermeersch P, Dirksen MT, Cervinka P, De Carlo M, Erglis A, Chechi T, Ortolani P, Schalij MJ, Diem P, Meier B, Windecker S, Juni P Drug eluting and bare metal stents in people with and without diabetes: collaborative network meta-analysis. BMJ 2008;337:a1331
352. Bangalore S, Kumar S, Fusaro M, Amoroso N, Kirtane AJ, Byrne RA, Williams DO, Slater J, Cutlip DE, Feit F. Outcomes with various drug eluting or bare metal stents in patients with diabetes mellitus: mixed treatment comparison analysis of 22,844 patient years of follow-up from randomised trials. BMJ 2012;345:e5170
353. TaggartDP, Altman DG, Gray AM, Lees B, Nugara F, Yu LM, Campbell H, Flather M Randomized trial to compare bilateral vs. single internal mammary coronary artery bypass grafting: 1-year results of the Arterial Revascularisation Trial (ART). Eur Heart J 2010;31(20):2470–2481
354. Puskas JD, Sadiq A, Vassiliades TA, Kilgo PD, Lattouf OM. Bilateral internal thoracic artery grafting is associated with significantly improved long-term survival, even among diabetic patients. Annals of Thoracic Surgery 2012;94(3):710–715;discussion 715–716
355. Locker C, Schaff HV, Dearani JA, Joyce LD, Park SJ, Burkhart HM, Suri RM, Greason KL, Stulak JM, Li Z, Daly RC. Multiple arterial grafts improve late survival of patients undergoing coronary artery bypass graft surgery: analysis of 8622 patients with multivessel disease. Circulation 2012;126(9):1023–1030
356. Schwann TA, Al-Shaar L, Engoren M, Habib RH. Late effects of radial artery vs.saphenous vein grafting for multivessel coronary bypass surgery in diabetics: a propensity-matched analysis. Eur J Cardiothorac Surg 2013;44(4):701–710
357. Giugliano RP, White JA, Bode C, Armstrong PW, Montalescot G, Lewis BS, van ’t Hof A, Berdan LG, Lee KL, Strony JT, Hildemann S, Veltri E, Van de Werf F, Braunwald E, Harrington RA, Califf RM, Newby LK, Investigators EA. Early vs delayed, provisional eptifibatide in acute coronary syndromes. N Engl J Med 2009;360(21):2176–2190
358. Mellbin LG, Malmberg K, Norhammar A,Wedel H, Ryden L. The impact of glucose lowering treatment on long-term prognosis in patients with type 2 diabetes and myocardial infarction: a report from the DIGAMI 2 trial. Eur Heart J 2008;29(2): 166–176
359. Zeller M, Danchin N, Simon D, Vahanian A, Lorgis L, Cottin Y, Berland J, Gueret P, Wyart P, Deturck R, Tabone X, Machecourt J, Leclercq F, Drouet E, Mulak G, Bataille V, Cambou JP, Ferrieres J, Simon T. Impact of type of preadmission sulfonylureas on mortality and cardiovascular outcomes in diabetic patients with acute myocardial infarction. The Journal of Clinical Endocrinology and Metabolism 2010; 95(11):4993–5002
360. Takagi T, Okura H, Kobayashi Y, Kataoka T, Taguchi H, Toda I, Tamita K, Yamamuro A, Sakanoue Y, Ito A, Yanagi S, Shimeno K, Waseda K, Yamasaki M, Fitzgerald PJ, Ikeno F, Honda Y, Yoshiyama M, YoshikawaJ.Aprospective, multicenter, randomized trial to assess efficacy of pioglitazone on in-stent neointimal suppression in type 2 diabetes: POPPS (Prevention of In-Stent Neointimal Proliferation by Pioglitazone Study). JACC Cardiovascular Interventions 2009;2(6):-524–531
361. Bhamidipati CM, LaPar DJ, Stukenborg GJ, Morrison CC, Kern JA, Kron IL, Ailawadi G. Superiority of moderate control of hyperglycemia to tight control in patients undergoing coronary artery bypass grafting. J Thorac Cardiovasc Surg-2011;141(2):543–551
362. Scirica BM, Bhatt DL, Braunwald E, Steg PG, Davidson J, Hirshberg B, Ohman P, Frederich R, Wiviott SD, Hoffman EB, Cavender MA, Udell JA, Desai NR, Mosenzon O, McGuire DK, Ray KK, Leiter LA, Raz I. Saxagliptin and cardiovascular outcomes in patients with type 2 diabetes mellitus. N Engl J Med 2013;369(14): 1317–1326
363. Timmer JR, Ottervanger JP, de Boer MJ, Boersma E, Grines CL,Westerhout CM, Simes RJ, Granger CB, Zijlstra F, Primary Coronary Angioplasty vs.Thrombolysis-2 Trialists Collaborators G. Primary percutaneous coronary intervention compared with fibrinolysis for myocardial infarction in diabetes mellitus: results from the Primary Coronary Angioplasty vs. Thrombolysis-2 trial. Arch Intern Med 2007; 167(13):1353–1359
364. Cannon CP, Weintraub WS, Demopoulos LA, Vicari R, Frey MJ, Lakkis N, Neumann FJ, Robertson DH, DeLucca PT, DiBattiste PM, Gibson CM, Braunwald E, Investigators TTiMI. Comparison of early invasive and conservative-strategies in patients with unstable coronary syndromes treated with the glycoprotein IIb/IIIa inhibitor tirofiban. N Engl J Med 2001;344(25):1879–1887
365. Roffi M, Topol EJ. Percutaneous coronary intervention in diabetic patients with non-ST-segment elevation acute coronary syndromes. Eur Heart J 2004;25(3): 190–198
366. Lindahl B, Toss H, Siegbahn A, Venge P,Wallentin L. Markers of myocardial damage and inflammation in relation to long-term mortality in unstable coronary artery disease. FRISC Study Group. Fragmin during Instability in Coronary Artery Disease. N Engl J Med 2000;343(16):1139–1147
367. Lima EG, Hueb W, Garcia RM, Pereira AC, Soares PR, Favarato D, Garzillo CL, D’Oliveira Vieira R, Rezende PC, Takiuti M, Girardi P, Hueb AC, Ramires JA, Kalil Filho R. Impact of diabetes on 10-year outcomes of patients with multivessel coronary artery disease in the Medicine, Angioplasty, or Surgery Study II (MASS II) trial Am Heart J 2013;166(2):250–257
368. Dorman MJ, Kurlansky PA, Traad EA, Galbut DL, Zucker M, Ebra G. Bilateral internal mammary artery grafting enhances survival in diabetic patients: a 30-year followup of propensity score-matched cohorts. Circulation 2012;126(25):2935–2942
369. Chertow GM, Normand SL, McNeil BJ. "Renalism": inappropriately low rates of coronary angiography in elderly individuals with renal insufficiency. J Am Soc Nephrol 2004;15(9):2462–2468
370. Charytan D, Mauri L, Agarwal A, Servoss S, Scirica B, Kuntz RE. The use of invasive cardiac procedures after acute myocardial infarction in long-term dialysis patients Am Heart J 2006;152(3):558–564
371. Szummer K, Lundman P, Jacobson SH, Schon S, Lindback J, Stenestrand U, Wallentin L, Jernberg T. Influence of renal function on the effects of early revascularization in non-ST-elevation myocardial infarction: data from the SwedishWeb- System for Enhancement and Development of Evidence-Based Care in Heart Disease Evaluated According to Recommended Therapies (SWEDEHEART). Circulation 2009;120(10):851–858
372. Hemmelgarn BR, Southern D, Culleton BF, Mitchell LB, Knudtson ML, GhaliWA Survival after coronary revascularization among patients with kidney disease. Circulation 2004;110(14):1890–1895
373. Reddan DN, Szczech LA, Tuttle RH, Shaw LK, Jones RH, Schwab SJ, Smith MS, Califf RM, Mark DB, OwenWFJr. Chronic kidney disease, mortality, and treatment strategies among patients with clinically significant coronary artery disease. JAmSoc Nephrol 2003;14(9):2373–2380
374. Huang HD, Alam M, Hamzeh I, Virani S, Deswal A, Aguilar D, Rogers P, Kougias P, Birnbaum Y, Paniagua D, Kar B, Ballantyne C, Bozkurt B, Jneid H. Patients with severe chronic kidney disease benefit from early revascularization after acute coronary syndrome. Int J Cardiol 2013;168(4):3741–3746
375. Tsai TT, Messenger JC, Brennan JM, Patel UD, Dai D, Piana RN, Anstrom KJ, Eisenstein EL, Dokholyan RS, Peterson ED, Douglas PS. Safety and efficacy of drug-eluting stents in older patients with chronic kidney disease: a report from the linked CathPCI Registry-CMS claims database. J Am Coll Cardiol 2011;58(18): 1859–1869
376. Shenoy C, Boura J, Orshaw P, Harjai KJ. Drug-eluting stents in patients with chronic kidney disease: a prospective registry study. PLoS One 2010;5(11):e15070
377. Ashrith G, LeeVV, ElaydaMA, ReulRM, Wilson JM. Short- and long-term outcomes of coronary artery bypass grafting or drug-eluting stent implantation for multivessel coronary artery disease in patients with chronic kidney disease. Am J Cardiol 2010; 106(3):348–353
378. Charytan DM,Li S, Liu J, Herzog CA. Risks of death and end-stage renal disease after surgical compared with percutaneous coronary revascularization in elderly patients with chronic kidney disease. Circulation 2012;126(11 Suppl 1):S164–9
379. Ix JH, Mercado N, Shlipak MG, Lemos PA, Boersma E, LindeboomW, O’NeillWW, WijnsW, SerruysPW. Association of chronic kidney disease with clinical outcomes after coronary revascularization: the Arterial Revascularization Therapies Study (ARTS). Am Heart J 2005;149(3):512–519
380. Chawla LS, Zhao Y, Lough FC, Schroeder E, Seneff MG, Brennan JM. Off-pump vs on-pump coronary artery bypass grafting outcomes stratified by preoperative renal function. J Am Soc Nephrol 2012;23(8):1389–1397
381. Charytan DM, Yang SS, McGurk S, Rawn J. Long and short-term outcomes following coronary artery bypass grafting in patients with and without chronic kidney disease. Nephrol Dial Transplant 2010;25(11):3654–3663
382. Chang TI, Shilane D, Kazi DS, Montez-Rath ME, Hlatky MA,WinkelmayerWC.Multivessel coronary artery bypass grafting vs. percutaneous coronary intervention in ESRD. J Am Soc Nephrol 2012;23(12):2042–2049
383. Herzog CA, Ma JZ, Collins AJ. Long-term outcome of renal transplant recipients in the United States after coronary revascularization procedures. Circulation 2004; 109(23):2866–2871
384. Brar SS, Shen AY, Jorgensen MB, Kotlewski A, Aharonian VJ, Desai N, Ree M, Shah AI, Burchette RJ. Sodium bicarbonate vs.sodium chloride for the prevention of contrast medium-induced nephropathy in patients undergoing coronary angiography: a randomized trial. JAMA 2008;300(9):1038–1046
385. Merten GJ, Burgess WP, Gray LV, Holleman JH, Roush TS, Kowalchuk GJ, Bersin RM, Van Moore A, Simonton CA 3rd, Rittase RA, Norton HJ, Kennedy TP. Prevention of contrast-induced nephropathy with sodium bicarbonate: a randomized controlled trial. JAMA 2004;291(19):2328–2334
386. Li Y, Liu Y, Fu L, Mei C, Dai B. Efficacy of short-term high-dose statin in preventing contrast-induced nephropathy: a meta-analysis of seven randomized controlled trials. PLoS One 2012;7(4):e34450
387. Sadat U, Usman A, Gillard JH, Boyle JR. Does ascorbic acid protect against contrast-induced acute kidney injury in patients undergoing coronary angiography: a systematic review with meta-analysis of randomized, controlled trials. J Am Coll Cardiol 2013;62(23):2167–2175
388. Marenzi G, Assanelli E, Campodonico J, Lauri G, Marana I,DeMetrio M,Moltrasio M, Grazi M, Rubino M, Veglia F, Fabbiocchi F, Bartorelli AL. Contrast volume during primary percutaneous coronary intervention and subsequent contrast-induced nephropathy and mortality. Ann Intern Med 2009;150(3):170–177
389. Laskey WK, Jenkins C, Selzer F, Marroquin OC, Wilensky RL, Glaser R, Cohen HA, Holmes DR Jr. Volume-to-creatinine clearance ratio: a pharmacokinetically based risk factor for prediction of early creatinine increase after percutaneous coronary intervention. J Am Coll Cardiol 2007;50(7):584–590
390. Fox CS, Muntner P, Chen AY, Alexander KP, Roe MT, Cannon CP, Saucedo JF, Kontos MC, Wiviott SD. Use of evidence-based therapies in short-term outcomes of ST-segment elevation myocardial infarction and non-ST-segment elevation myocardial infarction in patients with chronic kidney disease: a report from the National Cardiovascular Data Acute Coronary Treatment and Intervention Outcomes Network registry. Circulation 2010;121(3):357–365
391. Yan LQ, Guo LJ, Zhang FC, GaoW. The relationship between kidney function and angiographically-derived SYNTAX score. Can J Cardiol 2011;27(6):768–772
392. Zheng H, Xue S, Lian F, Huang RT,HuZL,Wang YY. Meta-analysis of clinical studies comparing coronary artery bypass grafting with percutaneous coronary intervention in patients with end-stage renal disease. Eur J Cardiothorac Surg 2013;43(3): 459–467
393. Del Duca D, Iqbal S, Rahme E, Goldberg P, de Varennes B. Renal failure after cardiac surgery: timing of cardiac catheterization and other perioperative risk factors. Ann Thorac Surg 2007;84(4):1264–1271
394. Ranucci M, Ballotta A, Kunkl A, De Benedetti D, Kandil H, Conti D, Mollichelli N, Bossone E, Mehta RH. Influence of the timing of cardiac catheterization and the amount of contrast media on acute renal failure after cardiac surgery. Am J Cardiol 2008;101(8):1112–1118
395. Medalion B, Cohen H, Assali A, Vaknin Assa H, Farkash A, Snir E, Sharoni E, Biderman P, Milo G, Battler A, Kornowski R, Porat E. The effect of cardiac angiography timing, contrast media dose, and preoperative renal function on acute renal failure after coronary artery bypass grafting. J Thorac Cardiovasc Surg;139(6): 1539–1544
396. Sajja LR, Mannam G, Chakravarthi RM, Sompalli S, Naidu SK, Somaraju B, Penumatsa RR. Coronary artery bypass grafting with or without cardiopulmonary bypass in patients with preoperative non-dialysis dependent renal insufficiency: a randomized study. J Thorac Cardiovasc Surg 2007;133(2):378–388
397. Maioli M, Toso A, Leoncini M, Micheletti C, Bellandi F. Effects of hydration in contrast-induced acute kidney injury after primary angioplasty: a randomized, controlled trial. Circ Cardiovasc Interv 2011;4(5):456–462
398. Aspelin P, Aubry P, Fransson SG, Strasser R, Willenbrock R, Berg KJ. Nephrotoxic effects in high-risk patients undergoing angiography. N Engl J Med 2003;348(6): 491–499
399. Jo SH, Youn TJ, Koo BK, Park JS, Kang HJ, Cho YS, Chung WY, Joo GW, Chae IH, Choi DJ, Oh BH, Lee MM, Park YB, Kim HS. Renal toxicity evaluation and comparison between visipaque (iodixanol) and hexabrix (ioxaglate) in patients with renal insufficiency undergoing coronary angiography: the RECOVER study: a randomized controlled trial. J Am Coll Cardiol 2006;48(5):924–930
400. Solomon RJ, Natarajan MK, Doucet S, Sharma SK, Staniloae CS, Katholi RE, Gelormini JL, Labinaz M, Moreyra AE. Cardiac Angiography in Renally Impaired Patients (CARE) study: a randomized double-blind trial of contrast-induced nephropathy in patients with chronic kidney disease. Circulation 2007;115(25): 3189–3196
401. Leoncini M, Toso A, Maioli M, Tropeano F, Villani S, Bellandi F. Early high-dose rosuvastatin for Contrast-Induced Nephropathy Prevention in Acute Coronary Syndrome Results from Protective effect of Rosuvastatin and Antiplatelet Therapy On contrast-induced acute kidney injury and myocardial damage in patients with Acute Coronary Syndrome (PRATO-ACS Study). J Am Coll Cardiol 2014;63(1): 71–79
402. McCullough PA, Bertrand ME, Brinker JA, Stacul F. A meta-analysis of the renal safety of isosmolar iodixanol compared with low-osmolar contrast media. J Am Coll Cardiol 2006;48(4):692–699
403. Briguori C, Visconti G, Focaccio A, Airoldi F, Valgimigli M, Sangiorgi GM, Golia B, Ricciardelli B, Condorelli G. Renal Insufficiency After Contrast Media Administration Trial II (REMEDIAL II): RenalGuard System in high-risk patients for contrast-induced acute kidney injury. Circulation 2011;124(11):1260–1269
404. Marenzi G, Ferrari C, Marana I, Assanelli E, De Metrio M, Teruzzi G, Veglia F, Fabbiocchi F, Montorsi P, Bartorelli AL. Prevention of contrast nephropathy by furosemide with matched hydration: the MYTHOS (Induced Diuresis With Matched Hydration Compared to Standard Hydration for Contrast Induced Nephropathy Prevention) trial. JACC Cardiovasc Interv 2012;5(1):90–97
405. ACT-Investigators. Acetylcysteine for prevention of renal outcomes in patients undergoing coronary and peripheral vascular angiography: main results from the randomized Acetylcysteine for Contrast-induced nephropathy Trial (ACT). Circulation 2011;124(11):1250–1259
406. Klima T, Christ A, Marana I, Kalbermatter S, Uthoff H, Burri E, Hartwiger S, Schindler C, Breidthardt T, Marenzi G, Mueller C. Sodium chloride vs. sodium bicarbonate for the prevention of contrast medium-induced nephropathy: a randomized controlled trial. Eur Heart J 2012;33(16):2071–2079
407. Marenzi G, Marana I, Lauri G, Assanelli E, Grazi M, Campodonico J, Trabattoni D, Fabbiocchi F, Montorsi P, Bartorelli AL. The prevention of radiocontrastagent- induced nephropathy by hemofiltration. N Engl J Med 2003;349(14):-1333–1340
408. Marenzi G, Lauri G, Campodonico J, Marana I, Assanelli E, De Metrio M, Grazi M, Veglia F, Fabbiocchi F, Montorsi P, Bartorelli AL. Comparison of two hemofiltration protocols for prevention of contrast-induced nephropathy in high-risk patients.Am J Med 2006;119(2):155–162
409. Cruz DN, Goh CY, Marenzi G, Corradi V, Ronco C, Perazella MA. Renal replacement therapies for prevention of radiocontrast-induced nephropathy: a systematic review. Am J Med 2012;125(1):p66–78, e3
410. Vogt B, Ferrari P, Schonholzer C, Marti HP, Mohaupt M, Wiederkehr M, Cereghetti C, Serra A, Huynh-Do U, Uehlinger D, Frey FJ. Prophylactic hemodialysis after radiocontrast media in patients with renal insufficiency is potentially-harmful. Am J Med 2001;111(9):692–698
411. Vahanian A, Alfieri O, Andreotti F, Antunes MJ, Baron-Esquivias G, Baumgartner H, Borger MA, Carrel TP, De Bonis M, Evangelista A, Falk V, Iung B, Lancellotti P, Pierard L, Price S, Schafers HJ, Schuler G, Stepinska J, Swedberg K, Takkenberg J, Von Oppell UO, Windecker S, Zamorano JL, Zembala M. Guidelines on the management of valvular heart disease (version 2012). Eur Heart J 2012;33(19): 2451–2496
412. Czer LS, Gray RJ, Stewart ME, De Robertis M, Chaux A, Matloff JM. Reduction in sudden late death by concomitant revascularization with aortic valve replacement J Thorac Cardiovasc Surg 1988;95(3):390–401
413. Iung B, Drissi MF, Michel PL, de Pamphilis O, Tsezana R, Cormier B, Vahanian A, Acar J. Prognosis of valve replacement for aortic stenosis with or without coexisting coronary heart disease: a comparative study. J Heart Valve Dis 1993;2(4):430–439
414. Lund O, Nielsen TT, Pilegaard HK, Magnussen K, Knudsen MA. The influence of coronary artery disease and bypass grafting on early and late survival after valve replacement for aortic stenosis. J Thorac Cardiovasc Surg 1990;100(3):327–337
415. Mullany CJ, Elveback LR, Frye RL, Pluth JR, Edwards WD, Orszulak TA, Nassef LA Jr., Riner RE, Danielson GK. Coronary artery disease and its management: influence on survival in patients undergoing aortic valve replacement. J Am Coll Cardiol 1987; 10(1):66–72
416. Hannan EL, Wu C, Bennett EV, Carlson RE, Culliford AT, Gold JP, Higgins RS, Smith CR, Jones RH. Risk index for predicting in-hospital mortality for cardiac valve surgery. Ann Thorac Surg 2007;83(3):921–929
417. van Gameren M, Kappetein AP, Steyerberg EW, Venema AC, Berenschot EA, Hannan EL, Bogers AJ, Takkenberg JJ. Do we need separate risk stratification models for hospital mortality after heart valve surgery? Ann Thorac Surg 2008;-85(3):921–930
418. Hamm CW, Mollmann H, Holzhey D, Beckmann A, Veit C, Figulla HR, Cremer J, Kuck KH, Lange R, Zahn R, Sack S, Schuler G,Walther T, Beyersdorf F, Bohm M, Heusch G, Funkat AK, Meinertz T, Neumann T, Papoutsis K, Schneider S, Welz A, Mohr FW. The German Aortic Valve Registry (GARY): in-hospital outcome. Eur Heart J 2014;35:1588–1598
419. Beach JM, MihaljevicT, SvenssonLG, Rajeswaran J,Marwick T, GriffinB, Johnston DR, Sabik JF 3rd, Blackstone EH. Coronary artery disease outcomes of aortic valve replacement for severe aortic stenosis. J AmColl Cardiol 2013;61(8):837–848
420. D’Ascenzo F, Conrotto F, Giordana F, Moretti C, D’Amico M, Salizzoni S, OmedeP, La Torre M, Thomas M, Khawaja Z, Hildick-Smith D, Ussia G, Barbanti M, Tamburino C, Webb J, Schnabel RB, Seiffert M, Wilde S, Treede H,-Gasparetto V, Napodano M, Tarantini G, Presbitero P, Mennuni M, Rossi ML, Gasparini M, Biondi Zoccai G, Lupo M, Rinaldi M, Gaita F, Marra S. Mid-term prognostic value of coronary artery disease in patients undergoing transcatheter aortic valve implantation: A meta-analysis of adjusted observational results. Int J Cardiol 2013;168(3):2528–2532
421. Stefanini GG, Stortecky S, Cao D et al. Coronary artery disease severity and aortic stenosis: clinical outcomes according to SYNTAX-score in patients undergoing transcatheter aortic valve implantation. Eur Heart J 2014. Published online 28 March 2014; doi:1093/eurheartj/ehu074
422. Wenaweser P, Pilgrim T, Guerios E, Stortecky S, Huber C, Khattab AA, Kadner A, Buellesfeld L, Gloekler S, Meier B, CarrelT, Windecker S. Impact of coronary artery disease and percutaneous coronary intervention on outcomes in patients with severe aortic stenosis undergoing transcatheter aortic valve implantation. EuroIntervention 2011;7(5):541–548
423. Abdel-Wahab M, Mostafa AE, Geist V, Stocker B, Gordian K, Merten C, Richardt D, Toelg R, Richardt G. Comparison of outcomes in patients having isolated transcatheter aortic valve implantation vs. combined with preprocedural percutaneous coronary intervention. Am J Cardiol 2012;109(4):581–586
424. Conradi L, Seiffert M, Franzen O, Baldus S, Schirmer J, Meinertz T, Reichenspurner H, Treede H. First experience with transcatheter aortic valve implantation and concomitant percutaneous coronary intervention. Clin Res Cardiol-2011;100(4):311–316
425. Van Mieghem NM, van der Boon RM, Faqiri E, Diletti R, Schultz C, van Geuns RJ, SerruysPW, Kappetein AP, van Domburg RT, de Jaegere PP. Complete revascularization is not a prerequisite for success in current transcatheter aortic valve implantation practice. JACC Cardiovasc Interv 2013;6(8):867–875
426. Gautier M, Pepin M, Himbert D, Ducrocq G, Iung B, Dilly MP, Attias D, Nataf P, Vahanian A. Impact of coronary artery disease on indications for transcatheter aortic valve implantation and on procedural outcomes. EuroIntervention 2011; 7(5):549–555
427. Pasic M, Unbehaun A, DrewsT, Hetzer R. Latewound healing problems after use of BioGlue for apical hemostasis during transapical aortic valve implantation. Interact Cardiovasc Thorac Surg 2011;13(5):532–534
428. Pasic M, Dreysse S, Unbehaun A, Buz S, Drews T, Klein C, D’Ancona G, Hetzer R Combined elective percutaneous coronary intervention and transapical transcatheter aortic valve implantation. Interact Cardiovasc Thorac Surg 2012;14(4):463–468
429. Goel SS, Ige M, Tuzcu EM, Ellis SG, Stewart WJ, Svensson LG, LytleBW, Kapadia SR Severe aortic stenosis and coronary artery disease:implications for management in the transcatheter aortic valve replacement era: a comprehensive review. J Am Coll Cardiol 2013;62(1):1–10
430. Byrne JG, Leacche M, Vaughan DE, Zhao DX. Hybrid cardiovascular procedures JACC Cardiovasc Interv 2008;1(5):459–468
431. Deja MA, Grayburn PA, Sun B, Rao V, She L, Krejca M, Jain AR, Leng Chua Y, Daly R, Senni M, Mokrzycki K, Menicanti L, Oh JK, Michler R, Wrobel K, Lamy A, Velazquez EJ, Lee KL, Jones RH. Influence of mitral regurgitation repair on survival in the surgical treatment for ischemic heart failure trial. Circulation 2012;125(21): 2639–2648
432. Chan KM, Punjabi PP, Flather M,Wage R, Symmonds K, Roussin I, Rahman-Haley S, Pennell DJ, Kilner PJ, Dreyfus GD, Pepper JR, Investigators R. Coronary artery bypass surgery with or without mitral valve annuloplasty in moderate functional ischemic mitral regurgitation: final results of the Randomized Ischemic Mitral Evaluation (RIME) trial. Circulation 2012;126(21):2502–2510
433. Aboyans V, Lacroix P. Indications for carotid screening in patients with coronary artery disease. Presse Med 2009;38(6):977–986
434. Chaturvedi S, Bruno A, Feasby T, Holloway R, Benavente O, Cohen SN, Cote R, Hess D, Saver J, Spence JD, Stern B, Wilterdink J. Carotid endarterectomy:an evidence-based review: report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology. Neurology 2005;65(6): 794–801
435. LiY,Walicki D, Mathiesen C, Jenny D, Li Q, IsayevY, Reed JF 3rd, Castaldo JE. Strokes after cardiac surgery and relationship to carotid stenosis. Arch Neurol 2009;66(9): 1091–1096
436. Tarakji KG, Sabik JF 3rd, Bhudia SK, Batizy LH, Blackstone EH. Temporal onset, risk factors, and outcomes associated with stroke after coronary artery bypass grafting JAMA 2011;305(4):381–390
437. Ratib K, Mamas MA, Routledge HC, Ludman PF, Fraser D, Nolan J. Influence of access site choice on incidence of neurologic complications after percutaneous coronary intervention. Am Heart J 2013;165(3):317–324
438. Wardlaw JM, Chappell FM, Stevenson M, De Nigris E, Thomas S, Gillard J, Berry E, Young G, Rothwell P, Roditi G, Gough M, Brennan A, Bamford J, Best J. Accurate, practical and cost-effective assessment of carotid stenosis in the UK. Health Technol Assess 2006;10(30):iii–iv, ix–x, 1–182
439. Zingone B, Rauber E, Gatti G, Pappalardo A, Benussi B, Dreas L, Lattuada L. The impact of epiaortic ultrasonographic scanning on the risk of perioperative stroke Eur J Cardiothorac Surg 2006;29(5):720–728
440. Marui A, Okabayashi H, KomiyaT, Tanaka S, Furukawa Y, Kita T, KimuraT, Sakata R Benefits of off-pump coronary artery bypass grafting in high-risk patients. Circulation 2012;126(11 Suppl 1):S151–157
441. Lamy A, Devereaux PJ, Prabhakaran D, Taggart DP, Hu S, Paolasso E, Straka Z, Piegas LS, Akar AR, Jain AR, Noiseux N, Padmanabhan C, Bahamondes JC, Novick RJ, Vaijyanath P, Reddy S, Tao L, Olavegogeascoechea PA, Airan B, Sulling TA, Whitlock RP, Ou Y, Ng J, Chrolavicius S, Yusuf S. Off-pump or on-pump coronary-artery bypass grafting at 30 days. N Engl J Med 2012;366(16): 1489–1497
442. Emmert MY, Seifert B, Wilhelm M, Grunenfelder J, Falk V, Salzberg SP. Aortic no-touch technique makes the difference in off-pump coronary artery bypass grafting J Thorac Cardiovasc Surg 2011;142(6):1499–1506
443. Misfeld M, Brereton RJ, Sweetman EA, Doig GS. Neurologic complications after off-pump coronary artery bypass grafting with and without aortic manipulation: meta-analysis of 11,398 cases from 8 studies. J Thorac Cardiovasc Surg 2011; 142(2):e11–e17
444. Bouchard D, Carrier M, Demers P, Cartier R, Pellerin M, Perrault LP, Lambert J Statin in combination with beta-blocker therapy reduces postoperative stroke after coronary artery bypass graft surgery. Ann Thorac Surg 2011;91(3):654–659
445. Ederle J, Featherstone RL, Brown MM. Randomized controlled trials comparing endarterectomy and endovascular treatment for carotid artery stenosis: a Cochrane systematic review. Stroke 2009;40(4):1373–1380
446. Ederle J, Dobson J, Featherstone RL, Bonati LH, van der Worp HB, de Borst GJ, Lo TH, Gaines P, Dorman PJ, Macdonald S, Lyrer PA, Hendriks JM, McCollum C, Nederkoorn PJ, Brown MM. Carotid artery stenting compared with endarterectomy in patients with symptomatic carotid stenosis (International Carotid Stenting Study): an interim analysis of a randomised controlled trial. Lancet 2010;375(9719): 985–997
447. Brott TG, Hobson RW 2nd, Howard G, Roubin GS, Clark WM, Brooks W, Mackey A, Hill MD, Leimgruber PP, Sheffet AJ, Howard VJ, Moore WS, Voeks JH, Hopkins LN, Cutlip DE, Cohen DJ, Popma JJ, Ferguson RD, Cohen SN,-Blackshear JL, Silver FL, Mohr JP, Lal BK, Meschia JF. Stenting vs. endarterectomy for treatment of carotid-artery stenosis. N Engl J Med 2010;363(1):11–23
448. Bonati LH, Lyrer P, Ederle J, Featherstone R, BrownMM.Percutaneous transluminal balloon angioplasty and stenting for carotid artery stenosis. Cochrane Database Syst Rev 2012;9:CD000515
449. Shishehbor MH, Venkatachalam S, Sun Z, Rajeswaran J, Kapadia SR, Bajzer C, Gornik HL, Gray BH, Bartholomew JR, Clair DG, Sabik JF 3rd, Blackstone EH. A Direct Comparison of Early and Late Outcomes with Three Approaches to Carotid Revascularization and Open Heart Surgery. J Am Coll Cardiol 2013; 62(21):1948–1956
450. Nallamothu BK, Gurm HS, Ting HH, Goodney PP, Rogers MA, Curtis JP, Dimick JB, Bates ER, Krumholz HM, Birkmeyer JD. Operator experience and carotid stenting outcomes in Medicare beneficiaries. JAMA 2011;306(12):1338–1343
451. Tendera M, Aboyans V, Bartelink ML, Baumgartner I, Clement D, Collet JP, Cremonesi A, De Carlo M, Erbel R, Fowkes FG, Heras M, Kownator S, Minar E, Ostergren J, Poldermans D, Riambau V, Roffi M, Rother J, Sievert H, van-Sambeek M, Zeller T. ESC Guidelines on the diagnosis and treatment of peripheral artery diseases: Document covering atherosclerotic disease of extracranial carotid and vertebral, mesenteric, renal, upper and lower extremity arteries: the Task Force on the Diagnosis and Treatment of Peripheral Artery Diseases of the European Society of Cardiology (ESC). Eur Heart J 2011;32(22):2851–2906
452. Ziada KM, Yadav JS, Mukherjee D, Lauer MS, Bhatt DL, Kapadia S, Roffi M, Vora N, Tiong I, Bajzer C. Comparison of results of carotid stenting followed by open heart surgery vs. combined carotid endarterectomy and open heart surgery (coronary bypass with or without another procedure). Am J Cardiol 2005;96(4):519–523
453. Don CW, House J, White C, Kiernan T, Weideman M, Ruggiero N, McCann A, Rosenfield K. Carotid revascularization immediately before urgent cardiac surgery practice patterns associated with the choice of carotid artery stenting or endarterectomy: a report from the CARE (Carotid Artery Revascularization and Endarterectomy) registry. JACC Cardiovasc Interv 2011;4(11):1200–1208
454. Antithrombotic Trialists C. Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ 2002;324(7329):71–86
455. Dalainas I, Nano G, Bianchi P, Stegher S, Malacrida G, Tealdi DG. Dual antiplatelet regime vs. acetyl-acetic acid for carotid artery stenting. Cardiovasc Intervent Radiol 2006;29(4):519–521
456. McKevitt FM, Randall MS, Cleveland TJ, Gaines PA, Tan KT, Venables GS. The benefits of combined anti-platelet treatment in carotid artery stenting. Eur J Vasc Endovasc Surg 2005;29(5):522–527
457. Parikh SV, Saya S, Divanji P, Banerjee S, Selzer F, Abbott JD, Naidu SS, Wilensky RL, FaxonDP, Jacobs AK, Holper EM. Risk of death and myocardial infarction in patients with peripheral arterial disease undergoing percutaneous coronary intervention (from the National Heart, Lung and Blood Institute Dynamic Registry). Am J Cardiol 2011;107(7):959–964
458. Brilakis ES, Hernandez AF, Dai D, Peterson ED, Banerjee S, Fonarow GC, Cannon CP, Bhatt DL. Quality of care for acute coronary syndrome patients with known atherosclerotic disease: results from the Get With the Guidelines Program. Circulation 2009;120(7):560–567
459. Diehm N, Schmidli J, Setacci C, Ricco JB, de Donato G, Becker F, Robert-Ebadi H, Cao P, Eckstein HH, De Rango P, Teraa M, Moll FL, Dick F, Davies AH, Lepantalo M, Apelqvist J. Chapter III: Management of cardiovascular risk factors and medical therapy. Eur J Vasc Endovasc Surg 2011;42 Suppl 2:S33–42
460. McFalls EO,Ward HB, Moritz TE, Goldman S, Krupski WC, Littooy F, Pierpont G, Santilli S, Rapp J, Hattler B, Shunk K, Jaenicke C, Thottapurathu L, Ellis N, Reda DJ, HendersonWG.Coronary-artery revascularization before electivemajor vascular surgery. N Engl J Med 2004;351(27):2795–2804
461. Monaco M, Stassano P, Di Tommaso L, Pepino P, Giordano A, Pinna GB, Iannelli G, Ambrosio G. Systematic strategy of prophylactic coronary angiography improves long-term outcome after major vascular surgery in medium- to high-risk patients: a prospective, randomized study. J Am Coll Cardiol 2009;54(11):989–996
462. Fleisher LA, Beckman JA, Brown KA, Calkins H, Chaikof EL, Fleischmann KE, Freeman WK, Froehlich JB, Kasper EK, Kersten JR, Riegel B, Robb JF. 2009 ACCF/AHA focused update on perioperative beta blockade incorporated into the ACC/AHA 2007 guidelines on perioperative cardiovascular evaluation and care for noncardiac surgery: a report of the American college of cardiology foundation/American heart association task force on practice guidelines. Circulation-2009;120(21):e169–e276
463. Zhao DX, Leacche M, Balaguer JM, Boudoulas KD, Damp JA, Greelish JP, Byrne JG, WritingGroup of the Cardiac Surgery CA,Interventional Cardiology Groupsat the Vanderbilt H, Vascular I, Ahmad RM, Ball SK, Cleator JH, Deegan RJ, Eagle SS, Fong PP, Fredi JL, Hoff SJ, Jennings HS 3rd, McPherson JA, Piana RN, Pretorius M, Robbins MA, Slosky DA, Thompson A. Routine intraoperative completion angiography after coronary artery bypass grafting and 1-stop hybrid revascularization results from a fully integrated hybrid catheterization laboratory/operating room J Am Coll Cardiol 2009;53(3):232–241
464. Thielmann M, Massoudy P, Jaeger BR, Neuhauser M, Marggraf G, Sack S, Erbel R, Jakob H. Emergency re-revascularization with percutaneous coronary intervention, reoperation, or conservative treatment in patients with acute perioperative graft failure following coronary artery bypass surgery. Eur J Cardiothorac Surg 2006;30(1):117–125
465. Thygesen K, Alpert JS, Jaffe AS, Simoons ML, Chaitman BR, White HD, Writing Group on the Joint ESCAAHAWHFTFftUDoMI, Thygesen K, Alpert JS, White HD, Jaffe AS, Katus HA, Apple FS, Lindahl B, Morrow DA, Chaitman BA, Clemmensen PM, Johanson P, Hod H, Underwood R, Bax JJ, Bonow RO, Pinto F, Gibbons RJ, Fox KA, Atar D, Newby LK, Galvani M, Hamm CW, Uretsky BF, Steg PG, Wijns W, Bassand JP, Menasche P, Ravkilde J, Ohman EM, Antman EM, Wallentin LC, Armstrong PW, Simoons ML, Januzzi JL, Nieminen MS, Gheorghiade M, Filippatos G, Luepker RV, Fortmann SP, Rosamond WD, Levy D,Wood D, Smith SC, Hu D, Lopez-Sendon JL, Robertson RM,Weaver D, Tendera M, Bove AA, Parkhomenko AN, Vasilieva EJ, Mendis S, Guidelines ESCCfP. Third universal definition of myocardial infarction. Eur Heart J 2012;33(20):2551–2567
466. Davierwala PM, Verevkin A, Leontyev S, Misfeld M, BorgerMA,MohrFW. Impact of expeditious management of perioperative myocardial ischemia in patients undergoing isolated coronary artery bypass surgery. Circulation 2013;128(11 Suppl 1): S226–234
467. Laflamme M, DeMey N, Bouchard D, Carrier M, Demers P, Pellerin M, Couture P, Perrault LP. Management of early postoperative coronary artery bypass graft failure. Interact Cardiovasc Thorac Surg 2012;14(4):452–456
468. Subramanian S, Sabik JF 3rd, Houghtaling PL, Nowicki ER, Blackstone EH, LytleBW Decision-making for patients with patent left internal thoracic artery grafts to left anterior descending. Ann Thorac Surg 2009;87(5):1392–1398; discussion 1400
469. Desai ND, Cohen EA, Naylor CD, Fremes SE, Radial Artery Patency Study I.A randomized comparison of radial-artery and saphenous-vein coronary bypass grafts.N Engl J Med 2004;351(22):2302–2309
470. Deb S, Cohen EA, Singh SK, Une D, Laupacis A, Fremes SE, Investigators R. Radial artery and saphenous vein patency more than 5 years after coronary artery bypass surgery: results from RAPS (Radial Artery Patency Study). J Am Coll Cardiol 2012; 60(1):28–35
471. Tatoulis J, Buxton BF, Fuller JA. Patencies of 2127 arterial to coronary conduits over 15 years. Ann Thorac Surg 2004;77(1):93–101
472. Hattler B, Messenger JC, Shroyer AL, Collins JF, Haugen SJ, Garcia JA, Baltz JH, Cleveland JC Jr., Novitzky D, Grover FL. Off-Pump coronary artery bypass surgery is associated with worse arterial and saphenous vein graft patency and less effective revascularization: Results from the Veterans Affairs Randomized On/Off Bypass (ROOBY) trial. Circulation 2012;125(23):2827–2835
473. Alexander JH, Hafley G, Harrington RA, Peterson ED, Ferguson TB Jr., Lorenz TJ, Goyal A, Gibson M, Mack MJ, Gennevois D, CaliffRM, KouchoukosNT. Efficacy and safety of edifoligide, an E2F transcription factor decoy, for prevention of vein graft failure following coronary artery bypass graft surgery: PREVENT IV: a randomized controlled trial. JAMA 2005;294(19):2446–2454
474. Tatoulis J, Buxton BF, Fuller JA. The right internal thoracic artery: the forgotten conduit:5,766 patients and 991 angiograms. Ann Thorac Surg 2011;92(1):9–15; discussion 15–17
475. Barner HB, Bailey M, Guthrie TJ, Pasque MK, Moon MR, Damiano RJ Jr., Lawton JS Radial artery free and T graft patency as coronary artery bypass conduit over a 15-year period. Circulation 2012;126(11 Suppl 1):S140–144
476. Achouh P, Boutekadjirt R, Toledano D, Hammoudi N, Pagny JY, Goube P, Isselmou KO, Lancelin B, Fouquet R, Acar C. Long-term (5- to 20-year) patency of the radial artery for coronary bypass grafting. J Thorac Cardiovasc Surg 2010; 140(1):73–79, 79 e1–e2
477. Sabik JF 3rd, Blackstone EH, Houghtaling PL,Walts PA, LytleBW. Is reoperation still a risk factor in coronary artery bypass surgery? Ann Thorac Surg 2005;80(5): 1719–1727
478. Yap CH, Sposato L, Akowuah E, Theodore S, DinhDT, Shardey GC, Skillington PD, Tatoulis J, Yii M, Smith JA, Mohajeri M, Pick A, Seevanayagam S, Reid CM. Contemporary results show repeat coronary artery bypass grafting remains a risk factor for operative mortality. Ann Thorac Surg 2009;87(5):1386–1391
479. Morrison DA, Sethi G, Sacks J, Henderson WG, Grover F, Sedlis S, Esposito R, Investigators of the Department of Veterans Affairs Cooperative Study AWESOME. Percutaneous coronary intervention vs. repeat bypass surgery for patients with medically refractory myocardial ischemia: AWESOME randomized trial and registry experience with post-CABG patients. J Am Coll Cardiol 2002; 40(11):1951–1954
480. Harskamp RE, BeijkMA, Damman P, Kuijt WJ,Woudstra P, Grundeken MJ, Kloek JJ, Tijssen JG, de Mol BA, de Winter RJ. Clinical outcome after surgical or percutaneous revascularization in coronary bypass graft failure. J Cardiovasc Med (Hagerstown) 2013;14(6):438–445
481. Sabik JF 3rd, Raza S, Blackstone EH, Houghtaling PL, Lytle BW. Value of internal thoracic artery grafting to the left anterior descending coronary artery at coronary reoperation. J Am Coll Cardiol 2013;61(3):302–310
482. Coolong A, Baim DS, Kuntz RE, O’Malley AJ, Marulkar S, Cutlip DE, Popma JJ, Mauri L. Saphenous vein graft stenting and major adverse cardiac events: a predictive model derived from a pooled analysis of 3958 patients. Circulation 2008;117(6): 790–797
483. Roffi M, Mukherjee D, Chew DP, Bhatt DL, Cho L, Robbins MA, Ziada KM, Brennan DM, Ellis SG, Topol EJ. Lack of benefit from intravenous platelet glycoprotein IIb/IIIa receptor inhibition as adjunctive treatment for percutaneous interventions of aortocoronary bypass grafts: a pooled analysis of five randomized clinical trials. Circulation 2002;106(24):3063–3067
484. Baim DS,Wahr D, George B, Leon MB, Greenberg J, Cutlip DE, Kaya U, Popma JJ, Ho KK, Kuntz RE, Saphenous vein graft Angioplasty Free of Emboli Randomized Trial I. Randomized trial of a distal embolic protection device during percutaneous intervention of saphenous vein aorto-coronary bypass grafts. Circulation 2002; 105(11):1285–190
485. StoneGW, Rogers C, Hermiller J, Feldman R, Hall P, Haber R, Masud A, Cambier P, Caputo RP, Turco M, Kovach R, Brodie B, Herrmann HC, Kuntz RE, Popma JJ, Ramee S, Cox DA, FilterWire EXREI. Randomized comparison of distal protection with a filter-based catheter and a balloon occlusion and aspiration system during percutaneous intervention of diseased saphenous vein aorto-coronary bypass grafts. Circulation 2003;108(5):548–553
486. Mauri L, Cox D,Hermiller J, Massaro J,Wahr J, TaySW, Jonas M, Popma JJ, Pavliska J, Wahr D, Rogers C. The PROXIMAL trial: proximal protection during saphenous vein graft intervention using the Proxis Embolic Protection System: a randomized, prospective, multicenter clinical trial. J Am Coll Cardiol 2007;50(15):1442–1449
487. Naidu SS, Turco MA, Mauri L, Coolong A, Popma JJ, Kereiakes DJ. Contemporary incidence and predictors of major adverse cardiac events after saphenous vein graft intervention with embolic protection (an AMEthyst trial substudy). Am J Cardiol 2010;105(8):1060–1064
488. Giugliano GR, Falcone MW, Mego D, Ebersole D, Jenkins S, Das T, Barker E, Ruggio JM, Maini B, Bailey SR. A prospective multicenter registry of laser therapy for degenerated saphenous vein graft stenosis: the COronary graft Results following Atherectomy with Laser (CORAL) trial. Cardiovasc Revasc Med 2012;13(2): 84–89
489. Frobert O, Schersten F, James SK, Carlsson J, Lagerqvist B. Long-term safety and efficacy of drug-eluting and bare metal stents in saphenous vein grafts. Am Heart J 2012;164(1):87–93
490. Wiisanen ME, Abdel-Latif A, Mukherjee D, Ziada KM. Drug-eluting stents vs. baremetal stents in saphenous vein graft interventions: a systematic review and meta-analysis. JACC Cardiovasc Interv 2010;3(12):1262–1273
491. Brilakis ES, Lichtenwalter C, Abdel-karim AR, de Lemos JA, Obel O, Addo T, Roesle M, Haagen D, Rangan BV, Saeed B, Bissett JK, Sachdeva R, Voudris VV, Karyofillis P, Kar B, Rossen J, Fasseas P, Berger P, Banerjee S. Continued benefit from paclitaxel-eluting compared with bare-metal stent implantation in saphenous vein graft lesions during long-term follow-up of the SOS (Stenting of Saphenous Vein Grafts) trial. JACC Cardiovasc Interv 2011;4(2):176–182
492. Hakeem A, Helmy T, Munsif S, Bhatti S, Mazraeshahi R, Cilingiroglu M, Effat M, Leesar M, Arif I. Safety and efficacy of drug eluting stents compared with bare metal stents for saphenous vein graft interventions: a comprehensive meta-analysis of randomized trials and observational studies comprising 7,994 patients. Catheter Cardiovasc Interv 2011;77(3):343–355
493. Mamas MA, Foley J, Nair S, Wiper A, Clarke B, El-Omar M, Fraser DG, Khattar R, Neyses L, Fath-Ordoubadi F. A comparison of drug-eluting stents vs. bare metal stents in saphenous vein graft PCI outcomes: a meta-analysis. J Interv Cardiol 2011;24(2):172–180
494. Ko DT, Guo H, Wijeysundera HC, Zia MI, Dzavik V, Chu MW, Fremes SE, Cohen EA, Tu JV. Long-term safety and effectiveness of drug-eluting stents for the treatment of saphenous vein grafts disease: a population-based study. JACC Cardiovasc Interv 2011;4(9):965–973
495. Mehilli J, Pache J, Abdel-Wahab M, Schulz S, Byrne RA, Tiroch K, Hausleiter J, Seyfarth M, Ott I, Ibrahim T, Fusaro M, Laugwitz KL, Massberg S, Neumann FJ, Richardt G, Schomig A, Kastrati A. Drug-eluting vs. bare-metal stents in saphenous vein graft lesions (ISAR-CABG): a randomised controlled superiority trial. Lancet 2011;378(9796):1071–1078
496. Nauta ST, Van Mieghem NM, Magro M, Deckers JW, Simsek C, Van Geuns RJ, Van Der Giessen WJ, De Jaegere P, Regar E, Van Domburg RT, SerruysPW. Seven-year safety and efficacy of the unrestricted use of drug-eluting stents in saphenous vein bypass grafts. Catheter Cardiovasc Interv 2012;79(6):912–918
497. Alam M, Bandeali SJ, Virani SS, Jneid HM, Shahzad SA, Ramanathan KB, Kar B, Kleiman NS, Lakkis N. Clinical outcomes of percutaneous interventions in saphenous vein grafts using drug-eluting stents compared to bare-metal stents: a comprehensive meta-analysisof all randomized clinical trials. Clin Cardiol 2012;35(5): 291–296
498. Brilakis ES, Lasala JM, Cox DA, Berger PB, Bowman TS, Starzyk RM, Dawkins KD Outcomes after implantation of the TAXUS paclitaxel-eluting stent in saphenous vein graft lesions: results from the ARRIVE (TAXUS Peri-Approval Registry: AMulticenter Safety Surveillance) program. JACC Cardiovasc Interv 2010;3(7):742–750
499. Seshadri N, Whitlow PL, Acharya N, Houghtaling P, Blackstone EH, Ellis SG. Emergency coronary artery bypass surgery in the contemporary percutaneous coronary intervention era. Circulation 2002;106(18):2346–2350
500. Richardson SG, Morton P, Murtagh JG, O’Keeffe DB, Murphy P, Scott ME. Management of acute coronary occlusion during percutaneous transluminal coronary angioplasty: experience of complications in a hospital without on site facilities for cardiac surgery. BMJ 1990;300(6721):355–358
501. Kastrati A, Mehilli J, von Beckerath N, Dibra A, Hausleiter J, Pache J, Schuhlen H, Schmitt C, Dirschinger J, Schomig A. Sirolimus-eluting stent or paclitaxel-eluting stent vs.balloon angioplasty for prevention of recurrences in patients with coronary in-stent restenosis: a randomized controlled trial. JAMA 2005;293(2):165–171
502. Mehilli J, Byrne RA, Tiroch K, Pinieck S, Schulz S, Kufner S, Massberg S, Laugwitz KL, Schomig A, Kastrati A. Randomized trial of paclitaxel- vs. sirolimus-eluting stents for treatment of coronary restenosis in sirolimus-eluting stents: the ISAR-DESIRE 2 (Intracoronary Stenting and Angiographic Results: Drug Eluting Stents for In-Stent Restenosis 2) study. J Am Coll Cardiol 2010;55(24):2710–2716
503. Alfonso F, Perez-Vizcayno MJ, Hernandez R, Bethencourt A, Marti V, Lopez-Minguez JR, Angel J, Mantilla R, Moris C, Cequier A, Sabate M, Escaned J, Moreno R, Banuelos C, Suarez A, Macaya C. A randomized comparison of-sirolimus-eluting stent with balloon angioplasty in patients with in-stent restenosis: results of the Restenosis Intrastent: Balloon Angioplasty Vs. Elective Sirolimus-Eluting Stenting (RIBS-II) trial. J Am Coll Cardiol 2006;47(11):2152–2160
504. Alfonso F, Zueco J, Cequier A, Mantilla R, Bethencourt A, Lopez-Minguez JR, Angel J, Auge JM, Gomez-Recio M, Moris C, Seabra-Gomes R, Perez-Vizcayno MJ, Macaya C. A randomized comparison of repeat stenting with balloon angioplasty in patients with in-stent restenosis. J Am Coll Cardiol 2003; 42(5):796–805
505. Dibra A, Kastrati A, Alfonso F, Seyfarth M, Perez-Vizcayno MJ, Mehilli J, Schomig A Effectiveness of drug-eluting stents in patients with bare-metal in-stent restenosis: meta-analysis of randomized trials. J Am Coll Cardiol 2007;49(5):616–623
506. Scheller B, Clever YP, Kelsch B, Hehrlein C, Bocksch W, Rutsch W, Haghi D, Dietz U, Speck U, Bohm M, Cremers B. Long-term follow-up after treatment of coronary in-stent restenosis with a paclitaxel-coated balloon catheter. JACC Cardiovasc Interv 2012;5(3):323–330
507. Scheller B, Hehrlein C, BockschW, RutschW, Haghi D, Dietz U, Bohm M, Speck U Treatment of coronary in-stent restenosis with a paclitaxel-coated balloon catheter N Engl J Med 2006;355(20):2113–2124
508. Unverdorben M, Vallbracht C, Cremers B, Heuer H, Hengstenberg C, Maikowski C, Werner GS, Antoni D, Kleber FX, Bocksch W, Leschke M, Ackermann H, Boxberger M, Speck U, Degenhardt R, Scheller B. Paclitaxel-coated balloon catheter vs. paclitaxel-coated stent for the treatment of coronary in-stent restenosis. Circulation 2009;119(23):2986–2994
509. Rittger H, Brachmann J, Sinha AM,Waliszewski M, Ohlow M, Brugger A, Thiele H, Birkemeyer R, Kurowski V, Breithardt OA, Schmidt M, Zimmermann S, Lonke S, von Cranach M, Nguyen TV, Daniel WG, Wohrle J. A randomized, multicenter, single-blinded trial comparing paclitaxel-coated balloon angioplasty with plain balloon angioplasty in drug-eluting stent restenosis: the PEPCAD-DES study J Am Coll Cardiol 2012;59(15):1377–1382
510. Habara S, Mitsudo K, Kadota K, Goto T, Fujii S, Yamamoto H, Katoh H, Oka N, Fuku Y, Hosogi S, Hirono A, Maruo T, Tanaka H, Shigemoto Y, Hasegawa D, Tasaka H, Kusunose M, Otsuru S, Okamoto Y, Saito N, Tsujimoto Y, Eguchi H, Miyake K, Yoshino M. Effectiveness of paclitaxel-eluting balloon catheter in patients with sirolimus-eluting stent restenosis. JACC Cardiovasc Interv 2011;4(2):149–154
511. Byrne RA, Neumann FJ, Mehilli J, Pinieck S,Wolff B, Tiroch K, Schulz S, Fusaro M, Ott I, Ibrahim T, Hausleiter J, Valina C, Pache J, Laugwitz KL, Massberg S, Kastrati A. Paclitaxel-eluting balloons, paclitaxel-eluting stents, and balloon angioplasty in patients with restenosis after implantation of a drug-eluting stent (ISARDESIRE 3): a randomised, open-label trial. Lancet 2013;381(9865):461–467
512. Indermuehle A, Bahl R, Lansky AJ, Froehlich GM, Knapp G, Timmis A, Meier P Drug-eluting balloon angioplasty for in-stent restenosis: a systematic review and meta-analysis of randomised controlled trials. Heart 2013;99(5):327–333
513. Tousek P, Pavei A, Oreglia J, Martin G, Sharif F, Fajadet J, Farah B. Impact of atherosclerotic disease progression on mid-term clinical outcome in diabetic patients in the drug-eluting stent era. EuroIntervention 2009;4(5):588–592
514. Zellweger MJ, Kaiser C, Jeger R, Brunner-La Rocca HP, Buser P, Bader F, Mueller-Brand J, Pfisterer M. Coronary artery disease progression late after successful stent implantation. J Am Coll Cardiol 2012;59(9):793–799
515. Chechi T, Vecchio S, Vittori G, Giuliani G, Lilli A, Spaziani G, Consoli L, Baldereschi G, Biondi-Zoccai GG, Sheiban I, Margheri M. ST-segment elevation myocardial infarction due to early and late stent thrombosis a new group of highrisk-patients. J Am Coll Cardiol 2008;51(25):2396–2402
516. Alfonso F, Dutary J, Paulo M, Gonzalo N, Perez-Vizcayno MJ, Jimenez-Quevedo P, Escaned J, Banuelos C, Hernandez R, Macaya C. Combineduse of optical coherence tomography and intravascular ultrasound imaging in patients undergoing coronary interventions for stent thrombosis. Heart 2012;98(16):1213–1220
517. Armstrong EJ, FeldmanDN,WangTY, Kaltenbach LA, Yeo KK,Wong SC, Spertus J, Shaw RE, Minutello RM, Moussa I, Ho KK, Rogers JH, Shunk KA. Clinical presentation, management, and outcomes of angiographically documented early, late, and very late stent thrombosis. JACC Cardiovasc Interv 2012;5(2):131–140
518. Wiviott SD, Braunwald E, McCabe CH, Montalescot G, Ruzyllo W, Gottlieb S, Neumann FJ, Ardissino D, De Servi S, Murphy SA, Riesmeyer J, Weerakkody G, Gibson CM, Antman EM. Prasugrel vs. clopidogrel in patients with acute coronary syndromes. N Engl J Med 2007;357(20):2001–2015
519. Mehta SR, Bassand JP, Chrolavicius S, Diaz R, Eikelboom JW, Fox KA, Granger CB, Jolly S, Joyner CD, Rupprecht HJ, Widimsky P, Afzal R, Pogue J, Yusuf S, Investigators C-O. Dose comparisons of clopidogrel and aspirin in acute coronary syndromes. N Engl J Med. 2010;363(10):930–942
520. Bonatti JO, Zimrin D, Lehr EJ, Vesely M, Kon ZN, Wehman B, de Biasi AR, Hofauer B, Weidinger F, Schachner T, Bonaros N, Friedrich G. Hybrid coronary revascularization using robotic totally endoscopic surgery: perioperative outcomes and 5-year results. Ann Thorac Surg 2012;94(6):1920–1926; discussion 1926
521. Shen L, HuS,Wang H, Xiong H, Zheng Z, Li L,XuB, Yan H, Gao R. One-stop hybrid coronary revascularization vs. coronary artery bypass grafting and percutaneous coronary intervention for the treatment of multivessel coronary artery disease: 3-year follow-up results from a single institution. J Am Coll Cardiol 2013;61(25): 2525–2533
522. Harskamp RE, Bonatti JO, Zhao DX, Puskas JD, de Winter RJ, Alexander JH, Halkos ME. Standardizing definitions for hybrid coronary revascularization J Thorac Cardiovasc Surg 2014;147(2):556–560
523. Zembala M, Tajstra M, Filipiak K, Knapik P, Hrapkowicz T, Gierlotka M, Hawranek M, Polonski L, Gasior M. Prospective randomised pilOt study evaLuating the safety and efficacy of hybrid revascularisation in Multi-vessel coronary artery DisEaSe (POLMIDES) - study design. Kardiol Pol 2011;69(5):460–466
524. Alfonso F, Perez-Vizcayno MJ, Cardenas A, Garcia Del Blanco B, Seidelberger B, Iniguez A, Gomez-Recio M, Masotti M, Velazquez MT, Sanchis J, Garcia-Touchard A, Zueco J, Bethencourt A, Melgares R, Cequier A, Dominguez A, Mainar V, Lopez-Minguez JR, Moreu J, Marti V, Moreno R, Jimenez-Quevedo P, Gonzalo N, Fernandez C, Macaya C.ARandomized Comparison of Drug-Eluting Balloon Vs. Everolimus-Eluting Stent in Patients With Bare- Metal Stent In-Stent Restenosis: The RIBS V Clinical Trial. J Am Coll Cardiol 2014; 63(14):1378–1386
525. Holmes DR Jr., Davis KB, Mock MB, Fisher LD, Gersh BJ, Killip T 3rd, Pettinger M The effect of medical and surgical treatment on subsequent sudden cardiac death in patients with coronary artery disease: a report from the Coronary Artery Surgery Study. Circulation 1986;73(6):1254–1263
526. Veenhuyzen GD, Singh SN, McAreavey D, Shelton BJ, Exner DV. Prior coronary artery bypass surgery and risk of death among patients with ischemic left ventricular dysfunction. Circulation 2001;104(13):1489–1493
527. Bigger JT Jr. Prophylactic use of implanted cardiac defibrillators in patients at high risk for ventricular arrhythmias after coronary-artery bypass graft surgery. Coronary Artery Bypass Graft (CABG) Patch Trial Investigators. N Engl J Med 1997; 337(22):1569–1575
528. Barsheshet A, Goldenberg I, Moss AJ, Huang DT, ZarebaW, McNitt S, Klein HU, Guetta V. Effect of elapsed time from coronary revascularization to implantation of a cardioverter defibrillator on long-term survival in the MADIT-II trial J Cardiovasc Electrophysiol 2011;22(11):1237–1242
529. Al-Khatib SM, Hellkamp AS, Lee KL, Anderson J, Poole JE, Mark DB, Bardy GH, scd-heft i. Implantable cardioverter defibrillator therapy in patients with prior coronary revascularization in the Sudden Cardiac Death in Heart Failure Trial (SCD-HeFT). J Cardiovasc Electrophysiol 2008;19(10):1059–1065
530. Funaro S, La Torre G, Madonna M, Galiuto L, Scara A, Labbadia A, Canali E, Mattatelli A, Fedele F, Alessandrini F, Crea F, Agati L, Investigators A. Incidence, determinants, and prognostic value of reverse left ventricular remodelling after primary percutaneous coronary intervention: results of the Acute Myocardial Infarction Contrast Imaging (AMICI) multicenter study. Eur Heart J 2009;30(5): 566–575
531. Antoni ML, Mollema SA, Delgado V, Atary JZ, Borleffs CJ, Boersma E, Holman ER, van derWall EE, Schalij MJ, Bax JJ. Prognostic importance of strain and strain rate after acute myocardial infarction. Eur Heart J 2010;31(13):1640–1647
532. SesselbergHW, Moss AJ, McNitt S, ZarebaW, Daubert JP, Andrews ML, Hall WJ, McClinitic B, Huang DT, Group M-IR. Ventricular arrhythmia storms in postinfarction patients with implantable defibrillators for primary prevention indications: a MADIT-II substudy. Heart Rhythm 2007;4(11):1395–1402
533. Spaulding CM, Joly LM, Rosenberg A, Monchi M,Weber SN, Dhainaut JF, Carli P Immediate coronary angiography in survivors of out-of-hospital cardiac arrest. N Engl J Med 1997;336(23):1629–1633
534. Kern KB. Optimal treatment of patients surviving out-of-hospital cardiac arrest JACC Cardiovasc Interv 2012;5(6):597–605
535. Garot P, Lefevre T, Eltchaninoff H, Morice MC, Tamion F, Abry B, Lesault PF, Le Tarnec JY, Pouges C, Margenet A, Monchi M, Laurent I, Dumas P, Garot J, LouvardY. Six-month outcomeof emergency percutaneous coronary intervention in resuscitated patients after cardiac arrest complicating ST-elevation myocardial infarction. Circulation 2007;115(11):1354–1362
536. Radsel P, Knafelj R, Kocjancic S, Noc M. Angiographic characteristics of coronary disease and postresuscitation electrocardiograms in patients with aborted cardiac arrest outside a hospital. Am J Cardiol 2011;108(5):634–638
537. Anyfantakis ZA, Baron G, Aubry P, Himbert D, Feldman LJ, Juliard JM, Ricard-Hibon A, Burnod A, Cokkinos DV, Steg PG. Acute coronary angiographic findings in survivors of out-of-hospital cardiac arrest. Am Heart J 2009;157(2): 312–318
538. Dumas F, Cariou A, Manzo-Silberman S, Grimaldi D, Vivien B, Rosencher J, Empana JP, Carli P, Mira JP, Jouven X, Spaulding C. Immediate percutaneous coronary intervention is associated with better survival after out-of-hospital cardiac arrest: insights from the PROCAT (Parisian Region Out of hospital Cardiac ArresT) registry. Circ Cardiovasc Interv 2010;3(3):200–207
539. Cronier P, Vignon P, Bouferrache K, Aegerter P, Charron C, Templier F, Castro S, El Mahmoud R, Lory C, Pichon N, Dubourg O, Vieillard-Baron A. Impact of routine percutaneous coronary intervention after out-of-hospital cardiac arrest due to ventricular fibrillation. Crit Care 2011;15(3):R122
540. Noc M, Fajadet J, Lassen JF, Kala P, MacCarthy P, Olivecrona GK, Windecker S, Spaulding C. Invasive Coronary Treatment Strategies for Out-Of-Hospital Cardiac Arrest:AConsensus Statement from the European Association for Percutaneous Cardiovascular Interventions (EAPCI)/Stent for Life (SFL) groups. EuroIntervention 2014;10:31–37
541. Mrdovic I, Savic L, Krljanac G, Perunicic J, Asanin M, Lasica R, Antonijevic N, Kocev N, Marinkovic J, Vasiljevic Z, Ostojic M. Incidence, predictors, and 30-day outcomes of new-onset atrial fibrillation after primary percutaneous coronary intervention: insight into the RISK-PCI trial. Coron Artery Dis 2012;23(1):1–8
542. Lopes RD, Elliott LE, White HD, Hochman JS, Van de Werf F, Ardissino D, NielsenTT,WeaverWD,Widimsky P, ArmstrongPW, Granger CB. Antithrombotic therapy and outcomes of patients with atrial fibrillation following primary percutaneous coronary intervention: results from the APEX-AMI trial. Eur Heart J 2009;30(16):2019–2028
543. Chan W, Ajani AE, Clark DJ, Stub D, Andrianopoulos N, Brennan AL, New G, Sebastian M, Johnston R,Walton A, Reid CM, Dart AM, Duffy SJ, Melbourne Interventional Group I. Impact of periprocedural atrial fibrillation on short-termclinical outcomes following percutaneous coronary intervention. Am J Cardiol 2012; 109(4):471–477
544. Pilgrim T, Kalesan B, Zanchin T, Pulver C, Jung S, Mattle H, Carrel T, Moschovitis A, Stortecky S, Wenaweser P, Stefanini GG, Raber L, Meier B, Juni P, Windecker S Impact of atrial fibrillation on clinical outcomes among patients with coronary artery disease undergoing revascularisation with drug-eluting stents. EuroIntervention 2013;8(9):1061–1071
545. Bernard A, Fauchier L, Pellegrin C, Clementy N, Saint Etienne C, Banerjee A, Naudin D, Angoulvant D. Anticoagulation in patients with atrial fibrillation undergoing coronary stent implantation. Thromb Haemost 2013;110(3):560–568
546. Ruiz-Nodar JM, Marin F, Roldan V, Valencia J, Manzano-Fernandez S, Caballero L, Hurtado JA, Sogorb F, Valdes M, Lip GY. Should we recommend oral anticoagulation therapy in patients with atrial fibrillation undergoing coronary artery stenting with a high HAS-BLED bleeding risk score? Circ Cardiovasc Interv 2012;5(4): 459–466
547. Camm AJ, Lip GY, De Caterina R, Savelieva I, Atar D, Hohnloser SH, Hindricks G, Kirchhof P, Guidelines ESCCfP. 2012 focused update of the ESC Guidelines for the management of atrial fibrillation: an update of the 2010 ESC Guidelines for the management of atrial fibrillation. Developed with the special contribution of the European Heart Rhythm Association. Eur Heart J 2012;33(21):2719–2747
548. Shen J, Lall S, Zheng V, Buckley P, Damiano RJ Jr., Schuessler RB. The persistent problem of new-onset postoperative atrial fibrillation: a single-institution experience over two decades. J Thorac Cardiovasc Surg 2011;141(2):559–570
549. Maesen B, Nijs J, Maessen J, Allessie M, Schotten U. Postoperative atrial fibrillation: a maze of mechanisms. Europace 2012;14(2):159–174
550. Mariscalco G, Klersy C, Zanobini M, Banach M, Ferrarese S, Borsani P, Cantore C, Biglioli P, Sala A. Atrial fibrillation after isolated coronary surgery affects late survival Circulation 2008;118(16):1612–1618
551. Burgess DC, Kilborn MJ, Keech AC. Interventions for prevention of postoperative atrial fibrillation and its complications after cardiac surgery: a meta-analysis. Eur Heart J 2006;27(23):2846–2857
552. Crystal E, Connolly SJ, Sleik K, Ginger TJ, Yusuf S. Interventions on prevention of postoperative atrial fibrillation in patients undergoing heart surgery: a meta-analysis. Circulation 2002;106(1):75–80
553. Connolly SJ, Cybulsky I, Lamy A, Roberts RS, O’Brien B, Carroll S, Crystal E, Thorpe KE, Gent M. Double-blind, placebo-controlled, randomized trial of prophylactic metoprolol for reduction of hospital length of stay after heart surgery: the beta-Blocker Length Of Stay (BLOS) study. Am Heart J 2003;145(2): 226–232
554. Lucio EA, Flores A, Blacher C, Leyes PE, Lucchese FA, Ribeiro JP. Effectiveness of metoprolol in preventing atrial fibrillation and flutter in the postoperative period of coronary artery bypass graft surgery. Arq Bras Cardiol 2003;82:42–46
555. Tsuboi J, Kawazoe K, Izumoto H, Okabayashi H. Postoperative treatment with carvedilol, a-adrenergic blocker, prevents paroxysmal atrial fibrillation after coronary artery bypass grafting. Circ J 2008;72:588–591
556. Koniari I, Apostolakis E, Rogkakou C, Baikoussis NG, Dougenis DE. Pharmacologic prophylaxis for atrial fibrillation following cardiac surgery: a systematic review J Cardiothorac Surg 2010;5:121
557. Dunning J, Treasure T, Versteegh M, Nashef SA. Guidelines on the prevention and management of de novo atrial fibrillation after cardiac and thoracic surgery. Eur J Cardiothorac Surg 2006;30:852–872
558. Wurdeman RL, Mooss AN, Mohiuddin SM, Lenz TL. Amiodarone vs. sotalol as prophylaxis against atrial fibrillation/flutter after heart surgery: a meta-analysis Chest 2002;121(4):1203–1210
559. ZhuJ,Wang C,Gao D, Zhang C, ZhangY, LuY,GaoY. Meta-analysis ofamiodarone vs. beta-blocker as a prophylactic therapy against atrial fibrillation following cardiac surgery. Intern Med J 2012;42(10):1078–1087
560. El-Chami MF, Kilgo P, Thourani V, Lattouf OM, Delurgio DB, Guyton RA, Leon AR, Puskas JD. New-onset atrial fibrillation predicts long-termmortality after coronary artery bypass graft. J Am Coll Cardiol 2010;55(13):1370–1376
561. Kirchhof P, Bax J, Blomstrom-Lundquist C, Calkins H, Camm AJ, Cappato R, Cosio F, Crijns H, Diener HC, Goette A, Israel CW, Kuck KH, Lip GY, Nattel S, Page RL, Ravens U, Schotten U, Steinbeck G, Vardas P, Waldo A,-Wegscheider K, Willems S, Breithardt G. Early and comprehensive management of atrial fibrillation: executive summary of the proceedings from the 2nd AFNET-EHRA consensus conference ’research perspectives in AF’. Eur Heart J-2009;30(24):2969–2977c
562. CoxJL,AdN, PalazzoT. Impact of the maze procedureon the strokerate in patients with atrial fibrillation. J Thorac Cardiovasc Surg 1999;118(5):833–840
563. Garcia-Fernandez MA, Perez-David E, Quiles J, Peralta J, Garcia-Rojas I, Bermejo J, Moreno M, Silva J. Role of left atrial appendage obliteration in stroke reduction in patients with mitral valve prosthesis: a transesophageal echocardiographic study J Am Coll Cardiol 2003;42(7):1253–1258
564. Holmes DR, Reddy VY, Turi ZG, Doshi SK, Sievert H, Buchbinder M, Mullin CM, Sick P, Investigators PA. Percutaneous closure of the left atrial appendage vs. warfarin therapy for prevention of stroke in patients with atrial fibrillation: a randomised non-inferiority trial. Lancet 2009;374(9689):534–542
565. Bagshaw SM, Galbraith PD, Mitchell LB, Sauve R, ExnerDV, GhaliWA. Prophylactic amiodarone for prevention of atrial fibrillation after cardiac surgery: a meta-analysis. Ann Thorac Surg 2006;82:1927–1937
566. Reddy VY, Holmes D, Doshi SK, Neuzil P, Kar S. Safety of percutaneous left atrial appendage closure: results from the Watchman Left Atrial Appendage System for Embolic Protection in Patients with AF (PROTECT AF) clinical trial and the Continued Access Registry. Circulation 2011;123:417–424
567. Otterstad JE, Kirwan BA, Lubsen J, De Brouwer S, Fox KA, Corell P, Poole-Wilson PA, Action I. Incidence and outcome of atrial fibrillation in stable symptomatic coronary disease. Scand Cardiovasc J 2006;40(3):152–159
568. Goldenberg I, Moss AJ, McNitt S, Zareba W, Hall WJ, Andrews ML, Wilber DJ, Klein HU, Investigators M-I. Time dependence of defibrillator benefit after coronary revascularization in the Multicenter Automatic Defibrillator Implantation Trial (MADIT)-II. J Am Coll Cardiol 2006;47(9):1811–1817
569. Wang G, Bainbridge D, Martin J, Cheng D. The efficacy of an intraoperative cell saver during cardiac surgery: a meta-analysis of randomized trials. Anesth Analg 2009;109(2):320–30
570. McIlroy DR, Myles PS, Phillips LE, Smith JA. Antifibrinolytics in cardiac surgical patients receiving aspirin: a systematic review and meta-analysis. Br J Anaesth 2009;102(2):168–178
571. Bhaskar B, Dulhunty J, Mullany DV, Fraser JF. Impact of blood product transfusion on short and long-term survival after cardiac surgery: more evidence. Ann Thorac Surg 2012;94(2):460–467
572. Jakobsen CJ, Ryhammer PK, Tang M, Andreasen JJ, Mortensen PE. Transfusion of blood during cardiac surgery is associated with higher long-term mortality in low-risk patients. Eur J Cardiothorac Surg 2012;42(1):114–120 573. Hajjar LA, Vincent JL, Galas FR, Nakamura RE, Silva CM, Santos MH, Fukushima J, Kalil Filho R, Sierra DB, Lopes NH, Mauad T, Roquim AC, Sundin MR, Leao WC, Almeida JP, Pomerantzeff PM, Dallan LO, Jatene FB, Stolf NA, Auler JO Jr. Transfusion requirements after cardiac surgery: the TRACS randomized controlled trial JAMA 2010;304(14):1559–1567
574. Zenati MA, Shroyer AL, Collins JF, Hattler B, Ota T, Almassi GH, Amidi M, Novitzky D, Grover FL, Sonel AF. Impact of endoscopic vs. open saphenous vein harvest technique on late coronary artery bypass grafting patient outcomes in the ROOBY (Randomized On/Off Bypass) Trial. J Thorac Cardiovasc Surg 2011; 141(2):338–344
575. Lopes RD, Hafley GE, Allen KB, Ferguson TB, Peterson ED, Harrington RA, Mehta RH, Gibson CM, Mack MJ, Kouchoukos NT, Califf RM, Alexander JH. Endoscopic vs. Open Vein-Graft Harvesting in Coronary-Artery Bypass Surgery.NEng J Med 2009;361(3):235–244
576. Deppe AC, Liakopoulos OJ, Choi YH, Slottosch I, KuhnEW, Scherner M, Stange S, Wahlers T. Endoscopic vein harvesting for coronary artery bypass grafting: a systematic review with meta-analysis of 27,789 patients. J Surg Res 2012;180(1): 114–124
577. Yun KL, Wu Y, Aharonian V, Mansukhani P, Pfeffer TA, Sintek CF, Kochamba GS, Grunkemeier G, Khonsari S. Randomized trial of endoscopic vs. open vein harvest for coronary artery bypass grafting: six-month patency rates. J Thorac Cardiovasc Surg 2005;129(3):496–503
578. Ouzounian M, Hassan A, Buth KJ, MacPherson C, Ali IM, Hirsch GM, Ali IS. Impact of endoscopic vs. open saphenous vein harvest techniques on outcomes after coronary artery bypass grafting. Ann Thorac Surg 2010;89(2):403–408
579. Williams JB, Peterson ED, Brennan JM, Sedrakyan A, Tavris D, Alexander JH, Lopes RD, Dokholyan RS, Zhao Y, O’Brien SM, Michler RE, Thourani VH, Edwards FH, Duggirala H, Gross T, Marinac-Dabic D, Smith PK. Association-between endoscopic vs. open vein-graft harvesting and mortality, wound complications and cardiovascular events in patients undergoing CABG surgery. JAMA 2012; 308(5):475–484
580. Brown EN,Kon ZN,Tran R, Burris NS,GuJ, Laird P, Brazio PS, Kallam S, Schwartz K, Bechtel L, Joshi A, Zhang S, Poston RS. Strategies to reduce intraluminal clot formation in endoscopically harvested saphenous veins. J Thorac Cardiovasc Surg 2007; 134(5):1259–1265
581. Khaleel MS, Dorheim TA, Duryee MJ, Durbin HE Jr., Bussey WD, Garvin RP, Klassen LW, Thiele GM, Anderson DR. High-pressure distention of the saphenous vein during preparation results in increased markers of inflammation: a potential mechanism for graft failure. Ann Thorac Surg 2012;93(2):552–558
582. Rousou LJ, Taylor KB, Lu XG, Healey N, Crittenden MD, Khuri SF, Thatte HS. Saphenous vein conduits harvested by endoscopic technique exhibit structural and functional damage. Ann Thorac Surg 2009;87(1):62–70
583. Navia JL, Olivares G, Ehasz P, Gillinov AM, Svensson LG, Brozzi N, Lytle B. Endoscopic radial artery harvesting procedure for coronary artery bypass grafting Ann Cardiothorac Surg 2013;2(4):557–564
584. Souza DS, Dashwood MR, Tsui JC, Filbey D, Bodin L, Johansson B, Borowiec J Improved patency in vein grafts harvested with surrounding tissue: results of a randomized study using three harvesting techniques. Ann Thorac Surg 2002;73(4): 1189–1195
585. Johansson BL, Souza DS, Bodin L, Filbey D, Loesch A, Geijer H, Bojo L. Slower progression of atherosclerosis in vein grafts harvested with ’no touch’ technique compared with conventional harvesting technique in coronary artery bypass grafting: an angiographic and intravascular ultrasound study. Eur J Cardiothorac Surg 2010;38(4): 414–419
586. Deo SV, Shah IK, Dunlay SM, Erwin PJ, Locker C, Altarabsheh SE, Boilson BA, Park SJ, Joyce LD. Bilateral internal thoracic artery harvest and deep sternal wound infection in diabetic patients. Ann Thorac Surg 2013;95(3):862–869
587. SaMP, Ferraz PE, Escobar RR, Vasconcelos FP, Ferraz AA, Braile DM, Lima RC. Skeletonized vs. pedicled internal thoracic artery and risk of sternal wound infection after coronary bypass surgery: meta-analysis and meta-regression of 4817 patients Interact Cardiovasc Thorac Surg 2013;16(6):849–857
588. Sakic A, Chevtchik O, Kilo J, Schistek R, Mueller LC, Ulmer H, Grimm M, Ruttmann E. Simple adaptations of surgical technique to critically reduce the risk of postoperative sternal complications in patients receiving bilateral internal thoracic arteries. Interact Cardiovasc Thorac Surg 2013;17(2):378–382
589. Lytle BW. Skeletonized internal thoracic artery grafts and wound complications J Thorac Cardiovasc Surg 2001;121(4):625–627
590. Wendler O, Hennen B, Markwirth T, Konig J, Tscholl D, Huang Q, Shahangi E, Schafers HJ. T grafts with the right internal thoracic artery to left internal thoracic artery vs. the left internal thoracic artery and radial artery: flow dynamics in the internal thoracic artery main stem. J Thorac Cardiovasc Surg 1999;118(5):841–848
591. Taggart DP. Incomplete revascularization: appropriate and inappropriate. Eur J Cardiothorac Surg 2012;41(3):542–543
592. Zimarino M, Curzen N, Cicchitti V, De Caterina R. The adequacy of myocardial revascularization in patients with multivessel coronary artery disease. Int J Cardiol 2013;168(3):1748–1757
593. Ong AT, Serruys PW. Complete revascularization: coronary artery bypass graft surgery vs. percutaneous coronary intervention. Circulation 2006;114(3):249–255
594. Farooq V, Serruys PW, Garcia–Garcia HM, Zhang Y, Bourantas CV, Holmes DR, Mack M, Feldman T, Morice MC, Stahle E, James S, Colombo A, Diletti R, Papafaklis MI, de Vries T, Morel MA, van Es GA, Mohr FW, Dawkins KD,-Kappetein AP, Sianos G, Boersma E. The negative impact of incomplete angiographic revascularization on clinical outcomes and its association with total occlusions: the SYNTAX (Synergy Between Percutaneous Coronary Intervention with Taxus and Cardiac Surgery) trial. J Am Coll Cardiol 2013;61(3):282–294
595. Head SJ, Mack MJ, Holmes DR Jr., Mohr FW, Morice MC, Serruys PW, Kappetein AP. Incidence, predictors and outcomes of incomplete revascularization after percutaneous coronary intervention and coronary artery bypass grafting: a subgroup analysis of 3-year SYNTAX data. Eur J Cardiothorac Surg 2012;41(3): 535–541
596. Kim YH, Park DW, Lee JY, Kim WJ, Yun SC, Ahn JM, Song HG, Oh JH, Park JS, Kang SJ, LeeSW, LeeCW, ParkSW, Park SJ. Impact of angiographic complete revascularization after drug-eluting stent implantation or coronary artery bypass graft surgery for multivessel coronary artery disease. Circulation 2011;123(21): 2373–2381
597. Mohammadi S, Kalavrouziotis D, Dagenais F, Voisine P, Charbonneau E. Completeness of revascularization and survival among octogenarians with triple-vessel disease. Ann Thorac Surg 2012;93(5):1432–1437
598. Yi G, Youn YN, Joo HC, Hong S, Yoo KJ. Association of incomplete revascularization with long-term survival after off-pump coronary artery bypass grafting. J Surg Res 2013;185(1):166–173
599. Rastan AJ,Walther T, FalkV,Kempfert J, Merk D, Lehmann S, Holzhey D, MohrFW Does reasonable incomplete surgical revascularization affect early or long-term survival in patients with multivessel coronary artery disease receiving left internal mammary artery bypass to left anterior descending artery? Circulation 2009; 120(11 Suppl):S70–77
600. Garcia S, Sandoval Y, Roukoz H, Adabag S, Canoniero M, Yannopoulos D, Brilakis ES. Outcomes after complete vs. incomplete revascularization of patients with multivessel coronary artery disease: a meta-analysis of 89,883 patients enrolled in randomized clinical trials and observational studies. J Am Coll Cardiol 2013;62(16):1421–1431
601. Scott R, Blackstone EH, McCarthy PM, Lytle BW, Loop FD, White JA, Cosgrove DM. Isolated bypass grafting of the left internal thoracic artery to the left anterior descending coronary artery. J Thorac Cardiovasc Surg 2000;120(1): 173–184
602. Boylan MJ, LytleBW, Loop FD, Taylor PC, Borsh JA, Goormastic M, Cosgrove DM Surgical treatment of isolated left anterior descending coronary stenosis. Comparison of left internal mammary artery and venous autograft at 18 to 20 years of follow-up. J Thorac Cardiovasc Surg. 1994;107:657–662
603. Sabik JF 3rd, Blackstone EH, Gillinov AM, Banbury MK, Smedira NG, Lytle BW. Influence of patient characteristics and arterial grafts on freedom from coronary reoperation J Thorac Cardiovasc Surg 2006;131(1):90–98
604. Schmitto JD, Rajab TK, Cohn LH. Prevalence and variability of internal mammary graft use in contemporary multivessel coronary artery bypass graft. Curr Opin Cardiol 2010;25(6):609–612
605. Taggart DP, D’Amico R, Altman DG. Effect of arterial revascularisation on survival: a systematic review of studies comparing bilateral and single internal mammary arteries Lancet 2001;358(9285):870–875
606. Ruttmann E, Fischler N, Sakic A, Chevtchik O, Alber H, Schistek R, Ulmer H, Grimm M. Second internal thoracic artery vs. radial artery in coronary artery bypass grafting: a long-term, propensity score-matched follow-up study. Circulation 2011;124(12):1321–1329
607. Galbut DL, Kurlansky PA, Traad EA, Dorman MJ, Zucker M, Ebra G. Bilateral internal thoracic artery grafting improves long-term survival in patients with reduced ejection fraction: a propensity-matched study with 30-year follow-up. J Thorac Cardiovasc Surg 2012;143(4):844–853 e4
608. Grau JB, Ferrari G, Mak AW, Shaw RE, Brizzio ME, Mindich BP, Strobeck J, Zapolanski A. Propensity matched analysis of bilateral internal mammary artery vs. single left internal mammary artery grafting at 17-year follow-up: validation of a contemporary surgical experience. Eur J Cardiothorac Surg 2012;41(4):770–775, discussion 776
609. LytleBW. Bilateral internal thoracic artery grafting. Ann Cardiothorac Surg 2013;2(4): 485–492
610. Weiss AJ, Zhao S, Tian DH, Taggart DP, Yan TD. A meta-analysis comparing bilateral internalmammaryartery with left internalmammary artery for coronary artery bypass grafting. Ann Cardiothorac Surg 2013;2(4):390–400
611. Hemo E, Mohr R, Uretzky G, Katz G, Popovits N, Pevni D, Medalion B. Long-term outcomes of patients with diabetes receiving bilateral internal thoracic artery grafts. J Thorac Cardiovasc Surg 2013;146(3):586–592
612. Taggart DP, Lees B, Gray A, Altman DG, Flather M, Channon K, Investigators ART Protocol for the Arterial Revascularisation Trial (ART). A randomised trial to compare survival following bilateral vs. single internal mammary grafting in coronary revascularisation [ISRCTN46552265]. Trials 2006;7:7
613. Elmistekawy EM, Gawad N, Bourke M, Mesana T, Boodhwani M, Rubens FD. Is bilateral internal thoracic artery use safe in the elderly? J Card Surg 2012;27(1):1–5
614. Toumpoulis IK, Theakos N, Dunning J. Does bilateral internal thoracic artery harvest increase the risk of mediastinitis? Interact Cardiovasc Thorac Surg 2007; 6(6):787–791
615. Tranbaugh RF, Dimitrova KR, Friedmann P, Geller CM,Harris LJ, Stelzer P,CohenB, Hoffman DM. Radial artery conduits improve long-term survival after coronary artery bypass grafting. Ann Thorac Surg 2010;90(4):1165–1172
616. Tranbaugh RF, Dimitrova KR, Friedmann P, Geller CM, Harris LJ, Stelzer P, Cohen BM, Ko W, DeCastro H, Lucido D, Hoffman DM. Coronary artery bypass grafting using the radial artery: clinical outcomes, patency, and need for reintervention Circulation 2012;126(11 Suppl 1):S170–175
617. Schwann TA, Engoren M, Bonnell M, Clancy C, Habib RH. Comparison of late coronary artery bypass graft survival effects of radial artery vs. saphenous vein grafting in male and female patients. Ann Thorac Surg 2012;94(5):1485–1491
618. Hayward PA, Gordon IR, Hare DL, Matalanis G, Horrigan ML, Rosalion A, Buxton BF. Comparable patencies of the radial artery and right internal thoracic artery or saphenous vein beyond 5 years: results from the Radial Artery Patency and Clinical Outcomes trial. J Thorac Cardiovasc Surg 2010;139(1):60–65; discussion 65–67
619. Kieser TM, Rose S, Kowalewski R, Belenkie I. Transit-time flow predicts outcomes in coronary artery bypass graft patients: a series of 1000 consecutive arterial grafts Eur J Cardiothorac Surg 2010;38(2):155–162
620. Jokinen JJ,Werkkala K, Vainikka T, Perakyla T, Simpanen J, Ihlberg L. Clinical value of intra-operative transit-time flow measurement for coronary artery bypass grafting: a prospective angiography-controlled study. Eur J Cardiothorac Surg 2011;39(6): 918–923
621. Lamy A, Devereaux PJ, Prabhakaran D, Taggart DP, Hu S, Paolasso E, Straka Z, Piegas LS, Akar AR, Jain AR, Noiseux N, Padmanabhan C, Bahamondes JC, Novick RJ, Vaijyanath P, Reddy SK, Tao L, Olavegogeascoechea PA, Airan B, Sulling TA, Whitlock RP, Ou Y, Pogue J, Chrolavicius S, Yusuf S, Investigators C Effects of off-pump and on-pump coronary-artery bypass grafting at 1 year. N Engl J Med 2013;368(13):1179–1188
622. Diegeler A, Borgermann J, Kappert U, Breuer M, Boning A, Ursulescu A, Rastan A, Holzhey D, Treede H, Riess FC, Veeckmann P, Asfoor A, Reents W, Zacher M, Hilker M. Off-pump vs. on-pump coronary-artery bypass grafting in elderly-patients. N Engl J Med 2013;368(13):1189–1198
623. Shroyer AL, Grover FL, Hattler B, Collins JF, McDonald GO, Kozora E, Lucke JC, Baltz JH, Novitzky D. On-pump vs. off-pump coronary-artery bypass surgery N Engl J Med 2009;361(19):1827–1837
624. Houlind K, Kjeldsen BJ, Madsen SN, Rasmussen BS, Holme SJ, Nielsen PH, Mortensen PE, Group DS. On-pump vs. off-pump coronary artery bypass surgery in elderly patients: results from the Danish on-pump vs. off-pump randomization study. Circulation 2012;125(20):2431–2439
625. Hattler B, Messenger JC, Shroyer AL, Collins JF, Haugen SJ, Garcia JA, Baltz JH, Cleveland JC Jr., Novitzky D, Grover FL, Veterans Affairs Randomized On, /Off Bypass Study G. Off-Pump coronary artery bypass surgery is associated with worse arterial and saphenous vein graft patency and less effective revascularization: Results from the Veterans Affairs Randomized On/Off Bypass (ROOBY) trial. Circulation 2012;125(23):2827–2835
626. Sedrakyan A, Wu AW, Parashar A, Bass EB, Treasure T. Off-pump surgery is associated with reduced occurrence of stroke and other morbidity as compared with traditional coronary artery bypass grafting: a meta-analysis of systematically reviewed trials. Stroke 2006;37(11):2759–2769
627. Keeling WB, Kilgo PD, Puskas JD, Halkos ME, Lattouf OM, Guyton RA, Thourani VH. Off-pump coronary artery bypass grafting attenuates morbidity and mortality for patients with low and high body mass index. J Thorac Cardiovasc-Surg 2012;146(6):1142–1148
628. Puskas JD, WilliamsWH,O’Donnell R, Patterson RE, Sigman SR, Smith AS, BaioKT, Kilgo PD, Guyton RA. Off-pump and on-pump coronary artery bypass grafting are associated with similar graft patency, myocardial ischemia, and freedom from reintervention: long-term follow-up of a randomized trial. Ann Thorac Surg 2011;91(6): 1836–1842; discussion 1842–1843
629. Puskas JD, Thourani VH, Kilgo P, Cooper W, Vassiliades T, Vega JD, Morris C, Chen E, Schmotzer BJ, Guyton RA, Lattouf OM. Off-pump coronary artery bypass disproportionately benefits high-risk patients. Ann Thorac Surg 2009;88(4): 1142–1147
630. Head SJ, Borgermann J, Osnabrugge RL, Kieser TM, Falk V, Taggart DP, Puskas JD, Gummert JF, Kappetein AP. Coronary artery bypass grafting: Part 2:optimizing outcomes and future prospects. Eur Heart J 2013;34(37):2873–2886
631. Diegeler A,WaltherT, Metz S, FalkV, Krakor R, Autschbach R,MohrFW. Comparison of MIDCAP vs. conventional CABG surgery regarding pain and quality of life Heart Surg Forum 1999;2(4):290–295; discussion 295–296
632. Groh MA, Sutherland SE, BurtonHG3rd, JohnsonAM, ElySW. Port-access coronary artery bypass grafting: technique and comparative results. Ann Thorac Surg 1999; 68(4):1506–1508
633. Lapierre H, Chan V, Sohmer B, Mesana TG, Ruel M. Minimally invasive coronary artery bypass grafting via a small thoracotomy vs. off-pump: a case-matched study. Eur J Cardiothorac Surg 2011;40(4):804–810
634. Siregar S, Groenwold RH, de Mol BA, Speekenbrink RG, Versteegh MI, Brandon Bravo Bruinsma GJ, Bots ML, van der Graaf Y, van Herwerden LA. Evaluation of cardiac surgery mortality rates: 30-day mortality or longer follow-up? Eur J Cardiothorac Surg 2013;44(5):875–883
635. Peterson ED, Coombs LP, DeLong ER, Haan CK, Ferguson TB. Procedural volume as a marker of quality for CABG surgery. JAMA 2004;291(2):195–201
636. Sergeant P, Blackstone E, Meyns B. Validation and interdependence with patientvariables of the influence of procedural variables on early and late survival after CABG. K.U. Leuven Coronary Surgery Program. Eur J Cardiothorac Surg 1997; 12(1):1–19
637. Williams JB, Peterson ED, Brennan JM, Sedrakyan A, Tavris D, Alexander JH, Lopes DR, Dokholyan RS, Zhao Y, O’Brien SM, Michler RE, Thourani VH, Edwards FH, Duggirala H, Gross T, Marinac-Dabic D, Smith PK. Association-Between Endoscopic vs.Open Vein-Graft Harvesting and Mortality,Wound Complications, and Cardiovascular Events in Patients Undergoing CABG Surgery. JAMA 2012;308:(5):475–484
638. Bakaeen FG. Endoscopic vein harvest for coronary artery bypass grafting is safe J Surg Res 2013;185(2):522–523
639. Schmitto JD, Rajab TK, Cohn LH. Prevalence and variability of internal mammary graft use in contemporary multivessel coronary artery bypass graft. Curr Opin Cardiol 2010;25:609–612
640. Dorman MJ, Kurlansky PA, Traad EA, Galbut DL, Zucker M, Ebra G. Bilateral Internal Mammary Artery Grafting Enhances Survival in Diabetic Patients : A 30-Year Follow-Up of Propensity Score 2Matched Cohorts. Circulation 2012;126: 2935–2942
641. Kieser TM, LewinAM, Graham MM, Martin BJ, Galbraith PD, Rabi DM, Norris CM, Faris PD, Knudtson ML, GhaliWA, Investigators A. Outcomes associated with bilateral internal thoracic artery grafting: the importance of age. Ann Thorac Surg 2011; 92(4):1269–1275; discussion 1275–1276
642. Desai ND, Cohen EA, Naylor CD, Fremes SE. A Randomized Comparison of Radial-Artery and Saphenous-Vein Coronary Bypass Grafts. N Engl J Med 2004; 351:2302–2309
643. Tatoulis J. Total arterial coronary revascularization-patient selection, stenoses, conduits, targets. Ann Cardiothorac Surg 2013;2(4):499–506
644. Borgermann J, Hakim K, Renner A, Parsa A, Aboud A, Becker T, Masshoff M, Zittermann A,Gummert JF, Kuss O. Clampless off-pump vs. conventional coronary artery revascularization: a propensity score analysis of 788 patients. Circulation 2012;126(11 Suppl 1):S176–182
645. Brophy JM, Belisle P, Joseph L. Evidence for use of coronary stents. A hierarchical bayesian meta-analysis. Ann Intern Med 2003;138(10):777–786
646. Kastrati A, Mehilli J, Dirschinger J, Dotzer F, Schuhlen H, Neumann FJ, Fleckenstein M, Pfafferott C, Seyfarth M, Schomig A. Intracoronary stenting and angiographic results: strut thickness effect on restenosis outcome (ISAR-STEREO)-trial. Circulation 2001;103(23):2816–2821
647. Pache J, Kastrati A, Mehilli J, Schuhlen H, Dotzer F, Hausleiter J, Fleckenstein M, Neumann FJ, Sattelberger U, Schmitt C, Muller M, Dirschinger J, Schomig A. Intracoronary stenting and angiographic results: strut thickness effect on restenosis outcome (ISAR-STEREO-2) trial. J Am Coll Cardiol 2003;41(8):1283–1288
648. Mehran R, Baber U, Steg PG, Ariti C,Weisz G, Witzenbichler B, Henry TD, Kini AS, Stuckey T, Cohen DJ, Berger PB, Iakovou I, Dangas G,Waksman R, Antoniucci D, Sartori S, Krucoff MW, Hermiller JB, Shawl F, Gibson CM, Chieffo A, Alu M, Moliterno DJ, Colombo A, Pocock S. Cessation of dual antiplatelet treatment and cardiac events after percutaneous coronary intervention (PARIS): 2 year results from a prospective observational study. Lancet 2013;382(9906): 1714–1722
649. Kastrati A, Mehilli J, Pache J, Kaiser C, Valgimigli M, Kelbaek H, Menichelli M, Sabate M, Suttorp MJ, Baumgart D, Seyfarth M, Pfisterer ME, Schomig A. Analysis of 14 trials comparing sirolimus-eluting stents with bare-metal stents. N Engl J Med 2007;356(10):1030–1039
650. Stone GW, Moses JW, Ellis SG, Schofer J, Dawkins KD, Morice MC, Colombo A, Schampaert E, Grube E, Kirtane AJ, Cutlip DE, Fahy M, Pocock SJ, Mehran R, Leon MB. Safety and efficacy of sirolimus- and paclitaxel-eluting coronary stents N Engl J Med 2007;356(10):998–1008
651. Daemen J, Wenaweser P, Tsuchida K, Abrecht L, Vaina S, Morger C, Kukreja N, Juni P, Sianos G, Hellige G, van Domburg RT, Hess OM, Boersma E, Meier B, Windecker S, Serruys PW. Early and late coronary stent thrombosis of-sirolimus-eluting and paclitaxel-eluting stents in routine clinical practice: data from a large two-institutional cohort study. Lancet 2007;369(9562):667–678
652. De Luca G, Dirksen MT, Spaulding C, Kelbaek H, Schalij M, Thuesen L, van der Hoeven B, Vink MA, Kaiser C, Musto C, Chechi T, Spaziani G, Diaz de la Llera LS, Pasceri V, Di Lorenzo E, Violini R, Cortese G, Suryapranata H, Stone GW. Drug-eluting vs.bare-metal stents in primary angioplasty: a pooled patient-level meta-analysis of randomized trials. Arch Intern Med 2012;172(8): 611–621, discussion 621–622
653. Nabel EG, Braunwald E.Atale of coronary artery disease and myocardial infarction N Engl J Med 2012;366(1):54–63
654. Stone GW, Rizvi A, Newman W, Mastali K, Wang JC, Caputo R, Doostzadeh J, Cao S, Simonton CA, Sudhir K, Lansky AJ, Cutlip DE, Kereiakes DJ Everolimus-eluting vs. paclitaxel-eluting stents in coronary artery disease. N Engl J Med 2010;362(18):1663–1674
655. SerruysPW, Silber S, Garg S, van Geuns RJ, Richardt G, Buszman PE, Kelbaek H, van Boven AJ, Hofma SH, Linke A, Klauss V, WijnsW, Macaya C, Garot P, DiMario C, Manoharan G, Kornowski R, Ischinger T, Bartorelli A, Ronden J, Bressers M, Gobbens P, Negoita M, van Leeuwen F, Windecker S. Comparison of zotarolimus-eluting and everolimus-eluting coronary stents. N Engl J Med 2010; 363(2):136–146
656. Christiansen EH, Jensen LO, Thayssen P, Tilsted HH, Krusell LR, Hansen KN, Kaltoft A, Maeng M, Kristensen SD, Botker HE, Terkelsen CJ, Villadsen AB, Ravkilde J, Aaroe J, Madsen M, Thuesen L, Lassen JF. Biolimus-eluting biodegradable polymer-coated stent vs. durable polymer-coated sirolimus-eluting stent in unselected patients receiving percutaneous coronary intervention (SORT OUT V): a randomised non-inferiority trial. Lancet 2013;381(9867):661–669
657. Byrne RA, Kastrati A, Kufner S, Massberg S, Birkmeier KA, Laugwitz KL, Schulz S, Pache J, Fusaro M, Seyfarth M, Schomig A, Mehilli J. Randomized, non-inferiority trial of three limus agent-eluting stents with different polymer coatings: the Intracoronary Stenting and Angiographic Results: Test Efficacy of 3 Limus-Eluting Stents (ISAR-TEST-4) Trial. Eur Heart J 2009;30(20):2441–2449
658. Smits PC, Hofma S, Togni M, Vazquez N, Valdes M, Voudris V, Slagboom T, Goy JJ, Vuillomenet A, Serra A, Nouche RT, den Heijer P, van der Ent M. Abluminal biodegradable polymer biolimus-eluting stent vs. durable polymer everolimus-eluting stent (COMPARE II): a randomised, controlled, non-inferiority trial. Lancet 2013; 381(9867):651–660
659. Massberg S, Byrne RA, Kastrati A, Schulz S, Pache J, Hausleiter J, IbrahimT, Fusaro M, Ott I, Schomig A, Laugwitz KL, Mehilli J. Polymer-free sirolimus- and probucol-eluting vs. new generation zotarolimus-eluting stents in coronary artery disease: the Intracoronary Stenting and Angiographic Results: Test Efficacy of Sirolimus- and Probucol-Eluting vs. Zotarolimus-eluting Stents (ISAR-TEST 5) trial. Circulation 2011;124(5):624–632
660. Tada N, Virmani R, Grant G, Bartlett L, Black A, Clavijo C, Christians U, Betts R, Savage D, Su SH, Shulze J, Kar S. Polymer-free biolimus a9-coated stent demonstrates more sustained intimal inhibition, improved healing, and reduced inflammation compared with a polymer-coated sirolimus-eluting cypher stent in a porcine model. Circ Cardiovasc Interv 2010;3(2):174–183
661. Planer D, Smits PC, Kereiakes DJ, Kedhi E, Fahy M, Xu K, Serruys PW, StoneGW Comparison of everolimus- and paclitaxel-eluting stents in patients with acute and stable coronary syndromes: pooled results from the SPIRIT (A Clinical Evaluation of the XIENCE V Everolimus Eluting Coronary Stent System) and COMPARE (A Trial of Everolimus-Eluting Stents and Paclitaxel-Eluting Stents for Coronary Revascularization in Daily Practice) Trials. JACC Cardiovasc Interv 2011;4(10):1104–1115
662. ParkKW, Kang SH, Velders MA, Shin DH, Hahn S, Lim WH, Yang HM, Lee HY, Van Boven AJ, Hofma SH, Kang HJ, Koo BK, Oh BH, Park YB, Kandzari DE, Kim HS Safety and efficacy of everolimus- vs. sirolimus-eluting stents: a systematic review and meta-analysis of 11 randomized trials. Am Heart J 2013;165(2):241–250 e4
663. HawnMT, Graham LA, Richman JS, Itani KM, HendersonWG, Maddox TM. Risk of major adverse cardiac events following noncardiac surgery in patients with coronary stents. JAMA 2013;310(14):1462–1472
664. Stone GW, Teirstein PS, Meredith IT, Farah B, Dubois CL, Feldman RL, Dens J, Hagiwara N, Allocco DJ, Dawkins KD. A prospective, randomized evaluation of a novel everolimus-eluting coronary stent: the PLATINUM (a Prospective, Randomized, Multicenter Trial to Assess an Everolimus-Eluting Coronary Stent System [PROMUS Element] for the Treatment of Up to Two de Novo Coronary Artery Lesions) trial. J Am Coll Cardiol 2011;57(16):1700–1708
665. von Birgelen C, Sen H, Lam MK, Danse PW, Jessurun GA, Hautvast RW, van Houwelingen GK, Schramm AR, Gin RM, Louwerenburg JW, de Man FH, Stoel MG, Lowik MM, Linssen GC, Said SA, Nienhuis MB, Verhorst PM, Basalus MW, Doggen CJ, Tandjung K. Third-generation zotarolimus-eluting and everolimus-eluting stents in all-comer patients requiring a percutaneous coronary intervention (DUTCH PEERS): a randomised, single-blind, multicentre, noninferiority trial. Lancet 2013;383(9915):413–423
666. von Birgelen C, Basalus MW, Tandjung K, van Houwelingen KG, Stoel MG, Louwerenburg JH, Linssen GC, Said SA, Kleijne MA, Sen H, Lowik MM, van der Palen J, Verhorst PM, de Man FH. A randomized controlled trial in secondgeneration zotarolimus-eluting Resolute stents vs. everolimus-eluting Xience V stents in real-world patients: the TWENTE trial. J Am Coll Cardiol 2012;59(15): 1350–1361
667. Kedhi E, Joesoef KS, McFadden E,Wassing J, van MieghemC, Goedhart D, Smits PC Second-generation everolimus-eluting and paclitaxel-eluting stents in real-life practice (COMPARE): a randomised trial. Lancet 2010;375(9710):201–209
668. Windecker S, Serruys PW, Wandel S, Buszman P, Trznadel S, Linke A, Lenk K, Ischinger T, Klauss V, Eberli F, Corti R, Wijns W, Morice MC, di Mario C, Davies S, van Geuns RJ, Eerdmans P, van Es GA, Meier B, Juni P. Biolimus-eluting stent with biodegradable polymer vs. sirolimus-eluting stent with durable polymer for coronary revascularisation (LEADERS): a randomised non-inferiority trial. Lancet 2008;372(9644):1163–1173
669. Natsuaki M, Kozuma K, Morimoto T, Kadota K, Muramatsu T, Nakagawa Y, Akasaka T, Igarashi K, Tanabe K, Morino Y, Ishikawa T, Nishikawa H, Awata M, Abe M, Okada H, Takatsu Y, Ogata N, Kimura K, Urasawa K, Tarutani Y,-Shiode N, Kimura T. Biodegradable polymer biolimus-eluting stent vs. durable polymer everolimus-eluting stent: a randomized, controlled, noninferiority trial. J Am Coll Cardiol 2013;62(3):181–190
670. Serruys PW, Garg S, Abizaid A, Ormiston J, Windecker S, Verheye S, Dubois C, Stewart J, Hauptmann KE, Schofer J, Stangl K, Witzenbichler B, Wiemer M, Barbato E, de Vries T, den Drijver AM, Otake H, Meredith L, Toyloy S, Fitzgerald P. A randomised comparison of novolimus-eluting and zotarolimuseluting coronary stents: 9-month follow-up results of the EXCELLA II study. Euro- Intervention 2010;6(2):195–205
671. Verheye S, Ramcharitar S, Grube E, Schofer JJ, Witzenbichler B, Kovac J, Hauptmann KE, Agostoni P, Wiemer M, Lefevre T, Spaargaren R, Serruys PW, Garcia-Garcia HM, van Geuns RJ. Six-month clinical and angiographic results of the STENTYS(R) self-apposing stent in bifurcation lesions. EuroIntervention 2011; 7(5):580–587
672. Verheye S, Agostoni P, Dubois CL, Dens J, Ormiston J, Worthley S, Trauthen B, Hasegawa T, Koo BK, Fitzgerald PJ, Mehran R, Lansky AJ. 9-month clinical, angiographic, and intravascular ultrasound results of a prospective evaluation of the Axxess self-expanding biolimus A9-eluting stent in coronary bifurcation lesions: the DIVERGE (Drug-Eluting Stent Intervention for Treating Side Branches Effectively) study. J Am Coll Cardiol 2009;53(12):1031–1039
673. Buysschaert I, Dubois CL, Dens J, Ormiston J, Worthley S, McClean D, Ottervanger JP, Meredith I, Uren N, Wijns W, Whitbourn R, Mehran R, Lansky AJ, Bichalska M, Meis S, Verheye S. Three-year clinical results of the Axxess Biolimus A9 eluting bifurcation stent system: the DIVERGE study. EuroIntervention 2013;9(5):573–581
674. Dani S, Costa RA, Joshi H, Shah J, Pandya R, Virmani R, Sheiban I, Bhatt S, Abizaid A First-in-human evaluation of the novel BioMime sirolimus-eluting coronary stent with bioabsorbable polymer for the treatment of single de novo lesions located in native coronary vessels - results from the meriT-1 trial. EuroIntervention 2013; 9(4):493–500
675. Haude M, Lee SW,Worthley SG, Silber S, Verheye S, Erbs S, Rosli MA, Botelho R, Meredith I, Sim KH, Stella PR, Tan HC, Whitbourn R, Thambar S, Abizaid A, Koh TH, Den Heijer P, Parise H, Cristea E, Maehara A, Mehran R. The REMEDEE trial: a randomized comparison of a combination sirolimus-eluting endothelial progenitor cell capture stent with a paclitaxel-eluting stent. JACC Cardiovasc Interv 2013; 6(4):334–343
676. Vranckx P, SerruysPW, Gambhir S, Sousa E, Abizaid A, Lemos P, Ribeiro E, Dani SI, Dalal JJ, Mehan V, Dhar A, Dutta AL, Reddy KN, Chand R, Ray A, Symons J Biodegradable-polymer-based, paclitaxel-eluting Infinnium stent: 9-Month clinical and angiographic follow-up results from the SIMPLE II prospective multi-centre registry study. EuroIntervention 2006;2(3):310–317
677. Ormiston J,Webster M, Stewart J, Vrolix M, Whitbourn R, Donohoe D, Knape C, Lansky A, Attizzani GF, Fitzgerald P, Kandzari DE, WijnsW. First-in-Human Evaluation of a Bioabsorbable Polymer-Coated Sirolimus-Eluting Stent: Imaging and Clinical Results of the DESSOLVE I Trial (DES With Sirolimus and a Bioabsorbable Polymer for the Treatment of Patients With De Novo Lesion in the Native Coronary Arteries). JACC Cardiovasc Interv 2013;6(10):1026–1034
678. Dani S, Kukreja N, Parikh P, Joshi H, Prajapati J, Jain S, Thanvi S, Shah B, Dutta JP Biodegradable-polymer-based, sirolimus-eluting Supralimus stent: 6-month angiographic, 30-month clinical follow-up results from the series I prospective study EuroIntervention 2008;4(1):59–63
679. Seth A, Chandra P, Chouhan NS, Thakkar AS. A first-in-man study of sirolimus-eluting, biodegradable polymer coated cobalt chromium stent in real life patients. Indian Heart J 2012;64(6):547–552
680. Meredith IT, Verheye S, Dubois CL, Dens J, Fajadet J, Carrie D, Walsh S, Oldroyd KG, Varenne O, El-Jack S, Moreno R, Joshi AA, Allocco DJ, Dawkins KD. Primary endpoint results of the EVOLVE trial: a randomized evaluation of a novel bioabsorbable polymer-coated, everolimus-eluting coronary stent. J Am Coll Cardiol 2012;59(15):1362–1370
681. Carrie D, Berland J, Verheye S, Hauptmann KE, Vrolix M, Violini R, Dibie A, Berti S, Maupas E, Antoniucci D, Schofer J. A multicenter randomized trial comparing amphilimus- with paclitaxel-eluting stents in de novo native coronary artery lesions. J Am Coll Cardiol 2012;59(15):1371–1376
682. Mehilli J, Kastrati A, Wessely R, Dibra A, Hausleiter J, Jaschke B, Dirschinger J, Schomig A. Randomized trial of a nonpolymer-based rapamycin-eluting stent vs a polymer-based paclitaxel-eluting stent for the reduction of late lumen loss. Circulation 2006;113(2):273–279
683. Byrne RA, Iijima R, Mehilli J, Pinieck S, Bruskina O, Schomig A, Kastrati A. Durability of antirestenotic efficacy in drug-eluting stents with and without permanent polymer. JACC Cardiovasc Interv 2009;2(4):291–299
684. Garg S, Bourantas C, SerruysPW. New concepts in the design of drug-eluting coronary stents. Nat Rev Cardiol 2013;10(5):248–260
685. Ormiston JA, SerruysPW, Regar E, Dudek D, Thuesen L,WebsterMW, Onuma Y, Garcia-Garcia HM, McGreevy R, Veldhof S. A bioabsorbable everolimus-eluting coronary stent system for patients with single de-novo coronary artery lesions (ABSORB): a prospective open-label trial. Lancet 2008;371(9616):899–907
686. Serruys PW, Ormiston JA, Onuma Y, Regar E, Gonzalo N, Garcia-Garcia HM, Nieman K, Bruining N, Dorange C, Miquel-Hebert K, Veldhof S, Webster M, Thuesen L, Dudek D. A bioabsorbable everolimus-eluting coronary stent system-(ABSORB): 2-year outcomes and results from multiple imaging methods. Lancet 2009;373(9667):897–910
687. Haude M, Erbel R, Erne P, Verheye S, Degen H, Bose D, Vermeersch P, Wijnbergen I,Weissman N, Prati F,Waksman R, Koolen J. Safety and performance of the drug-eluting absorbable metal scaffold (DREAMS) in patients with de-novo coronary lesions: 12 month results of the prospective, multicentre, first-in-man BIOSOLVE-I trial. Lancet 2013;381(9869):836–844
688. Verheye S, Ormiston JA, Stewart J, Webster M, Sanidas E, Costa R, Costa JR Jr., Chamie D, Abizaid AS, Pinto I, Morrison L, Toyloy S, Bhat V, Yan J, Abizaid A. A Next-Generation Bioresorbable Coronary Scaffold System-From Bench to First Clinical Evaluation: Six- and 12-Month Clinical and Multimodality Imaging Results. JACC Cardiovasc Interv 2013;7(1):89–99
689. Maier LS, Maack C, Ritter O, Bohm M. Hotline update of clinical trials and registries presented at theGerman Cardiac Society meeting 2008. (PEPCAD,LokalTax, INH, German ablation registry, German device registry, DES.DE registry, DHR, Reality, SWEETHEART registry, ADMA, GERSHWIN). Clin Res Cardiol 2008;97(6): 356–363
690. Fischer D, Scheller B, Schafer A, Klein G,Bohm M, CleverY, Cremers B. Paclitaxcelcoated balloon plus bare metal stent vs. sirolimus-eluting stent in de novo lesions: an IVUS study. EuroIntervention 2012;8(4):450–455
691. Belkacemi A, Agostoni P, Nathoe HM, Voskuil M, Shao C, Van Belle E, Wildbergh T, Politi L, Doevendans PA, SangiorgiGM, Stella PR. First results of the DEB-AMI (drug eluting balloon in acute ST-segment elevation myocardial infarction) trial: a multicenter randomized comparison of drug-eluting balloon plus bare-metal stent vs bare-metal stent vs. drug-eluting stent in primary percutaneous coronary intervention with 6-month angiographic, intravascular, functional, and clinical outcomes. J Am Coll Cardiol 2012;59(25):2327–2337
692. Latib A, Colombo A, Castriota F, Micari A, Cremonesi A, De Felice F, Marchese A, Tespili M, Presbitero P, Sgueglia GA, Buffoli F, Tamburino C, Varbella F, Menozzi A Arandomized multicenter study comparing a paclitaxel drug-eluting balloon with a paclitaxel-eluting stent in small coronary vessels: the BELLO (Balloon Elution and Late Loss Optimization) study. J Am Coll Cardiol 2012;60(24):2473–2480
693. Bondesson P, Lagerqvist B, James SK, Olivecrona GK, Venetsanos D, Harnek J Comparison of two drug-eluting balloons: a report from the SCAAR registry. Euro- Intervention 2012;8(4):444–449
694. Stella PR, Belkacemi A,Waksman R, Stahnke S, Torguson R, von Strandmann RP, Agostoni P, Sangiorgi G, Silber S. The Valentines Trial: results of the first one week worldwide multicentre enrolment trial, evaluating the real world usage of the second generation DIORpaclitaxel drug-eluting balloon for in-stent restenosis treatment. EuroIntervention 2011;7(6):705–710
695. Waksman R, Serra A, Loh JP, Malik FT, Torguson R, Stahnke S, von Strandmann RP, Rodriguez AE. Drug-coated balloons for de novo coronary lesions: results from the Valentines II trial. EuroIntervention 2013;9(5):613–619
696. Gutierrez-Chico JL, van Geuns RJ, Koch KT, Koolen JJ, Duckers H, Regar E, Serruys PW. Paclitaxel-coated balloon in combination with bare metal stent for treatment of de novo coronary lesions: an optical coherence tomography-first-in-human randomised trial, balloon first vs. stent first. EuroIntervention 2011; 7(6):711–722
697. Hehrlein C, Dietz U, Kubica J, Jorgensen E, Hoffmann E, Naber C, Lesiak M, Schneider H, Wiemer M, Tolg R, Richardt G. Twelve-month results of a paclitaxel releasing balloon in patients presenting with in-stent restenosis First-in-Man (PEPPER) trial. Cardiovasc Revasc Med 2012;13(5):260–264
698. Abdel-Wahab M, Richardt G, Joachim Buttner H, Toelg R, Geist V, Meinertz T, Schofer J, King L, Neumann FJ, Khattab AA. High-speed rotational atherectomy before paclitaxel-eluting stent implantation in complex calcified coronary lesions: the randomized ROTAXUS (Rotational Atherectomy Prior to Taxus Stent Treatment for Complex Native Coronary Artery Disease) trial. JACC Cardiovasc Interv 2013;6(1):10–19
699. Mintz GS, Nissen SE, Anderson WD, Bailey SR, Erbel R, Fitzgerald PJ, Pinto FJ, Rosenfield K, Siegel RJ, Tuzcu EM, Yock PG. American College of Cardiology Clinical Expert Consensus Document on Standards for Acquisition, Measurement, Reporting of Intravascular Ultrasound Studies (IVUS). A report of the American College of Cardiology Task Force on Clinical Expert Consensus Documents. J Am Coll Cardiol 2001;37(5):1478–1492
700. Nissen SE, Tuzcu EM, Schoenhagen P, Crowe T, Sasiela WJ, Tsai J, Orazem J, Magorien RD, O’Shaughnessy C, Ganz P, Reversal of Atherosclerosis with Aggressive Lipid Lowering I. Statin therapy, LDL cholesterol, C-reactive protein, and coronary artery disease. N Engl J Med 2005;352(1):29–38
701. Mintz GS, Garcia-Garcia HM, Nicholls SJ, Weissman NJ, Bruining N, Crowe T, Tardif JC, SerruysPW. Clinical expert consensus document on standards for acquisition, measurement and reporting of intravascular ultrasound regression/progression studies. EuroIntervention 2011;6(9):1123–1130, 9
702. Casella G, Klauss V, Ottani F, Siebert U, Sangiorgio P, Bracchetti D. Impact of intravascular ultrasound-guided stenting on long-term clinical outcome: a meta-analysis of available studies comparing intravascular ultrasound-guided and angiographically guided stenting. Catheter Cardiovasc Interv 2003;59(3):314–321
703. Parise H, Maehara A, StoneGW, Leon MB, Mintz GS. Meta-analysis of randomized studies comparing intravascular ultrasound vs. angiographic guidance of percutaneous coronary intervention in pre-drug-eluting stent era. Am J Cardiol 2011;107(3): 374–382
704. Zhang Y, Farooq V, Garcia-Garcia HM, Bourantas CV, Tian N, Dong S, Li M, Yang S, Serruys PW, Chen SL. Comparison of intravascular ultrasound vs. angiographyguided drug-eluting stent implantation: a meta-analysis of one randomised trial and ten observational studies involving 19,619 patients. EuroIntervention 2012; 8(7):855–865
705. Park SJ, Kim YH, Park DW, Lee SW, Kim WJ, Suh J, Yun SC, Lee CW, Hong MK, Lee JH, ParkSW. Impact of intravascular ultrasound guidance on long-termmortality in stenting for unprotected left main coronary artery stenosis. Circ Cardiovasc Interv 2009;2(3):167–177
706. Witzenbichler B, Maehara A, Weisz G, Neumann FJ, Rinaldi MJ, Metzger DC, Henry TD, Cox DA, Duffy PL, Brodie BR, Stuckey TD, Mazzaferri EL Jr., Xu K, Parise H, Mehran R, Mintz GS, Stone GW. Relationship Between Intravascular Ultrasound Guidance and Clinical Outcomes After Drug-Eluting Stents: The Assessment of Dual Antiplatelet Therapy With Drug-Eluting Stents (ADAPT-DES) Study. Circulation 2014;129(4):463–470
707. Tearney GJ, Regar E, Akasaka T, Adriaenssens T, Barlis P, Bezerra HG, Bouma B, Bruining N, Cho JM, Chowdhary S, Costa MA, de Silva R, Dijkstra J, Di Mario C, Dudek D, Falk E, Feldman MD, Fitzgerald P, Garcia-Garcia HM, Gonzalo N, Granada JF, Guagliumi G, Holm NR, Honda Y, Ikeno F, Kawasaki M, Kochman J, Koltowski L, Kubo T, Kume T, Kyono H, Lam CC, Lamouche G, Lee DP, Leon MB, Maehara A, Manfrini O, Mintz GS, Mizuno K, Morel MA, Nadkarni S, Okura H, Otake H, Pietrasik A, Prati F, Raber L, Radu MD, Rieber J, Riga M, Rollins A, Rosenberg M, Sirbu V, Serruys PW, Shimada K, Shinke T, Shite J, Siegel E, Sonoda S, Suter M, Takarada S, Tanaka A, Terashima M, Thim T,-Uemura S, Ughi GJ, van Beusekom HM, van der Steen AF, van Es GA, van Soest G, Virmani R, Waxman S, Weissman NJ, Weisz G, International Working Groupfor Intravascular Optical CoherenceT. Consensus standards for acquisition,-measurement, and reporting of intravascular optical coherence tomography studies: a report from the InternationalWorking Group for Intravascular Optical Coherence Tomography Standardization and Validation. J Am Coll Cardiol 2012; 59(12):1058–1072
708. Cassar A, MatsuoY, Herrmann J, Li J, Lennon RJ, Gulati R, Lerman LO, Kushwaha SS, Lerman A. Coronary atherosclerosis with vulnerable plaque and complicated lesions in transplant recipients: new insight into cardiac allograft vasculopathy by optical coherence tomography. Eur Heart J 2013;34(33):2610–2617
709. Prati F, Guagliumi G, Mintz GS, Costa M, Regar E, Akasaka T, Barlis P, Tearney GJ, Jang IK, Arbustini E, Bezerra HG, Ozaki Y, Bruining N, Dudek D, Radu M, Erglis A, Motreff P, Alfonso F, Toutouzas K, Gonzalo N, Tamburino C, Adriaenssens T, Pinto F, Serruys PW, Di Mario C. Expert review document part 2: methodology, terminology and clinical applications of optical coherence tomography for the assessment of interventional procedures. Eur Heart J 2012;33(20):2513–2520
710. Radu MD, Raber L, Heo J, Gogas BD, Jorgensen E, Kelbaek H, Muramatsu T, Farooq V, Helqvist S, Garcia-Garcia HM, Windecker S, Saunamaki K, Serruys PW. Natural history of optical coherence tomography-detected non-flow-limiting edge dissections following drug-eluting stent implantation. Euro- Intervention 2014;9(9):1085–1094
711. Prati F, Di Vito L, Biondi-Zoccai G, Occhipinti M, La Manna A, Tamburino C, Burzotta F, Trani C, Porto I, Ramazzotti V, Imola F, Manzoli A, Materia L, Cremonesi A, Albertucci M. Angiography alone vs. angiography plus optical coherence tomography to guide decision-making during percutaneous coronary intervention: the Centro per la Lotta contro l’Infarto-Optimisation of Percutaneous Coronary Intervention (CLI-OPCI) study. EuroIntervention 2012;8(7):823–829
712. Kang SJ, Mintz GS, Akasaka T, ParkDW, Lee JY, Kim WJ, Lee SW, Kim YH, Whan Lee C, Park SW, Park SJ. Optical coherence tomographic analysis of in-stent neoatherosclerosis after drug-eluting stent implantation. Circulation 2011; 123(25):2954–2963
713. Pijls NH, De Bruyne B, Peels K, Van Der Voort PH, Bonnier HJ, Bartunek JKJJ, Koolen JJ. Measurement of fractional flow reserve to assess the functional severity of coronary-artery stenoses. N Engl J Med 1996;334(26):1703–1708
714. Sen S, Escaned J, Malik IS, MikhailGW, Foale RA, Mila R, Tarkin J, Petraco R, Broyd C, Jabbour R, Sethi A, Baker CS, Bellamy M, Al-Bustami M, Hackett D, Khan M, Lefroy D, Parker KH, Hughes AD, Francis DP, Di Mario C, Mayet J, Davies JE. Development and validation of a new adenosine-independent index of stenosis severity from coronary wave-intensity analysis: results of the ADVISE (ADenosine Vasodilator Independent Stenosis Evaluation) study. J Am Coll Cardiol 2012; 59(15):1392–1402
715. Nakazato R, Park HB, Berman DS, Gransar H, Koo BK, Erglis A, Lin FY,DunningAM, Budoff MJ, Malpeso J, Leipsic J, Min JK. Non-invasive Fractional Flow Reserve Derived from CT Angiography (FFRCT) for Coronary Lesions of Intermediate Stenosis Severity: Results from the DeFACTO study. Circ Cardiovasc Imaging 2013;6(6):881–889
716. Koo BK, Erglis A, Doh JH, Daniels DV, Jegere S, Kim HS, Dunning A, DeFrance T, Lansky A, Leipsic J, Min JK. Diagnosis of ischemia-causing coronary stenoses by noninvasive fractional flow reserve computed from coronary computed tomographic angiograms. Results from the prospective multicenter DISCOVER-FLOW (Diagnosis of Ischemia-Causing Stenoses Obtained Via Noninvasive Fractional Flow Reserve) study. J Am Coll Cardiol 2011;58(19):1989–1997
717. Patel Y, Depta JP, Novak E, Yeung M, Lavine K, Banerjee S, Lin CH, Zajarias A, Kurz HI, Lasala JM, Bach RG, Singh J. Long-term outcomes with use of intravascular ultrasound for the treatment of coronary bifurcation lesions. Am J Cardiol 2012; 109(7):960–965
718. Myler RK, Shaw RE, Stertzer SH, Hecht HS, Ryan C, Rosenblum J, Cumberland DC, Murphy MC, Hansell HN, Hidalgo B. Lesion morphology and coronary angioplasty: current experience and analysis. J Am Coll Cardiol 1992;19(7):1641–1652
719. Steigen TK, Maeng M, Wiseth R, Erglis A, Kumsars I, Narbute I, Gunnes P, Mannsverk J, Meyerdierks O, Rotevatn S, Niemela M, Kervinen K, Jensen JS, Galloe A, Nikus K, Vikman S, Ravkilde J, James S, Aaroe J, Ylitalo A, Helqvist S,-Sjogren I, Thayssen P, Virtanen K, Puhakka M, Airaksinen J, Lassen JF, Thuesen L Randomized study on simple vs. complex stenting of coronary artery bifurcation lesions: the Nordic bifurcation study. Circulation 2006;114(18):1955–1961
720. Latib A, Colombo A. Bifurcation disease: what do we know, what should we do? JACC Cardiovasc Interv 2008;1(3):218–226
721. Al Suwaidi J, YehW, Cohen HA, DetreKM, WilliamsDO,HolmesDRJr. Immediate and one-year outcome in patients with coronary bifurcation lesions in the modern era (NHLBI dynamic registry). Am J Cardiol 2001;87(10):1139–1144
722. Stinis CT, Hu SP, Price MJ, Teirstein PS. Three-year outcome of drug-eluting stent implantation for coronary artery bifurcation lesions. Catheter Cardiovasc Interv 2010; 75(3):309–314
723. Iakovou I, Schmidt T, Bonizzoni E, Ge L, Sangiorgi GM, Stankovic G, Airoldi F, Chieffo A, Montorfano M, Carlino M, Michev I, Corvaja N, Briguori C, Gerckens U, Grube E, Colombo A. Incidence, predictors, and outcome of thrombosis after successful implantation of drug-eluting stents. JAMA 2005;293(17): 2126–2130
724. Colombo A, Moses JW, Morice MC, Ludwig J, Holmes DR Jr., Spanos V, Louvard Y, Desmedt B, Di Mario C, Leon MB. Randomized study to evaluate sirolimus-eluting stents implanted at coronary bifurcation lesions. Circulation 2004;109(10): 1244–1249
725. Iakovou I, Ge L, Colombo A. Contemporary stent treatment of coronary bifurcations J Am Coll Cardiol 2005;46(8):1446–1455
726. Maeng M, Holm NR, Erglis A, Kumsars I, Niemela M, Kervinen K, Jensen JS, Galloe A, Steigen TK, Wiseth R, Narbute I, Gunnes P, Mannsverk J, Meyerdierks O, Rotevatn S, Nikus K, Vikman S, Ravkilde J, James S, Aaroe J, Ylitalo A, Helqvist S, Sjogren I, Thayssen P, Virtanen K, Puhakka M, Airaksinen J, Christiansen EH, Lassen JF, Thuesen L. Long-term results after simple vs. complex stenting of coronary artery bifurcation lesions: Nordic Bifurcation Study 5-year follow-up results. J Am Coll Cardiol 2013;62(1):30–34
727. Ferenc M, Gick M, Kienzle RP, Bestehorn HP,Werner KD, Comberg T, Zhao M, Buettner HJ, Neumann FJ. Long-term outcome of percutaneous catheter intervention for de novo coronary bifurcation lesions with drug-eluting stents or-bare-metal stents. Am Heart J 2010;159(3):454–461
728. Hildick-Smith D, de Belder AJ, Cooter N, Curzen NP, Clayton TC, Oldroyd KG, Bennett L, Holmberg S, Cotton JM, Glennon PE, Thomas MR, Maccarthy PA, Baumbach A, Mulvihill NT, Henderson RA, Redwood SR, Starkey IR, Stables RH Randomized trial of simple vs. complex drug-eluting stenting for bifurcation lesions: the British Bifurcation Coronary Study: old, new, and evolving strategies Circulation 2010;121(10):1235–1243
729. BehanMW, Holm NR, Curzen NP, Erglis A, Stables RH, de Belder AJ, Niemela M, Cooter N, Chew DP, Steigen TK, Oldroyd KG, Jensen JS, Lassen JF, Thuesen L, Hildick-Smith D. Simple or complex stenting for bifurcation coronary lesions: a patient-level pooled-analysis of the Nordic Bifurcation Study and the British Bifurcation Coronary Study. Circ Cardiovasc Interv 2011;4(1):57–64
730. Chen SL, SantosoT, Zhang JJ,YeF,XuYW, FuQ, Kan J, Paiboon C,ZhouY, Ding SQ, Kwan TW. A randomized clinical study comparing double kissing crush with provisional stenting for treatment of coronary bifurcation lesions: results from the DKCRUSH-II (Double Kissing Crush vs. Provisional Stenting Technique for Treatment of Coronary Bifurcation Lesions) trial. J Am Coll Cardiol 2011;57(8):914–920
731. Assali AR, Vaknin-Assa H, Lev E, Teplitsky I, Dvir D, Brosh D, Bental T, Battler A, Kornowski R. Drug eluting stenting in bifurcation coronary lesions long-term results applying a systematic treatment strategy. Catheter Cardiovasc Interv 2012; 79(4):615–622
732. Song YB, Hahn JY, Song PS, Yang JH, Choi JH, Choi SH, Lee SH, Gwon HC. Randomized comparison of conservative vs. aggressive strategy for provisional side branch intervention in coronary bifurcation lesions: results from the SMARTSTRATEGY (Smart Angioplasty Research Team-Optimal Strategy for Side Branch Intervention in Coronary Bifurcation Lesions) randomized trial. JACC Cardiovasc Interv 2012;5(11):1133–1140
733. Niemela M, Kervinen K, Erglis A, Holm NR, Maeng M, Christiansen EH, Kumsars I, Jegere S, Dombrovskis A, Gunnes P, Stavnes S, Steigen TK, Trovik T, Eskola M, Vikman S, Romppanen H, Makikallio T, Hansen KN, Thayssen P, Aberge L, Jensen LO, Hervold A, Airaksinen J, Pietila M, Frobert O, Kellerth T, Ravkilde J, Aaroe J, Jensen JS, Helqvist S, Sjogren I, James S, Miettinen H, Lassen JF, Thuesen L. Randomized comparison of final kissing balloon dilatation vs. no final kissing balloon dilatation in patients with coronary bifurcation lesions treated with main vessel stenting: the Nordic-Baltic Bifurcation Study III. Circulation 2011; 123(1):79–86
734. GwonHC,Hahn JY,KooBK, Song YB,Choi SH, Choi JH, Lee SH, JeongMH,Kim HS, SeongIW, Yang JY, RhaSW, Jang Y, Yoon JH, Tahk SJ, Seung KB, Park SJ. Final kissing ballooning and long-termclinical outcomes in coronary bifurcation lesions treated with 1-stent technique: results from the COBIS registry. Heart 2012;98(3): 225–231
735. Mylotte D, Meftout B, Moynagh A, Vaquerizo B, Darremont O, Silvestri M, Louvard Y, Leymarie JL, Morice MC, Lefevre T, Garot P. Unprotected left main stenting in the real world: five-year outcomes of the French Left Main Taxus registry EuroIntervention 2012;8(8):970–981
736. Teirstein PS, Price MJ. Left main percutaneous coronary intervention. J Am Coll Cardiol 2012;60(17):1605–1613
737. Chen SL, Zhang Y, Xu B, Ye F, Zhang J, Tian N, Liu Z, Qian X, Ding S, Li F, Zhang A, Liu Y, Lin S. Five-year clinical follow-up of unprotected left main bifurcation lesion stenting: one-stent vs. two-stent techniques vs. double-kissing crush technique EuroIntervention 2012;8(7):803–14
738. Di Mario C, Werner GS, Sianos G, Galassi AR, Buttner J, Dudek D, Chevalier B, Lefevre T, Schofer J, Koolen J, Sievert H, Reimers B, Fajadet J, Colombo A, Gershlick A, Serruys PW, Reifart N. European perspective in the recanalisation of Chronic Total Occlusions (CTO): consensus document from the EuroCTO Club. EuroIntervention 2007;3(1):30–43
739. Christofferson RD, Lehmann KG, Martin GV, Every N, Caldwell JH, Kapadia SR Effect of chronic total coronary occlusion on treatment strategy. Am J Cardiol 2005;95(9):1088–1091
740. Claessen BE, Dangas GD, Godino C, Lee SW, Obunai K, Carlino M, Suh JW, Leon MB, Di Mario C, Park SJ, StoneGW, Moses JW, Colombo A, Mehran R. Longterm clinical outcomes of percutaneous coronary intervention for chronic total occlusions in patients with vs. without diabetes mellitus. Am J Cardiol 2011; 108(7):924–931
741. Mehran R, Claessen BE, Godino C, Dangas GD, Obunai K, Kanwal S, Carlino M, Henriques JP, Di Mario C, Kim YH, Park SJ, Stone GW, Leon MB, Moses JW, Colombo A. Long-term outcome of percutaneous coronary intervention for-chronic total occlusions. JACC Cardiovasc Interv 2011;4(9):952–961
742. Jones DA, Weerackody R, Rathod K, Behar J, Gallagher S, Knight CJ, Kapur A, Jain AK, Rothman MT, Thompson CA, Mathur A, Wragg A, Smith EJ. Successful recanalization of chronic total occlusions is associated with improved long-term survival. JACC Cardiovasc Interv 2012;5(4):380–388
743. Joyal D, Afilalo J, Rinfret S. Effectiveness of recanalization of chronic total occlusions: a systematic review and meta-analysis. Am Heart J 2010;160(1):179–187
744. Hannan EL, Racz M, Holmes DR, King SB 3rd,Walford G, Ambrose JA, Sharma S, Katz S, Clark LT, Jones RH. Impact of completeness of percutaneous coronary intervention revascularization on long-term outcomes in the stent era. Circulation 2006;113(20):2406–2412
745. Grantham JA, Jones PG, Cannon L, Spertus JA. Quantifying the early health status benefits of successful chronic total occlusion recanalization: Results from the Flow- Cardia’s Approach to Chronic Total Occlusion Recanalization (FACTOR) Trial Circ Cardiovasc Qual Outcomes 2010;3(3):284–290
746. Werner GS, Hochadel M, Zeymer U, Kerber S, Schumacher B, Grube E, Hauptmann KE, Brueck M, Zahn R, Senges J. Contemporary success and complication rates of percutaneous coronary intervention for chronic total coronary occlusions: results from the ALKK quality control registry of 2006. EuroIntervention 2010; 6(3):361–366
747. Fefer P, Knudtson ML, Cheema AN, Galbraith PD, Osherov AB, Yalonetsky S, Gannot S, Samuel M, Weisbrod M, Bierstone D, Sparkes JD, Wright GA, Strauss BH. Current perspectives on coronary chronic total occlusions: the Canadian-Multicenter Chronic Total Occlusions Registry. J Am Coll Cardiol 2012; 59(11):991–997
748. Morino Y, Kimura T, Hayashi Y, Muramatsu T, Ochiai M, Noguchi Y, Kato K, Shibata Y, Hiasa Y, Doi O, Yamashita T, Morimoto T, Abe M, Hinohara T, Mitsudo K. In-hospital outcomes of contemporary percutaneous coronary intervention in patients with chronic total occlusion insights from the J-CTO Registry (Multicenter CTO Registry in Japan). JACC Cardiovasc Interv 2010;3(2):143–151
749. Surmely JF, Tsuchikane E, Katoh O, Nishida Y, Nakayama M, Nakamura S, Oida A, Hattori E, Suzuki T. New concept for CTO recanalization using controlled antegrade and retrograde subintimal tracking: the CART technique. J Invasive Cardiol 2006;18(7):334–338
750. Sianos G, Barlis P, Di Mario C, Papafaklis MI, Buttner J, Galassi AR, Schofer J, Werner G, Lefevre T, Louvard Y, Serruys PW, Reifart N. European experience with the retrograde approach for the recanalisation of coronary artery chronic-total occlusions. A report on behalf of the euroCTO club. EuroIntervention 2008; 4(1):84–92
751. Colmenarez HJ, Escaned J, Fernandez C, Lobo L, Cano S, del Angel JG, Alfonso F, Jimenez P, Banuelos C, Gonzalo N, Garcia E, Hernandez R, Macaya C. Efficacy and safety of drug-eluting stents in chronic total coronary occlusion recanalization: a systematic review and meta-analysis. J Am Coll Cardiol 2010;55(17):1854–1866
752. Saeed B, Kandzari DE, Agostoni P, LombardiWL,Rangan BV, Banerjee S, Brilakis ES Use of drug-eluting stents for chronic total occlusions: a systematic review and meta-analysis. Catheter Cardiovasc Interv 2011;77(3):315–332
753. Van den Branden BJ, Rahel BM, Laarman GJ, Slagboom T, Kelder JC, Ten Berg JM, Suttorp MJ. Five-year clinical outcome after primary stenting of totally occluded native coronary arteries: a randomised comparison of bare metal stent implantation with sirolimus-eluting stent implantation for the treatment of total coronary occlusions (PRISON II study). EuroIntervention 2012;7(10):1189–1196
754. Patel MR, Marso SP, Dai D, Anstrom KJ, Shunk KA, Curtus JP, Brennan JM, Sedrakyan A, Messenger JC, Douglas PS. Comparative effectiveness of drug-eluting vs. bare-metal stents in elderly patients undergoing revascularization of chronic total coronary occlusions: results from the National Cardiovascular Data Registry, 2005–2008. JACC Cardiovasc Interv 2012;5(10):1054–1061
755. Jokhi P, Curzen N. Percutaneous coronary intervention of ostial lesions. EuroIntervention 2009;5(4):511–514
756. Pritchard CL, Mudd JG, Barner HB. Coronary ostial stenosis. Circulation 1975;52(1): 46–48
757. Thompson R. Isolated coronary ostial stenosis in women. J Am Coll Cardiol 1986; 7(5):997–1003
758. Miller GA, Honey M, el-Sayed H. Isolated coronary ostial stenosis. Cathet Cardiovasc Diagn 1986;12(1):30–34
759. Rissanen V. Occurrence of coronary ostial stenosis in a necropsy series of myocardial infarction, sudden death, and violent death. Br Heart J 1975;37(2):182–191
760. Popma JJ, Dick RJ, Haudenschild CC, Topol EJ, Ellis SG. Atherectomy of right coronary ostial stenoses: initial and long-term results, technical features and histologic findings. Am J Cardiol 1991;67(5):431–433
761. Koh JS, Koo BK, Kim JH, Yang HM, ParkKW, Kang HJ, Kim HS, Oh BH, Park YB. Relationship between fractionalflowreserve and angiographic and intravascular ultrasound parameters in ostial lesions: major epicardial vessel vs. side branch ostial lesions. JACC Cardiovasc Interv 2012;5(4):409–415
762. Muramatsu T, Tsukahara R, Ho M, Ito S, Inoue T, Akimoto T, Hirano K. Efficacy of cutting balloon angioplasty for lesions at the ostium of the coronary arteries. J Invasive Cardiol 1999;11(4):201–206
763. Kurbaan AS, Kelly PA, Sigwart U. Cutting balloon angioplasty and stenting for aorto-ostial lesions. Heart 1997;77(4):350–352
764. Chung CM, Nakamura S, Tanaka K, Tanigawa J, Kitano K, Akiyama T, Matoba Y, Katoh O. Comparison of cutting balloon vs. stenting alone in small branch ostial lesions of native coronary arteries. Circ J 2003;67(1):21–25
765. Popma JJ, BroganWC3rd, Pichard AD, Satler LF, Kent KM, Mintz GS, Leon MB. Rotational coronary atherectomy of ostial stenoses. Am J Cardiol 1993;71(5): 436–438
766. Schwartz L, Morsi A. The draw-back stent deployment technique: a strategy for the treatment of coronary branch ostial lesions. J Invasive Cardiol 2002;14(2):66–71
767. Szabo S, Abramowitz B, Vaitkus P. New technique of aorto-ostial stent placement Am J Cardiol 2005;96:p212H
768. Gutierrez-Chico JL, Villanueva-Benito I, Villanueva-Montoto L, Vazquez- Fernandez S, Kleinecke C, Gielen S, Iniguez-Romo A. Szabo technique vs. conventional angiographic placement in bifurcations 010–001 of Medina and in-aorto-ostial stenting: angiographic and procedural results. EuroIntervention 2010; 5(7):801–808
769. Park DW, Hong MK, Suh IW, Hwang ES, Lee SW, Jeong YH, Kim YH, Lee CW, Kim JJ, ParkSW, Park SJ. Results and predictors of angiographic restenosis and longterm adverse cardiac events after drug-eluting stent implantation for aorto-ostial coronary artery disease. Am J Cardiol 2007;99(6):760–765
770. Al-Lamee R, Ielasi A, Latib A, Godino C, Mussardo M, Arioli F, Figin F, Piraino D, Carlino M, Montorfano M, Chieffo A, Colombo A. Comparison of long-term clinical and angiographic outcomes following implantation of bare metal stents and drug-eluting stents in aorto-ostial lesions. Am J Cardiol 2011;108(8):1055–1060
771. Iakovou I, Ge L, Michev I, Sangiorgi GM, Montorfano M, Airoldi F, Chieffo A, Stankovic G, Vitrella G, Carlino M, Corvaja N, Briguori C, Colombo A. Clinical and angiographic outcome after sirolimus-eluting stent implantation in aorto-ostial lesions. J Am Coll Cardiol 2004;44(5):967–971
772. Lee SW, Kim SH, Kim SO, Han S, Kim YH, Park DW, Kang SJ, Lee CW, Park SW, Park SJ. Comparative long-term efficacy and safety of drug-eluting stent vs. coronary artery bypass grafting in ostial left main coronary artery disease: analysis of the MAIN-COMPARE registry. Catheter Cardiovasc Interv 2012;80(2):206–212
773. Silber S, Albertsson P, Aviles FF, Camici PG, Colombo A, Hamm C, Jorgensen E, Marco J, Nordrehaug JE, Ruzyllo W, Urban P, Stone GW, Wijns W. Guidelines for percutaneous coronary interventions. The task force for percutaneous coronary interventions of the European Society of Cardiology. Eur Heart J 2005;26: 804–847
774. Patrono C, Andreotti F, Arnesen H, Badimon L, Baigent C, Collet JP, De Caterina R, Gulba D, Huber K, Husted S, Kristensen SD, Morais J, Neumann FJ, Rasmussen LH, Siegbahn A, Steg PG, StoreyRF, Van deWerf F, FV. Antiplatelet agents for the treatment and prevention of atherothrombosis. Eur Heart J 2011;32(23):2922–2932
775. Patrono C, Rodriguez LA, Landolfi R, Baigent C. Low-Dose Aspirin for the Prevention of Atherothrombosis. N Eng J Med. 2005;353:2373–2383
776. Antiplatelet tc. Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ 2002;324:71–86
777. Bellemain-Appaix A, O’Connor SA, Silvain J, Cucherat M, Beygui F, Barthe´le´my O, Collet JP, Jacq L, Bernasconi F, Montalescot G. Association of Clopidogrel Pretreatment With Mortality, Cardiovascular Events, and Major Bleeding Among Patients Undergoing Percutaneous Coronary Intervention: A Systematic Review and Meta-analysis. JAMA 2012;308(23):2507–2516
778. Price MJ, Berger PB, Teirstein PS, Tanguay JF, Angiolillo DJ, Spriggs D, Puri S, Robbins M, Garratt KN, Bertrand OF, Stillablower ME, Aragon JR, Kandzari DE, StinisCT, Lee MS, Manoukian SV, CannonCP, Schork NJ, Topol EJ, for GI. Standardvs high-dose clopidogrel based on platelet function testing after percutaneous coronary intervention: the GRAVITAS randomized trial. JAMA 2011;305(11): 1097–1105
779. Grines CL, Bonow RO, Casey DE Jr., Gardner TJ, Lockhart PB, Moliterno DJ, O’Gara P, Whitlow P, American Heart A, American College of C, Society for Cardiovascular A, Interventions, American College of S, American Dental A, American College of P. Prevention of premature discontinuation of dual antiplatelet therapy in patients with coronary artery stents: a science advisory from the American Heart Association, American College of Cardiology, Society for Cardiovascular Angiography and Interventions, American College of Surgeons, and American Dental Association, with representation from the American College of Physicians. Circulation 2007;115:813–818
780. Valgimigli M, Percoco G, Barbieri D, Ferrari F, Guardigli G, Parrinello G, Soukhomovskaia O, Ferrari R. The additive value of tirofiban administered with the high-dose bolus in the prevention of ischemic complications during high-risk coronary angioplasty: the ADVANCE Trial. J Am Coll Cardiol 2004;44(1):14–19
781. Biondi-Zoccai G, Valgimigli M, Margheri M, Marzocchi A, Lettieri C, Stabile A, Petronio AS, Binetti G, Bolognese L, Bellone P, Sardella G, Contarini M, Sheiban I, Marra S, Piscione F, Romeo F, Colombo A, Sangiorgi G. Assessing the role of eptifibatide in patients with diffuse coronary disease undergoing drug-eluting stenting: the INtegrilin plus STenting to Avoid myocardial Necrosis Trial. Am Heart J 2012;163(5):835.e1–e7
782. Kastrati A, Mehilli J, Schuhlen H, Dirschinger J, Dotzer F, ten Berg JM, Neumann FJ, Bollwein H, Volmer C, Gawaz M, Berger PB, Schomig A, Intracoronary S, Antithrombotic Regimen-Rapid Early Action for Coronary Treatment Study I. A clinical trial of abciximab in elective percutaneous coronary intervention after pretreatment with clopidogrel. N Engl J Med 2004;350(3):232–238
783. Lincoff AM, Kleiman NS, Kereiakes DJ, Feit F, Bittl JA, Jackman JD, Sarembock IJ, Cohen DJ, Spriggs D, Ebrahimi R, Keren G, Carr J, Cohen EA, Betriu A, DesmetW, RutschW, Wilcox RG, de Feyter PJ, Vahanian A, Topol EJ. Long-term efficacy of bivalirudin and provisional glycoprotein IIb/IIIa blockade vs.heparin and planned glycoprotein IIb/IIIa blockade during percutaneous coronary revascularization: REPLACE-2 randomized trial. JAMA 2004;292(6):696–703
784. Kastrati A, Neumann FJ, Mehilli J, Byrne RA, Iijima R, Buttner HJ, Khattab AA, Schulz S, Blankenship JC, Pache J, Minners J, Seyfarth M, Graf I, Skelding KA, Dirschinger J, Richardt G, Berger PB, Schomig A, Investigators I-RT. Bivalirudin vs. unfractionated heparin during percutaneous coronary intervention. N Engl J Med 2008;359(7):688–696
785. Ndrepepa G, Schulz S, Keta D, Mehilli J, Birkmeier A, Massberg S, Laugwitz K, Neumann F, Seyfarth M, Berger P, Scho¨mig A, Kastrati A. Bleeding after percutaneous coronary intervention with Bivalirudin or unfractionated Heparin and one-year mortality. Am J Cardiol 2010;105(2):163–167
786. Montalescot G, White HD, Gallo R, Cohen M, Steg PG, Aylward PE, Bode C, Chiariello M, King SB 3rd, Harrington RA, Desmet WJ, Macaya C, Steinhubl SR Enoxaparin vs. unfractionated heparin in elective percutaneous coronary intervention N Engl J Med 2006;355(10):1006–1017
787. Montalescot G, Gallo R, White HD, Cohen M, Steg PG, Aylward PE, Bode C, Chiariello M, King SB 3rd, Harrington RA, Desmet WJ, Macaya C, Steinhubl SR Enoxaparin vs. unfractionated heparin in elective percutaneous coronary intervention 1-year results from the STEEPLE (SafeTy and efficacy of enoxaparin in percutaneous coronary intervention patients, an international randomized evaluation) trial. JACC Cardiovasc Interv 2009;2(11):1083–1091
788. Silvain J, Beygui F, Barthe´le´my O, Pollack C Jr., Cohen M, Zeymer U, Huber K, Goldstein P, Cayla G, Collet J-P, Vicaut E, Montalescot G. Efficacy and safety of enoxaparin vs. unfractionated heparin during percutaneous coronary intervention: systematic review and meta-analysis. BMJ 2012;344
789. Di Sciascio G, Patti G, Pasceri V, Gatto L, Colonna G, Montinaro A. Effectiveness of in-laboratory high-dose clopidogrel loading vs. routine pre-load in patients undergoing percutaneous coronary intervention: results of the ARMYDA-5 PRELOAD (Antiplatelet therapy for Reduction of MYocardial Damage during Angioplasty) randomized trial. J Am Coll Cardiol 2010;56(7):550–557
790. Montalescot G, Sideris G, Meuleman C, Bal-dit-Sollier C, Lellouche N, Steg PG, Slama M, Milleron O, Collet JP,Henry P, Beygui F, Drouet L.Arandomized comparison of high clopidogrel loading doses in patients with non-ST-segment elevation acute coronary syndromes: the ALBION (Assessment of the Best Loading Dose of Clopidogrel to Blunt Platelet Activation, Inflammation and Ongoing Necrosis) trial. J Am Coll Cardiol 2006;48(5):931–938
791. Steinhubl SR, Berger S, Mann JT, Fry ETA, DeLago A, Wilmer C, Topol EJ, for the Credo I. Early and sustained dual oral antiplatelet therapy following percutaneous coronary intervention. JAMA 2002;288:2411–2418
792. Widimsky P, Motovska Z, Simek S, Kala P, Pudil R, Holm F, Petr R, Bilkova D, Skalicka H, Kuchynka P, Poloczek M, Miklik R, Maly M, Aschermann M. Clopidogrel pre-treatment in stable angina: for all patients.6 h before elective coronary angiography or only for angiographically selected patients a few minutes before PCI? A randomized multicentre trial PRAGUE-8. Eur Heart J 2008;29(12):1495–1503
793. Collaborative overview of randomised trials of antiplatelet therapy:I: Prevention of death, myocardial infarction, and stroke by prolonged antiplatelet therapy in various categories of patients. Antiplatelet Trialists’ Collaboration. BMJ (Clinical research ed.) 1994;308(6921):81–106
794. Baigent C, Blackwell L, Collins R, Emberson J, Godwin J, Peto R, Buring J, Hennekens C, Kearney P, Meade T, Patrono C, Roncaglioni MC, Zanchetti A Aspirin in the primary and secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from randomised trials. Lancet 2009; 373(9678):1849–1860
795. Bertrand ME, Rupprecht HJ, Urban P, Gershlick AH. Double-blind study of the safety of clopidogrel with and without a loading dose in combination with aspirin compared with ticlopidine in combination with aspirin after coronary stenting : the clopidogrel aspirin stent international cooperative study (CLASSICS). Circulation 2000;102(6):624–629
796. Taniuchi M, Kurz HI, Lasala JM. Randomized comparison of ticlopidine and clopidogrel after intracoronary stent implantation in a broad patient population. Circulation 2001;104(5):539–543
797. Muller C, Buttner HJ, Petersen J, Roskamm H. A randomized comparison of clopidogrel and aspirin vs. ticlopidine and aspirin after the placement of coronary-artery stents. Circulation 2000;101(6):590–593
798. von Beckerath N, Taubert D, Pogatsa-Murray G, Schomig E, Kastrati A, Schomig A Absorption, metabolization, and antiplatelet effects of 300-, 600-, and 900 mg loading doses of clopidogrel: results of the ISAR-CHOICE (Intracoronary Stenting and Antithrombotic Regimen: Choose Between 3 High Oral Doses for Immediate Clopidogrel Effect) Trial. Circulation 2005;112(19):2946–2950
799. Valgimigli M, Campo G, Monti M, Vranckx P, Percoco G, Tumscitz C, Castriota F, Colombo F, Tebaldi M, Fuca` G, Kubbajeh Md, Cangiano E, Minarelli M, Scalone A, Cavazza C, Frangione A, Borghesi M, Marchesini J, Parrinello G, Ferrari R. Short- vs. long-term duration of dual-antiplatelet therapy after coronary stenting: a randomized multicenter trial. Circulation 2012;125(16):2015–2026
800. Scho¨mig A,NeumannFJ, Kastrati A, Schu¨hlen H, Blasini R, Hadamitzky M,Walter H, Zitzmann-Roth EM, Richardt G, Alt E, Schmitt C, Ulm K.Arandomized comparison of antiplatelet and anticoagulant therapy after the placement of coronary-artery stents. N Engl J Med 1996;334(17):1084–1089
801. Leon MB, Baim DS, Popma JJ, Gordon PC, Cutlip DE, Ho KK, Giambartolomei A, Diver DJ, Lasorda DM, WilliamsDO, Pocock SJ, Kuntz RE.Aclinical trial comparing three antithrombotic-drug regimens after coronary-artery stenting. Stent Anticoagulation Restenosis Study Investigators. N Engl J Med 1998;339(23):1665–1671
802. Cassese S, Byrne RA, Tada T, King LA, Kastrati A. Clinical impact of extended dual antiplatelet therapy after percutaneous coronary interventions in the drug-eluting stent era: a meta-analysis of randomized trials. Eur Heart J 2012;33(24):3078–3087
803. GwonHC,Hahn JY, ParkKW, Song YB, Chae IH, Lim DS, HanKR, Choi JH, Choi SH, Kang HJ, Koo BK, Ahn T, Yoon JH, Jeong MH, Hong TJ, ChungWY, Choi YJ, Hur SH, Kwon HM, Jeon DW, Kim BO, Park SH, Lee NH, Jeon HK, Jang Y, Kim HS. Sixmonth vs. 12-month dual antiplatelet therapy after implantation of drug-eluting stents: the Efficacy of Xience/Promus Vs. Cypher to Reduce Late Loss After Stenting (EXCELLENT) randomized, multicenter study. Circulation 2012;125(3): 505–513
804. Feres F, Costa RA, Abizaid A, Leon MB, Marin-Neto JA, Botelho RV, King SB, Negoita M, Liu M, de Paula JE, Mangione JA, Meireles GX, Castello HJ, Nicolela E, Perin MA, Devito FS, Labrunie A, Salvadori D, Gusma˜o M, Staico R, Costa JR, de Castro JP, Abizaid AS, Bhatt DL. Three vs.Twelve Months of Dual Antiplatelet Therapy After Zotarolimus-Eluting Stents: The OPTIMIZE Randomized Trial JAMA 2013;310(23):2510–2522
805. Kim BK, Hong MK, Shin DH, Nam CM, Kim JS, Ko YG, Choi D, Kang TS, Park BE, KangWC,Lee SH, Yoon JH, Hong BK, Kwon HM, Jang Y.Anew strategy for discontinuation of dual antiplatelet therapy: the RESET Trial (REal Safety and Efficacy of 3-month dual antiplatelet Therapy following Endeavor zotarolimus-eluting stent implantation). J Am Coll Cardiol 2012;60(15):1340–1348
806. Schulz S, Mehilli J,NeumannFJ, SchusterT, Massberg S, Valina C, Seyfarth M, Pache J, Laugwitz KL, Buttner HJ, Ndrepepa G, Schomig A, Kastrati A. ISAR-REACT 3A: a study of reduced dose of unfractionated heparin in biomarker negative patients undergoing percutaneous coronary intervention. Eur Heart J 2010;31(20): 2482–2491
807. Dumaine R, Borentain M, Bertel O, Bode C, Gallo R, White HD, Collet JP, Steinhubl SR, Montalescot G. Intravenous low-molecular-weight heparins compared with unfractionated heparin in percutaneous coronary intervention: quantitative review of randomized trials. Arch Intern Med 2007;167(22):2423–2430
808. Mehran R, Pocock SJ, StoneGWet al. Associations of major bleeding and myocardial infarction with the incidence and timing of mortality in patients presenting with non-ST-elevation acute coronary syndromes: a risk model from the ACUITY trial Eur Heart J 2009;30:1457–1466
809. Subherwal S, Bach RG, Chen AY, Gage BF, Rao SV, Newby LK, Wang TY, Gibler WB, Ohman EM, Roe MT, Pollack CV Jr., Peterson ED, Alexander KP. Baseline risk of major bleeding in non-ST-segment-elevation myocardial infarction: the CRUSADE (Can Rapid risk stratification of Unstable angina patients Suppress ADverse outcomes with Early implementation of the ACC/AHA Guidelines) Bleeding Score. Circulation 2009;119(14):1873–1882
810. Pena A, Collet JP, Hulot JS, Silvain J, Barthe´le´my O, Beygui F, Funck-Brentano C, Gilles M. Can we override clopidogrel resistance? Circulation 2009;119(21): 2854–2858
811. Roe MT, Armstrong PW, Fox KA, White HD, Prabhakaran D, Goodman SG, Cornel JH, Bhatt DL, Clemmensen P, Martinez F, Ardissino D, Nicolau JC, Boden WE, Gurbel PA, Ruzyllo W, Dalby AJ, McGuire DK, Leiva-Pons JL,-Parkhomenko A, Gottlieb S, Topacio GO, Hamm C, Pavlides G, Goudev AR, Oto A, Tseng CD, Merkely B, Gasparovic V, Corbalan R, Cinteza M, McLendon RC, Winters KJ, Brown EB, Lokhnygina Y, Aylward PE, Huber K, Hochman JS, Ohman EM. Prasugrel vs. clopidogrel for acute coronary syndromes without revascularization. N Engl J Med 2012;367(14):1297–1309
812. Mehta S, Tanguay JF, Eikelboom JW, Jolly SS, Joyner CD, Granger CB, Faxon DP, Rupprecht HJ, Budaj A, Avezum A, Widimsky P, Steg PG, Bassand JP, Montalescot G, Macaya C, Di Pasquale G, Niemela K, Ajani AE, White HD,-Chrolavicius S, Gao P, Fox KAA, Yusuf S, on behalf of the CI. Double-dose vs standard-dose clopidogrel and high-dose vs. low-dose aspirin in individuals undergoing percutaneous coronary intervention for acute coronary syndromes (CURRENT-OASIS 7): a randomised factorial trial. Lancet 2010;376:1233–1243
813. Boersma E, Harrington RA, Moliterno DJ, White H, Theroux P, Van deWerf F, de Torbal A, Armstrong PW,Wallentin LC, Wilcox RG, Simes J, Califf RM, Topol EJ, SimoonsML. Platelet glycoprotein IIb/IIIa inhibitors in acute coronary syndromes: a meta-analysis of all major randomised clinical trials. Lancet 2002;359(9302): 189–198
814. Kastrati A, Mehilli J, Neumann F-J, Dotzer F, ten Berg J, Bollwein H, Graf I, Ibrahim M, Pache J, Seyfarth M, Schu¨hlen H, Dirschinger J, Berger PB, Scho¨mig A. Abciximab in patients with acute coronary syndromes undergoing percutaneous coronary intervention after clopidogrel pretreatment: the ISAR-REACT 2 randomized trial. JAMA-2006;295(13):1531–1538
815. StoneGW,McLaurinBT,CoxDA, Bertrand ME, Lincoff AM, MosesJW, WhiteHD, Pocock SJ, Ware JH, Feit F, Colombo A, Aylward PE, Cequier AR, Darius H, Desmet W, Ebrahimi R, Hamon M, Rasmussen LH, Rupprecht HJ, Hoekstra J, Mehran R, Ohman EM. Bivalirudin for patients with acute coronary syndromes N Engl J Med 2006;355(21):2203–2216
816. StoneGW,Ware JH, Bertrand ME, Lincoff AM, Moses JW, Ohman EM, White HD, Feit F, Colombo A, McLaurin BT, Cox DA, Manoukian SV, Fahy M, Clayton TC, Mehran R, Pocock SJ. Antithrombotic strategies in patients with acute coronary syndromes undergoing early invasive management: one-year results from the ACUITY trial. JAMA 2007;298(21):2497–2506
817. Kastrati A, Neumann F-J, Schulz S, Massberg S, Byrne RA, Ferenc M, Laugwitz K-L, Pache J, Ott I, Hausleiter J, Seyfarth M, Gick M, Antoniucci D, Scho¨mig A, Berger PB, Mehilli J. Abciximab and heparin vs. bivalirudin for non-ST-elevation myocardial infarction N Engl J Med 2011;365(21):1980–1989
818. O’Donoghue M, Antman EM, Braunwald E, Murphy SA, Steg PG, Finkelstein A, Penny WF, Fridrich V, McCabe CH, Sabatine MS, Wiviott SD. The efficacy safety of prasugrel with without a glycoprotein IIb/IIIa inhibitor in patients with acute coronary syndromes undergoing percutaneous intervention: a TRITON-TIMI 38 (Trial to Assess Improvement in Therapeutic utcomes by Optimizing Platelet Inhibition With Prasugrel-Thrombolysis In Myocardial Infarction 38) analysis. J Am Coll Cardiol 2009;54(8):678–685
819. Cohen M, Mahaffey KW, Pieper K, Pollack CV Jr., Antman EM, Hoekstra J, Goodman SG, Langer A, Col JJ, White HD, Califf RM, Ferguson JJ. A subgroup analysis of the impact of prerandomization antithrombin therapy on outcomes in the SYNERGY trial: enoxaparin vs. unfractionated heparin in non-ST-segment elevation acute coronary syndromes. J Am Coll Cardiol 2006;48(7):1346–1354
820. Ferguson JJ, Califf RM, Antman EM, Cohen M, Grines CL, Goodman S, Kereiakes DJ, Langer A, Mahaffey KW, Nessel CC, Armstrong PW, Avezum A, Aylward P, Becker RC, Biasucci L, Borzak S, Col J, Frey MJ, Fry E, Gulba DC, Guneri S, Gurfinkel E, Harrington R, Hochman JS, Kleiman NS, Leon MB, Lopez-Sendon JL, Pepine CJ, RuzylloW, Steinhubl SR, Teirstein PS, Toro-Figueroa L, White H. Enoxaparin vs.unfractionated heparin in high-risk patients with non-ST-segment elevation acute coronary syndromes managed with an intended early invasive strategy: primary results of the SYNERGY randomized trial. JAMA 2004;292(1): 45–54
821. Kastrati A, Neumann F-J, Mehilli J, Byrne RA, Iijima R, Bu¨ttner HJ, Khattab AA, Schulz S, Blankenship JC, Pache J, Minners J, Seyfarth M, Graf I, Skelding KA, Dirschinger J, Richardt G, Berger PB, Scho¨mig A. Bivalirudin vs. unfractionated heparin during percutaneous coronary intervention. N Engl J Med 2008;359(7): 688–696
822. Fifth Organization to Assess Strategies in Acute Ischemic Syndromes I, Yusuf S, Mehta SR, Chrolavicius S, Afzal R, Pogue J, Granger CB, Budaj A, Peters RJG, Bassand J-P, Wallentin L, Joyner C, Fox KAA. Comparison of fondaparinux and enoxaparin in acute coronary syndromes. N Engl J Med 2006;354(14):1464–1476
823. Steg PG, James S, Harrington RA, Ardissino D, Becker RC, Cannon CP, Emanuelsson H, Finkelstein A HS, Katus H, Kilhamn J, Olofsson S, Storey RF, Weaver WD, Wallentin L, for the PSG. Ticagrelor Vs. Clopidogrel in Patients With ST-Elevation Acute Coronary Syndromes Intended for Reperfusion With Primary Percutaneous Coronary Intervention: A Platelet Inhibition and Patient Outcomes (PLATO) Trial Subgroup Analysis. Circulation 2010;122(21): 2131–2141
824. Antman EM, McCabe CH, Gurfinkel EP, Turpie AG, Bernink PJ, Salein D, Bayes De Luna A, Fox K, Lablanche JM, Radley D, Premmereur J, Braunwald E. Enoxaparin prevents death and cardiac ischemic events in unstable angina/non-Q-wave myocardial infarction. Results of the thrombolysis in myocardial infarction (TIMI) 11B trial. Circulation 1999;100(15):1593–1601
825. Mehta SR, Yusuf S, Peters RJ, Bertrand ME, Lewis BS, Natarajan MK, Malmberg K, Rupprecht H, Zhao F, Chrolavicius S, Copland I, Fox KA. Effects of pretreatment with clopidogrel and aspirin followed by long-term therapy in patients undergoing percutaneous coronary intervention: the PCI-CURE study. Lancet 2001; 358(9281):527–533
826. Montalescot G, Bolognese L, Dudek D, Goldstein P, Hamm C, Tanguay J-F, Ten Berg JM, Miller DL, Costigan TM, Goedicke J, Silvain J, Angioli P, Legutko J, Niethammer M, Motovska Z, Jakubowski JA, Cayla G, Visconti LO, Vicaut E,-Widimsky P, the AI. Pretreatment with Prasugrel in Non-ST-Segment Elevation Acute Coronary Syndromes. N Engl J Med 2013;369(11):999–1010
827. Steg PG, Jolly SS, Mehta SR, Afzal R, Xavier D, Rupprecht HJ, Lopez-Sendon JL, Budaj A, Diaz R, Avezum A, Widimsky P, Rao SV, Chrolavicius S, Meeks B, Joyner C, Pogue J, Yusuf S. Low-dose vs.standard-dose unfractionated heparin for percutaneous coronary intervention in acute coronary syndromes treated with fondaparinux: the FUTURA/OASIS-8 randomized trial. JAMA 2010;304(12): 1339–1349
828. Montalescot G, Wiviott SD, Braunwald E, Murphy SA, Gibson CM, McCabe CH, Antman EM, investigators T-T. Prasugrel compared with clopidogrel in patients undergoing percutaneous coronary intervention for ST-elevation myocardial infarction (TRITON-TIMI 38): double-blind, randomised controlled trial. Lancet 2009;373(9665):723–731
829. Erlinge D, Ten Berg J, Foley D, Angiolillo DJ,Wagner H, Brown PB, Zhou C, Luo J, Jakubowski JA, Moser B, Small DS, Bergmeijer T, James S, Winters KJ. Reduction in platelet reactivity with prasugrel 5 mg in low-body-weight patients is noninferior to prasugrel 10 mg in higher-body-weight patients: results from the FEATHER trial. J Am Coll Cardiol 2012;60(20):2032–2040
830. Bellemain-Appaix A, Brieger D, Beygui F, Silvain J, Pena A, Cayla G, Barthe´le´my O, Collet JP, Montalescot G. New P2Y12 inhibitors vs. clopidogrel in percutaneous coronary intervention: a meta-analysis. J Am Coll Cardiol. 2010;56(19):1542–1551
831. De Luca G, Navarese E, Marino P. Risk profile and benefits from Gp IIb-IIIa inhibitors among patients with ST-segment elevation myocardial infarction treated with primary angioplasty: a meta-regression analysis of randomized trials. Eur Heart J 2009;30:2705–2713
832. Montalescot G, Barragan P, Wittenberg O, Ecollan P, Elhadad S, Villain P, Boulenc JM, Morice MC, Maillard L, Pansieri M, Choussat R, Pinton P. Platelet glycoprotein IIb/IIIa inhibition with coronary stenting for acute myocardial infarction. N Engl J Med 2001;344(25):1895–1903
833. Neumann FJ, Kastrati A, Pogatsa-Murray G, Mehilli J, Bollwein H, Bestehorn HP, Schmitt C, Seyfarth M, Dirschinger J, Schomig A. Evaluation of prolonged antithrombotic pretreatment ("cooling-off" strategy) before intervention in patients with unstable coronary syndromes: a randomized controlled trial. JAMA 2003; 290(12):1593–1599
834. Herrmann HC, Lu J, Brodie BR, Armstrong PW, Montalescot G, Betriu A, Neuman F-J, Effron MB, Barnathan ES, Topol EJ, Ellis SG, Investigators F. Benefit of facilitated percutaneous coronary intervention in high-risk ST-segment elevation myocardial infarction patients presenting to nonpercutaneous coronary intervention hospitals. JACC Cardiovascular Interventions 2009;2(10):917–924
835. Van’t Hof AW, Ten Berg J, Heestermans T, Dill T, Funck RC, van Werkum W, Dambrink JH, Suryapranata H, van Houwelingen G, Ottervanger JP, Stella P, Giannitsis E, Hamm C, Ongoing Tirofiban In Myocardial infarction Evaluation 2 study g. Prehospital initiation of tirofiban in patients with ST-elevation myocardial infarction undergoing primary angioplasty (On-TIME 2): a multicentre, doubleblind, randomised controlled trial. Lancet 2008;372(9638):537–546
836. en Berg JM, van ’t HofAW, Dill T, Heestermans T, vanWerkum JW, Mosterd A, van Houwelingen G, Koopmans PC, Stella PR, Boersma E,HammC. Effect of early, prehospital initiation of high bolus dose tirofiban in patients with ST-segment elevation myocardial infarction on short- and long-term clinical outcome. J Am Coll Cardiol 2010;55(22):2446–2455
837. Montalescot G. Mechanical reperfusion: treat well, treat on time too. Lancet 2008; 372(9638):509–510
838. Stone GW, Maehara A, Witzenbichler B, Godlewski J, Parise H, Dambrink JH, Ochala A, Carlton TW, Cristea E, Wolff SD, Brener SJ, Chowdhary S, El-Omar M, Neunteufl T, Metzger DC, Karwoski T, Dizon JM, Mehran R, Gibson CM. Intracoronary abciximab and aspiration thrombectomy in patients with large anterior myocardial infarction: the INFUSE-AMI randomized trial JAMA 2012;307(17):1817–1826
839. Thiele H, Wo¨ hrle J, Hambrecht R, Rittger H, Birkemeyer R, Lauer B, Neuhaus P, Brosteanu O, Sick P, Wiemer M, Kerber S, Kleinertz K, Eitel I, Desch S, Schuler G. Intracoronary vs. intravenous bolus abciximab during primary percutaneous coronary intervention in patients with acute ST-elevation myocardial infarction: a randomise trial. Lancet 2012;379(9819):923–931
840. Stone GW, Witzenbichler B, Guagliumi G, Peruga JZ, Brodie BR, Dudek D, Kornowski R, Hartmann F, Gersh BJ, Pocock SJ, Dangas G,Wong SC, Kirtane AJ, Parise H, Mehran R. Bivalirudin during primary PCI in acute myocardial infarction N Engl J Med 2008;358(21):2218–2230
841. Steg PG, van ’t HofAW,HammCW, Clemmensen P, Lapostolle F, Coste P, Berg JT, Van Grunsven P, Eggink GJ, Nibbe L, Zeymer U, Orto MC, Nef H, Steinmetz J, Soulat L, Huber K, Deliargyris EN, Bernstein D, Schuette D, Prats J, Clayton TC, Pocock SJ, Hamon M, Goldstein P. Bivalirudin Started during Emergency Transport for Primary PCI. N Engl J Med 2013;369(23):2207–2217
842. Shahzad A, Kemp I, Mars C, Wilson K, Roome C, Cooper R, Andron M, Appleby C, Fisher M, Khand A, Kunadian B, Mills JD, Morris JL, Morrison WL, Munir S, Palmer ND, Perry RA, Ramsdale DR, Velavan P, Stables RH; for the HEAT-PPCI trial investigators. Unfractionated heparin versus bivalirudin in primary percutaneous coronary intervention (HEAT-PPCI): an open-label, single centre, randomised controlled trial. Lancet 2014.doi: 10.1016/S0140-6736(14)60924-7
843. Richardt G. Bavarian Reperfusion Alternatives Evaluation (BRAVE) 4 Trial. Eur Heart J. Published online 9 May 2014; doi: 10.1093/eurheartj/ehu182
844. Collet J-P, Huber K, Cohen M, Zeymer U, Goldstein P, Pollack C Jr., Silvain J, Henry P, Varenne O, Carrie´ D, Coste P, Angioi M, Le Breton H, Cayla G, Elhadad S, Teiger E, Filippi E, Aout M, Vicaut E, Montalescot G, Investigators A. A-Direct Comparison of Intravenous Enoxaparin With Unfractionated Heparin in Primary Percutaneous Coronary Intervention (from the ATOLL Trial). Am J Cardiol 2013;112(9):1367–1372
845. Yusuf S, Mehta SR, Chrolavicius S, Afzal R, Pogue J, Granger CB, Budaj A, Peters RJ, Bassand JP,Wallentin L, Joyner C, Fox KA. Effects of fondaparinux on mortality and reinfarction in patients with acute ST-segment elevation myocardial infarction: the OASIS-6 randomized trial. JAMA 2006;295(13):1519–1530
846. Zeymer U, Arntz HR, Mark B, Fichtlscherer S, Werner G, Scholler R, Zahn R, Diller F, Darius H, Dill T, Huber K. Efficacy and safety of a high loading dose of clopidogrel administered prehospitally to improve primary percutaneous coronary intervention in acute myocardial infarction: the randomized CIPAMI trial. Clin Res Cardiol 2012;101(4):305–312
847. Koul S, Smith JG, Schersten F, James S, Lagerqvist B, Erlinge D. Effect of upstream clopidogrel treatment in patients with ST-segment elevation myocardial infarction undergoing primary percutaneous coronary intervention. Eur Heart J 2011;32(23): 2989–2997
848. Dorler J, Edlinger M, Alber HF, Altenberger J, Benzer W, Grimm G, Huber K, Pachinger O, Schuchlenz H, Siostrzonek P, Zenker G, Weidinger F. Clopidogrel pre-treatment is associated with reduced in-hospital mortality in primary percutaneous coronary intervention for acute ST-elevation myocardial infarction. Eur Heart J 2011;32(23):2954–2961
849. De Luca G, Bellandi F, Huber K, Noc M, Petronio AS, Arntz HR, Maioli M, Gabriel HM, Zorman S, De Carlo M, Rakowski T, Gyongyosi M, Dudek D. Early glycoprotein IIb-IIIa inhibitors in primary angioplasty-abciximab long-term results (EGYPT-ALT) cooperation: individual patient’s data meta-analysis. Journal of Thrombosis and Haemostasis: JTH 2011;9(12):2361–2370
850. Montalescot G, Zeymer U, Silvain J, Boulanger B, Cohen M, Goldstein P, Ecollan P, Margenet A, Huber K, Pollack C, Be´nezet JF, Stibbe O, Filippi E, Teiger E, Cayla G, Elhadad S, Adnet F, Chouihed T, Gallula S, Greffet A, Aout M, Collet JP, Vicaut E, for the AI. Intravenous Enoxaparin or Unfractionated Heparin in Primary Percutaneous Coronary Intervention for ST-Elevation Myocardial Infarction. Lancet 2011; 378(9792):693–703
851. Chan AW, Moliterno DJ, Berger PB, Stone GW, DiBattiste PM, Yakubov SL, Sapp SK,Wolski K, Bhatt DL, Topol EJ. Triple antiplatelet therapy during percutaneous coronary intervention is associated with improved outcomes including-one-year survival: results from the Do Tirofiban and ReoProGive Similar Efficacy Outcome Trial (TARGET). J Am Coll Cardiol 2003;42(7):1188–1195
852. Bhatt DL, Stone GW, Mahaffey KW, Gibson CM, Steg PG, Hamm CW, Price MJ, Leonardi S, Gallup D, Bramucci E, Radke PW, Widimsky´ P, Tousek F, Tauth J, Spriggs D, McLaurin BT, Angiolillo DJ, Ge´ne´reux P, Liu T, Prats J, Todd M, Skerjanec S, White HD, Harrington RA. Effect of Platelet Inhibition with Cangrelor during PCI on Ischemic Events. N Engl J Med 2013;368(14):1303–1313
853. Steg PG, Bhatt DL, HammCW, StoneGW, Gibson CM, MahaffeyKW, Leonardi S, Liu T, Skerjanec S, Day JR, Iwaoka RS, Stuckey TD, GogiaHS, Gruberg L, French WJ, White HD, Harrington RA. Effect of cangrelor on periprocedural outcomes in percutaneous coronary interventions: a pooled analysis of patient-level data. Lancet 2013;382(9919):1981–1992
854. Angiolillo DJ, Firstenberg MS, Price MJ, Tummala PE, Hutyra M, Welsby IJ, Voeltz MD, Chandna H, Ramaiah C, Brtko M, Cannon L, Dyke C, Liu T, Montalescot G, Manoukian SV, Prats J, Topol EJ. Bridging antiplatelet therapy with cangrelor in patients undergoing cardiac surgery: a randomized controlled trial. JAMA 2012;307(3):265–274
855. Mega JL, Braunwald E, Wiviott SD, Bassand JP, Bhatt DL, Bode C, Burton P, Cohen M, Cook-Bruns N, Fox KA, Goto S, Murphy SA, Plotnikov AN, Schneider D, Sun X, Verheugt FW, Gibson CM, the AACSTI. Rivaroxaban in Patients with a Recent Acute Coronary Syndrome. N Engl J Med. 2012;366:9–19
856. Gibson CM,Chakrabarti AK, Mega J, Bode C, Bassand J-P, VerheugtFWA, Bhatt DL, Goto S, Cohen M, Mohanavelu S, Burton P, Stone G, Braunwald E, Investigators A-AT. Reduction of Stent Thrombosis in Patients With Acute Coronary Syndromes Treated With Rivaroxaban in ATLAS-ACS 2 TIMI 51. J Am Coll Cardiol 2013;62(4):286–290
857. Mega JL, Braunwald E, Murphy SA, Plotnikov AN, Burton P, Kiss RG, Parkhomenko A, Tendera M, Widimsky P, Gibson CM. Rivaroxaban in patients stabilized after a ST-segment elevation myocardial infarction: results from the ATLAS ACS-2-TIMI-51 trial (Anti-Xa Therapy to Lower Cardiovascular Events in Addition to Standard Therapy in Subjects with Acute Coronary Syndrome-Thrombolysis In Myocardial Infarction-51). J Am Coll Cardiol 2013;61(18):1853–1859
858. Alexander JH, Lopes RD, James S, Kilaru R, He Y, Mohan P, Bhatt DL, Goodman S, Verheugt FW, Flather M, Huber K, Liaw D, Husted SE, Lopez-Sendon J, De Caterina R, Jansky P, Darius H, Vinereanu D, Cornel JH, Cools F, Atar D, Leiva-Pons JL, Keltai M, Ogawa H, Pais P, Parkhomenko A, Ruzyllo W, Diaz R, White H, Ruda M, Geraldes M, Lawrence J, Harrington RA, Wallentin L, Investigators A-. Apixaban with antiplatelet therapy after acute coronary syndrome N Engl J Med. 2011;365(8):699–708
859. Oldgren J, Budaj A, Granger CB, Khder Y, Roberts J, Siegbahn A, Tijssen JGP, Van de Werf F, Wallentin L. Dabigatran vs. placebo in patients with acute coronary syndromes on dual antiplatelet therapy: a randomized, double-blind, phase II trial Eur Heart J 2011;32(22):2781–2789
860. Steg PG, Mehta SR, Jukema JW, Lip GYH, Gibson CM, Kovar F, Kala P, Garcia-Hernandez A, Renfurm RW, Granger CB. RUBY-1: a randomized, doubleblind, placebo-controlled trial of the safety and tolerability of the novel oral factor Xa inhibitor darexaban (YM150) following acute coronary syndrome. Eur Heart J 2011;32(20):2541–2554
861. Alexander JH, Becker RC, Bhatt DL, Cools F, Crea F, Dellborg M, Fox KA, Goodman SG, Harrington RA, Huber K, Husted S, Lewis BS, Lopez-Sendon J, Mohan P, Montalescot G, Ruda M, RuzylloW, Verheugt F,Wallentin L. Apixaban, an oral, direct, selective factor Xa inhibitor, in combination with antiplatelet therapy after acute coronary syndrome: results of the Apixaban for Prevention of Acute Ischemic and Safety Events (APPRAISE) trial. Circulation 2009;119(22): 2877–2885
862. Mega JL, Braunwald E, Mohanavelu S, Burton P, Poulter R, Misselwitz F, Hricak V, Barnathan ES, Bordes P, Witkowski A, Markov V, Oppenheimer L, Gibson CM. Rivaroxaban vs. placebo in patients with acute coronarysyndromes (ATLASACS-TIMI 46): a randomised, double-blind, phase II trial. Lancet 2009;374(9683):29–38
863. Ruiz-Nodar JM, Marı´n F, Hurtado JA, Valencia J, Pinar E, Pineda J, Gimeno JR, Sogorb F, Valde´s M, Lip GYH. Anticoagulant and antiplatelet therapy use in 426 patients with atrial fibrillation undergoing percutaneous coronary intervention and stent implantation implications for bleeding risk and prognosis. J Am Coll Cardiol 2008;51(8):818–825
864. Hansen ML, Sørensen R, Clausen MT, Fog-Petersen ML, Raunsø J, Gadsbøll N, Gislason GH, Folke F, Andersen SS, Schramm TK, Abildstrøm SZ, Poulsen HE, Køber L, Torp-Pedersen C. Risk of bleeding with single, dual, or triple therapy with warfarin, aspirin, and clopidogrel in patients with atrial fibrillation. Archives of Internal Medicine 2010;170(16):1433–1441
865. Lamberts M, Olesen JB, Ruwald MH, Hansen CM, Karasoy D, Kristensen SL, Køber L, Torp-Pedersen C, Gislason GH, Hansen ML. Bleeding after initiation of multiple antithrombotic drugs, including triple therapy, in atrial fibrillation patients following myocardial infarction and coronary intervention: a nationwide cohort study. Circulation 2012;126(10):1185–1193
866. Faxon DP, Eikelboom JW, Berger PB, Holmes DR Jr., Bhatt DL, Moliterno DJ, Becker RC, Angiolillo DJ. Antithrombotic therapy in patients with atrial fibrillation undergoing coronary stenting: a North American perspective: executive summary Circulation. Cardiovascular Interventions 2011;4(5):522–534
867. Lip GYH, Huber K, Andreotti F, Arnesen H, Airaksinen JK, Cuisset T, Kirchhof P, Marı´n F. Antithrombotic management of atrial fibrillation patients presenting with acute coronary syndrome and/or undergoing coronary stenting: executive summary:a Consensus Document of the European Society of Cardiology Working Group on Thrombosis, endorsed by the European Heart Rhythm Association (EHRA) and the European Association of Percutaneous Cardiovascular Interventions (EAPCI). Eur Heart J 2010;31(11):1311–1318
868. Sarafoff N, Martischnig A,Wealer J, Mayer K, Mehilli J, Sibbing D, Kastrati A. Triple therapy with aspirin, prasugrel, and vitamin K antagonists in patients with drug-eluting stent implantation and an indication for oral anticoagulation. J Am-Coll Cardiol 2013;61(20):2060–2066
869. Bangalore S, Kumar S, Fusaro M, Amoroso N, Attubato MJ, Feit F, Bhatt DL, Slater J Short- and long-termoutcomes with drug-eluting and bare-metal coronary stents: a mixed-treatment comparison analysis of 117 762 patient-years of follow-up from randomized trials. Circulation 2012;125(23):2873–2891
870. Dewilde WJ, Oirbans T, Verheugt FW, Kelder JC, De Smet BJ, Herrman JP, Adriaenssens T, Vrolix M, Heestermans AA, Vis MM, Tijsen JG, van ’t Hof AW, ten Berg JM. Use of clopidogrel with or without aspirin in patients taking oral anticoagulant therapy and undergoing percutaneous coronary intervention: an openlabel, randomised, controlled trial. Lancet 2013;381(9872):1107–1115
871. Park S-J, Park D-W, Kim Y-H, Kang S-J, Lee S-W, Lee CW, Han K-H, Park S-W, Yun S-C, Lee S-G, Rha S-W, Seong I-W, Jeong M-H, Hur S-H, Lee N-H, Yoon J, Yang J-Y, Lee B-K, Choi Y-J, Chung W-S, Lim D-S, Cheong S-S, Kim K-S, Chae JK, Nah D-Y, Jeon D-S, Seung KB, Jang J-S, Park HS, Lee K. Duration of dual antiplatelet therapy after implantation of drug-eluting stents. N Engl J Med 2010;362(15): 1374–1382
872. Kedhi E, Stone GW, Kereiakes DJ, Serruys PW, Parise H, Fahy M, Simonton CA, Sudhir K, Sood P, Smits PC. Stent thrombosis: insights on outcomes, predictors and impact of dual antiplatelet therapy interruption from the SPIRIT II, SPIRIT III, SPIRIT IV and COMPARE trials. EuroIntervention 2012;8(5):599–606
873. Silber S, Kirtane AJ, Belardi JA, Liu M, Brar S, Rothman M, Windecker S. Lack of association between dual antiplatelet therapy use and stent thrombosis between 1 and 12 months following resolute zotarolimus-eluting stent implantation. Eur Heart J 2014, published online February 7
874. Agewall S, Cattaneo M, Collet JP, Andreotti F, Lip GY, Verheugt FW, Huber K, Grove EL, Morais J, Husted S, Wassmann S, Rosano G, Atar D, Pathak A, Kjeldsen K, Storey RF, Pharmacology ESCWGoC, Drug T, Thrombosis-ESCWGo. Expert position paper on the use of proton pump inhibitors in patients with cardiovascular disease and antithrombotic therapy. Eur Heart J 2013;34(23): 1708–1713, 1713a–1713b
875. Alexander KP, Chen AY, Roe MT, Newby LK, Gibson CM, Allen-LaPointe NM, Pollack C, Gibler WB, Ohman EM, Peterson ED. Excess dosing of antiplatelet and antithrombin agents in the treatment of non-ST-segment elevation acute coronary syndromes. JAMA 2005;294(24):3108–3116
876. Steg PG, Huber K, Andreotti F, Arnesen H, Atar D, Badimon L, Bassand JP, De Caterina R, Eikelboom JA, Gulba D, Hamon M, Helft G, Fox KA, Kristensen SD, Rao SV, VerheugtFW, Widimsky P, Zeymer U, Collet JP. Bleeding in acute coronary syndromes and percutaneous coronary interventions: position paper by the Working Group on Thrombosis of the European Society of Cardiology. Eur Heart J. 2011;32(15):1854–1864
877. James S, Budaj A, Aylward P, Buck KK, Cannon CP, Cornel JH, Harrington RA, Horrow J, Katus H, Keltai M, Lewis BS, Parikh K, Storey RF, Szummer K, Wojdyla D, Wallentin L. Ticagrelor vs. clopidogrel in acute coronary syndromes in relation to renal function: results from the Platelet Inhibition and Patient Outcomes (PLATO) trial. Circulation 2010;122(11):1056–1067
878. Sousa-Uva M, Storey R, Huber K, Falk V, Leite-Moreira A, Amour J, Attar NA, Ascione R, Taggart D, Collet JP. Expert position paper on the management of antiplatelet therapy in patients undergoing coronary artery bypass graft surgery. Eur Heart J 2014;35:1510–1514
879. Ferraris VA, Saha SP, Oestreich JH, Song HK, Rosengart T, Reece TB, Mazer CD, Bridges CR, Despotis GJ, Jointer K, Clough ER. 2012 update to the Society of Thoracic Surgeons guideline on use of antiplatelet drugs in patients having cardiac and noncardiac operations. The Annals of Thoracic Surgery 2012;94(5):1761–1781
880. Smith PK, Goodnough LT, Levy JH, Poston RS, Short MA, Weerakkody GJ, Lenarz LA. Mortality benefit with prasugrel in the TRITON-TIMI 38 coronary artery bypass grafting cohort: risk-adjusted retrospective data analysis. J Am Coll Cardiol 2012;60(5):388–396
881. Varenhorst C, Alstro¨mU, Scirica BM, HogueCW,A° senblad N, Storey RF, Steg PG, Horrow J, Mahaffey KW, Becker RC, James S, Cannon CP, Brandrup-Wognsen G, Wallentin L, Held C. Factors contributing to the lower mortality with ticagrelor compared with clopidogrel in patients undergoing coronary artery bypass surgery. J Am Coll Cardiol 2012;60(17):1623–1630
882. Kwak Y-L, Kim J-C, Choi Y-S, Yoo K-J, SongY, Shim J-K. Clopidogrel responsiveness regardless of the discontinuation date predicts increased blood loss and transfusion requirement after off-pump coronary artery bypass graft surgery. J Am Coll Cardiol 2010;56(24):1994–2002
883. Mahla E, Suarez TA, Bliden KP, Rehak P, Metzler H, Sequeira AJ, Cho P, Sell J, Fan J, Antonino MJ, Tantry US, Gurbel PA. Platelet function measurement-based strategy to reduce bleeding and waiting time in clopidogrel-treated patients undergoing coronary artery bypass graft surgery: the timing based on platelet function strategy to reduce clopidogrel-associated bleeding related toCABG(TARGET-CABG) study Circulation. Cardiovascular interventions 2012;5(2):261–269
884. Savonitto S, D’Urbano M, Caracciolo M, Barlocco F, Mariani G, Nichelatti M, Klugmann S, De Servi S. Urgent surgery in patients with a recently implanted coronary drug-eluting stent: a phase II study of ’bridging’ antiplatelet therapy with tirofiban during temporary withdrawal of clopidogrel. British Journal of Anaesthesia 2010;104(3):285–291
885. Collet JP, Himbet F, Steg PG. Myocardial infarction after aspirin cessation in stable coronary artery disease patients. Int J Cardiol 2000;76(2–3):257–258
886. DeoSV, Dunlay SM, Shah IK, Altarabsheh SE, Erwin PJ, Boilson BA, Park SJ, Joyce LD Dual anti-platelet therapy after coronary artery bypass grafting: is there any benefit? A systematic review and meta-analysis. Journal of Cardiac Surgery 2013;28(2): 109–116
887. Stone GW, Witzenbichler B, Weisz G, Rinaldi MJ, Neumann FJ, Metzger DC, Henry TD, Cox DA, Duffy PL, Mazzaferri E, Gurbel PA, Xu K, Parise H, Kirtane AJ, Brodie BR, Mehran R, Stuckey TD. Platelet reactivity and clinical outcomes after coronary artery implantation of drug-eluting stents (ADAPT-DES): a prospective multicentre registry study. Lancet 2013;382(9892):614–623
888. Parodi G, Marcucci R, Valenti R, Gori AM, Migliorini A, Giusti B, Buonamici P, Gensini GF, Abbate R, Antoniucci D. High residual platelet reactivity after clopidogrel loading and long-termcardiovascular events among patients with acute coronary syndromes undergoing PCI. JAMA 2011;306(11):1215–1223
889. Breet NJ, vanWerkum JW, Bouman HJ, Kelder JC, Ruven HJ, Bal ET, Deneer VH, Harmsze AM, van der Heyden JA, Rensing BJ, Suttorp MJ, Hackeng CM, ten Berg JM. Comparison of platelet function tests in predicting clinical outcome in patients undergoing coronary stent implantation (POPular Study). JAMA 2010; 303(8):754–762
890. Aradi D, Storey RF, Komocsi A, Trenk D, Gulba D, Kiss RG, Husted S, Bonello L, Sibbing D, Collet JP, Huber K, on behalf of the Working Group on Thrombosis of the European Society ofCardiology. Expert position paperon the role of platelet function testing in patients undergoing percutaneous coronary intervention. Eur Heart J 2014;35(4):209–215
891. Trenk D, Stone GW, Gawaz M, Kastrati A, Angiolillo DJ, Mu¨ller U, Richardt G, Jakubowski JA, Neumann F-J. A Randomized Trial of Prasugrel Vs. Clopidogrel in Patients With High Platelet Reactivity on Clopidogrel After Elective Percutaneous Coronary Intervention With Implantation of Drug-Eluting Stents: Results of the TRIGGER-PCI (Testing Platelet Reactivity In Patients Undergoing Elective Stent Placement on Clopidogrel to Guide Alternative Therapy With Prasugrel) Study. J Am Coll Cardiol 2012;59(24):2159–2164
892. Collet J-P, Cuisset T, Range´ G, Cayla G, Elhadad S, Pouillot C, Henry P, Motreff P, Carrie´ D, Boueri Z, Belle L, Van Belle E, Rousseau H, Aubry P, Monse´gu J, Sabouret P, O’Connor SA, Abtan J, Kerneis M, Saint-Etienne C, Barthe´le´my O, Beygui F, Silvain J,MDEV, Montalescot G. Bedside Monitoring to Adjust Antiplatelet Therapy for Coronary Stenting. N Engl J Med 2012;367(22):2100–2109
893. Collet J-P, Hulot J-S, Pena A, Villard E, Esteve J-B, Silvain J, Payot L, Brugier D, Cayla G, Beygui F, Bensimon G, Funck-Brentano C, Montalescot G. Cytochrome P450 2C19 polymorphism in young patients treated with clopidogrel after myocardial infarction: a cohort study. Lancet 2009;373(9660):309–317
894. Mega JL, Close SL, Wiviott SD, Shen L, Walker JR, Simon T, Antman EM, Braunwald E, Sabatine MS. Genetic variants inABCB1andCYP2C19and cardiovascular outcomes after treatment with clopidogrel and prasugrel in the TRITONTIMI 38 trial: a pharmacogenetic analysis. Lancet 2010;376(9749):1312–1319
895. Mega JL, Simon T, Anderson JL, Bliden K, Collet JP, Danchin N, Giusti B, Gurbel P, Horne BD, Kastrati A, Montalescot G, Neumann FJ, Shen L, Sibbing D, Steg PG, Trenk D, Wiviott SD, Sabatine MS. CYP2C19 Genetic Variants and Clinical Outcomes With Clopidogrel: A Collaborative Meta-Analysis. Circulation 2009;120: S598-b-9
896. Trenk D, Hochholzer W, Fromm MF, Chialda LE, Pahl A, Valina CM, Stratz C, Schmiebusch P, Bestehorn HP, Bu¨ttner HJ, Neumann FJ. Cytochrome P450 2C19 681G.A polymorphism and high on-clopidogrel platelet reactivity associated with adverse 1-year clinical outcome of elective percutaneous coronary intervention with drug-eluting or bare-metal stents. J Am Coll Cardiol. 2008;51: 1925–1934
897. Roberts JD, Wells GA, Le May MR, Labinaz M, Glover C, Froeschl M, Dick A, Marquis JF, O’Brien E, Goncalves S, Druce I, Stewart A, Gollob MH, So DYF Point-of-care genetic testing for personalisation of antiplatelet treatment (RAPID GENE): a prospective, randomised, proof-of-concept trial: the RAPID GENE trial. Lancet 2012 (http://dx.doi.org/10.1016/S0140-6736(12)60161-5)
898. Silberman S, Neukirch-Stoop C, Steg PG. Rapid desensitization procedure for patients with aspirin hypersensitivity undergoing coronary stenting. Am J Cardiol 2005;95(4):509–510
899. A randomised, blinded, trial of clopidogrel vs. aspirin in patients at risk of ischaemic events (CAPRIE). CAPRIE Steering Committee. Lancet 1996;348(9038): 1329–1339
/113/sh.jpg)
/113/r3.jpg)

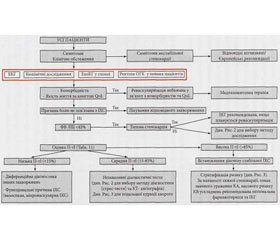
/113/tab1.jpg)
/113/tab2.jpg)
/113/tab3.jpg)
/113/tab4.jpg)
/113/tab5.jpg)
/113/tab6_7.jpg)
/113/tab8.jpg)
/113/tab9_10.jpg)
/113/tab11.jpg)
/113/tab12.jpg)
/113/tab13.jpg)
/113/r1.jpg)
/113/tab14.jpg)
/113/tab15.jpg)
/113/tab16.jpg)
/113/tab17.jpg)
/113/tab18.jpg)
/113/tab19.jpg)
/113/38.jpg)
/113/38_2.jpg)
/113/tab20.jpg)
/113/tab21.jpg)
/113/tab22.jpg)
/113/tab23.jpg)
/113/tab24.jpg)
/113/tab25.jpg)
/113/tab26.jpg)
/113/tab27.jpg)
/113/tab29.jpg)
/113/tab30.jpg)
/113/tab33.jpg)
/113/tab31.jpg)
/113/tab32.jpg)
/113/tab33_2.jpg)
/113/tab34.jpg)
/113/tab35.jpg)
/113/tab36.jpg)
/113/tab37.jpg)
/113/tab38.jpg)
/113/tab39.jpg)
/113/tab40.jpg)
/113/tab41.jpg)
/113/tab42.jpg)
/113/tab43.jpg)
/113/tab44.jpg)
/113/tab45.jpg)
/113/tab46.jpg)
/113/tab47.jpg)
/113/tab48.jpg)
/113/tab48_2.jpg)
/113/tab49.jpg)
/113/tab50.jpg)
/113/tab51.jpg)
/113/tab52.jpg)
/113/tab52_2.jpg)
/113/tab53.jpg)
/113/tab54.jpg)
/113/tab55.jpg)
/113/tab56.jpg)
/113/tab56_2.jpg)
/113/tab57.jpg)
/113/tab58.jpg)
/113/tab58_2.jpg)
/113/tab59.jpg)
/113/tab60.jpg)
/113/tab61.jpg)