Статья опубликована на с. 103-111
Одной из наиболее актуальных проблем современной медицины является головная боль, среди разновидностей которой важное место занимает мигрень [1].
Мигрень — заболевание, предположительно связанное с дисфункцией вазомоторной регуляции и проявляющееся приступами головной боли, обычно пульсирующего характера, часто сопровождающейся тошнотой, рвотой, фото- и фонофобией. Это часто встречающееся заболевание головного мозга, имеющее наследственную природу [2, 3].
По данным различных популяционных исследований, распространенность мигрени колеблется от 0,7 до 22 % [1]. Распространенность заболевания в общей популяции достигает 5–25 % среди женщин и 2–10 % среди мужчин. Чаще заболевание начинается в детском и подростковом возрасте: пик заболеваемости мигренью без ауры приходится на возраст 10–11 лет среди мальчиков и 14–17 лет среди девочек. Распространенность мигрени достигает пика к возрасту 35–40 лет. У женщин (в меньшей степени у мужчин) после 45–50 лет распространенность мигрени постепенно снижается.
По данным ВОЗ, мигрень находится в списке 20 заболеваний, максимально нарушающих социальную адаптацию пациентов. Мигрень поражает преимущественно молодых людей трудоспособного возраста и влияет на самые различные стороны жизни пациента — взаимоотношения в семье, карьерный рост, трудоспособность, может быть причиной временной нетрудоспособности и т.д. Несмотря на то что мигрень не является фатальным заболеванием, финансовые затраты, связанные с ее диагностикой и лечением, поистине огромны и приравниваются к таковым при сердечно-сосудистых заболеваниях, что определяет значимость правильных подходов и использования современных эффективных средств для ее лечения [1, 4].
Долгое время симптомы мигрени связывали исключительно с изменением тонуса сосудов: ауру — с сужением внутримозговых артерий, боль — с расширением артерий твердой мозговой оболочки. В настоящее время очевидно, что важное значение в патогенезе боли имеет активация нейронов ядра тройничного нерва, образующих тригеминоваскулярную систему. Вследствие нее из нервных окончаний в стенке сосудов выделяются биологически активные вещества, вызывающие фокальное нейрогенное воспаление, отек сосудов и прилегающего участка твердой мозговой оболочки.
В инициации приступа важную роль играет активация серотонинергических нейронов ядер шва. Она, возможно, инициирует волну функциональной инактивации нейронов коры, которая, предположительно, лежит в основе ауры. Эта волна движется от затылочной коры кпереди, сопровождаясь вторичным снижением кровотока.
В патогенезе мигрени важное место занимает наследственная предрасположенность. Возможно, играет роль наследственная митохондриальная дисфункция, нарушающая метаболизм в корковых нейронах.
В настоящее время обсуждается вопрос о том, что мигрень может быть фактором риска развития мозгового инсульта.
Таким образом, приступ мигрени сопровождается расширением сосудов твердой мозговой оболочки, в иннервации которых участвуют волокна тройничного нерва (ВТН). Вазодилатация и ощущение боли во время приступа мигрени обусловлены выделением из окончаний ВТН болевых нейропептидов-вазодилататоров, важнейшим из которых является пептид, связанный с геном кальцитонина. По данным последних исследований, механизм такой активации связан с тем, что у больных мигренью имеется повышенная чувствительность ВТН, с одной стороны, и повышенная возбудимость коры головного мозга — с другой. Патофизиологические механизмы мигрени связаны с развитием асептического нейрогенного воспаления, высвобождением простагландина Е2 (ПГЕ2) и оксида азота, которые оказывают непосредственное влияние на периваскулярные ноцицепторы [5].
Лечение мигрени включает немедикаментозные и фармакологические методы, направленные на облегчение головной боли и симптомов, сопровождающих мигрень, профилактику повторных головных болей и возвращение пациента к обычной жизнедеятельности, а также минимальное использование лекарственных средств [6].
Лечение начинают с объяснения пациенту характера заболевания и возможных путей его лечения. Необходимо совместно с пациентом тщательно проанализировать его образ жизни для выявления факторов, провоцирующих возникновение головной боли или способствующих ему, и по возможности устранить или свести к минимуму их воздействие.
При назначении лечения для купирования приступа мигрени следует обсудить с пациентом риск развития головной боли вследствие чрезмерного использования лекарственных средств.
При назначении лекарственных средств для купирования приступа мигрени следует учитывать тяжесть и частоту приступов, наличие других симптомов, предпочтения пациента и историю лечения.
Несмотря на широкий выбор средств для лечения приступа мигрени, по-прежнему нет полного согласия в оценке их эффективности. С одной стороны, накоплено большое количество исследований, посвященных этой проблеме, и в то же время лишь немногие из них соответствуют требованиям медицины, основанной на доказательствах (GCP). Поэтому принят консенсус по лечению мигрени, который отражен в рекомендациях Международного общества по изучению головной боли [7].
Были опубликованы данные о неотложной терапии мигрени, основанные на результатах нескольких крупных рандомизированных плацебо-контролируемых исследований. В большинстве этих исследований успешное лечение приступов мигрени имело в своей основе следующие критерии [8]:
— отсутствие боли через 2 ч;
— уменьшение головной боли от умеренной или тяжелой к легкой или отсутствие боли через 2 ч [6];
— стойкий эффект при двух из трех приступов;
— отсутствие повторного возникновения головной боли и неупотребление лекарств в течение последующих 24 ч после успешного лечения (так называемое устойчивое снижение боли или отсутствие боли).
Для купирования острых мигренозных приступов используют: неспецифические препараты (анальгетики и нестероидные противовоспалительные препараты (НПВП)) и специфические для данного заболевания (производные эрготамина и триптаны).
Лечение приступов мигрени носит пошаговый характер.
Первый этап лечения приступа мигрени с высоким уровнем достоверности включает назначение нестероидных противовоспалительных препаратов в монотерапии или в комбинации с противорвотными средствами (домперидон, метоклопрамид).
При этом желательно использовать растворимые или рассасываемые таблетки, принимать препарат в самом начале приступа в адекватной дозе. При наличии у пациента рвоты предпочтительны препараты в форме ректальных свечей. При рецидиве приступа в течение 48 часов допускается повторный прием препарата. Опиоидные анальгетики не должны рутинно назначаться для терапии приступов мигрени ввиду риска развития головной боли вследствие чрезмерного использования лекарственных средств.
Эффективность НПВП при мигрени связана с подавлением нейрогенного воспаления в мозговой оболочке. Противовоспалительная активность препаратов реализуется за счет антиэкссудативного действия и уменьшения алгогенного действия медиаторов воспаления. Антиэкссудативные свойства обусловливают уменьшение воспалительного отека, оказывающего механическое давление на болевые рецепторы тканей. Ингибирующее влияние этих препаратов на выработку и активность медиаторов воспаления уменьшает воздействие на нервные окончания таких биологически активных веществ, как субстанция Р, пептид, связанный с геном кальцитонина (CGRP), простагландины, брадикинин, гистамин, серотонин [5]. Важно отметить, что ингибирование синтеза простагландинов уменьшает вызываемую ими сенсибилизацию болевых рецепторов к действию других химических и механических раздражителей. Уменьшение биосинтеза простагландинов в большей степени коррелирует с обезболивающим эффектом НПВП, чем с их противовоспалительным действием [6].
В ЦНС НПВП оказывают болеутоляющее действие за счет ингибирования синтеза простагландинов (ПГ1, ПГ2 и ПГ2-альфа), участвующих в проведении болевой информации. Полагают, что снижение уровня простагландинов в ЦНС вызывает подавление боли вследствие усиления высвобождения норадреналина и повышения его стимулирующего влияния на альфа-адренорецепторы [9]. Показано также, что в центральное болеутоляющее действие ненаркотических анальгетиков и НПВП вовлечена нисходящая тормозная серотонинергическая система и это действие реализуется, в частности, через серотониновые рецепторы спинного мозга и чувствительного ядра тройничного нерва. В целом анальгетическая активность многих НПВП в отношении воспаленной ткани не уступает активности наркотических анальгетиков [5].
Исходя из вышеизложенного, лекарственными средствами выбора для терапии приступа мигрени легкой или средней тяжести признаны НПВП [10]. Свидетельством эффективного лечения мигрени является по крайней мере одно плацебо-контролируемое исследование, в котором изучались ацетилсалициловая кислота (АСК) до 1000 мг [11], ибупрофен 200–800 мг [11], диклофенак 50–100 мг [12], феназон 1000 мг [13], метамизол 1000 мг [14], толфенаминовая кислота 200 мг [15] и парацетамол 1000 мг [16]. Кроме того, фиксированные комбинации АСК, парацетамола и кофеина являются эффективными при лечении острой мигрени, а также более эффективны, чем отдельные вещества или их сочетания без кофеина [17]. Внутривенное введение АСК более эффективно, чем подкожное введение эрготамина; внутривенное введение метамизола превосходит плацебо в случае приступа мигрени без ауры или с аурой. Лизин-АСК в сочетании с метоклопрамидом имели сопоставимую эффективность с суматриптаном. Растворимая форма АСК 1000 мг, вероятно, так же эффективна, как ибупрофен 400 мг и как суматриптан 50 мг [11].
НПВП, включая напроксен натрия [18], являются эффективными в лечении мигрени и сопутствующих симптомов, но желудочно-кишечные побочные эффекты являются общими [19].
Напроксен является эффективным неселективным ингибитором циклооксигеназы (ЦОГ), в результате чего осуществляет ингибирование синтеза простагландинов, опосредованное с помощью как ЦОГ-1, так и ЦОГ-2. Напроксен натрия улучшает действие напроксена, достигая быстрого поглощения и раннего начала действия.
Согласно данным клинических исследований, напроксен натрия обеспечивает лучшее облегчение головной боли по сравнению с плацебо в лечении мигрени [20–22]. Напроксен натрия является препаратом выбора первого порядка для лечения острого приступа мигрени [10] и препаратом второго порядка для профилактики мигрени [23].
Согласно данным Британской ассоциации лечения головной боли (2010 г.), напроксен в дозировке 1000 мг является препаратом первой линии выбора для лечения мигрени [24].
Напроксен натрия имеет более новую, эффективную молекулу по сравнению с ибупрофеном, парацетамолом, АСК, кетопрофеном, которые сейчас наиболее широко представлены, в связи с чем его можно применять пациентам с высоким кардиоваскулярным риском [20].
Анализ частоты возникновения инфаркта миокарда проводился по результатам 29 исследований, в которых было зафиксировано 554 события. Для трех препаратов (напроксен, диклофенак и эторикоксиб) риск развития инфаркта миокарда не превышал такового при использовании плацебо. Прием остальных препаратов, как представлялось, был связан с увеличенным риском в сравнении с плацебо.
Анализ сердечно-сосудистой смертности, составлявшей 46 % всех смертельных исходов, проводился по результатам 26 исследований, в которых было зафиксировано 312 событий. Существуют определенные доказательства увеличения риска наступления смерти от сердечно-сосудистых причин вследствие приема любого из НПВП, кроме напроксена, в сравнении с плацебо. Расчетные уровни относительного риска были выше 1,3 для ибупрофена (2,39; 0,69–8,64), диклофенака (3,98; 1,48–12,70), целекоксиба (2,07; 0,98–4,55), эторикоксиба (4,07; 1,23–15,70), рофекоксиба (1,58; 0,88–2,84), люмиракоксиба (1,89; 0,64–7,09).
Анализ общей смертности проводился по результатам 28 исследований, в которых было зафиксировано 676 событий. Прием любого из НПВП, как представлялось, был связан с увеличением риска наступления смерти от любой причины в сравнении с плацебо. Расчетные уровни относительного риска были выше 1,3 для ибупрофена (1,77; 0,73–4,30), диклофенака (2,31; 1,00–4,95), целекоксиба (1,50; 0,96–2,54), эторикоксиба (2,29; 0,94–5,71), рофекоксиба (1,56; 1,04–2,23) и люмиракоксиба (1,75; 0,78–4,17) [25].
В Украине напроксен натрия представлен препаратом Налгезин форте 550 мг рецептурного отпуска и Налгезин 275 мг безрецептурного отпуска, которые эффективны при лечении мигрени и других видов головной боли различной интенсивности и локализации.
Табл. 1 содержит обзор анальгетиков, эффективных при лечении приступа мигрени [10].
Для лечения тошноты и возможной рвоты при приступах мигрени рекомендуется прием противорвотных препаратов. Существует версия, что эти препараты улучшают резорбцию анальгетиков [26]. Метоклопрамид также обладает собственной средней анальгетической эффективностью при пероральном использовании и высокой эффективностью при внутривенном введении [26]. В табл. 2 представлены противорвотные средства, рекомендуемые для использования при приступах мигрени [10].
Для купирования приступа мигрени с успехом применяется препарат дифметре (шипучие таблетки). В состав препарата входит: 25 мг индометацина, 2 мг прохлорперазина, 75 мг кофеина. Дифметре рекомендовано применять как можно раньше после начала головной боли. При недостаточной эффективности можно повторить прием препарата через 2 часа.
Таким образом, препаратами первого выбора для купирования приступов при мигрени являются ацетилсалициловая кислота в дозе от 500 до 1000 мг, парацетамол — 500–1000 мг, ибупрофен в дозе 400–800 мг, напроксен натрия — 500–1000 мг.
Следует отметить, что высокие дозы ацетилсалициловой кислоты и парацетамола могут быть причиной заболеваний желудочно-кишечного тракта. Напроксен натрия является более безопасным препаратом по сравнению с ибупрофеном, парацетамолом, ацетилсалициловой кислотой, кетопрофеном [60].
Другие НПВП (толфенамовая кислота, диклофенак и флурбипрофен) также могут быть использованы для лечения приступов мигрени.
Комбинированные анальгетики более эффективны, чем простые, в лечении острого приступа мигрени. Однако эти препараты, особенно кофеинсодержащие, могут повышать риск возникновения абузусной головной боли. В целях предотвращения приступов головной боли, вызванных передозировкой лекарственных средств, прием простых анальгетиков должен быть ограничен 15 днями в месяц и комбинированных анальгетиков — 10 днями в месяц [10].
Если приступы не удается купировать с помощью НПВП, назначают препараты с более выраженным специфическим действием — триптаны (перорально). Они рекомендованы для купирования приступов мигрени любой степени тяжести.
Второй этап лечения приступа мигрени с высоким уровнем достоверности включает:
— триптаны (суматриптан, золмитриптан, алмотриптан и др.);
— препараты эрготаминового ряда.
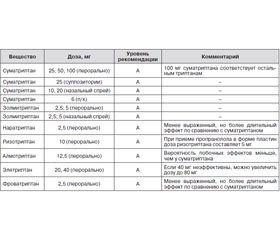
Клиническая эффективность триптанов при мигрени доказана в больших плацебо-контролируемых исследованиях, результаты которых отражены в нескольких опубликованных сравнительных анализах [27, 28]. Агонисты рецептора 5-HT1B/1D — суматриптан, золмитриптан, наратриптан, ризатриптан, алмотриптан, элетриптан и фроватриптан — являются лекарственными средствами для лечения мигрени и не должны применяться при других видах головной боли, за исключением кластерной головной боли. Различные триптаны для терапии мигрени приведены в табл. 3 [10]. Для суматриптана и золмитриптана проведены сравнительные исследования с АСК и метоклопрамидом [28]. В этих сравнительных исследованиях триптаны не были вообще или были лишь немного более эффективными, чем АСК. Примерно в 60 % случаев отсутствия эффекта от применения нестероидных противовоспалительных средств эффективны триптаны [29]. Суматриптан 6 мг подкожно является более эффективным средством, чем внутривенное введение АСК 1000 мг, но обладает большим количеством побочных эффектов [30]. Триптаны могут быть эффективными в любое время при приступе мигрени. Однако есть свидетельства того, что раннее применение триптанов более эффективно [28, 29].
/107.jpg)
Среди пероральных триптанов для купирования приступов мигрени предпочтение следует отдавать золмитриптану (1,25–2,50 мг, при необходимости повторно через 2 ч, максимальная доза — 10 мг/сут), алмотриптану (12,5 мг), элетриптану (40–80 мг) или ризатриптану (10 мг).
Если отсутствует ответ на лечение определенным триптаном, необходимо назначить другой препарат этого класса.
При приступе мигрени триптаны следует использовать в самом начале или вскоре после начала фазы головной боли. Триптаны нельзя принимать более 10 дней в месяц, так как это повышает риск лекарственно индуцированной головной боли [31]. Для определения оптимального препарата рекомендуется последовательно назначить несколько триптанов в различных лекарственных формах. При неэффективности первой дозы триптана прием второй дозы не рекомендуется.
Комбинация суматриптана (50–100 мг) и напроксена натрия (500 мг) может быть полезным терапевтическим подходом при приступе мигрени, особенно при длительных и часто повторяющихся приступах [32].
Необходимо помнить об основных побочных эффектах при использовании всех триптанов: дискомфорте в груди, тошноте, парестезиях, усталости [33].
Общие противопоказания для назначения триптанов: артериальная гипертензия (нелеченая), ишемическая болезнь сердца, цереброваскулярные болезни, болезнь Рейнауда, беременность и кормление грудью, возраст до 18 лет (за исключением суматриптана в форме назального спрея) и старше 65 лет, тяжелые заболевания печени или почек [33].
Одной из наиболее сложных проблем в лечении приступа мигрени является рецидив головной боли, который определяется как усиление головной боли после ее отсутствия или наличия боли легкой степени, возникший в течение 24 ч после приема препарата. Согласно данным международных исследований, около 15–40 % пациентов, принимающих перорально триптан, испытывают рецидивы [32, 35, 36].
Эрготамин раньше был основным препаратом в лечении мигрени, но в настоящее время он не относится к препаратам выбора для купирования острых мигренозных приступов. В отдельных случаях (при очень длительных и частых приступах и при неэффективности других препаратов) эффективным является эрготамин. Использование инъекционной формы дигидроэрготамина и новой лекарственной формы дигидроэрготамина — спрея является перспективным в лечении головной боли. При редких приступах головной боли и отсутствии терапевтического эффекта от анальгетиков и НПВП, а также триптанов может быть эффективным назначение эрготамина (1–2 мг) или дигидроэрготамина (2 мг) в форме назального спрея.
Существует ряд других препаратов, эффективность которых доказана в единичных исследованиях. Так, имеются доказательства, что внутривенное введение вальпроевой кислоты в дозе 300–800 мг эффективно при лечении приступа мигрени [37, 38], а введение флунаризина способствует быстрому купированию приступа [39]. Однако доказательства являются слабыми. Трамадол в комбинации с парацетамолом также показал эффективность при лечении приступов мигрени [40]. Тем не менее опиоиды имеют лишь незначительную эффективность и не могут быть рекомендованы для широкого применения в клинической практике.
Профилактика мигрени
Лекарственная профилактическая терапия оправданна при частых (не менее 3 раз в месяц) тяжелых приступах мигрени, а также при наличии коморбидных нарушений, если они существенно нарушают состояние пациентов в межприступном периоде и качество жизни в целом. К таким нарушениям относятся эмоциональные (депрессия и повышенная тревога) и вегетативные (панические атаки, гипервентиляционный синдром) расстройства, нарушения ночного сна, дисфункция перикраниальных мышц и др.
Профилактическое лечение мигрени рекомендовано примерно 1/3 пациентов.
Результаты исследований показали, что проведение профилактики на 50 % снижает тяжесть и частоту эпизодов головной боли.
Наряду с профилактическим лечением мигрени больному должна быть назначена соответствующая терапия для купирования приступов мигрени.
С целью профилактики мигрени используют β-блокаторы, антиконвульсанты, антидепрессанты и другие лекарственные средства [41–59]. Пропранолол в дозе от 40 до 120 мг 2 раза в сутки, метопролол в дозе 25–100 мг 2 раза в сутки рекомендованы в качестве терапии первой линии для профилактики мигрени. Тимолол, атенолол, надолол могут использоваться в качестве альтернативы пропранололу для профилактики мигрени.
У пациентов с эпизодической и хронической мигренью рекомендовано применение топирамата в дозе 50–200 мг/сут для снижения частоты эпизодов и тяжести головной боли.
У больных с эпизодической мигренью рекомендовано использование вальпроата натрия в дозе 400–600 мг 2 раза в сутки для снижения частоты эпизодов и тяжести головной боли.
Пациентам с эпизодической и хронической мигренью может быть назначен габапентин в дозе 1200–2400 мг/сут для снижения частоты эпизодов головной боли.
В профилактике мигрени эффективны антидепрессанты. Амитриптилин в дозе 25–75 мг/сут на ночь рекомендован пациентам, которым необходима профилактика мигрени. Венлафаксин в дозе 75–150 мг/сутки является эффективным альтернативным по отношению к трициклическим антидепрессантам профилактическим подходом. Селективные ингибиторы обратного захвата серотонина не рекомендованы для профилактики мигрени.
Польза пизотифена в профилактике мигрени ограниченна.
Метисергид может быть эффективен, однако должен использоваться только под наблюдением специалиста.
Имеются данные об эффективности лизиноприла, кандесартана, некоторых нутрицевтиков (рибофлавин, коэнзим Q).
В последнее время появились новые методы профилактики мигрени.
Существуют данные об эффективности методов нейромодуляции (стимуляция большого затылочного нерва) в профилактике мигрени.
Эффективность и безопасность ботулотоксина типа А продолжает изучаться в клинических исследованиях.
Вопрос о прекращении профилактической терапии решают в индивидуальном порядке (обычно через 6–12 мес. после достижения стабильного клинического эффекта).
Пациенты с мигренью обладают большой чувствительностью к воздействию различных провоцирующих факторов: короткого или продолжительного сна, голодания, перемены погоды, изменения характера физической нагрузки, стресса.
Поэтому пациентам с мигренью рекомендованы размеренный образ жизни и соблюдение режима дня.
Ожирение может быть фактором риска прогрессирования эпизодической мигрени с переходом в хроническую форму. Поэтому рекомендуется нормализация массы тела.
Приступ мигрени могут вызывать: пропуск приема пищи, употребление алкоголя, некоторых продуктов (шоколад, кофе, сыры, орехи), пищевых добавок и консервантов (нитриты, нитраты, глутамат натрия, аспартам). Следует избегать этих провоцирующих факторов.
У некоторых пациентов могут оказаться эффективными биологическая обратная связь, обучение технике релаксации и поведенческая терапия; в ряде исследований получены данные, что эти методы позволяют уменьшить частоту приступов мигрени на 30–40 %.
Эффективность методов альтернативной медицины (акупунктура, мануальная терапия, гипноз и др.) не доказана.
Таким образом, проведенный анализ литературных данных позволяет сделать следующие выводы:
1. Препаратами первой линии для лечения мигрени с доказанной эффективностью являются НПВП и триптаны. Комбинированное применение НПВП и триптанов позволяет более эффективно купировать головную боль и предупредить рецидив мигрени.
2. Одним из наиболее эффективных НПВП для лечения и профилактики мигрени является напроксен натрия. В Украине напроксен натрия представлен препаратом Налгезин форте 550 мг рецептурного отпуска и Налгезин 275 мг безрецептурного отпуска, который эффективен при лечении мигрени и других видов головной боли различной интенсивности и локализации.
3. Назначение профилактического лечения рекомендовано примерно 1/3 пациентов с мигренью. Лекарственная профилактическая терапия включает: бета-блокаторы, блокаторы кальциевых каналов, противоэпилептические препараты, НПВП, антидепрессанты и др. Выбор лекарственного средства должен рассматриваться индивидуально для каждого больного с учетом эффективности, переносимости, безопасности данных препаратов, а также наличия коморбидной патологии.
Список литературы
1. Lipton R.B., Bigal M.E. Migraine: Epidemiology, impact, and risk factors for progression // Headache. — 2005. — 45 (Suppl. 1). — P. 3-13.
2. Headache Classification Committee for the International Headache Society. The international classification of headache disorders: Second edition // Cephalalgia. — 2004. — 24 (Suppl. 1). — P. 1-151.
3. Kelman L., Tanis D. The relationship between migraine pain and other associated symptoms // Cephalalgia. — 2006. — 26. — P. 548-553.
4. Landy S. Migraine throughout the life cycle. Treatment through the ages // Neurology. — 2004. — 62 (Suppl. 2). — P. 2-8.
5. Jenkins D., Feniuk W., Humphrey P. Characterization of the prostanoid receptor types involved in mediating calcitonin generelated peptide release from cultured rat trigeminal neurones // Br. J. Pharmacol. — 2001. — 134. — P. 1296-1302.
6. Stephanie A., Edvinsson L. Treatment of migraine attacks based on the interaction with the trigemino-cerebrovascular system // J. Headache Pain. — 2008. — 9. — P. 5-12.
7. Beithon J. et al. Institute for Clinical Systems Improvement // Diagnosis and Treatment of Headache. — 2013.
8. Tfelt-Hansen P., Block G. et al. Guidelines for controlled trials of drugs in migraine: second edition // Cephalalgia. — 2000. — 20. — P. 765-786.
9. Lipton R., Bigal M., Diamond M. et al. Migraine prevalence, disease burden, and the need for preventive therapy // Neurology. — 2007. — 68. — P. 343-349.
10. Evers S., Afra J., Frese A. et al. EFNS guideline on the drug treatment of migraine — revised report of an EFNS task force // European Journal of Neurology. — 2009. — 16. — P. 968-981.
11. Diener H., Bussone G., Liano H. et al. Placebo-controlled comparison of effervescent acetylsalicylic acid, sumatriptan and ibuprofen in the treatment of migraine attacks // Cephalalgia. — 2004. — 24. — P. 947-954.
12. Dahlof C., Bjorkman R. Diclofenac-K (50 and 100 mg) and placebo in the acute treatment of migraine // Cephalalgia. — 1993. — 13. — P. 117-123.
13. Gobel H., Heinze A., Niederberger U. et al. Efficacy of phenazone in the treatment of acute migraine attacks: a double-blind, placebo-controlled, randomized study // Cephalalgia. — 2004. — 24. — P. 888-893.
14. Tulunay F., Ergun H., Gulmez S. et al. The efficacy and safety of dipyrone (Novalgin) tablets in the treat ment of acute migraine attacks: a double-blind, cross over, randomized, placebo-controlled, multi-center study // Funct. Neurol. — 2004. — 19. — P. 197-202.
15. Myllyla V., Havanka H., Herrala L. et al. Tolfenamic acid rapid release versus sumatriptan in the acute treatment of migraine: comparable effect in a double-blind, randomized, controlled, parallel-group study // Headache. — 1998. — 38. — P. 201-207.
16. Lipton R., Baggish J., Stewart W., Codispoti J. Efficacy and safety of acetaminophen in the treatment of migraine: results of a randomized, double-blind, placebo-controlled, population-based study // Arch. Intern. Med. — 2000. — 160. — P. 3486-3492.
17. Diener H., Pfaffenrath V., Pageler L. The fixed combination of acetylsalicylic acid, paracetamol and caffeine is more effective than single substances and dual combination for the treatment of headache: a multi-centre, randomized, double-blind, single-dose, placebo-controlled parallel group study // Cephalalgia. — 2005. — 25. — P. 776-787.
18. Johnson E., Ratcliffe D., Wilkinson M. Naproxen sodium in the treatment of migraine // Cephalalgia. — 1985. — 5. — P. 5-10.
19. Rasmussen M., Binzer M. Non-steroidal antiinflammatory drugs in the treatment of migraine // Current Medical Research and Opinion. — 2001. — 17 (Suppl. 1). — P. 26-29.
20. Brandes J., Kudrow D., Stark S. et al. Sumatriptan-naproxen for acute treatment of migraine: a randomized trial // JAMA. — 2007. — 297. — P. 1443-1454.
21. Johnson E., Ratcliffe D., Wilkinson M. Naproxen sodium in the treatment of migraine // Cephalalgia. — 1985. — 5. — P. 5-10.
22. Nestvold K., Kloster R., Partinen M., Sulkava R. Treatment of acute migraine attack: Naproxen and placebo compared // Cephalalgia. — 1985. — 5. — P. 115-119.
23. Ziegler D., Ellis D. Naproxen in prophylaxis of migraine // Arch. Neurol. — 1985. — 42. — P. 582-584.
24. Guidelines of the British Association for the study of headache. — 2010. — http://www.bash.org.uk/guidelines/primary-headache-disorders/
25. Sven Trelle, Stephan Reichenbach, Simon Wandel, Pius Hildebrand, Beatrice Tschannen, Peter M. Villiger, Matthias Egger, Peter Jüni. Кардиоваскулярная безопасность нестероидных противовоспалительных препаратов: сетевой метаанализ // Международный неврологический журнал. — 2013. — № 1(33). — С. 62-77.
26. Friedman B., Corbo J., Lipton R. et al. A trial of metoclopramide vs sumatriptan for the emergency department treatment of migraines // Neurology. — 2005. — 64. — P. 463-468.
27. Ferrari M., Roon K., Lipton R., Goadsby P. Oral triptans (serotonin 5-HT1B//1D agonists) in acute migraine treatment: a meta-analysis of 53 trials // Lancet. — 2001. — 358. — P. 1668-1675.
28. Lainez M., Galvan J., Heras J., Vila C. Crossover, double-blind clinical trial comparing almotriptan and ergotamine plus caffeine for acute migraine therapy // Eur. J. Neurol. — 2007. — 14. — P. 269-275.
29. Diamond M., Hettiarachchi J., Hilliard B., Sands G., Nett R. Effectiveness of eletriptan in acute migraine: primary care for Excedrin nonresponders // Headache. — 2004. — 44. — P. 209-216.
30. Diener H. Efficacy and safety of intravenous acetylsalicylic acid lysinate compared to subcutaneous sumatriptan and parenteral placebo in the acute treatment of migraine. A double-blind, double-dummy, randomized, multi-center, parallel group study // Cephalalgia. — 1999. — 19. — P. 581-588.
31. Bigal M., Serrano D., Buse D. et al. Acute migraine medications and evolution from episodic to chronic migraine: a longitudinal population-based study // Headache. — 2008. — 48. — P. 1157-1168.
32. Limmroth V., Kazarawa S., Fritsche G., Diener H. Headache after frequent use of new serotonin agonists zolmitriptan and naratriptan // Lancet. — 1999. — P. 353-378.
33. Katsarava Z., Fritsche G., Muessig M. et al. Clinical features of withdrawal headache following overuse of triptans and other headache drugs // Neurology. — 2001. — 57. — P. 1694-1698.
34. Brandes J., Kudrow D., Stark S. et al. Sumatriptan-naproxen for acute treatment of migraine: a randomized trial // JAMA. — 2007. — 297. — P. 1443-1454.
35. Bates D., Ashford E., Dawson R. et al. Subcutaneous sumatriptan during the migraine aura // Neurology. — 1994. — 44. — P. 1587-1592.
36. Olesen J., Diener H., Schoenen J., Hettiarachchi J. No effect of eletriptan administration during the aura phase of migraine // Eur. J. Neurol. — 2004. — 11. — P. 671-677.
37. Edwards K., Norton J., Behnke M. Comparison of intravenous valproate versus intramuscular dihydroergotamine and metoclopramide for acute treatment of migraine headache // Headache. — 2001. — 41. — P. 976-980.
38. Leniger T., Pageler L., Stude P. et al. Comparison of intravenous valproate with intravenous lysine-acetylsalicylic acid in acute migraine attacks // Headache. — 2005. — 45. — P. 42-46.
39. Soyka D., Taneri Z., Oestreich W., Schmidt R. Flunarizine i.v. in the acute treatment of the migraine attack. A double-blind placebo-controlled study // Cephalalgia. — 1988. — 8 (Suppl. 8). — P. 35-40.
40. Silberstein S., Freitag F., Rozen T. et al. Tramadol acetaminophen for the treatment of acute migraine pain: findings of a randomized, placebo-controlled trial // Headache. — 2005. — 45. — P. 1317-1327.
41. Sorensen P., Larsen B., Rasmussen M. et al. Flunarizine versus metoprolol in migraine prophylaxis: a double-blind, rando-mized parallel group study of efficacy and tolerability // Headache. — 1991. — 31. — P. 650-657.
42. Gawel M., Kreeft J., Nelson R. et al. Comparison of the efficacy and safety of flunarizine to propranolol in the prophylaxis of migraine // Can. J. Neurol. Sci. — 1992. — 19. — P. 340-345.
43. Worz R., Reinhardt-Benmalek B., Grotemeyer K. Bisoprolol and metoprolol in the prophylactic treatment of migraine with and without aura — a randomized double-blind cross-over multicenter study // Cephalalgia. — 1991. — 11 (Suppl. 11) — P. 152-153.
44. Stellar S., Ahrens S., Meibohm A., Reines S. Migraine prevention with timolol. A double-blind crossover study // JAMA. — 1984. — 252. — P. 2576-2580.
45. Johannsson V., Nilsson L., Widelius T. et al. Atenolol in migraine prophylaxis a double-blind cross-over multi- centrestud // Headache. — 1987. — 27. — P. 372-374.
46. Louis P. A double-blind placebo-controlled prophylactic study of flunarizine in migraine // Headache. — 1981. — 21. — P. 235-239.
47. Diamond S., Schenbaum H. Flunarizine, a calcium channel blocker, in the prophylactic treatment of migraine // Headache. — 1983. — 23. — P. 39-42.
48. Gerber W., Schellenberg R., Thom M. et al. Cyclande — late versus propranolol in the prophylaxis of migraine — a double-blind placebo-controlled study // Funct. Neurol. — 1995. — 10. — P. 27-35.
49. Diener H., Foh M., Iaccarino C. et al. Cyclandelate in the prophylaxis of migraine: a randomized, parallel, double-blind study in comparison with placebo and propranolol // Cephalalgia. — 1996. — 16. — P. 441-447.
50. Freitag F., Collins S., Carlson H. et al. A randomized trial of divalproex sodium extended-release tablets in migraine prophylaxis // Neurology. — 2002. — 58. — P. 1652-1659.
51. Brandes J., Saper J., Diamond M. et al. Topiramate for migraine prevention: a randomized controlled trial // JAMA. — 2004. — 291. — P. 965-973.
52. Diener H., Tfelt-Hansen P., Dahlof C. et al. Topiramate in migraine prophylaxis: results from a placebo-controlled trial with propranolol as an active control // J. Neurol. — 2004. — 251. — P. 943-950.
53. Steiner T., Findley L., Yuen A. Lamotrigine versus placebo in the prophylaxis of migraine with and without aura // Cephalalgia. — 1997. — 17. — P. 109-112.
54. Mathew N., Rapoport A., Saper J. et al. Efficacy of gabapentin in migraine prophylaxis // Headache. — 2001. — 41. — P. 119-128.
55. Silberstein S., Saper J., Berenson F. et al. Oxcarbazepine in migraine headache: a double-blind, randomized, placebo-controlled study // Neurology. — 2008. — 70. — P. 548-555.
56. Peto R., Gray R., Collins R. et al. Randomised trial of prophylactic daily aspirin in male British doctors // BMJ. — 1988. — 296. — P. 313-316.
57. Buring J., Peto R., Hennekens C. Low-dose aspirin for migraine prophylaxis // JAMA. — 1990. — 264. — P. 1711-1713.
58. Welch K., Ellis D., Keenan P. Successful migraine prophylaxis with naproxen sodium // Neurology. — 1985. — 35. — P. 1304-1310.
59. Bellavance A., Meloche J. A comparative study of naproxen sodium, pizotyline and placebo in migraine prophylaxis // Headache. — 1990. — 30. — P. 710-715.
60. McGettigan P., Henry D. Cardiovascular Risk with Non-Steroidal Anti-Inflammatory Drugs: Systematic Review of Population-Based Controlled Observational Studies // PLoS Med. — 2011. — 8(9): e1001098. — P. 1-18.

/106.jpg)
/107.jpg)