Резюме
У статті наведені дані дослідження ЕЕГ-корелятів порушення церебрального кровообігу та їх зв’язку з ризиком виникнення інсульту в пацієнтів із множинними «німими» інфарктами мозку (мНІМ). Аналіз біоелектричної активності мозку був проведений у 36 пацієнтів (середній вік 54,00 ± 3,22 року) із МРТ-ознаками поодинокого НІМ (пНІМ) та в 24 пацієнтів (середній вік 67,89 ± 1,84 року) із МРТ-ознаками мНІМ. Протягом року після ЕЕГ-дослідження в 4 пацієнтів із мНІМ стався симптомний інсульт. У пацієнтів із мНІМ числові показники ЕЕГ-корелятів порушення церебрального кровообігу значно відрізнялися від таких пацієнтів із пНІМ. Порівняно з пацієнтами з групи пНІМ для картини ЕЕГ пацієнтів із мНІМ було притаманне значне зниження спектральної потужності (за коефіцієнтом α/δ), щільності (14,87 ± 2,83 та 1,89 ± 0,49 мкВ2/Гц відповідно, р < 0,001) та індексу (39,18 ± 2,96 та 11,65 ± 1,17 % відповідно, р < 0,001) α-ритму на тлі зростання аналогічних показників δ-ритму. Загальна спектральна потужність ЕЕГ у пацієнтів групи мНІМ була в 2,3 раза нижчою, ніж у пацієнтів групи пНІМ (124,81 ± 18,24 та 285,03 ± 35,71 мкВ2 відповідно, р < 0,001), коефіцієнт потужності α/δ — у 7 разів меншим (0,35 ± 0,05 та 2,49 ± 0,34 відповідно, р < 0,001), а (δ + θ)/(α + β)-коефіцієнт — у 2,7 раза більшим (1,96 ± 0,26 та 0,71 ± 0,08 відповідно, р < 0,001). Саме зниження загальної спектральної потужності ЕЕГ, α/δ-коефіцієнта та підвищення (δ + θ)/(α + β)-коефіцієнта є найбільш показовими та загрозливими ЕЕГ-ознаками з точки зору ризику симптомного інсульту в пацієнтів із мНІМ.
В статье приведены данные исследования ЭЭГ-коррелятов нарушения церебрального кровообращения и их связи с риском возникновения инсульта у пациентов с множественными «немыми» инфарктами мозга (мНИМ). Анализ биоэлектрической активности мозга был проведен у 36 пациентов (средний возраст 54,00 ± 3,22 года) с МРТ-признаками одиночного НИМ (оНИМ) и у 24 пациентов (средний возраст 67,89 ± 1,84 года) с МРТ-признаками мНИМ. В течение года после ЭЭГ-обследования у 4 пациентов с мНИМ произошел симптомный инсульт. У пациентов с мНИМ числовые показатели ЭЭГ-коррелятов нарушения церебрального кровообращения значительно отличались от таковых пациентов с оНИМ. В сравнении с пациентами группы оНИМ для картины ЭЭГ пациентов с мНИМ было присуще значительное снижение спектральной мощности (по коэффициенту α/δ), плотности (14,87 ± 2,83 и 1,89 ± 0,49 мкВ2/Гц соответственно, р < 0,001) и индекса (39,18 ± 2,96 и 11,65 ± 1,17 % соответственно, р < 0,001) α-ритма на фоне увеличения аналогичных показателей δ-ритма. Общая спектральная мощность ЭЭГ у пациентов группы мНИМ была в 2,3 раза ниже, чем у пациентов в группе оНИМ (124,81 ± 18,24 и 285,03 ± 35,71 мкВ2 соответственно, р < 0,001), коэффициент мощности α/δ — в 7 раз ниже (0,35 ± 0,05 и 2,49 ± 0,34 соответственно, р < 0,001), а (δ + θ)/(α + β)-коэффициент — в 2,7 раза выше (1,96 ± 0,26 и 0,71 ± 0,08 соответственно, р < 0,001). Именно снижение общей спектральной мощности ЭЭГ, α/δ-коэффициента и повышение (δ + θ)/(α + β)-коэффициента являются наиболее показательными и угрожающими ЭЭГ-признаками с точки зрения риска симптомного инсульта у пациентов с мНИМ.
The article presents data from a study on the EEG-correlates of cerebral circulatory disorders and their relationship with risk of stroke in patients with multiple silent cerebral infarctions (mSCI). Analysis of bioelectrical activity of the brain was performed in 36 patients (mean age 54.00 ± 3.22 years) with MRI signs of a single SCI (sSCI) and in 24 patients (mean age 67.89 ± 1.84 years) with MRI signs of mSCI. Within a year after EEG examination, 4 patients with mSCI developed symptomatic stroke. In patients with mSCI, the numerical indicators of EEG-correlates of cerebral circulatory disorders were significantly different from those of patients with sSCI. Compared to the patients from sSCI group, the EEG-pattern in patients with mSCI was characterized by a significant reduction in the power spectrum (by the α/δ coefficient), density (14.87 ± 2.83 and 1.89 ± 0.49 mcV2/Hz, respectively, p < 0.001) and index (39.18 ± 2.96 and 11.65 ± 1.17 %, re-spectively, p < 0.001) of α-rhythm against the background of an increase of the same parameters of δ-rhythm. The total spectral power of the EEG in patients from mSCI group was 2.3 times lower than in patients from sSCI group (124.81 ± 18.24 and 285.03 ± 35.71 mcV2/Hz, respectively, p < 0.001), α/δ power factor — 7 times lower (0.35 ± 0.05 and 2.49 ± 0.34, respectively, p < 0.001), and (δ + θ)/(α + β) coefficient — 2.7 times higher (1.96 ± 0.26 and 0.71 ± 0.08, respectively, p < 0.001). This reduction in total spectral power of EEG, α/δ factor and increase of (δ + θ)/(α + β) coefficient are the most revealing and alarming EEG features in terms of the risk of symptomatic stroke in patients with mSCI.
Статтю опубліковано на с. 118-122
На сьогодні достеменно відомий характер змін цілої низки ЕЕГ-показників у короткостроковому періоді (від однієї години до доби) до виникнення гострого порушення церебрального кровообігу (вазоспазм, транзиторна ішемічна атака, інсульт), а також під час та після розгортання судинної катастрофи [1–6]. Але громоподібні зміни в ЕЕГ є ознакою вузькості терапевтичного вікна [4], тому дуже актуальним є питання визначення ЕЕГ-корелятів, що задовго до виникнення загрозливих для життя подій можуть бути значущими із точки зору предикції симптомного інсульту. Особливо важливим є вирішення цієї проблеми для пацієнтів групи ризику, зокрема осіб, у яких перебіг порушення мозкового кровообігу є практично безсимптомним — у хворих із «німими» інфарктами мозку (НІМ). Оскільки наявність асимптомних уражень мозку сама по собі більш ніж у 2 рази підвищує ризик виникнення симптомного інсульту, що збільшується зі зростанням їх кількості [7–9], дослідження стану ЕЕГ-корелятів, пов’язаних із ризиком інсульту в пацієнтів із множинними НІМ, є актуальним питанням.
Матеріали та методи
Аналіз біоелектричної активності мозку був проведений 60 пацієнтам із МРТ-ознаками «німих» інфарктів мозку. За кількістю та тяжкістю асимптомних інфарктів хворі були поділені на 2 групи: пацієнти з МРТ-ознаками поодинокого «німого» інфаркту мозку (пНІМ), хворі з множинними «німими» інфарктами мозку (мНІМ). Групу пНІМ становили 36 пацієнтів (у тому числі 21 жінка) віком від 33 до 69 років (середній вік 54,00 ± 3,22 року), а мНІМ-групу — 24 пацієнти (у тому числі 12 жінок) віком від 62 до 76 років (середній вік 67,89 ± 1,84 року).
Реєстрація ЕЕГ здійснювалася за допомогою комп’ютерного діагностичного комплексу «Нейрон-спектр +» від 20 електродів, що були розташовані згідно з міжнародною системою «10–20», у стані спокою. Для комп’ютерної оцінки потужності спектра, індексу ритмів використовувалися вільні від артефактів відтинки монополярного запису ЕЕГ (із 2 іпсилатеральними вушними електродами) за 10 епохами (тривалість кожної 2,56 с) для 5 діапазонів ритмів: δ (дельта) — 0–3 Гц, θ (тета) — 4–7 Гц, α (альфа) — 8–13 Гц, β1 (бета) — 14–19 Гц, β2 — 20–40 Гц. Для оцінки ЕЕГ-ознак ризиків інсульту було проведено визначення величини високочутливих маркерів та предикторів змін неврологічного статусу [4–7]: а) (δ + θ)/(α + β)- та α/δ-коефіцієнтів за співвідношенням потужностей певних частотних діапазонів спектра ЕЕГ; б) індексу симетрії мозкової активності (BSI — brain symmetry index) за усередненим показником симетричності спектральної потужності усіх частотних діапазонів ЕЕГ. Окрім того, для виявлення в цереброваскулярній системі найбільш уразливої до судинної катастрофи ланки проводився аналіз топографії змін індексу та потужності ритмів ЕЕГ, оскільки розміщення електродів відповідало основним супратенторіальним васкулярним територіям мозку: фронтоцентральний (F) — басейну передньої мозкової артерії, центротемпоральний (С-Т) — басейну середньої мозкової артерії, парієтально-окципітальний (Р-О) — басейну задньої мозкової артерії [4, 5].
Результати та їх обговорення
Кількісний аналіз показників ЕЕГ очікувано виявив розбіжності між хворими з поодиноким та множинними асимптомними ураженнями за величиною ЕЕГ-предикторів інсульту через наявність прямого зв’язку кількості НІМ із вірогідністю виникнення гострого інсульту [7–9]. Так, у нашому дослідженні протягом року після проведення даного ЕЕГ-обстеження в 4 пацієнтів (16,66 %) із мНІМ-групи стався гострий інсульт, в одному випадку з летальним результатом (4,17 %).
Найбільш характерними змінами в картині ЕЕГ, що спостерігаються при гострому порушенні церебрального току, є втрата швидкої активності (α- та β-діапазон) та посилення повільнохвильової активності (δ- та θ-діапазон). В основі цього феномену лежить зв’язок швидкості кровотоку в мозку з рівнем клітинного дихання: зміни швидкості церебрального кровотоку призводять до змін у кисневому обміні відповідно до змін метаболічної та електричної активності коркових нейронів, що неодмінно відбивається на ЕЕГ [11]. До того ж показник індексу δ-ритму має 100% чутливість до гострої ішемії та ішемічного інсульту [5]. Але представленість δ-ритму, як і α-ритму, у спектрі біоелектричної активності корелює зі швидкістю церебрального кровотоку не тільки під час гострих цереброваскулярних порушень. Підвищені показники представленості повільнохвильової активності та зниження α-ритму в спектрі ЕЕГ також є ознакою певного рівня ішемії та фактором ризику розвитку ішемічного інсульту, оскільки зниження церебрального метаболізму, що на ЕЕГ проявляється уповільненням, може не тільки слідувати за клінічним погіршенням, пов’язаним з ішемічним ураженням, але і передувати йому [4, 5]. У нашому дослідженні в пацієнтів із мНІМ, за даними комп’ютерного аналізу, на ЕЕГ спостерігалася дезорганізація біоелектричної активності, насамперед за рахунок збільшення питомого індексу δ-ритму практично в 2 рази (р < 0,001) та зниження відсотка α-ритму в спектрі ЕЕГ в 3,4 раза порівняно з пНІМ-групою (р < 0,001) (табл. 1).
/119.jpg)
Порівняльний аналіз топографії змін індексів ритмів продемонстрував, що, незважаючи на дифузний характер збільшення повільних хвиль на ЕЕГ, у пацієнтів із мНІМ порівняно з хворими з пНІМ найбільше зростання представленості δ-активності спостерігалося в тім’яно-потиличних зонах неокортексу — практично в 2 рази (р < 0,001), у лобних — у 1,4 раза (р < 0,001), у центрально-скроневих — до 1,7 раза (р < 0,001) (рис. 1). Зниження індексу α-ритму в пацієнтів із мНІМ порівняно з пацієнтами з пНІМ також найбільш вираженим було в тім’яно-потиличних ділянках кори — до 3,8–4 разів (р < 0,001), у передньо-центральних — до 3–3,2 раза (р < 0,001) (рис. 1). Таким чином, найбільше зростання індексів δ- та α-активності в задніх відділах неокортексу в пацієнтів із мНІМ дозволяє припустити, що зоною найбільшого ризику гострого інсульту при множинних асимптомних ураженнях мозку може бути басейн задньої мозкової артерії або суміжна зона басейнів середньої та задньої мозкових артерій.
/120.jpg)
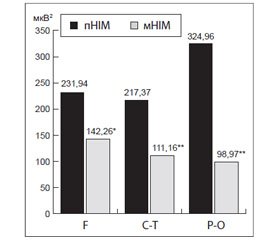
Наявність загрозливих змін церебрального кровообігу, з точки зору ризику виникнення гострого інсульту, у хворих із мНІМ також підтверджується зниженням питомого показника загальної потужності біоелектричної активності в діапазоні 0,5–40 Гц. У групі мНІМ цей показник був у 2,3 раза нижчим, ніж у пацієнтів із пНІМ: 124,81 ± 18,24 та 285,03 ± 35,71 мкВ2 відповідно (р < 0,001). Значущість виявленої в пацієнтів із НІМ різниці за даним ЕЕГ-показником обумовлена тим фактом, що загальна потужність біоелектричної активності мозку в діапазоні 1–30 Гц має 67% чутливість до ішемії, пов’язаної з фокальними ураженнями та 91% чутливість до усіх ішемічних подій, зокрема 100% чутливість до НІМ [4, 5, 12]. Інші параметри потужності демонструють нижчу чутливість до ішемічних подій: окремий показник потужності або коефіцієнт за α-ритмом — 64 %, δ-ритмом — 45 %, стиснутий спектральний розподіл — 44 % [4, 12].
Аналіз топографічних особливостей рівня нейрональної активності виявив у пацієнтів із мНІМ найбільше зниження (у 3,3 раза (р < 0,001)) загальної потужності біоелектричної активності в діапазоні 0,5–40 Гц у тім’яно-потиличній зоні кори, що супратенторіально відповідає басейну задньої мозкової артерії. У лобних та центрально-скроневих зонах неокортексу загальна потужність усіх ритмів ЕЕГ у пацієнтів із мНІМ була нижчою, ніж у хворих із пНІМ, у 1,6 (р < 0,01) та 2 (р < 0,001) рази відповідно (рис. 2). Таким чином, як і у випадку індексів δ- та α- ритмів, у показнику загальної потужності тім’яно-потиличної ділянки кори відобразилося зниження активності чутливих до ішемії пірамідних нейронів внаслідок порушення кровообігу в басейні задньої мозкової артерії [4, 5, 13].
/121.jpg)
Виявлене в пацієнтів із мНІМ зниження загальної потужності біоелектричної активності мозку, на відміну від пацієнтів із симптомним інсультом, було більшою мірою пов’язане зі зниженням потужності джерел α-активності, ніж із посиленням потужності повільнохвильових джерел. Якщо спектральна щільність δ-ритму в пацієнтів із мНІМ була лише на 20 % більшою за таку у хворих із пНІМ: 61,38 ± 9,81 та 50,41 ± 8,25 мкВ2/Гц відповідно, то спектральна щільність α-ритму в мНІМ-групі була майже в 8 разів меншою, ніж у пНІМ-групі: 1,89 ± 0,49 та 14,87 ± 2,83 мкВ2/Гц відповідно (р < 0,001).
Зниження потужності джерел біоелектричної активності мозку в діапазоні 8–30 Гц, що було властивим для хворих із мНІМ, відповідно відбилося на значенні таких чутливих ЕЕГ-показників ішемії, як коефіцієнти потужності (δ + θ)/(α + β) та α/δ. Так, α/δ-коефіцієнт у пацієнтів із мНІМ був у 7 разів нижчим, ніж у хворих із пНІМ-групи (0,35 ± 0,05 та 2,49 ± 0,34 відповідно, р < 0,001), у здорових осіб він становить у середньому 2,76 ± 0,42. Згідно з даними літератури, зниження α/δ-коефіцієнта пов’язане з розвитком відстроченої церебральної ішемії [14], до того ж, за даними одних авторів, коефіцієнт потужності α/δ продемонстрував щодо відстроченої церебральної ішемії чутливість та специфічність від достатньої до доброї [12, 15], інші дослідники чутливість α/δ-коефіцієнта оцінили в 89 %, а специфічність — у 84 % [14]. До того зменшення α/δ-коефіцієнта, відбиваючи наявність у пацієнтів із мНІМ ЕЕГ-ознак порушень церебрального кровообігу, може вказувати на підвищення ризику розвитку в цих хворих гострого ішемічного інсульту. На користь цього припущення говорить збільшення (δ + θ)/(α + β)-коефіцієнта, що є незалежним предиктором розвитку інсульту та несприятливого результату в пацієнтів із лакунарними ураженнями мозку: при (δ + θ)/(α + β) > 2,4 вірогідність розвитку гострого інсульту становить 13,00 (95% ДІ 1,11–152,35; р = 0,041) [3]. У мНІМ-групі цей коефіцієнт сягав рівня 1,96 ± 0,26, що в 2,7 раза перевищувало (δ + θ)/(α + β)-коефіцієнт у пНІМ-групі — 0,71 ± 0,08 (р < 0,001).
Ще одним важливим ЕЕГ-показником рівня функціональної активності мозку, у тому числі при порушеннях мозкового кровообігу, є індекс асиметрії мозку — BSI. За даними літератури, цей індекс є предиктором цілої низки неврологічних станів і здатен вказувати: при 0,05 < BSI < 0,12 із чутливістю у 95 % на раннє погіршення з виключенням інсульту, при BSI > 0,19 зі специфічністю в 90 % — на наявність гострого інсульту, при BSI > 0,22 зі 100% чутливістю та 78% специфічністю — на гостре погіршення після інсульту з несприятливим прогнозом та з точністю в 97 % — на летальний кінець [4, 16]. У пацієнтів із множинними асимптомними ураженнями мозку ішемічного походження збільшення індексу BSI від 0,12 підвищує ризик розвитку інсульту з коефіцієнтом вірогідності 2,69 (ДІ 1,24–5,82, p = 0,012) [3]. Як показали наші дослідження, у пацієнтів із мНІМ індекс BSI становив 0,09 ± 0,02, що вдвічі перевищувало показник здорових осіб (BSI = 0,042 ± 0,005) [17] та показник у пацієнтів із пНІМ (BSI = 0,04 ± 0,01) (р < 0,05).
На основі вищенаведеного аналізу даних електрографічного дослідження біоелектричної активності мозку пацієнтів із НІМ було показано, що за показниками ЕЕГ пацієнти з мНІМ мали значні вірогідні відмінності від пацієнтів із групи пНІМ. За нашими даними, для ЕЕГ пацієнтів із мНІМ була притаманна наявність більшості ЕЕГ-корелятів цереброваскулярних порушень. Усі виявлені у хворих із мНІМ важливі ЕЕГ-маркери церебральної ішемії за вірогідністю визначення ризику симптомного інсульту можна поділити на ті, що суттєво змінюються тільки під час розгортання інсульту, відображаючи локалізацію та обсяг крововиливу, та ті, що пов’язані зі змінами церебрального кровообігу будь-якого ступеня та можуть вказувати на відповідний ризик гострого інсульту. Як ЕЕГ-показники ризику інсульту в пацієнтів із мНІМ можуть використовуватися такі характеристики δ- та α-ритму, як спектральна потужність (за коефіцієнтом α/δ), щільність та індекс. За цими показниками ЕЕГ, окрім того, можна визначити найбільш уразливі ділянки цереброваскулярної системи, у пацієнтів із мНІМ — басейн задньої мозкової артерії або суміжна зона басейнів середньої та задньої мозкових артерій. Найбільш показовими та надійними, з точки зору визначення вірогідності виникнення симптомного інсульту, у пацієнтів із мНІМ є загальна потужність спектра ЕЕГ та коефіцієнти потужності α/δ та (δ + θ)/(α + β). Цей висновок обумовлений тим, що загальна спектральна потужність загалом відбиває рівень нейрональної активності, що напряму пов’язана з рівнем метаболізму та кисневого забезпечення нейронів; α/δ-коефіцієнт свідчить про ступінь, а (δ + θ)/(α + β)-коефіцієнт — про напрямок змін церебрального кровоплину (прискорення або уповільнення).
Висновки
1. У пацієнтів із МРТ-ознаками множинних «німих» інфарктів числові показники ЕЕГ-корелятів порушення церебрального кровообігу значно відрізняються від таких у пацієнтів із поодинокими асимптомними ураженнями мозку.
2. Для ЕЕГ пацієнтів із множинними асимптомними ураженнями притаманне зниження значень ЕЕГ-характеристик α-ритму (спектральна потужність, щільність, індекс) на тлі зростання аналогічних показників δ-ритму; зниження загальної спектральної потужності ЕЕГ, α/δ-коефіцієнта та підвищення (δ + θ)/(α + β)-коефіцієнта.
3. Найбільш показовими та загрозливими ЕЕГ-ознаками з точки зору ризику симптомного інсульту в пацієнтів із множинними асимптомними ураженнями мозку є показник загальної спектральної потужності ЕЕГ та (δ + θ)/(α + β)-коефіцієнт.
4. За значеннями більшості ЕЕГ-корелятів у пацієнтів із множинними «німими» інфарктами мозку найбільш уразливим до виникнення симптомного інсульту є басейн задньої мозкової артерії або суміжна зона басейнів середньої та задньої мозкових артерій.
Список литературы
1. Using continuous electroencephalography in the management of delayed cerebral ischemia following subarachnoid hemorrhage / R. Rathakrishnan, J. Gotman, F. Dubeau, M. Angle // Neurocrit. Care. — 2011. — V. 14. — P. 152-161.
2. Intracortical EEG for the detection of vasospasm in patients with poor-grade subarachnoid hemorrhage / R.M. Stuart, A. Waziri, D. Weintraub et al. // Neurocrit. Care. — 2010. — V. 13. — Р. 355-358.
3. Quantitative EEG in ischemic stroke: correlation with infarct volume and functional status in posterior circulation and lacunar syndromes / R.V. Sheorajpanday, G. Nagels, A.J. Weeren, P.P. De Deyn // Clin. Neurophysiol. — 2011. — V. 122. — № 5. — P. 884-890.
4. Handbook of ICU EEG monitoring / Ed. by Suzette M. LaRoche. — NY: Demos Medical, 2013. — 338 p.
5. Foreman B. Quantitative EEG for the detection of brain ischemia / B. Fore-man, J. Classen // Critical Care. — 2012. — V. 16, № 2. — P. 216-225.
6. Quantitative EEG in ischemic stroke: correlation with functional status after 6 months / R.V. Sheorajpanday, G. Nagels, A.J. Weeren et al. // Clin. Neurophysiol. — 2011. — V. 122. — № 5. — P. 874-883.
7. Vermeer S.E. Silent brain infarcts: a systematic review / S.E. Vermeer, W.T. Longstreth, P.J. Koudstaal // Lancet Neurol. — 2007. — V. 6, № 7. — P. 611-619.
8. Ritter M.A. Silent brain infarcts / M.A. Ritter, R. Dittrich, E.B. Ringelstein // Nervenarzt. — 2011. — V. 82, № 8. — P. 1043-1052.
9. Burden and outcome of prevalent ischemic brain disease in a national acute stroke registry / S. Koton, R. Tsabari, N. Molshazki et al. // Stroke. — 2013. — V. 44, № 12. — P. 3293-3297.
10. A promising method to distinguish vascular dementia from Alzheimer’s disease with standardized low-resolution brain electromagnetic tomography and quantitative EEG / L. Wu, L. Wu, Y. Chen, J. Zhou // Clin. EEG Neurosci. — 2014. — V. 45, № 3. — P. 152-157.
11. Hossmann K.A. Viability thresholds and the penumbra of focal ischemia / Ann. Neurol. — 1994. — V. 36. — Р. 557-565.
12. Quantitative EEG monitoring for patients with subarachnoid hemorrhage / D.R. Labar, B.J. Fisch, T.A. Pedley et al. // Electroencephalogr. Clin. Neurophysiol. — 1991. — V. 78. — Р. 325-332.
13. Amzica F. Cellular substrates of brain rhythms / F. Amzica, F.H. Lopes da Silva // In Niedermeyer’s Electroencephalography: Basic Principles, Clinical Applications, and Related Fields. — 6th ed. / Ed. by E. Niedermeyer, D.L. Schomer, F.H. Lopes da Silva. — Philadelphia: Wolters Kluwer/Lippincott Williams & Wilkins Health, 2010. — Р. 33-64.
14. Quantitative continuous EEG for detecting delayed cerebral ischemia in patients with poor-grade subarachnoid hemorrhage / J. Claassen, L.J. Hirsch, K.T. Kreiter et al. // Clin. Neurophysiol. — 2004. — V. 115. — Р. 2699-2710.
15. Early detection of vasospasm after acute subarachnoid hemorrhage using continuous EEG ICU monitoring / P.M. Vespa, M.R. Nuwer, C. Juhasz et al. // Electroencephalogr. Clin. Neurophysiol. — 1997. — V. 103. — Р. 607-615.
16. Additional value of quantitative EEG in acute anterior circulation syndrome of presumed ischemic origin / R.V. Sheorajpanday, G. Nagels, A.J. Weeren et al. // Clin Neurophysiol. — 2010. — V. 121, № 10. — Р. 1719-1725.
17. De Vos C.C. Continuous EEG monitoring during thrombolysis in acute hemispheric stroke patients using the brain symmetry index / C.C. de Vos, S.M. van Maarseveen, P.J. Brouwers, M.J. van Putten // J. Clin. Neurophysiol. — 2008. — V. 25, № 2. — P. 77-82.
/121.jpg)

/119.jpg)
/120.jpg)