Статья опубликована на с. 10-12 (Укр.)
В наши дни из-за быстрого старения населения остеоартроз (ОА) стал одной из основных медицинских проблем в большинстве развитых стран. По данным G.Y. Reginster (2003), распространенность ОА в популяции составляет 10 %, причем половина лиц старше 50 лет имеют его клинические и/или рентгенологические симптомы. В возрасте старше 70 лет рентгенологические признаки ОА находят у 90 % женщин и 80 % мужчин. При этом заболевании в первую очередь поражаются «нагрузочные» суставы, что значительно ухудшает качество жизни больных и представляет серьезную социально-экономическую проблему. И хотя развитие ОА не влияет на жизненный прогноз, это патологическое состояние является одной из основных причин преждевременной потери трудоспособности и инвалидизации.
До недавнего времени основными классами препаратов, применяемых для симптоматической терапии остеоартроза, были НПВП и хондропротекторы. Но, к сожалению, лекарственные средства с предположительно хондропротекторным действием не оправдали возлагавшихся на них надежд. Однако наука не стоит на месте, открывая дорогу новым классам препаратов — болезнь-модифицирующим, которые влияют как на симптомы болезни, так и на структуру суставных тканей, вовлеченных в патогенез заболевания. Эти лекарственные средства способны не только воздействовать на болевой синдром при остеоартрозе, но и замедлять прогрессирование заболевания.
1–3 июня в Одессе состоялся Восточноевропейский конгресс по боли, в рамках которого были рассмотрены актуальные вопросы лечения остеоартроза, направленного на обезболивание и замедление прогрессирование заболевания, а также возможности оценки потенциала медленнодействующих болезнь-модифицирующих препаратов (SYSADOA).
С докладом «Современные возможности оценки болезнь-модифицирующего потенциала препаратов для лечения остеоартроза» выступил главный внештатный ревматолог Министерства здравоохранения Украины, заведующий кафедрой внутренних болезней стоматологического факультета Национального медицинского университета им. А.А. Богомольца доктор медицинских наук, профессор Олег Борисович Яременко
На сегодняшний день одной из проблем современной ревматологии является отсутствие унифицированных методических подходов к оценке структурно-модифицирующего действия препаратов, применяемых для лечения остеоартроза. Вместе с тем именно замедление процесса деструкции хряща и рентгенологического прогрессирования ОА является одной из главных задач в лечении данного заболевания, а также критерием оценки эффективности терапии.
Согласно рекомендациям Ассоциации ревматологов Украины 2004 года, к критериям качества лечения остеоартроза относятся: отсутствие или значительное снижение проявлений суставного синдрома, отсутствие рецидивов синовита, улучшение качества жизни пациента; замедление рентгенологического прогрессирования процесса, деструктивных изменений суставного хряща по данным ультразвукового исследования суставов (УЗИ) и магнитно-резонансной томографии (МРТ).
Именно рентгенологическое исследование, УЗИ и МРТ являются основными инструментальными методами, позволяющими подтвердить замедление прогрессирования данной патологии при изучении потенциала медленнодействующих болезнь-модифицирующих препаратов.
Рентгенологическое исследование в клинической практике применяется уже давно, давая возможность установить диагноз и определить стадию остеоартроза. Обычно с этой целью используют полуколичественную оценку изменений по Kellgren и Lawrence, шкалу OARSI, а также измеряют степень сужения суставной щели.
Рентгенологическое исследование имеет ряд преимуществ, и прежде всего это дешевизна и доступность метода, позволяющего визуализировать остеофиты, выявить склероз и наличие кист. Однако ему присущи и существенные недостатки. Помимо того, что данный метод связан с вредным ионизирующим излучением, он не позволяет визуализировать хрящевую ткань. Кроме того, методика проведения рентгенологического исследования долгие годы не была унифицирована, позиция больного при проведении исследования в динамике не была строго установленной, могла изменяться, что приводило к несопоставимости результатов разных исследований и трудностям оценки динамики сужения суставной щели.
Однако несколько лет назад по рекомендации ЕМА и FDA методика проведения рентгенографии была стандартизирована, что позволило получить адекватное изображение и возможность более достоверного измерения ширины суставной щели. Согласно этой методике рентгенограмма переднезадней проекции коленного сустава производится в зафиксированном положении благодаря специальному фиксирующему устройству. Угол направления луча составляет 10°, ширина суставной щели измеряется на расстоянии 15 мм от ее края и на протяжении 3 см. Это позволяет более точно определить изменение суставной щели в динамике и использовать данный метод в рандомизированных клинических исследованиях для оценки рентгенологического прогрессирования заболевания.
Так, в исследовании, проведенном E. Maheu et al. (2013 г.) с участием 399 пациентов, изучалась эффективность Пиаскледина в лечении коксартроза и в качестве первичной конечной точки оценивалось рентгенологическое прогрессирование деструкции суставного хряща. Результаты исследования продемонстрировали, что применение Пиаскледина на протяжении 3 лет замедляет рентгенологическое прогрессирование: оно встречалось на 20 % реже, чем в группе контроля (рис. 1).
/10_u.jpg)
Для исследования суставов при остеоартрозе может также применяться УЗИ. Адекватность этого метода в решении поставленных задач сравнивалась с золотым стандартом в изучении суставов — артроскопией. Была показана высокая точность ультразвуковой визуализации изменений бедренного хряща в сравнении с данными, полученными при артроскопии. Кроме этого, результаты изучения корреляции величин толщины суставного хряща, полученных по данным УЗИ и по данным аутопсий, доказали возможность использования данного метода у больных ОА коленного сустава как с минимальными изменениями, так и при значительном поражении сустава. Однако методика УЗИ при данной патологии также не стандартизирована и потому не рекомендована для проведения рандомизированных исследований эффективности структурно-модифицирующей терапии остеоартроза.
Высокую оценку международных ассоциаций (OARSI, FDA) получила магнитно-резонансная томография, которая в настоящее время официально рекомендована для оценки морфологии хряща в рандомизированных клинических исследованиях. МРТ, обладающая высокой разрешающей способностью, в последние годы активно используется в ранней диагностике остеоартроза. Этот метод позволяет визуализировать субхондральные кисты, истончение хряща на определенных участках, определять содержание в хряще гликозаминогликанов, идентифицировать внутрихрящевые остеофиты. Таким образом, количественная МРТ на сегодня — это наиболее чувствительный и предпочтительный метод для ранней диагностики ОА и решения основных задач относительно контроля эффективности его лечения. Данный метод позволяет на качественно новом уровне доказательности демонстрировать наличие или отсутствие влияния терапии на деградацию хряща.
Как свидетельствуют результаты проведенных исследований, данные МРТ не всегда коррелируют с рентгенографическими изменениями. Так, в 2015 году было проведено исследование влияния глюкозамина сульфата и хондроитина сульфата на структурные изменения при ОА коленного сустава. По данным количественной МРТ, у больных с этой патологией, принимавших глюкозамина сульфат и хондроитина сульфат, через 24 месяца наблюдалось уменьшение потери объема хряща в отдельных регионах. Это регистрировалось как на фоне приема НПВС (у больных с меньшим сужением ширины суставной щели), так и без их приема (у больных с большим сужением ширины суставной щели). Эти данные свидетельствуют о болезнь-модифицирующем эффекте глюкозамина сульфата и хондроитина сульфата, который не идентифицируется рентгенографически.
Нередко ревматологи сталкиваются с диссоциацией между клиническими симптомами и структурно-морфологическими изменениями суставных тканей, в том числе хряща. Например, у пациентов с небольшими рентгенологическими изменениями может наблюдаться выраженная симптоматика и наоборот. Поэтому сохраняет актуальность оценка структурно-модифицирующего действия терапии ОА по другим параметрам — биомаркерам состояния хрящевой ткани. В первую очередь к таким биомаркерам относятся uCTX-II — продукт деградации коллагена ІІ типа, являющегося главным структурным компонентом хряща, и СОМР — неколлагеновый гликопротеин, который имеет хрящевое происхождение, но также выявляется во многих других тканях, включая синовиальные оболочки и сухожилия. Эти биомаркеры являются предикторами прогрессирования остеофитов и рентгенологического сужения суставной щели (только uCTX-II).
Кроме того, в качестве биомаркеров состояния суставного хряща на сегодняшний день рассматривают матриксные металлопротеазы (ММР), цитокины, фоллистатинподобный белок-1 (FSTL1), воспалительный белок макрофагов (MIP-1α), ИЛ-1α, ИЛ-2, ИЛ-15, ММР-7, фосфолипиды w-3 и w-6 PUFfs (полиненасыщенных жирных кислот), ИЛ-6, адипонектин, висфатин, лептин. Несмотря на наличие некоторых лимитирующих факторов (отсутствие линейной зависимости концентрации биомаркеров и изменений структурных параметров; взаимосвязь маркеров ОА с возрастными изменениями, независимыми от ОА), в настоящее время выполняется достаточно много работ, в которых исследуются вещества, которые могли бы играть роль биомаркеров метаболизма хряща. Также изучаются препараты, способные оказывать влияние на уровень биомаркеров.
В исследовании TROPOS I фазы с участием женщин с постменопаузальным остеопорозом было продемонстрировано влияние стронция ранелата на уровень маркера резорбции суставного хряща — С-телопептида коллагена ІІ типа. После 6 и 12 недель лечения данным препаратом в дозе 2 г/день уровень мочевого СТХ II понизился на 40 % по сравнению с базовыми показателями у 30 здоровых волонтеров.
В III фазе исследования TROPOS из 2617 пациентов, принимающих в течение 3 лет стронция ранелат по 2 г в день или плацебо, в группе стронция ранелата было показано снижение среднего уровня этого маркера на 15–20 % по сравнению с группой плацебо. Это является наглядным биохимическим подтверждением положительного влияния препарата на хрящевую ткань. Однако ЕМЕА до настоящего времени так и не одобрило стронция ранелат для лечения остеоартроза и ограничило его применение при остеопорозе из-за сердечно-сосудистых побочных эффектов.
Пиаскледин — препарат, который относится к группе медленнодействующих болезнь-модифицирующих препаратов (SYSADOA) и включает комплекс неомыляемых фитостеролов и насыщенных жирных кислот (неомыляемые соединения сои и авокадо в пропорции 1 : 2 — ASU), также продемонстрировал разнообразное влияние на биомаркеры, участвующие в деградации хряща. В ходе экспериментальных исследований, проведенных Е. Henrotin et al. в 1998 году, было установлено, что Пиаскледин снижает уровень металлопротеаз, принимающих участие в деградации коллагеновых фибрилл экстрацеллюлярного матрикса, и факторов, принимающих активное участие в развитии воспаления при ОА, — цитокинов IL-6 и IL-8, простагландина Е2.
В другом исследовании Y.E. Henrotin (2003), проведенном in vitro, было показано, что Пиаскледин ингибирует продукцию провоспалительных медиаторов IL-6 и IL-8, MIP-1β и синтез оксида азота.
Кроме того, получены интересные клинические данные (Altinel L., 2007), демонстрирующие способность Пиаскледина вызывать повышение уровня трансформирующего фактора роста TGF-β1 и TGF-β2 в синовиальной жидкости и хрящевой ткани коленных суставов, что свидетельствует о регенераторной способности этого препарата (рис. 2). Несмотря на то что уровень TGF-β1 и TGF-β2 через 3 месяца снижается, он по-прежнему остается значимым.
В собственном исследовании О.Б. Яременко и соавт. изучалось изменение уровня uCTX-II при лечении Пиаскледином больных с остеоартрозом коленных суставов. В исследовании приняли участие 8 пациентов (2 мужчин и 6 женщин) с данным диагнозом, средний возраст которых составил 60,80 ± 3,95 года, со II рентгенологической стадией ОА — 5, с III — 3.
Оценка результатов исследования показала, что Пиаскледин значительно снижает уровень uCTX-II. Если до лечения он составлял 13,38 мг/мл, то через месяц терапии — 2,62 мг/мл, через 3 месяца — 8,76 мг/мл (рис. 3).
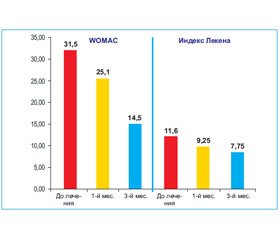
Также был изучен клинический ответ на лечение Пискледином. Было отмечено уменьшение интенсивности боли по шкале WOMAC: до лечения — 31,5 балла, через 1 и 3 месяца — 25,1 и 14,5 соответственно. По шкале Лекена определялось уменьшение боли и дискомфорта в суставах, улучшение ходьбы и повседневной активности (до лечения — 11,6 балла, через 1 и 3 месяца — 9,25 и 7,75 балла соответственно) (рис. 4).
Авторы пришли к выводу, что назначение Пиаскледина при остеоартрозе коленных суставов уменьшает боль, улучшает функциональное состояние суставов и повышает уровень повседневной активности.
В 2008 г. Christensen et al. был проведен метаанализ 4 рандомизированных клинических исследований по изучению эффективности Пиаскледина у 421 пациента с остеоартрозом тазобедренных и коленных суставов. Длительность исследований составила от 3 до 24 месяцев. В 3 исследованиях (F. Blotman, E. Maheu, Т. Appelboom) отмечался достоверно больший, чем при применении плацебо, положительный эффект Пиаскледина, лишь в исследовании M. Lequesne et al. симптоматический эффект Пиаскледина не отличался от эффекта плацебо. Также была установлена хорошая переносимость препарата и высокая приверженность пациентов к терапии (только 3 % больных прекратили лечение).
Таким образом, резюмируя все вышеперечисленное, можно сделать следующие выводы:
1. Количественная МРТ — наиболее чувствительный метод оценки структурно-модифицирующего действия препаратов для лечения остеоартроза, результаты которого не всегда коррелируют с рентгенографическими данными.
2. Применение МРТ позволяет на качественно новом уровне доказательности демонстрировать наличие/отсутствие влияния лечения на деградацию хряща.
3. Среди множества биомаркеров наиболее подходящими для оценки прогрессирования остеоартроза коленных суставов в клинических условиях являются uCTX-II (С-телопептид коллагена II типа в моче) и СОМР (олигомерный матриксный протеин хряща в сыворотке).
4. Применение Пиаскледина у больных с остеоартрозом коленных суставов, кроме симптоматического эффекта, сопровождается снижением сывороточного уровня маркера суставного хряща — u CTX-II, что свидетельствует о болезнь-модифицирующем действии препарата.

/10_u.jpg)
/12_u.jpg)
/12_u2.jpg)