Статья опубликована на с. 67-73
Менее чем у половины больных, поступивших с легкой закрытой черепно-мозговой травмой (ЛЗЧМТ), удается выявить симптомы поражения анимальной нервной системы (табл. 1).
/68.jpg)
При ЛЗЧМТ нередко только проявления вегетативных стигм позволяют объективно судить о перенесенной травме, ее тяжести и течении.
Нами было проведено углубленное изучение состояния вегетативной нервной системы (ВНС) с исследованием ее тонуса, реактивности и вегетативного обеспечения деятельности (ВОД) у 100 больных в остром периоде сотрясения головного мозга.
Вегетативный тонус определялся расчетом индекса Кердо, минутного объема крови (МО) и индекса МО. При вегетативной эйтонии вегетативный индекс Кердо (ВИ) = 0, МО = 4,4 л, индекс МО около 0. Преобладание симпатического тонуса проявляется положительным ВИ, увеличением МО и повышением индекса МО до 1,5–1,8; повышение парасимпатического тонуса — отрицательным ВИ, снижением МО и индекса МО до 0,7. Для определения межсистемных соотношений вычисляли коэффициент Хильдебранта — в норме от 2,8 до 4,9. Вегетативная реактивность изучалась с помощью рефлекса Даньини — Ашнера и ортостатической пробы Превеля. Замедление пульса при вызывании глазосердечного рефлекса на 6–12 ударов оценивалось как нормальная вегетативная реактивность (ВР), более выраженное — как повышение ВР, слабое замедление и его отсутствие — пониженная ВР, учащение (симпатическая реакция) — извращение вегетативной реактивности. При проведении ортостатической пробы ускорение пульса более чем на 24 удара и возрастание АД более чем на 20 мм рт.ст. указывает на повышение ВР симпатикотонической направленности. Падение систолического или диастолического давления более чем на 10–15 мм рт.ст. и учащение пульса не менее чем на 6 ударов в 1 мин происходит при пониженной вегетативной реактивности.
Вегетативное обеспечение деятельности обследовалось при физической и умственной нагрузке. Для моделирования допустимой для данной категории больных физической деятельности обследуемый лежа десятикратно максимально сжимал кистевой динамометр. Умственная деятельность заключалась в устном счете (вычитание по 7 от 200). По нашим данным, полученным при обследовании здоровых людей, при данной физической нагрузке наблюдается учащение пульса не более чем на 6 ударов в 1 мин и повышение АД не более чем на 10 мм рт.ст., а при устном счете — учащение пульса на 12–20 ударов в 1 мин. Эти показатели оценивались как нормальное вегетативное обеспечение, при превышении контрольных цифр — избыточное, при падении АД, замедлении или незначительном учащении пульса — недостаточное.
Изучение изменений вегетативной нервной системы при ЛЗЧМТ показало, что различные симптомы патологии этой системы прослеживаются у большинства больных на всем протяжении острого периода заболевания. Вегетативно-сосудистые и адаптационные нарушения возникают непосредственно после травмы, прослеживаются до наиболее позднего срока нашего наблюдения — 20–21-х суток и динамика их имеет свои характерные особенности.
В табл. 2 приведены изменения частоты сердечных сокращений, величины АД, лабильности пульса и АД, асимметрии АД у больных на протяжении острого периода.
/69.jpg)
Непосредственно после ЛЗЧМТ у половины больных наблюдается нарушение частоты сердечных сокращений и величины АД. Наиболее характерным для изменения пульса является возникновение у больных тахикардии, брадикардия отмечается у значительно меньшего количества больных, которое на всем протяжении острого периода почти не претерпевает изменений. Наибольшей выраженности в 1–2-е сутки достигает лабильность пульса, АД, а также повышение АД. Из приведенных в табл. 2 данных видно, что наибольшего проявления нарушения вегетативной регуляции сердечно-сосудистой системы достигли на 7–8-е сутки после ЛЗЧМТ. Это проявлялось наибольшими нарушениями сердечного ритма (у 61,7 % больных), нарушениями величины АД (у 50,6 % больных), асимметриями АД (у 40,7 % больных). Уже на 14–15-е сутки у большинства больных отмечается нормализация АД, наполовину уменьшается количество асимметрий АД, уменьшаются проявления тахикардии и лабильности пульса. На 20–21-е сутки у большинства больных происходит нормализация пульса (у 64,3 % больных) и АД (88,1 % больных). Полностью нивелируются проявления лабильности, асимметрии и повышения АД. Значительно уменьшается лабильность пульса и тахикардия у больных, лишь явления брадикардии не претерпевают никаких изменений.
Такая сложная гипоталамическая функция, как регуляция вегетативных межсистемных взаимоотношений, в остром периоде ЛЗЧМТ нарушается у небольшого числа больных и имеет убывающую динамику. Так, в 1–2-е сутки вегетативные взаимоотношения между сердечно-сосудистой и легочной системами были нарушены у 19 %, на 7–8-е сутки — у 13,6 % и на 14–15-е сутки — у 10,5 % больных. На 20–21-е сутки нарушений межсистемных отношений не отмечалось.
Приведенная в табл. 3 динамика вегетативного тонуса, вегетативной реактивности и вегетативного обеспечения деятельности на протяжении острого периода ЛЗЧМТ отражает сложные вегетативно-адаптационные нарушения, развивающиеся при этой патологии.
Определяющиеся в 1–2-е сутки изменения вегетативного тонуса показывают, что в этот срок наиболее характерна для больных в покое эйтония (57 % больных), а выраженность преобладания парасимпатического или симпатического тонуса почти одинакова. Вегетативный тонус на 7–8-е сутки, не считая небольшого увеличения числа больных с ваготонией, не претерпевал никаких изменений. На 14–15-е сутки отмечается значительное увеличение, особенно по сравнению с 1–2-ми сутками, числа больных с преобладанием парасимпатического тонуса в покое и уменьшение больных с симпатикотонией. На 20–21-е сутки у большинства больных определялась эйтония, хотя и ваготония регистрировалась у каждого пятого больного.
Изменения вегетативной реактивности после ЛЗЧМТ проявлялись в основном повышением симпатической реактивности, что обусловливало повышенную реактивность в ортостатической пробе у 42 % больных и получение симпатического ответа у 31 % больных при вызывании глазосердечного рефлекса. Отмечалось также и снижение парасимпатической реактивности у большинства больных, которое прослеживалось на всем протяжении острого периода заболевания и только несколько количественно уменьшалось на 20–21-е сутки. На 7–8-е сутки повышение симпатической реактивности было отмечено у меньшего количества больных, снижение избыточной симпатической реактивности особенно проявлялось в резком уменьшении симпатических ответов при глазосердечной пробе. На 14–15-е сутки отмечалось резкое усиление симпатической реактивности у большинства больных. Она была повышенной в ортостатической пробе у 63,2 % больных и у 36,8 % больных при вызывании глазосердечного рефлекса получали симпатический ответ. На 20–21-е сутки симпатическая реактивность почти у всех больных нормализовалась. Если сравнить изменения вегетативной реактивности и вегетативного тонуса у больных в динамике острого периода ЛЗЧМТ, то проведенное нами исследование показало, что вегетативный тонус не позволяет судить о преимущественной направленности вегетативно-адаптационных реакций. Так, возрастание к 14–15-м суткам количества ваготоний у больных в покое происходит на фоне усиления симпатической реактивности.
Изучение вегетативного обеспечения деятельности выявило его нарушение непосредственно после ЛЗЧМТ у половины больных, наибольшее возрастание дезадаптации ВОД — на 7–8-е сутки и восстановление к 20–21-му дню нормального ВОД более чем у половины больных. На всем протяжении острого периода травмы ВОД было нарушено в основном за счет его недостаточности.
Таким образом, наиболее выраженная симптоматика нарушения интегрирующей функции надсегментарной структуры ВНС отмечается на 7–8-е сутки после ЛЗЧМТ, что проявляется наибольшим усилением в этот срок вегетативно-сосудистых расстройств и нарушений вегетативного обеспечения деятельности. На 14–15-е сутки наблюдается значительное усиление вегето–адаптационных реакций, что проявляется повышением симпатической реактивности у большинства больных. Восстановление интегрирующей функции гипоталамуса у большей части больных происходит к 20–21-му дню. За счет восстановления нормальных вагосимпатических взаимоотношений к этому сроку более чем у половины больных наблюдается нормализация ВОД. Полностью к этому сроку исчезают явления асимметрии АД.
Субъективные проявления острого периода ЛЗЧМТ в основном изначально представлены головной болью (80,7 %), тошнотой (78,2 %), общей слабостью (76,6 %), быстрой утомляемостью (62,3 %), раздражительностью (59,8 %), головокружением (41,9 %), рвотой (31,9 %), почти каждый 5-й пациент отмечает нарушения сна. Динамика субъективных проявлений показывает относительно быстрое уменьшение и исчезновение у большинства больных жалоб на головные боли, тошноту, головокружение и длительное сохранение общей слабости, быстрой утомляемости, раздражительности, инсомнии и других симптомов астении как проявлений вегетативной дисфункции, которая может сохраняться и в дальнейшем.
Астения — это междисциплинарная проблема, сопутствующая большинству как острых, так и хронических заболеваний и сопровождающаяся повышенной утомляемостью, слабостью, головными болями напряжения, фибромиалгиями, головокружениями, раздражительностью, нарушениями сна, памяти, внимания и т.д. У таких больных отмечается значительное снижение качества жизни и развитие стойких адаптационных расстройств. Независимо от этиологии основного заболевания астения сама по себе требует своевременного и адекватного лечения.
Среди наиболее эффективных и безопасных лекарственных средств ноотропной группы для лечения различных астенических состояний — от легких до выраженных — особое место занимает препарат Энтроп [2].
Энтроп — производное пирролидона с включением в молекулу ГАМК-производного препарата ноофен. Препарат изначально создан с целью повышения устойчивости ЦНС и коррекции функциональных систем организма в условиях пилотируемых космических полетов. У Энтропа выявлено психостимулирующее, антиастеническое, более выраженное, чем у пирацетама, вегетотропное, анксиолитическое действие и повышение устойчивости мозга к физическим и психическим нагрузкам, противосудорожная активность [3, 4].
Многими авторами отмечалась эффективность включения препарата в комплекс лечения больных как в остром, так и в отдаленном периоде лечения травматической болезни мозга [5–8]. Черний Т.В., Андронова И.А., Черний В.И. (2009) показали, что применение Энтропа при тяжелой ЧМТ в дозе 300 мг в течение двух недель положительно влияет на мозговой кровоток, уменьшает дезорганизацию ЭЭГ-паттернов и снижает летальность [8].
Грицай Н.Н. с соавт. (2008) с учетом положительного влияния на интегративные функции, а также микроциркуляцию головного мозга рекомендует Энтроп как препарат с ноотропным и церебропротективным действием для лечения пациентов после перенесенных нейроинфекций и черепно-мозговых травм курсом не менее 2 месяцев в дозе 150 мг в сутки [9].
Нами ранее было изучено влияние препарата Энтроп в дозе 100 мг в течение 1 месяца на состояние когнитивной сферы, эмоционального фона, астенизации и зависимое от здоровья качество жизни пациентов [10, 11].
Для оценки качества жизни пациентов использовалась короткая версия вопросника здоровья (MOS36-Item Short-Form Health Survey, или MOS SF‑36, автор — Ware J.E., 1992) [12]. Вопросник измеряет общее здоровье, то есть те составляющие здоровья, которые не являются специфичными для возрастных групп, определенных заболеваний или программ лечения [13, 14]. Данная версия вопросника SF‑36 обладает надежными психометрическими свойствами [15]. Вопросник содержит 11 пунктов, некоторые из которых, в свою очередь, имеют от трех до десяти подпунктов, общее число вопросов — 36. Вопросы отражают общую самооценку здоровья в динамике за последний год, а также 8 сфер (субшкал) здоровья: физическое функционирование, ролевое физическое функционирование, боль, общее здоровье, жизнеспособность, социальное функционирование, ролевое эмоциональное функционирование, психологическое здоровье.
Изучение параметров качества жизни у пациентов экспериментальной и контрольной группы до лечения не выявило их существенной разницы. Изучение параметров качества жизни у пациентов экспериментальной и контрольной группы после лечения выявило улучшение параметров по всем субшкалам вопросника с лучшими результатами лечения у пациентов, получавших Энтроп, при этом наибольший эффект отмечался в областях ролевого эмоционального функционирования и психологического здоровья (значимость критерия Колмогорова — Смирнова менее 0,05). Детально параметры качества жизни представлены ниже (рис. 1–8).
Показатели физического функционирования у пациентов, получавших базовую терапию, составили 84,9 % от показателей у пациентов, получавших базовую терапию + Энтроп, принятых за 100 %.
Показатели ролевого физического функционирования у пациентов, получавших базовую терапию, составили 61 % от показателей у пациентов, получавших базовую терапию + Энтроп, принятых за 100 %.
Показатели боли у пациентов, получавших базовую терапию, составили 66,2 % от показателей у пациентов, получавших базовую терапию + Энтроп, принятых за 100 %.
Показатели общего здоровья у пациентов, получавших базовую терапию, составили 65,2 % от показателей у пациентов, получавших базовую терапию + Энтроп, принятых за 100 %.
Показатели жизнеспособности у пациентов, получавших базовую терапию, составили 62,3 % от показателей у пациентов, получавших базовую терапию + Энтроп, принятых за 100 %.
Показатели социального функционирования у пациентов, получавших базовую терапию, составили 72,7 % от показателей у пациентов, получавших базовую терапию + Энтроп, принятых за 100 %.
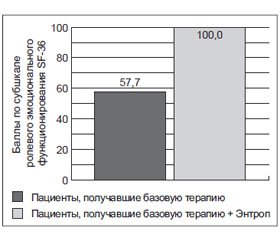
Показатели ролевого эмоционального функционирования у пациентов, получавших базовую терапию, составили 57,7 % от показателей у пациентов, получавших базовую терапию + Энтроп, принятых за 100 %.
Показатели психологического здоровья у пациентов, получавших базовую терапию, составили 35 % от показателей у пациентов, получавших базовую терапию + Энтроп, принятых за 100 %.
Выводы
Полученные данные о влиянии Энтропа на когнитивные функции, состояние психоэмоциональной сферы и зависимое от здоровья качество жизни в сравнении с результатами лечения в контрольной группе продемонстрировали статистически более значимое улучшение этих параметров в группе больных, принимавших Энтроп. Таким образом, активирующее действие Энтропа с нормализацией вегетативной регуляции, повышением устойчивости к физическим нагрузкам и эмоциональному напряжению, повышением уровня внимания, успешности выполнения интеллектуальных задач и регистрируемым улучшением оперативной памяти, противосудорожная активность позволяют рекомендовать его для включения в терапевтические комплексы, традиционно применяемые при черепно-мозговых повреждениях и других заболеваниях нервной системы, сопровождающихся вегетативной дисфункцией и астенией.
Список литературы
1. Курако Ю.Л., Букина В.В. Легкая закрытая черепно-мозговая травма. — К.: Здоровье, 1989. — 160 с.
2. Ахапкина В.Н., Федин А.И., Аведисова А.С., Ахапкин Р.В. Эффективность Фенотропила при лечении астенического синдрома и синдрома хронической усталости // Атмосфера. Нервные болезни. — 2004. — № 3. — С. 28-31.
3. Ахапкина В.И. Адаптогенное действие ноотропных препаратов // Российский медицинский журнал. — 2005. — № 3. — С. 40-43.
4. Мамчур В.И., Опрышко В.И., Кравченко К.А., Куник А.В. Особенности фармакологии ноотропов при когнитивном дефиците на фоне повышенной судорожной готовности мозга // Актуальные вопросы психоневрологии. — 2009. — С. 169-174.
5. Алешина Н.В., Степанов В.П., Филиппова С.Ю. Применение препарата Фенотропил для лечения астенодепрессивных синдромов при отдаленных последствиях черепно-мозговых травм // Трудный пациент. — 2005. — Т. 3, № 5.
6. Савченко А.Ю., Захарова Н.С., Степанов И.Н. Лечение последствий органического поражения головного мозга фенотропилом // Журнал неврологии и психиатрии им. С.С. Корсакова. — 2005. — № 12. — С. 22-26.
7. Чикина Е.С., Левин В.В. Черепно-мозговые травмы: применение современных ноотропных препаратов в острый период и при лечении посттравматической энцефалопатии // Врач. — 2005. — № 11. — С. 53-58.
8. Черний Т.В., Андронова И.А., Черний В.И. Возможности применения Энтропа в комплексной терапии тяжелой ЧМТ // Нейронауки: теоретичні та клінічні аспекти. — 2009. — Т. 5, № 1-2. — С. 76-81.
9. Грицай Н.Н., Кобзистая Н.А., Силенко Г.Я., Мартыненко А.Н. Влияние ноотропного препарата Энтроп на когнитивные функции мозга пациентов, перенесших нейроинфекцию или черепно-мозговую травму // Український вісник психоневрології. — 2008. — Т. 16, вип. 2 (55). — С. 10-11.
10. Горанский Ю.И., Герцев В.Н., Лебедь Е.П., Парневая Е.В. Применение препарата Энтроп у больных с дисциркуляторной энцефалопатией: Тезисы докладов III Южно-Украинской научно-практической конференции «Лечение болезней сердечно-сосудистой системы и ассоциированной патологии». — Одесса, 2008. — С. 32-34.
11. Горанский Ю.И., Герцев В.Н., Лебедь Е.П. Применение препарата Энтроп при когнитивных нарушениях // Матеріали науково-практичної конференції з міжнародною участю «Когнітивна діяльність при старінні». — К., 2008. — С. 20-21.
12. Ware J.E., Sherbourne C.D. The MOS36-Item short-form health survey (SF‑36): conceptual framework and item selection // Med. Care. — 1992. — Vol. 30, № 6. — P. 473-483.
13. Кудряшова И.В. Ранняя диагностика хронического панкреатита с позиции использования ультразвуковой томографии и индекса качества жизни: Методические рекомендации. — Смоленск: СГМА, 2003. — С. 8-14.
14. Новик А.А., Ионова Т.И. Руководство по исследованию качества жизни в медицине. — СПб.: Нева; М.: ОЛМА-ПРЕСС: Звездный мир, 2002. — 320 с.
15. Новик А.А., Ионова Т.И., Кайнд П. Концепция исследования качества жизни в медицине. — СПб.: ЭЛБИ, 1999. — 140 с.
/69.jpg)

/68.jpg)
/69_2.jpg)
/71.jpg)
/72.jpg)