Журнал "Хирургия детского возраста" 1-2 (50-51) 2016
Вернуться к номеру
Частота виникнення хронічного болю після корекції лійкоподібної деформації грудної клітки за Nuss у дітей
Авторы: Альбокрінов А.А.(1), Мигаль І.І.(2), Фесенко У.А.(3), Кузик А.С.(3), Дворакевич А.О.(1) - (1) КЗ ЛОР «Львівська обласна дитяча клінічна лікарня «ОХМАТДИТ», відділення анестезіології та інтенсивної терапії, м. Львів, Україна; (2) Комунальна міська клінічна лікарня швидкої медичної допомоги, відділення анестезіології та інтенсивної терапії, м. Львів, Україна; (3) Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Педиатрия/Неонатология, Хирургия
Разделы: Клинические исследования
Версия для печати
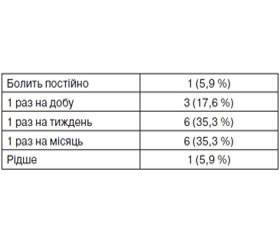
Вступ. Лійкоподібна деформація грудної клітки (ЛДГК) — це один із найчастіших видів деформацій грудної клітки в дітей. Стандартним методом хірургічної корекції ЛДГК є операція Nuss. Частота виникнення хронічного болю після операції Nuss у дітей не вивчена. Мета — вивчити частоту розвитку, інтенсивність та характер хронічного болю після хірургічної корекції ЛДГК за Nuss. Матеріали та методи. Було проведено телефонне опитування 53 пацієнтів. Пацієнтів із наявністю хронічного болю запрошували в клініку для анкетування. Їм пропонувалося відповісти на питання щодо локалізації, максимальної інтенсивності, характеру болю, частоти його виникнення, провокуючих факторів, наявності парестезій та порушень чутливості в ділянці локалізації болю. Для виявлення невропатичного компонента болю використовувався опитувальник PainDETECT. Також був проведений аналіз історій хвороби та анестезіологічної бази даних. Результати. На хронічний біль скаржилися 32 % пацієнтів. У більшості пацієнтів він був помірної інтенсивності, локалізувався по передніх аксилярних лініях у місцях стояння пластини, виникав із частотою від 1 разу на тиждень до 1 разу на місяць та мав ознаки нейропатичного болю. Хронічний біль високої інтенсивності був у 11,2 % пацієнтів. У пацієнтів із вираженою ЛДГК хронічний біль виникав частіше порівняно з тими, хто мав ЛДГК легкого ступеня. Також частота виникнення хронічного болю була вищою в пацієнтів, котрим проводилися повторні оперативні втручання. Частота виникнення хронічного болю не залежала від способу загальної анестезії. У пацієнтів з епідуральною анестезією хронічний біль виникав рідше порівняно з пацієнтами з паравертебральним знеболюванням. Хронічний біль виникав частіше в пацієнтів із більш інтенсивним післяопераційним болем. Висновки. Частота виникнення хронічного болю після корекції ЛДГК за Nuss є високою (32 %). Ризик розвитку хронічного болю вищий у пацієнтів із більш вираженою деформацією та з високою інтенсивністю післяопераційного болю. Частота розвитку хронічного болю, можливо, нижча при використанні епідуральної анестезії. У більшості пацієнтів хронічний біль після корекції ЛДГК за Nuss має ознаки нейропатичного.
Введение. Воронкообразная деформация грудной клетки (ВДГК) — одна из самых частых деформаций грудной клетки у детей. Стандартным методом хирургической коррекции ВДГК является операция Nuss. Частота возникновения хронической боли после операции Nuss у детей не изучена. Цель — изучить частоту развития, интенсивность и характер хронической боли после хирургической коррекции ВДГК по Nuss. Материалы и методы. Был проведен телефонный опрос 53 пациентов. Пациентов с наличием хронической боли приглашали в клинику для анкетирования. Им предлагалось ответить на вопросы о локализации, максимальной интенсивности, характере боли, частоте ее возникновения, провоцирующих факторах, наличии парестезий и нарушений чувствительности в области локализации боли. Для выявления невропатического компонента боли использовался опросник PainDETECT. Также был проведен анализ историй болезни и анестезиологической базы данных. Результаты. На хроническую боль жаловались 32 % пациентов. У большинства она была умеренной интенсивности, локализовалась по передним аксиллярным линиям в местах стояния пластины, возникала с частотой от 1 раза в неделю до 1 раза в месяц и имела признаки нейропатической боли. Хроническая боль высокой интенсивности отмечалась у 11,2 % пациентов. У пациентов с выраженной ВДГК хроническая боль возникала чаще по сравнению с теми, кто имел ВДГК легкой степени. Также частота возникновения хронической боли была выше у пациентов, которым проводились повторные оперативные вмешательства. Частота возникновения хронической боли не зависела от способа общей анестезии. У пациентов с эпидуральной анестезией хроническая боль развивалась реже по сравнению с пациентами с паравертебральным обезболиванием. Хроническая боль возникала чаще у пациентов с более интенсивной послеоперационной болью. Выводы. Частота возникновения хронической боли после коррекции ВДГК по Nuss высокая (32 %). Риск развития хронической боли выше у пациентов с более выраженной деформацией и более высокой интенсивностью послеоперационной боли. Частота развития хронической боли, возможно, ниже при использовании эпидуральной анестезии. У большинства пациентов хроническая боль после коррекции ВДГК по Nuss имеет признаки нейропатической.
Introduction. Pectus excavatum (PE) — one of the most common chest deformities in children. The standard method of PE surgical correction is Nuss procedure. The incidence of chronic pain after Nuss procedure in children is not studied yet. Objective — to study the incidence, intensity and nature of chronic pain after surgical correction of PE according to Nuss. Materials and methods. A telephone survey of 53 patients was conducted. Patients with the presence of chronic pain were invited to the clinic for questioning. They were asked to answer questions about the location, maximum intensity, nature of pain, incidence of its occurrence, provoking factors, the presence of paresthesias and violations of sensitivity in the region of pain localization. To identify a neuropathic component of the pain, PainDETECT questionnaire has been used. Also, an analysis of case records and anesthetic database was performed. Results. 32 % of patients complained about chronic pain. In most patients, it was of moderate intensity, was located on the front axillary lines, where the plate was fixed, occurred 1 time a week, not more often than 1 time per month and had symptoms of neuropathic pain. Chronic pain of high intensity was detected in 11.2 % of patients. In patients with significant PE, chronic pain occurred more frequently compared with those who had mild PE. Also, the incidence of chronic pain was higher in patients who underwent reoperation. The incidence of chronic pain is not dependent on the method of general anesthesia. In patients with epidural anesthesia, chronic pain occurred less frequently than in patients with paravertebral one. Chronic pain occurred more often in patients with more severe postoperative pain. Conclusions. The incidence of chronic pain after PE correction by Nuss is high (32 %). The risk of chronic pain is higher in patients with more severe deformation and high intensity of postoperative pain. The incidence of chronic pain is probably lower when using epidural anesthesia. In most patients after the correction for PE according to Nuss, chronic pain has symptoms of neuropathic one.
хронічний біль, післяопераційний біль, лійкоподібна деформація грудної клітки, операція Nuss, діти.
хроническая боль, послеоперационная боль, воронкообразная деформация грудной клетки, операция Nuss, дети.
chronic pain, postoperative pain, pectus excavatum, Nuss procedure, children.
Статтю опубліковано на с. 26-32
Вступ
Матеріали та методи
Результати та обговорення
/29.jpg)
Висновки
1. Гланц С. Медико-биологическая статистика / С. Гланц. — М.: Практика, 1999. — 500 с.
2. A 10-year review of a minimally invasive technique for the correction of pectus excavatum / D. Nuss, R.E. Kelly Jr, D.P. Croitoru, M.E. Katz // J. Pediatr. Surg. — 1998. — Vol. 33(4). — P. 545-552.
3. A Comparison of Patient Controlled Epidural Analgesia With Intravenous Patient Controlled Analgesia for Postoperative Pain Management After Major Gynecologic Oncologic Surgeries: A Randomized Controlled Clinical Trial / F. Moslemi, S. Rasooli, A. Baybordi, S.E. Golzari // Anesth. Pain. Med. — 2015. — Vol. 17; 5(5). — e29540.
4. Acute postoperative pain predicts chronic pain and long-term analgesic requirements after breast surgery for cancer / A. Fassoulaki, A. Melemeni, C. Staikou et al. // Acta Anaesthesiol. Belg. — 2008. — Vol. 59(4). — P. 241-248.
5. Acute to chronic postoperative pain in children: preliminary findings / M.A. Fortier, J. Chou, E.L. Maurer, Z.N. Kain // J. Pediatr. Surg. — 2011. — Vol. 46(9). — P. 1700-1705.
6. Andreae M.H. Regional anaesthesia to prevent chronic pain after surgery: a Cochrane systematic review and meta-analysis / M.H. Andreae, D.A. Andreae // Br. J. Anaesth. — 2013. — Vol. 111(5). — P. 711-720.
7. Campbell C.M. Ethnic differences in pain and pain management / C.M. Campbell, R.R. Edwards // Pain –Manag. — 2012. — Vol. 2(3). — P. 219-230.
8. Clinical Pain Management, Chronic Pain / P.R. Wilson, P.J. Watson, J.A. Haythornthwaite, T.S. Jensen. — London: Hodder and Stoughton Limited, 2008. — P. 405-140.
9. Chou J. Post-thoracotomy pain in children and adolescence: a retrospective cross-sectional study / J. Chou, C.W. Chan, G.A. Chalkiadis // Pain Med. — 2014. — Vol. 15(3). — P. 452-459.
10. Chronic pain after inguinal hernia repair in children / A.D. Kristensen, P. Ahlburg, M.C. Lauridsen et al. // Br. J. Anaesth. — 2012. — Vol. 109(4). — P. 603-608.
11. Chronic pain in adults after thoracotomy in childhood or youth / A.D. Kristensen, T.A. Pedersen, V.E. Hjortdal et al. // Br. J. Anaesth. — 2010. — Vol. 104(1). — P. 75-79.
12. Chronic pain in children after cardiac surgery via sternotomy / M.H. Lauridsen, A.D. Kristensen, V.E. Hjortdal et al. // Cardiol. Young. — 2014. — Vol. 24(5). — P. 893-899.
13. Costochondral changes in the chest wall after the Nuss procedure: ultrasonographic findings / Q. Zeng, J.Y. Lai, X.M. Wang et al. // J. Pediatr. Surg. — 2008. — Vol. 43(12). — P. 2147-2150.
14. Different anesthetic techniques associated with different incidences of chronic post-thoracotomy pain: low-dose remifentanil plus presurgical epidural analgesia is preferable to high-dose remifentanil with postsurgical epidural analgesia / J.C. Salengros, I. Huybrechts, A. Ducart et al. // J. Cardiothorac. Vasc. Anesth. — 2010. — Vol. 24(4). — P. 608-616.
15. Edwards R.R. Genetic predictors of acute and chronic pain / R.R. Edwards // Curr. Rheumatol. Rep. — 2006. — Vol. 8(6). — P. 411-417.
16. Haller J.A. Jr. Use of CT scans in selection of patients for pectus excavatum surgery: a preliminary report / J.A. Haller Jr, S.S. Kramer, S.A. Lietman // J. Pediatr. Surg. — 1987. — Vol. 22(10). — P. 904-906.
17. Hebra A. Minimally invasive repair of pectus excavatum / A. Hebra // Semin. Thorac. Cardiovasc. Surg. — 2009. — Vol. 21(1). — P. 76-84.
18. Imbelloni L.E. Pathophysiology of Paresthesia / L.E. Imbelloni, M.A. Gouveia // Tech. Open. — 2012. — P. 2-17.
19. Impact of childhood inguinal hernia repair in adulthood: 50 years of follow-up / B. Zendejas, A.E. Zarroug, Y.M. Erben et al. // J. Am. Coll. Surg. — 2010. — Vol. 211(6). — P. 762-768.
20. Incidence of post-thoracotomy pain: a comparison between total intravenous anaesthesia and inhalation anaesthesia / J.G. Song, J.W. Shin, E.H. Lee et al. // Eur. J. Cardiothorac. Surg. — 2012. — Vol. 41(5). — P. 1078-82.
21. Kehlet H. Persistent postsurgical pain: risk factors and prevention / H. Kehlet, T.S. Jensen, C.J. Woolf // Lancet. — 2006. — Vol. 367(9522). — P. 1618-1625.
22. Kotzot D. Etiology of chest wall deformities — a genetic review for the treating physician / D. Kotzot, A.H. Schwabegger // J. Pediatr. Surg. — 2009. — Vol. 44(10). — P. 2004-2011.
23. Lauder G.R. Total intravenous anesthesia will supercede inhalational anesthesia in pediatric anesthetic practice / G.R. Lauder // Paediatr. Anaesth. — 2015. — Vol. 25(1). — P. 52-64.
24. Macrae W.A. Chronic pain after surgery / W.A. Macrae // British Journal of Anaesthesia. — 2001. — Vol. 87(1). — P. 88-98.
25. Macrae W.A. Chronic post-surgical pain: 10 years on / W.A. Macrae // British Journal of Anaesthesia. — 2008. — Vol. 101(1). — P. 77-86.
26. Macrae W.A. Chronic postsurgical pain / W.A. Macrae, H.T.O. Davies // Crombie I.K., Linton S., Croft P. et al. — Epidemiology of Pain. — Seattle: International Association for the Study of Pain, 1999. — P. 125-42.
27. Mauck M. Epigenetics of chronic pain after thoracic surgery / M. Mauck, T. Van de Ven, A.D. Shaw // Curr. Opin. Anaesthesiol. — 2014. — Vol. 27(1). — P. 1-5.
28. Moawad H.E. Postoperative analgesia after major abdominal surgery: Fentanyl-bupivacaine patient controlled epidural analgesia versus fentanyl patient controlled intravenous analgesia / H.E.S. Moawad, E.M. Mokbel // Egyptian Journal of Anaesthesia. — 2014. — Vol. 30(4). — P. 393-397.
29. Mogyoros I. Mechanisms of paresthesias arising from healthy axons / I. Mogyoros, H. Bostock, D. Burke // Muscle Nerve. — 2000. — Vol. 23(3). — P. 310-320.
30. Nikolajsen L. Chronic pain after surgery in children / L. Nikolajsen, L.D. Brix // Curr. Opin. Anaesthesiol. — 2014. — Vol. 27(5). — P. 507-512.
31. Pain Medicine. Acute pain management: scientific evidence / P.E. Macintyre, S.A. Schug, D.A. Scott et al. — Australian and New Zealand College of Anaesthetists and Faculty of Pain Medicine, 2010. — 491 p.
32. PainDETECT: a new screening questionnaire to identify neuropathic components in patients with back pain / R. Freynhagen, R. Baron, U. Gockel, T.R. Tölle // Curr. Med. Res. Opin. — 2006. — Vol. 22(10). — P. 1911-1920.
33. Painful Peripheral Neuropathies / P. Marchettini, M. Lacerenza, E. Mauri, C. Marangoni // Current Neuropharmacology. — 2006. — Vol. 4(3). — P. 175-181.
34. Patient Satisfaction Following Minimally Invasive Repair of Pectus Excavatum: Single Surgeon Experience / A. Barua, V.P. Rao, B. Barua, A. Majewski // Journal of Surgical Technique and Case Report. — 2012. — Vol. 4(2). — P. 86-88.
35. Perkins F.M. Chronic Pain as an Outcome of Surgery: A Review of Predictive Factors / F.M. Perkins, H. Kehlet // Anesthesiology. — 2000. — Vol. 93. — P. 1123-1133.
36. Procedure-specific risk factor analysis for the development of severe postoperative pain / H.J. Gerbershagen, E. Pogatzki-Zahn, S. Aduckathil et al. // Anesthesiology. — 2014. — Vol. 120(5). — P. 1237-1245.
37. Psychosocial predictors and correlates for chronic post-surgical pain (CPSP) — a systematic review / A. Hinrichs-Rocker, K. Schulz, I. Järvinen et al. // Eur. J. Pain. — 2009. — Vol. 13. — P. 719-730.
38. Race and chronic pain: A comparative study of young black and white Americans presenting for management / C.R. Green, T.A. Baker, Y. Sato et al. // J. Pain. — 2003. — Vol. 4(4). — P. 176-183.
39. Ravitch M.M. The Operative Treatment of Pectus Excavatum / M.M. Ravitch // Ann. Surg. — 1949. — Vol. 129(4). — P. 429-444.
40. Reddi D. Chronic pain after surgery: pathophysiology, risk factors and prevention / D. Reddi, N. Curran // Postgrad. Med. J. — 2014. — Vol. 90(1062). — P. 222-227.
41. Rib cartilage characterization in patients affected by pectus excavatum / F. Tocchioni, M. Ghionzoli, L. Calosi et al. // Anat. Rec. (Hoboken). — 2013. — Vol. 296(12). — P. 1813-1820.
42. Richman J.M. Epidural analgesia for postoperative pain / J.M. Richman, C.L. Wu // Anesthesiol. Clin. North America. — 2005. — Vol. 23(1). — P. 125-140.
43. Tait R.C. Racial/ethnic disparities in the assessment and treatment of pain: psychosocial perspectives / R.C. Tait, J.T. Chibnall // Am. Psychol. — 2014. — Vol. 69(2). — P. 131-141.
44. The neuropathic component in persistent postsurgical pain: a systematic literature review / S. Haroutiunian, L. Nikolajsen, N.B. Finnerup, T.S. Jensen // Pain. — 2013. — Vol. 154(1). — P. 95-102.
45. Stress distribution on the thorax after the Nuss procedure for pectus excavatum results in different patterns between adult and child patients / T. Nagasao, J. Miyamoto, T. Tamaki et al. // J. Thorac. Cardiovasc. Surg. — 2007. — Vol. 134(6). — P. 1502-1507.
46. Schwabegger H.A. Congenital Thoracic Wall Deformities: Diagnosis, Therapy and Current Developments / H.A. Schwabegger. — Wien: Springer-Verlag, 2011. — 347 p.
47. Shared genetic factors underlie chronic pain syndromes / J. Vehof, H.M. Zavos, G. Lachance et al. // Pain. — 2014. — Vol. 155(8). — P. 1562-1568.
48. Studies comparing Numerical Rating Scales, Verbal Rating Scales, and Visual Analogue Scales for assessment of pain intensity in adults: a systematic literature review / M.J. Hjermstad, P.M. Fayers, D.F. Haugen et al. European Palliative Care Research Collaborative (EPCRC) // J. Pain. Symptom. Manage. — 2011. — Vol. 41(6). — P. 1073-1093.
49. Three new datasets supporting use of the Numerical Rating Scale (NRS-11) for children’s self-reports of pain intensity / C.L. von Baeyer, L.J. Spagrud, J.C. McCormick et al. // Pain. — 2009. — Vol. 143(3). — P. 223-227.
50. Visser E.J. Chronic post-surgical pain: Epidemiology and clinical implications for acute pain management / E.J. Visser // Acute Pain. — 2006. — Vol. 8(2). — P. 73-81.
51. Voscopoulos C. When does acute pain become chronic? / C. Voscopoulos, M. Lema // British Journal of Anaesthesia. — 2010. — Vol. 105(S1). — P. 69-85.
52. Walega D.R. Chronic postherniorrhaphy pain following inguinal hernia surgery: Etiology, risk factors, anatomy, and treatment options / D.R. Walega // Techniques in Regional Anesthesia and Pain Management. — 2011. — Vol. 15. — P. 104-109.

/28.jpg)