Журнал «Здоровье ребенка» 5 (73) 2016
Вернуться к номеру
Реализация противовирусного и антиоксидантного действия биофлавоноидов при лечении острых респираторных вирусных инфекций
Авторы: Абатуров А.Е., Высочина И.Л. - ГУ «Днепропетровская медицинская академия МЗ Украины», г. Днепр, Украина
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
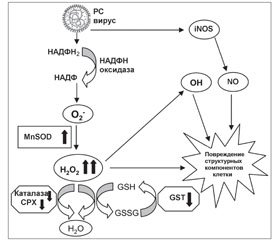
У системному аналітичному огляді подані дані про особливості розвитку вірус-асоційованого оксидативного стресу та показана необхідність антиоксидантної медикаментозної підтримки саногенезу гострих респіраторних вірусних інфекцій. Надані дані про противірусну активність і антиоксидатну дію біофлавоноїдів диких злаків Calamagrostis epigeios L. і Deschampsia caespitosa L., що входять до складу лікарського препарату Імунофлазид. Продемонстровано ефективність і безпеку застосування Імунофлазиду як препарату вибору при лікуванні гострих респіраторних вірусних інфекцій.
В системном аналитическом обзоре представлены данные об особенностях развития вирус-ассоциированного оксидативного стресса и показана необходимость антиоксидантной медикаментозной поддержки саногенеза острых респираторных вирусных инфекций. Представлены данные о противовирусной активности и антиоксидантном действии биофлавоноидов диких злаков Calamagrostis epigeios L. и Deschampsia caespitosa L., входящих в состав лекарственного препарата Иммунофлазид. Продемонстрирована эффективность и безопасность применения Иммунофлазида как препарата выбора при лечении острых респираторных вирусных инфекций.
The comprehensive analytic review reflects the characteristics of the virus-associated oxidative stress, and shows the need for antioxidant drug support for sanogenesis at acute respiratory viral infections. There are described the data on the antiviral activity and antioxidant protective effect of bioflavonoids of wild grasses Calamagrostis epigeios L. and Deschampsia caespitosa L. as the components of medicinal product Immunоflazidum. There are demonstrated the effectiveness and safety of Immunоflazidum as a drug of choice for the treatment of acute respiratory viral infections.
гострі респіраторні вірусні інфекції, флавоноїди, прямий противірусний ефект, антиоксидантний ефект.
острые респираторные вирусные инфекции, флавоноиды, прямой противовирусный эффект, антиоксидантный эффект.
acute respiratory viral infections, flavonoids, direct antiviral effect, antioxidant effect.
Статья опубликована на с. 128-134
Введение
Противовирусное действие препарата Иммунофлазид
Антиоксидантные свойства препарата Иммунофлазид
Доказательная база клинической эффективности препарата Иммунофлазид при лечении острых респираторных вирусных инфекций
Заключение
1. Абатуров А.Е. Роль прооксидантной и антиоксидантной систем при воспалительных заболеваниях органов дыхания / А.Е. Абатуров, А.П. Волосовец, Е.И. Юлиш. — Харьков: Планета-Принт, 2013. — 496 с.
2. Абатуров А.Е. Активированные кислородсодержащие метаболиты — компонент системы неспецифической защиты респираторного тракта / А.Е. Абатуров // Здоровье ребенка. — 2009. — № 2. — С. 120-125.
3. Абатуров А.Е. Механизм действия активированных кислородсодержащих метаболитов в респираторном тракте. Противовоспалительное действие (часть 3) / А.Е. Абатуров, А.П. Волосовец // Здоровье ребенка. — 2015. — № 5 (65). — С. 136-140.
4. Абатуров А.Е. Молекулярные механизмы неспецифической защиты респираторного тракта / А.Е. Абатуров, О.Ю. Потоцкая, Е.И. Юлиш // Здоровье ребенка. — 2007. — № 4. — С. 124-130.
5. Бекетова Г.В. Иммунофлазид в педиатрии: системный анализ эффективности и безопасности применения / Г.В. Бекетова, Н.В. Хайтович, А.И. Гриневич // Педиатрия. Восточная Европа. — 2014. — № 3 (07). — C. 141-152.
6. Годованець О.І. Антиоксидантна терапія в комплексі лікування хронічного катарального гінгівіту у дітей, які проживають на нітратнозабруднених територіях / О.І. Годованець // Вісник Української медичної стоматологічної академії. — 2007. — Т. 7, № 4. — С. 20-23.
7. Годованець О.І. Віддалені результати застосування препаратів антиоксидантної дії у комплексі лікування хронічного катарального гінгівіту в дітей / О.І. Годованець // Світ медицини та біології. — 2012. — № 3. — С. 80-83.
8. Годованець О.І. Ефективність застосування препаратів Протефлазид та Імунофлазид у комплексі лікування хронічного катарального гінгівіту в дітей / О.І. Годованець, М.М. Рожко // Современная педиатрия. — 2007. — Т. 16, № 3. — С. 94-98.
9. Крамарев С.А. Метаанализ результатов клинических исследований эффективности флавоноидов при вирусных и вирусно-бактериальных заболеваниях у детей / С.А. Крамарев, А.И. Гриневич, О.Б. Тонковид, О.В. Выговская // Cовременная педиатрия. — 2014. — № 5 (61). — С. 1-7.
10. Лискова Е.В. Клиника гриппа в современный период / Е.В. Лискова // Медицинский альманах. — 2011. — № 4. — С. 112-114.
11. Отчет «О доклиническом изучении новых (лечебных) форм Протефлазида® на моделях вируса гриппа». АМН Украины. Институт эпидемиологии и инфекционных болезней им. Л.В. Громашевского. — К., 2006.
12. Отчет о научно-исследовательской работе «Проведение дополнительных клинических испытаний препарата Протефлазид®». Институт эпидемиологии и инфекционных болезней (ИЕИХ). — К., 2002.
13. Пальчиковська Л.Г. Антивірусні властивості рослинних флавоноїдів інгібіторів синтезу ДНК і РНК / Л.Г. Пальчиковська, О.В. Васильченко, М.О. Платонов та ін. // Biopolymers and Cell. — 2013. — Т. 29, № 2. — P. 150-156.
14. Рыбалко С.Л. Отчет «Изучение механизмов действия биологически активных веществ лечебной субстанции Протефлазид». — 2010. — 84 с.
15. Сергеева И.В. Патогенез острых респираторных вирусных инфекций и гриппа / И.В. Сергеева, Е.П. Тихонова, Н.И. Камзалакова, Г.В. Булыгин // Практическая медицина. — 2012. — № 6 (61). — С. 47-50.
16. Січненко П.І. Застосування Імунофлазиду в лікуванні РГВІ у дітей раннього віку / П.І. Січненко, Н.П. Куропятник, Н.В. Хрін, О.В. Вінник // Актуальні питання клінічної медицини. — 2009. — С. 88.
17. Сокуренко Л.М. Антитоксична дія імунофлазиду при грипі / Л.М. Сокуренко // Таврический медико-биологический вестник. — 2012. — Т. 15, № 4 (60). — C. 339-341.
18. Токарчук Н.І. Використання Імунофлазиду для профілактики та лікування грипу і ГРВІ у дітей під час сезонного підвищення захворюваності / Н.І. Токарчук, Л.С. Старинець // Современная педиатрия. — 2012. — Т. 41, № 1. — С. 123-127.
19. Токарчук Н.І. Досвід використання Імунофлазиду в комплексі лікувально-профілактичних заходів під час сезонного підвищення захворюваності на грип та ГРВІ / Н.І. Токарчук, Л.С. Старинець // Перинатология и педиатрия. — 2012. — Т. 49, № 1. — С. 1-5.
20. Червяковский Е.М. Роль флавоноидов в биологических реакциях с переносом электронов / Е.М. Червяковский, В.П. Курченко, В.А. Костюк // Труды Белорусского государственного университета. — 2009. — Т. 4, ч. 1.
21. Abdul-Careem M.F. Induction of innate host responses in the lungs of chickens following infection with a very virulent strain of Marek's disease virus / M.F. Abdul-Careem, K. Haq, S. Shanmuganathan et al. // Virology. 2009 Oct 25; 393 (2): 250-7. doi: 10.1016/j.virol.2009.08.001.
22. Bao X. Identification of human metapneumovirus — induced gene networks in airway epithelial cells by microarray analysis / X. Bao, M. Sinha, T. Liu et al. // Virology. 2008 Apr 25; 374 (1): 114-27.
23. Checconi P. Redox proteomics of the inflammatory secretome identifies a common set of redoxins and other glutathionylated proteins released in inflammation, influenza virus infection and oxidative stress / P. Checconi, S. Salzano, L. Bowler et al. // PLoS One. 2015 May 18; 10 (5): e0127086. doi: 10.1371/journal.pone.0127086.
24. Hernández-Ortega L.D. Quercetin improves hepatic fibrosis reducing hepatic stellate cells and regulating pro-fibrogenic/anti-fibrogenic molecules balance / L.D. Hernández-Ortega, B.E. Alcántar-Díaz, L.A. Ruiz-Corro et al. // J. Gastroenterol. Hepatol. 2012 Dec; 27 (12): 1865-72. doi: 10.1111/j.1440-1746.2012.07262.x.
25. Hosakote Y.M. Respiratory syncytial virus induces oxidative stress by modulating antioxidant enzymes / Y.M. Hosakote, T. Liu, S.M. Castro et al. // Am. J. Respir. Cell Mol. Biol. 2009 Sep; 41 (3): 348-57. doi: 10.1165/rcmb.2008-0330OC.
26. Hosakote Y.M. Viral-mediated inhibition of antioxidant enzymes contributes to the pathogenesis of severe respiratory syncytial virus bronchiolitis / Hosakote Y.M., Jantzi P.D., Esham D.L. et al. // Am. J. Respir. Crit. Care Med. 2011 Jun 1; 183 (11): 1550-60. doi: 10.1164/rccm.201010-1755OC.
27. Ichikawa T. TLR3 activation augments matrix metalloproteinase production through reactive nitrogen species generation in human lung fibroblasts / T. Ichikawa, H. Sugiura, A. Koarai et al. // J. Immunol. 2014 Jun 1; 192(11): 4977-88. doi: 10.4049/jimmunol.1302919.
28. Izzi V. The effects of dietary flavonoids on the regulation of redox inflammatory networks / V. Izzi, L. Masuelli, I. Tresoldi et al. // Front Biosci (Landmark Ed). 2012 Jun 1; 17: 2396-418. PMID: 22652788.
29. Jaspers I. Diesel exhaust enhances influenza virus infections in respiratory epithelial cells / I. Jaspers, J.M. Ciencewicki, W. Zhang et al. // Toxicol Sci. 2005 Jun; 85(2): 990-1002.
30. Kawabata K. Quercetin and related polyphenols: new insights and implications for their bioactivity and bioavailability / K. Kawabata, R. Mukai, A. Ishisaka // Food Funct. 2015 May; 6(5): 1399-417. doi: 10.1039/c4fo01178c.
31. Komaravelli N. Respiratory Viral Infections and Subversion of Cellular Antioxidant Defenses / N. Komaravelli, A. Casola // J. Pharmacogenomics Pharmacoproteomics. 2014 Sep 30; 5 (4). pii: 1000141.
32. Lebold K.M. Toll-Like Receptor 7-Targeted Therapy in Respiratory Disease / K.M. Lebold, D.B. Jacoby, M.G. Drake // Transfus Med. Hemother. 2016 Mar; 43(2): 114-9. doi: 10.1159/000445324.
33. Papi A. Reducing agents inhibit rhinovirus-induced up-regulation of the rhinovirus receptor intercellular adhesion molecule‑1 (ICAM‑1) in respiratory epithelial cells / A. Papi, N.G. Papadopoulos, L.A. Stanciu et al. // FASEB J. 2002 Dec; 16(14): 1934-6. doi: 10.1096/fj.02-0118fje.
34. Papi A. Role of xanthine oxidase activation and reduced glutathione depletion in rhinovirus induction of inflammation in respiratory epithelial cells / Papi A., Contoli M., Gasparini P. et al. // J. Biol. Chem. 2008 Oct 17; 283(42): 28595-606. doi: 10.1074/jbc.M805766200.
35. Schadich E. Effects of Ginger Phenylpropanoids and Quercetin on Nrf2-ARE Pathway in Human BJ Fibroblasts and HaCaT Keratinocytes / E. Schadich, J. Hlaváč, T. Volná et al. // Biomed. Res. Int. 2016; 2016: 2173275. doi: 10.1155/2016/2173275.
36. Selemidis S. Nox1 oxidase suppresses influenza a virus-induced lung inflammation and oxidative stress / S. Selemidis, H.J. Seow, B.R. Broughton et al. // PLoS One. 2013; 8(4): e60792. doi: 10.1371/journal.pone.0060792.
37. Spencer J.P. Beyond antioxidants: the cellular and molecular interactions of flavonoids and how these underpin their actions on the brain / J.P. Spencer // Proc. Nutr. Soc. 2010 May; 69(2): 244-60. doi: 10.1017/S0029665110000054.
38. Steffen Y. Mono-O-methylated flavanols and other flavonoids as inhibitors of endothelial NADPH oxidase / Y. Steffen, C. Gruber, T. Schewe, H. Sies // Arch. Biochem. Biophys. 2008 Jan 15; 469(2): 209-19. doi: 10.1016/j.abb.2007.10.012.
39. Strengert M. Mucosal reactive oxygen species are required for antiviral response: role of Duox in influenza a virus infection / M. Strengert, R. Jennings, S. Davanture et al. // Antioxid Redox Signal. 2014 Jun 10; 20(17): 2695-709. doi: 10.1089/ars.2013.5353.
40. Tanigawa S., Fujii M., Hou D.X. Action of Nrf2 and Keap1 in ARE-mediated NQO1 expression by quercetin/ S. Tanigawa, M. Fujii, D.X. Hou // Free Radic Biol Med. 2007 Jun 1; 42(11): 1690-703. doi: 10.1016/j.freeradbiomed.2007.02.017.
41. Tsao R. Chemistry and biochemistry of dietary polyphenols / R. Tsao // Nutrients. 2010 Dec; 2(12): 1231-46. doi: 10.3390/nu2121231.
42. Umeno A. Antioxidative and Antidiabetic Effects of Natural Polyphenols and Isoflavones / Umeno A., Horie M., Murotomi K. et al. // Molecules. 2016 May 30; 21(6). pii: E708. doi: 10.3390/molecules21060708.
43. Vareille M. The airway epithelium: soldier in the fight against respiratory viruses / M. Vareille, E. Kieninger, M.R. Edwards, N. Regamey // Clin. Microbiol. Rev. 2011 Jan; 24(1): 210-29. doi: 10.1128/CMR.00014-10.
44. Vogel J.U. Effects of S-acetylglutathione in cell and animal model of herpes simplex virus type 1 infection / J.U. Vogel, J. Cinatl, N. Dauletbaev et al. // Med. Microbiol. Immunol. 2005 Jan; 194 (1-2): 55-9. doi 10.1007/s00430-003-0212-z.
45. Xu W. Role of epithelial nitric oxide in airway viral infection / S. Zheng, R.A. Dweik, S.C. Erzurum // Free Radic. Biol. Med. 2006 Jul 1; 41 (1): 19-28. doi: 10.1016/j.freeradbiomed.2006.01.037.

/129.jpg)
/131.jpg)